Биология внутренних вод, 2020, № 2, стр. 137-144
Качественный состав и количественные характеристики зоопланктона прибрежья оз. Тана (Эфиопия) в конце сухого сезона
А. В. Крылов a, *, В. Зелалем b, А. А. Прокин a
a Институт биологии внутренних вод им. И.Д. Папанина РАН
пос. Борок, Некоузский р-н, Ярославская обл., Россия
b Бахар-Дарский исследовательский центр рыбного хозяйства и аквакультуры
Бахар-Дар, Эфиопия
* E-mail: krylov@ibiw.ru
Поступила в редакцию 28.08.2018
После доработки 08.11.2018
Принята к публикации 27.11.2018
Аннотация
Исследования зоопланктона прибрежья Бахар-Дарского залива оз. Тана (Эфиопия), проведенные в марте 2018 г., выявили богатство его качественного состава (61 вид – Rotifera, 4 – Copepoda, 13 – Cladocera), а также высокие количественные характеристики. Максимальными численностью и биомассой отличался зоопланктон в зарослях гидатофитов (степень зарастания 10–50%), в зарослях гелофитов (степень зарастания 100%) количественные показатели сообществ и отдельных таксономических групп беспозвоночных были достоверно меньше. Предположено, что разница характеристик зоопланктона в заросших воздушно-водными и погруженными макрофитами участках в пределах отдельных станций определялась сверху со стороны хищников. При увеличении воздействия хищников возрастал индекс Шеннона и сокращались количественные показатели планктонных беспозвоночных.
ВВЕДЕНИЕ
В большинстве стран имеются озера и реки, становящиеся их символом. Как правило, это крупные водоемы и водотоки, водные и биологические ресурсы которых играют важнейшую роль в экономике страны. Нередко они также отличаются высоким биологическим разнообразием. В некоторых из них найдены редкие или эндемичные виды. В Эфиопии к таким водным объектам принадлежит оз. Тана.
Оз. Тана – высокогорный водоем, расположенный в северо-западной части Эфиопского нагорья на высоте ~1800 м над у.м. По площади (~3150 км2) оз. Тана – крупнейшее озеро Эфиопии. Оно граничит с низкими равнинами на севере, востоке и юго-западе. Эти равнины часто затопляются в сезон дождей, образуя обширные водно-болотные угодья. На западе и северо-западе озеро граничит с некоторыми крутыми скалистыми участками. По ряду химических показателей оз. Тана относят к мезотрофным водоемам (Teshale et al., 2001), однако, по содержанию хлорофилла a и величине первичной продукции оно принадлежит к категории олиготрофных (Wondie et al., 2007). В настоящее время на большинстве рек бассейна оз. Тана возведены водохранилища. Их строительство оказало сильное влияние на гидрологический режим территории и сделало невозможными нерестовые миграции большинства видов рыб, населяющих озеро.
Основополагающие сведения о зоопланктоне оз. Тана опубликованы в ряде работ (Akoma, 2010; Brunelli, Cannicci, 1940; Dejen et al., 2002, 2004; Imoobe, Akoma, 2008; Rzóska, 1976; Wudneh, 1998). В них представлен его видовой состав, описаны временное и пространственное распределения, связи с основными факторами среды, сезонные изменения, роль в питании африканских усачей Barbus tanapelagius Graaf, Dejen, Sibbing et Osse и B. humilis Boulenger. Эти два вида усачей служат кормовой базой для коммерчески значимых рыб оз. Тана. Тем не менее, сведения о зоопланктоне оз. Тана нельзя признать исчерпывающими, по степени изученности элементов экосистемы озеро значительно уступаeт водоемам стран Азии и Нового Света (Africa…, 2008; African…, 2016).
Для оз. Тана характерны значительные колебания уровня воды (до 1 м). Изменение уровня определяется чередованием сухого (декабрь–май) и влажного (июнь–ноябрь) сезонов. Периодические изменения уровня воды способствуют формированию зоны временного затопления, которая представляет собой специфичный водно-болотный комплекс с зарослями гелофитов. В литературе сведений об особенностях структуры сообществ гидробионтов этой зоны и сравнительного анализа с группировками беспозвоночных в постоянно существующих участках литорали обнаружить не удалось. Учитывая важнейшую роль зоны временного затопления в формировании гидрохимического и биологического режимов водоема, очевидно, что проведение таких исследований актуально.
Цель работы – исследовать видовой состав, количественные характеристики и структуру зоопланктона разнотипных прибрежных участков Бахар-Дарского залива в конце сухого сезона (постдождливый сезон).
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Материал был собран в марте 2018 г. на шести станциях Бахар-Дарского залива (рис. 1). Выбранные станции отличались по биотопическим характеристикам и антропогенной нагрузке (Zelalem, Prokin, 2017). На каждой станции сбор проб проводили на двух участках: “а” – в разреженных зарослях погруженных растений (гидатофиты), “b” – в сплошных зарослях воздушно-водных растений (гелофиты), приуроченных к зоне временного затопления.
Рис. 1.
Карта-схема оз. Тана. Стрелками указано – направление течения притоков. На выноске – Бахар-Дарский залив и местонахождения станций (1–6).
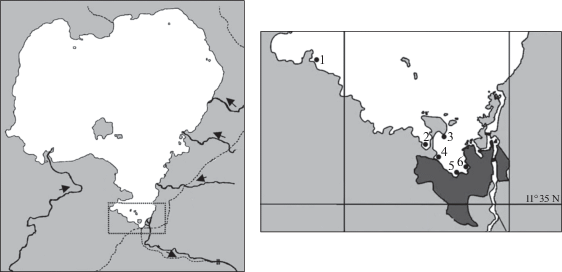
Станция 1 (“Infranz”) – устье одноименной реки, которая орошает сеть сельскохозяйственных земель. Растительность представлена развитым поясом растений: Cyperus papyrus L., Cyperus sp., Phragmites karka (Retz.) Trin. ex Steud., Vossia cuspidata (Roxb.) Griff. и Azolla africana Desv. В зоне смешения речных и озерных вод развиты заросли Potamogeton thunbergii Cham. et Schlecht., Nymphaea lotus L., Ceratophyllum sp. По берегам гнездятся Plectropterus g. gambensis (L.) и Alopochen aegyptiaca (L.). Степень зарастания уч. 1а глубиной 3 м – 50%, уч. 1b (глубина 3 м) – 100%.
Станция 2 (“Hospital”) – большой мелководный залив, заполняющийся при максимальном уровне воды. В береговой зоне здесь идет перегрузка c лодок на мулов папируса и дров, свозимых со всего озера, что определяет поступление дополнительного количества органического вещества. Растительность представлена Cyperus papyrus, Phragmites karka, Vossia cuspidata, Nymphaea lotus, Persicaria senegalensis (Meisn.) Soják, Ceratophylum sp., Azolla africana, а также Nymphoides prob. indica occidentalis A. Raynal, Utricularia inflexa Forssk., Ipomoea aquatica Forssk. В этом месте обитают Actophilornis africana (Gmelin), Phalacrocorax africanus (Gmelin), Anhinga rufa (Dandin), Threskiornis aethiopicus (Latham), Varanus prob. niloticus L. Степень зарастания уч. 2а (глубина 4 м) – 40%, уч. 2b (глубина 2.5 м) – 100%.
Станция 3 (“Gerima”) – сплавина, которая изолирована от берега в течение влажного сезона. Растительность представлена Cyperus papyrus, Phragmites karka, Vossia cuspidata, Nymphaea lotus, Azolla africana. Это основное место обитания Plectropterus g. gambensis, Alopochen aegyptiaca, Balearica regulorum Bennett, Helioneetus vocifer (Daudin), Actophilornis africana, Ardea alba L. и других водных и околоводных птиц. Степень зарастания уч. 3а (глубина 4 м) – 10%, уч. 3b (глубина 2.5 м) – 100%.
Станция 4 (“Resort”) – небольшой залив, окруженный кварталами современных городских зданий, с отелями на берегу. Растительность представлена развитым поясом растений: Cyperus papyrus, Phragmites karka, Vossia cuspidata, Persicaria senegalensis. За этим поясом следует пояс погруженного Ceratophyllum sp. Степень зарастания уч. 4а (глубина 4 м) – 30%, уч. 4b (глубина 2 м) – 100%.
Станция 5 (“St. George”) находится рядом с городской набережной у порта. Растительность представлена Cyperus papyrus, Phragmites karka, Vossia cuspidata. Здесь швартуются пассажирские и рыболовные суда, сбрасываются в озеро остатки рыбы после разделки улова для продажи, постоянно кормятся стаи Pelecanus onocrotalus L., а также несколько других видов птиц – Phalacrocorax africanus, Ardeola spp., Egretta spp., Threskiornis aethiopicus (Latham). Степень зарастания уч. 5а (глубина 3 м) – 20%, уч. 5b (глубина 2 м) – 100%.
Станция 6 (“Shum-Abo”) находится рядом с густонаселенным кварталом трущоб (“фавела”), лишенных какой-либо централизованной системы водоотведения. Растительность представлена развитым поясом Cyperus papyrus, Phragmites karka, Vossia cuspidata, Persicaria senegalensis. Степень зарастания уч. 6а (глубина 4 м) – 40%, уч. 6b (глубина 2.5 м) – 100%.
На участках “а” пробы собирали сетью Джеди с ячеей 64 мкм, протягивая ее от дна до поверхности, на участках “b” – ведром, процеживая 50 л воды через сеть с ячеей 64 мкм. Пробы фиксировали 4%-ным формалином, камеральную обработку проводили по стандартной методике (Методика…, 1975), биомассу рассчитывали с учетом размеров организмов (Балушкина, Винберг, 1979). Статистический анализ включал оценку достоверности различий средних по Н-критерию Краскела–Уоллеса (р < 0.05).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
В составе зоопланктона обнаружено 78 видов беспозвоночных: 61 – Rotifera, 4 – Copepoda, 13 – Cladocera. Каких-либо значительных различий видового состава зоопланктеров в двух типах биотопов не выявлено. В зоне гидатофитов зарегистрировано 62 вида (49 – Rotifera, 4 – Copepoda, 9 – Cladocera), гелофитов – 63 (50 – Rotifera, 3 – Copepoda, 10 – Cladocera). Максимальным числом видов отличались роды Lecane (17), Trichocerca (9) и Brachionus (4). К числу часто встречаемых видов (>50% проб) среди Rotifera относились Asplanchna brightwelli Gosse, Bdelloidea sp., Brachionus caudatus caudatus Barrois et Daday, B. falcatus Zacharias, Cephalodella mucronata Myers, Hexarthra oxyuris (Zernov), Keratella cochlearis cochlearis Gosse, K. tropica tropica (Apstein), Lecane acronycha Harring et Myers, L. bulla Gosse, L. chankensis Bogoslovsky, Platyias quadricornis (Ehrenberg), P. patulus (O.F. Müller), Pomphophyx complonata Gosse, Synchaeta sp., Tetramastix opoliensis Zacharias, Trichocerca cylindrica chattoni Imhof, среди Copepoda – Thermocyclops ethiopiensis Defaye, Thermodiaptomus galebi lacustris Defaye, среди Cladocera – Bosmina longirostris O.F. Müller, Ceriodaphnia cornuta Sars, Diaphanosoma excisum Sars и Moina micrura Kurz.
Удельное количество видов в зарослях погруженных растений варьировало от 16 до 43, воздушно-водных – от 22 до 42 (рис. 2а). Основу количества видов во всех пробах представляли Rotifera – 62.5–80%, доля видов Cladocera варьировала от 13.3 до 27.3%, Copepoda – от 4.7 до 12.5%. На ст. 1, 4 и 6 наибольшее количество видов в пробе отмечено в зарослях гелофитов, на станциях 2, 3 и 5 – гидатофитов. Среднее количество видов в зарослях гелофитов было больше, чем в зарослях гидатофитов, однако, различия были статистически не значимы (табл. 1).
Численность зоопланктона на участках 1а–6а варьировала от 226 до 1113 тыс. экз./м3, минимальные значения зарегистрированы на участках 2а и 4а, максимальное значение – на уч. 5а (рис. 2б). На участках “b” численность планктонных животных была в 3–12.5 раз меньше, чем на участках “а”, за счет сокращения плотности всех таксономических групп (табл. 1), лишь коловраток было на ст. 1 в 1.3 раза больше. Средняя численность сообществ и отдельных групп зоопланктеров (за исключением Rotifera) достоверно превышала таковую в зарослях гидатофитов (табл. 1). Основу численности на большинстве станций формировали Copepoda, но на участках 3а и 6а – Cladocera, на участках 2b и 4b – Rotifera, на уч. 6b – Cladocera (рис. 2б). Среди доминирующих по численности организмов на всех участках отмечены ювенильные Cyclopoida (кроме уч. 6b), а на участках 2а, 2b и 4b присутствовали Rotifera и отсутствовали Cladocera (табл. 2). Минимальное количество доминантов зарегистрировано на уч. 6b. Величины индекса Шеннона, рассчитанного по численности, варьировали в широких пределах, максимальные значения отмечены на участках 1а, 2b, 3b, минимальное – на уч. 5а (рис. 2в). На станциях 1, 4 и 6 значения индекса были выше в зарослях гидатофитов, на остальных – гелофитов.
Рис. 2.
Число видов (а), численность (б) и биомасса (в) зоопланктона, индекс Шеннона (г). 1 – Rotifera, 2 – Copepoda, 3 – Cladocera, 4 – индекс Шеннона по численности (бит/экз.), 5 – индекс Шеннона по биомассе (бит/г). На оси абсцисс: а – прибрежные участки с зарослями погруженных макрофитов, b – участки с зарослями воздушно-водных растений; 1–6 – номера станций.
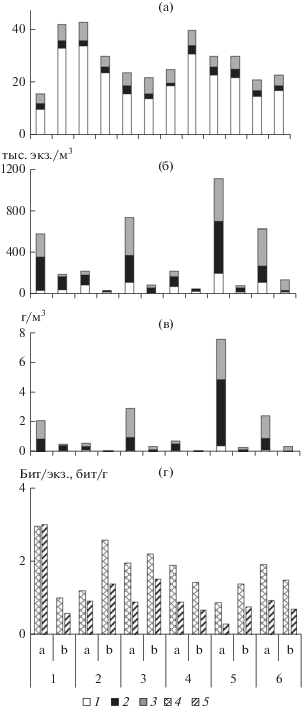
Таблица 1.
Средние (M ± SD) величины основных характеристик зоопланктона на участках с зарослями погруженных (a) и воздушно-водных (b) макрофитов
| Характеристика видов | Участки | Н-критерий | р | |
|---|---|---|---|---|
| а | b | |||
| Число видов: | ||||
| Rotifera | 19.5 ± 3.4 | 23.5 ± 3.1 | 0.64 | 0.4233 |
| Copepoda | 2.2 ± 0.3 | 2.5 ± 0.2 | 0.65 | 0.4227 |
| Cladocera | 4.8 ± 0.5 | 5.2 ± 0.4 | 0.45 | 0.5001 |
| Всего | 26.5 ± 3.8 | 31.2 ± 3.4 | 0.65 | 0.4201 |
| Численность, тыс. экз./м3: | ||||
| Rotifera | 106.9 ± 22.4 | 26.6 ± 4.8 | 7.41 | 0.0065 |
| Copepoda | 236.4 ± 63.7 | 40.8 ± 17.1 | 6.56 | 0.0104 |
| Cladocera | 241.7 ± 66.8 | 32.9 ± 14.2 | 6.56 | 0.0104 |
| Всего | 585.0 ± 136.6 | 100.3 ± 23.8 | 8.31 | 0.0039 |
| Биомасса, г/м3: | ||||
| Rotifera | 0.17 ± 0.06 | 0.037 ± 0.011 | 5.02 | 0.0250 |
| Copepoda | 1.25 ± 0.64 | 0.11 ± 0.05 | 7.41 | 0.0065 |
| Cladocera | 1.33 ± 0.41 | 0.15 ± 0.05 | 5.76 | 0.0163 |
| Всего | 2.75 ± 1.04 | 0.30 ± 0.07 | 8.31 | 0.0039 |
| Доля в общей численности, %: | ||||
| Rotifera | 22.3 ± 5.1 | 33.7 ± 8.6 | 1.25 | 0.2623 |
| Copepoda | 40.5 ± 4.2 | 37.1 ± 7.5 | 0.02 | 0.8728 |
| Cladocera | 37.2 ± 6.0 | 29.2 ± 9.8 | 1.25 | 0.2623 |
| Доля в общей биомассе, %: | ||||
| Rotifera | 10.1 ± 4.4 | 15.5 ± 3.8 | 0.64 | 0.4233 |
| Copepoda | 41.7 ± 5.8 | 36.8 ± 8.5 | 0.02 | 0.8728 |
| Cladocera | 48.2 ± 6.9 | 47.7 ± 10.7 | 0.10 | 0.7488 |
| Индекс Шеннона: | ||||
| по биомассе, бит/г | 1.80 ± 0.29 | 1.69 ± 0.24 | 0.02 | 0.8728 |
| по численности, бит/экз. | 1.16 ± 0.38 | 0.94 ± 0.16 | 0.41 | 0.5218 |
Таблица 2.
Доминирующие по численности (N) и биомассе (B) организмы зоопланктона в Бахар-Дарском заливе оз. Тана
| Участок | N | B |
|---|---|---|
| 1а | Науплиусы и копеподиты Cyclopoida, Bosmina longirostris | Копеподиты Calanoida, Thermodiaptomus galebi, Bosmina longirostris, Diaphanosoma excisum |
| 1b | Науплиусы и копеподиты Cyclopoida, Bosmina longirostris | Копеподиты Cyclopoida, Thermodiaptomus galebi, Bosmina longirostris |
| 2а | Polyarthra remata Skorikov, 1896, науплиусы Cyclopoida | Asplanchna brightwelli, Thermodiaptomus galebi, Ceriodaphnia cornuta |
| 2b | Polyarthra remata, науплиусы Cyclopoida | Копеподиты Calanoida, Thermodiaptomus galebi |
| 3а | Науплиусы и копеподиты Cyclopoida, Bosmina longirostris | Thermodiaptomus galebi, Diaphanosoma excisum |
| 3b | Науплиусы и копеподиты Cyclopoida, Ceriodaphnia cornuta | Копеподиты Cyclopoida, Ceriodaphnia cornuta |
| 4а | Науплиусы и копеподиты Cyclopoida, Bosmina longirostris | Thermodiaptomus galebi |
| 4b | Lecane bulla, копеподиты Cyclopoida | Копеподиты Cyclopoida, Ceriodaphnia cornuta, Diaphanosoma excisum |
| 5а | Науплиусы и копеподиты Cyclopoida, Bosmina longirostris | Thermodiaptomus galebi, Diaphanosoma excisum |
| 5b | Копеподиты Cyclopoida, Ceriodaphnia cornuta | Asplanchna brightwelli, копепо-диты Cyclopoida, Ceriodaphnia cornuta, Diaphanosoma excisum |
| 6а | Копеподиты Cyclopoida, Bosmina longirostris | Thermodiaptomus galebi, Bosmina longirostris, Diapha-nosoma excisum |
| 6b | Bosmina longirostris | Bosmina longirostris, Ceriodaphnia cornuta, Diaphanosoma excisum |
Биомасса зоопланктона на участках “а” варьировала от 0.585 (ст. 2) до 7.595 г/м3 (ст. 5), на участках “b” – от 0.073 (ст. 2) до 0.560 г/м3 (ст. 1) (рис. 2г). Средние величины биомассы таксономических групп беспозвоночных и сообществ в целом в зарослях гидатофитов достоверно больше, чем в зарослях гелофитов (табл. 1). Основу биомассы на большинстве биотопов составляли Cladocera, за исключением участков 4а, 5а, 1b и 2b, где максимальная доля принадлежала Copepoda (рис. 2г). Достоверных различий доли таксономических групп беспозвоночных в общей биомассе зоопланктона между двумя группами участков не выявлено, однако, в зарослях гелофитов отмечена тенденция увеличения доли Rotifera и снижения Copepoda (табл. 2). Минимальное количество доминирующих по биомассе организмов зарегистрировано на участках 4а, 2b, 3b, 5а, лишь в зарослях гелофитов на ст. 5 среди доминантов отмечен один вид коловраток, а на ст. 3–6 отсутствовали Calanoida (табл. 2). Максимальное значение индекса Шеннона, рассчитанного по биомассе, зарегистрировано на уч. 1а, минимальное – на уч. 5а (рис. 2г). На станциях 2, 3 и 5 величины индекса были выше в зарослях воздушно-водных растений, на остальных станциях – погруженных растений.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В результате проведенного исследования оз. Тана выявлено 78 видов планктонных беспозвоночных (61 – Rotifera, 4 – Copepoda, 13 – Cladocera), это больше, чем было обнаружено при изучении зоопланктона в начале влажного сезона – 44 (16 – Rotifera, 12 – Copepoda, 16 – Cladocera) (Imoobe, Akoma, 2008), а также в ходе более продолжительных исследований: 26 (7 – Rotifera, 3 – Copepoda, 7 – Cladocera) (Brunelli, Cannicci, 1940), 26 (12 – Rotifera, 3 – Copepoda, 11 – Cladocera) (Dejen et al., 2004), 17 (7 – Rotifera, 3 – Copepoda, 7 – Cladocera) (Wudneh, 1998). Литературные данные и результаты настоящих исследований свидетельствуют, что на протяжении всей истории изучения водоема основной состав наиболее распространенных и доминирующих видов не изменялся.
Анализ основных показателей среды оз. Тана позволил выделить четыре сезона, которые в разных источниках несколько варьируют. Так, по Вуднэ (Wudneh, 1998), декабрь–февраль – сухой сезон, характеризующийся минимальной температурой воды; март–май – отличающийся снижением уровня воды, небольшими дождями и относительно высокой температурой воды; июнь–август – сезон с сильными дождями, повышением уровня воды; сентябрь–ноябрь – конец сезона дождей и самый высокий уровень воды. Дейен с соавт. (Dejen et al., 2004) выделяли декабрь–апрель как длинный сухой сезон; май–июнь – сезон перед дождями; июль–сентябрь – сезон дождей; октябрь–ноябрь – сезон после дождей. Сезоны дождей способствуют водной эрозии почвы в пределах водосбора оз. Тана, ее величина в течение года колеблется от 31 до 50 т/га (Teshale et al., 2001). В результате в сезоны дождей увеличивается мутность воды, которая в основном и определяет изменения обилия и структуры зоопланктона (Akoma, 2010; Dejen et al., 2004; Imoobe, Akoma, 2008; Wudneh, 1998). Высокая иловая нагрузка способствует снижению доступности пищи для зоопланктеров из-за ограничения световых условий для первичных продуцентов, связывания растворенного органического вещества взвешенными в воде частицами и забивания фильтрационного аппарата беспозвоночных. Это нарушает ожидаемый стимулирующий эффект от поступления питательных веществ с водосбора при увеличении поверхностного стока (Wudneh, 1998).
Как правило, при описании результатов сезонных исследований зоопланктона оз. Тана авторы представляли средние значения численности и биомассы за отдельные периоды, при этом максимальные величины фиксировали в сухой сезон, в отдельных случаях указывали период с марта по май (Wudneh, 1998) или ноябрь–апрель (Dejen et al., 2004). Следовательно, во временной промежуток, отличающийся высокими количественными характеристиками зоопланктона, включались данные за март. Наши наблюдения также показали, что в марте 2018 г. численность и биомасса планктонных беспозвоночных достигали высоких величин, превышающих известные средние для сухого сезона. Так, численность ракообразных в сухой сезон 2000–2001 гг. в литоральной зоне была ~50 тыс. экз./м3, в сублиторали – ~95 тыс. экз./м3 (Dejen et al., 2004), а в марте 2018 г. – 74 и 478 тыс. экз./м3 соответственно. Средние за сухой сезон 2000 и 2001 гг. доли Copepoda и Cladocera в общей численности ракообразных в литоральной зоне были 72 и 28% соответственно, в сублиторали – 68.5 и 31.5%. В марте 2018 г. в общей численности зоопланктона в разных зонах водоема также преобладали Copepoda: в литоральной – 59.5%, в сублиторальной – 53.2%, но доля Cladocera возросла до 40.5 и 46.8% соответственно. Это косвенно свидетельствует о снижении мутности воды и формировании лучших условий для существования фильтраторов. Следовательно, есть основания полагать, что в марте создаются наиболее благоприятные условия среды для развития зоопланктона, которые выражаются в повышении температуры воды, снижении ее уровня и мутности из-за небольшого количества осадков, способствующих умеренному поступлению питательных веществ и взвеси с водосбора. По-видимому, формирование благоприятных условий для зоопланктона в оз. Тана может наблюдаться в определенные сезоны при оптимальном сочетании этого ряда факторов.
Распределение зоопланктона в основных зонах водоема так или иначе анализировалось в большинстве работ, освещающих результаты изучения оз. Тана. Наиболее часто сообщества, характеризующиеся максимальными количественными характеристиками, обнаруживали в литоральной зоне, а по направлению к глубоким участкам открытой акватории они сокращались (Akoma, 2010; Wudneh, 1998). Однако Дейен с соавт. (Dejen et al., 2004) наибольшую плотность ракообразных регистрировали в сублиторали, а наименьшую – в литоральной зоне. Такое распределение позже объяснялось тем, что участки литоральной зоны были лишены зарослей макрофитов (Akoma, 2010). Результаты наших исследований показали, что сообщества литорали также уступали сообществам сублиторали по уровню количественных характеристик, хотя на обоих типах мелководий были представлены заросли макрофитов. Следовательно, количественные характеристики зоопланктона в прибрежной зоне определяются не только наличием или отсутствием макрофитов, но и их принадлежностью к разным экологическим группам, плотностью растений, близостью расположения к береговой линии и колебаниями уровня воды. Для полностью заросших гелофитами прибрежных участков характерны меньшие численность и биомасса, но бо́льшая доля коловраток в общей численности и биомассе зоопланктона. Это может определяться низкой емкостью среды из-за высокой плотности зарослей, а также влиянием макрофитов на абиотические и биотические условия водоема. В густых зарослях происходит гипераккумуляция органического вещества, ухудшается кислородный режим, накапливается аммонийный азот, сероводород и болотный газ (Дьяченко, 2011). Эти факторы также могут приводить к сокращению количества основной пищи планктонных беспозвоночных – фитопланктона, в первую очередь, вследствие повышенной затененности. Показано, что в густых зарослях воздушно-водных растений лишь <1% фотосинтетически активной радиации достигает поверхности воды, что обусловливает невысокую численность водорослей (Комаркова и др., 1983; Халиуллина, Яковлев, 2015). Необходимо отметить, что зоопланктон уч. 1b имел ряд существенных отличий от остальных участков с зарослями гелофитов – высокое удельное число видов, максимальные численность и биомассу. На наш взгляд, это определяется положением станции в устьевой области реки, благодаря чему при смешении речных и озерных вод наблюдается краевой эффект. Кроме того, здесь аккумуляция органического вещества водосбора плавно распределяется в зарослях вдоль течения реки, по сравнению с озерными береговыми буферными участками зарослей гелофитов, которые принимают на себя всю нагрузку поверхностного стока. В разреженных зарослях гидатофитов, находящихся в необсыхающих в сухой сезон участках с бóльшими глубинами, условия среды были более благоприятными для зоопланктона.
Среди факторов, определяющих распределение зоопланктеров, ведущее значение имеет также контроль со стороны хищников. Роль рыб (Clarias gariepinus (Burchell, 1822), Barbus brevicephalus и B. trispilopleura) в горизонтальном распределении зоопланктона оз. Тана рассматривалась при сравнении сообществ в глубоководных и прибрежных участках. Показано, что в центральных глубоководных участках, где плотность рыб выше (Dejen et al., 2004), зоопланктон характеризуется меньшими количественными характеристиками и преобладанием мелких форм беспозвоночных (Akoma, 2010; Dejen et al., 2002; Imoobe, Akoma, 2008). Однако и на участках прибрежья концентрация рыб может различаться. Это может быть связано с прессом рыбоядных птиц и других рыбоядных хищников, а также с интенсивностью рыболовства и абиотическими факторами, в частности, с кислородным режимом. Рыбы характеризуются двумя типами поведения относительно жертвы: они могут выбирать более заметных жертв, либо переключаться на более многочисленную жертву, даже если она имеет небольшие размеры (Gliwicz, 2002; Murdoch, 1969; Murdoch et al., 1975). В результате изменяется степень доминирования видов и, как следствие, величины индекса Шеннона. Предположительно, одна из причин разного соотношения величин индексов Шеннона зоопланктона на участках, заросших разными экологическими группами водных растений в пределах одной станции, – плотность рыб и хищных нектонных беспозвоночных. На станциях 2, 3 и 5 они могли преобладать в зарослях воздушно-водных макрофитов, на станциях 1, 4 и 6 – погруженных, в результате чего в первой группе станций значения индексов были выше в зарослях гелофитов, а во второй – гидатофитов (рис. 2в). Об этом также свидетельствует разница количественных характеристик зоопланктона между двумя участками, характеризующая эффект выедания. Так, на станциях 2, 3 и 5 численность Cladocera в зоне гелофитов была ниже, чем в зоне гидатофитов в 16.4, 10.1 и 14.8 раз соответственно, на станциях 1, 4 и 6 – в 9.1, 7.3 и 6.1, общая численность – в 7.4, 7.8, 12.5 и в 3.0, 4.0, 4.5 раз соответственно (рис. 2б). Аналогичная разница наблюдалась по биомассе Cladocera, которая в зарослях гелофитов на станциях 2, 3 и 5 была меньше, чем в зарослях гидатофитов в 23.9, 9.2, 15.9 раз, в то время как на станциях 1, 4 и 6 – в 8.4, 4.1 и 4.8, а общая биомасса в 8.0, 8.1, 24.8 и 3.8, 6.9 и 6.6 раз соответственно (рис. 2г).
Выводы. В марте зоопланктон прибрежных участков оз. Тана характеризуется богатством качественного состава планктонных беспозвоночных (61 – Rotifera, 4 – Copepoda, 13 – Cladocera) и высокими количественными характеристиками. Максимальные численность и биомасса зоопланктона обнаружены в зарослях гидатофитов (степень зарастания 10–50%), в зарослях гелофитов (степень зарастания 100%) плотность и биомасса сообществ были достоверно меньше. Различия количественных характеристик зоопланктона в заросших гелофитами и гидатофитами участках в пределах отдельных станций могут определяться контролем со стороны рыб и беспозвоночных хищников, при увеличении которого возрастают индексы Шеннона и сокращаются количественные показатели планктонных беспозвоночных.
Список литературы
Балушкина Е.Б., Винберг Г.Г. 1979. Зависимость между массой и длиной тела у планктонных животных // Общие основы изучения водных экосистем. Ленинград: Наука. С. 169.
Дьяченко Т.Н. 2011. Биологические и экологические особенности тростника южного (Phragmites australis) в аспекте оптимального использования его ресурсов // Гидробиол. журн. Т. 47. № 4. С. 23.
Комаркова И.Я., Марван П., Рычкова М.А. 1983. Первичная продукция и роль водорослей в литоральной зоне водоемов различного типа // Гидробиологические процессы в водоемах. Ленинград: Наука. С. 81.
Методика изучения биогеоценозов внутренних водоемов. 1975. Москва: Наука.
Халиуллина Л.Ю., Яковлев В.А. 2015. Фитопланктон мелководий в верховьях Куйбышевского водохранилища. Казань: Изд-во Академии наук РТ.
Africa: Atlas of Our Changing Environment. 2008. Nairobi: United Nations Environment Program (UNEP).
African Economic Outlook. Sustainable Cities and Structural Transformation. 2016. Paris: OECD Publishing.
Akoma O.C. 2010. Hydrobiological Survey of the Bahir Dar Gulf of lake Tana, Ethiopia // African Research Review. V. 4(2). P. 57.
Brunelli G., Cannicci E.G. 1940. Le Caratteristiche Biologiche del Lag Tana. Missione di Studio al Lago Tana richerge limnologiche // Bollettino di Chemica e Biologia, Reale Accademia d’Italia. V. 3. P. 71.
Dejen E., Rutjes H.A., de Graaf M. et al. 2002. The “small barbs” Barbus humilis and B. trispilopleura of Lake Tana (Ethiopia): are they ecotypes of the same species? // Environ. Biol. Fishes. V. 65. P. 373.
Dejen E., Vijverberg J., Nagelkerke L.A.J., Sibbing F.A. 2004. Temporal and spatial distribution of microcrustacean zooplankton in relation to turbidity and other environmental factors in a large tropical lake L. Tana, Ethiopia // Hydrobiologia. V. 513. P. 39–49.
Gliwicz Z.M. 2002. On the different nature of top-down and bottom-up effects in pelagic food webs // Freshwater Biol. V. 47. P. 2296.
Imoobe T.O.T., Akoma O.C. 2008. Assessment of zooplankton community structure of the Bahir Dar gulf of Lake Tana, Ethiopia // Ethiopian J. Environmental Studies
Management. V. 1. № 2. P. 26.
Murdoch W.W. 1969. Switching in general predators: experiments on predator specificity and stability of prey populations // Ecological Monographs. V. 39. P. 335.
Murdoch W.W., Avery S., Smyth M.E.B. 1975. Switching in predatory fish // Ecology. V. 56. P. 1094.
Rzóska J. 1976. Lake Tana, headwater of the Blue Nile // The Nile, Biology of Ancient River. The Hague; The Netherlands: Dr W. Junk Publishers. P. 223.
Teshale B., Lee R., Zawdie G. 2001. Development initiatives and challenges for sustainable resource management and livelihood in the Lake Tana region of Northern Ethiopia // Proceedings of the Wetland Awareness Creation and Activity Identification Workshop in Amhara National Regional State. January 23rd 2001. Bahar Dar, Ethiopia. P. 33.
Wondie A., Mengistu S., Vijverberg J., Dejen E. 2007. Seasonal variation in primary production of a high altitude tropical lake (Lake Tana, Ethiopia); effects of nutrient availability and water transparency // Aquat. Ecol. V. 4. P. 195.
Wudneh T. 1998. Biology and Management of Fish Stocks in Bahar Dar Gulf, Lake Tana, Ethiopia. PhD Thesis. Wageningen: Wageningen Agricultural University.
Zelalem W., Prokin A. 2017. Physico-chemical characteristics and macrozoobenthos abundance in the Gulf of Lake Tana // Ethiopian Journal of biological sciences. V. 16. № 2. P. 181.
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод


