Биология внутренних вод, 2020, № 2, стр. 192-197
Влияние холинолитиков на скорость пищевой реакции карпа Cyprinus carpio L.
Е. С. Смирнова a, В. В. Кузьмина a, *
a Институт биологии внутренних вод им. И.Д. Папанина Российской академии наук
Некоузский р-н, Ярославская обл. пос. Борок, Россия
* E-mail: vkuzmina@ibiw.yaroslavl.ru
Поступила в редакцию 25.01.2018
После доработки 29.05.2018
Принята к публикации 27.11.2018
Аннотация
Исследовано влияние холинолитиков, блокирующих передачу сигналов в холинергической системе, на скорость пищевой реакции молоди карпа Cyprinus carpio L. Выявлены различия в величине и продолжительности эффектов холинолитиков, действующих на М- и Н-холинорецепторы, на один из показателей пищевого поведения рыб – скорость пищевой реакции. При введении наибольшей дозы (1.0 мг/кг массы тела) атропина и метацина максимальное увеличение латентного времени питания (уменьшение скорости пищевой реакции) рыб на 710 и 224% соответственно наблюдается через 1.5 ч, пентамина – на 249% через 30 мин после введения; возвращение к норме – через 9 ч при использовании атропина и метацина, через 8 ч – пентамина. Уменьшение дозы всех исследованных препаратов вызывает дозозависимое снижение времени их действия и величины латентного времени питания. Разная степень снижения скорости пищевой реакции при введении препаратов, оказывающих преимущественно центральное (атропин) и периферическое (метацин, пентамин) действие, свидетельствует о зависимости этого параметра от их влияния на М- или Н-холинорецепторы.
ВВЕДЕНИЕ
Известна важная роль нервной системы в регуляции пищевого поведения рыб и особая значимость рефлекторного торможения и возбуждения пищевого центра, а также слабая степень его развития у рыб (Пегель, 1979). Показано, что в контроль за питанием рыб вовлечены теленцефалон, гипоталамус и другие области головного мозга (Андреева, Обухов, 1999; Кузьмина, 2015; Cerda-Reverter, Canosa, 2009; Peter, 1979). У рыб разных таксономических групп выявлена зона гипоталамуса (inferior lobes), связанная с регуляцией питания. Нейроны этой зоны возбуждаются при стимуляции вкусовых и обонятельных рецепторов, а также ядер блуждающего нерва. Их электрическая стимуляция вызывает поисковую пищевую реакцию (Demski, 1982, 2012).
Поскольку пищевой центр гипоталамуса тесно связан с мозжечком, стволом мозга и спинным мозгом, он опосредует координацию сенсомоторных компонентов питания, визуальную, акустическую, механо- и электрорецептивную, а также соматосенсорную информацию, включая контроль за энергетическими запасами, обеспечивает мультисенсорный контроль питания хрящевых и костистых рыб (Андреева, Обухов, 1999; Demski, 2012). При этом особенно важна связь пищевого центра с передним мозгом, обрабатывающим указанную выше информацию (Андреева, Обухов, 1999).
Известно, что в регуляции питания и пищеварения рыб участвуют холинергические механизмы. Выделяют два основных типа холинэстераз: ацетилхолинэстераза (ацетилхолин ацетилгидролаза, К.Ф. 3.1.1.7) и холинэстераза (ацилхолин ацилгидролаза, К.Ф. 3.1.1.8), представленная рядом ферментов, в том числе бутирилхолинэстеразой. Ацетилхолинэстераза гидролизует ацетилхолин, роль бутирилхолинэстеразы не достаточно выяснена (Чуйко, Подгорная, 2007).
Ацетилхолин – один из наиболее важных трансмиттеров, контролирующих когнитивные функции (Захарова, Дудченко, 2012), а также моторику и секрецию кислоты в пищеварительной системе (Шпарковский, 1986; Tobin et al., 2009). Ключевой фермент синтеза ацетилхолина – холинацетилтрансфераза, катализирующая синтез медиатора из холина и ацетилкоэнзима А. Ацетилхолин синтезируется в нервных окончаниях нейронов. Биомаркеры холинергических нейронов – холинацетилтрансфераза (ChAT), ацетилхолинэстераза и везикулярный транспортер ацетилхолина (VAChT) (Arvidsson et al., 1997; Olsson, 2011; Schemann et al., 1993). Иммуногистохимические и фармакологические эксперименты позволили предположить, что у атлантической трески Gadus morhua L. ChAT- и VAChT-иммунореактивные нервные клетки содержат как моторные нейроны, так и интернейроны (Karila, Holmgren, 1995; Uyttebroek et al., 2010). Однако недостаток специфических антисывороток холинацетилтрансферазы и везикулярного транспортера ацетилхолина не позволяет получить данные о распределении холинергических нейронов у рыб (Olsson, 2011).
В качестве маркера холинергических нейронов чаще рассматривают ацетилхолинэстеразу, выявленную у многих видов рыб. Ее отмечали в телах нервных клеток и в нервных окончаниях, контактирующих с мышечными волокнами поперечно-полосатой мускулатуры пищеварительного тракта рыб (Чуйко, Подгорная, 2007; Шпарковский, 1986; Domeneghini et al., 1999, 2000; Radaelli et al., 2001). При исследовании гибрида спаровых рыб Pagrus major (Temminck & Schlegel, 1843) × Dentex dentex L. сильная реакционная способность обнаружена в телах нервных клеток Ауэрбахова сплетения дистальной части кишечника рыб (Radaelli et al., 2001). Фармакологические данные также показали вагусную холинергическую иннервацию у костистых (Nilsson, 1983).
Особого внимания заслуживает блуждающий нерв, осуществляющий связь между центральной нервной системой и периферией. При исследовании Danio rerio (Hamilton) показано, что первые нервные клетки появляются в кишечнике в течение 48 ч после оплодотворения (Holmberg et al., 2004), а через 3 сут после него (за 2–3 сут до начала экзогенного питания) нервные волокна большей части кишечника начинают экспрессировать различные сигнальные вещества (Holmberg et al., 2003; Olsson et al., 2008). У большинства видов рыб блуждающий нерв иннервирует часть пищевода, желудок и проксимальную часть кишечника, у некоторых видов рыб – только пищевод (Краюхин, 1963; Holmgren, Olsson, 2009; Nilsson, 1983). Помимо этого, пищеварительная система рыб находится под контролем автономной нервной системы, представленной парасимпатическим, симпатическим и метасимпатическим отделами (Краюхин, 1963; Шпарковский, 1986; Fange, Grove, 1979). Холинергические механизмы, обеспечивающие передачу информации от межмышечного, подслизистого и субсерозного нервных сплетений, играют важную роль в осуществлении периферических рефлексов (Шпарковский, 1986).
Активность ацетилхолинэстеразы обнаружена в различных органах и плазме крови, однако, наибольшая активность выявлена в мозге, где она играет важную роль в регуляции пищевого поведения рыб (Чуйко, Подгорная, 2007). Снижение активности ацетилхолинэстеразы при хроническом действии фосфорорганических соединений на рыб вызывает дискоординацию пищевого поведения и приводит к снижению количества потребляемого корма (Чуйко, Подгорная, 2007). Так, введение атропина (блокатора М-холинергических синапсов) лещу Abramis brama L., подвергшемуся действию фосфорорганического пестицида, приводит к восстановлению интенсивности питания и активности ацетилхолинэстеразы в мозге рыб, что подтверждает важную роль холинергической системы в регуляции их пищевого поведения (Chuiko et al., 2004). Сведения о влиянии холинолитиков различной природы на скорость пищевой реакции, одну из важных характеристик пищевого поведения рыб, до начала нашей работы отсутствовали.
Цель работы – исследовать влияние холинолитиков на скорость пищевой реакции пресноводных костистых рыб (на примере карпа).
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объектом исследования была молодь карпа Cyprinus carpio L. массой тела 7.31 ± 0.26 г. Опыты проводили при температуре 15 ± 2°С в непроточных аквариумах с принудительно аэрируемой водой объемом 40 л, площадью поверхности 30 × 50 см. До начала опытов рыб кормили ежедневно комбикормом в количестве 5% массы тела. Предварительно рыб акклимировали в течение 2 нед. к условиям эксперимента, приучая их брать корм с пинцета у поверхности воды. В качестве корма использовали мышечные волокна плотвы, близкие по форме и массе таковой личинок хирономид Chironomus sp. За 2 сут до опытов кормление рыб прекращали. В течение всего эксперимента рыб не кормили (получали только мышечные волокна плотвы во время каждого опыта). Для исследования влияния холинолитиков на скорость пищевой реакции молоди карпа формировали четыре группы рыб (одну контрольную и три опытных) по семь особей в каждой. Рыбам контрольной группы при помощи инсулинового шприца внутрибрюшинно вводили 0.2 мл раствора Рингера для холоднокровных животных (109 мM NaCl, 1.9 мM KCl, 1.1 мM CaCl2, 0.84 мM NaHCO3). Рыбам опытных групп вводили тот же объем раствора холинолитиков, приготовленных на основе раствора Рингера: метоциния йодид C19H24INO3 (метацин), атропина сульфат C17H23NO3 (атропин) – М-холинолитики, и азаметония бромид C13H33Br2NO3 (пентамин) – Н-холинолитик. Исследуемые вещества вводили в дозах 1.0, 0.75, 0.5, 0.1 или 0.05 мг/кг массы тела. Рыбам каждой группы исследуемый препарат вводили последовательно, начиная с минимальной дозы. Интервал между опытами в зависимости от дозы препарата колебался от одной до двух недель. В этот период рыб кормили ежедневно комбикормом в количестве 5% массы тела. Следующая серия опытов начиналась после полного восстановления нормы.
Скорость пищевой реакции оценивали по ЛВП рыб – величине, обратно пропорциональной скорости пищевой реакции. Критерием служил промежуток времени (с) от момента соприкосновения пищи с поверхностью воды в центре аквариума до момента схватывания ее первой из группы рыб (Пегель, 1979). Опыты проводили один раз в сутки. За 1 ч до опыта в аквариумах меняли 1/2 объема воды. Рыб контрольной группы инъецировали в 9 ч, опытных – последовательно через каждые 5 мин после окончания процедуры инъецирования рыб соответствующей группы. Показания снимали сразу после инъекции (“нулевая” точка), через 30 мин и далее через каждый час в течение 9 ч после инъекции исследуемых веществ. Всего проведено 20 опытов (129 определений ЛВП).
Вычисляли значения средних арифметических и ошибок среднего. С помощью t-критерия Стьюдента для малых выборок рассчитывали достоверность различий между данными опыта и контроля при р < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
При исследовании влияния максимальной дозы (1 мг/кг массы тела) метацина, атропина и пентамина на пищевое поведение рыб зарегистрированы увеличение ЛВП и различия в величине и продолжительности эффекта указанных препаратов (рис. 1 ). При введении атропина максимальное увеличение ЛВП (на 710%) наблюдали через 1.5 ч после начала эксперимента, при введении метацина – на 224% в то же время, при введении пентамина – на 249% через 30 мин после начала эксперимента. Несмотря на снижение ЛВП у рыб опытных групп, в течение 7 ч эксперимента их показатели достоверно отличались от таковых контроля (р < 0.05). Возвращение ЛВП к норме в первых двух случаях наблюдалось через 9 ч, в последнем – через 8 ч.
Рис. 1. Зависимость влияния холинолитиков на ЛВП Cyprinus carpio L. По оси ординат – ЛВП, с; по оси абсцисс – время, ч. Доза препарата, мг/кг: а – 1.0, б – 0.75, в – 0.5, г – 0.1, д – 0.05 мг/кг. ⚫ – контроль, ◻ – атропин, ▲ – метацин, ⚪ – пентамин.
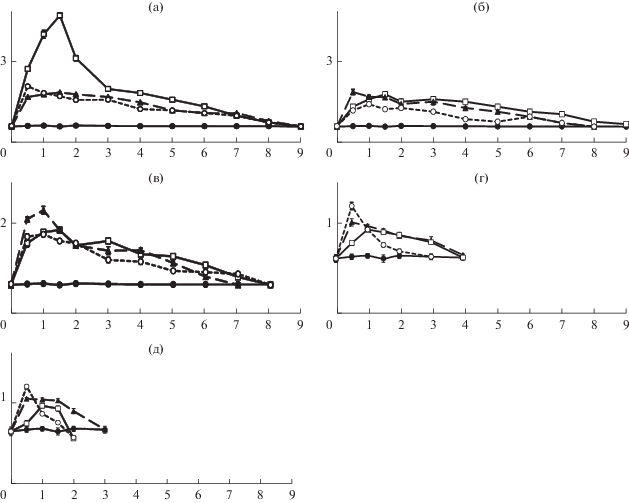
При исследовании влияния меньших доз этих веществ (0.75 и 0.5 мг/кг массы тела) на пищевое поведение рыб установлено более чем двукратное снижение ЛВП под влиянием атропина по сравнению с дозой 1 мг/кг массы тела, а также уменьшение продолжительности эффектов метацина и пентамина до 8 ч (в случае метацина в дозе 0.5 мг/кг массы тела до 7 ч). Следует отметить более резкое снижение ЛВП под влиянием атропина, особенно через 1.5 ч после введения препарата в этих дозах по сравнению с бóльшей дозой (1 мг/кг массы), а также укорочение сроков возвращение ЛВП к норме, когда наблюдались достоверные отличия показателей опытов от таковых контроля.
При исследовании влияния низких доз (0.1 и 0.05 мг/кг массы тела) указанных веществ отмечено еще большее снижение величины ЛВП, особенно при использовании атропина и метацина, по сравнению дозами препаратов 0.5–1.0 мг/кг массы тела. Максимальное увеличение ЛВП под влиянием метацина наблюдалось через 30 мин, атропина – через 1 ч после введения (на 65.6 и 57.4% соответственно при дозе 0.1 мг/кг массы тела и на 48.4 и 11.5% при дозе 0.05 мг/кг массы тела). При использовании пентамина ЛВП увеличивалось на 93.4 и 75.4% соответственно. Продолжительность эффекта препаратов при дозе 0.1 мг/кг массы тела снижалась до 4 ч (атропин, метацин) и 3 ч (пентамин), при дозе 0.05 мг/кг массы тела – до 3 ч (метацин) и 2 ч (атропин, пентамин).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Поскольку сведения о влиянии холинолитиков на пищевое поведение рыб ограничены (Chuiko et al., 2004), важно отметить, что полученные данные подтверждают участие парасимпатической нервной системы (Шпарковский, 1986; Domeneghini et al., 1999, 2000; Radaelli et al., 2001) и значительную роль М- и Н-холинорецепторов в проведении импульсов, обеспечивающих реализацию процессов пищеварения (Шпарковский, 1986; Nilsson, 1983), существенно влияющих на их пищевое поведение.
Действительно, блокада М- и Н-рецепторов различными холинолитиками вызывает дозозависимое увеличение ЛВП рыб. При этом степень увеличения и характер изменения показателя различны. Так, эффект метацина и пентамина резко возрастает при увеличении дозы от 0.1 до 0.5 мг/кг массы тела. Зависимость эффекта атропина от дозы в большинстве случаев сходна с описанной выше, однако наблюдается резкое увеличение показателя при повышении дозы до 1 мг/кг массы тела.
Также обращают на себя внимание значительно бóльшие эффекты атропина по сравнению с метацином и пентамином в течение первых 1.5 ч после введения препарата. Последнее может быть обусловлено их различным действием на нервную систему. Действительно, атропин – классический М-холиноблокатор, нарушающий проведение нервного импульса в результате конкуренции с ацетилхолином и блокирования разных подтипов М-холинорецепторов в области окончаний парасимпатических нервных волокон (Усов и др., 1990).
Метацин и пентамин, будучи периферическими холинолитиками, действуют на холинорецепторы периферических тканей. Этот факт свидетельствует о важной роли сигналов, поступающих из периферии, в том числе пищеварительной системы (Holmgren, Olsson, 2009; Olsson, 2011), в реализации пищевого поведения рыб. Метацин конкурентно блокирует М-холинорецепторы преимущественно периферических холинергических структур. Пентамин прерывает проведение нервных импульсов через вегетативные ганглии, блокируя Н-холинорецепторы парасимпатических и симпатических вегетативных ганглиев, а также уменьшает выделение адренергических веществ надпочечниками. При этом первый не проникает через гематоэнцефалический барьер, второй может частично преодолевать его (Усов и др., 1990).
Кроме того, при использовании минимальных доз пенамина показано, что его эффект снижается в меньшей степени по сравнению с таковым атропина и метацина. Выявленные различия могут быть обусловлены тем, что пентамин блокирует не только Н-холинорецепторы, расположенные в парасимпатических, но и в симпатических ганглиях, а также в хромаффинной ткани надпочечников, что может приводить к уменьшению выделения адреналина.
Поскольку холинолитики, действующие на периферические холинорецепторы и блокирующие информацию, поступающую от пищеварительного тракта, оказывают меньшее воздействие на скорость пищевой реакции рыб, чем холинолитик, обладающий центральным действием, не исключено, что последний может блокировать передачу сигналов не только от пищеварительной системы, но и от сенсорных систем. При этом создается впечатление, что более ярко выраженный дозозависимый эффект атропина может быть обусловлен его участием в проведении импульсов, поступающих от различных сенсорных систем – визуальной, акустической, механо- и электрорецептивной – и обеспечивающих мультисенсорный контроль питания (Андреева, Обухов, 1999). Сопоставление данных, касающихся малых доз М-холинолитиков, свидетельствует о большей продолжительности действия М-холинолитиков по сравнению с Н-холинолитиками, что, по-видимому, связано с разным количеством рецепторов тех и других.
Выводы. Выявлены различия в величине и продолжительности эффектов холинолитиков, действующих на М- и Н-холинорецепторы, на один из показателей пищевого поведения рыб – скорость пищевой реакции. При введении наибольшей дозы (1.0 мг/кг массы тела) атропина и метацина максимальное увеличение ЛВП рыб на 710 и 224% соответственно наблюдается через 1.5 ч, пентамина – на 249% через 30 мин после введения, возвращение к норме – через 9 ч (в опытах с атропином и метацином) и 8 ч (с пентамином). Снижение дозы препаратов вызывает дозозависимое укорочение времени их действия и снижение ЛВП. Эффект меньших доз пентамина снижается в меньшей степени по сравнению с таковым метацина и атропина. Разная степень снижения скорости пищевой реакции при введении препаратов, оказывающих преимущественно центральное (атропин) и периферическое (метацин, пентамин) действие, свидетельствует о зависимости этого параметра от их влияния на М- или Н-холинорецепторы.
Список литературы
Андреева Н.Г., Обухов Д.К. 1999. Эволюционная морфология нервной системы позвоночных. Санкт-Петербург: Лань.
Захарова Е.И., Дудченко А.М. 2012. Холинацетилтрансфераза и еe роль в регуляции обмена и секреции ацетилхолина // Патогенез. Т. 10. № 4. С. 29.
Краюхин Б.В. 1963. Физиология пищеварения пресноводных костистых рыб. Москва: Изд-во АН СССР.
Кузьмина В.В. 2015. Процессы экзотрофии у рыб. Организация. Регуляция. Адаптации. Москва: Полиграф-Плюс.
Пегель В.А. 1979. Эколого-физиологические особенности пищеварения у рыб // Современные вопросы экологической физиологии рыб. Москва: Наука. С. 42.
Чуйко Г.М., Подгорная В.А. 2007. Холинэстеразы пресноводных костистых рыб // Физиология и токсикология пресноводных животных. Рыбинск: Дом печати. С. 100.
Шпарковский И.А. 1986. Физиология пищеварения рыб. Двигательная функция. Ленинград: Наука.
Усов И.Н., Фурсевич B.M., Кевра М.К. 1990. Фармако-рецептурный справочник педиатра. Минск: Вышэйша школа.
Arvidsson U., Riedl M., Elde R. et al. 1997. Vesicular acetylcholine transporter (VAChT) protein: a novel and unique marker for cholinergic neurons in the central and peripheral nervous systems // J. Comp. Neurol. V. 378. P. 454.
Cerda-Reverter J.M., Canosa L.F. 2009. Neuroendocrine systems of the fish brain // Fish Physiology. Cambridge, MA: Academic Press. P. 3.
Chuiko G.M., Gerassimov Y.V., Pavlov D.D. 2004. Cholinergic regulation of feeding behavior of bream Abramis brama, a freshwater teleost // Abstr. Pavlov Centenary Symposium Integrative physiology&behaviour. Saint Petersburg. P. 50.
Demski L.S. 1982. A hypothalamic feeding area in the brain of sharks and teleosts // Florida Mar. Res. Publ. V. 45. № 1. P. 34.
Demski L.S. 2012. The neural control of feeding in elasmobranchs: A review and working model // Environ. Biol. Fish. V. 95. Issue 1. P. 169.
Domeneghini C., Arrighi S., Radaelli G. et al. 1999. A morphological and histochemical analysis of the neuroendocrine system of the gut in Acipenser transmontanus // J. Appl. Ichthyol. V. 15. P. 81.
Domeneghini C., Radaelli G., Krighi S. et al. 2000. Neurotransmitters and putative neuromodulators in the gut of Anguilla anguilla (L.). Localizations in the enteric nervous and endocrine systems // Eur. J. Histochem. V. 44. P. 295.
Fange R., Grove D. 1979. Digestion // Fish physiology. New York: Acad. Press. V. 8. P. 162.
Holmgren S., Olsson C. 2009. The neuronal and endocrine regulation of gut function // Fish Physiology. Cambridge: Academic Press. V. 28. P. 467.
Holmberg A., Schwerte T., Fritsche R. et al. 2003. Ontogeny of intestinal motility in correlation to neuronal development in zebrafish embryos and larvae // J. Fish Biol. V. 63. P. 318.
Holmberg A., Schwerte T., Pelster B. et al. 2004. Ontogeny of the gut motility control system in zebrafish Danio rerio embryos and larvae // J. Exp. Biol. V. 207. P. 4085.
Karila P., Holmgren S. 1995. Enteric reflexes and nitric oxide in the fish intestine // J. Exp. Biol. V. 198. P. 2405.
Nilsson S. 1983. Autonomic Nerve Function in the Vertebrates // Zoophysiology. V. 13. Berlin: Springer. P. 5.
Olsson C. 2011. The Enteric Nervous System // Fish Physiology. The multifunctional gut of fish. Amsterdam: Acad. Press. V. 30. P. 320.
Olsson C., Holmberg A., Holmgren S. 2008. Development of enteric and vagal innervation of the zebrafish (Danio rerio) gut // J. Comp. Neurol. V. 508. P. 756.
Peter R.E. 1979. The brain and feeding behaviour // Fish Physiology. V. 8. New York: Acad. Press. P. 121.
Radaelli G., Domeneghini C., Arrighi S. et al. 2001. Neurotransmitters, neuromodulators, and neurotrophin receptors in the gut of pantex, a hybrid sparid fish (Pagrus major x Dentex dentex). Localizations in the enteric nervous and endocrine systems // Histol. Histopathol. V. 16. P. 845. https://doi.org/10.14670/HH-16.845
Schemann M., Sann H., Schaaf C. et al. 1993. Identification of cholinergic neurons in enteric nervous system by antibodies against choline acetyltransferase // Amer. J. Physiol. V. 265. P. G1005.
Tobin G., Giglio D., Lundgren O. 2009. Muscarinic receptor subtypes in the alimentary tract // J. Physiol. Pharmacol. V. 60. P. 3.
Uyttebroek L., Shepherd I.T., Harrisson F. et al. 2010. Neurochemical coding of enteric neurons in adult and embryonic zebrafish (Danio rerio) // J. Comp. Neurol. V. 518. № 21. P. 4419.
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод


