Биология внутренних вод, 2020, № 4, стр. 325-333
Флора золотистых водорослей (Chrysophyceae: Synurales, Paraphysomonadales) дельты р. Меконг
Е. С. Гусев a, c, *, В. А. Гусаков b, c, Е. Е. Гусева a, М. С. Куликовский a, А. И. Цветков b, c, Ку Нгуен Динь c
a Институт физиологии растений им. К.А. Тимирязева Российской академии наук
Москва, Россия
b Институт биологии внутренних вод им. И.Д. Папанина Российской академии наук
пос. Борок, Некоузский р-н, Ярославская обл., Россия
c Российско-Вьетнамский тропический научно-исследовательский и технологический центр
Ханой, Вьетнам
* E-mail: algogus@yandex.ru
Поступила в редакцию 02.08.2019
После доработки 10.10.2019
Принята к публикации 23.11.2019
Аннотация
Приведены первые данные о флоре золотистых водорослей из порядков Synurales, Paraphysomonadales. Выявлено 15 таксонов, из них 9 рода Mallomonas, 1 – рода Synura, 5 родa Paraphysomonas. Шесть таксонов впервые отмечены во Вьетнаме. Распределение найденных таксонов по станциям было неравномерным, чаще всего присутствовало по одному-два вида. Наибольшее количество видов (12) зарегистрировано на станции с соленостью воды >1 г/л. С учетом предыдущих флористических исследований золотистых водорослей Вьетнама количество таксонов, известных из водных объектов страны, увеличилось до 66. Расширен список видов, обнаруженных при величинах солености воды ~1 г/л.
ВВЕДЕНИЕ
Река Меконг – основная водная артерия Юго-Восточной Азии и одна из крупнейших рек Мира. На берегах р. Меконг и его притоков в настоящее время проживает ~70 млн человек из шести стран: Китая, Мьянмы, Таиланда, Лаоса, Камбоджи и Вьетнама. Дельта р. Меконг, расположенная почти целиком на территории Вьетнама, – один из самых густонаселенных районов страны с населением >17 млн человек и средней плотностью >400 жителей на квадратный километр. В настоящее время природные и социальные системы дельты р. Меконг сталкиваются с многочисленными проблемами, ведущими к усилению деградации окружающей среды. Это – все возрастающая урбанизация и гидростроительство в бассейне, увеличение степени загрязнения и обеднение биоресурсов вследствие сельскохозяйственной, промышленной и другой деятельности человека на водосборе и непосредственно на самой реке. Новые риски связаны также с глобальными изменениями климата, а именно – потеплением, в результате которого может произойти повышение уровня океана. Последнее приведет к подтоплению значительных территорий в устьевой части дельты, а также к засолению почв и воды (Cosslett T., Cosslett P., 2014; Kuenzer, Renaud, 2012; Räsänen, 2014). В связи с этим, актуальны оценка современного состояния окружающей среды в бассейне дельты и в самой реке и прогноз его дальнейших изменений вследствие вышеупомянутых угроз. В рамках данных задач в 2018 г. начаты комплексные исследования по изучению внутренних и контурных сообществ гидробионтов в разнотипных рукавах р. Меконг на территории Вьетнама, а также основных факторов, определяющих их структурно-функциональную организацию на современном этапе.
Золотистые (хризофитовые) водоросли – обширная группа организмов, относящихся к эволюционной линии Stramenopiles или Heterokontophyta, включает >1200 видов (Kristiansen, Škaloud, 2017). Прежде всего, золотистые водоросли – основной компонент фитопланктона, однако они могут играть важную роль в бентосе и нейстоне. Подходы к их систематике долгое время зависели (и зависят) от применяемых методов, и видовая концепция группы менялась несколько раз, что связано с развитием электронно-микроскопических, биохимических и молекулярно-генетических методов (Kristiansen, 2005; Kristiansen, Škaloud, 2017; Škaloud et al., 2013). К настоящему времени только для чешуйчатых золотистых водорослей (Synurales и Paraphysomonadales) хорошо разработана непротиворечивая система морфологических критериев для различения таксонов, которая согласуется с молекулярно-генетическими данными (Scoble, Cavalier-Smith, 2014; Siver et al., 2015; Škaloud et al., 2013). Это позволяет широко использовать их в палеоэкологических исследования как виды-индикаторы (Siver, 1991; Siver, Lott, 2012; Smol, 2005). В тропических водоемах выявлена богатая и своеобразная флора водорослей из различных классов, включающая много эндемичных видов (Kristiansen, 2001; Kristiansen, Preisig, 2007; Glushchenko, Kulikovskiy, 2018, 2019 и др. работы). Только из Вьетнама за последние 7 лет описано >10 новых видов родов золотистых водорослей Mallomonas и Synura (Gusev, 2012, 2013, 2015a; Gusev, Siver, 2017; Siver et al., 2018), однако специализированных исследований золотистых водорослей р. Меконг не проводили.
Цель работы – исследовать флору золотистых водорослей в дельте р. Меконг.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Длина р. Меконг достигает 4505 км, площадь водосборного бассейна ~795 тыс. км2, среднегодовой расход воды ~475 км3. В нижнем течении река разбивается на несколько рукавов, формируя обширную дельту, площадь которой составляет ~41 тыс. км2. Основная часть дельты расположена во Вьетнаме и занимает почти весь юго-запад его территории. Климат в регионе тропический муссонный, как правило, с четко выраженными влажным (май–октябрь) и сухим (ноябрь–апрель) сезонами. Среднегодовое количество осадков в разных частях дельты реки 1600–2400 мм, среднемесячная температура 25–28°С, относительная влажность в течение всего года ~85% (Cosslett T.L., Cosslett P.D., 2014; Räsänen, 2014).
Исследования проводили в сухой период года (с 6 по 18 декабря 2018 г.) на 13 станциях в трех рукавах дельты р. Меконг: Хамлуонг (Hàm Luông), Котиен (Cổ Chiên) и Хау (Hậu) (рис. 1). Станции располагались в рипальной зоне, в ~10–60 м от береговой линии. Основные характеристики среды на станциях даны в табл. 1.
Таблица 1.
Основные характеристики исследованных станций
| Номер станции |
Дата сбора |
Координаты, с.ш., в.д. | Глубина, м | Скорость течения, м/с | Температура, °C |
Содержание O2 | Электропроводность, мкСм/см* | Мутность, NTU |
pH | |
|---|---|---|---|---|---|---|---|---|---|---|
| мг/л | % | |||||||||
| 1 | 06.12.2018 | 10°04.617′, 106°14.165′ | 2.3 | 0.59 | 28.9 | 5.02 | 65.3 | 1591 | 60.0 | 6.82 |
| 2 | 07.12.2018 | 10°13.147′, 106°09.144′ | 3.0 | 0.19 | 29.3 | 5.15 | 67.4 | 150 | 36.2 | 6.61 |
| 3 | 07.12.2018 | 10°09.797′, 106°12.503′ | 5.0 | 0.71 | 29.0 | 5.44 | 70.8 | 154 | 49.7 | 6.40 |
| 4 | 08.12.2018 | 09°53.923′, 105°58.476′ | 4.0 | 0.39 | 29.3 | 4.96 | 64.9 | 143 | 62.5 | 6.73 |
| 5 | 08.12.2018 | 09°56.339′, 105°56.402′ | 3.0 | 0.31 | 29.3 | 4.95 | 64.8 | 139 | 83.1 | 6.64 |
| 6 | 14.12.2018 | 10°03.340′, 106°27.861′ | 2.0 | 0.92 | 28.6 | 5.20 | 67.5 | 1677 | 92.0 | 7.37 |
| 7 | 14.12.2018 | 10°11.671′, 106°21.155′ | 1.0 | 0.38 | 28.7 | 4.50 | 58.2 | 177 | 46.1 | 6.36 |
| 8 | 15.12.2018 | 10°14.755′, 106°18.995′ | 4.0 | 0.23 | 29.5 | 5.21 | 68.3 | 152 | 38.6 | 6.88 |
| 9 | 15.12.2018 | 10°14.644′, 106°13.338′ | 1.0 | 0.27 | 29.7 | 4.52 | 59.5 | 154 | 38.0 | 6.35 |
| 10 | 16.12.2018 | 09°56.528′, 106°27.282′ | 6.0 | 0.84 | 29.3 | 6.16 | 81.1 | 2370 | 24.7 | 7.20 |
| 11 | 16.12.2018 | 09°59.421′, 106°20.414′ | 1.0 | 0.21 | 29.6 | 5.82 | 76.5 | 353 | 95.5 | 6.95 |
| 12 | 17.12.2018 | 09°49.147′, 106°35.527′ | 1.0 | 0.44 | 28.8 | 7.13 | 94.3 | 6594 | 27.5 | 7.78 |
| 13 | 18.12.2018 | 09°58.473′, 106°37.231′ | 2.0 | 0.24 | 28.2 | 7.32 | 97.5 | 11 888 | 25.9 | 7.86 |
Количественные пробы фитопланктона собирали в поверхностном слое потока (0–0.5 м) сачком из мельничного газа с размером ячеи 20 мкм. Отфильтрованную взвесь транспортировали и хранили в 15-миллилитровых пробирках при естественном освещении и температуре до дальнейшей обработки. Для изучения водорослей в трансмиссионном электронном микроскопе пробы концентрировали и отмывали в дистиллированной воде. Осадок помещали на сетки, покрытые формваровой пленкой (EMS FF200-Cu-50, Electron Microscopy Sciences) и исследовали на трансмиссионном микроскопе JEM-1011.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Всего выявлено 15 таксонов, из них 9 рода Mallomonas, 1 рода Synura, 5 рода Paraphysomonas (табл. 2). Ниже приведены их иллюстрированные (рис. 2, 3) описания и особенности распространения.
Таблица 2.
Таксономический состав золотистых водорослей на исследованных станциях дельты р. Меконг
| Таксон | Номер станции | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | |
| Mallomonas сf. corymbosa | – | – | – | – | – | – | + | – | – | + | – | – | – |
| M. lamii | – | – | – | – | – | + | – | – | – | + | – | – | – |
| M. multisetigera | – | – | – | – | – | – | – | – | – | + | – | – | – |
| M. paragrandis | + | – | – | – | – | – | – | – | – | + | – | – | – |
| M. peronoides | – | – | – | – | – | – | – | – | – | + | – | – | – |
| M. portae-ferreae | – | – | – | – | – | – | – | – | – | + | – | – | – |
| M. pseudomatvienkoae | – | – | – | – | – | – | – | – | – | + | – | – | – |
| M. spinosa | + | – | – | – | – | – | – | – | – | – | – | – | – |
| M. sp. | – | – | – | – | – | – | – | – | – | + | – | – | – |
| Synura longitubularis | – | – | – | – | – | – | – | – | – | + | – | – | – |
| Paraphysomonas bandaiensis | – | – | – | – | – | – | – | – | – | + | – | – | – |
| P. longispina | – | + | – | – | – | – | – | + | – | – | – | – | – |
| P. vulgaris ssp. vulgaris | – | – | – | + | – | – | – | – | – | + | – | – | – |
| P. vulgaris ssp. brevispina | – | – | – | – | – | – | – | – | – | + | – | – | – |
| cf. Paraphysomonas sp. | – | – | – | – | – | – | – | – | – | – | – | – | + |
| Всего | 2 | 1 | 0 | 1 | 0 | 1 | 1 | 1 | 0 | 12 | 0 | 0 | 1 |
Рис. 2.
Чешуйки таксонов родов Mallomonas (a–п) и Synura (р): а–в – Mallomonas cf. corymbosa; г – M. multisetigera; д – М. lamii; е, ж – M. paragrandis; з – M. peronoides; и, к – M. pseudomatvienkoae; л, м – M. sp. 2; н, о – M. portae-ferreae; п – M. spinosa; p – Synura longitubularis.
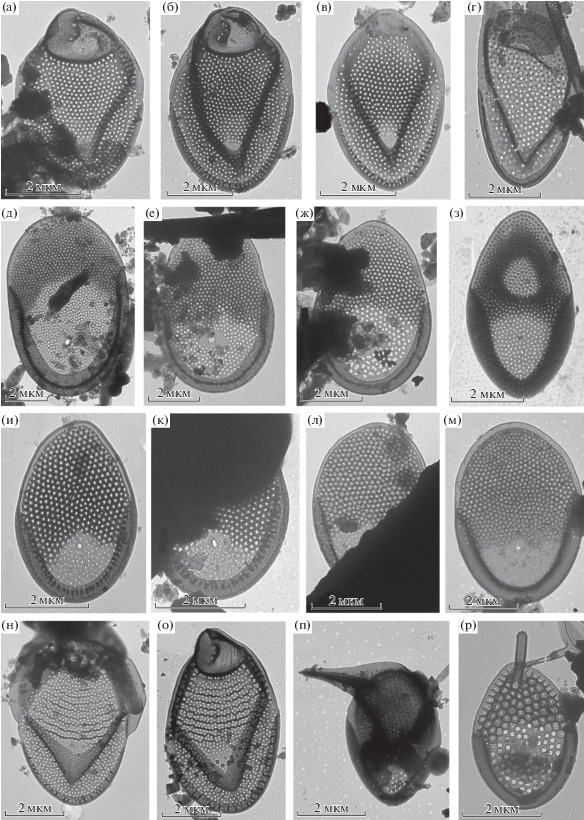
Рис. 3.
Чешуйки таксонов рода Paraphysomonas: а – P. bandaiensis, б – P. longispina, в – P. vulgaris subsp. vulgaris, г – P. vulgaris cf. subsp. brevispina, д – cf. P. sp.

Mallomonas cf. corymbosa Asmund (рис. 2а–2в). Обнаружен на ст. 10. Для полностью достоверной идентификации данного вида требуется находка щетинок, строение которых служит важным диагностическим признаком. Однако размеры и строение чешуек, развитый вторичный кремнеземный слой позволяют провести предварительную идентификацию вида. Это первая находка во Вьетнаме. Считается, что вид имеет биполярное распространение (Kristiansen, Preisig, 2007), но находки в Южной Корее (Kim, Han, 2011) и, предположительно, во Вьетнаме свидетельствуют, что он распространен и в субтропической, и тропической областях. Для подтверждения этого необходимы молекулярно-генетические исследования.
M. multisetigera Dürrschmidt (рис. 2г). Отмечен на ст. 10. Описан из Чили (Dürrschmidt, 1982), впоследствии найден в других регионах, включая Европу, Северную и Южную Америку, Африку и Австралию; считается широко распространенным таксоном (Kristiansen, 2001; Kristiansen, Preisig, 2007). Вторая находка во Вьетнаме после обнаружения вида в провинции Кханьхоа (Gusev, Siver, 2017).
M. lamii Gusev, Kulizin, Guseva, Shkurina & Kulikovskiy (рис. 2д). Недавно описан из Вьетнама (Gusev et al., 2019б). Зарегистрирован на ст. 6, 10. Чешуйки отличаются большими размерами (9.1–9.2 × 6.0–6.1 мкм), имеют небольшие папиллы, рассеянные по всей поверхности щита и развитый вторичный слой в дистальной области чешуйки. По строению и размерам его чешуйки сходны с таковыми M. matvienkoae var. grandis Dürrschmidt & G. Cronberg, с чешуйками 8–9 × 5.0–5.5 мкм и ископаемым M. pleuriforamen Siver, Lott, Jo, Shin, Kim & Andersen (6.8–7.4 × × 5.6–6.3 мкм). Однако M. matvienkoae var. grandis и M. pleuriforamen хорошо отличаются от М. lamii наличием нескольких (3–7) крупных пор в дистальной области базальной пластинки, у М. lamii она только одна (Dürrschmidt, Cronberg, 1989; Jo et al., 2013). Также имеются различия в размере более мелких пор базальной пластинки и в степени развития вторичного кремнеземного слоя. Во Вьетнаме найден в шести провинциях (Gusev et al., 2017, 2019б).
M. paragrandis Gusev (рис. 2е, 2ж). Зарегистрирован на ст. 1, 10. Недавно описан из Вьетнама (Gusev, 2015б), отмечен там в провинциях Кханьхоа и Донгнай (Gusev, Nguyen, 2011; Gusev et al., 2017, 2019a), также найден в Индонезии на о‑ве Ява (Kapustin, Gusev, 2019). Эндемик Юго-Восточной Азии. Очень сходен по строению чешуек с M. sorohexareticulata Jo, Shin, Kim, Siver & Andersen и M. hexareticulata Jo, Shin, Kim, Siver & Andersen. Отличается от них степенью перфорированности базальной пластинки, формой и размером пор, структурой вторичного кремнеземного слоя, а также строением щетинок.
M. peronoides (K. Harris) Momeu & L.S. Péterfi (рис. 2з). Зарегистрирован на ст. 10. Большинство находок вида приурочено к водоемам тропической и субтропической зон, редкие находки отмечены в летнее время в умеренной зоне (Barreto, 2005). Считается космополитом (Kristiansen, Preisig, 2007). Во Вьетнаме обнаружен в провинциях Кханьхоа и Донгнай (Gusev, Nguyen, 2011; Gusev et al., 2017).
M. pseudomatvienkoae Jo, Shin, Kim, Siver & Andersen (рис. 2и, 2к). Найден на ст. 10. Недавно описан из Южной Кореи, отличается от M. matvienkoae (Matvienko) Asmund Kristiansen структурой вторичного кремнеземного слоя и расположением пор базальной пластинки, которые отсутствуют в проксимальной области чешуйки (Jo et al., 2013). Во Вьетнаме ранее отмечен в национальном парке Каттьен (Gusev et al., 2017) и заболоченных водоемах п-ова Камрань (Gusev et al., 2019a). Эндемик Восточной и Юго-Восточной Азии.
M. sp. (рис. 2л, 2м). Отмечен на ст. 10. По строению чешуек сходен с M. pseudomatvienkoae, отличается от него более крупными размерами чешуек (5.3–5.6 × 3.6–4.0 мкм против 3–5 × 2–3 мкм у M. pseudomatvienkoae), строением вторичного кремнеземного слоя (формой ячей сетчатой структуры) в дистальной части чешуек и наличием папилл на щите чешуек. Молекулярно-генетические исследования (по неопубликованным данным) показали идентичность этого организма штамму M. sp. 19 из Южной Кореи, описанному без иллюстраций в работе Siver et al. (2015) и отличающемуся от M. pseudomatvienkoae. Требуются дальнейшие исследования для уточнения таксономического статуса этого организма. Во Вьетнаме ранее отмечен в национальном парке Каттьен (Gusev et al., 2017) и заболоченных водоемах п-ова Камрань (Gusev, 2013; Gusev et al., 2019a).
M. portae-ferreae Péterfi & Asmund (рис. 2н, 2о). Найден на ст. 10. Ограничен в распространении субтропическими и тропическими регионами (Kristiansen, 2000; Kristiansen, Preisig, 2007). Это один из наиболее обильных и часто встречаемых видов в эвтрофных водоемах Индии (Wujek, Saha, 1996). Ранее во Вьетнаме обнаружен в эвтрофном водохранилище в провинции Кханьхоа (Gusev, Nguyen, 2011).
M. spinosa Gusev em end. Wei & Kristiansen (рис. 2п). Отмечен на ст. 1. Недавно описан из Вьетнама (провинции Донгнай и Кханьхоа), имеет уникальную структуру чешуек, вооруженных длинным и мощным четырехгранным шипом (Gusev, 2012). Редкий вид, единичные находки в Малайзии (Dürrschmidt, Croome, 1985), тропической части Китая (Wei et al., 2014) и Индонезии (Kapustin, Gusev, 2019). Эндемик Юго-Восточной Азии. Во Вьетнаме найден во временном водоеме в национальном парке Каттьен и эвтрофном водохранилище в провинции Кханьхоа (Gusev, 2012).
Synura longitubularis Jo, Shin, Kim & Siver (рис. 2p). Найдена на ст. 2 и 8. Описана в 2016 г. из Южной Кореи на основании молекулярно-генетических данных (Jo et al., 2016). По морфологическому строению чешуек почти неотличимa от S. curtispina (Petersen & Hansen) Asmund. Хотя у S. longitubularis немного больше диаметр пор базальной пластинки и диаметр ячей вторичного кремнеземного слоя, а также более длинные трубчатые хвостовые чешуйки, однако значения этих показателей перекрываются у видов. Достоверно идентифицировать этот вид можно только используя молекулярно-генетический подход. Наши неопубликованные данные по 15 штаммам из 12 водоемов четырех провинций Вьетнама по маркеру ITS rDNA свидетельствуют, что в водоемах Вьетнама встречается только S. longitubularis, поэтому мы указываем именно этот таксон. Ранее этот вид был отмечен в других районах Вьетнама как S. curtispina (Gusev, Nguyen, 2011; Gusev et al., 2017, 2019a).
Paraphysomonas bandaiensis Takahashi (рис. 3а). Зарегистрирован на ст. 10. Характеризуется очень мелкими чешуйками диаметром 0.5 мкм и шипом длиной 1 мкм, утолщенным ободком, а также наличием мелких пор вдоль ободка. Редкий вид, описан из пресноводных водоемов Японии (Takahashi, 1976), также найден в Европе, Северной Америке (Preisig, Hibberd, 1982) и России (Волошко, 2017). Во Вьетнаме отмечен впервые.
P. longispina J.M. Scoble & T. Cavalier-Smith (рис. 3б). Найден на ст. 2, 8. Обнаруженные чешуйки с утолщенным краем, их диаметр 1.5–2.0 мкм. Шипы длиной 5.0–7.5 мкм, постепенно суживающиеся от основания к концу. Соотношение длины шипа с диаметром чешуйки – 3–4. Описан из Мексики (Scoble, Cavalier-Smith, 2014), во Вьетнаме отмечен впервые.
P. vulgaris subsp. vulgaris J.M. Scoble & T. Cavalier-Smith (рис. 3в). Найден на ст. 4, 10. Обнаруженные чешуйки (диаметр 1.6–2.4 мкм) были с утолщенным краем и часто выраженной центральной складкой. Шипы длиной 2.7–3.1 мкм, постепенно суживающиеся от основания к концу. Отношение длины шипа к диаметру чешуйки 1.6–1.7. Молекулярно-генетические данные показали, что вид обычен и в умеренной, и в тропической зоне (Scoble, Cavalier-Smith, 2014). Обнаружен в Великобритании, Швейцарии и Индии (Scoble, Cavalier-Smith, 2014). Во Вьетнаме отмечен впервые.
P. vulgaris cf. subsp. brevispina J.M. Scoble & T. Cavalier-Smith (рис. 3г). Найден на ст. 10. Обнаруженная чешуйка (диаметр 1.4 мкм) с утолщенным краем. Хотя шип был сломан, по его структуре можно утверждать, что его длина не превышает 2 мкм. Меньший диаметр чешуек и длина шипа характерны для подвида P. vulgaris subsp. brevispina. По последовательности SSUr DNA этот подвид не отличается от типа. Описан из Великобритании (Scoble, Cavalier-Smith, 2014). Первая находка во Вьетнаме.
cf. P. sp. (рис. 3д). Одна чешуйка диаметром 3.3 мкм и с длиной шипа 11 мкм обнаружена на ст. 13. Вид сбоку не позволяет достоверно идентифицировать данный организм, но, по-видимому, он относится к роду Paraphysomonas.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
При гидробиологических исследованиях водоемов и водотоков Вьетнама, в том числе р. Меконг, зарегистрировано несколько видов золотистых водорослей с кремнеземными покровами: Mallomonas caudata, M. tonsurata и Synura uvella (Dang et al., 2002; Le, 2001, 2010). Однако эти находки не были подтверждены электронно-микроскопическими исследованиями и считаются сомнительными. Для выявления разнообразия этой группы водорослей требуется применение комплекса современных подходов, в первую очередь трансмиссионной и сканирующей электронной микроскопии (Kristiansen, 2005; Škaloud et al., 2013). Для идентификации ряда таксонов необходимо применение молекулярно-генетических методов (Jo et al., 2013, 2016). С помощью этих методов можно проводить корректную идентификацию, решать вопросы биогеографии водорослей и в дальнейшем использовать данную группу в целях биоиндикации в палеолимнологических исследованиях (Siver, 1995; Smol, 2005). В ходе наших исследований из обнаруженных 15 таксонов 6 впервые отмечены для Вьетнама: Mallomonas cf. corymbosa, Synura longitubularis, Paraphysomonas bandaiensis, P. longispina, P. vulgaris ssp. vulgaris, P. vulgaris ssp. brevispina. Данный факт отражает своеобразие условий в дельте р. Меконг. С учетом предыдущих флористических исследований золотистых водорослей Вьетнама количество таксонов, известных из водоемов страны, увеличилось до 66. Из них шесть таксонов Mallomonas spinosa, M. pseudomatvienkoae, M. paragrandis, М. lamii, M. sp., Synura longitubularis) пока можно считать эндемиками Восточной и Юго-Восточной Азии, однако все они – недавно описанные виды, и в дальнейшем возможны их находки в других тропических районах. Еще один вид – Mallomonas portae-ferreae обнаружен в тропических и субтропических областях. Широко распространенные и космополитные таксоны представлены тремя видами – M. multisetigera, M. peronoides и Paraphysomonas vulgaris ssp. vulgaris. Для остальных таксонов пока недостаточно подтвержденных данных, чтобы отнести их к какой-либо категории видов по географическому распространению.
Выявлено неравномерное распределение найденных таксонов по станциям. Чаще всего на станциях было по 1–2 вида, однако на ст. 10 их отмечено 12. Это было неожиданно, поскольку здесь зарегистрированы довольно высокие значения минерализации воды (>1 г/л), хотя все обнаруженные на станции виды относились к пресноводным организмам. Считается, что чешуйчатые хризофиты (за исключением морских видов Paraphysomonas) предпочитают низкоминерализованные воды (Sandgren, 1988; Siver, 1991). Однако имеется ряд немногочисленных исследований, которые показывают, что некоторые виды могут встречаться и в солоновато-водных условиях, в частности, в Балтийском море (Ikavalko, 1994; Ikavalko, Thomsen, 1996). По данным Немцовой и др. (Němcová et al., 2016), соленость – один из важных факторов, формирующих состав золотистых водорослей прибрежных озер и заливов Балтийского моря, и с возрастанием солености количество видов снижается. В этой же работе показано, что распространение отдельных видов чешуйчатых хризофит было положительно скоррелировано с величинами солености (в пределах 0.01–3.08 г/л), в частности, Mallomonas tonsurata и M. alpina. Довольно богатая флора чешуйчатых хризофит обнаружена в мангровых водоемах на п-ове Камрань, где также наблюдался градиент солености (Gusev, 2013). При солености >1.5 г/л чешуек золотистых водорослей не находили. Однако среди видов, присутствующих в водах с повышенной соленостью до 1.5 г/л, отмечены Mallomonas korshikovii Gusev, Mallomonas guttata Wujek, M. furtiva Gusev, Certnerová, Škaloudová & Škaloud, M. cf. matvienkoae, Synura papillosa Kapustin, Gusev & Siver. Наши исследования расширили список видов, обнаруженных при солености ~1 г/л.
Выводы. Флора дельты р. Меконг достаточно своеобразна, включает большую долю эндемичных для региона Юго-Восточной и Восточной Азии видов. Шесть из пятнадцати обнаруженных видов – новые для флоры Вьетнама. Наибольшее количество видов обнаружено при солености воды ~1 г/л.
Список литературы
Волошко Л.Н. 2017. Золотистые водоросли севера России. Санкт-Петербург: Реноме.
Barreto S. 2005. The silica-scaled chrysophyte flora of Hungary // Nova Hedwigia. Beih. V. 128. P. 11.
Cosslett T.L., Cosslett P.D. 2014. Water Resources and Food Security in the Vietnam Mekong Delta. Switzerland: Springer International Publishing.
Dang N.T., Ho T.H., Duong D.T., May D. 2002. Hydrobiology in inland freshwaters of Viet Nam. Hanoi: Science and Technique Publisher. (in Vietnamese).
Dürrschmidt M. 1982. Studies on the Chrysophyceae from South Chilean inland waters by means of scanning and transmission electron microscopy, II // Algol. Stud. V. 31. P. 121.
Dürrschmidt M., Cronberg G. 1989. Contribution to the knowledge of tropical Chrysophytes: Mallomonadaceae and Paraphysomonadaceae from Sri Lanka // Algol. Stud. V. 54. P. 15.
Dürrschmidt M., Croome R. 1985. Mallomonadaceae (Chrysophyceae) from Malaysia and Australia // Nord. J. Bot. V. 5. P. 285.
Glushchenko A.M., Kulikovskiy M.S. 2017. Taxonomy and distribution of the genus Eunotia Ehrenberg in water ecosystems of Vietnam. Inland Water Biology 10(2): 130–139.
Glushchenko A.M., Kulikovskiy M.S. 2019. First Record of Cymatopleura aquastudia Kociolek & You and C. xinjiangiana You & Kociolek in Aquatic Ecosystems of Vietnam. Inland Water Biology 12(2): 254–257.
Gusev E.S. 2012. A new species of the genus Mallomonas (Synurophyceae), Mallomonas spinosa sp. nov., from Vietnam // Phytotaxa. V. 66. P. 1.
Gusev E.S. 2013. Studies on synurophycean algae from mangrove wetlands (Vietnam) // Nova Hedwigia. Beih. V. 142. P. 87.
Gusev E.S. 2015a. A new species of the genus Mallomonas (Synurales, Chrysophyceae), Mallomonas fimbriata sp. nov. // Phytotaxa. V. 195. P. 291.
Gusev E.S. 2015б. A New Species in Genus Mallomonas Perty (Synurales, Chrysophyceae) from Vietnam // Int. J. Algae. V. 17. P. 351. https://doi.org/10.15407/alg25.04.428
Gusev E.S., Nguyen T.H.T. 2011. Silica-scaled chrysophytes (Chrysophyceae and Synurophyceae) from Vietnam (Khanh Hoa and Quang Nam provinces) // Nova Hedwigia. V. 93. P. 191. https://doi.org/10.1127/0029-5035/2011/0093-0191
Gusev E.S., Siver P.A. 2017. Mallomonas neoampla sp. nov. from Vietnam, a new species that bridges the gap between fossil and modern taxa // Nova Hedwigia. V. 104. P. 521. https://doi.org/10.1127/nova_hedwigia/2016/0389
Gusev E.S., Doan N.H., Nguyen N.L. 2017. Silica-scaled chrysophytes from Cat Tien National Park (Dong Nai Province, Vietnam) // Nova Hedwigia. V. 105. P. 347.
Gusev E.S., Doan N.H., Nguyen N.L. et al. 2019a. Silica-scaled chrysophytes from Cam Ranh Peninsula (Khanh Hoa Province, Vietnam) // Nova Hedwigia. Beih. V. 148. P. 63.
Gusev E., Kulizin P., Guseva E. et al. 2019б. Mallomonas lamii sp. nov. (Synurales, Chrysophyceae), a new species bearing large scales described from the tropics // Phytotaxa. V. 423. P. 266. https://doi.org/10.11646/phytotaxa.423.4.5
Ikavalko J. 1994. Observations on silica-scaled flagellates (Chrysophyceae and Synurophyceae) in the brackish water of Pojo Bay, SW coast of Finland // Ann. Bot. Fenn. V. 31. P. 1.
Ikavalko J., Thomsen H.A. 1996. Scale-covered and loricate flagellates (Chrysophyceae and Synurophyceae) from Baltic Sea ice // Nova Hedwigia. Beih. V. 114. P. 147.
Jo B.Y., Shin W., Kim H.S. et al. 2013. Phylogeny of the genus Mallomonas (Synurophyceae) and descriptions of five new species on the basis of morphological evidence // Phycologia. V. 52. P. 266. https://doi.org/10.2216/12-107.1
Jo B.Y., Kim J.I., Škaloud P., Siver P.A., Shin W. 2016. Multigene phylogeny of Synura (Synurophyceae) and descriptions of four new species based on morphological and DNA evidence // Eur. J. Phycol. V. 51. P. 413.
Kapustin D.A., Gusev E.S. 2019. Silica-scaled chrysophytes from West Java (Indonesia) including description of a new Chrysosphaerella species // Nova Hedwigia. Beih. V. 148. P. 11. https://doi.org/10.1127/nova-suppl/2019/025
Kim J.H., Han S.K. 2011. Seasonal occurrence of silica-scaled chrysophytes in a small eutrophic swamp, South Korea // Nova Hedwigia. V. 93. P. 411.
Kristiansen J. 2000. Cosmopolitan chrysophytes // Syst. Geogr. Pl. V. 70. P. 291. https://doi.org/10.2307/3668648
Kristiansen J. 2001. Biogeography of silica-scaled chrysophytes // Nova Hedwigia. Beih. V. 122. P. 23.
Kristiansen J. 2005. Golden algae: a biology of chrysophytes. Kӧnigstein: Koeltz Scientific Books.
Kristiansen J., Preisig H.R. 2007. Chrysophyte and Haptophyte algae. Part 2: Synurophyceae // Süßwasserflora von Mitteleuropa. Freshwater Flora of Central Europe. V. 1/2. Berlin: Spektrum Akademischer.
Kristiansen J., Škaloud P. 2017. Chrysophyta // Handbook of the Protists. Switzerland: Springer International Publishing. P. 331.
Kuenzer C., Renaud F.G. 2012. Climate and Environmental Change in River Deltas Globally: Expected Impacts, Resilience, and Adaptation // The Mekong Delta System. Interdisciplinary Analyses of a River Delta. Dordrecht: Springer Science + Business Media. P. 7.
Le T.C. 2001. Checklist of plant species of Viet Nam. V. 1. Ha Noi. (in Vietnamese).
Le T. 2010. Changes in species composition and abundance of phytoplankton in Ea Nhai and Ea Sup reservoirs, Dak Lak Province. PhD thesis. Dak Lak: Dak Lak University. 214 p. (in Vietnamese).
Němcová Y., Pusztai M., Škaloudová M., Neustupa J. 2016. Silica-scaled chrysophytes (Stramenopiles, Ochrophyta) along a salinity gradient: a case study from the Gulf of Bothnia western shore (northern Europe) // Hydrobiologia. V. 764. P. 187.
Preisig H.R., Hibberd D.J. 1982. Ultrastructure and taxonomy of Paraphysomonas (Chrysophyceae) and related genera II // Nord. J. Bot. V. 2. P. 601. https://doi.org/10.1111/j.1756-1051.1983.tb01056.x
Räsänen T.A. 2014. Hydrological changes in the Mekong River Basin – The effects of climate variability and hydropower development. Helsinki: School of Engineering.
Sandgren C.D. 1988. The ecology of chrysophyte flagellates: their growth and perennation strategies as freshwater phytoplankton // Growth and Reproductive Strategies of Freshwater Phytoplankton. Cambridge: Cambridge University Press. P. 9.
Scoble J.M., Cavalier-Smith T. 2014. Scale evolution in Paraphysomonadida (Chrysophyceae): Sequence phylogeny and revised taxonomy of Paraphysomonas, new genus Clathromonas, and 25 new species // Europ. J. Protistol. V. 50. P. 551.
Siver P.A. 1991. The Biology of Mallomonas. Morphology, Taxonomy, Ecology. Dordrecht: Kluwer Academic Publishers.
Siver P.A. 1995. The distribution of chrysophytes along environmental gradients: their use as biological indicators // Chrysophyte Algae. Cambridge: Cambridge University Press. P. 232.
Siver P.A., Lott A.M. 2012. Biogeographic patterns in scaled chrysophytes from the east coast of North America // Freshwater Biol. V. 57. P. 451.
Siver P.A., Jo B.Y., Kim J.I. et al. 2015. Assessing the evolutionary history of the class Synurophyceae (Heterokonta) using molecular, morphometric, and paleobiological approaches // Am. J. Bot. V. 102. P. 921.
Siver P.A., Kapustin D.A., Gusev E.S. 2018. Investigations of two-celled colonies of Synura formerly described as Chrysodidymus with descriptions of two new species // Eur. J. Phycol. V. 53. P. 245.
Škaloud P., Kristiansen J., Škaloudová M. 2013. Developments in the taxonomy of silica scaled chrysophytes – From morphological and ultrastructural to molecular approaches // Nord. J. Bot. V. 31. P. 385.
Smol J.P. 2005. Applications of chrysophytes to problems in paleoecology // Chrysophyte Algae. Cambridge: Cambridge University Press. P. 232.
Takahashi E. 1976. Studies on genera Mallomonas and Synura, and other plankton in freshwater with the electron microscope X. The genus Paraphysomonas (Chrysophyceae) // British Phycol. J. V. 11. P. 39.
Wei Y.-X., Yuan X.-P., Kristiansen J. 2014. Silica-scaled chrysophytes from Hainan, Guangdong Provinces and Hong Kong Special Administrative Region, China // Nord. J. Bot. V. 32. P. 881.
Wujek D.E., Saha L.C. 1996. Scale-bearing chrysophytes (Chrysophyceae and Synurophyceae) from India. II // Nova Hedwigia. Beih. V. 112. P. 367.
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод



