Биология внутренних вод, 2020, № 4, стр. 373-381
Влияние вирусной инфекции на функционирование и лизис черноморских микроводорослей Tetraselmis viridis (Chlorophyta) и Phaeodactylum tricornutum (Bacillariophyta)
Л. В. Стельмах a, *, О. А. Степанова b
a Федеральный исследовательский центр “Институт биологии южных морей им. А.О. Ковалевского РАН”
Севастополь, Россия
b Институт природно-технических систем
Севастополь, Россия
* E-mail: lustelm@mail.ru
Поступила в редакцию 05.06.2019
После доработки 22.07.2019
Принята к публикации 05.12.2019
Аннотация
Проведены экспериментальные исследования на культурах черноморских микроводорослей Tetraselmis viridis (Rouchijajnen) R.E. Norris, Hori & Chihara (Chlorophyta) и Phaeodactylum tricornutum Bohlin (Bacillariophyta) с использованием штаммов альговирусов этих микроводорослей – TsV-S1 и PtV-S18, выделенных из воды Черного моря. Выявлено влияние интенсивности света и исходной численности клеток микроводорослей на начало их инфицирования вирусами и на отмирание в результате лизиса. Уже на вторые-третьи сутки в зараженных вирусами культурах отмечены клетки, изменившие свою форму и увеличившиеся в объеме. В это же время наблюдалось снижение красной автофлуоресценции хлорофилла а, начального уровня переменной флуоресценции в расчете на клетку и фотохимической эффективности фотосистемы 2. Начало снижения численности клеток в исследуемых культурах вследствие вирусного лизиса отмечено на одни-двое суток позже. Пороговая численность клеток, при достижении которой наблюдали этот процесс, не зависела от световых условий и достигала 3 × 105 кл./мл у Tetraselmis viridis и 18 × 105 кл./мл у Phaeodactylum tricornutum. Полный лизис клеток водорослей выявлен к концу четвертых–шестых суток. При отсутствии света отмечено незначительное влияние вирусов на микроводоросли.
ВВЕДЕНИЕ
Вирусы – одни из важнейших компонентов водных экосистем. В 1 мл морской воды содержится от 105 до 109 вирусных частиц (Stepanova, 2017; Suttle, 2007). Большинство из них поражают бактерии, а также макро- и микроводоросли. Основные причины гибели функционально активных клеток морского фитопланктона – их потребление зоопланктоном и лизис, вызванный экзогенной вирусной инфекцией (Beckett, Weitz, 2018; Bidle et al., 2007; Pasulka et al., 2015). Вирусный лизис считается основной причиной ежедневной гибели ~3–5% клеток фитопланктона (Wommack, Colwell, 2000), в отдельные периоды эта величина достигает 25–30% (Evans et al., 2003; Mojica et al., 2016). Довольно быстрое прекращение “цветения воды”, вызываемое отдельными видами микроводорослей, может происходить в результате высокой численности вирусов в зонах “цветений” и, как следствие этого, вирусного лизиса растительных клеток (Baudoux et al., 2006, 2008; Bratbak et al., 1993, 1996; Cottrell, Suttle, 1995; Lehahn et al., 2014; Suttle, 2007; Vardi et al., 2009). Органическое вещество фитопланктона, попадающее во внешнюю среду в результате вирусного лизиса его представителей, потребляется, главным образом, бактериями. Этот процесс получил название “вирусного шунта” (Pagarete et al., 2015; Wommack, Colwell, 2000).
Для общей оценки доли фитопланктона, погибающего под действием вирусной инфекции, в настоящее время используют модифицированный метод разведения (Evans et al., 2003). Однако он очень трудоемок и пока не нашел широкого применения в гидробиологической практике. Четкая и общепризнанная методология проведения исследований по влиянию вирусов на фитопланктон до настоящего времени не разработана. Одна из возможных причин этого связана с высокой видовой специфичностью вирусов, поражающих узкий круг хозяев. Часто один штамм вируса имеет только одного хозяина – один вид водорослей (Kim et al., 2015), хотя для некоторых черноморских альговирусов обнаружено по два и более (Stepanova, 2016). На фоне многочисленных публикаций и литературных обзоров о роли влияния условий среды на стимулирование вирусного лизиса фитопланктонных клеток основные причины пока неясны (Horas et al., 2018; Wommack, Colwell, 2000). Для выявления роли отдельных факторов, таких как свет, температура, биогенные вещества, в регуляции этого процесса логично использовать результаты лабораторных экспериментов контакта вирусов с их хозяевами – микроводорослями. Причем такие результаты впоследствии могут быть экстраполированы на ситуацию с фитопланктоном морских и пресноводных водоемов, а также использоваться при разработке методологии исследований по выявлению роли вирусов в функционировании фитопланктона и его отдельных представителей.
Цель работы – оценить влияние вирусной инфекции на некоторые структурные и функциональные характеристики двух видов черноморских микроводорослей Tetraselmis viridis и Phaeodactylum tricornutum в условиях их роста в накопительной культуре при разной интенсивности света и в темноте.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объектом исследования были альгологически чистые культуры микроводорослей Tetraselmis viridis (Rouchijajnen) R.E. Norris, Hori & Chihara (Chlorophyta) и Phaeodactylum tricornutum Bohlin (Bacillariophyta), выделенные из планктона Черного моря и содержащиеся в коллекции отдела экологической физиологии водорослей Федерального исследовательского центра “Институт биологии южных морей им. А.О. Ковалевского РАН”. Средний объем клеток первого вида 260 ± 40 мкм3, второго – 80 ± 20 мкм3. Эти виды водорослей часто используются в качестве модельных объектов, обладающих высокой жизнеспособностью в процессе культивирования. До начала эксперимента каждую культуру адаптировали в течение двух-трех суток к двум значениям интенсивности непрерывного света: первое (I) – лимитировало рост водорослей, второе (II) – обеспечивало их максимальную скорость роста. Для Tetraselmis viridis первое значение было 20 мкЭ/(м2 · с), второе – 60 мкЭ/(м2 · с), для Phaeodactylum tricornutum – 20 мкЭ/(м2 · с) и 100 мкЭ/(м2 · с) соответственно. Для третьего варианта опыта культуру Tetraselmis viridis адаптировали к темноте в течение 3 сут.
Каждую адаптированную культуру делили на три части (по 50 мл) и помещали в конические колбы объемом 150 мл. В первую (контрольную) колбу вносили 50 мл стерильной морской воды с питательной средой f/2 (Guillard, Ryther, 1962). Во вторую и третью (опытные колбы) добавляли по 50 мл вирусной суспензии при титре 107 вирионов/мл для альговируса Tetraselmis viridis (штамм TsV-S1) и 106 вирионов/мл для альговируса Phaeodactylum tricornutum (штамм PtV-S18). Титр (концентрация, численность) альговирусов в вирусных суспензиях определяли по авторской запатентованной методике (Stepanova, 2016).
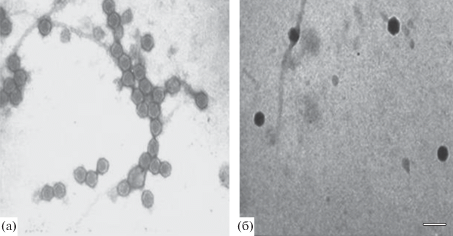
Методом электронной микроскопии ранее установлено, что штамм TsV-S1 имеет форму икосаэдра с диаметром 56–60 нм (рис. 1а). Штамм PtV-S18 также представляет собой икосаэдр с диаметром 45–48 нм (рис. 1б). На основании результатов изучения черноморских альговирусов, в том числе используемых в работе вирусных штаммов, с учетом генетического анализа, они отнесены к сем. Phycodnaviridae (Stepanova, 2016).
Рис. 1.
Электронно-микроскопические фотографии альговирусов микроводорослeй Tetraselmis viridis (а) (штамм TvV-S1) и Phaeodactylum tricornutum (б) (штамм PtV-S18). Масштаб на рис. 1б – 103 нм.
Вирусную суспензию до начала экспериментов хранили при –20°С. Для активации вирусов в размороженную суспензию вносили культуру хозяина (1 : 1 по объему), находившуюся в фазе логарифмического роста, и экспонировали на рассеянном свету при температуре 18°С в течение 10–14 сут. После вирусного лизиса культуры и установления вирусного титра в суспензии проводили ее предварительную очистку путем центрифугирования при 3000 оборотов/мин в течение 10 мин. Затем вирусную суспензию пропускали через трековую мембрану с диаметром пор 0.2 мкм. В результате получали чистые вирусные суспензии двух штаммов TsV-S1 и PtV-S18, которые использовали в экспериментах.
Контрольные и опытные колбы, помещенные на световую решетку, освещали снизу с помощью светодиодов. Освещенность измеряли с помощью люксметра Ю-116, коэффициент перехода от освещенности в люксах к интенсивности света – 104 лк = 170 мкЭ/(м2 · с) (Парсонс и др., 1982). В экспериментах использовали оптимальную для развития данных видов водорослей температуру воды 18°С.
Длительность экспериментов при разных интенсивностях света была 4–6 сут. Пробы объемом 5 мл в контроле и опыте отбирали с 9 до 17 ч с интервалом 4–8 ч. В эксперименте с культурой Tetraselmis viridis, помещенной в темноту, пробы отбирали в течение 10 сут с интервалом 48–96 ч, что связано с замедлением лизиса клеток водорослей в темноте в результате снижения их физиологической активности, отражающейся на способности продуцировать вирусы.
Для учета численности клеток и их фотографирования в светлом и темном поле использовали световой микроскоп Микромед 3ЛЮМ. Дополнительно микроскоп оснащали флуоресцентным блоком с ртутной лампой мощностью 100 Вт и фотокамерой ToupCam UCMOS 14 000 KPA. Для возбуждения красной автофлуоресценции Хл а использовали синий светофильтр (диапазон возбуждения флуоресценции 410–490 нм). Наблюдение красного свечения объекта (в отраженном свете) после прохождения через запирающий светофильтр (515 нм) проводили в области >515–700 нм.
Счет клеток осуществляли в светлом поле в трех повторностях в счетной камере Горяева. Общее увеличение системы микроскопа было ×100 в процессе счета клеток и ×1000 при их регистрации (фотографировании). Относительная погрешность подсчета клеток в параллельных пробах не превышала 10%. Удельную суточную скорость роста микроводорослей и скорость их отмирания рассчитывали по приросту или убыли численности клеток в пробах по уравнению:
где µ – удельная скорость роста или отмирания водорослей, сут–1; N0 – исходная численность клеток, Nt – их численность через сутки.Оценку фотохимической эффективности фотосистемы-2 (Fv/Fm) микроводорослей осуществляли на двухвспышечном флуориметре, принцип работы и устройство которого разработаны на кафедре биофизики биологического факультета МГУ им. М. В. Ломоносова (Погосян и др., 2009). Измерения проводили после 30 мин адаптации водорослей к темноте, чтобы все реакционные центры фотосистемы 2 перешли в открытое состояние. Во флуориметре реализован метод измерения начального уровня переменной флуоресценции (F0) при помощи коротких зондирующих вспышек и ее максимального уровня (Fm) при помощи насыщающей вспышки. По измеренным показателям рассчитывали переменную флуоресценцию Fv = Fm – F0 и Fv/Fm. Относительная погрешность определений величины Fv/Fm не превышала 5%. Величина F0, как правило, хорошо коррелирует с концентрацией Хл а в клетках микроводорослей (Цилинский и др., 2018). Поэтому данный параметр использован нами в качестве показателя изменчивости концентрации Хл в клетках исследуемых водорослей в процессе их роста.
При статистической обработке данных вычисляли средние значения показателей и их стандартное отклонение.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
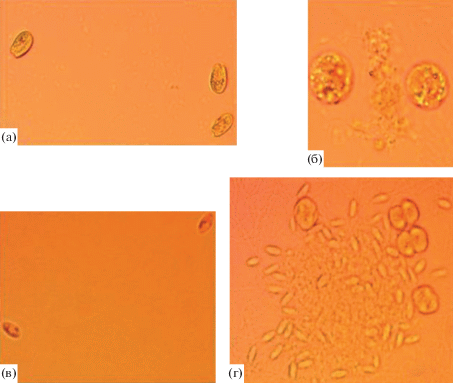
Вид клеток в исходных культурах микроводорослей Tetraselmis viridis и Phaeodactylum tricornutum представлен на рис. 2а, 2в. В инфицированных соответствующими вирусами культурах уже на вторые сутки при насыщающих рост интенсивностях света и на третьи сутки при низких интенсивностях света выявлены клетки, изменившие форму и увеличившиеся в объеме в 3–4 раза по сравнению с исходной культурой (рис. 2б, 2г). Постепенно количество таких клеток возрастало. Увеличение в размерах клеток микроводорослей приводило к их последующей деструкции, что сопровождалось попаданием клеточного содержимого в окружающую среду.
Рис. 2.
Клетки микроводорослей до заражения (а, в) и после заражения вирусной инфекцией (б, г): a, б – Tetraselmis viridis, в, г – Phaeodactylum tricornutum.
Эксперимент с культурой Tetraselmis viridis. В условиях светового лимитирования роста водорослей в течение первых четырех суток наблюдалось постепенное увеличение численности клеток T. viridis в контроле и опыте (рис. 3а). Удельная скорость роста была 0.24–0.48 сут–1 (табл. 1). К концу 4-х суток численность клеток в инфицированной вирусом культуре достигла максимума (3 × 105 кл./мл), что в ~4 раза выше ее исходных значений. Затем произошло быстрое снижение численности клеток в результате их лизиса, который полностью завершился к концу 6-х суток. При этом на 5-е сутки эксперимента удельная скорость отмирания водорослей была –1.20 сут–1, а на 6-е сутки возросла в ~5.5 раза (табл. 1). Одновременно в контроле численность клеток T. viridis продолжала нарастать, достигнув стационарной фазы роста лишь к концу 5-х суток.
Рис. 3.
Динамика численности клеток, F0/кл. и Fv/Fm в культуре Tetraselmis viridis при низкой (а, б) и высокой (в, г) интенсивности света: а, в – численность клеток в контроле (1) и опыте (2), F0/кл. в контроле (3) и опыте (4), б, г – Fv/Fm в контроле (1) и опыте (2). Даны средние значения и их стандартное отклонение.
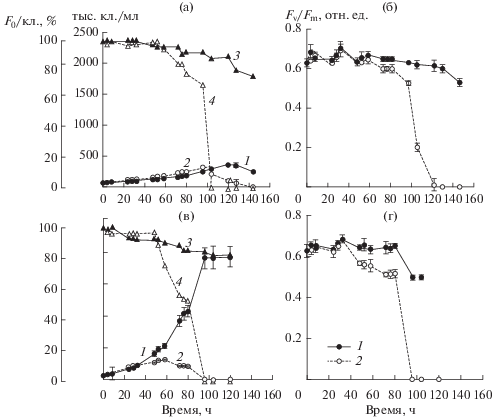
Таблица 1.
Удельная скорость роста и убыли (µ) клеток в культурах водорослей Tetraselmis viridis и Phaeodactylum tricornutum при лимитирующей рост интенсивности света (I) и насыщающей интенсивности (II)
| Время, сут | µ, сут–1 | |
|---|---|---|
| I | II | |
| Tetraselmis viridis | ||
| 1 | $\frac{{0.24 \pm 0.04}}{{0.48 \pm 0.08}}$ | $\frac{{0.88 \pm 0.15}}{{1.02 \pm 0.20}}$ |
| 2 | $\frac{{0.24 \pm 0.05}}{{0.24 \pm 0.06}}$ | $\frac{{0.87 \pm 0.17}}{{0.31 \pm 0.08}}$ |
| 3 | $\frac{{0.48 \pm 0.09}}{{0.48 \pm 0.070}}$ | $\begin{array}{*{20}{l}} {\frac{{0.81 \pm 0.15}}{{\left( {--0.23} \right) \pm \left( {0.06} \right)}}} \end{array}$ |
| 4 | $\frac{{0.24 \pm 0.04}}{{0.24 \pm 0.03}}$ | $\frac{{0.72 \pm 0.13}}{{\left( {--6.28} \right) \pm \left( {--0.28} \right)}}$ |
| 5 | $\frac{{0.10 \pm 0.03}}{{\left( {--1.20} \right) \pm \left( {--0.32} \right)}}$ | $\frac{0}{ - }$ |
| 6 | $\frac{{\left( {--0.36} \right) \pm \left( {--0.07} \right)}}{{\left( {--6.68} \right) \pm \left( {--0.22} \right)}}$ | – |
| Phaeodactylum tricornutum | ||
| 1 | $\frac{{0.91 \pm 0.02}}{{0.69 \pm 0.07}}$ | $\frac{{1.39 \pm 0.09}}{{0.83 \pm 0.07}}$ |
| 2 | $\frac{{0.87 \pm 0.07}}{{0.13 \pm 0.04}}$ | $\frac{{0.78 \pm 0.06}}{{\left( {--0.05} \right) \pm (--0.02)}}$ |
| 3 | $\frac{{0.63 \pm 0.04}}{{\left( {--0.11} \right) \pm \left( {--0.03} \right)}}$ | $\frac{{0.67 \pm 0.03}}{{\left( {--0.16} \right) \pm \left( {--0.03} \right)}}$ |
| 4 | $\frac{{0.49 \pm 0.03}}{{\left( {--3.84} \right) \pm (0.22)}}$ | $\frac{0}{{\left( {--8.00} \right) \pm \left( {--0.75} \right)}}$ |
Начальный уровень флуоресценции в расчете на клетку F0/кл. и Fv/Fm в процессе роста культуры T. viridis снижались и в контроле, и в опыте. Однако в контроле это снижение было слабым, тогда как в опыте уже в конце 5-х суток значения обоих параметров падали до нуля (рис. 3а, 3б).
Красная автофлуоресценция Хл а у T. viridis в контроле почти не изменялась в течение эксперимента, свечение охватывало большую часть клетки. В инфицированной вирусом культуре подобная картина наблюдалась только в первые сутки эксперимента. В конце 2–3-х суток красная автофлуоресценция Хл в преобладавших по численности видоизмененных клетках ослабевала, а на 5-е сутки была едва заметна.
При оптимальной для роста интенсивности света в течение первых суток численность клеток T. viridis возрастала и в контроле, и в опыте почти с одинаковой скоростью (рис. 3в). На 2-е сутки удельная скорость роста водорослей в опыте стала в 2.8 раза ниже контрольной (табл. 1). В результате к концу 2-х суток общая численность клеток в инфицированной культуре была на ~30% меньше, чем в контроле и составляла 3 × 105 кл./мл (рис. 3в). Затем инфицированная культура быстро отмирала, полный лизис наблюдался к концу 4-х суток. В этот период контрольная культура находились в фазе экспоненциального роста. В контроле значения F0/кл. и Fv/Fm в процессе роста накопительной культуры немного снижались, в опыте они достигали 0 уже к концу 4-х суток (рис. 3в, 3г).
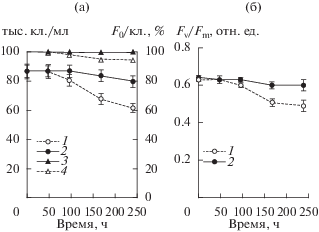
В темноте в течение 10 сут численность клеток T. viridis в контроле варьировала в пределах нескольких процентов, а в инфицированной культуре на 10-е сутки она была лишь на 20% ниже исходной. Показатели F0/кл. и Fv/Fm в контроле не изменялись, в опыте снизились незначительно (рис. 4а, 4б).
Рис. 4.
Динамика численности клеток, F0/кл. и Fv/Fm в культуре T. viridis в темноте: а – численность клеток в опыте (1) и контроле (2), F0/кл. в опыте (3) и контроле (4), б – Fv/Fm в опыте (1) и в контроле (2). Даны средние значения и их стандартное отклонение.
Эксперимент с культурой Phaeodactylum tricornutum. В условиях светового лимитирования роста культуры в контроле в течение всего эксперимента наблюдалось увеличение численности клеток (рис. 5а). Удельная скорость роста достигала 0.49–0.91 сут–1 (табл. 1). В инфицированной культуре ее интенсивный рост отмечен лишь в начале эксперимента (0.69 сут–1). На 2-е сутки скорость прироста инфицированной культуры водорослей была незначительна (0.13 сут–1), а численность клеток достигала максимума – 18 × 105 кл./мл, что в 2.3 раза выше ее исходных значений. Уже на 3-и сутки водоросли начинали интенсивно отмирать, а на 4-е произошел их полный лизис. Параметры F0/кл. и Fv/Fm в контроле изменялись слабо (рис. 5а, 5б), в инфицированной культуре они постепенно снижались до нуля.
Рис. 5.
Динамика численности клеток, F0/кл. и Fv/Fm в культуре Phaeodactylum tricornutum при низкой (а, б) и высокой (в, г) интенсивности света: а, в – численность клеток в контроле (1) и опыте (2), F0/кл. в контроле (3) и опыте (4); б, г – Fv/Fm в контроле (1) и опыте (2). Даны средние значения и их стандартное отклонение.
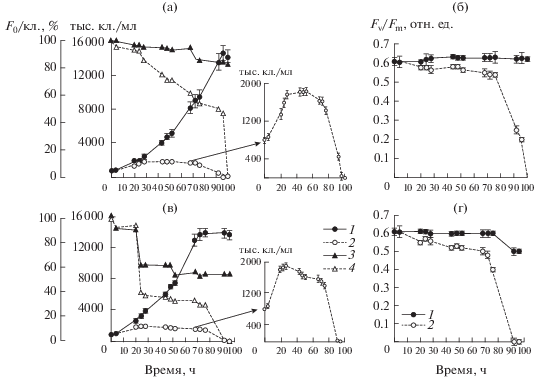
При оптимальной для роста Ph. tricornutum интенсивности света численность клеток в течение первых суток возрастала и в контроле, и в инфицированной культуре (рис. 5в). В начале 2-х суток эксперимента удельная скорость роста культуры, находившейся в контакте с вирусами, была во много раз ниже относительно контроля (табл. 1). К концу 2-х суток численность клеток в инфицированной культуре была в ~3.8 раза меньше контрольной и составляла 18 × 105 кл./мл (рис. 5в). Затем произошло ее быстрое отмирание (табл. 1), завершившееся полным лизисом клеток к концу 4-х суток. Значения F0/кл. и Fv/Fm в процессе роста культуры снижались в контроле значительно слабее, чем в опыте, в инфицированной вирусом культуре к концу эксперимента они достигли нуля (рис. 5в, 5г).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В последние годы в различных районах Мирового океана проведены исследования по количественной оценке влияния вирусного лизиса на смертность фитопланктона с помощью модифицированного метода разведения (Baudoux et al., 2008; Mojica et al., 2016; Pasulka et al., 2015). Показано, что в Северном море за лето 2003 г. в результате вирусного лизиса пикофитопланктона в окружающую среду попало в среднем 8% органического углерода, синтезированного пикофракцией фитопланктона, в отдельных случаях его содержание достигало 32% (Baudoux et al., 2008). В Калифорнийском течении в октябре 2008 г. смертность фитопланктона при совместном влиянии микрозоопланктона и вирусов была в среднем на 38% выше, чем при влиянии только микрозоопланктона (Pasulka et al., 2015). В Северной Атлантике в июле–августе 2009 г. скорость гибели пикоцианобактерий и эукариотического пикофитопланктона в результате вирусного лизиса достигала 0.14–0.23 сут–1, что соответствует 20–30% их максимальной удельной скорости роста (Mojica et al., 2016). Полученные результаты позволяют судить о важной роли альговирусов в морских экосистемах. Однако до настоящего времени не совсем ясно, как абиотические факторы среды, и прежде всего свет, влияют на скорость лизиса фитопланктонных клеток. В море в силу методических и методологических трудностей это выяснить крайне сложно. Ситуацию могут прояснить лабораторные эксперименты на отдельных видах водорослей в контролируемых условиях.
В настоящих исследованиях, проведенных на морских микроводорослях Tetraselmis viridis и Phaeodactylum tricornutum, были использованы максимальные концентрации альговирусов, численность которых на один–два порядка превышала таковую водорослей. Такой подход обычно применяют в экспериментах по изучению контакта альговирусов с их хозяевами – микроводорослями (Pagarete et al., 2015). Высокая концентрация вирусов в среде обычно обеспечивает наиболее быстрое инфицирование водорослей. По нашим данным, начало инфицирования Tetraselmis viridis и Phaeodactylum tricornutum зависело от световых условий. Оптимальные световые условия способствовали быстрому увеличению численности и активности клеток – хозяев альговирусов TsV-S1 и PtV-S18. При насыщающей рост водорослей интенсивности света видоизмененные клетки, вероятно, инфицированные вирусом, отмечали уже через сутки от начала эксперимента. При снижении интенсивности света в 3–5 раз этот процесс наблюдали на 1 сут позже. Определение флуоресцентных параметров позволило выявить снижение внутриклеточного содержания Хл а в водорослях по мере усиления их инфицирования вирусами. Изменение формы и размеров инфицированных клеток, а также деградация внутриклеточных пигментов ранее показаны на культурах кокколитофориды Emiliania huxleyi (Lohmann) W.W. Hay & H.P. Mohler (Bidle et al., 2007), зеленой микроводоросли Tetraselmis striata Butcher (Pagarete et al., 2015) и диатомовой водоросли Chaetoceros tenuissimus Meunier (Kimura, Tomaru, 2015).
Одновременно со структурными изменениями в инфицированных вирусами культурах исследованных водорослей происходило снижение Fv/Fm. По мнению Бидле и др. (Bidle et al., 2007), осуществляется перестройка метаболизма в клетках водорослей и активация экспрессии белка метакаспазы, необходимой для воспроизводства вирусных частиц. Разрыв клеточной оболочки водорослей, инфицированных вирусом, происходит обычно в тот момент, когда численность вирусов в цитоплазме клеток хозяина достигает ~100 вирионов на клетку (Kim et al., 2015). Несмотря на ослабление функциональной активности инфицированных водорослей Tetraselmis viridis и Phaeodactylum tricornutum, отмечено дальнейшее увеличение количества их клеток до определенной численности, которую условно можно назвать пороговой. Только после достижения пороговой численности клеток в исследованных культурах, инфицированных альговирусами, отмечено быстрое их отмирание вследствие вирусного лизиса. Интервал от момента внесения в среду вирусов до полного лизиса их хозяев составил 4–6 сут. Аналогичные результаты получены ранее на культурах кокколитофориды Emiliania huxleyi (Bidle et al., 2007), зеленой микроводоросли Tetraselmis striata (Pagarete et al., 2015) и диатомовой водоросли Chaetoceros tenuissimus (Kimura, Tomaru, 2015). В настоящем исследовании, прирост численности клеток в темноте не наблюдался, поэтому влияние вирусов на микроводоросли было незначительным. Вероятно, при неблагоприятных условиях, например при недостаточном освещении, активная вирусная инфекция, вызывающая лизис клеток хозяина, переходит в состояние лизогении (переживание вируса внутри клетки своего хозяина) (Wommack, Colwell, 2000).
Экстраполируя наши и ранее опубликованные другими авторами (Bidle et al., 2007; Kimura, Tomaru, 2015; Pagarete et al., 2015) данные на природные популяции фитопланктона, мы полагаем, что деградация “цветения воды” фитопланктоном может произойти в течение нескольких cуток. Вероятно, процесс вирусного лизиса клеток микроводорослей будет интенсивно осуществляться только в верхней части зоны фотосинтеза, где свет не лимитирует рост представителей фитопланктона. В результате этого поток вещества и энергии от фитопланктона на высшие трофические уровни резко сократится. При этом большое количество органического вещества, попавшее в окружающую среду вследствие вирусного лизиса водорослей, может служить основой для усиленного роста бактерий и других одноклеточных организмов (Stepanova, 2017; Wommack, Colwell, 2000). У основания фотосинтетической зоны роль вирусов в гибели фитопланктонных клеток, вероятно, будет незначительна.
Выводы. Показано, что даже при высокой концентрации вирусов в экспериментах начало инфицирования клеток водорослей Tetraselmis viridis и Phaeodactylum tricornutum, зарегистрированное по увеличению их объема, а также снижению красной автофлуоресценции Хл а, переменной флуоресценции и фотохимической эффективности фотосистемы 2, зависело от световых условий и исходной численности клеток микроводорослей. Повышение интенсивности света и начального количества клеток водорослей вызывало усиление этих процессов, выявленных на 2-е–3-и сутки от начала эксперимента. Снижение количества водорослей в результате вирусного лизиса отмечено на одни-двое суток позже. Выявлена пороговая численность клеток микроводорослей, при которой наблюдалось начало их деструкции под действием вирусов. Независимо от световых условий, для T. viridis она была 3 × 105 кл./мл, а для Ph. tricornutum – в 6 раз выше. Полный лизис клеток исследованных культур выявлен к концу 4–6-х суток. В темноте влияние вирусной инфекции на процесс отмирания клеток водорослей крайне слабое.
Список литературы
Парсонс Т.Р., Такахаши М., Харгрейв Б. 1982. Биологическая океанография. Москва: Легк. и пищ. пром-сть.
Погосян С.И., Гальчук С.В., Казимирко Ю.В. и др. 2009. Применение флуориметра “Мега-25” для определения количества фитопланктона и оценки состояния его фотосинтетического аппарата // Вода: химия и экология. № 2. С. 34.
Цилинский В.С., Суслин В.В., Финенко З.З. 2018. Сезонная динамика эффективности работы фотосинтетического аппарата фитопланктона в прибрежных районах Черного моря // Океанология. Т. 58. № 3. С. 593. https://doi.org/10.1134/S0001437018040112
Baudoux A., Noordeloos A., Veldhuis M., Brussaard C. 2006. Virally induced mortality of Phaeocystis globosa during two spring blooms in temperate coastal waters // Aquat. Microb. Ecol. V. 44. P. 207. https://doi.org/10.3354/ame044207
Baudoux A.C., Veldhuis M.J.W., Noordeloos A.A.M. et al. 2008. Estimates of virus-vs. grazing, induced mortality of picophytoplankton in the North Sea during summer // Aquat. Microb. Ecol. V. 52. P. 69. https://doi.org/10.3354/ame01207
Beckett S.J., Weitz J.S. 2018. The Effect of Strain Level Diversity on Robust Inference of Virus-Induced Mortality of Phytoplankton // Front. Microbiol. V. 9. P. 1850. https://doi.org/10.3389/fmicb.2018.01850
Bidle K.D., Haramaty L., Barcelos e Ramos J., Falkowski P. 2007. Viral activation and recruitment of metacaspases in the unicellular coccolithophore Emiliania huxleyi // PNAS. V. 104(14). P. 6049. https://doi.org/10.1073/pnas.0701240104
Bratbak G., Heldal M., Egge J.K. 1993. Termination of algal blooms: viral mortality of the marine coccolithophorid Emiliania huxleyi // Mar. Ecol. Prog. Ser. V. 93. P. 39. https://doi.org/10.3354/meps093039
Bratbak G., Wilson W., Heldal M. 1996. Viral control of Emiliania huxleyi blooms? // J. Marine Systems. V. 9. № 1–2. P. 75. https://doi.org/10.1016/0924-7963(96)00018-8
Cottrell M.T., Suttle C.A. 1995. Dynamics of a lytic virus infecting the photosynthetic marine picoflagellate Micromonas pusilla // Limnol., Oceanogr. V. 40. P. 730. https://doi.org/10.4319/lo.1995.40.4.0730
Evans C.S., Arscher S.D., Jacquet S., Wilson W.Y. 2003. Direct estimates of the contribution of viral lysis and microzooplankton grazing to the decline of a Micromonas spp. population // Aquat. Microb. Ecol. V. 30. P. 207. https://doi.org/10.3354/ame030207
Guillard R.R.L., Ryther J.H. 1962. Studies of marine planktonic diatoms. I. Cyclotella nana Hustedt and Detonula confervacea Cleve // Can. J. Microbiol. V. 8. P. 229.
Horas E.L., Theodosiou L., Becks L. 2018. Why Are Algal Viruses Not Always Successful? // Viruses. V. 10. № 9. P. 474. https://doi.org/10.3390/v10090474
Kim J.J, Yoon S.H., Choi T.J. 2015. Isolation and physiological characterization of a novel virus infecting Stephanopyxis palmeriana (Bacillariophyta) // Algae. V. 30(2). P. 81. https://doi.org/10.4490/algae.2015.30.2.081
Kimura K., Tomaru Yu. 2015. Discovery of Two Novel Viruses Expands the Diversity of Single-Stranded DNA and Single-Stranded RNA Viruses Infecting a Cosmopolitan Marine Diatom // Appl. Environ. Microbiol. V. 81. P. 1120. https://doi.org/10.1128/AEM.02380-14
Lehahn Y., Koren I., Schatz D. et al. 2014. Decoupling physical from biological processes to assess the impact of viruses on a mesoscale algal bloom // Curr. Biol. V. 24. P. 2041. https://doi.org/10.1016/j.cub.2014.07.046
Mojica K.D.A., Huisman J., Wilhelm S.W., Brussaard C.P.D. 2016. Latitudinal variation in virus-induced mortality of phytoplankton across the North Atlantic Ocean // ISME J. V. 10. P. 500. https://doi.org/10.1038/ismej.2015.130
Pagarete A., Grébert T., Stepanova O. et al. 2015. Tsv-N1: A Novel DNA Algal Virus that Infects Tetraselmis striata // Viruses. V. 7. P. 3937. https://doi.org/10.3390
Pasulka A.L., Samo TY J., Landry M.L. 2015. Grazer and viral impacts on microbial growth and mortality in the southern California Current Ecosystem // J. Plankton Res. V. 37(2). P. 320. https://doi.org/10.1093/plankt/fbv011
Stepanova O.A. 2016. Black Sea algal viruses // Russ. J. Mar. Biol. V. 42. № 2. P. 99. https://doi.org/10.1134/S1063074016020103
Stepanova O.A. 2017. Interaction between Algal Viruses and the Mussel Mytilus galloprovincialis Lamarck, 1819 (Bivalvia: Mytilidae) in Experiment // Russ. J. Mar. Biol. V. 43. № 2. P. 127. https://doi.org/10.1134/S1063074017020110
Suttle C.A. 2007. Marine viruses: major players in the global ecosystem // Nat. Rev. Microbiol. V. 5. P. 801. https://doi.org/10.1038/nrmicro1750
Suttle C.A., Chan A.M., Cottrell M.T. 1990. Infection of phytoplankton by viruses and reduction of primary productivity // Nature. V. 347. P. 467.
Vardi A.,Van Mooy B.A.S., Fredricks H.F. et al. 2009. Viral glycosphingolipids induce lytic infection and cell death in marine phytoplankton // Science. V. 326. P. 861. https://doi.org/10.1126/science.1177322
Wommack K.E., Colwell R.R. 2000.Virioplankton: Viruses in aquatic ecosystems // Microbiol. Mol. Biol. Rev. V. 64. № 1. P. 69. https://doi.org/10.1128/MMBR.64.1.69-114.2000
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод


