Биология внутренних вод, 2020, № 4, стр. 393-403
Особенности ультраструктуры мезонефроса покатной молоди балтийского лосося Salmo salar и кумжи Salmo trutta
Е. А. Флёрова a, b, *, Д. С. Сендек c, В. В. Юрченко d
a Ярославский государственный университет им. П.Г. Демидова
Ярославль, Россия
b Ярославский научно-исследовательский институт животноводства и кормопроизводства –
филиал ФГБНУ “ФНЦ ВИК им. В.Р. Вильямса”
Ярославская обл., пос. Михайловский, Россия
c Государственный научно-исследовательский институт озерного и речного рыбного хозяйства им. Л.С. Берга
Санкт-Петербург, Россия
d Институт биологии внутренних вод им. И.Д. Папанина Российской академии наук
Некоузский р-н, Ярославская обл., пос. Борок, Россия
* E-mail: katarinum@mail.ru
Поступила в редакцию 22.02.2018
После доработки 27.11.2018
Принята к публикации 06.02.2019
Аннотация
Изучена ультраструктура мезонефроса природной популяции покатной молоди балтийского лосося (Salmo salar L., 1758) и кумжи (Salmo trutta L., 1758), которые обитают в р. Луге Ленинградской обл. Дана общая схема организации туловищной почки, выявлены особенности строения лейкоцитов и структур нефрона лососевых, находящихся на стадии смолтификации. Обнаружено, что клетки почек смолтов лососевых превышают таковые пресноводных костистых рыб в размерах лейкоцитов и высоте эпителиоцитов проксимальных канальцев. Зарегистрировано увеличение количества, размеров и плотности митохондрий; бо́льшее развитие шероховатого и гладкого эндоплазматичекого ретикулума у разных типов клеток мезонефроса; увеличение количества везикул в базальной части дистальных канальцев почек смолтов лососевых по сравнению с пресноводными рыбами. Впервые в мезонефросе одного вида, на примере лосося, обнаружены клетки с радиально расположенными везикулами различной ультраструктуры. Все описанные особенности ультраструктуры клеток мезонефроса выявлены до перехода смолтов в морскую воду.
ВВЕДЕНИЕ
Термин “смолтификация” объединяет широкий круг явлений этолого-физиолого-биохимической перестройки организма древней и уникальной группы лососевых рыб, предшествующей и сопутствующей миграции из реки в море. При выборе проходной жизненной стратегии, под воздействием комплекса внешних циклически изменяющихся факторов, происходит ряд адаптивных преобразований, которые начинаются в предмиграционный период, продолжаются при миграции молоди вниз по реке и завершаются у преобладающего числа особей ко времени выхода из устья реки (Варнавский, 1990). Несмотря на обилие гистологических работ, посвященных вопросам смолтификации лососевых, преобладающее их число ограничивается описанием морфологических перестроек, происходящих в жаберном аппарате, – ультраструктурой хлоридных клеток жабр. Ряд работ посвящен изучению внутриклеточных перестроек, происходящих в проксимальных и дистальных канальцах нефрона (Винниченко и др., 1975; Лебская, 1988; Maksimovich et al., 2000). Комплексные работы, посвященные изучению особенностей ультраструктуры клеток, образующих ткани почек лососевых в период миграции, отсутствуют. В большинстве работ центральным моментом изучения процесса смолтификации остается анализ скорости адаптации системы водно-солевого обмена в экспериментальных условиях при воздействии определенного фактора. При этом работы, связанные с изучением клеточных перестроек осморегуляторной системы природных популяций лососевых, до сих пор фрагментарны (Maksimovich et al., 2000).
Цель работы – описать тонкое строение клеток, образующих интерстиций и нефроны почек дикой молоди балтийского лосося и кумжи, совершающей покатную миграцию.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Балтийского лосося (Salmo salar Linnaeus, 1758) и кумжу (Salmo trutta L., 1758) отлавливали в р. Луга Ленинградской обл. – единственной реке на территории России, в которой обитает популяция балтийского лосося естественного происхождения. Река Луга считается крупнейшей из 40 рек, в которых обнаружены дикие популяции кумжи Финского залива (Reports…, 2012). В работе использовано 16 экз. смолтов балтийского лосося и четыре экз. смолтов кумжи. Рыбу механически обездвиживали, измеряли ее длину и массу. Туловищные почки иссекали, фиксировали и затем исследовали по стандартной для электронной микроскопии методике. Ультратонкие срезы готовили на микротоме Leica EM UC7, контрастировали уранилацетатом и цитратом свинца, просматривали под электронным микроскопом JEM 1011. Измерения проводили на цифровых фотографиях. При статистической обработке вычисляли средние значения и их ошибки.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
В интерстиции почек обнаружены лейкоциты различной стадии зрелости, образующие кроветворную ткань органа, КРВ и ионтранспортирующие клетки.
Результаты исследования показали, что характерная черта лимфоцитов исследованных видов – их большие размеры, достигающие у кумжи 7 мкм, и крупное округлое ядро (средние размеры 5.0 × × 4.0 мкм), занимающее почти весь объем клетки. Гетерохроматин глыбчатый располагается и вдоль ядерной мембраны, и диффузно по площади ядра. Узкий ободок цитоплазмы содержит в среднем 4 митохондрии, большое количество свободных рибосом и отдельные цистерны шероховатого эндоплазматического ретикулума (табл. 1, рис. 1а, 2а).
Таблица 1.
Морфометрические показатели лейкоцитов Salmo salar и Salmo trutta
| Показатель | Лимфоцит | Плазматическая клетка | Макрофаг | Нейтрофил | Эозинофил |
|---|---|---|---|---|---|
| Salmo salar | |||||
| Размер, мкм: | |||||
| клетки | (5.82 ± 0.42) × × (4.68 ± 0.38) | (10.41 ± 1.18) × × (7.62 ± 1.21) | (11.33 ± 1.88) × × (8.63 ± 1.58) | (9.77 ± 0.15) × × (7.42 ± 0.74) | (11.24 ± 1.47) × × (6.94 ± 0.50) |
| ядра | (4.81 ± 0.29) × × (4.07 ± 0.06) | (6.18 ± 0.77) × × (4.23 ± 0.69) | (4.75 ± 0.65) × × (3.57 ± 0.36) | (6.00 ± 1.38) × × (2.98 ± 0.66) | (6.27 ± 0.90) × × (3.07 ± 0.60) |
| фагосомы | – | – | (2.57 ± 0.43) × × (1.91 ± 0.31) | – | – |
| гранулы | – | – | – | (0.37 ± 0.04) × × (0.27 ± 0.04) | (0.55 ± 0.01) × × (0.40 ± 0.01) |
| Количество на срезе клетки: | |||||
| фагосом | – | – | 5.20 ± 0.65 | – | – |
| гранул | – | – | – | 5.25 ± 0.99 | 86.00 ± 10.47 |
| Salmo trutta | |||||
| Размер, мкм: | |||||
| клетки | (7.08 ± 1.47) × × (5.34 ± 0.86) | (8.82 ± 0.02) × × (8.45 ± 0.16) | (14.19 ± 2.04) × × (11.16 ± 1.12) | (9.65 ± 0.59) × × (7.56 ± 0.56) | (10.81 ± 0.76) × × (7.47 ± 1.15) |
| ядра | (4.81 ± 0.75) × × (4.34 ± 0.86) | (5.10 ± 0.28) × × (4.61 ± 0.43) | (6.17 ± 1.28) × × (3.16 ± 0.68) | (3.63 ± 0.25) × × (1.47 ± 0.15) | (4.66 ± 0.79) × × (3.17 ± 0.41) |
| фагосомы | – | – | (3.74 ± 0.46) × × (2.70 ± 0.38) | – | – |
| гранулы | – | – | – | (0.39 ± 0.02) × × (0.30 ± 0.02) | (0.59 ± 0.01) × × (0.42 ± 0.01) |
| Количество на срезе клетки: | |||||
| фагосом | – | – | 19.00 ± 4.24 | – | – |
| гранул | – | – | – | 15.00 ± 3.68 | 117 ± 25.24 |
Рис. 1.
Ультраструктура клеток интерстиция мезонефроса Salmo salar: а – лимфоцит, б – плазматическая клетка, в – макрофаг, г – макрофагальный центр, д – клетка с радиально расположенными везикулами, е – нейтрофил, ж – специфические гранулы нейтрофила, з – эозинофил, и – цитоплазма хлоридной клетки. В – везикулы, ГХ – гетерохроматин, М – митохондрия, ПГ – пигментные гранулы, СГ – специфические гранулы, ТР – тубулярный ретикулум, ШЭР – шероховатый эндоплазматический ретикулум, ЭХ – эухроматин, Ф – фагосома, Я – ядро, Яд – ядрышко.
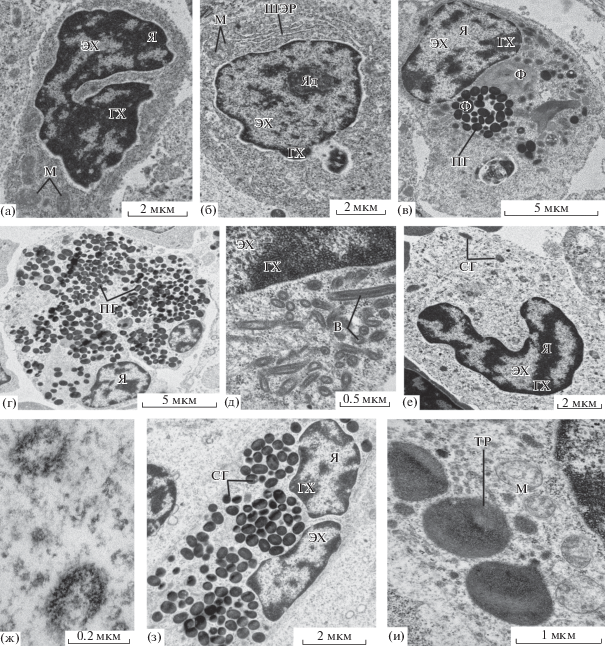
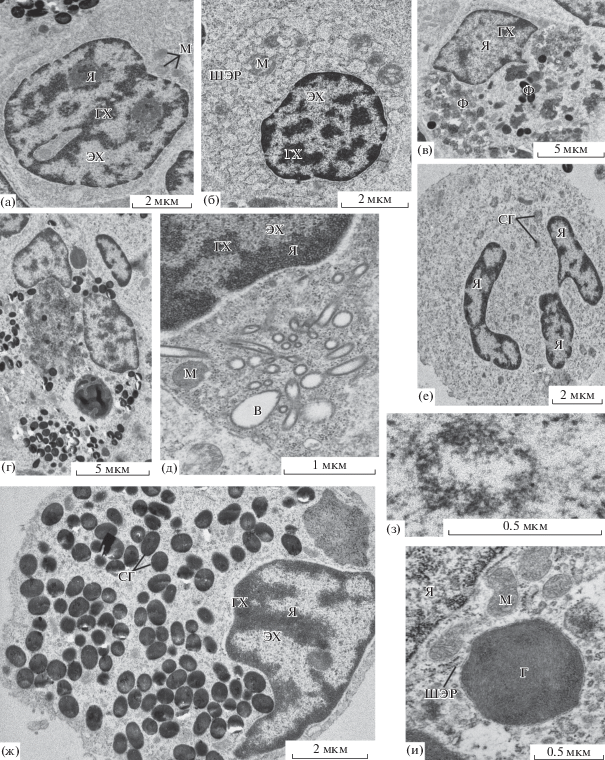
Рис. 2.
Ультраструктура клеток интерстиция мезонефроса Salmo trutta: а – лимфоцит, б – плазматическая клетка, в – макрофаг, г – макрофагальный центр, д – клетка с радиально расположенными везикулами, е – нейтрофил, ж – эозинофил, з – специфическая гранула нейтрофила, и – цитоплазма хлоридной клетки. Г – гранула. Остальные обозначения, как на рис. 1.
Плазматические клетки. Крупные клетки, длиной 8–10 мкм, как правило, овальной формы, с эксцентрично расположенным округлым ядром. Гетерохроматин сконцентрирован вдоль ядерной мембраны между ядерными порами, а также в центре ядра. Цитоплазма содержит цистерны хорошо развитого шероховатого эндоплазматического ретикулума шириной от 0.14 до 0.46 мкм, свободные рибосомы (в среднем семь митохондрий), электронно-плотные лизосомы (табл. 1, рис. 1б, 2б).
Макрофаги. Крупные клетки, средние размеры 11–14 мкм. Ядро расположено эксцентрично, гетерохроматина мало, в основном, он располагается на периферии ядра. Цитоплазма содержит фагосомы, занимающие почти весь объем клетки. Основная масса фагосом – крупные электронно-плотные включения. Помимо них цитоплазма содержит митохондрии, короткие каналы шероховатого эндоплазматического ретикулума, свободные рибосомы, лизосомы и мелкие светлые везикулы (табл. 1, рис. 1в, 2в). Кроме одиночных макрофагов, в интерстиции мезонефроса присутствуют макрофагальные центры –заключенные в общую оболочку агрегаты плотно упакованных макрофагов с включениями электронно-плотных пигментных гранул (рис. 1г, 2г).
Нейтрофилы. Длина ~10 мкм, имеют округлую форму с ацентрично расположенным ядром. Форма ядра варьирует от бобовидной до сегментовидной. Глыбчатый гетерохроматин в основном расположен вдоль ядерной мембраны. Цитоплазма содержит митохондрии, канальцы шероховатого и гладкого эндоплазматического ретикулумов, иногда – фагосомы и мелкие светлые везикулы. Характерный признак нейтрофилов – специфические гранулы, заполняющие цитоплазму. Особенностью в строении данных гранул у лосося и кумжи является наличие электронно-плотных тонких полос (фибрилл), расположенных вдоль гранулы. В цитоплазме нейтрофилов кумжи обнаружены гранулы с более светлой центральной частью и темными фибриллярными краями. В нейтрофилах лосося выявлены два типа гранул. У гранул первого типа фибриллы равномерно распределены по всей длине. Гранулы второго типа аналогичны таковым кумжи (табл. 1, рис. 1е, 1ж, 2е, 2з).
Эозинофилы. Их характерный признак – наличие в цитоплазме округлых электронно-плотных гранул гомогенной структуры. Следует отметить, что эозинофилы исследованных видов крупнее нейтрофилов (табл. 1, рис. 1з, 2ж).
КРВ. Клетки имеют округлую форму, длина 6–7 мкм, ширина 4–5 мкм (табл. 2). Ядро расположено эксцентрично, бобовидной формы, содержит большое количество глыбчатого гетерохроматина. Цитоплазма зернистая, но менее плотная по сравнению с лимфоцитами, содержит короткие цистерны гладкого эндоплазматического ретикулума и митохондрии. В апикальной части клеток располагаются везикулы, рядом с ними видны одна–две митохондрии (рис. 3в, 3г). В почках лосося встречаются как клетки с вытянутыми электронно-прозрачными везикулами с электронно-плотной сердцевиной, так и клетки с везикулами, не имеющими электронно-плотной сердцевины. В почках кумжи обнаружен лишь второй тип клеток (рис. 1д, 2д).
Таблица 2.
Морфометрические показатели клеток с радиально расположенными везикулами и ионтранспортирующих клеток Salmo salar и Salmo trutta
| Показатель | КРВ | Хлоридная клетка | ||
|---|---|---|---|---|
| Salmo salar | Salmo trutta | Salmo salar | Salmo trutta | |
| Размер, мкм: | ||||
| клетки | (6.03 ± 0.45) × × (4.71 ± 0.20) | (7.23 ± 2.14) × × (4.54 ± 0.05) | (15.03 ± 0.87) × × (5.32 ± 0.44) | (15.04 ± 0.86) × × (4.87 ± 0.14) |
| ядра | (4.21 ± 0.44) × × (3.13 ± 0.89) | (4.69 ± 0.24) × × (2.99 ± 0.69) | (4.74 ± 0.37) × × (3.81 ± 0.29) | (4.92 ± 0.57) × × (2.94 ± 0.86) |
| везикулы | 0.42 ± 0.09 | 0.42 ± 0.08 | – | – |
| митохондрии | 0.59 ± 0.02 | 0.55 ± 0.05 | ||
| Количество на срезе: | ||||
| клеток везикулы | 39.0 ± 1.41 | 25.50 ± 3.54 | – | – |
| митохондрий | – | – | 22.0 ± 1.97 | 25.0 ± 1.86 |
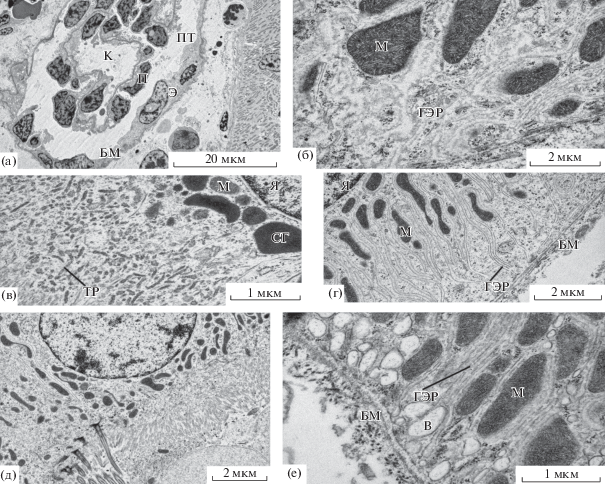
Рис. 3.
Ультраструктура нефрона Salmo salar: а – почечное тельце, б – базальная часть эпителиоцита 1 типа проксимального канальца, в – апикальная часть эпителиоцита I типа проксимального канальца, г – базальная часть эпителиоцита II типа проксимального канальца, д – апикальная часть эпителиоцита 2 типа проксимального канальца, е – базальная часть эпителиоцита дистального канальца. БМ – базальная мембрана, В – везикула, ВК – вставочная клетка, ГЭР – гладкий эндоплазматический ретикулум, ЗЭ – зона эндоцитоза, К – капилляр, М – митохондрия, П – подоцит, ПТ – полость тельца, СГ – секреторные гранулы, ТР – тубулярный ретикулум, ЩК – щеточная каемка, Я – ядро.
Ионтранспортирующие клетки. Длинные и узкие клетки (табл. 2), локализуются диффузно в паренхиме органа, а также окружают сосуды и канальцы нефрона мезонефроса. Округлое ядро располагается ближе к периферии клетки, гетерохроматин глыбчатый. Цитоплазма светлая, содержит большое количество митохондрий (табл. 2). На срезах клеток видны крупные электронно-плотные гранулы и две мембранные системы – тубулярный и гладкий эндоплазматический ретикулум. Отдельные тубулы распределяются по всей клетке, цистерны располагаются преимущественно в околоядерной зоне, степень их развития невелика (рис. 1и, 2и).
Почечное тельце формирует первый отдел нефрона. Состоит из боуменовой капсулы и клубочка капилляров. У исследованных видов почечное тельце построено по единому принципу. Боуменова капсула состоит из двух слоев: наружного и внутреннего. Между слоями имеется полость (3.28 ± 0.58 мкм у лосося и 5.89 ± 0.65 мкм у кумжи), куда из просвета кровеносных капилляров поступает клубочковый фильтрат. Наружный слой капсулы построен из однослойного плоского эпителия, находящегося на базальной мембране. Образующие его эпителиоциты вытянутые, с центрально расположенным ядром. Гетерохроматин располагается как вдоль ядерной мембраны, так и диффузно по площади ядра. Цитоплазма клеток зернистая, содержит митохондрии, канальцы ретикулума, иногда встречаются везикулы. Внутренний слой образован подоцитами, которые находятся на наружной поверхности капилляров клубочка. Толщина базальной мембраны внутреннего слоя капсулы у лосося 0.13 ± ± 0.01 мкм, у кумжи – 0.15 ± 0.01 мкм (рис. 3а, 4а).
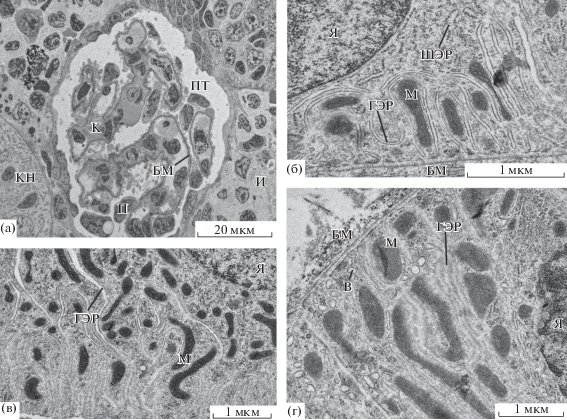
Рис. 4.
Ультраструктура нефрона Salmo trutta: а – почечное тельце, б – базальная часть эпителиоцита I типа проксимального канальца, в – базальная часть эпителиоцита II типа проксимального канальца, г – базальная часть эпителиоцита дистального канальца. И – интерстиций, КН – каналец нефрона, ШЭР – шероховатый эндоплазматический ретикулум. Остальные обозначения, как на рис. 3.
Эпителиоциты проксимального канальца. Все эпителиоциты построены по плану, характерному для клеток этого участка нефрона. От клеток дистального канальца их отличает наличие щеточной каемки, высота которой наибольшая на начальном участке и постепенно уменьшается к его концу. Анализ ультраструктуры клеток, выстилающих этот участок канальца, показал, что эпителиоциты можно разделить на два типа.
Эпителиоциты I типа образуют начало проксимального канальца. Эти клетки наибольшие среди всех типов клеток проксимального канальца (табл. 3). Это вытянутые, пирамидальной формы клетки, плотно прилегающие друг к другу. Ядра округлой формы, расположены в базальной части клеток. Зернистая цитоплазма содержит большое количество митохондрий (табл. 3). От базальной части вдоль клеток тянутся многочисленные складки плазматической мембраны, которые затем переходят в систему канальцев гладкого эндоплазматического ретикулума. Такие складки характерны для всех типов эпителиоцитов всех отделов канальца (рис. 3б, 4б). Имеются лизосомы и крупные электронно-плотные секреторные гранулы, характерные для этого участка нефрона (табл. 3). В апикальной части клеток на границе со щеточной каемкой расположена хорошо развитая зона эндоцитоза (табл. 3). Данная зона характеризуется наличием тубуло-везикулярной системы (рис. 3в). Щеточная каемка наиболее высокая для этого типа эпителиоцитов (табл. 3). Она состоит из большого числа микроворсинок, обращенных в просвет канальца. Кроме того, встречаются одиночные клетки, щеточная каемка которых образована ресничками (табл. 3). Структура реснитчатых эпителиоцитов несколько отличается от таковой эпителиоцитов I типа, несущими на апикальной поверхности микроворсинки. Цитоплазма реснитчатых клеток более светлая, по сравнению с эпителиоцитами I типа. Зона эндоцитоза развита очень слабо, встречаются лишь одиночные тубулы, небольшое количество везикул, в апикальной части клеток обнаруживаются крупные митохондрии, расположенные ниже базальных телец ресничек (рис. 3д).
Таблица 3.
Морфометрические показатели структур нефрона Salmo salar и Salmo trutta
| Показатель | Эпителиоциты проксимального отдела канальца | Эпителиоциты дистального отдела канальца |
|
|---|---|---|---|
| I тип | II тип | ||
| Salmo salar | |||
| Размер, мкм: | |||
| клетки | (13.99 ± 0.81) × (8.68 ± 1.02) | (13.99 ± 0.81) × (8.68 ± 1.02) | (17.14 ± 0.55) × (8.19 ± 0.87) |
| ядра | (6.07 ± 0.59) × (5.54 ± 0.68) | (6.30 ± 0.80) × (5.67 ± 0.99) | (6.75 ± 0.53) × (3.51 ± 0.46) |
| митохондрии | (0.87 ± 0.09) × (0.33 ± 0.03) | (1.80 ± 0.14) × (0.40 ± 0.03)* (0.70 ± 0.07) × (0.30 ± 0.02)** |
(1.18 ± 0.20) × (0.39 ± 0.04)* (0.45 ± 0.03) × (0.29 ± 0.02)** |
| секреторной гранулы | (1.61 ± 0.18) × (0.95 ± 0.11) | – | – |
| зоны эндоцитоза | 2.98 ± 0.17 | 1.38 ± 0.14 | – |
| щеточной каемки | 3.65 ± 0.12 | 2.21 ± 0.33 | – |
| реснички | 0.21 ± 0.00 | 0.22 ± 0.00 | – |
| микроворсинки | 0.10 ± 0.01 | 0.15 ± 0.00 | – |
| Количество на срезе клетки: | |||
| митохондрий | 35.83 ± 2.20 | 49.00 ± 8.15 | 62.25 ± 2.84 |
| секреторных гранул | 8.83 ± 1.28 | – | – |
| Salmo trutta | |||
| Размер, мкм: | |||
| клетки | (14.04 ± 0.86) × (7.98 ± 0.70) | (11.89 ± 1.19) × (10.41 ± 1.50) | (18.46 ± 0.69) × (13.64 ± 0.51) |
| ядра | (5.01 ± 0.35) × (3.51 ± 0.38) | (6.51 ± 0.85) × (5.43 ± 0.49) | (6.20 ± 0.36) × (4.79 ± 0.26) |
| митохондрии | (0.94 ± 0.14) × (0.45 ± 0.15) – |
(1.12 ± 0.09) × (0.18 ± 0.01)* (0.54 ± 0.03) × (0.19 ± 0.02)** |
(1.62 ± 0.15) × (0.38 ± 0.02)* (0.59 ± 0.03) × (0.39 ± 0.03)** |
| секреторной гранулы | (1.73 ± 0.16) × (1.16 ± 0.15) | – | – |
| зоны эндоцитоза | 3.51 ± 0.38 | 2.75 ± 0.19 | – |
| щеточной каемки | 2.48 ± 0.20 | 2.02 ± 0.27 | – |
| реснички | 0.20 ± 0.01 | 0.19 ± 0.00 | – |
| микроворсинки | 0.11 ± 0.00 | 0.16 ± 0.01 | – |
| Количество на срезе клетки: | |||
| митохондрий | 35.50 ± 4.00 | 72.33 ± 13.16 | 80.00 ± 10.49 |
| секреторных гранул | 11 ± 1.95 | 11 ± 1.95 | 11 ± 1.95 |
Эпителиоциты II типа – клетки, которые по плану строения схожи с эпителиоцитами I типа, но меньше таковых по высоте (табл. 3). Ядра эпителиоцитов II типа, как и в клетках I типа, округлой формы, расположены в базальной части клеток. Гетерохроматина мало, большая часть его расположена вдоль ядерной мембраны, между ядерными порами. Цитоплазма менее зернистая, содержит большое количество митохондрий, которые в базальной части клетки расположены вдоль продольной оси клеток. Митохондрии в этой части клеток – это крупные вытянутые органоиды. В апикальной части клеток митохондрии лежат менее упорядочено и представляют собой округлые, меньших размеров органеллы (табл. 3, рис. 3г). Характерный признак эпителиоцитов II типа – отсутствие в цитоплазме секреторных гранул. Зона эндоцитоза развита слабее по сравнению с клетками I типа (табл. 3), хотя четко просматривается наличие тубуло-везикулярной системы. Щеточная каемка менее высокая, чем у клеток I типа (табл. 3), тем не менее, в ее состав входят как реснички – выросты реснитчатых эпителиоцитов (вставочных клеток), так и микроворсинки – выросты цитоплазмы апикальной части эпителиальных клеток, составляющих основу проксимальных канальцев (табл. 3, рис. 3д).
Эпителиоциты дистального канальца – клетки высокие и очень широкие у основания (табл. 3). Ядра большинства этих клеток занимают центральное положение, иногда смещены к базальной части. Гетерохроматин сконцентрирован как на периферии ядра между ядерными порами, так и диффузно по всей поверхности. Для цитоплазмы лосося и кумжи характерно наличие свободных рибосом, складчатость плазматической мембраны и ретикулума, большое количество везикул, локализующихся в базальной части клеток. Обнаружено значительное количество крупных вытянутых митохондрий, расположенных по всей длине строго вдоль продольной оси клетки (табл. 3, рис. 3е, 4г). Зона эндоцитоза отсутствует. Апикальная часть клеток образует лопастевидные цитоплазматические выросты, обращенные в просвет канальца.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Проведенный цитологический анализ мезонефроса лосося и кумжи, находящихся на стадии смолтификации, показал, что почки исследованных видов имеют единый план строения. Интерстиций образован лейкоцитами, формирующими кроветворную ткань, в которой присутствуют единичные клетки эпителиальной природы. Нами обнаружены следующие типы лейкоцитов: лимфоциты, плазматические клетки, макрофаги, нейтрофилы и эозинофилы, встречаются макрофагальные центры небольших размеров. Эпителиальные клетки представлены ионтранспортирующими клетками. Кроме того, в интерстиции мезонефроса, выявлены КРВ, вопрос о природе и функциях которых в организме рыб остается открытым.
Анализ ультраструктуры лейкоцитов показал, что лимфоциты, плазматические клетки, макрофаги, макрофагальные центры почек смолтов лосося и кумжи имеют единый план строения с таковым у пресноводных рыб (Флёрова, 2012; Флёрова, Балабанова, 2013; Cannon et. al., 1980; Cenini, 1984; Smith et al., 1970). Выявлено, что основная форма специфических гранул нейтрофилов исследованных видов – вытянутая гранула фибриллярной структуры. Основная форма специфических гранул эозинофилов – крупная электронно-плотная гомогенная гранула. Ранее гранулоциты с подобными типами гранул были описаны для пресноводных рыб отрядов лососеобразные (Salmo gairdneri, Coregonus albula (L.)) и окунеобразные (Perca fluviatilis L., Stizostedion lucioperca (L.), Stizostedion volgense (Gmelin)) (Флёрова, Балабанова, 2013). Основные отличия описываемых клеток смолтов лосося и кумжи заключаются в большем количестве митохондрий на срезах лимфоцитов и плазматических клеток, более развитом шероховатом эндоплазматическом ретикулуме плазматических клеток, в большем размере всех типов лейкоцитов по сравнению с клетками ранее исследованных пресноводных рыб. Для агранулоцитов рыб, обитающих в пресных водах характерно наличие одной, реже двух митохондрий, размеры клеток в среднем 3 мкм для лимфоцитов и 7 мкм для плазматических клеток (Флёрова, 2012). Следует отметить, что обнаруженное количество митохондрий на срезах агранулоцитов в большей степени характерно для морских рыб, для которых описано наличие 2–4 митохондрий на срезах клеток (Флёрова, 2012, 2016). Расширение цистерн шероховатого эндоплазматического ретикулума в цитоплазме плазматических клеток, возможно, связано с усилением синтетической функции в клетках, возникшей в результате стресса, испытываемого рыбами в процессе миграции из реки в море. Подобные ультраструктурные изменения иммунокомпетентных клеток в почках и селезенке карпа (Cyprinus carpio L., 1758) наблюдали ранее при иммунизации рыб (Балабанова, Заботкина, 1988).
Обнаруженные в интерстиции мезонефроса у исследованных нами видов КРВ ранее описаны для изучаемого органа у ряда представителей отрядов карпообразные, окунеобразные и лососеобразные (Балабанова, 2006; Флёрова, 2012). Эти клетки у пресноводных и морских рыб имеют единый план строения, основные различия наблюдаются в тонком строении везикул: наличие фибриллярной структуры везикул у ранее описанных видов карпообразных рыб и ее отсутствие у рыб отрядов окунеобразные и лососеобразные (Балабанова, 2006; Флёрова, 2012, 2016). Интересен факт, что в отличие от срезов клеток почек кумжи, где обнаружены только электронно-прозрачные везикулы, характерные для лососеобразных, в почках лососей на стадии смолтификации, впервые описаны КРВ с электронно-плотной фибриллой, тянущейся вдоль везикулы. Природа этих клеток до сих пор не ясна. Они встречаются в кроветворных органах, периферической крови, перинатальной жидкости и кишечнике рыб (Балабанова, 2006; Ferguson, 1976; Lopez et al., 2001). Отмечено, что они очень редки, имеются не у всех видов рыб и не у всех представителей одного и того же вида (Балабанова, 2006; Lopez et al., 2001). Обнаружение у лосося КРВ с различной ультраструктурой везикул, указывает на то, что строение везикул – не систематический признак, поскольку оно связано в бо́льшей степени с физиологическим состоянием вида. Возможно, данный тип клеток участвует в защитных реакциях организма. В пользу такого предположения свидетельствует наличие этих клеток в кроветворных органах и периферической крови рыб, а также обнаружение разнотипных КРВ в почках лосося, испытывающего стресс в период миграции из реки в море.
В почках смолтов кумжи и лосося найдены клетки, имеющие сходную структуру с ионтранспортирующими клетками жаберного эпителия костистых рыб (Корниенко, 2008; Матей, 1996; Carmona et al., 2004; Kaneko, Katoh, 2004). Известно, что цитоплазма ионтранспортирующих клеток жабр морских видов рыб содержит большее количество митохондрий по сравнению с пресноводными рыбами (Колобов, 2014; Матей, 1996). Данное утверждение справедливо и для клеток почек: количество митохондрий в них больше, чем у пресноводных рыб (Флёрова, 2012, 2016). По количеству митохондрий на срезах ионтранспортирующих клеткок смолты лосося и кумжи занимают промежуточное положение.
Анализ основных отделов нефрона показал, что почечное тельце смолтов лосося и кумжи имеет единый план строения с пресноводными костистыми рыбами (Флёрова, 2012). Высота эпителиоцитов проксимальных канальцев соответствует таковой у горбуши Oncorhynchus gorbuscha (Walbaum, 1792), идущей на нерестовую миграцию и пойманной в устье реки (Maksimovich et al., 2000). Длина зоны эндоцитоза, щеточной каемки и диаметр микроворсинок эпителиоцитов проксимального канальца ближе к таковым пресноводных костистых рыб (Флёрова, 2012; Maksimovich et al., 2000). По количеству митохондрий и развитию гладкого эндоплазматического ретикулума на срезах проксимальных канальцев I типа смолты лосося и кумжи занимают промежуточное положение между пресноводными и морскими рыбами (Винниченко и др., 1975; Флёрова, 2012). Переплетений мембраны, характерных для эпителиоцитов морских рыб, не обнаружено. Плотность митохондрий проксимальных канальцев I и II типа и дистальных канальцев смолтов лосося и кумжи соответствует таковой митохондриям горбуши O. gorbuscha, обитающей в море (Maksimovich et al., 2000). Размеры митохондрий в базальной части клеток проксимальных канальцев II типа смолтов лосося и кумжи ближе к таковым пресноводных костистых рыб (Флёрова, 2012). Количество митохондрий в эпителиоцитах II типа проксимального, а также эпителиоцитов дистального канальцев превосходит этот показатель не только у ранее исследованных пресноводных костистых рыб (Флёрова, 2012), но и у некоторых видов, обитающих в Черном море (Флёрова, 2012). Следует отметить, что большое количество везикул в базальной части дистальных канальцев также является цитологическим маркером нефронов рыб, обитающих в море (Флёрова, 2012).
Выводы. Сопоставление ультраструктурных особенностей клеток почек лососевых, находящихся на стадии смолтификации, с клетками, образующими мезонефрос пресноводных и морских костистых рыб, дает основание полагать, что размеры лейкоцитов и высота эпителиоцитов проксимальных канальцев, количество, размеры и плотность митохондрий, развитие шероховатого и гладкого эндоплазматичекого ретикулума у разных типов клеток, количество везикул в базальной части дистальных канальцев, наличие КРВ с разной ультраструктурой везикул – цитологические маркеры процесса смолтификации, выявляющиеся до перехода смолтов в морскую воду.
Список литературы
Балабанова Л.В. 2006. Клетки с радиально расположенными везикулами у рыб разных видов // Цитология. Т. 48. № 8. С. 636.
Балабанова Л.В., Заботкина Е.А. 1988. Ультраструктура клеток иммунной системы карпа Cyprinus carpio в норме и при иммунизации // Цитология. Т. 30. № 6. С. 657.
Варнавский В.С. 1990. Смолтификация лососевых. Владивосток: ДВО АН СССР.
Винниченко Л.Н., Наточин Ю.В., Сабинин Г.В. 1975. Ультраструктура и функции клеток проксимального и дистального сегментов нефрона проходных и пресноводных рыб // Цитология. Т. 17. № 4. С. 403.
Корниенко М.С. 2008. Структурно-функциональная характеристика ионоцитов жабр и почки некоторых видов рыб при изменении солености окружающей среды: Автореф. … канд. биол. наук. Владивосток.
Колобов В.А. 2014. Ультраструктура хлоридных клеток жаберного эпителия молоди симы Ncorhynchus masou (Salmonidae) при изменении солености воды // Вопр. ихтиол. Т. 54. № 5. С. 620.
Лебская Т.К. 1988. Способ определения стадии смолтификации у молоди лососевых рыб. Патент SU 1376996.
Матей В.Е. 1996. Жабры пресноводных костистых рыб: Морфофункциональная организация, адаптация, эволюция. Санкт-Петербург: Наука.
Флёрова Е.А. 2012. Клеточная организация почек костистых рыб (на примере отрядов Cypriniformes и Perciformes). Ярославль: ФГБОУ ВПО “Ярославская ГСХА”.
Флёрова Е.А. 2016. Ультраструктура клеток интерстиция мезонефроса костистых рыб черного моря // Биол. моря. Т. 42. № 2. С. 122.
Флёрова Е.А., Балабанова Л.В. 2013. Ультраструктура гранулоцитов костистых рыб (отр. Salmoniformes, Cypriniformes, Perciformes) // Журн. эвол. биохим. и физиол. Т. 49. № 2. С. 162.
Cannon M.S., Mollenhauer H.H., Eurell T.E. et al. 1980. An ultrastructural study of the leucocytes of the channel catfish (Ictalurus punctatus) // J. Morphol. V. 164. № 1. P. 1.
Carmona R., Garcia-Gallego M., Sanz A. et al. 2004. Chloride cells and pavement cells in gill epithelia of Acipenser naccarii: ultrastructural modifications in seawater-acclimated specimens // J. Fish Biol. V. 64. № 2. P. 553.
Cenini P. 1984. The ultrastructure of leucocytes in carp (Cyprinus carpio) // J. Zool. V. 204. № 4. P. 509.
Ferguson H.W. 1976. The ultrastructure of plaice (Pleuronectes platessa) leucocytes // J. Fish Biol. V. 8. № 2. P. 139.
Kaneko T., Katoh F. 2004. Functional morphology of chloride cells in killifish Fundulus heteroclitus, a euryhaline teleost with seawater preference // Fish. Sci. V. 70. P. 723.
Lopez F.P., Pazquin B., Diago M.L., Villena A. 2001. Pear-shaped lymphocytes in randow trout: characterization, tissue distribution and organ // Book of abstracts. X International Conference “Disease fish and shellfish”. Dublin. P. 71.
Maksimovich A.A., Serkov V.M., Zagal’skaya E.O., Kudra A.A. 2000. Ultrastructure and Function of Proximal Tubular Cells of Nephrons of Pacific Salmons Adapted to Environments with Different Salinity // J. Evol. Biochem. Physiol. V. 36. № 3. P. 334.
Report of the Baltic Salmon and Trout Assessment Working Group (WGBAST). 2012. Uppsala.
Smith A.M., Nelson A.W., Potter M. 1970. Plasmacytopoiesis in the pronephros of the carp (Cyprinus carpio L.) // The Anatomical Records. V. 167. P. 351.
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод


