Биология внутренних вод, 2020, № 4, стр. 343-354
Пространственное распределение и межгодовая динамика бактериопланктона в Тайширском и Дургунском водохранилищах (Западная Монголия)
a Институт биологии внутренних вод им. И.Д. Папанина Российской академии наук
Некоузский р-н, Ярославская обл., пос. Борок, Россия
b Череповецкий государственный университет
Череповец, Россия
* E-mail: dkos@ibiw.ru
Поступила в редакцию 13.01.2018
После доработки 06.02.2019
Принята к публикации 22.07.2019
Аннотация
В двух недавно образованных крупнейших в Монголии Тайширском и Дургунском водохранилищах, расположенных в Котловине Больших озер, в течение пяти лет изучали пространственное распределение гетеротрофного бактериопланктона. Общая численность бактерий в водохранилищах и водотоках, на которых они созданы, варьировала в пределах (2.5–14.5) × 106 кл./мл, биомасса – 45–386 мг С/м3. Эти показатели достигали значений, характерных для эвтрофных вод, в обоих водохранилищах, но в Дургунском водохранилище они были в среднем в 1.4 раза выше по сравнению с Тайширским. Полученные данные свидетельствуют, что бактериопланктон этих водохранилищ в период проведения исследований находился в стадии становления. Основу численности и биомассы бактерий составляли одиночные клетки (в среднем 91% общей биомассы). Более крупные агрегированные и нитевидные бактерий вносили существенно меньший вклад в формирование общей биомассы сообщества (в среднем 6.7 и 2.3% соответственно) и достигали наибольшей численности и биомассы в литорали водохранилищ.
ВВЕДЕНИЕ
В Монголии в современный период происходит ускорение темпов роста промышленного производства и увеличение объемов жилищного строительства. Это требует больших затрат электроэнергии, с целью получения которой в стране осуществляется сооружение ГЭС, что приводит к зарегулированию рек и образованию водохранилищ. Изучение формирования биологических сообществ водохранилищ необходимо для понимания общих закономерностей структурно-функциональной организации этих искусственных экосистем на разных этапах их существования. Это особенно важно при исследовании водных экосистем в засушливых регионах, к которым относится Котловина Больших озер в Западной Монголии (Мурзаев, 2006).
В Монголии традиционно развито скотоводство, и в настоящее время происходит возрастание поголовья сельскохозяйственных животных, вследствие чего в водоемы и водотоки повышается поступление органических веществ и соединения биогенных элементов. Также увеличивается добыча полезных ископаемых. Кроме того, в условиях современных климатических изменений наблюдается рост количества атмосферных осадков, усиливаются поверхностный сток и испаряемость, снижается уровень и водообмен озер и расход рек. Все эти факторы способствуют эвтрофированию водных экосистем Монголии (Gomboluudev et al., 2010).
Гетеротрофные бактерии являются важным компонентом пресноводного и морского планктона, вносят значительный вклад в формирование его биомассы и продуктивности, активно участвуют в минерализации органических веществ, круговороте элементов, образовании и потреблении парниковых газов, служат важным пищевым объектом для протистов и многоклеточного зоопланктона (Копылов, Косолапов, 2008; Azam et al., 1990; Kato, 1996; Simon et al., 1992). Определение уровня количественного развития и изучение пространственно-временной динамики бактерий необходимы при исследовании круговорота углерода и других биогенных элементов в водных экосистемах, а также процессов их самоочищения и формирования качества воды.
Цель работы – исследовать количественное распределение и межгодовую динамику бактериопланктона в Тайширском и Дургунском водохранилищах (Котловина Больших озер, Западная Монголия) в первые годы их существования.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Исследования проводили в августе 2011–2015 гг. на двух крупнейших в Монголии водохранилищах: Тайширском (46°43′ с.ш., 96°41′ в.д., 1701 м над уровнем моря) и Дургунском (48°20′ с.ш., 92°48′ в.д., 1156 м над уровнем моря). Эти водоемы расположены в западной части страны на территории Говь-Алтайского и Ховд аймаков, в Котловине Больших Озер, которая относится к Центрально-Азиатскому бессточному бассейну. Климат в местности резко континентальный, преимущественный ландшафт – сухие степи, полупустыни и пустыни (Мурзаев, 2006). На этих водохранилищах построены самые мощные в стране ГЭС. Сооружение Тайширской ГЭС закончено в 2007 г. в верховьях крупнейшего водотока Западной Монголии – р. Завхан. В Тайширском водохранилище, длина которого ~35 км, максимальная глубина в районе плотины ~40 м, воду из поверхностного слоя отбирали в центральной и прибрежной частях его верхнего, среднего и приплотинного участков, а также в р. Завхан в ~1 км выше подпора и в 0.5 км ниже плотины ГЭС. Дургунская ГЭС построена в 2008 г. на протоке Чонохарайх, которая вытекает из оз. Хар-Ус и через ~50 км впадает в оз. Хар. В Дургунском водохранилище, длина которого ~4 км, воду отбирали в верховьях и приплотинной части, в протоке Чонохайрайх – на участках ~1 км выше подпора и ~1 км ниже плотины. Более подробное описание этих водоемов и водотоков дано в работе Крылова и др. (2014).
Воду для микроскопических исследований сразу же после отбора проб фиксировали 40%-ным формалином до конечной концентрации 2%, хранили в темноте при температуре 4°С не более 1 мес. Общую численность и размеры бактериопланктона, а также численность и размеры одиночных, агрегированных и нитевидных бактерий определяли методом эпифлуоресцентной микроскопии с использованием флуорохрома ДАФИ (Porter et al., 1983) и микроскопа Olympus BX51 (Япония), соединенного с цифровой камерой и персональным компьютером. Сырую биомассу бактерий получали путем умножения их численности на средний объем клеток (V, мкм3). Содержание углерода в бактериальных клетках (С, фг С/кл) рассчитывали по уравнению: С = 120V 0.72 (Norland, 1993).
Параллельно с отбором проб измеряли глубину, прозрачность, температуру, электропроводность и рН воды, а также концентрацию растворенного кислорода. Для этого использовали портативный многопараметрический зонд “YSI Model 85” (“YSI, Inc.”, США) и портативный pH-метр “Hanna HI 98129” (“HANNA instruments”, США).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Максимальные глубины обнаружены на приплотинных участках водохранилищ, минимальные – в их прибрежной части и на незарегулированных участках водотоков (табл. 1). В Тайширском водохранилище прозрачность воды была существенно выше, чем в Дургунском. В августе температура воды на исследованных участках водоемов и водотоков варьировала в пределах 9.8–25.3°С. Наибольшие значения отмечены в 2011 и 2012 гг. В системе: протока Чонохарайх – Дургунское водохранилище температура была выше по сравнению с р. Завхан и Тайширским водохранилищем. В Тайширском водохранилище электропроводность воды обычно уменьшалась от верховьев к плотине ГЭС. Такой закономерности в распределении этого показателя в менее крупном Дургунском водохранилище не обнаружено. Значения рН воды находились в слабощелочном диапазоне и незначительно отличались между обследованными водными объектами. В период проведения наблюдений кислородный режим водоемов и водотоков был благополучным для развития гидробионтов: концентрация кислорода постоянно превышала 70% растворимости.
Таблица 1.
Пределы колебаний физико-химических параметров в Тайширском и Дургунском водохранилищах, р. Завхан и протоке Чонохарайх в августе 2011–2015 гг.
| Водный объект | H | Z | T | EC | рН | O2 |
|---|---|---|---|---|---|---|
| Тайширское вдхр. | 0.5–30 | 370–600 | 16.5–22.9 | 130–267 | 7.55–9.01 | 7.84–9.26 |
| Река Завхан | ||||||
| выше водохранилища | 0.4–1.2 | До дна | 13.7–20.1 | 124–254 | 7.83–8.70 | 8.22–9.17 |
| ниже водохранилища | 0.5–0.8 | До дна | 9.8–18 | 156–280 | 7.95–8.57 | 7.88–10.25 |
| Дургунское вдхр. | 0.5–13 | 60–210 | 19.6–25.0 | 187–234 | 7.22–9.2 | 7.32–8.53 |
| Протока Чонохарайх | ||||||
| выше водохранилища | 0.5–2 | 80–100 | 14.7–21.8 | 185–231 | 7.54–8.50 | 7.21–7.67 |
| ниже водохранилища | 0.5–1.2 | До дна | 19.7–25.3 | 189–231 | 7.70–8.89 | 7.31–9.03 |
В августе 2011–2015 гг. общая численность бактериопланктона в Тайширском водохранилище варьировала в пределах (2.51–12.56) × 106 кл./мл, в среднем (6.74 ± 2.47) × 106 кл./мл. Наибольшие значения зарегистрированы в пелагиали и литорали приплотинного плеса в 2013 г., наименьшие – в литорали приплотинного плеса в 2015 г. и в верховьях водохранилища в 2011 и 2015 гг.
В Дургунском водохранилище общая численность варьировала от 5.34 × 106 до 14.46 × 106 кл./мл (в среднем (9.60 ± 2.69) × 106 кл./мл). Наибольшие значения отмечены в верховьях водохранилища в 2013 г. и на приплотинном участке в 2014 г., наименьшие – в верховьях в 2012 г. и на приплотинном участке в 2011 и 2012 гг.
Средние объемы бактериальных клеток изменялись в Тайширском водохранилище от 0.031 до 0.286 мкм3, в Дургунском – от 0.038 до 0.234 мкм3. Средние за 5 лет наблюдений значения этого показателя в исследованных водоемах оказались примерно одинаковыми – 0.109 и 0.103 мкм3 соответственно.
Биомасса бактериопланктона в Тайширском водохранилище изменялась в пределах 45–386 (в среднем 153 ± 89) мг С/м3, в Дургунском водохранилище – в пределах 111–377 (в среднем 209 ± ± 67) мг С/м3. Хотя средняя биомасса бактерий была выше в Дургунском водохранилище, максимальное за весь период наблюдений значение этого параметра зарегистрировано в августе 2012 г. в приплотинном плесе Тайширского водохранилища. В Тайширском водохранилище наиболее высокая биомасса наблюдалась там, где бактерии имели наибольшие размеры, в Дургунском водохранилище – на участках с максимальной численностью бактерий.
Количество бактериопланктона в Тайширском водохранилище превышало таковое на незарегулированных участках р. Завхан и увеличивалось от верховьев к прилотинному участку (рис. 1а). Размеры клеток, наоборот, были меньше в водохранилище по сравнению с рекой (рис. 1б). Соответственно различия биомассы бактериопланктона на зарегулированных и незарегулированных участках реки оказались менее заметны. Наибольшие значения биомассы отмечены в приплотинном плесе водохранилища (рис. 1в). Численность и биомасса бактерий в р. Завхан ниже плотины ГЭС была больше, чем на участке реки, расположенном выше водохранилища.
Рис. 1.
Средние за 2011–2015 гг. значения численности (N, 106 кл./мл) (а), среднего объема клеток (V, мкм3) (б) и биомассы (B, мкг/м3) (в) бактериопланктона в верхней (II), средней (III) и нижней (IV) частях Тайширского (1) и Дургунского (2) водохранилищ и в водотоках выше (I) и ниже (V) этих водохранилищ (1, 2).
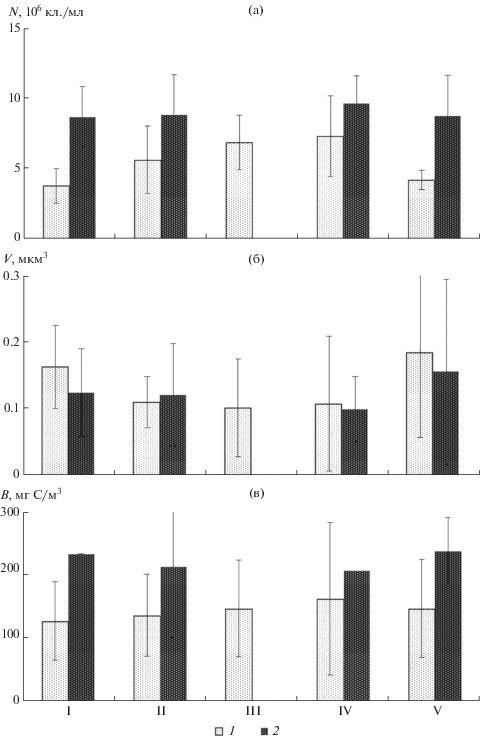
По сравнению с системой Тайширского водохранилища и р. Завхан различия микробиологических показателей между разными участками Дургунского водохранилища и протоки Чонохарайх были менее заметны (рис. 1а–1в), хотя в среднем количество бактериопланктона было наибольшим (при наименьших размерах) в приплотинной части водохранилища, а его размеры и биомасса – в протоке ниже плотины. В среднем биомасса бактерий в протоке Чонохарайх превышала таковую в Дургунском водохранилище: 236 и 208 мг С/м3 соответственно.
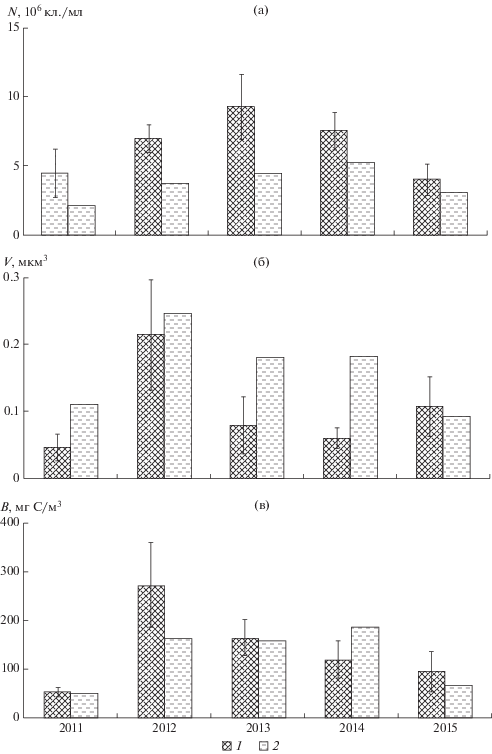
Показатели количественного развития бактериопланктона в глубоководных и прибрежно-мелководных участках водохранилищ в разные годы соотносились по-разному (рис. 2, 3). Например, в Дургунском водохранилище в 2011 и 2014 гг. численность и биомасса бактерий были выше в литорали, а в остальные годы – в пелагиали. По-видимому, на характер пространственного распределения бактериопланктона существенное влияние оказывают характер водного и температурного режимов года и метеорологические условия во время проведения исследований, в частности, сила и направление ветра, осадки и др.
Рис. 2.
Численность (а), средний объем клеток (б) и биомасса (в) бактериопланктона в пелагиали (1) и литорали (2) Тайширского водохранилища в 2011–2015 гг.
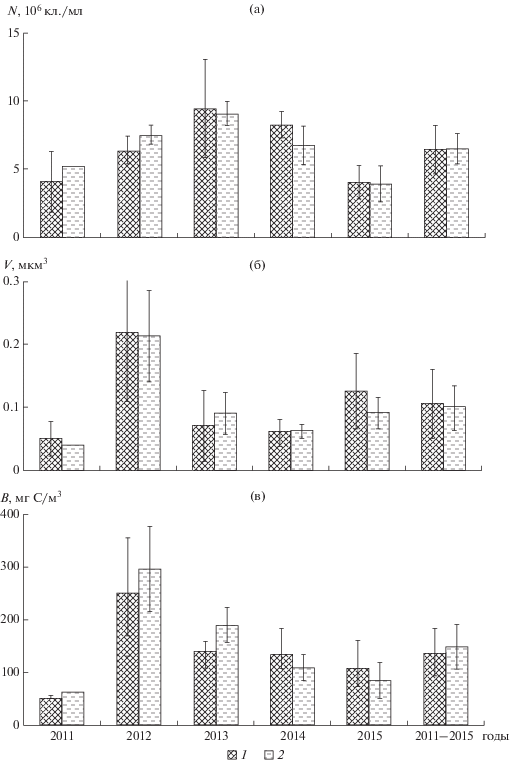
Рис. 3.
Численность (а), средний объем клеток (б) и биомасса (в) бактериопланктона в пелагиали (1) и литорали (2) Дургунского водохранилища в 2011–2015 гг.
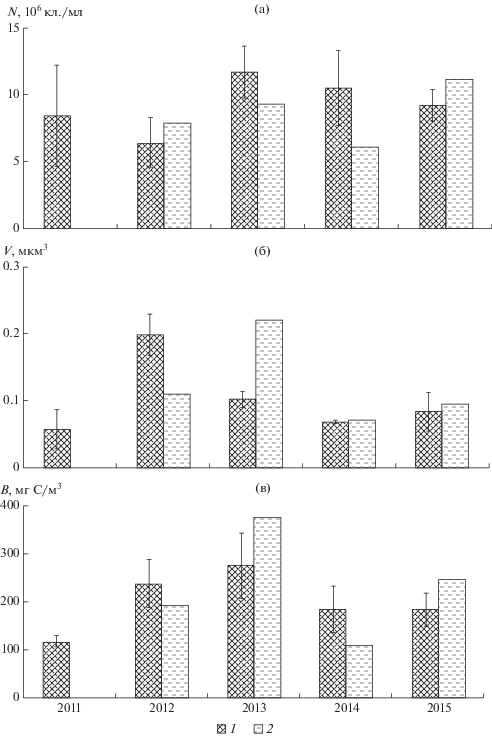
В Тайширском водохранилище максимальная средняя численность бактериопланктона ((9.36 ± ± 2.36) × 106 кл./мл) была в 2013 г., т.е. на седьмой год его существования, минимальная (в среднем (4.06 ± 1.14) × 106 кл./мл) – в 2015 г. (рис. 4а). Максимальная средняя биомасса (275 ± 87 мг С/м3) отмечена в 2012 г. при максимальном среднем объеме клеток (0.217 ± 0.083 мкм3) (рис. 4б, 4в). Минимальные размеры клеток (в среднем 0.047 ± 0.020 мкм3) и биомасса (в среднем 54.7 ± 8.9 мг С/м3) бактерий зарегистрированы в 2011 г.
Рис. 4.
Численность (а), средний объем клеток (б) и биомасса (в) бактериопланктона в Тайширском водохранилище (1) и р. Завхан (2) выше водохранилища в 2011–2015 гг.
Количество и биомасса бактериопланктона на незарегулированном участке р. Завхан, расположенном выше Тайширского водохранилища, были меньше таковых в водохранилище (рис. 4). Межгодовая динамика этих показателей в реке отличалась от таковой в водохранилище: они достигали максимума в 2014 г. (5.34 × 106 кл./мл и 189 мг С/м3), минимума – в 2011 г. (2.16 × 106 кл./мл и 53.6 мг С/м3). Во все годы, за исключением 2015 г., бактерии в реке были крупнее, чем в водохранилище, и достигали максимальных размеров (0.248 мкм3) в 2012 г.
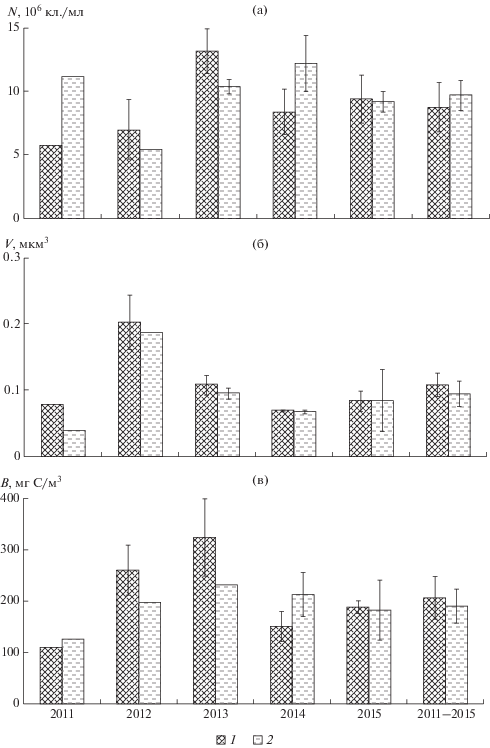
В Дургунском водохранилище наибольшие численность и биомасса бактерий зарегистрированы в 2013 г., на шестой год его существования – (11.80 ± 1.94) × 106 кл./мл и 278 ± 69 мг С/м3 соответственно (рис. 5). Наиболее крупные размеры бактерий (в среднем 0.199 ± 0.031 мкм3), как и в Тайширском водохранилище, обнаружены в 2012 г. В протоке Чонохарайх выше водохранилища максимальную численность наблюдали в 2015 г., максимальные размеры и биомассу, как и в водохранилище, – в 2013 г.
Рис. 5.
Численность (а), средний объем клеток (б) и биомасса (в) бактериопланктона в Дургунском водохранилище (1) и протоке Чонохорайх (2) выше водохранилища в 2011–2015 гг.
Размерно-морфологическую структуру бактериопланктона изучали в августе 2015 г. Основу численности и биомассы бактериопланктона исследованных водохранилищ и водотоков составляли одиночные клетки, объем которых оказался в среднем равным 0.091 мкм3. На долю этих клеток приходилось 91.0% биомассы бактерий (табл. 2). Более крупные агрегированные (прикрепленные к детритным частицам и образующие микроколонии) бактерии (средний объем клеток 0.177 мкм3) и нитевидные бактерии (2.363 мкм3) были минорными компонентами сообщества. Их вклад в формирование биомассы бактериопланктона составил в среднем 6.74 и 2.23% соответственно.
Таблица 2.
Биомасса бактериопланктона (В) и вклад в ее формирование одиночных, агрегированных и нитевидных бактерий в исследованных водных объектах в августе 2015 г.
| Место отбора проб | В, мг С/м3 | Доля группы бактерий, % | ||
|---|---|---|---|---|
| одиночные | агрегированные | нити | ||
| Тайширское вдхр. | ||||
| Верховье, | ||||
| пелагиаль | 85.8 | 93.94 | 4.13 | 1.93 |
| литораль | 115.8 | 91.12 | 7.13 | 1.75 |
| Средняя часть | ||||
| пелагиаль | 69.4 | 96.11 | 2.43 | 1.47 |
| литораль | 92.7 | 88.86 | 9.69 | 1.45 |
| Приплотинный участок | ||||
| пелагиаль | 169.0 | 95.22 | 2.70 | 2.08 |
| литораль | 50.0 | 89.05 | 9.89 | 1.07 |
| Река Завхан | ||||
| выше водохранилища | 68.2 | 92.50 | 5.42 | 2.08 |
| ниже водохранилища | 83.1 | 95.54 | 2.98 | 1.48 |
| Дургунское вдхр. | ||||
| Верховье | ||||
| пелагиаль | 179.6 | 87.20 | 9.46 | 3.34 |
| литораль | 141.8 | 80.22 | 13.04 | 6.74 |
| Приплотинный участок | ||||
| пелагиаль | 198.0 | 93.55 | 4.51 | 1.94 |
| литораль | 223.8 | 85.37 | 11.24 | 3.39 |
| Протока Чонохарайх | ||||
| выше водохранилища | 249.3 | 93.50 | 5.37 | 1.14 |
| ниже водохранилища | 210.8 | 92.21 | 6.37 | 1.42 |
В Тайширском водохранилище доля в бактериопланктоне одиночных клеток была выше, а доля агрегированных и нитевидных бактерий ниже, по сравнению с Дургунским. Вклад этих трех групп в формирование общей бактериальной биомассы в двух водохранилищах в среднем равнялся 92.4 и 86.6%, 6.0 и 9.6%, 1.6 и 3.8% соответственно. Доля агрегированных бактерий достигала наибольших значений в литорали Дургунского водохранилища – 11.2–13.0% биомассы бактериопланктона. В Тайширском водохранилище она также была выше в литоральной зоне. Нити вносили наибольший вклад (6.74%) в формирование биомассы бактериопланктона в литорали верховьев Дургунского водохранилища. В водотоках доля одиночных, агрегированных и нитевидных бактерий в биомассе сообщества изменялась в пределах 92.2–95.5, 3.0–6.4 и 1.1–2.1% соответственно.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В Тайширском и Дургунском водохранилищах зарегистрирована высокая численность и биомасса гетеротрофного бактериопланктона, характерная для эвтрофных вод (Копылов, Косолапов, 2007). При этом необходимо учитывать, что наши исследования проведены в августе, когда количество бактерий в водохранилищах, в том числе расположенных в Центральной Азии, обычно достигает своих наибольших значений (Кожова, Мамонтова, 1979).
Несмотря на общие черты (оба пресные, крупные, расположены на плоскогорье, в зоне аридного климата), эти водохранилища имеют и ряд различий, обусловленных, главным образом, типом их формирования. Тайширское водохранилище образовано на р. Завхан и относится к озерному типу. Меньшее по размерам Дургунское водохранилище принадлежит к каньонному типу. Оно образовано на протоке Чонохарайх, вытекающей из эвтрофного оз. Хар-Ус, воды которого поступают в водохранилище и во многом определяют условия существования гидробионтов. Характерная особенность Дургунского водохранилища – многочисленные плавающие тростниковые острова, приносимые из заболачиваемых участков озера. При разрушении этих образований материал, из которых они состоят, оседает на дно, что способствует дополнительному эвтрофированию водоема. В результате этого уровень трофии и количественное развитие бактериопланктона в Дургунском водохранилище выше, чем в Тайширском. Однако в последнем бактериальные параметры варьировали в более широких пределах, в том числе из-за его больших размеров. Объем клеток бактерий оказался более вариабельным, чем их количество: коэффициенты вариации этих показателей в Тайширском водохранилище составили 70.9 и 36.7%, в Дургунском – 50.5 и 28.0% соответственно.
Как и в большинстве других водных экосистем, включая водохранилища (Копылов, Косолапов, 2008), основу численности и биомассы бактериопланктона Тайширского и Дургунского водохранилищ и водотоков, на которых они образованы, представляли одиночные клетки. Зарегулирование реки и протоки пока не привело к заметному изменению количества и доли в сообществе бактерий, прикрепленных к взвешенным частицам. При исследовании небольшого водохранилища, расположенном на юго-западе США, установлено, что количество агрегированных бактерий мало изменялось вдоль его продольного профиля. Небольшое увеличение происходило только в его озерной части (до 30% общей численности). В реке выше и ниже водохранилища агрегированные бактерии составляли в среднем 42–45 и 19–32% численности бактериопланктона соответственно (Kondratieff, Simmons, 1985). Соотношение одиночных бактерий и бактерий, прикрепленных к детритным частицам, в сообществе зависит от уровня развития и физиологического состояния фитопланктона. Количество агрегированных бактерий, как правило, возрастало в периоды интенсивного цветения воды фитопланктоном. Другие факторы также оказывали влияние. Так, в речной части водохранилища, расположенного в субтропической зоне США, бактерии, прикрепленные к частицам взвеси, составляли большую часть биомассы сообщества во время летних штормов, в остальные периоды преобладали одиночные бактерии. В промежуточной зоне водохранилища шторма не влияли на количество одиночных бактерий, оно почти не изменялось и было существенно выше количества агрегированных бактерий (Lind, Barcena, 2003).
После возведения плотин на реках на их зарегулированных участках происходят значительные трансформации, оказывающие существенное влияние на сообщества гидробионтов: замедляется скорость течения воды и водообмен, усиливаются колебания уровня и седиментация, изменяются температурный и кислородный режимы, возникает стратификация водной толщи и др. (Авакян и др., 1987). Уровень развития бактериальных сообществ в водохранилищах в значительной степени определяется их гидрологическими и гидрохимическими характеристиками и гидрометеорологическими условиями. Межгодовые колебания метеорологических и гидрологических условий, влияющих на время водообмена, является “ключевым фактором лимнологии водохранилищ” (Straškraba et al., 1993). Гидрохимический режим водохранилищ формируется под влиянием процессов, происходящих в самом водоеме, на его водосборной площади и в прибрежно-мелководной зоне. Литораль занимает небольшую часть Тайширского и еще меньшую Дургунского водохранилищ. За исключением периода таяния снега и льда, поступления органических веществ и биогенных элементов с водосборной площади играют незначительную роль в функционировании этих водных экосистем, что связано с бедностью почв и растительного покрова и небольшим количеством выпадающих осадков. По-видимому, в водохранилищах гетеротрофные бактерии для своего метаболизма используют в основном субстраты, образуемые фитопланктоном.
При изучении структурно-функциональных характеристик бактериопланктона равнинных водохранилищ Европы, в частности построенных на реках Волга и Днепр, выявлены основные стадии его сукцессии (Гак, 1975; Михайленко, 1999; Романенко, 1985). Первая стадия характеризуется активизацией бактериальных процессов вследствие действия “эффекта затопления”. В бактериальном сообществе преобладают быстрорастущие популяции, активно потребляющие лабильные органические вещества. Примерно через 10–15 или более лет наступает вторая стадия – период стабилизации, который характеризуется уменьшением количества и продукции бактерий. По-видимому, наши исследования, начатые в 2011 г., – на пятый год существования Тайширского водохранилища и на четвертый год существования Дургунского водохранилища – проводились в период становления бактериопланктона. В дальнейшем можно ожидать уменьшения его количества и активности, и, соответственно, замедления процессов микробного разложения органических веществ и, следовательно, самоочищения водохранилищ. Однако для выявления тенденций многолетних изменений бактериопланктона этих водоемов необходимы дальнейшие исследования. Пока можно только констатировать, что в последние два года исследований (2014–2015 гг.) в обоих водохранилищах отмечалось уменьшение бактериальной численности и биомассы (рис. 4, 5). В то же время, по данным А.В. Крылова и др. (2014), зоопланктон Тайширского и Дургунского водохранилищ уже окончательно сформировался и сейчас находится на этапе стабилизации.
В водохранилищах наблюдаются пространственные изменения вдоль продольного градиента от реки к плотине, формируемого по мере того, как течение реки замедляется, и свойства экосистемы изменяются с лотических на лентические. В результате замедления течения и водообмена происходят изменения физических, химических и биологических характеристик (Straškrabova et al., 2005). Обычно вдоль продольного профиля водохранилища выделяют три основные зоны: речную, промежуточную и озерную, которые могут различаться и по трофическому статусу (Lind, 2002).
В результате исследования водохранилищ Европы и Америки выявлены особенности продольного распределения бактериальных сообществ (Comerma et al., 2001; Lind, 2002; Lind, Barcena, 2003; Straškrabova et al., 2005). В речной зоне водохранилищ бактерии (и частично фитопланктон) контролируются в основном “снизу” запасами субстратов и биогенных элементов. В промежуточной зоне с увеличением количества протистов начинает преобладать “контроль сверху”, поскольку эти организмы – главный фактор, влияющий на биомассу, продукцию, структуру, морфологию и разнообразие бактерий (Jürgens, Matz, 2002; Simon et al., 1992). В нижней части промежуточной зоны многоклеточный зоопланктон, поступающий из озерной зоны, оказывает сильное воздействие на все компоненты микробной “петли”. В озерной зоне водохранилищ динамика планктона сходна с таковой в озерах, расположенных в таких же климатических условиях, хотя накладывает отпечаток то, что в водохранилищах меньше период водообмена и более выражена горизонтальная гетерогенность.
В Тайширском водохранилище численность и биомасса бактериопланктона выше, чем в р. Завхан, и они постепенно уменьшаются от его верховьев к плотине (рис. 1). Размеры бактерий, наоборот, больше в реке по сравнению с водохранилищем. Микробиологические показатели на участке реки ниже плотины ГЭС превышают таковые на ее участке выше водохранилища.
Различия в количественном развитии бактериопланктона между различными участками Дургунского водохранилища и протокой Чонохарайх выражены менее явно по сравнению с Тайширским водохранилищем (рис. 1). Если численность бактерий в приплотинной части Дургунского водохранилища выше, чем в его верховьях и протоке, то их биомасса, наоборот, выше в протоке. По-видимому, в первую очередь это связано с тем, что в Дургунское водохранилище поступают эвтрофные воды оз. Хар-Ус. Кроме того, характер продольного распределения бактериопланктона во многом зависит от степени развития зоопланктона, которая, как показано ранее, определяется скоростью течения, а также типом и площадью затапливаемых участков суши (Крылов и др., 2014). Если в Дургунском водохранилище численность и биомасса зоопланктона уменьшаются по направлению от верховьев к плотине, то в Тайширском, наоборот, увеличиваются. В верховье Дургунского водохранилища в общей численности и биомассе зоопланктона больше доля ракообразных, чем в верховье Тайширского водохранилища, где обнаружены только коловратки. В приплотинной части Дургунского водохранилища зоопланктон характеризуются меньшей долей ветвистоусых ракообразных, чем в Тайширском водохранилище. В связи с этим важно понимать, что кладоцеры, в частности дафнии, способны оказывать мощное воздействие на все компоненты микробной трофической сети, выедая как одиночных, так и агрегированных бактерий, а также их основных потребителей – простейших (Degans et al., 2002; Kato, 1996).
Исследуемые водохранилища расположены в Центрально-Азиатском бессточном бассейне, характеризующимся резко континентальным засушливым климатом. Закономерности формирования и функционирования биологических сообществ водохранилищ аридной зоны изучены гораздо хуже по сравнению с водохранилищами, расположенными в регионах с нормальным и избыточным увлажнением. В последние десятилетия в Центрально-Азиатском бассейне происходят существенные изменения, связанные с локальными и глобальными антропогенными и климатическими факторами. В результате в этом регионе изменяются уровенный, температурный и кислородный режимы, характер стратификации, минерализация и трофический статус озер, рек и водохранилищ, что приводит к значительной перестройке их биологических сообществ. Все это обосновывает необходимость дальнейшего продолжения исследований микробных сообществ водохранилищ. В частности, важным представляется вопрос о факторах, регулирующих развитие бактериопланктона в таких искусственных экосистемах как водохранилища, представляющих собой “гибрид” реки и озера (Kimmel et al., 1990). Знание этих факторов будет способствовать пониманию того, как углерод и другие биогенные элементы циркулируют в планктонных трофических сетях. В эвтрофном водохранилище каньонного типа (Испания) продукция бактериопланктона регулировались запасами субстратов и биогенных элементов, а его количество и активность в речной части контролировались консументами, в озерной части – консументами и концентрацией биогенных элементов (Gasol et al., 2002). Исследования олигомезотрофного водохранилища (Франция) в первые годы после его образования показали, что активным метаболизмом обладает только малая часть (0.04–3.23%) планктонных бактерий, однако именно они отвечают за метаболизм всего бактериального сообщества (Jugnia et al., 2000). С использованием корреляционного и регрессионного анализов установлено, что активность бактериопланктона этого водохранилища зависит в основном от температуры (на 80%) и концентрации легкоокисляемых растворимых органических веществ, таких как аминокислоты и моносахариды.
Выводы. Тайширское и особенно Дургунское водохранилища характеризуются высоким уровнем развития бактериопланктона, характерным для мезо- и эвтрофных вод. По-видимому, в период проведения наших исследований бактериопланктон этих недавно образованных водоемов находился в стадии своего становления. В дальнейшем можно ожидать наступления периода стабилизации и уменьшения количества и активности бактерий, хотя темпы и характер протекания процесса в Тайширском и Дургунском водохранилищах, вероятно, будут различными. Изучение закономерностей распределения и динамики бактериопланктона и факторов, их регулирующих, необходимо для прогноза ответных реакций бактериальных сообществ в различных ситуациях и моделирования функционирования и формирования качества воды водохранилищ.
Список литературы
Авакян А.Б., Салтанкини В.П., Шарапов В.А. 1987. Водохранилища. Москва: Мысль.
Гак Д.З. 1975. Бактериопланктон и его роль в биологической продуктивности водохранилищ. Москва: Наука.
Кожова О.М., Мамонтова Л.М. 1979. Бактериопланктон ангарских водохранилищ и статистические методы его анализа. Ленинград: Гидрометеоиздат.
Копылов А.И., Косолапов Д.Б. 2007. Микробиологические индикаторы эвтрофирования пресных вод // Биоиндикация в мониторинге пресноводных экосистем: Сб. матер. межд. конф. Санкт-Петербург: Изд-во “Лема”. С. 176.
Копылов А.И., Косолапов Д.Б. 2008. Бактериопланктон водохранилищ Верхней и Средней Волги. Москва: Изд-во Соврем. гуманитар. ун-та.
Крылов А.В., Солонго Д., Мэндсайхан Б. 2014. Зоопланктон Дургунского и Тайширского водохранилищ (Западная Монголия) в конце периода наполнения // Аридные экосист. Т. 20. № 2(59). С. 48.
Михайленко Л.Е. 1999. Бактериопланктон днепровских водохранилищ. Киев: Ин-т гидробиол. НАН Украины.
Мурзаев Э.М. 2006. О самом северном проникновении сухих пустынь // Очерки физической географии Монголии. Улаанбаатар: Бэмби сан. С. 452.
Романенко В.И. 1985. Микробиологические процессы продукции и деструкции органического вещества во внутренних водоемах. Ленинград: Наука.
Azam F., Cho B.C., Smith D.C., Simon M. 1990. Bacterial cycling of matter in the pelagic zone of aquatic ecosystems // Large Lakes – Ecological Structure and Function. Berlin: Springer. P. 477.
Comerma M., Garcia J.C., Armengol J. et al. 2001. Planktonic food web structure along the Sau Reservoir (Spain) in summer 1997 // Int. Rev. Hydrobiol. V. 86. P. 193.
Degans H., Zöllner E., Gucht K. et al. 2002. Rapid Daphnia-mediated changes in microbial community structure: an experimental study // FEMS Microbiol. Ecol. V. 42. № 1. P. 137. https://doi.org/10.1111/j.1574-6941.2002.tb01003.x
Gasol J.M., Comerma M., Garcıa J.C. et al. 2002. A transplant experiment to identify the factors controlling bacterial abundance, activity, production, and community composition in a eutrophic canyon-shaped reservoir // Limnol. Oceanogr. V. 47. № 1. P. 62. https://doi.org/10.4319/lo.2002.47.1.0062
Gomboluudev P., Natsagdorj L., Sarantuya G. 2010. Climatic changes on the Mongolian territory and their consequences // Ecological consequences of biosphere processes in the ecotone zone of southern Siberia and Central Asia. Ulaanbaatar: Bembi san Publishing House. P. 41.
Jürgens K., Matz C. 2002. Predation as a shaping force for the phenotypic and genotypic composition of planktonic bacteria // Antonie Van Leeuwenhoek. V. 81. № 1–4. P. 413. https://doi.org/10.1023/A:1020505204959
Jugnia L.B., Richardot M., Debroas D. et al. 2000. Variations in the number of active bacteria in the euphotic zone of a recently flooded reservoir // Aquat. Microb. Ecol. V. 22. P. 251. https://doi.org/10.3354/ame022251
Kato K. 1996. Bacteria – a link among ecosystem constituents // Res. Popul. Ecol. V. 38. P. 185.
Kimmel B.L., Lind O.T., Paulson L.J. 1990. Reservoir primary production // Reservoir Limnology: Ecological Perspectives. New York: Wiley-Interscience. P. 109.
Kondratieff P.F., Simmons G.M., Jr. 1985. Microbial colonization of seston and free bacteria in an impounded river // Hydrobiologia. V. 128. P. 127.
Lind O. 2002. Microbial production and reservoir zone trophic states // Lake and Reservoir Management. V. 18. P. 129.
Lind O.T., Barcena E. 2003. Riverine and transition zone bacterioplankton community dynamics in response to pulsed river inflow // Hydrobiologia. V. 504. P. 79. https://doi.org/10.1023/B:HYDR.0000008510.07516.49
Norland S. 1993. The relationship between biomass and volume of bacteria // Handbook of methods in aquatic microbial ecology. Boca Raton: Lewis Publishers. P. 303.
Pernthaler J. 2005. Predation on prokaryotes in the water column and its ecological implications // Nat. Rev. Microbiol. V. 3. № 7. P. 537. https://doi.org/10.1038/nrmicro1180
Porter K.G., Feig Y.S. 1980. The use of DAPI for identifying and counting of aquatic microflora // Limnol. Oceanogr. V. 25. № 5. P. 943.
Simon M., Cho B.C., Azam F. 1992. Significance of bacterial biomass in lakes and the ocean: comparison to phytoplankton biomass and biogeochemical implications // Mar. Ecol. Prog. Ser. V. 86. P. 103.
Straškraba M., Tundisi J.G., Duncan A. 1993. State-of-the-art of reservoir limnology and reservoir management // Comparative reservoir limnology and water quality management. Dordrecht: Kluwer Acad. Pub. P. 213.
Straškrabova V., Šimek K., Vrba J. 2005. Long-term development of reservoir ecosystems – changes in pelagic food webs and their microbial component // Limnetica. V. 24. № 1–2. P. 9.
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод


