Биология внутренних вод, 2020, № 5, стр. 458-468
Разнообразие и особенности формирования стоматоцист хризофит в мелководном эвтрофном водоеме на юге Западной Сибири
О. П. Баженова a, *, И. Ю. Игошкина a
a Омский государственный аграрный университет им. П.А. Столыпина
Омск, Россия
* E-mail: olga52@bk.ru
Поступила в редакцию 12.04.2019
После доработки 22.07.2019
Принята к публикации 23.09.2019
Аннотация
По данным сканирующей электронной микроскопии, в планктоне мелководного эвтрофного водоема природного парка “Птичья гавань” (г. Омск), расположенного на юге Западной Сибири, выделено 105 морфотипов стоматоцист хризофит, объединенных в 20 групп. Разнообразие морфотипов значительно превышает видовое богатство хризофит (24 вида) в этом водоеме. Наиболее высокое разнообразие морфотипов (64) характерно для орнаментированных стоматоцист. Максимальное обилие стоматоцист наблюдается осенью, минимальное – зимой. Преобладают неорнаментированные стоматоцисты сферической формы без воротничка. Полученные данные могут быть использованы при создании палеолимнологических реконструкций.
ВВЕДЕНИЕ
Хризофиты или золотистые водоросли, относящиеся к отделу Ochrophyta (M. Guiry, G. Guiry, 2018), представляют собой группу разнообразных по морфологии флагеллат, формирующих значительную часть биомассы фитопланктона в водоемах со средней и низкой продуктивностью (Kristiansen, 1986; Siver, 2003). В последние годы установлено, что в эвтрофных реках и озерах хризофиты могут создавать до 20% биомассы планктона (Баженова и др., 2012а; Волошко, 2017) и даже вызывать “цветение” воды (Nicholls, 1995; Watson et al., 2001). В условиях возрастающего антропогенного эвтрофирования и загрязнения водных объектов легкорастворимыми органическими веществами видовое богатство и обилие хризофит может резко возрастать, как это установлено, например, для фитопланктона рек и озер Омского Прииртышья (Баженова и др., 2012а, 2019).
Одна из особенностей хризофит классов Сhrysophyceae и Synurophyceae – способность формировать покоящиеся стадии или стоматоцисты. Благодаря своему составу кремниевые стоматоцисты хорошо сохраняются в донных отложениях и поэтому широко применяются в палеолимнологических исследованиях в качестве индикаторов трофности водоемов, изменений климата и других параметров окружающей среды (Edlund et al., 1995; Smol, 1995; Vorobyova et al., 1996; Lotter et al., 1997; Wilkinson, Smol, 1998; Wilkinson et al., 1999; Rull, Vegas-Vilarrubia, 2000; Paterson et al., 2003; Фирсова, 2008). Изучение стоматоцист хризофит имеет важное значение и для оценки экологического состояния водных объектов, поскольку морфология стоматоцист для многих таксонов видоспецифичнa (Duff et al., 1995; Волошко, 2017).
В последние годы исследованиям стоматоцист в России уделяется повышенное внимание (Фирсова, Лихошвай, 2006; Баженова, Шаховал, 2011; Баженова и др., 2012б; Волошко, 2016; Снитько и др., 2016, 2018; Жукова и др., 2017; Снитько, Волошко, 2017, 2018; Фирсова и др., 2017; Шадрина, 2018), чему способствовало более широкое применение СЭМ и возросший интерес к изучению биоразнообразия водных экосистем в условиях повышенного антропогенного воздействия.
Природный парк “Птичья гавань” расположен в левобережной долине р. Иртыш в центре г. Омскa (54°58′0″ c.ш., 73°23′0″ в.д.). Его своеобразным ядром служит одноименный водоем. Парк относится к особо охраняемым природным территориям регионального значения (Bazhenova, Igoshkina, 2016).
Предыдущие исследования стоматоцист в Сибири проводили, в основном, на глубоководных олиготрофных водоемах, таких как озера Байкал (Фирсова, 2008; Фирсова, Лихошвай, 2006; Фирсова и др., 2008, 2017) и Телецкое (Митрофанова, 2012), отличающихся высоким разнообразием хризофит. Между тем, на юге Западной Сибири, где находится г. Омск, расположено огромное количество мелководных эвтрофных озер с малоизученным разнообразием стоматоцист, поэтому исследование особенностей их формирования в подобных водоемах актуально.
Цель работы – исследовать разнообразие и выявить особенности формирования стоматоцист хризофит в мелководном эвтрофном водоеме юга Западной Сибири.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Водоем природного парка “Птичья гавань” (далее – Птичья гавань) находится на пути поверхностного, грунтового и подземного стоков в сторону р. Иртыш, уровень воды в нем выше, чем в реке. После работ по реконструкции и дноуглублению (2007–2010 гг.) небольшие природные озера Птичьей гавани, ранее разделенные перемычками из отложений ила и водной растительности, были объединены в один большой водоем со значительной островной частью. Максимальная глубина водоема 2.7 м, средняя – 1.6 м. В период открытой воды 2010–2012 гг. измеряли температуру и прозрачность воды по диску Секки (табл. 1). Гидрохимический анализ проводили один раз в сезон.
Таблица 1.
Прозрачность и температура воды водоема Птичья гавань в 2010–2012 гг.
| Месяц | Прозрачность по диску Секки, см | Температура воды, °С | ||||
|---|---|---|---|---|---|---|
| 2010 г. | 2011 г. | 2012 г. | 2010 г. | 2011 г. | 2012 г. | |
| Апрель | 60.0 | 78.0 | 98.0 | 8.0 | 9.0 | 10.5 |
| Май | 132.0 | 111.5 | 118.0 | 14.0 | 16.0 | 14.0 |
| Июнь | 134.0 | 141.0 | 163.0 | 18.0 | 20.5 | 25.0 |
| Июль | 49.0 | 96.0 | 97.0 | 24.0 | 20.0 | 30.0 |
| Август | 40.5 | 50.0 | 70.0 | 18.0 | 19.5 | 19.5 |
| Сентябрь | 38.5 | 145.0 | 86.0 | 16.0 | 15.0 | 8.0 |
| Октябрь | 71.0 | 115.0 | 143.0 | 7.0 | 7.0 | 6.0 |
Гидрохимический режим водоема отличался ярко выраженной нестабильностью (табл. 2). В период с зимы 2010 г. по весну 2011 г. его воды по ионному составу относились к классу сульфатных, начиная с лета 2011 г. – к классу гидрокарбонатных.
Таблица 2.
Гидрохимические показатели водоема Птичья гавань в 2010–2012 гг.
| Показатель | 2010 г. | 2011 г. | 2012 г. | |||||||
|---|---|---|---|---|---|---|---|---|---|---|
| зима | весна | лето | осень | весна | осень | зима | весна | лето | осень | |
| Гидрокарбонаты, мг/дм3 | 302.0 ± 11.06 | 137.30 ± 6.12 | 109.80 ± 5.29 | 188.60 ± 7.66 | 169.0 ± 7.10 | 206.20 ± 13.30 | 277.60 ± 10.30 | 186.0 ± 12.0 | 246.0 ± 16.0 | 253.0 ± 10.0 |
| Сульфаты, мг/дм3 | 487.0 ± 38.09 | 242.50 ± 20.98 | 216.50 ± 19.16 | 297.30 ± 24.81 | 221.40 ± 20.40 | 187.80 ± 17.10 | 243.0 ± 22.0 | 173.0 ± 17.0 | 192.0 ± 18.0 | 202.0 ± 19.0 |
| Кальций, мг/дм3 | 177.50 ± 11.38 | 64.30 ± 4.25 | 54.70 ± 3.65 | 88.80 ± 5.79 | 51.20 ± 3.40 | 22.0 ± 1.60 | 51.10 ± 3.40 | 22.40 ± 1.60 | 76.80 ± 5.0 | 78.20 ± 5.10 |
| Магний, мг/дм3 | 98.60 | 24.00 | 28.80 | 38.30 | 43.20 | 59.70 | 71.60 ± 18.70 | 64.10 ± 6.80 | 41.0 ± 4.20 | 40.10 ± 4.20 |
| Натрий + калий, мг/дм3 | 108.0 | 116.20 | 95.20 | 114.20 | 97.0 | 92.70 | 103.50 ± 21.70 | 55.0 ± 9.0 | 82.0 ± 17.20 | 96.80 ± 15.50 |
| Азот нитратный, мг/дм3 | 0.307 ± 0.080 | 0.103 ± 0.030 | 0.017 ± 0.008 | 0.053 ± 0.020 | <0.010 | <0.010 | 0.017 ± 0.008 | <0.010 | 0 | 0.019 ± 0.009 |
| Азот нитритный, мг/дм3 | 0.005 ± 0.005 | 0.031 ± 0.008 | 0.020 ± 0.007 | 0.010 ± 0.005 | <0.010 | 0.106 ± 0.280 | <0.005 | <0.005 | <0.005 | <0.005 |
| Азот аммонийный, мг/дм3 | 0 | 0 | 0 | 0 | 0 | 0 | 0.65 ± 0.05 | 0 | 0 | 0 |
| Хлориды, мг/дм3 | 219.80 ± 7.99 | 89.70 ± 4.09 | 92.35 ± 4.17 | 101.70 ± 4.45 | 92.90 ± 4.20 | 86.10 ± 4.0 | 105.30 ± 4.60 | 69.10 ± 3.50 | 86.90 ± 4.0 | 96.10 ± 4.30 |
| рН | 7.31 ± 0.10 | 7.84 ± 0.10 | 8.50 ± 0.10 | 7.90 ± 0.10 | 7.95 ± 0.10 | 8.20 ± 0.10 | 7.10 ± 0.10 | 8.0 ± 0.10 | 7.10 ± 0.10 | 8.0 ± 0.10 |
| Сумма ионов, мг/дм3 | 1392.90 | 674.0 | 597.30 | 828.90 | 675.0 | 654.50 | 852.10 ± 57.70 | 597.0 ± 37.0 | 724.0 ± 44.0 | 766.20 ± 41.50 |
| Фосфор общий, мг/дм3 | 0.110 ± 0.030 | 0.040 ± 0.025 | 0.049 ± 0.030 | 0.020 ± 0.022 | 0.020 ± 0.020 | 0.058 ± 0.028 | 0.040 ± 0.025 | 0.029 ± 0.024 | 0.035 ± 0.025 | 0.037 ± 0.025 |
| БПК5, мгО/дм3 | 1.55 ± 0.39 | 4.26 ± 0.56 | 2.43 ± 0.45 | 2.13 ± 0.43 | 2.17 ± 0.43 | 2.19 ± 0.43 | 1.20 ± 0.40 | 3.27 ± 0.50 | <1.0 | 2.50 ± 0.40 |
| ХПК, мгО/дм3 | 59.0 ± 4.84 | 56.30 ± 4.68 | 58.50 ± 4.81 | 52.80 ± 4.47 | 40.40 ± 3.70 | 24.90 ± 2.79 | 28.80 ± 3.0 | 31.0 ± 3.20 | 26.80 ± 2.90 | 30.10 ± 3.10 |
| Жесткость общая, мМ/дм3 | 16.97 ± 1.29 | 5.18 ± 0.43 | 5.10 ± 0.42 | 7.58 ± 0.60 | 6.12 ± 0.50 | 6.01 ± 0.49 | 8.44 ± 0.67 | 6.39 ± 0.52 | 7.20 ± 0.58 | 7.20 ± 0.58 |
Нестабильность степени минерализации воды, ионного состава и других гидрохимических показателей обусловлена тем, что исследования проводили и в течение, и после мероприятий по дноуглублению и расчистке водоема при регулярной подкачке воды из р. Иртыш. Во время строительства обводного канала и реконструкции акватории были вскрыты подстилающие засоленные грунты, что повлекло за собой изменение ряда химических показателей. После окончания реконструкции в водоеме было отмечено снижение содержания кальция, азота нитратного, азота нитритного, азота аммонийного, хлоридов, фосфора общего. По некоторым показателям, ранее достигавшим высоких величин (сульфаты, магний, БПК5, ХПК), также зафиксировано снижение концентраций (Баженова, Игошкина, 2014).
Материал по фитопланктону собирали в водоеме в 2008–2012 гг. С декабря 2009 г. по ноябрь 2012 г. количественные пробы объемом 0.5 л отбирали, как правило, один раз в месяц из поверхностного слоя воды на равномерно расположенных по акватории водоема шести станциях, фиксировали формалином и концентрировали осадочным методом. Для определения видового состава, численности и биомассы фитопланктона материал обрабатывали по общепринятым методикам (Федоров, 1979). Для дополнительных исследований планктона на содержание стоматоцист использовали качественные пробы, отобранные в 2008 и 2009 гг.
После соответствующей подготовки все пробы исследовали в СЭМ. Биомасса фитопланктона в 2009–2012 гг. колебалась в пределах 1.60–5.49 г/м3, в водоеме наблюдалась начальная стадия “цветения”. Согласно комплексной классификации качества поверхностных вод суши (Оксиюк и др., 1993), Птичья гавань соответствует эвтрофной категории вод (Баженова, Игошкина, 2014).
Микрофотографии стоматоцист (312 экз.) сделаны на СЭМ Hitachi S3400N при увеличении в 2.1–21 тыс. раз в Институте водных и экологических проблем СО РАН (г. Барнаул). Перед исследованием проб в СЭМ материал освобождали от органических веществ методом холодного сжигания (Балонов, 1975).
Систематика хризофит приведена в соответствии с AlgaeBase (M. Guiry, G. Guiry, 2018). Cтоматоцисты описаны согласно правилам и терминологии, принятым Международной рабочей группой по исследованию статоспор (стоматоцист) (International Statospore Working Group – ISWG) (Cronberg, Sandgren, 1986; Duff et al., 1995). Группы стоматоцист выделяли по форме и характеру орнаментации, морфотипы внутри каждой группы – с учетом морфологии поры и воротничка.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
В планктоне Птичьей гавани идентифицировано 24 вида хризофит, способных образовывать стоматоцисты, в том числе из класса Chrysophyceae – 19, из класса Synurophyceae – 5. В их составе зарегистрированы представители восьми родов, наибольшим видовым богатством характеризуются роды Kephyrion Pascher (9 видов) и Pseudokephyrion Pasher (5 видов). В родах Mallomonas Perty и Dinobryon Ehrenberg отмечено по три вида, в родах Microglena Ehrenberg, Synura Ehrenberg, Ochromonas Wyssotzky и Chrysococcus Klebs – по одному.
Несмотря на относительно низкое видовое богатство хризофит в фитопланктоне Птичьей гавани (5.8% общего количества идентифицированных видов), они принимают значительное участие в формировании доминирующего комплекса. Более трети (37.5%) видов хризофит, найденных в водоеме, являются доминантами. Среди них особо выделяется Chrysococcus biporus Skuja, лидирующий в фитопланктоне во все сезоны года. Реже в комплекс доминантов входят Kephyrion inconstans (Schmid) Bourrelly и Ochromonas crenata Klebs, хотя также встречаются в пробах круглогодично и формируют высокую численность (Баженова, Игошкина, 2014).
Сезонную динамику обилия стоматоцист в планктоне водоема рассматривали на примере 2012 г., когда были изучены пробы всех сезонов года. Всего в 2012 г. найдено 70 экз. стоматоцист, их максимальное обилие отмечено осенью – 35 экз., весной в пробах найдено 26, летом – 8, зимой всего 1 стоматоциста.
Размеры стоматоцист варьировали в широких пределах – от 1.86 до 21.24 мкм. Средний диаметр достигал 8.40 ± 2.78 мкм. Самая крупная стоматоциста обнаружена в водоеме осенью перед ледоставом (31.10.2012 г.), самая мелкая – весной (16.05.2012 г.) (рис. 1).
Рис. 1.
Стоматоцисты хризофитовых водорослей из Птичьей гавани с максимальным (а) и минимальным (б) размерами.

В составе стоматоцист водоема Птичьей гавани выделено 20 групп морфотипов, включающих 105 морфотипов (табл. 3, рис. 2).
Таблица 3.
Морфологические группы и подгруппы стоматоцист из планктона Птичьей гавани
| Группа и подгруппа | Число морфотипов | |
|---|---|---|
| без воротничка | с воротничком | |
| Неорнаментированные | ||
| Сферические | 7 | 13 |
| Овальные | 5 | 4 |
| Яйцевидные | ‒ | 4 |
| Обратнояйцевидные | 1 | ‒ |
| Сплющенные | 5 | 2 |
| Всего | 18 | 23 |
| Орнаментированные | ||
| Сферические: | ||
| шероховатые | 6 | 7 |
| с шипами | – | 2 |
| бородавчатые | – | 6 |
| с коническими выростами | – | 8 |
| с палочковидными выростами | 1 | 6 |
| с палочковидными и коническими выростами | – | 2 |
| с гребнями | – | 3 |
| поверхность с выемками | 4 | 2 |
| с вариабельным ретикулом | 2 | – |
| с правильным ретикулом | – | 1 |
| со сложной орнаментацией | 1 | 5 |
| Овальные: | ||
| шероховатые | 1 | – |
| поверхность с выемками | 1 | – |
| Яйцевидные шероховатые | – | 4 |
| Неправильной формы шероховатые | 1 | 1 |
| Всего | 17 | 47 |
| Общее число | 105 | |
Рис. 2.
Группы морфотипов стоматоцист из планктона Птичьей гавани: a – сферические гладкие; б – сферические шероховатые; в – сферические с шипами; г – сферические бородавчатые; д – сферические с коническими выростами; е – сферические с палочковидными выростами; ж – сферические с палочковидными и коническими выростам; з – сферические с выемками; и – сферические с вариабельным ретикулом; к – сферические с правильным ретикулом; л – сферические с гребнями; м – сферические со сложной орнаментацией; н – овальные гладкие; о – овальные шероховатые; п – овальные с выемками; р – яйцевидные гладкие; с – яйцевидные шероховатые; т – обратнояйцевидные гладкие; у – сплющенные гладкие; ф – неправильной формы шероховатые.
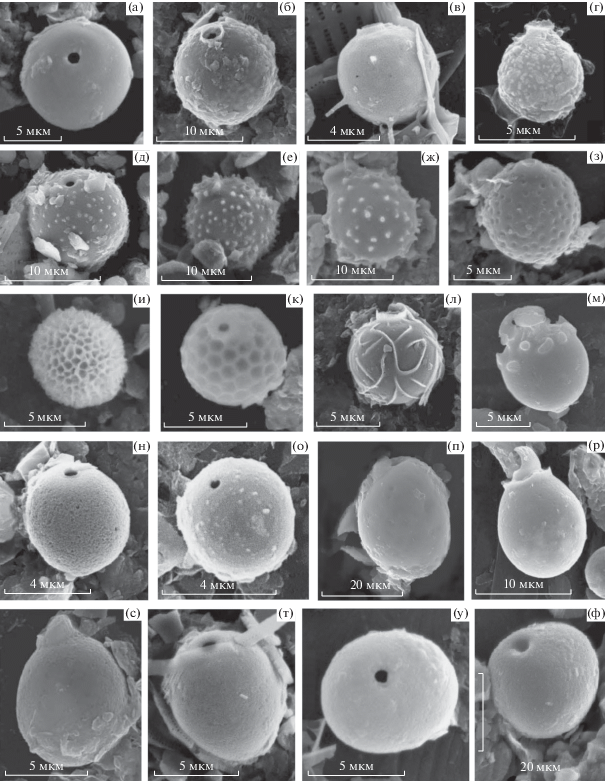
Большинство стоматоцист имели сферическую форму (270 экз. или 86.54% их общего количества). Гораздо реже встречались стоматоцисты с овальной (15 экз.), яйцевидной (12) и сплющенной (11) формами, очень редко – с обратнояйцевидной (3) и неопределенной (1).
Распределение стоматоцист различной формы по сезонам (данные 2012 г.) характеризовалось такой же закономерностью (рис. 3).
Рис. 3.
Встречаемость стоматоцист различной формы в планктоне Птичьей гавани по сезонам 2012 г.: 1 – сферические неорнаментированные; 2 – сферические орнаментированные; 3 – овальные неорнаментированные; 4 – овальные орнаментированные; 5 – яйцевидные неорнаментированные.
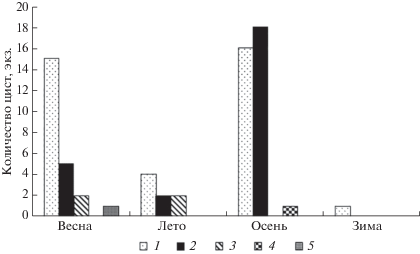
В целом за весь период исследований в планктоне преобладали неорнаментированные стоматоцисты (215 экз. или 68.91%), среди них выделен 41 морфотип. Наиболее высокое разнообразие морфотипов (64) отмечено у орнаментированных стоматоцист, составляющих ~1/3 (97 экз. или 31.09%) их общего количества. В сезонном аспекте характерно возрастание количества орнаментированных стоматоцист от весны к осени (рис. 3). В течение всего периода исследований и во все сезоны года в планктоне Птичьей гавани доминировали стоматоцисты без воротничка – 213 экз. или 68.27% их общего числа.
Только для нескольких стоматоцист, обнаруженных в Птичьей гавани, установлена видовая принадлежность. Поскольку они представляют наибольший интерес, ниже приводим их описание.
Наиболее распространенный морфотип стомацист, найденных во все сезоны года, – неорнаментированные сферические без воротничка (рис. 2а). Диаметр стоматоцист 3.70–10.43 мкм, пора вдавленная, диаметром 0.39–1.04 мкм, без аннулуса. Этот морфотип сходен со стоматоцистами 1, 9, 15 Duff et Smol, 1988 emend. Zeeb et Smol, 1993, стоматоцистой 42 Duff et Smol, 1991 (Duff et al., 1995), и стоматоцистой 103 Firsova et Likhoshway (Фирсова, Лихошвай, 2006), но отличается от них меньшим размером. Согласно литературным данным (Волошко, 2017; Снитько и др., 2018; Фирсова, Лихошвай, 2006; Фирсова и др., 2017, 2018; Duff et al., 1995; Pang, Wang, 2014; Wilkinson et al., 2001), эти стоматоцисты могут продуцироваться несколькими видами хризофит – Paraphysomonas sp., Synura petersenii Korshikov, Chrysosphaerella longispina Lauterborn emend. Nicholls, Ch. brevispina Korschikov emend. Harris et Bradley, Ch. conradii Bourrelly и Chrysolepidomonas dendrolepidota Peters et Andersen, однако, в водоеме во время исследований они не обнаружены.
К группе сферических неорнаментированных принадлежит стоматоциста с воротничком и аннулусом, имеющая большое сходство со стоматоцистой 156 Zeeb et Smol, 1993 (рис. 4а). Стоматоциста с гладкой поверхностью, диаметром 9.04 мкм, правильная пора (диаметр 0.6 мкм) окружена широким плоским аннулусом (диаметр 2.3 мкм) и валикообразным воротничком (ширина 0.74 мкм). Найдена в мае 2009 г. Диаметр стоматоцисты несколько меньше, чем у найденной в оз. Байкал (9.5–11.0 мкм). Согласно данным Фирсовой и др. (2017), эта стоматоциста продуцируется широко распространенным видом Chrysosphaerella coronacircumspina Wjuek et Kristiansen, но в Птичьей гавани он не обнаружен.
Рис. 4.
Стоматоцисты из водоема Птичья гавань: а – стоматоциста 156 Zeeb et Smol, 1993; б – стоматоциста 75 Duff et Smol, 1991.

Из группы сферических шероховатых зарегистрирована стоматоциста 75 Duff et Smol, 1991 (рис. 4б). Стоматоциста с шероховатой поверхностью, диаметром 6.70 мкм, пора (диаметр 0.48 мкм) окружена сложным воротничком шириной 2.43 мкм. Найдена в июле 2009 г. От стоматоцисты 75 Duff et Smol, 1991 отличается меньшим диаметром (Duff et al., 1995). Эти стоматоцисты продуцирует Dinobryon bavaricum Imhof, в Птичьей гавани вид не встречен, но обнаружен в р. Иртыш (Баженова и др., 2019), откуда в водоем происходит регулярная закачка воды.
Стоматоциста на рис. 2л сходна со стоматоцистой 111 (Zeeb et al., 1990) и стоматоцистой 223 Firsova et Likhoshway (Фирсова, Лихошвай, 2006; Фирсова и др., 2017), которую продуцирует широко распространенный вид Spiniferomonas trioralis (Takahashi) Preisig et Hibberd (Волошко, 2017). Стоматоциста сферическая, диаметр 7.6 мкм, поверхность покрыта низкими изогнутыми гребнями, варьирующими по длине и направлению. Воротничок цилиндрический, диаметром 2.5 мкм, высотой 0.8 мкм. Край воротничка зубчатый. Зарегистрирована в октябре 2012 г. Присутствие этих стоматоцист связывают с эвтрофными условиями водоема (Zeeb et al., 1990, 1994).
Стоматоциста на рис. 2р похожа на стоматоцисту 135 Duff et Smol, 1992, продуцируемую различными видами рода Uroglena, с широкой толерантностью к рН среды (Duff et al., 1995). Форма стоматоцист от яйцевидной до овальной, поверхность гладкая, размеры (8.0–9.6) × (10.0–11.7) мкм. Правильная пора (диаметр 0.57 мкм) окружена тремя воротничками. Второй воротничок имеет крючкообразный выступ, нависающий над первым воротничком. Край третьего (внешнего) воротничка обычно волнистый. Обнаружена в мае 2009 и 2012 гг., июле 2008 и 2010 гг.
Стоматоциста на рис. 2т очень сходна со стоматоцистой 196 Duff et Smol, 1994, emend. Wilkinson et Smol. Возможно, продуцируется Chrysoxys major Skuja (Wilkinson et al., 2001). Стоматоциста обратнояйцевидная с гладкой поверхностью, размеры (7.03–9.74) × (8.10–10.7) мкм. Пора мелкая, вдавленная, диаметром 0.51–0.76 мкм. Найдена в июле 2008 г. и мае 2009 г.
Указанные выше виды хризофит не обнаружены в водоеме во время наших исследований.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Наиболее полные исследования разнообразия стоматоцист хризофит проводили, в основном, в глубоководных олиготрофных и мезотрофных озерах. Приведенные в статье сведения относятся к другому типу водных объектов – мелководным эвтрофным водоемам юга Западной Сибири и существенно дополняют ранее опубликованные результаты (Баженова, Шаховал, 2011; Баженова и др., 2012б).
Сведения о сезонном распределении обилия стоматоцист в водоеме Птичья гавань соответствуют закономерностям, выявленным для планктона оз. Байкал, где максимальная численность стоматоцист наблюдалась в летне-осенний период (Святенко и др., 2002) или осенью (Фирсова и др., 2008, 2017). Авторы связывают это явление с минимальной концентрацией биогенов в воде и окончанием жизненного цикла хризофит. Следует отметить, что весной 2012 г. в планктоне Птичьей гавани также наблюдали высокое обилие стоматоцист, хотя и ниже, чем осенью. В это время в водоеме было отмечено минимальное за год содержание общего фосфора и нитратного азота, но повышенное содержание легко окисляемых органических веществ (по БПК5) (табл. 2), а поскольку хризофиты, как и другие флагелляты, способны к поглощению растворенной органики (Корнева, 2009), то, по-видимому, они не испытывали недостатка в питании в это время.
Размеры стоматоцист из планктона Птичьей гавани отличаются более широкими пределами варьирования, чем в других водоемах. Например, диаметр стоматоцист в планктоне оз. Байкал колебался в пределах 3.3–12.8 мкм (Фирсова и др., 2017), в других водных объектах Омского Прииртышья – 2.82–12.58 мкм (Баженова, Шаховал, 2011; Баженова и др., 2012б), в оз. Телецкое – 2.7–12.7 мкм (Баженова и др., 2012б). По данным Снитько и Волошко (2018), в водоемах Южного Урала минимальный диаметр цист составлял 2 мкм, у одной из обнаруженных нами стоматоцист диаметр был 1.86 мкм, диаметр поры – 0.19 мкм (рис. 1б). Известно (Моисеенко, 2011), что к измельчанию клеток водорослей приводит эвтрофирование и длительное токсическое загрязнение тяжелыми металлами водных объектов. Эти процессы характерны в настоящее время для среднего течения р. Иртыш, откуда в Птичью гавань регулярно закачивается вода. Ранее в р. Иртыш зарегистрировано статистически достоверное измельчание домиков эвгленовой водоросли Trachelomonas volvocina (Ehr.) Ehr. до диаметра 5.0 мкм (Гульченко и др., 2016), хотя согласно определителям эвгленовых водорослей (Попова, 1966; Сафонова, 1987) его наименьший диаметр составляет 6.0 мкм. У некоторых из описанных нами стоматоцист с установленной видовой принадлежностью также отмечено уменьшение размеров по сравнению с литературными данными (Duff et al., 1995; Фирсова, Лихошвай, 2006; Фирсова и др., 2017).
Разнообразие морфотипов стоматоцист в водоеме Птичьей гавани значительно превышает количество идентифицированных видов хризофит. Подобное явление характерно как для обследованных водных объектов Омского Прииртышья (Баженова, Шаховал, 2011; Баженова и др., 2012б), так и ряда других водоемов. Например, в высокогорном олиготрофном оз. Санабрия (Lake Sanabria) в Испании выявлено 15 видов хризофит и 27 морфотипов стоматоцист в верхнем слое донных отложений (De Hoyos et al., 1998), в оз. Телецкое – 30 видовых и внутривидовых таксонов (ВВТ) хризофит и 70 морфотипов (Митрофанова, 2012), в планктоне оз. Байкал – до 37 ВВТ хризофит (Воробьева и др., 1992) и 142 морфотипа стоматоцист (Фирсова, Лихошвай, 2006; Фирсова и др., 2017, 2018). По мнению Е.Ю. Митрофановой (2012), с одной стороны, это может свидетельствовать о наличии в водоеме неидентифицированных видов хризофит, с другой – о полиморфизме стоматоцист даже у одного вида. Мы считаем верными оба этих суждения, а высокое разнообразие морфотипов стоматоцист в Птичьей гавани связываем с ярко выраженной нестабильностью гидрохимического режима водоема во время проведения исследований.
Отличительная черта хризофит в планктоне мелководного эвтрофного водоема Птичья гавань – доминирование неорнаментированных сферических стоматоцист без воротничка. В планктоне глубоководных озер Телецкое (Баженова и др., 2012б; Митрофанова, 2012) и Байкал (Фирсова, 2008; Фирсова, Лихошвай, 2006; Фирсова и др., 2008, 2017) преобладают орнаментированные стоматоцисты с различными выростами и шипами. Возможно, это связано с приспособлением к парению в условиях слабоминерализованных глубоководных водоемов. Сходство с нашими данными обнаружено в составе стоматоцист неглубоких водохранилищ Польши (Piątek, 2007) и малых пресноводных водоемов Южного Урала (Снитько и др., 2018).
Видовая принадлежность большинства стоматоцист, найденных в планктоне Птичьей гавани, к настоящему времени не установлена. Только для некоторых из обнаруженных стоматоцист известны виды, которые их продуцируют, но они еще не найдены в водоеме. Это характерно для многих подобных работ, поскольку, как отмечала Волошко (2017), для достоверной видовой идентификации стоматоцист необходимо изучение полных жизненных циклов хризофит в культуре.
Выводы. В планктоне водоема “Птичья гавань” выявлено 105 морфотипов стоматоцист хризофит, объединенных в 20 групп. Разнообразие морфотипов значительно выше видового богатства хризофит, что характерно и для водных объектов Омского Прииртышья и многих других водоемов. Наиболее высокое разнообразие морфотипов (64) зарегистрировано у орнаментированных стоматоцист. В сезонной динамике отмечено возрастание количества орнаментированных стоматоцист от весны к осени. Наибольшее обилие стоматоцист наблюдается осенью, минимальное – зимой. Размеры стоматоцист колеблются от 1.86 до 21.24 мкм (в среднем 8.40 ± 2.78 мкм). Преобладают неорнаментированные стоматоцисты сферической формы без воротничка, что может быть связано с мелководностью, нестабильностью гидрохимического режима и высоким трофическим уровнем водоема. У большинства найденных стоматоцист видовая принадлежность к настоящему времени не установлена. Полученные данные подтверждают общепринятое мнение, что одни и те же виды хризофит в различных условиях среды могут формировать отличающиеся по строению и размерам стоматоцисты.
Список литературы
Баженова О.П., Игошкина И.Ю. 2014. Фитопланктон и экологическое состояние водоема природного парка “Птичья Гавань” (г. Омск). Омск: Изд-во “Вариант-Омск”.
Баженова О.П., Шаховал В.Е. 2011. Первые сведения о цистах хризофитовых водорослей из планктона водных объектов Омского Прииртышья // Водные экосистемы Сибири и перспективы их использования: Матер. Всерос. конф. с междунар. участием. Томск. С. 21.
Баженова О.П., Барсукова Н.Н., Герман Л.В. и др. 2012а. Chrysophyta водоемов и водотоков Омского Прииртышья (Россия) // Альгология. Т. 22. № 3. С. 286. (Bazhenova O.P., Barsukova N.N., German L.V. et al. 2012a. Chrysophyta of Water Bodies of Omsk Priirtyshye (Russia) // Int. J. Algae. V. 14. № 4. P. 315).
Баженова О.П., Митрофанова Е.Ю., Шаховал В.Е. 2012б. Стоматоцисты хризофитовых водорослей из водных объектов Омского Прииртышья и озера Телецкое (Горный Алтай, Россия) // Сиб. экол. журн. № 4. С. 571. (Bazhenova O.P., Mitrofanova E.Yu., Shakhoval V.E. 2012b. Stomatocysts of chrysophyte algae from bodies of water in territory near Irtysh river in Omsk Region and Lake Teletskoe in Gorny Altai, Russia // Contemporary Problems of Ecology. V. 5. № 4. P. 423).
Баженова О.П., Барсукова Н.Н., Игошкина И.Ю. и др. 2019. Фитопланктон Омского Прииртышья. Омск: Изд-во ФГБОУ ВО Омский ГАУ.
Балонов И.М. 1975. Подготовка диатомовых и золотистых водорослей к электронной микроскопии // Методика изучения биогеоценозов внутренних водоемов. Москва: Наука. С. 87.
Волошко Л.Н. 2016. Золотистые водоросли (Chrysophyta) водоемов Севера России. Разнообразие стоматоцист // Ботан. журн. Т. 101. № 11. С. 1257.
Волошко Л.Н. 2017. Золотистые водоросли водоемов Севера России. Санкт-Петербург: Реноме.
Воробьева С.С., Бондаренко Н.А., Карпов С.А. и др. 1992. К изучению видового состава Chrysophyta озера Байкал // Альгология. Т. 2. № 3. С. 68.
Гульченко Я.И., Баженова О.П., Алейникова В.С. 2016. Размерные характеристики Trachelomonas volvocina (Ehrenberg) Ehrenberg из планктона среднего течения реки Иртыш // Вестник Омского государственного аграрного университета. № 3(23). С. 135.
Жукова К.В., Баженова О.П., Игошкина И.Ю. 2017. Стоматоцисты хризофитовых водорослей из планктона водоема природного парка “Птичья гавань” (г. Омск) // Всемирный день охраны окружающей среды (Экологические чтения – 2017): Матер. Междунар. науч.-практ. конф. (3–5 июня 2017 г.) Омск: ЛИТЕРА. С. 120.
Корнева Л.Г. 2009. Формирование фитопланктона водоемов бассейна Волги под влиянием природных и антропогенных факторов: Автореф. дис. … докт. биол. наук. Санкт-Петербург. 48 с.
Митрофанова Е.Ю. 2012. Разнообразие стоматоцист золотистых водорослей в планктоне Телецкого озера // Проблемы ботаники Южной Сибири и Монголии: Матер. XI междунар. науч.-практ. конф. Барнаул: APТИКА. С. 139.
Моисеенко Т.И. 2011. Устойчивость водных экосистем и их изменчивость в условиях токсичного загрязнения // Экология. № 6. С. 441.
Оксиюк О.П., Жукинский В.Н., Брагинский П.Н. и др. 1993. Комплексная экологическая классификация качества поверхностных вод суши // Гидробиол. журн. Т. 29. № 4. С. 62.
Попова Т.Г. 1966. Эвгленовые водоросли // Флора споровых растений СССР. Москва; Ленинград: Наука. Т. 8.
Сафонова Т.А. 1987. Эвгленовые водоросли Западной Сибири. Новосибирск: Наука.
Святенко Г.С., Павлов Б.К., Пешкова Е.В. 2002. Сезонные изменения фитопланктона в Южном Байкале в 1989–1991 гг. // Сиб. экол. журн. № 4. С. 491.
Снитько Л.В., Волошко Л.Н. 2017. Золотистые водоросли (Chrysophyceae, Synurophyceae) в подледном планктоне озер Восточных предгорий Южного Урала // Тез. докл. III Междунар. конф. “Биоиндикация и мониторинг пресноводных экосистем”. Санкт-Петербург. С. 301.
Снитько Л.В., Волошко Л.Н. 2018. О находках стоматоцист золотистых водорослей (Chrysophyceae, Synurophyceae) на Южном Урале // Водоросли: проблемы таксономии, экологии и использование в мониторинге: Сб. матер. докл. IV Всерос. науч. конф. с междунар. участием. Санкт-Петербург: С. 422.
Снитько Л.В., Снитько В.П., Блинов И.А., Волошко Л.Н. 2016. Золотистые водоросли (Chrysophyta) в водоемах восточных предгорий Южного и Среднего Урала // Ботан. журн. Т. 101. № 12. С. 1361.
Снитько Л.В., Снитько В.П., Блинов И.А. 2018. Формирование и морфология стоматоцист золотистых водорослей (Сhrysophyceae, Synurophyceae) в планктоне водоемов Южного Урала // Междунар. журн. прикл. и фундамент. исследований. № 11(1). С. 114. http://applied-research.ru/ru/article/view?id=12460.
Федоров В.Д. 1979. О методах изучения фитопланктона и его активности. Москва: Изд-во МГУ.
Фирсова А.Д. 2008. Разнообразие современных и ископаемых стоматоцист золотистых водорослей некоторых водоемов Азии и их стратиграфическое значение: Автореф. дис. … канд. биол. наук. Москва.
Фирсова А.Д., Лихошвай Е.В. 2006. Атлас цист хризофитовых водорослей озера Байкал. Новосибирск: Наука.
Фирсова А.Д., Кузьмина А.Е., Томберг И.В. и др. 2008. Сезонная динамика формирования стоматоцист хризофитовых водорослей в планктоне Южного Байкала // Изв. РАН. Сер. биол. Т. 5. С. 589.
Фирсова А.Д., Бессудова А.Ю., Лихошвай Е.В. 2017. Новые данные о стоматоцистах хризофитовых из озера Байкал // Acta Biologica Sibirica. V. 3(4). С. 113.
Фирсова А.Д., Бессудова А.Ю., Лихошвай Е.В. 2018. Стоматоцисты хризофитовых в притоках северной оконечности озера Байкал // Acta Biologica Sibirica. V. 4 (4). С. 25.
Шадрина С.Н. 2018. Разнообразие стоматоцист золотистых водорослей восточной части Финского залива // Водоросли: проблемы таксономии, экологии и использование в мониторинге: Сб. матер. докл. IV Всерос. науч. конф. с междунар. участием. Санкт-Петербург: С. 484.
Bazhenova O.P., Igoshkina I.Yu. 2016. Formation of Symbiotic Communities of Ciliates, Algae and Cyanobacteria in a Waterbody of the Ptich’ya Gavan Nature Park (Omsk) // Inland Wat. Biol. V. 9(3). P. 268. https://doi.org/10.1134/S1995082916030032
Cronberg G., Sandgren C.D. 1986. A proposal for the development of standardized nomenclature and terminology for chrysophycean statospores // Chrysophytes: Aspects and Problems. Cambridge: Cambridge University Press. P. 317.
De Hoyos C., Aldasoro J.J., Toro M. et al. 1998. Specific composition and ecology of chrysophyte flagellates in Lake Sanabria (NW Spain) // Hydrobiologia. V. 369/370. P. 287.
Duff K.E., Zeeb B.A., Smol J.P. 1995. Atlas of Chrysophycean cysts // Dev. Hydrobiol. 99. Dordrecht: Kluwer Academic Publishers.
Edlund M.B., Stroemer E.F., Pilskaln C.H. 1995. Siliceous microfossil succession in the recent history of two basins in Lake Baikal, Siberia // J. Paleolimnol. V. 14. P. 165.
Guiry M.D., Guiry G.M. AlgaeBase. 2018. World-wide electronic publication, National University of Ireland, Galway. http://www.algaebase.org (дата обращения 10.02.2018).
Kristiansen J. 1986. Silica-scale bearing chrysophytes as environmental indicators // Brit. Phycol. V. 21. P. 435–436.
Lotter A.F., Birks H.J.B., Hofmann W. et al. 1997. Modern diatom, cladocera, chironomid, and chrysophyte stomatocyst assemblages as quantitative indicators for the reconstruction of past environmental conditions in the Alps. I. Climate // J. Paleolimnol. V. 18. P. 395.
Nicholls K.H. 1995. Chrysophyte blooms in the plankton and neuston of marine and freshwater systems // Chrysophyte algae. Distribution, phylogeny and development. N.Y.: Cambridge University Press. P. 181.
Pang W., Wang Q. 2014. Chrysophycean stomatocysts from the Aershan Geological Park (Innern Mongolia), China // Phytotaxa. V. 187(1). P. 1.
Paterson A.M., Betts-Piper A.A., Smol J.P. et al. 2003. Diatom and Chrysophyte algal response to long-term PCB contamination from a point-sourse in Northern Labrador, Canada // Water, Air and Soil Pollution. V. 145. P. 377.
Piątek J. 2007. Chrysophyte stomatocysts from sediments in a man-made water reservoir in central Poland // Ann. Bot. Fennici. V. 44. P. 186.
Rull V., Vegas-Vilarrubia T. 2000. Chrysophycean stomatocysts in Caribbean mangrove // Hydrobiologia. V. 428. P. 145.
Siver P.A. 2003. The Synurophyceae // Freshwater algae of North America. N.Y. P. 523.
Smol J.P. 1995. Applicatoin of chrysophytes to problems in paleolimnology // Chrysophyte algae. Distributon, phylogeny and development. New York: Cambridge University Press. P. 232.
Vorobyova S.S., Pomazkina G.V., Baranova E.Yu. et al. 1996. Chrysophycean cysts (stomatocysts) from Lake Baikal and Irkutsk Reservion, Siberia // J. Paleolimnol. V. 15. P. 271.
Watson S.B., Satchwill T., McCauley E. 2001. Drinking water taste and odour: a chrysophyte perspective // Nova Hedwigia, Beiheft. V. 122. P. 119.
Wilkinson A.N., Smol J.P. 1998. Chrysophycean stomatocyst flora from south-central Ontario lakes // Can. J. Bot. V. 76. P. 836.
Wilkinson A.N., Roland I.H., Smol J.P. 1999. Chrysophyte stomatocysts as paleolimnological indicators of environmental change due to cottage development and acidic deposition in the Muskoka-Halburton region, Ontario, Canada // J. Paleolimnol. V. 22. P. 17.
Wilkinson A.N., Zeeb B.A., Smol J.P. 2001. Atlas of Chrysophycean cysts. V. II. Dordrecht: Kluver Academic Publishers.
Zeeb B.A., Duff K.E., Smol J.P. 1990. Morphological descriptions and stratigraphic profiles of chrysophycean stomatocysts from the recent sediments of Little Round Lake, Ontario // Nova Hedwigia, Beiheft. V. 51. P. 361.
Zeeb B.A., Christie C.E., Smol J.P. et al. 1994. Responses of diatom and chrysophyte assemblages in Lake 227 to experimental eutrophication // Can. J. Fish. Aquat. Sci. V. 51. P. 2300.
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод


