Биология внутренних вод, 2020, № 5, стр. 503-512
Изменения в составе липидов жабр пресноводной мидии Anodonta cygnea под действием меди различных концентраций
Н. Н. Фокина a, *, И. В. Суховская a, О. Б. Васильева a, Н. Н. Немова a
a Институт биологии Карельского научного центра Российской академии наук
Петрозаводск, Россия
* E-mail: fokinann@gmail.com
Поступила в редакцию 19.09.2019
После доработки 30.10.2019
Принята к публикации 10.12.2019
Аннотация
Изучены изменения состава запасных и мембранных липидов в жабрах пресноводных моллюсков Anodonta cygnea L., 1758 в ответ на действие меди в различных концентрациях (5, 50, 100 и 250 мкг/л). Модификации на уровне фосфолипидов и их жирных кислот зависели от продолжительности воздействия меди: на 1-е сут отмечено повышение ненасыщенности жирных кислот фосфолипидов, а на 3-и сут – снижение. К концу эксперимента (на 7-е сут) изменения в жабрах моллюсков на уровне состава липидов определялись концентрацией меди: сравнительно невысокие концентрации (5 и 50 мкг/л) вызывали снижение ненасыщенности жирных кислот в составе фосфолипидов, концентрация меди 250 мкг/л, напротив, способствовала ее повышению. Показано, что перестройка структурной организации мембранных липидов и их жирных кислот у A. cygnea в условиях воздействия меди в различных концентрациях осуществляется посредством использования внутренних резервов (триацилглицеринов) и дополнительного синтеза ненасыщенных жирных кислот.
ВВЕДЕНИЕ
Ионы металлов встречаются в природе повсеместно. По типу взаимодействия с различными лигандами, а именно по кислотности Льюиса, выделяют три класса металлов: металлы класса А (например, Na+, K+, Ca2+, Mg2+), преимущественно формирующие ионные взаимодействия с лигандами, ионы пограничного (borderline) класса (в частности, Mn2+, Zn2+, Ni2+, Cu2+) и класса Б (например, Cd2+ и Hg2+), образующие прочные ковалентные связи и вызывающие значительные повреждения в структуре макромолекул и мембран (Duffus, 2002). При этом среди пограничного класса встречаются металлы, необходимые для жизнедеятельности организма. Один из таких эссенциальных металлов – медь – служит ко-фактором для различных ферментов и входит в состав гемоцианина (Company et al., 2008; Momcilovic, 2004; Nath, 1997). Показано, что недостаток и избыток меди в организме вызывает метаболические изменения, в том числе на уровне липидов (Burkhead, Lutsenko, 2013; Chan, Wang, 2018). Известно, что ионы меди, как и ионы железа, катализируют реакции по типу Фентона и Габера–Вейса, вызывая тем самым развитие окислительного стресса (Company et al., 2008; Viarengo, 1989). ПНЖК в составе фосфолипидов мембран являются основной мишенью для действия активных форм кислорода и свободных радикалов, что в конечном итоге приводит к перекисному окислению липидов и нарушению проницаемости клеточных мембран для ионов (Abele et al., 2011; Lesser, 2006). Высокоэнергетические липиды (главным образом, триацилглицерины) могут использоваться для получения энергии и для восстановления мембранных фосфолипидов, поврежденных оксидативными процессами (Chan, Wang, 2018). При этом некоторые ПНЖК (в частности, эйкозапентаеновая и арахидоновая кислоты) в составе фосфолипидов служат предшественниками гормоноподобных соединений – эйкозаноидов, которые модулируют воспалительные процессы, индуцированные окислительным стрессом (Harizi et al., 2008). Двустворчатые моллюски широко используются в качестве объектов исследования при изучении механизмов адаптаций на различных уровнях биологической организации к действию факторов среды обитания, в том числе к воздействию меди (Chan, Wang, 2018; Company et al., 2008; Nugroho, Frank, 2011; Rajalakshmi, Mohandas, 2005). Моллюски способны накапливать высокие концентрации органических и неорганических загрязняющих веществ (ксенобиотиков), которые вызывают у них изменения ряда биохимических показателей и указывают на метаболические перестройки, направленные на компенсацию воздействия чужеродных веществ.
Цель работы – исследовать состав запасных (триацилглицеринов) и мембранных (фосфолипидов и их жирных кислот) липидов у пресноводного моллюска Anodonta cygnea L., 1758 под действием меди в различных концентрациях.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Сбор моллюсков и постановка эксперимента. Взрослых пресноводных особей A. cygnea собирали в р. Суна (Кондопожский р-н, Республика Карелия) и сортировали по размеру раковины. Для эксперимента было отобрано 160 особей с длиной раковины 72.1 ± 6.4 мм (64.2–83.1 мм). Предварительно моллюсков акклимировали к лабораторным условиям в течение семи суток в аквариумах с температурой воды (19.0–20.0°С), pH (6.9–7.2), фотопериодом 12/12 и постоянной аэрацией воды. Ежедневно проводили частичную смену воды в аквариумах и контролировали гидрохимические показатели воды, которые в течение всего эксперимента были относительно стабильны (Table S1). После акклимации моллюсков разделили на пять групп (по 30 экз. в каждой): контрольную группу содержали в воде без добавления металла, четыре экспериментальные группы – с добавлением 5, 50, 100 и 250 мкг/л меди (эксперимент проводили в двух повторах для каждого воздействия). Необходимую концентрацию меди получали добавлением рассчитанного количества стокового раствора (500 мг/л) хлорида меди(II) двухводного. Схожие концентрации меди использованы в многочисленных исследованиях (Chan, Wang, 2018; Company et al., 2008; Kowalczyk-Pecka et al., 2017, 2018; Maazouzi et al., 2008; Nugroho, Frank, 2011; Rajalakshmi, Mohandas, 2005), что позволяет сравнить их с нашими результатами. Более того, показано, что концентрация меди в незагрязненных пресноводных водоемах колеблется от 1 до 20 мкг/л (Momcilovic, 2004), в загрязненных районах уровень меди в воде может достигать 1700 мкг/л (Smolders et al., 2003).
После 1, 3 и 7-х сут. эксперимента жабры A. cygnea (n = 7 из каждой экспериментальной группы) фиксировали в 97%-ном этиловом спирте и хранили не более двух недель при 4°С до проведения биохимического анализа.
Анализ содержания металлов в тканях моллюсков. Для определения содержания меди в тканях моллюсков жабры замораживали при –80°С, после лиофильной сушки (“Labconco FreeZone”, США) их анализировали на масс-спектрометре XSeries-2 ICP-MS (“Thermo Fisher Scientific”, США).
Определение состава липидов в тканях моллюсков. Анализ состава липидов в жабрах A. cygnea проводили на оборудовании Центра коллективного пользования Федерального исследовательского центра “Карельский научный центр” (г. Петрозаводск). Липиды экстрагировали по методу Фолча (Folch et al., 1957) и разделяли на основные классы (фосфолипиды, триацилглицерины, стерины и их эфиры) на тонкослойных пластинах (TLC Silica gel 60 F254 plates, “Merck”, Германия). Количественное содержание липидов основных классов определяли методами, описанными в работах Сидорова и др. (1972) и Энгельбрехта и др. (Engelbrecht et al., 1974). Фракционный состав фосфолипидов анализировали методом высокоэффективной жидкостной хроматографии на приборе “Маэстро” с детектором на диодной матрице (“Interlab”, Россия) по методу Ардуини (Arduini et al., 1996) на колонке “Roc Silica” 250 мм – 4.6 мм (“Restek”, “Restek Corporation”, США). Метиловые эфиры жирных кислот, полученные из фракции фосфолипидов, разделяли на газовом хроматографе “Agilent” (“Agilent Technologies”, США) с пламенно-ионизационным детектором на колонке “DB-23” (60 м – 0.25 мм) (“Agilent Technologies”, США).
ИН и ИТ жирных кислот рассчитывали по формулам:
Статистическая обработка данных. Проверку исходных данных на нормальность распределения осуществляли методом Колмогорова–Смирнова. Поскольку распределение большинства исследуемых показателей не отличалось от нормального, статистическую обработку данных проводили методом однофакторного дисперсионного анализа и методом Тьюки post-hoc. Различия считали достоверными при p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Содержание меди в целом организме и жабрах A. cygnea из данного района исследования варьирует от 6.8 до 14.2 мкг/г сухой массы и от 6.3 до 7.9 мкг/г сухой массы соответственно.
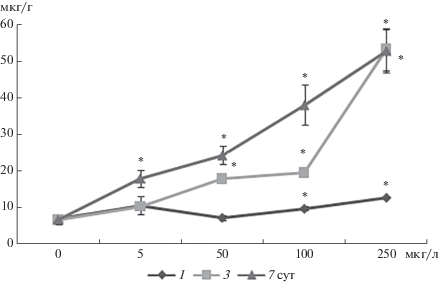
Данные по содержанию меди в жабрах моллюсков в ходе эксперимента свидетельствуют о накоплении металла в тканях A. cygnea уже с 1-х сут воздействия, главным образом, при влиянии 100 и 250 мкг/л меди (рис. 1). На 3-и сут отмечали значительное увеличениесодержания меди в жабрах A. cygnea, особенно при концентрации 50, 100 и 250 мкг/л меди, на 7-е сут экспериментального воздействия значительное повышение содержания меди в жабрах регистрировали при влиянии всех исследуемых концентраций меди.
Рис. 1.
Накопление меди в жабрах Anodonta cygnea. 1, 3 и 7 – продолжительность эксперимента, сут. По оси ординат – содержание меди (мкг/г ткани) в жабрах моллюсков, по оси абсцисс – концентрация меди (мкг/л), добавленная в воду аквариума. * – достоверные различия с контролем (0 мкг/л).
В 1-е сут воздействия максимальной концентрации меди (250 мкг/л) снижался уровень фосфолипидов (главным образом, ФХ и ФС), при действии 100 мкг/л меди повышался уровень стеринов (рис. 2, 3). При влиянии 50, 100 и 250 мкг/л меди в жирно-кислотном спектре фосфолипидов снижался уровень НЖК (преимущественно пальмитиновой кислоты, 16:0) и увеличивался уровень линолевой (18:2n-6), альфа-линоленовой (18:3n-3), эйкозапентаеновой (20:5n-3) и докозагексаеновой (22:6n-3) кислот, также росли ИН и ИТ жирных кислот (рис. 4–6, табл. S1). При действии всех исследуемых концентраций меди в жабрах моллюсков отмечено повышение уровня арахидоновой (20:4n-6) и гадолеиновой (20:1n-11) кислот (за исключением влияния 250 мкг/л меди), а также снижение соотношения n-3/n-6 полиненасыщенных жирных кислот. При этом в ответ на действие 50 и 100 мкг/л меди обнаружено уменьшение соотношений 20:0/20:1n-11 и 18:0/18:1n-9 (рис. 4–6, табл. S2).
Рис. 2.
Содержание триацилглицеринов (а) и стеринов (б) в жабрах Anodonta cygnea. По оси ординат – содержание триацилглицеринов и стеринов (% сухой массы общих липидов), по оси абсцисс – концентрация меди (мкг/л), ниже (1, 3, 7) – продолжительность эксперимента, сут. * – достоверные различия с контролем (0 мкг/л) (однофакторный дисперсионный анализ); a-aa b-bb – одинаковые символы у достоверных различий при сравнении концентраций меди между собой (post hoc тест Тьюки).
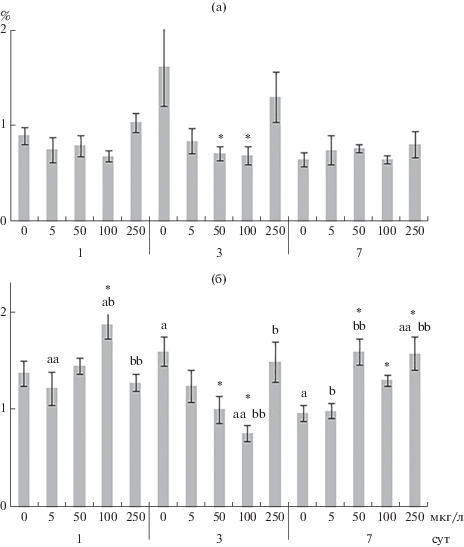
Рис. 3.
Содержание фосфатидилхолина (а), фосфатидилэтаноламина (б), фосфатидилсерина (в) и фосфатидилинозитола (г) в жабрах Anodonta cygnea. По оси ординат – содержание фосфолипидов (% сухой массы общих фосфолипидов), по оси абсцисс – концентрация меди (мкг/л). Остальные обозначения, как на рис. 2.
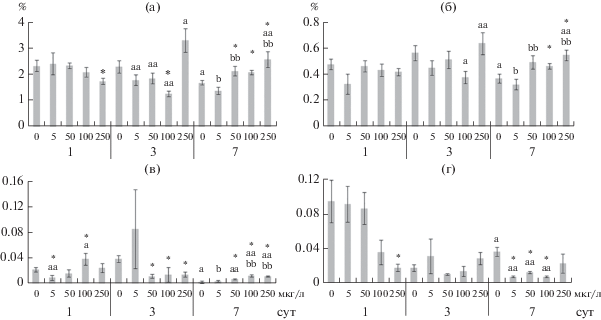
Рис. 4.
Содержание альфа-линоленовой 18:3n-3 (а), эйкозапентаеновой 20:5n-3 (б) и докозагексаеновой 22:6n-3 (в) кислот в фосфолипидах жабр Anodonta cygnea. По оси ординат – содержание жирных кислот (% суммы жирных кислот), по оси абсцисс – концентрация меди (мкг/л). Остальные обозначения, как на рис. 2.
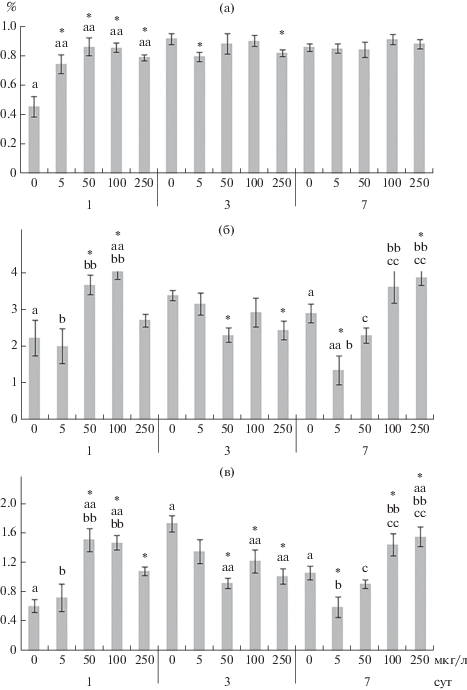
Рис. 5.
Содержание линолевой (18:2n-6, а) и арахидоновой (20:4n-6, б) кислот в фосфолипидах жабр Anodonta cygnea. По оси ординат – содержание жирных кислот (% суммы жирных кислот), по оси абсцисс – концентрация меди (мкг/л). Остальные обозначения, как на рис. 2.
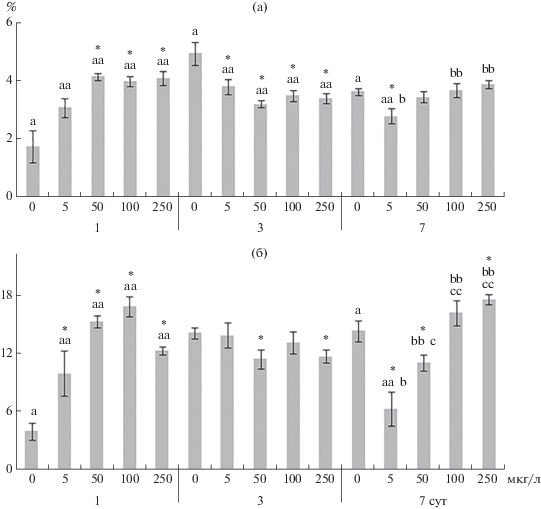
Рис. 6.
Индекс ненасыщенности (а) и индекс текучести (б) жирных кислот фосфолипидов жабр Anodonta cygnea. По оси ординат – индекс ненасыщенности и индекс текучести, по оси абсцисс – концентрация меди (мкг/л). Остальные обозначения, как на рис. 2.
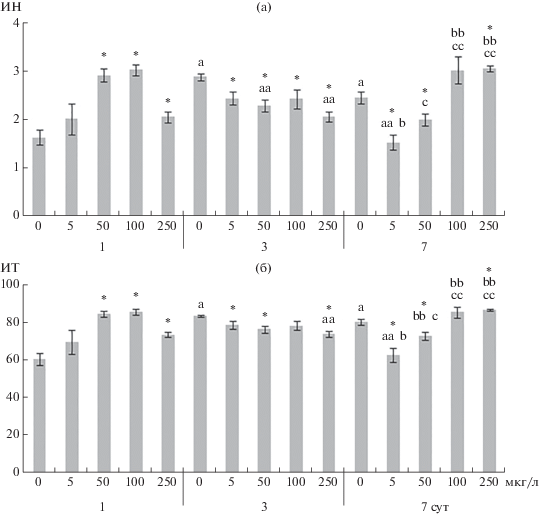
На 3-и сут влияния 50 и 100 мкг/л меди в жабрах A. cygnea снижались уровни общих липидов и всех основных фракций: фосфолипидов (ФХ и ФС), триацилглицеринов, стеринов и их эфиров (рис. 2–3, табл. S3). При влиянии всех исследуемых концентраций меди в жирно-кислотном спектре фосфолипидов повышался уровень НЖК (главным образом, 16:0) и снижались ИН и ИТ за счет уменьшения уровня большинства ненасыщенных жирных кислот: 16:1n-7, 18:1n-9, 18:2n-6, 18:3n-3, 18:3n-6, 20:4n-6, 20:5n-3 и 22:6n-3. При этом отмечено повышение соотношений 16:0/16:1n-7 и 18:0/18:1n-9 (рис. 4–6, табл. S3).
К концу эксперимента (на 7-е сут) при влиянии 50, 100 и 250 мкг/л меди повышалось содержание общих липидов, главным образом, фосфолипидов (ФС, ФХ и ФЭА) и стеринов (рис. 4–6, табл. S4). Кроме того, отмечено снижение содержания фосфатидилинозитола. Изменения в жирно-кислотном составе фосфолипидов определялись концентрацией меди. При влиянии 5 и 50 мкг/л меди повышался уровень НЖК (16:0 и 18:0) и снижалась ненасыщенность жирных кислот (в частности, снижение уровня 20:4n-6, 20:5n-3 и 22:6n-3 кислот, ИН и ИТ). Под действием высоких концентраций меди (преимущественно 250 мкг/л) наблюдались противоположные изменения в составе жирных кислот фосфолипидов: снижение уровня НЖК и повышение ненасыщенности жирных кислот (рис. 4–6, табл. S3).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Для проведения эксперимента моллюска A. cygnea собирали в русле реки, удаленном от источников промышленного загрязнения. Содержание меди в целом организме и жабрах A. cygnea из этого района было значительно ниже, чем у моллюсков, собранных в районах медных рудников и других источников загрязнения (44 мкг/г сухой массы и 127 мкг/г сухой массы соответственно) (Zorita et al., 2006).
Известно, что местом первичного поглощения и накопления меди у пресноводных моллюсков служат жабры, мантия и гепатопанкреас. В первую очередь содержание меди повышается в жабрах, где аккумулируется ~70% поступившей извне меди (Nugroho, Frank, 2011). В ходе эксперимента по изучению влияния меди в различных концентрациях на A. cygnea содержание меди в жабрах повышалось на протяжении всего эксперимента. Воздействие высоких концентраций меди в воде (100 и 250 мкг/л) способствовало увеличению концентрации меди в тканях моллюсков уже с 1-х сут эксперимента. Известно, что накопление меди в организме провоцирует развитие патологических процессов, в том числе окислительного стресса, который вызывает повреждения в структуре липидов, белков и ДНК (Company et al., 2008); нарушения гомеостаза Ca2+ вследствие ингибирования Ca2+-АТФазы (Santini et al., 2011); нейротоксического эффекта, посредством взаимодействия с ацетилхолинэстеразой (Najimi et al., 1997); снижения стабильности лизосомальных мембран (Viarengo, 1989; Rajalakshmi, Mohandas, 2005). Предполагается, что метаболизм липидов тесно связан с содержанием меди в организме (Chan, Wang, 2018). Как недостаток, так и ее избыток приводят к изменениям в метаболизме стеринов и жирных кислот, активности фосфолипазы А2 и пр. (Burkhead, Lutsenko, 2013). Хорошо известна окислительная активность меди, способствующая генерации активных форм кислорода – реакции Фентона и Габера–Вейса (Viarengo, 1989), которые при взаимодействии с липидами мембран повреждают их структуру и функции, вызывая тем самым развитие окислительного стресса (Company et al., 2008). Поскольку основной мишенью для окислительных процессов служат полиненасыщенные жирные кислоты в составе фосфолипидов мембран, снижение ненасыщенности жирных кислот в условиях воздействия ксенобиотиков, в первую очередь, связывают с активацией перекисного окисления липидов (Chan, Wang, 2018). Однако в нашем исследовании при изучении влияния меди на A. cygnea выявлено повышение уровня ненасыщенности жирных кислот преимущественно на 1-е сут воздействия. Установлено увеличение содержания n-6 (18:2 и 20:4) и n-3 (18:3, 20:5 и 22:6) ПНЖК в составе фосфолипидов жабр (соотношение ПНЖК сдвинуто в сторону превалирования доли n-6 ПНЖК). Известно, что линолевая 18:2n-6 и альфа-линоленовая 18:3n-3 кислоты являются эссенциальными жирными кислотами для большинства животных (Kelly, Scheibling, 2012; Napolitano, 1999). У пресноводных рыб и беспозвоночных в условиях недостаточного поступления с пищей длинноцепочечных ПНЖК (в том числе, арахидоновой 20:4n-6, эйкозапентаеновой 20:5n-3 и докозагексаеновой 22:6n-3 кислот) возможен их дополнительный синтез (Harizi et al., 2008; Napolitano, 1999; Turchini, Francis, 2009). Кроме того, в жабрах A. cygnea под действием меди выявлено снижение соотношений 20:0/20:1n-11 и 18:0/18:1n-9, которые косвенно указывают на активацию ферментов, ответственных за синтез ненасыщенных жирных кислот, а именно: дельта 9 (∆9) десатураз (Turchini, Francis, 2009; Vance, Vance, 2002) в условиях воздействия ионов меди. Ненасыщенные жирные кислоты выполняют защитную роль в составе фосфолипидов мембран (Lesser, 2006; Abele et al., 2011), поэтому усиление их дополнительного синтеза у моллюсков в условиях медь-индуцированных окислительных процессов, вероятно, обеспечивает целостность и проницаемость мембран. Подобные изменения на уровне ПНЖК также отмечены при изучении воздействия меди на амфиподу Dikerogammarus villosus (Sowinsky, 1894) и брюхоногого моллюска Helix pomatia (L., 1758) (Kowalczyk-Pecka et al., 2017, 2018; Maazouzi et al., 2008).
На 3-и сут эксперимента мы отмечали противоположные изменения в жирно-кислотном составе фосфолипидов: повышение насыщенности и снижение ненасыщенности жирных кислот. Повышение соотношений 16:0/16:1n-7 и 18:0/18:1n-9 косвенно указывает на ингибирование процессов синтеза ненасыщенных жирных кислот с участием ∆9 десатураз (Turchini, Francis, 2009; Vance, Vance, 2002). В жабрах происходило снижение содержания общих липидов и их основных фракций (фосфолипидов, ТАГ, стеринов и их эфиров), что свидетельствует о прогрессировании перекисного окисления липидов в условиях воздействия меди на моллюсков. Уменьшение содержания ТАГ также указывает на их гидролиз для получения энергии и/или, вероятно, их мобилизации для восстановления фосфолипидов, поврежденных окислительными процессами, которые протекают в жабрах моллюсков под действием меди (Chan, Wang, 2018).
Повышение содержания общих липидов, главным образом, мембранных фракций (стеринов и фосфолипидов – ФХ, ФЭА и ФС) на 7-е сут эксперимента связано, вероятно, с интенсивным образованием везикул (металл-обогащенных гранул и аутофагосом), участвующих в компартментализации металлов и их детоксикации у моллюсков (Wang et al., 2011). Известно, что медь выводится (но не полностью) из организма моллюска в течение 10 сут (Nugroho, Frank, 2011). По-видимому, активный синтез мембранных липидов обеспечивает процессы детоксикации меди у моллюсков. Подобный эффект (повышение уровня холестерина – основного стерина в составе мембран двустворчатых моллюсков) выявлен нами у морского моллюска Mytilus edulis L. в ответ на действие меди (Fokina et al., 2013). Кроме того, у пресноводной A. cygnea к концу эксперимента мы отмечали дозо-зависимый эффект меди на жирно-кислотный состав фосфолипидов. Сравнительно небольшие концентрации меди (5 и 50 мкг/л) вызывали повышение уровня НЖК и соответственно снижение ненасыщенности ЖК за счет эссенциальных (18:2n-6 и 18:3n-6) и длинноцепочечных ПНЖК (20:4n-6, 20:5n-3 и 22:6n-3). Напротив, повышенные концентрации меди (главным образом, 250 мкг/л) способствовали увеличению ненасыщенности фосфолипидов. Возможно, снижение ненасыщенных ЖК происходит не только под действием оксидативных процессов, индуцированных свободными радикалами, но и в результате их ферментативного окисления при синтезе физиологически активных соединений (Harizi et al., 2008). Воспалительный процесс – это защитная реакция организма, направленная на удаление опасного компонента и сохранение внутриклеточного гомеостаза. ПНЖК, а именно арахидоновая 20:4n-6 и эйкозапентаеновая 20:5n-3 кислоты, являются предшественниками для синтеза эндогенных регуляторов воспалительного процесса – эйкозаноидов (Harizi et al., 2008; D. Vance, J. Vance, 2002). По-видимому, к концу эксперимента (на 7-е сут) мы отмечали компенсаторные изменения на уровне состава липидов, обусловленные, главным образом, их защитной функцией: участием в компартментализации ксенобиотиков и регуляцией воспалительного процесса.
Выводы. Исследование ответной реакции на уровне состава липидов жабр пресноводного моллюска A. cygnea при действии меди в различных концентрациях выявило модификации мембранных липидов (фосфолипидов и жирных кислот), отражающие медь-индуцированные оксидативные повреждения структуры и функции мембран, а также участие данных липидов в защитных реакциях организма на действие ксенобиотиков (компартментализации и регуляции воспалительного процесса). Перестройка структурной организации мембранных липидов и их жирных кислот у A. cygnea в условиях воздействия меди осуществляется посредством использования внутренних резервов (триацилглицеринов) и дополнительного синтеза ненасыщенных жирных кислот (в частности, с участием ферментов десатураз). Модификации на уровне мембранных липидов определяются продолжительностью воздействия меди и ее концентрацией. Изменения на уровне ненасыщенных жирных кислот указывают на важную защитную функцию ПНЖК в условиях накопления металла в тканях моллюска. Выявленные изменения на уровне липидного состава жабр A. cygnea затронули основные классы липидов (фосфолипиды, триацилглицерины и стерины) и доминирующие насыщенные и ненасыщенные жирные кислоты. Модификации состава запасных и мембранных липидов свидетельствуют о развитии компенсаторных метаболических перестроек, направленных на поддержание оптимального физиологического состояния моллюсков при накоплении ксенобиотиков в их тканях.
Список литературы
Сидоров В.С., Лизенко Е.И., Болгова О.М., Нефедова З.А. 1972. Липиды рыб. 1. Методы анализа // Лососевые (Salmonidae) Карелии. Вып. 1. Экология. Паразитофауна. Биохимия. Петрозаводск: КФАН СССР. С. 150.
Abele D., Vazquez-Medina J.P., Zenteno-Savin T. 2011. Oxidative stress in aquatic ecosystems. London: John Wiley & Sons.
Arduini A., Peschechera A., Dottori S. et al. 1996. High performance liquid chromatography of long-chain acylcarnitine and phospholipids in fatty acid turnover studies // J. Lipid Res. V. 37(3). P. 684.
Burkhead J.L., Lutsenko S. 2013. The role of copper as a modifier of lipid metabolism // Lipid metabolism. Croatia: IntechOpen.
Chan C.Y., Wang W.X. 2018. A lipidomic approach to understand copper resilience in oyster Crassostrea hongkongensis // Aquat. Toxicol. V. 204. P. 160. https://doi.org/10.1016/j.aquatox.2018.09.011
Company R., Serafim A., Cosson R.P. et al. 2008. Antioxidant biochemical responses to long-term copper exposure in Bathymodiolus azoricus from Menez-Gwen hydrothermal vent // Sci. Total Environ. V. 389(2–3). P. 407. https://doi.org/10.1016/j.scitotenv.2007.08.056
Duffus J.H. 2002. “Heavy metals” a meaningless term? (IUPAC Technical Report) // Pure and Applied Chemistry. V. 74(5). P. 793. https://doi.org/10.1351/pac200274050793
Engelbrecht F.M., Mari F., Anderson J.T. 1974. Cholesterol determination in serum: a rapid direction method // S. Afr. Med. J. V. 48(7). P. 250.
Fokina N.N., Ruokolainen T.R., Nemova N.N., Bakhmet I.N. 2013. Changes of blue mussels Mytilus edulis L. lipid composition under cadmium and copper toxic effect // Biol. Trace Elem. Res. V. 154(2). P. 217. https://doi.org/10.1007/s12011-013-9727-3
Folch J., Lees M., Sloane Stanley G.H. 1957. A simple method for the isolation and purification of total lipides from animal tissues // J. Biol. Chem. V. 226(1). P. 497.
Harizi H., Corcuff J.B., Gualde N. 2008. Arachidonic-acid-derived eicosanoids: roles in biology and immunopathology // Trends Mol. Med. V. 14. № 10. P. 461. https://doi.org/10.1016/j.molmed.2008.08.005
Kelly J.R., Scheibling R.E. 2012. Fatty acids as dietary tracers in benthic food webs // Mar. Ecol.: Prog. Ser. V. 446. P. 1. https://doi.org/10.3354/meps09559
Kowalczyk-Pecka D., Kowalczuk-Vasilev E., Pecka S. 2017. The effect of heterogeneous copper micro-supplementation on fatty acid profiles in the tissues of snails Helix pomatia (Gastropoda Pulmonata) // Ecol. Indic. V. 76. P. 335. https://doi.org/10.1016/j.ecolind.2017.01.031
Kowalczyk-Pecka D., Kowalczuk-Vasilev E., Puchalski A., Klebaniuk R. 2018. Peroxidation and unsaturation indices as potential biomarkers of multifarious zinc and copper micro-supplementation in Helix pomatia L. // Ecotoxic. Environ. Saf. V. 148. P. 713. https://doi.org/10.1016/j.ecoenv.2017.11.051
Lesser M.P. 2006. Oxidative stress in marine environments: biochemistry and physiological ecology // Annu. Rev. Physiol. V. 68. P. 253. https://doi.org/10.1146/annurev.physiol.68.040104.110001
Maazouzi C., Masson G., Izquierdo M. S., Pihan J.C. 2008. Chronic copper exposure and fatty acid composition of the amphipod Dikerogammarus villosus: results from a field study // Environ. Pollut. V. 156(1). P. 221. https://doi.org/10.1016/j.envpol.2007.12.010
Momcilovic B. 2004. Copper // Elements and their Compounds in the Environment. Weinheim: Wiley-VHC. P. 731.
Najimi S., Bouhaimi A., Daubeze M. et al. 1997. Use of acetylcholinesterase in Perna perna and Mytilus galloprovincialis as a biomarker of pollution in Agadir Marine Bay (South of Morocco) // Bull. Environ. Contam. Toxicol. V. 58(6). P. 901. https://doi.org/10.1007/s001289900419
Napolitano G.E. 1999. Fatty acids as trophic and chemical markers in freshwater ecosystems // Lipids in freshwater ecosystems. New York: Springer. P. 21. https://doi.org/10.1007/978-1-4612-0547-0_3
Nath R. 1997. Copper deficiency and heart disease: molecular basis, recent advances and current concepts // The Internat. J. Biochem. Cell Biol. V. 29. № 11. P. 1245. https://doi.org/10.1016/S1357-2725(97)00060-5
Nugroho A.P., Frank H. 2011. Uptake, distribution, and bioaccumulation of copper in the freshwater mussel Anodonta anatina // Toxicol. Environ. Chem. V. 93. № 9. P. 1838. https://doi.org/10.1080/02772248.2011.582989
Rajalakshmi S., Mohandas A. 2005. Copper-induced changes in tissue enzyme activity in a freshwater mussel // Ecotoxicol. Environ. Saf. V. 62. № 1. P. 140. https://doi.org/10.1016/j.ecoenv.2005.01.003
Santini O., Chahbane N., Vasseur P., Frank H. 2011. Effects of low-level copper exposure on Ca2+-ATPase and carbonic anhydrase in the freshwater bivalve Anodonta anatina // Toxicol. Environ. Chem. V. 93(9). P. 1826. https://doi.org/10.1080/02772240903217598
Smolders A.J.P., Lock R.A.C., Van der Velde G. et al. 2003. Effects of mining activities on heavy metal concentrations in water, sediment, and macroinvertebrates in different reaches of the Pilcomayo River, South America // Arch. Environ. Contam. Toxicol. V. 44(3). P. 314. https://doi.org/10.1007/s00244-002-2042-1
Turchini G.M., Francis D.S. 2009. Fatty acid metabolism (desaturation, elongation and β-oxidation) in rainbow trout fed fish oil-or linseed oil-based diets // British Journal of Nutrition. V. 102. № 1. P. 69. https://doi.org/10.1017/S0007114508137874
Vance D.E., Vance J.E. 2002. Biochemistry of Lipids, Lipoproteins and Membranes. Amsterdam: Elsevier.
Viarengo A. 1989. Heavy metals in marine invertebrates: mechanisms of regulation and toxicity at the cellular level // Rev. Aquat. Sci. V. 1. № 2. P. 295.
Wang W.X., Yang Y., Guo X. et al. 2011. Copper and zinc contamination in oysters: subcellular distribution and detoxification // Environ. Toxicol. Chem. V. 30(8). P. 1767. https://doi.org/10.1002/etc.571
Zorita I., Ortiz-Zarragoitia M., Soto M., Cajaraville M.P. 2006. Biomarkers in mussels from a copper site gradient (Visnes, Norway): an integrated biochemical, histochemical and histological study // Aquat. Toxicol. V. 78. P. 109.
Дополнительные материалы
- скачать ESM_1.doc
- Table S1. Гидрохимическая характеристика аквариумной воды
Table S2. Состав липидов жабр A. cygnea под действием меди в различных концентрациях (продолжительность воздействия 1 сут.)
Table S3. Состав липидов жабр A. cygnea под действием меди в различных концентрациях (продолжительность воздействия 3 сут.)
Table S4. Cостав липидов жабр A. cygnea под действием меди в различных концентрациях (продолжительность воздействия 7 сут.)
Инструменты
Биология внутренних вод


