Биология внутренних вод, 2020, № 5, стр. 477-485
Зоопланктон прибрежной зоны оз. Тана (Эфиопия) в начале сухого сезона
А. В. Крылов a, *, В. Зелалем b, А. А. Прокин a, Ф. Н. Шкиль c, d, ***
a Институт биологии внутренних вод им. И.Д. Папанина Российской академии наук
Некоузский р-н, Ярославская обл., пос. Борок, Россия
b Бахар-Дарский колледж сельского хозяйства и наук о Земле
Бахар-Дар, Эфиопия
c Институт проблем экологии и эволюции им. А.Н. Северцова Российской академии наук
Москва, Россия
d Институт биологии развития им. Н.К. Кольцова Российской академии наук
Москва, Россия
* E-mail: krylov@ibiw.ru
*** E-mail: fedorshkil@gmail.com
Поступила в редакцию 31.07.2019
После доработки 20.11.2019
Принята к публикации 24.12.2019
Аннотация
Проведена оценка количественных показателей зоопланктона прибрежья оз. Тана (Эфиопия) в начале сухого сезона в участках трех типов – открытой воды, границы зарослей и в зарослях макрофитов. Минимальные количественные характеристики планктонных животных зарегистрированы в зарослях макрофитов, максимальные – на участках открытой воды. Получены отрицательные корреляционные связи между степенью зарастания макрофитами и количественными характеристиками зоопланктеров. Особенности количественного развития и структуры зоопланктона в зоне зарослей и на их границе, по сравнению с участками открытой воды, а также по сравнению со второй половиной сухого сезона, указывают на возможную ведущую роль контроля сверху в формировании сообществ планктонных беспозвоночных, что связано с увеличением количества молоди рыб в это время. Оптимальные условия для питания молоди рыб и укрытия в светлое время суток могут формироваться на границе зарослей макрофитов, в результате чего здесь обнаружены минимальные численность и биомасса зоопланктона.
ВВЕДЕНИЕ
Озеро Тана – источник р. Голубой Нил и одно из крупнейших озер Африки (площадь ~3050 км2) – расположено в северо-западной части Эфиопского нагорья на высоте 1830 м над уровнем моря и играет исключительную роль в жизни населения Эфиопии (Vijverberg et al., 2009). В связи с этим, одна из наиболее важных задач – комплексное изучение биологического режима водоема, результаты которого будут способствовать организации рационального использования его ресурсов.
Ключевым звеном лимносистем является зоопланктон – комплекс организмов, осуществляющий связь между первичными продуцентами и высшими трофическими уровнями, а также активно участвующий в биологическом самоочищении вод. Структурные характеристики зоопланктона отражают экологическое состояние водоемов, что делает необходимым их изучение при проведении гидробиологических работ, оценке кормности и экологического состояния (Андроникова, 1996).
Несмотря на малочисленность работ, посвященных исследованию зоопланктона оз. Тана, выявлено, что наиболее яркие изменения структуры сообществ происходят в сезон дождей (Akoma, 2010; Dejen et al., 2004; Imoobe, Akoma, 2008). Для данного региона характерен тропический высокогорный муссонный тип климата с одним сезоном дождей. Продолжительность этого сезона варьирует слабо и составляет около четырех месяцев, с июня по сентябрь. Пик сезона приходится на июль–август, когда ежемесячно выпадает 250–330 мм осадков (Abebe et al., 2017). В это время отмечается активная водная эрозия почвы на водосборе озера (Teshale et al., 2001). Эрозия значительно увеличивает мутность воды. Именно мутность воды влияет на обилие, структуру и распределение зоопланктона (Akoma, 2010; Dejen et al., 2004; Imoobe, Akoma, 2008).
Кроме того, установлено, что на горизонтальное распределение зоопланктона в оз. Тана значительно влияет давление хищников ‒ планктоноядных рыб и личинок хаоборид. Этот фактор определяет снижение количественных характеристик зоопланктона в центральных глубоководных участках озера по сравнению с таковыми в прибрежных (Akoma, 2010; Dejen et al., 2002, 2004; Imoobe, Akoma, 2008; Wudneh, 1998). Динамика структуры и состава сообщества планктоноядных хищников оз. Тана не изучена, но, по-видимому, также имеет сезонную специфику. Влажный сезон, особенно его вторая половина, являются сезоном размножения рыб, населяющих оз. Тана. Часть видов нерестится в озере, другая совершает нерестовые миграции в реки, питающие озеро (Anteneh et al., 2012; Dejen et al., 2003, 2017; Shkil et al., 2017). Однако личинки рыб уже на ранних этапах развития скатываются в озеро, где осуществляют нагул, питаясь преимущественно планктонными организмами (собственные данные). Появление в озере большого числа планктоноядных личинок и молоди рыб в конце влажного–начале сухого сезона может оказывать влияние на состав и структуру зоопланктона.
Проведенные работы, посвященные изучению зоопланктона оз. Тана, также не дают полного представления об особенностях сообществ в разных зонах водоема. Наименее изученными остаются прибрежные участки (литоральная зона), которые характеризуются весьма выраженной гетерогенностью, связанной с мозаичным расположением открытых и зарастающих водными растениями биотопов, различиями по степени зарастания макрофитами, их видового состава. При этом данные, получаемые на центральных участках озера, не представляется возможным экстраполировать на его литоральную зону. Такая ситуация не уникальна. Семенченко В.П., описывая особенности прибрежий различных водоемов, ссылается на Гливича (Gliwicz, 2003): “… различия между литоральной и пелагической зонами озер гораздо больше, чем различия между водными и наземными экосистемами” (Семенченко, 2006, с. 233). Мордухай-Болтовской Ф.Д. также писал о специфике прибрежий водоемов: “… зона зарослей высшей водной растительности имеет характер как бы “другого государства”, находящегося в пределах водной экосистемы, но живущего иной жизнью” (Мордухай-Болтовской, 1974, с. 163). Исследования Бахар-Дарского залива оз. Тана, проведенные во второй половине сухого сезона (март) 2018 г., показали высокие количественные характеристики зоопланктона в прибрежье (Krylov et al., 2020). Установлено, что максимальная численность и биомасса характерны для сообществ, обитающих в зарослях гидатофитов при степени зарастания 10–50%. Следовательно, при изучении литоральной зоны необходимо учитывать наибольший спектр биотопов, которые способствуют формированию специфичного видового состава, количественных характеристик и структуры сообществ гидробионтов.
Принимая во внимание существенные сезонные колебания основных факторов среды, а также роль литоральной зоны в жизни водоема, представляется актуальным изучение количественных характеристик и структуры зоопланктона разнотипных прибрежных участков оз. Тана в начале сухого сезона, характеризующегося падением пикового уровня воды (Wudneh, 1998) и наибольшей численностью планктоноядных рыб.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Пробы собраны в октябре 2018 г. в прибрежной зоне шести участков Бахар-Дарского залива оз. Тана (Эфиопия): ст. 1 “Infranz”, ст. 2 “Hospital”, ст. 3 “Gerima”, ст. 4 “Resort”, ст. 5 “St. George”, ст. 6 “Shum-Abo”, подробное описание которых дано ранее (Zelalem, Prokin, 2017; Krylov et al., 2020). На каждой станции пробы собирали в трех зонах: I – открытая вода, II – граница зарослей макрофитов, III – заросли макрофитов. В зоне I пробы отбирали сетью Джеди с ячеей 64 мкм, протягивая ее от дна до поверхности, в зоне II – процеживая с помощью ведра через планктонную сеть с ячеей 64 мкм 50 л воды, в зоне III – 20 л. Пробы фиксировали 4%-ным формалином, камеральную обработку проводили по стандартной методике (Методика …, 1975), биомассу рассчитывали с учетом размеров организмов (Балушкина, Винберг, 1979). Статистический анализ включал оценку достоверности различий средних по критерию Краскела–Уоллеса (р < 0.05), связи с параметрами среды оценивались по коэффициенту корреляции Спирмена R (р < 0.05).
Все пробы в зарослях макрофитов собраны на участках, характеризующихся степенью зарастания 90% (табл. 1). В зоне открытой воды степень зарастания варьировала от 0 до 20%, на границе зарослей – от 5 до 90%. Согласно экологической классификации качества поверхностных вод суши (Оксиюк и др., 1993; Романенко и др., 1990), по концентрации фосфат-иона PO4 и аниона NO3 большинство участков открытой воды и границы зарослей макрофитов (за исключением ст. 5 (зона II)) могут быть определены как гипертрофные. Станции 2, 3 (зона I) и 4–6 (зона II) являются мезотрофными. Все остальные станции и участки могут быть отнесены к эвтрофным водам (табл. 1). Мутность воды варьировала от 5 до 35 NTU (табл. 1). На большинстве станций она была больше в открытой части, чем на границе с зарослями макрофитов. Общая минерализация воды колебалась в пределах от 72 до 104 мг/л, не имея значительных различий в разных зонах прибрежья, лишь на ст. 1 обнаружена относительно большая разница между водой в открытой части и на границе зарослей макрофитов (табл. 1). Все исследованные участки имели нейтральные воды (табл. 1).
Таблица 1.
Степень зарастания и абиотические характеристики исследованных участков оз. Тана в начале сухого сезона
| Станция | Зона | СЗ, % | PO4, мг/л | NO3, мг/л | Мутность, NTU |
Общая минерализация воды, мг/л | рH |
|---|---|---|---|---|---|---|---|
| 1 | I | 7 | 0.18 | 0.616 | 35 | 75 | 7.38 |
| II | 30 | 0.28 | 0.968 | 29 | 104 | 7.39 | |
| III | 90 | – | – | – | – | – | |
| 2 | I | 50 | 0.12 | 0.334 | 14 | 92 | 7.31 |
| II | 90 | 0.18 | 0.312 | 5 | 92 | 7.27 | |
| III | 90 | – | – | – | – | – | |
| 3 | I | 0 | 0.18 | 0.484 | 29 | 97 | 7.15 |
| II | 20 | 0.14 | 0.616 | 29 | 80 | 7.18 | |
| III | 90 | – | – | – | – | – | |
| 4 | I | 5 | 0.12 | 0.572 | 23 | 72 | 7.34 |
| II | 25 | 0.14 | 0.317 | 17 | 74 | 7.37 | |
| III | 90 | – | – | – | – | – | |
| 5 | I | 0 | 0.16 | 0.616 | 29 | 78 | 7.35 |
| II | 5 | 0.02 | 0.317 | 23 | 76 | 7.35 | |
| III | 90 | – | – | – | – | – | |
| 6 | I | 0 | – | – | – | – | – |
| II | 50 | 0.14 | 0.484 | 26 | 75 | 7.28 | |
| III | 90 | – | – | – | – | – |
Примечание. Станции: 1 ‒ устье реки, орошающей сеть сельскохозяйственных земель; 2 ‒ большой мелководный залив, заполняющийся при максимальном уровне воды; 3 ‒ сплавина, изолированная от берега в течение влажного сезона; 4 ‒ небольшой залив, окруженный кварталами городских зданий; 5 ‒ станция рядом с городской набережной у порта; 6 ‒ станция рядом с густонаселенным кварталом трущоб (“фавела”), лишенных централизованной системы водоотведения. CЗ – степень зарастания, I – открытая вода, II – граница зарослей макрофитов, III – заросли макрофитов; “–” – отсутствие данных.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
В период изучения обнаружено 84 вида зоопланктона, 56 из них – Rotifera, 7 – Copepoda, 22 – Cladocera. Среди Rotifera наибольшим разнообразием отличались роды Trichocerca (12 видов), Lecane (9), Keratella (4) и Brachionus (4). Copepoda представлены двумя видами Calanoida и пятью видами Cyclopoida. В составе Cladocera отмечены представители семи семейств, среди которых наиболее разнообразны Chydoridae (12 видов) и Daphniidae (5 видов). В семействах Bosminidae, Ilyocryptidae, Macrothricidae, Moinidae и Sididae обнаружено по одному виду.
В зоне открытой воды удельное число видов сильно варьировало – от 23 (ст. 6) до 41 (ст. 2), но везде основу составляли коловратки – 66.7–80.5%. В то же время доля видов ветвистоусых ракообразных колебалась в диапазоне 14.6–25.8%, веслоногих – 4.9–15.4%. На границе зарослей макрофитов количество видов было от 3 (ст. 1) до 34 (ст. 6). Их основу также представляли Rotifera – 60.0–82.4%. Доля видов была меньше: Cladocera – Copepoda – 3.4–33.3%. В зарослях водных растений количество видов беспозвоночных варьировало от 15 (ст. 1) до 37 (ст. 2), коловраток было от 50 до 76.5%, ветвистоусых ракообразных – от 20.0 до 41.7%, веслоногих – от 0 до 10.8%.
Минимальные значения общего числа видов зоопланктона и его таксономических групп отмечены на границе зарослей водных растений, максимальные – в зоне открытой воды, хотя различия были статистически недостоверны (рис. 1а, табл. 2). Отмечены тенденции снижения доли видов Copepoda от открытых участков к зарослям макрофитов (с 9.1 до 4.7%) и увеличения доли видов Cladocera (с 18.3 до 29.1%).
Рис. 1.
Средние (m ± SD) число видов (а), численность (б) и биомасса (в) зоопланктона в зоне открытой воды (I), на границе зарослей макрофитов (II) и в зарослях (III) оз. Тана в начале (октябрь) и во второй половине (март) сухого сезона.
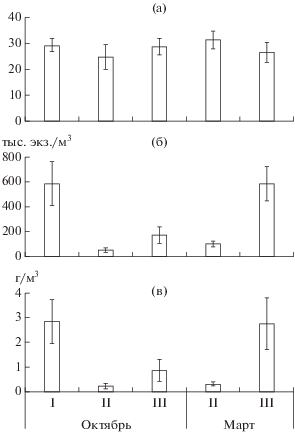
Таблица 2.
Число видов (S), численность (N), биомасса (В) таксономических групп зоопланктеров и индекс Шеннона, рассчитанный по численности (HN) и биомассе (HB) зоопланктона в зонах открытой воды (I), на границе зарослей макрофитов (II) и в зарослях (III) оз. Тана в начале (октябрь) и во второй половине (март) сухого сезона
| Показатель | Октябрь | Март (Krylov et al., 2020) | |||
|---|---|---|---|---|---|
| Iа | IIb | IIIc | IId | IIIe | |
| S: | |||||
| Rotifera | 21.2 ± 2.4 | 18.0 ± 3.9 | 19.0 ± 2.6 | 23.5 ± 3.1 | 19.5 ± 3.4 |
| Copepoda | 2.7 ± 0.3 | 1.3 ± 0.2*d | 1.3 ± 0.6 | 2.5 ± 0.2 | 2.2 ± 0.3 |
| Cladocera | 5.3 ± 0.7 | 5.3 ± 1.2 | 8.3 ± 1.5 | 5.2 ± 0.4 | 4.8 ± 0.5 |
| N, тыс. экз./м3: | |||||
| Rotifera | 277.6 ± 85.6*b | 26.0 ± 8.8 | 72.2 ± 25.5 | 26.6 ± 4.8*e | 106.9 ± 22.4 |
| Copepoda | 182.1 ± 44.4*b | 18.2 ± 9.9 | 63.5 ± 35.8*e | 40.8 ± 17.1*e | 236.4 ± 63.7 |
| Cladocera | 124.3 ± 60.7*b | 6.9 ± 3.6*d | 35.7 ± 14.1*e | 32.9 ± 14.2*e | 241.7 ± 66.8 |
| HN, бит/экз. | 3.90 ± 0.09 | 3.40 ± 0.44*d | 3.70 ± 0.25*e | 1.69 ± 0.24 | 1.80 ± 0.29 |
| B, г/м3: | |||||
| Rotifera | 0.139 ± 0.038*b | 0.014 ± 0.005 | 0.039 ± 0.013*e | 0.037 ± 0.011*e | 0.170 ± 0.060 |
| Copepoda | 1.632 ± 0.467*b, c | 0.156 ± 0.073 | 0.209 ± 0.105*e | 0.108 ± 0.047*e | 1.254 ± 0.639 |
| Cladocera | 1.071 ± 0.535*b | 0.054 ± 0.032 | 0.608 ± 0.254*e | 0.154 ± 0.047*e | 1.325 ± 0.407 |
| HB, бит/г | 3.04 ± 0.15 | 2.60 ± 0.34*d | 2.88 ± 0.22*e | 0.94 ± 0.16 | 1.16 ± 0.38 |
Численность зоопланктона в зоне открытой воды находилась в пределах от 267.4 (ст. 4) до 1431.7 (ст. 3) тыс. экз./м3. Ее основу представляли Rotifera – 45.1–53.3%. Лишь на ст. 1 преобладали Copepoda (49.3%), в то время как на других станциях их доля была 16.9–42.7%. Cladocera в зоне открытой воды достигали от 4.1 до 38.0% общей численности. На границе зарослей макрофитов плотность организмов была существенно ниже – 0.2 (ст. 1) – 129.7 тыс. экз./м3 (ст. 3). Доминировали здесь Rotifera – 56.2–81.8%, однако на ст. 3 преобладали Copepoda – 50.5%, их доля на других станциях колебалась от 18.2 до 33.1%. Доля Cladocera варьировала от 0 до 17.5%. В зарослях макрофитов численность зоопланктона изменялась от 3.7 (ст. 1) до 473.2 тыс. экз./м3 (ст. 2). На ст. 3–5 преобладали Rotifera (52.7–62.3%), на ст. 1 и 2 – Copepoda (65.3 и 49.1% соответственно), на ст. 6 – Cladocera (36.5%).
В целом, наибольшая средняя численность зоопланктона отмечена в зоне открытой воды, а на границе зарослей и в зарослях макрофитов она была меньше в 11.4 и 3.4 раза соответственно за счет всех таксономических групп беспозвоночных (рис. 1б, табл. 2). Максимальная средняя величина индекса Шеннона, рассчитанного по численности, наблюдалась в зоне открытой воды, минимальная – на границе зарослей макрофитов, хотя различия были статистически недостоверны (табл. 2).
В большинстве случаев зоны внутри станций различались по составу доминирующих по численности зоопланктеров, лишь на двух станциях преобладали одни и те же организмы – ювенильные Cyclopoida (ст. 2) и Ascomorpha agilis (ст. 5) (табл. 3). Плавающие ветвистоусые фильтраторы (Bosmina longirostris и Diaphanosoma excisum) зарегистрированы только в зонах открытой воды и на границе зарослей макрофитов. В зарослях преобладали ползающе-плавающие вторичные фильтраторы (представители сем. Chydoridae). В целом, на границе зарослей макрофитов отмечена тенденция увеличения доли доминирующих Rotifera (34.2%) и снижения доли Cladocera (2.2%) по сравнению с зонами открытой воды (22.3 и 6.3% соответственно) и зарослей водных растений (18.4 и 4.8%).
Таблица 3.
Состав планктонных организмов, доминирующих по численности в зоне открытой воды (I), на границе зарослей макрофитов (II) и в зарослях (III) оз. Тана в начале сухого сезона
| Станция | Зона | ||
|---|---|---|---|
| I | II | III | |
| 1 | Keratella tropica (Apstein, 1907), науплиусы и копеподиты Calanoida | Notommata pachyura Gosse, 1886 | Науплиусы и копеподиты Cyclopoida |
| 2 | Tetramastix opoliensis Zacharias, 1898, науплиусы и копеподиты Cyclopoida | Platyias patulus (O.F. Müller, 1786), Lecane bulla (Gosse, 1851), науплиусы и копеподиты Cyclopoida | Platyias patulus, науплиусы и копеподиты Cyclopoida |
| 3 | Synchaeta jollyae (Shiel et Koste, 1993), Keratella tropica, Sinantherina semibullata (Thorpe, 1889), Bosmina longirostris (O.F. Müller, 1785) | Ascomorpha ecaudis Perty, 1850, копеподиты Cyclopoida, копеподиты Calanoida | Synchaeta jollyae, науплиусы Cyclopoida |
| 4 | Ascomorpha ecaudis, Synchaeta jollyae, копеподиты Cyclopoida | Ascomorpha ecaudis, копеподиты Calanoida | Mytilina ventralis (Ehrenberg, 1832), науплиусы Cyclopoida, Chydorus sphaericus O.F. Müller, 1776 |
| 5 | Ascomorpha agilis Zacharias, Synchaeta jollyae, науплиусы и копеподиты Cyclopoida | Ascomorpha agilis, Tetramastix opoliensis, копеподиты Cyclopoida, Diaphanosoma excisum Sars, 1885 | Ascomorpha agilis, Sinantherina semibullata, Chydorus sp. |
| 6 | Sinantherina semibullata, Bosmina longirostris | Keratella tropica, науплиусы Cyclopoida | Науплиусы и копеподиты Cyclopoida, Chydorus sp. |
Примечание: Описание станций см. в табл. 1.
Биомасса зоопланктона в зоне открытой воды варьировала от 1.2 (ст. 6) до 6.8 г/м3 (ст. 3). Основу биомассы на большинстве участков представляли Copepoda (57.5–88.6%), на станциях 3 и 6 – Cladocera (54.3 и 67.2% соответственно). На границе зарослей макрофитов биомасса зоопланктона колебалась от 0.0001 (ст. 1) до 0.7 г/м3 (ст. 3). При этом наибольшую долю составляли Copepoda (от 45.5 до 90.3%), лишь на ст. 3 – Rotifera (54.0%). В зарослях растений биомасса планктонных беспозвоночных находилась в пределах от 0.01 (ст. 1) до 3.0 г/м3 (ст. 2). На станциях 2, 4–6 ее основу представляли Cladocera (55.3–83.2%), на станциях 1 и 3 – Copepoda (57.0 и 60.7% соответственно).
В целом, максимальная средняя биомасса зоопланктона характерна для зоны открытой воды, на границе зарослей макрофитов она была меньше в 12.7 раза, в зарослях – в 3.3 раза (рис. 1в) за счет всех таксономических групп планктонных животных (табл. 2). Минимальное среднее значение индекса Шеннона, рассчитанного по биомассе, зарегистрировано в зарослях растений, максимальное – в зоне открытой воды, хотя различия были статистически недостоверны (табл. 2).
Видовой состав доминирующих по биомассе организмов существенно различался в разных зонах в пределах отдельных станций (табл. 4). В зонах открытой воды и на границе зарослей макрофитов для большинства станций преобладали представители Calanoida (Copepoda), а в зоне зарослей – сем. Chydoridae (Cladocera). Так, в зарослях макрофитов средняя доля доминирующих Copepoda составила 36.4%. В зоне открытой воды и на границе зарослей их относительное обилие было выше (46.4 и 56.9% соответственно). В то же время, граница зарослей макрофитов характеризовалась минимальной долей доминирующих Cladocera (8.5%). Наибольшая доля последних отмечена в зарослях растений (43.3%). В зоне открытой воды средняя доля доминирующих Cladocera была 22.0%.
Таблица 4.
Состав планктонных организмов, доминирующих по биомассе в зоне открытой воды (I), на границе зарослей макрофитов (II) и в зарослях (III) оз. Тана в начале сухого сезона
| Станция | Зона | ||
|---|---|---|---|
| I | II | III | |
| 1 | Arctodiaptomus acutilobatus (Sars, 1903), копеподиты Calanoida | Notommata pachyura, копеподиты Cyclopoida | Копеподиты Cyclopoida, Thermocyclops ethiopiensis Defaye, 1988, Chydorus sphaericus |
| 2 | Науплиусы Cyclopoida, копеподиты Calanoida | Копеподиты Calanoida, Arctodiaptomus acutilobatus, Moina micrura Kurz, 1875 | Копеподиты Cyclopoida, Simocephalus vetulus (O.F. Müller, 1776) |
| 3 | Thermodiaptomus galebi lacustris Defaye, 1988, Diaphanosoma excisum | Копеподиты Calanoida, Arctodiaptomus acutilobatus | Науплиусы Cyclopoida, Thermocyclops ethiopiensis, Moina micrurа |
| 4 | Копеподиты Cyclopoida, Arctodiaptomus acutilobatus, Moina micrurа | Науплиусы Cyclopoida, копеподиты Calanoida, Arctodiaptomus acutilobatus | Camptocercus sp., Chydorus sphaericus, Oxyurella sp., Aloninae sp. |
| 5 | Копеподиты Cyclopoida, Arctodiaptomus acutilobatus, Diaphanosoma excisum | Копеподиты Cyclopoida, Diaphanosoma excisum | Moina micrurа, Chydorus sp. |
| 6 | Копеподиты Cyclopoida, Bosmina longirostris, Diaphanosoma excisum | Науплиусы и копеподиты Cyclopoida, Diaphanosoma excisum | Копеподиты Cyclopoida, Chydorus sp. |
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Влияние мутности воды на зоопланктон тропических озер относится к числу наиболее обсуждаемых вопросов (Aka et al., 2000; Hart, 1986). Особенно актуален он для оз. Тана, где мутность формируется наиболее вредным для гидробионтов типом глины (Cuker, Hudson, 1992). Полученные нами результаты указывают, что мутность воды в период изучения в зонах прибрежья статистически не различалась и демонстрировала относительно невысокие значения: в пересчете на мг/л она колебалась в пределах 2.9–20.3. В России предельный уровень мутности для рыбохозяйственных водоемов 25 мг/л (Перечень…, 1999), а уменьшение численности и преобразование распределения зоопланктеров чаще всего наблюдается при достижении мутности 60 мг/л (Строганов, 1979). Соответственно, мутность не может рассматриваться в качестве фактора, вызывающего наблюдаемые изменения сообществ планктонных беспозвоночных. Между выделенными зонами прибрежья также не выявлено ярко выраженных и статистически достоверных различий других измеренных характеристик воды, как не отмечено и статистически подтвержденных коэффициентов корреляции между ними и структурными показателями зоопланктона.
В то же время исследованные станции и отдельные зоны различались по степени зарастания макрофитами. Водные растения играют важную роль в формировании структуры зоопланктона, увеличивая гетерогенность среды, изменяя гидродинамические и гидрохимические характеристики литоральной зоны, а также кормовую базу беспозвоночных (Курбатова и др., 2013; Семенченко, 2006; Семенченко и др., 2013). Особую роль заросли макрофитов играют в обеспечении защиты планктонных беспозвоночных от хищников (в частности, рыб и хищных беспозвоночных) (Burks et al., 2002; Lauridsen, Buenk, 1996; Lewin et al., 2004). Однако полученные данные показали, что численность и биомасса зоопланктона в зарослях растений уступали таковым в открытой воде, а минимальные значения отмечены на границе зарослей (табл. 2, рис. 1). Более того, при увеличении степени зарастания сокращались общая численность и биомасса зоопланктона (r = –0.68 и ‒0.78 соответственно), численность и биомасса Copepoda (r = –0.66 и –0.75) и Cladocera (r = –0.80 и –0.77).
Можно предположить, что основным фактором, лежащим в основе наблюдаемых различий в количественных показателях зоопланктона, выступает давление молоди рыб. В оз. Тана богатая фауна планктофагов, в основном приуроченных к центральным участкам водоема, – Labeobarbus brevicephalus (Nagelkerke et Sibbing, 1997), Barbus tanapelagius (Graaf et al., 2000), Garra tana (Getahun et Stiassny, 2007) и Clarias gariepinus (Burchell, 1822) (Wudneh, 1998; Imoobe, Akoma, 2008; Akoma, 2010). Среди зарослей макрофитов и на границе с ними обитают Enteromius humilis (Boulenger, 1902), E. trispilopleura (Boulenger, 1902), E. paludinosus (Peters, 1852) и молодь других видов, специализирующаяся преимущественно на поедании планктона (Dejen et al., 2003; собственные данные). Пик размножения большинства рыб, населяющих оз. Тана, приходится на вторую половину сезона дождей – конец июля–сентябрь (Anteneh et al., 2012; Dejen et al., 2002, 2009, 2017; Dgebuadze et al., 1999; Geremew et al., 2015; Shkil et al., 2017). Часть из них нерестится в зарослях макрофитов в прибрежной зоне озера. Другая часть осуществляет нерестовые миграции в реки, питающие озеро, и их личинки после выклева и заполнения воздушного пузыря выкатываются в устья рек, откуда распределяются по зарослям прибрежных макрофитов в озере. В результате, в конце сезона дождей и начале сухого сезона в литоральной зоне наблюдается значимое увеличение плотности личинки и малька, специализирующихся на поедании планктона (собственные данные). По-видимому, граница зарослей макрофитов является наиболее удобным местообитанием молоди рыб, хорошо обеспечивающим защиту от хищников и богатым пищевыми ресурсами.
Зоопланктон на границе зарослей сочетает виды ракообразных, преобладающих как в зоне открытой воды (например, Arctodiaptomus acutilobatus, Diaphanosoma excisum), так и в зоне макрофитов (например, Moina micrura). Однако в начале сухого сезона численность и биомасса зоопланктона здесь отличается минимальными значениями (табл. 2, рис. 1), что закономерно при увеличении контроля сверху (Гиляров, 1987; Bartell, Kitchell, 1978; Hrbaček, 1962; Stenson et al., 1978). Это свидетельствует в пользу того, что в начале сухого сезона ведущим фактором, определяющим количественные характеристики зоопланктона прибрежной зоны оз. Тана, может выступать влияние рыб.
Помимо этого, нашу гипотезу подтверждают данные сравнительного анализа показателей зоопланктона в разные периоды сухого сезона. Так, в начале сухого сезона (октябрь) по сравнению со второй половиной (март) на границе зарослей статистически достоверно снижалась численность Cladocera (табл. 2), возрастали доли Rotifera в общей численности (p = 0.041) и Copepoda в общей биомассе (p = 0.045), в 2.0 раза сокращалась общая численность зоопланктона, в 2.2 раза – численность Copepoda. В зарослях растений статистически значимо меньше были численность и биомасса зоопланктона, Copepoda и Cladocera (табл. 2, рис. 1).
Известно, что выедание рыбами наиболее крупных и/или массово представленных видов беспозвоночных приводит к ослаблению меж- и внутривидовой конкуренции (Фенева и др., 2007; Gliwicz, 2002), что, по нашему мнению, должно способствовать также снижению степени доминирования одного вида и, как следствие, повышению выравненности сообществ беспозвоночных, в частности, увеличению индекса видового разнообразия Шеннона. Но в исследованных нами зонах прибрежья обнаружены обратные тенденции: на границе зарослей макрофитов величины этого индекса отличались наименьшими значениями, а в зоне открытой воды – наибольшими (табл. 2). По-видимому, направленность изменений индекса в разных зонах прибрежья зависит от силы пресса планктофагов, связанной с их плотностью, которая, к сожалению, в нашей работе не определена. Возможно, есть пороговая плотность хищников, при которой выедание ими беспозвоночных способствует снижению выравненности зоопланктона за счет повышения степени доминирования представителей мелких видов Rotifera. Одновременно увеличение роли планктоноядных хищников в начале сухого сезона подтверждает статистически достоверное повышение индекса Шеннона в зоне зарослей и на их границе по сравнению с данными, полученными для второй половины сухого сезона (табл. 2). Таким образом, сезонные изменения количества рыб могут быть одним из ведущих факторов, определяющих структуру и состав сообществ зоопланктона разнотипных участков прибрежья оз. Тана.
Полученные данные объясняют отсутствие роста количественных характеристик зоопланктона в оз. Тана в ответ на поступление с поверхностным стоком биогенных и органических веществ – явление, характерное для некоторых водоемов Восточной Африки (Mavuti, Litterick, 1981). В пик сезона дождей развитию планктона оз. Тана препятствует высокая мутность воды (Akoma, 2010; Dejen et al., 2004; Imoobe, Akoma, 2008). При стабилизации уровня воды и/или в начале его падения, а также при снижении мутности воды в начале сухого сезона можно было бы ожидать рост количественных характеристик зоопланктона. Однако, как показывают наши данные, этого не происходит, скорее всего, из-за увеличения давления планктоноядных хищников – личинок и молоди рыб, использующих водные растения в качестве защиты от многочисленных рыбоядных хищников (крупных беспозвоночных, рыб, рептилий, птиц и млекопитающих). Аналогичные факты мощного давления рыб на сообщества зоопланктона в зарослях макрофитов отмечены для ряда водоемов южных широт (Burks et al., 2002; Iglesias et al., 2007; Lewin et al., 2004; Meerhoff et al., 2007a, 2007b). Ранее снижение количественных характеристик зоопланктона в начале сухого сезона связывали с низкой температурой воды (Dejen et al., 2004). Данные исследования позволяют предположить, что решающую роль в этот период играет увеличение плотности рыбного населения. Однако для окончательных выводов необходимо продолжение исследований, которые должны включать наблюдения за состоянием кормовой базы беспозвоночных (в частности, водорослей, бактерий и простейших), плотностью молоди и взрослых рыб, а также их суточными миграциями.
Список литературы
Андроникова И.Н. 1996. Структурно-функциональная организация зоопланктона озерных экосистем разных трофических типов. Санкт-Петербург: Наука.
Балушкина Е.Б., Винберг Г.Г. 1979. Зависимость между массой и длиной тела у планктонных животных // Общие основы изучения водных экосистем. Ленинград: Наука. С. 169.
Гиляров А.М. 1987. Динамика численности пресноводных планктонных ракообразных. Москва: Наука.
Курбатова С.А., Лаптева Н.А., Ершов И.Ю., Борисовская Е.В. 2013. Средообразующая роль гидрофитов в развитии и функционировании планктонных сообществ // Труды Карельского научного центра РАН. № 3. С. 119.
Методика изучения биогеоценозов внутренних водоемов. 1975. Москва: Наука.
Мордухай-Болтовской Ф.Д. 1974. Фауна беспозвоночных прибрежной зоны Рыбинского водохранилища // Природные ресурсы Молого-Шекснинской низины. Рыбинское водохранилище. Вологда: Северо-Западное книжное издательство. С. 158.
Оксиюк О.П., Жукинский В.Н., Брагинский Л.П. и др. 1993. Комплексная экологическая классификация качества поверхностных вод суши // Гидробиол. журн. Т. 29. № 4. С. 62.
Перечень рыбохозяйственных нормативов: предельно допустимых концентраций (ПДК) и ориентировочно безопасных уровней воздействия (ОБУВ) вредных веществ для воды водных объектов, имеющих рыбохозяйственное значение. 1999. Москва: Изд-во ВНИРО.
Романенко В.Д., Оксиюк О.А., Жукинский В.Н. и др. 1990. Экологическая оценка воздействия гидротехнического строительства на водные объекты. Киев: Наук. думка.
Семенченко В.П. 2006. Зоопланктон литоральной зоны озер: структурные, динамические и функциональные показатели // Известия Самарского научного центра Российской академии наук. Т. 8. № 1. С. 233.
Семенченко В.П., Разлуцкий В.И., Бусева Ж.Ф., Палаш А.Л. 2013. Зоопланктон литоральной зоны озер разного типа. Минск: Белорусская наука.
Строганов Н.С. 1979. Токсикологический контроль загрязненности пресных вод // Влияние загрязнений на гидробиологию и экосистемы водоемов. Ленинград: Наука. С. 221.
Фенева И.Ю., Разлуцкий В.И., Палаш А.Л. 2007. Экспериментальное изучение влияния хищничества и конкуренции на видовую структуру сообществ ветвистоусых ракообразных // Биология внутр. вод. № 3. С. 41.
Abebe W., Michael T., Leggesse E.S. et al. 2017. Climate of Lake Tana Basin // Social and Ecological System Dynamics. New York: Springer. P. 51.
Aka M., Pagano M., Saint-Jean L. et al. 2000. Zooplankton variability in 49 shallow tropical reservoirs of Ivory Coast (West Africa) // Int. Rev. Hydrobiol. V. 85. P. 491.
Akoma O.C. 2010. Hydrobiological Survey of the Bahir Dar Gulf of lake Tana, Ethiopia // African Res. Rev. V. 4(2). P. 57.
Anteneh W., Getahun A., Dejen E. et al. 2012. Spawning migrations of the endemic Labeobarbus (Cyprinidae, Teleostei) species of Lake Tana, Ethiopia: status and threats // J. Fish Biol. V. 81. P. 750.
Bartell S.M., Kitchell J.F. 1978. Seasonal impact of planktifory on phosphorus release by Lake Wingra zooplankton // Verh. Int. Ver. theor. und angew. Limnol. V. 20. P. 466.
Burks R.L., Lodge D.M., Jeppesen E., Lauridsen T.L. 2002. Dial horizontal migration of zooplankton: costs and benefits of inhabiting the littoral // Freshwater Biol. V. 47. P. 343.
Cuker B.E., Hudson Jr.L. 1992. Type of suspended clay influences zooplankton response to phosphorus loading // Limnol., Oceanogr. V. 37. P. 566.
Dejen E., Rutjes H.A., de Graaf M. et al. 2002. The ‘small barbs’ Barbus humilis and B. trispilopleura of Lake Tana (Ethiopia): are they ecotypes of the same species? // Environ. Biol. Fish. V. 65. P. 373.
Dejen E., Sibbing F.A., Vijverberg J. 2003. Reproductive strategies of two sympatric ‘small barbs’ (Barbus humilis and B. tanapelagius, Cyprinidae) in Lake Tana, Ethiopia // Neth. J. Zool. V. 52. P. 281.
Dejen E., Vijverberg J., Nagelkerke L.A.J., Sibbing F.A. 2004. Temporal and spatial distribution of microcrustacean zooplankton in relation to turbidity and other environmental factors in a large tropical lake L. Tana, Ethiopia // Hydrobiologia. V. 513. P. 39.
Dejen E., Vijverberg J., Nagelkerke L.A.J., Sibbing F.A. 2009. Growth, biomass, and production of two small barbs (Barbus humilis and B. tanapelagius, Cyprinidae) and their role in the food web of Lake Tana (Ethiopia) // Hydrobiologia. V. 636. P. 89.
Dejen E., Anteneh W., Vijverberg J. 2017. The Decline of the Lake Tana (Ethiopia) Fisheries: Causes and Possible Solutions // Land Degrad. Develop. V. 28. P. 1842.
Dgebuadze Y., Mina M., Alekseyev S., Golubtsov A. 1999. Observations on reproduction of the Lake Tana barbs // J. Fish Biol. V. 54. P. 417.
Geremew A., Getahun A., Dejen E. 2015. Reproductive biology of Garra regressus and Garra tana (Cypriniformes: Cyprinidae) from Lake Tana, Ethiopia // Journal of Threatened Taxa. V. 7. № 6. P. 7223.
Gliwicz Z.M. 2002. On the different nature of top-down and bottom-up effects in pelagic food webs // Freshwater Biol. V. 47. P. 2296.
Gliwicz Z.M. 2003. Between Hazards of Starvation and Risk of Predation: The Ecology of Offshore Animals // Excellence in Ecology. Oldendorf/Luhe: Int. Ecol. Inst. V. 12. P. 379.
Hart R.C. 1986. Zooplankton density, community structure and dynamics in relation to inorganic turbidity, and the implications for a potential fishery in subtropical Lake le Roux, South Africa // Freshwater Biol. V. 16. P. 351.
Hrbaček J. 1962. Species composition and the amount of zooplankton in relation to the fish stock // Rozpr. Cesk. Akad. V. 72(10). P. 116.
Iglesias C., Goyenola G., Mazzeo N. et al. 2007. Horizontal dynamics of zooplankton in subtropical Lake Blanca (Uruguay) hosting multiple zooplankton predators and aquatic 7 plant refuges // Hydrobiologia. V. 584. P. 179.
Imoobe T.O.T., Akoma O.C. 2008. Assessment of zooplankton community structure of the Bahir Dar gulf of Lake Tana, Ethiopia // Ethiopian Journal of Environmental Studies and Management. V. 1. № 2. P. 26.
Kloos H., Legesse W. 2010. Water resources management in Ethiopia: implications for the Nile basin. New York: Cambria Press.
Krylov A.V., Zelalem W., Prokin A.A. 2020. Qualitative composition and quantitative characteristics of zooplankton in the littoral zone of Lake Tana (Ethiopia) at the end of the dry season // Inl. Wat. Biol. V. 13. № 2. P. 161. https://doi.org/10.1134/S1995082920020078
Lauridsen T.L., Buenk I. 1996. Dial changes in the horizontal distribution of zooplankton in the littoral zone of two shallow eutrophic lakes // Arch. Hydrobiol. V. 137. P. 161.
Lewin W.-Ch., Okun N., Mehner T. 2004. Determinants of the distribution of juvenile fish in the littoral area of a shallow lake // Freshwater Biol. V. 49(4). P. 410.
Mavuti K.M., Litterick M.R. 1981. Species composition and distribution of zooplankton in a tropical lake, Lake Naivasha, Kenya // Archiv für Hydrobiol. V. 93. P. 52.
Meerhoff M., Clemente J.M., Teixeira de Mello F. et al. 2007a. Can warm climate-related structure of littoral predator assemblies weaken the clear water state in shallow lakes? // Global Change Biology. V. 13. P. 1888.
Meerhoff M., Iglesias C., Teixeira De Mello F. et al. 2007b. Effects of habitat complexity on community structure and predator avoidance behaviour of littoral zooplankton in temperate versus subtropical shallow lakes // Freshwater Biol. V. 52(6). P. 1009.
Shkil F., Dzerzhinskii K., Abdissa B. et al. 2017. Notes on the breeding of large Tana barbs (Labeobarbus) in nature and laboratory // Ethiopian J. Biol. Sci. V. 16. P. 149.
Stenson J., Bohlin T., Henrikson L. et al. 1978. Effects of fish removal from a small lake // Verh. Int. Ver. Theor. und Angew. Limnol. V. 20. P. 794.
Teshale B., Lee R., Zawdie G. 2001. Development initiatives and challenges for sustainable resource management and livelihood in the Lake Tana region of Northern Ethiopia // Proceedings of the Wetland Awareness Creation and Activity Identification Workshop in Amhara National Regional State. January 23rd 2001. Bahar Dar, Ethiopia. P. 33.
Vijverberg J., Sibbing F.A., Dejen E. 2009. Lake Tana: Source of the Blue Nile // The Nile. Monographiae Biologicae. V. 89. P. 163.
Wudneh T. 1998. Biology and Management of Fish Stocks in Bahar Dar Gulf, Lake Tana, Ethiopia. PhD Thesis. Wageningen: Wageningen Agricultural University.
Zelalem W., Prokin A. 2017. Physico-chemical characteristics and macrozoobenthos abundance in the Gulf of Lake Tana // Ethiopian J. Biological Sciences. V. 16. № 2. P. 181.
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод


