Биология внутренних вод, 2020, № 5, стр. 513-519
Содержание ртути в водных жуках (Coleoptera: Dytiscidae, Hydrophilidae) разных размерных классов
Ю. Г. Удоденко a, b, *, А. А. Прокин a, b, Д. Г. Селезнев a, А. С. Сажнев a, Е. С. Иванова b
a Институт биологии внутренних вод им. И.Д. Папанина Российской академии наук
Некоузский р-н, Ярославская обл., пос. Борок, Россия
b Череповецкий государственный университет
Череповец, Россия
* E-mail: udu@ibiw.ru
Поступила в редакцию 20.12.2019
После доработки 27.02.2020
Принята к публикации 13.03.2020
Аннотация
Определено содержание ртути в имаго водных жуков, обитающих в бобровых прудах Полистово-Ловатской системы верховых болот (Новгородская обл.). Исследована 201 особь из девяти видов сем. Dytiscidae и одного вида сем. Hydrophilidae, относящихся к II и III размерным классам. Установлено, что в жуках II размерного класса содержание ртути достоверно различается между видами (χ2 = 32.93, р < < 0.01). Максимальные концентрации выявлены у Graphoderus cinereus (0.259 ± 0.091 мкг/г сухой массы), минимальные – у Hydrochara caraboides (0.091± 0.020 мкг/г сухой массы). Для жуков III размерного класса (более крупных) достоверных различий в содержании ртути между видами не обнаружено. У жуков II размерного класса c увеличением массы тела уменьшается концентрация ртути в организме (ранговый коэффициент Кендалла τ = –0.31, р < 0.01). Содержание ртути в отделах тела жуков рода Dytiscus увеличивается в ряду: надкрылья и крылья–ноги–голова и грудь–брюшко.
ВВЕДЕНИЕ
Ртуть – повсеместно распространенный токсичный элемент, поступающий в окружающую среду из естественных (извержения вулканов, дегазация с поверхности Мирового океана) и антропогенных (добыча золота, черная и цветная металлургия, сжигание ископаемого топлива и т.д.) источников (Driscoll et al., 2013; UN…, 2019). Накопление ртути зависит от трофического статуса и типа диеты (Wiener et al., 2002). Содержание ее в организме животных увеличивается с ростом их положения в трофической сети – максимальные значения отмечаются у хищных видов (Комов и др., 2017; Lobus, Komov, 2016). Наибольшие концентрации ртути среди гидробионтов пресных водоемов в умеренных широтах зарегистрированы у хищных видов рыб, занимающих наиболее высокие уровни в локальной трофической сети (Buck еt al., 2019). Накопление соединений ртути в органах и тканях животных, в том числе человека, приводит к развитию негативных биологических эффектов – изменению нормального гормонального фона и нарушению функционирования нервной, сердечно-сосудистой и репродуктивной систем (Немова, 2004; Scheuhammer et al., 2015).
Водные экосистемы играют одну из ключевых ролей в биогеохимическом цикле ртути, поступающей сюда в результате прямого осаждения из атмосферы и миграции с латеральным стоком из автономных геохимических ландшафтов (Selin, 2009). В водоемах под воздействием микроорганизмов ртуть переходит в биодоступную форму и вовлекается в пищевые цепи (Нaуnes et al., 2017). С увеличением заболоченности территории водосборного бассейна водоема возрастают уровни содержания ртути в мышцах обитающих в нем рыб (Greenfield et al., 2001).
Полистово-Ловатская болотная система, расположенная на северо-западе Российской Федерации, считается одним из наиболее крупных массивов верховых болот в Европе. Ее водные экосистемы значительно модифицированы в результате жизнедеятельности обыкновенного бобра (Castor fiber L., 1758) (Завьялов, 2015). Благодаря бобровым плотинам стабилизируется уровень воды, и накапливаются органические осадки, вовлекаемые в трофические сети (Collen, Gibson, 2000). В засуху пруды, созданные бобром, выступают в роли рефугиумов для водных обитателей, в том числе водных жесткокрылых (Сажнев, Завьялов, 2018). В бобровых прудах могут ускоряться процессы метелирования ртути, что способствует ее поступлению в локальную пищевую сеть (Roy еt al., 2009). Многие бобровые пруды в пределах Полистово-Ловатской системы безрыбны, тогда позицию верховных хищников в структуре локальных пищевых сетей могут занимать хищные водные жесткокрылые (Arnot et al., 2006).
К настоящему времени исследовано содержание ртути в органах и тканях окуня (Perca fluviatilis L., 1758) – наиболее массового вида рыб в озерах Полистово-Ловатской системы болот (Камшилова и др., 2013). Однако остаются неизвестными уровни накопления ртути водными жуками, занимающими в безрыбных бобровых прудах верхние уровни в локальных пищевых сетях.
Цель работы – изучить особенности накопления ртути у водных жуков, обитающих в безрыбных бобровых прудах в пределах Полистово-Ловатской системы верховых болот.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Материалом послужили сборы водных жесткокрылых в бобровых прудах, расположенных в пределах охранной зоны и на территории заповедника “Рдейский” (Новгородская обл.), занимающего восточную часть Полистово-Ловатской болотной системы (рис. 1).
Рис. 1.
Места сбора проб в бобровых поселениях на территории Рдейского заповедника и его охранной зоны. 1 – обследованные бобровые поселения (пронумерованы), 2 – Полистово-Ловатская болотная система, 3 – границы заповедника, 4 – мелиоративные каналы, 5 – озера, 6 – реки и ручьи.
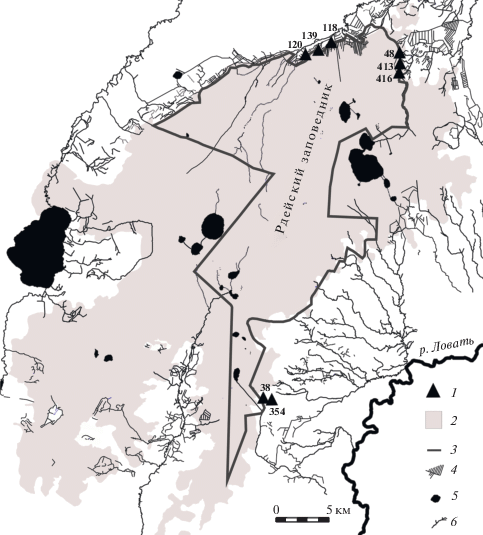
В весенне-раннелетний период 2016 г. (с 27 апреля по 2 мая и с 6 по 14 июня) обследовано восемь поселений обыкновенного бобра (в мелиоративных каналах и мелиорированных малых реках). Эти временные рамки сопоставимы с периодами активности жуков имагинальной стадии, по которой можно точно идентифицировать виды большинства водных жесткокрылых. Для обозначения прудов использована нумерация, принятая в работе Сажнева, Завьялова (2018).
Бобровые пруды № 48, 413 и 416 относятся к бассейну малой р. Редья, они образованы на мелиоративных каналах, выходящих из болота. Пруды № 118, 120 и 139 относятся к системе р. Порусья, среди них пруд № 118 находится ниже по течению, на стыке основного русла реки и крупного магистрального канала, выходящего из болота. Бобровый пруд № 38 напрямую не связан с речными системами. Он расположен на сети каналов в границах краевой топи болота и наиболее близок к болотному массиву. Пруд № 354 образован на основе временного водотока вне болотной системы и наиболее удален от болотного массива. Все изученные пруды безрыбные, и можно предположить, что хищные жесткокрылые занимают в них высшие позиции в структуре локальной пищевой сети.
Исследовано 10 видов водных жесткокрылых (табл. 1) из 63, известных для заповедника (Дядичко, 2013; Сажнев, Завьялов, 2018): девять видов сем. Dytiscidae, относящихся к хищникам на стадиях личинки и имаго, и один вид сем. Hydrophilidae (Hydrochara caraboides (L., 1758)), личинки которого ведут хищный образ жизни, а имаго питаются преимущественно растительными остатками (Archangelsky et al., 2016). Исследованные виды по классификации Петрова (2004) отнесены к II (средняя длина тела 7–18 мм) и III (26–41 мм) размерным классам, различающимся по экологическим и поведенческим параметрам.
Таблица 1.
Объем (экз.) исследованного материала
| Вид | Номер пруда | |||||||
|---|---|---|---|---|---|---|---|---|
| 38 | 48 | 118 | 120 | 139 | 354 | 413 | 416 | |
| II размерный класс | ||||||||
| Acilius canaliculatus (Nicolai, 1822) | 5 | 11 | 1 | 0 | 0 | 10 | 0 | 3 |
| A. sulcatus (L., 1758) | 0 | 2 | 0 | 0 | 1 | 9 | 0 | 2 |
| Graphoderus cinereus (L., 1758) | 0 | 0 | 7 | 0 | 6 | 0 | 0 | 0 |
| Hydaticus aruspex Clark, 1864 | 5 | 0 | 3 | 0 | 6 | 3 | 0 | 0 |
| H. seminiger (De Geer, 1774) | 7 | 0 | 3 | 0 | 4 | 9 | 0 | 3 |
| H. transversalis (Pontoppidan, 1763) | 0 | 0 | 5 | 0 | 0 | 8 | 0 | 5 |
| Hydrochara caraboides (L., 1758) | 0 | 9 | 1 | 0 | 3 | 10 | 0 | 0 |
| III размерный класс | ||||||||
| Dytiscus circumcinctus Ahrens, 1811 | 0 | 0 | 4 | 2 | 3 | 1 | 3 | 3 |
| D. dimidiatus Bersträsser, 1778 | 0 | 0 | 3 | 3 | 3 | 0 | 2 | 1 |
| D. marginalis L., 1758 | 0 | 0 | 3 | 3 | 3 | 3 | 6 | 14 |
| Всего | 17 | 22 | 30 | 8 | 29 | 53 | 11 | 31 |
Содержание ртути в жуках определяли на атомно-абсорбционном спектрометре с зеемановской коррекцией РА–915+, оборудованном пиролитической приставкой ПИРО (“Люмэкс”, Россия). У жуков II размерного класса содержание ртути определяли индивидуально во всем организме, у жуков III размерного класса (род Dytiscus) – в следующих отделах тела: голове и груди (вместе), ногах, крыльях и надкрыльях (вместе), брюшке. Всего исследован 201 экз. жуков (табл. 1).
Точность выполнения анализа контролировали с помощью сертифицированного материала DOLT-1 (Hg = 0.080 ± 0.011 мкг/г сухой массы) и DOLT-2 (Hg = 0.693 ± 0.053 мкг/г сухой массы) (NRC, Канада).
При статистическом анализе для определения зависимости накопления ртути от видовой принадлежности жуков, отдела их тела и местонахождения пруда применяли асимптотический перестановочный тест Фишера–Питмана. Апостериорное сравнение групп проводили с помощью HSD-теста Тьюки. Зависимость накопления ртути от массы тела определяли с помощью рангового коэффициента корреляции Кендалла (τ). Расчеты выполнены в среде статистического анализа R 3.5 с использованием пакета “coin”.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Уровни содержания ртути достоверно различались между видами жуков II размерного класса (χ2 = 32.93, р < 0.01) (рис. 2). У Hydrochara caraboides (сем. Hydrophilidae) выявлено минимальное среднее содержание ртути по сравнению с видами сем. Dytiscidae. Среди Dytiscidae II размерного класса максимальная средняя концентрация ртути отмечена у Graphoderus cinereus (L., 1758), минимальная – у Acilius sulcatus (L., 1758).
Рис. 2.
Накопление ртути у жуков различных видов: средняя линия – медиана, верхняя и нижняя границы “ящика” – первый (Q1) и третий (Q3) квартиль, “усы” – наблюдаемые минимум (Q1–1.5 (Q3–Q1)) и максимум (Q3 + 1.5 (Q3–Q1)), точки – выбросы. Ширина “ящика” пропорциональна объему выборки. 1 – Graphoderus cinereus, 2 – Hydaticus transversalis, 3 – Acilius canaliculatus, 4 – Hydaticus seminiger, 5 – Hydaticus aruspex, 6 – A. sulcatus, 7 – Hydrochara caraboides.

У жуков II размерного класса зарегистрирована общая закономерность в изменении уровня содержания ртути у экземпляров из разных прудов (табл. 2). Максимальные концентрации отмечены у жуков из прудов № 38 и 118, минимальные – из пруда № 354. Промежуточное между предельными значениями содержание ртути выявлено у жуков из прудов № 48, 139 и 416. Исключение составляют Acilius sulcatus и Hydaticus seminiger (De Geer, 1774), у которых различия между особями из разных прудов по содержанию ртути не достоверны.
Таблица 2.
Содержание ртути (мкг/г сухой массы) у жуков II размерного класса различных видов из отдельных бобровых прудов
| Вид | Номер пруда | |||||||
|---|---|---|---|---|---|---|---|---|
| 38 | 48 | 120 | 118 | 139 | 354 | 413 | 416 | |
| Acilius canaliculatus | 0.272a | 0.208ab | – | 0.320a | – | 0.129ab | – | 0.215ab |
| A. sulcatus | – | 0.157a | – | – | 0.151a | 0.089a | – | 0.169a |
| Graphoderus cinereus | – | – | – | 0.320a | 0.188b | – | – | – |
| Hydaticus aruspex | 0.438a | – | – | 0.267ab | 0.151b | 0.091b | – | – |
| H. seminiger | 0.155a | – | – | 0.205a | 0.195a | 0.208a | – | 0.193a |
| H. transversalis | – | – | – | 0.309a | – | 0.153b | – | 0.212ab |
| Hydrochara caraboides | 0.153a | 0.101b | – | – | 0.086bc | 0.076c | – | – |
| Dytiscus circumcinctus | – | – | 0.173a | 0.262a | 0.209a | 0.141a | 0.19a | 0.229a |
| D. dimidiatus | – | – | 0.155a | 0.229a | 0.144a | – | 0.197a | 0.162a |
| D. marginalis | – | – | 0.224ab | 0.279a | 0.171ab | 0.101b | 0.192ab | 0.228ab |
Между видами рода Dytiscus (III размерный класс) из одного пруда достоверных различий по содержанию ртути не было обнаружено (χ2 = 2.07, р = 0.355). Концентрация ртути в отделах тела у D. сircumcinctus Ahrens, 1811 и D. marginalis L., 1758 увеличивалась в ряду: крылья + надкрылья–ноги–голова + грудь–брюшко (табл. 3). Причем, концентрации ртути в крыльях + надкрылья и ногах была достоверно ниже, чем в голове + грудь и брюшке. У D. dimidiatus Bersträsser, 1778, напротив, концентрация ртути в голове + + грудь выше, чем в брюшке, и значения ртути во всех отделах тела достоверно различаются между собой.
Таблица 3.
Содержание ртути (мкг/г сухой массы) в отделах тела жуков рода Dytiscus (III размерный класс)
| Вид | Отдел тела | |||
|---|---|---|---|---|
| брюшко | голова+грудь | ноги | крылья+надкрылья | |
| D. circumcinctus | 0.256a | 0.235a | 0.147b | 0.091b |
| D. dimidiatus | 0.199ab | 0.231a | 0.127bc | 0.101c |
| D. marginalis | 0.249a | 0.236a | 0.136b | 0.093b |
Содержание ртути у трех видов рода Dytiscus из разных прудов также достоверно различалось (χ2 = 33.7, р < 0.05), хотя и в меньшей степени, чем у жуков II размерного класса. Максимальные показатели были зарегистрированы в пруду № 118, минимальные – в пруду № 354 (табл. 2). Среди остальных прудов по убыванию накопления ртути в жуках выделены две группы: № 416, 120 и № 139, 413.
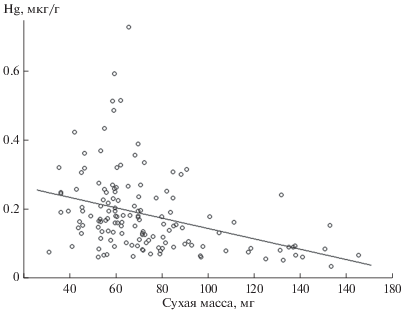
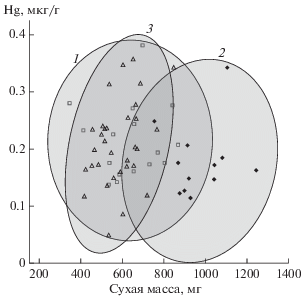
Концентрация ртути в жуках II размерного класса отрицательно коррелирует с сухой массой тела (τ = –5.7, p < 0.05) (рис. 3). Достоверная связь сухой массы тела с концентрацией ртути у жуков рода Dytiscus не выявлена (τ = 0.019, p = 0.98), однако, паттерны зависимости между этими показателями различаются между видами (рис. 4). Вид D. circumcinctus характеризуется наиболее широким размахом между предельными концентрациями ртути по сравнению с другими видами рода. Максимальная сухая масса зарегистрирована у D. dimidiatus.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Полученное среднее содержание ртути в расчете на сухую массу водных жуков из безрыбных бобровых прудов оказалось в 1.5–3 раза ниже такового в мышцах окуня из большинства исследованных озер Полистово-Ловатской системы болот (Камшилова и др., 2013). Максимальная концентрация ртути у отдельных экземпляров жуков, сопоставима с минимальной индивидуальной концентрацией ртути у окуня.
Расположение водоема в каскадной структуре местных геохимических ландшафтов определяет уровень содержания ртути в жуках из разных бобровых прудов Рдейского заповедника. Максимальные значения содержания ртути у жуков II размерного класса в пруду № 38, вероятно, обусловлены его наиболее близким расположением к болотному массиву, откуда с поверхностным стоком поступает больше растворенных органических соединений, и реакция среды смещена в кислую сторону. Отдаленное расположение пруда № 354 от болотного массива, наоборот, приводит к минимальному накоплению ртути в организме обитающих здесь жуков. Наиболее богатый, по сравнению с другими прудами, видовой состав водных жуков (39 видов), также свидетельствует о наличии в этом водоеме более благоприятных условий для данной группы насекомых (Сажнев, Завьялов, 2018).
Повышенные концентрации ртути в жуках из пруда № 118, возможно, связаны с его подчиненным положением в местных ландшафтах. Это предположение согласуется с результатами исследований накопления ртути беспозвоночными бобровых прудов на юге Канады, где было показано, что содержание ртути в животных, отловленных в нижнем течении от бобрового пруда, достоверно выше, чем у животных, обитающих в верхнем течении (Painter et al., 2015; Roy et al., 2009).
Тип питания у членистоногих из одних и тех же местообитаний определяет уровень накопления ртути в организме. Хищные и всеядные виды накапливают достоверно больше ртути, по сравнению с растительноядными (Razavi et al., 2019). Поэтому минимальное накопление металла имаго Hydrochara caraboides (Hydrophilidae), по сравнению с жуками сем. Dytiscidae, обусловлено тем, что вид хищничает на стадии личинки, а имаго питается преимущественно растительными остатками (Archangelsky et al., 2016). Рассмотренные виды жесткокрылых сем. Dytiscidae ведут хищный образ жизни и на стадии личинки, и на стадии имаго.
Установлено, что в исследованных прудах близкие виды – представители одного из родов Acilius и Hydaticus – с разной интенсивностью накапливают металл. Это свидетельствует о принципиальных различиях в их питании, что, вероятно, обеспечивает возможность синтопного обитания. Наибольший размах концентрации ртути у Dytiscus circumcinctus, по сравнению с другими видами рода, по-видимому, обусловлен более широким спектром питания, поскольку известно, что содержание ртути у животных одного вида разнится в большом диапазоне из-за разнообразного рациона (Rodenhouse et al., 2019; Wu et al., 2019).
Представители сем. Dytiscidae II размерного класса c относительно меньшей массой тела интенсивнее накапливают ртуть, чем более крупные представители этой размерной группы. Такие результаты согласуются с полученными при изучении прибрежных пауков на северо-востоке США, когда более крупные экземпляры накапливали достоверно меньше ртути, по сравнению с мелкими (Pennuto, Smith, 2015). Наблюдаемая тенденция может быть следствием более высокой скорости метаболизма у видов мелких размеров, требующей употребления большего количество пищи, по сравнению с крупными жуками (Culler et al., 2014). При одинаковом количестве потребленной пищи более высокие значения концентрации ртути у мелких жуков могут быть обусловлены поступлением большего количества ртути на единицу массы тела, в то время как у более крупных видов жуков отмечается эффект биологического разбавления, ранее описанный у рыб (Depew et al., 2013).
Неоднородное накопление ртути разными отделами тела у жуков рода Dytiscus характерно для большинства беспозвоночных и позвоночных животных. Исследования Dytiscus и Cybister из водоема Липецкой обл. показали сходные результаты – в брюшке отмечены достоверно большие концентрации, по сравнению с остальными отделами тела (Udodenko et al., 2019). Неравномерная аккумуляция ртути разными отделами тела ранее зарегистрирована у нехищных насекомых. Так, у перелетной саранчи (Locusta migratoria L., 1758) концентрация ртути в брюшке превышала таковую в голове и груди в 1.5–2 раза (Zheng et al., 2008). Меньшие значения концентрации ртути, отмеченные в тканях ног, надкрыльев и крыльев жуков обусловлены большей долей в этих отделах хитинизированных тканей, слабо аккумулирующих ртуть (Clarkson, Magos, 2006), в то время, как в состав тканей головы, груди и брюшка входят белки, содержащие сульфигидрильные группы и аминогруппы, с которыми ртуть способна образовывать ковалентные связи (Немова, 2004).
Выводы. Концентрации ртути в имаго исследованных видов водных жуков, обитающих в бобровых прудах Полистово-Ловатской системы болот, варьируют в широких пределах и ниже, чем в мышцах окуня. Минимальная концентрация отмечена у Hydrochara caraboides (Hydrophilidae), питающегося на стадии имаго растительными остатками, у девяти видов Dytiscidae, ведущих хищнический образ жизни на стадиях личинки и имаго, среднее содержание ртути в 1.5–2.5 раза выше. Виды Dytiscidae II размерного класса различались по уровню содержания ртути, у видов рода Dytiscus более крупного III размерного класса такие различия не обнаружены. У жуков II размерного класса выявлена связь между массой тела и содержанием в нем ртути – с увеличением массы концентрация ртути в организме уменьшается. Содержание ртути в различных отделах тела у жуков рода Dytiscus неоднородно, низкие концентрации отмечены в отделах тела с высокой долей хитина в составе тканей – ногах, крыльях и надкрыльях, более высокие – в брюшке или голове с грудью, в составе которых помимо хитина присутствуют белки.
Список литературы
Дядичко В.Г. 2013. Водные жуки подотряда Adephaga (Coleoptera) Полистово-Ловатской болотной системы: видовой состав, биотопическое распределение, особенности биологии // Тр. Гос. природ. заповед. “Рдейский”. Вып. 2. Великий Новгород: Типография “Виконт”. С. 69.
Завьялов Н.А. 2015. Средообразующая деятельность бобра (Castor fiber L.) в европейской части России // Тр. Гос. природ. заповед. “Рдейский”. Вып. 3. Великий Новгород: Типография “Виконт”.
Камшилова Т.Б., Комов В.Т., Гремячих В.А. 2013. Накопление ртути в мышцах и темпы роста окуня (Perca fluviatilis) из озер Полистово-Ловатского верхового болотного массива // Вода: химия и экология. № 12. С. 58.
Комов В.Т., Гремячих В.А., Удоденко Ю.Г. и др. 2017. Ртуть в абиотических и биотических компонентах водных и наземных экосистем посёлка городского типа на берегу Рыбинского водохранилища // Тр. Ин-та биол. внутр. вод РАН. № 77(80). С. 34.
Немова Н.Н. 2004. Биохимические эффекты накопления ртути в рыбе. Москва: Наука.
Петров П.Н. 2004. Водные жесткокрылые подотряда Adephaga (Coleoptera) Урала и Западной Сибири: Автореф. дис. … канд. биол. наук. Москва.
Сажнев А.С., Завьялов Н.А. 2018. Фауна и экология водных жесткокрылых бобровых прудов Рдейского заповедника // Бобры в заповедниках европейской части России // Тр. Гос. природ. заповед. “Рдейский”. Т. 4. Великие Луки: Великолукская типография. С. 423.
Archangelsky M., Beutel R.B., Komarek A. 2016. Hydrophilidae (Chapter 12.1) // Handbook of Zoology. Coleoptera, Beetles. V. 1. Berlin: De Gryuter. P. 236.
Arnott S.E., Jackson A., Alarie Y. 2006. The distribution and potential effects of water beetles in lakes recovering from acidification // J. North Am. Bentholog. Soc. V. 25. № 4. P. 811.
Buck D.G., Evers D.C., Adams E. et al. 2019. A global-scale assessment of fish mercury concentrations and the identification of biological hotspots // Sci. Total Environ. № 687. P. 956. https://doi.org/10.1016/j.scitotenv.2019.06.159
Clarkson T.W., Magos L. 2006. The toxicology of mercury and its chemical compounds // Crit. Rev. Toxicol. V. 36. P. 609. https://doi.org/10.1080/10408440600845619
Collen P., Gibson R.J. 2000. The general ecology of beavers (Castor spp.), as related to their influence on stream ecosystems and riparian habitats, and subsequent effects on fish – a review // Rev. Fish Biol. Fishery. V. 10. P. 439. https://doi.org/10.1023/A:1012262217012
Culler L.E., Shin-ya O., Crumrine P. 2014. Predator-prey interactions of Dytiscids (Chapter 8) // Ecology, systematics, and the natural history of predaceous diving beetles (Coleoptera: Dytiscidae). Dordrecht: Springer. P. 363.
Depew D.C., Burgess N.M., Anderson M.R. et al. 2013. An overview of mercury concentrations in freshwater fish species: a nationalfish mercury dataset for Canada // Can. J. Fish Aquat. Sci. № 70. P. 436. https://doi.org/10.1139/cjfas-2012-0338
Driscoll C.T., Mason R.P., Chan H.M. et al. 2013. Mercury as a global pollutant: sources, pathways, and effects // Environ. Sci. Technol. V. 47. P. 4967. https://doi.org/10.1021/es305071v
Greenfield B.K., Hrabik T.R., Harvey C.J., Carpenter S.R. 2001. Predicting mercury levels in yellow perch: use of water chemistry, trophic ecology, and spatial traits // Can. J. Fish Aquat. Sci. V. 58. № 7. P. 1419. https://doi.org/10.1139/f01-088
Haynes K.M., Kane E.S., Potvin L. et al. 2017. Mobility and transport of mercury and methylmercury in peat as a function of changes in water table regime and plant functional groups // Global Biogeochem. Cycles. V. 31. № 2. P. 233.
Lobus, N.V., Komov, V.T. 2016. Mercury in the muscle tissue of fish in the Central and South Vietnam // Inland Water Biol. V. 9. № 3. P. 319–328. https://doi.org/10.1134/S1995082916030159
Painter K.J., Westbrook C.J., Hall B.D. et al. 2015. Effects of in channel beaver impoundments on mercury bioaccumulation in Rocky Mountain stream food webs // Ecosphere. V. 6. № 10. P. 1. https://doi.org/10.1890/ES15-00167.1
Pennuto C.M., Smith M. 2015. From Midges to Spiders: Mercury Biotransport in Riparian Zones Near the Buffalo River Area of Concern (AOC), USA // Bull. Environ. Contamin. Toxicol. V. 95. № 6. P. 701. https://doi.org/10.1007/s00128-015-1658-6
Razavi N.R., Cushman S.F., Halfman J.D. 2019. Mercury bioaccumulation in stream food webs of the Finger Lakes in central New York State, USA // Ecotoxicol. Environ. Saf. № 172. P. 265. https://doi.org/10.1016/j.ecoenv.2019.01.060
Rodenhouse N.L., Lowe W.H., Gebauer R.L. 2019. Mercury bioaccumulation in temperate forest food webs associated with headwater streams // Sci. Total Environ. V. 665. P. 1125. https://doi.org/10.1016/j.scitotenv.2019.02.151
Roy V., Amyot M., Carignan R. 2009. Beaver ponds increase methylmercury concentrations in Canadian shield streams along vegetation and pond-age gradients // Environ. Sci. Technol. V. 43. № 15. P. 5605. https://doi.org/10.1021/es901193x
Scheuhammer A., Braune B., Chan H.M. et al. 2015. Recent progress on our understanding of the biological effects of mercury in fish and wildlife in the Canadian Arctic // Sci. Total Environ. V. 509–510. P. 91. https://doi.org/10.1016/j.scitotenv.2014.05.142
Selin N.E. 2009. Global Biogeochemical Cycling of Mercury: A Review // Ann. Rev. Environ. Res. № 34. P. 43. https://doi.org/10.1146/annurev.environ.051308.084314
Udodenko Yu.G., Seleznev D.G., Prokin A.A. et al. 2019. Mercury accumulation in adults of two large species of diving beetles (Coleoptera: Dytiscidae) // Russ. Entomol. J. V. 28. № 1. P. 23. https://doi.org/10.15298/rusentj.28.1.04
UN Environment. 2019. Global Mercury Assessment 2018. UN Environment Programme, Chemicals and Health Branch Geneva, Switzerland.
Wiener J.G., Krabbenhoft D.P., Heinz G.H., Scheuhammer A.M. 2002. Ecotoxicology of mercury // Handbook of Ecotoxicology. FL: CRC Press, Boca Raton. P. 409.
Wu P., Kainz M., Åkerblom S. et al. 2019. Terrestrial diet influences mercury bioaccumulation in zooplankton and macroinvertebrates in lakes with differing dissolved organic carbon concentrations // Sci. Total Environ. V. 669. P. 821. https://doi.org/10.1016/j.scitotenv.2019.03.171
Zheng D.-M., Wang Q.-C., Zhang Z.-S. et al. 2008. Bioaccumulation of Total and Methyl Mercury by Arthropods // Bull. Environ. Contam. Toxicol. № 81. P. 95. https://doi.org/10.1007/s00128-008-9393-x
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод