Биология внутренних вод, 2020, № 6, стр. 600-611
Структурная организация белков плазмы как фактор капиллярной фильтрации в группе Pisces (Обзор)
А. М. Андреева *
Институт биологии внутренних вод им И.Д. Папанина Российской академии наук
пос. Борок, Некоузский р-н, Ярославская обл., Россия
* E-mail: aam@ibiw.ru
Поступила в редакцию 05.12.2019
После доработки 04.03.2020
Принята к публикации 01.06.2020
Аннотация
Исследования капиллярной фильтрации, поддерживающей изотонию внеклеточных жидкостей в организме позвоночных, принято рассматривать в формате “обновленной” гипотезы Старлинга, разработанной на наземных позвоночных. Баланс внеклеточной жидкости в организме эта гипотеза объясняет сбалансированностью гидростатического и онкотического давления плазмы и интерстициальной жидкости (силы Старлинга) и ключевой ролью белков плазмы в обеспечении капиллярного водного трансфера. Модель исходит из внутрисосудистой локализации белков плазмы и доминирующего (до 80%) вклада альбумина в ее онкотическое давление. У рыб из-за отсутствия антигравитационных приспособлений полное признание сил Старлинга считается некорректным. В обзоре обсуждается особая “безальбуминовая” модель капиллярной фильтрации для водных низших позвоночных. Подобно классической, она исходит из ключевой роли белков плазмы в водном трансфере, но в то же время учитывает такие особенности рыб, как высокая концентрация общего белка в интерстиции, высокое содержание белков-олигомеров и отсутствие альбумина (или его слабое влияние на водный гомеостаз). Олигомерным белкам отводится важная роль в поддержании изотонии жидкостей за счет их реорганизаций по типу ассоциаций/диссоциаций, которые, предположительно, способствуют “выравниванию” осмоляльностей жидкостей по обе стороны стенки капилляра и поддержанию их изотонии в широком диапазоне условий среды.
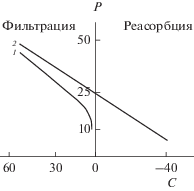
Рыбы относятся к наиболее процветающей группе позвоночных, не имеющей себе равных по разнообразию занимаемых экологических ниш. Наиболее пластичная, с точки зрения экологии, группа костистых рыб (Teleostei) заселила пресные воды, моря и акватории с колеблющейся соленостью. Ключевую роль в этом сыграли эффективные механизмы осморегуляции. Водно-солевой обмен у стеногалинных Teleostei реализуется посредством противоположных стратегий – гиперосмотической (в пресной воде) и гипоосмотической (в море); у эвригалинных видов при изменении солености воды эти стратегии сменяют друг друга (Мартемьянов, 2013). Перечисленные механизмы отвечают за водно-солевой обмен, прежде всего, между организмом и внешней средой. Внутри организма поддержание осмотического гомеостаза обеспечивает жидкая среда организма. Поддержание изотонии всех внеклеточных жидкостей в составе жидкой среды организма обеспечивает капиллярный обмен (КО). Сформулированные Старлингом в конце XIX столетия положения о движении внеклеточной жидкости через капиллярную стенку легли в основу гипотезы КО у позвоночных. Согласно гипотезе, вода внутри организма проникает во все компартменты и клетки, а распределение солей между внутри- и внесосудистыми жидкостями регулируется белками в соответствии с эффектом Гиббса–Доннана (Bianchetti et al., 2009; Jacob et al., 2016; Nguyen, Kurtz, 2004, 2006; Nguyen et al., 2014). КФ жидкости, как часть КО, обеспечивает перемещение воды из плазмы в интерстиций (рис. 1), участвуя в поддержании изотонии внеклеточных жидкостей организма.
Рис. 1.
Фильтрация и реабсорбция жидкости в норме (1) и при кратковременном снижении давления в капилляре (2). С – поток жидкости на единицу площади капиллярной стенки в (мкм с–1) × 103; Р – гидростатическое давление в капилляре в смН2О (по: Michel, Phillips, 1987).
В обзоре рассматриваются вопросы участия белков плазмы в стабилизации КФ у рыб и причины, по которым процессы их капиллярного обмена не вписываются в формат “обновленной” гипотезы Старлинга. На обсуждение выносится оригинальная гипотеза “безальбуминовой” КФ и соответствующая ей модель на примере группы Teleostei.
Развитие представлений о капиллярном обмене позвоночных. Белки плазмы – ключевой фактор капиллярной фильтрации жидкости
Исследования в области КО и КФ принято рассматривать в формате “обновленной” гипотезы капиллярного обмена Старлинга. В 1896 г. появилась статья Старлинга (Starling, 1896), идеи которой легли в основу современных представлений о КО. На модели собаки Старлинг описал перемещение тканевой жидкости в кровь и представил доказательства в пользу данного феномена. В основе гипотезы было предположение о полной проницаемости сосудов для воды и дифференциальной проницаемости стенок микрососудов для небольших молекул (соли, глюкоза) и макромолекул (белки). Первые свободно обменивались через стенку капилляра, а перемещения вторых были ограничены. Автор отметил значительное превышение концентрации белка в плазме над интерстицием и предположил, что эта разница лежит в основе осмотического давления, противодействующего бóльшему гидростатическому давлению в капиллярах, чем в ткани. Эти силы Старлинга – силы гидростатического давления и КОД плазмы и интерстициальной жидкости – основные движущие силы КО. Высказано предположение, что баланс между ними удерживает кровь в системе кровообращения и реализуется в разнонаправленных процессах фильтрации и реабсорбции жидкости (рис. 1).
Позднее установлено, что в большинстве капилляров происходит только фильтрация, но при падении капиллярного давления “запускается” реабсорбция, восстанавливающая баланс внеклеточной жидкости (Michel, 1997). Роль белков плазмы в КО определялась Старлингом как “ключевая”. Она заключалась в удержании белками воды внутри сосудов и поддержании коллоидно-осмотического давления плазмы и волемии сосудов. Баланс КОД и гидростатического давления регулировал водный капиллярный поток и, в конечном счете, способствовал поддержанию изотонии внеклеточной жидкости в организме.
“Обновление” гипотезы Старлинга было связано с обнаружением ряда фактов. В их числе: установление проникновения белков плазмы в интерстиций с помощью пассивных механизмов конвекции и диффузии через поры между эндотелиальными клетками (Adamson et al., 2004; Michel, 1997; Rosengren et al., 2004; Sarin, 2010; Weinbaum, 1998) и с помощью трансэндотелиальной мембрано-связанной тубулярно-везикулярной системы эндотелия (Bendayan, Rasio, 1996, 1997). Белки в интерстиции найдены благодаря усовершенствованной технике электронной микроскопии (Dvorak et al., 1996; Schatzki, Newsome, 1975; Shaklai, Tavassoli, 1982; Sharov, 1981; Ueda et al., 2001). Далее получены доказательства влияния на белковый трансфер эндотелиального гликокаликса, выполняющего функцию “молекулярного сита” (Chappell, Jacob, 2014; Curry, Adamson, 2012). Ранее считали, что скопление белка в интерстиции негативно сказывается на эффективности КФ жидкости из-за снижения величины градиента концентрации белка между плазмой и интерстициальной жидкостью.
(1)
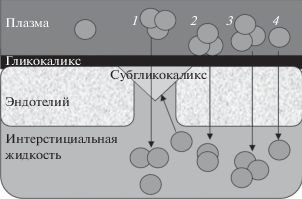
$\begin{gathered} {\text{Сила фильтрации}} = \\ = \left( {{{P}_{{{\text{пл}}}}} - {{Р}_{{{\text{иж}}}}}} \right) - \sigma \left( {{{П}_{{{\text{пл}}}}} - {{П}_{{{\text{иж}}}}}} \right), \\ \end{gathered} $Однако в свете установления особой роли гликокаликса в белковом трансфере отмечено, что эффективность КФ жидкости определяется распределением белка относительно гликокаликса. Независимо от концентрации белка в интерстиции, таковая в “защищенной” субгликокаликсной зоне, расположенной непосредственно под гликокаликсом, поддерживается на низком уровне, вследствие чего величина градиента белка между плазмой и субгликокаликсной зоной всегда достаточно высока для обеспечения эффективной фильтрации жидкости (Adamson et al., 2004; Levick, Michel, 2010; Curry, Adamson, 2012; Chappell, Jacob, 2014) (рис. 2). Соответственно, первоначальные расчеты величины силы фильтрации (1) были пересмотрены и в обновленной версии (2) параметр онкотического давления интерстициальной жидкости (Пиж) был заменен на параметр онкотического давления жидкости в субгликокаликсной зоне (Пг) (Levick, Michel, 2010).
(2)
$\begin{gathered} {\text{Cила фильтрации}} = \\ = \left( {{{P}_{{{\text{пл}}}}} - {{Р}_{{{\text{иж}}}}}} \right) - \sigma \left( {{{П}_{{{\text{пл}}}}} - {{П}_{{\text{г}}}}} \right), \\ \end{gathered} $Рис. 2.
Пути перемещения белка из плазмы в интерстициальное и субгликокаликсное (выделено треугольником) пространствo через малые поры (1) и трансваскулярно через большие поры (2–4) (по: (Levick, Michel, 2010) с изменениями, касающимися структурных реорганизаций олигомерных белков в ходе фильтрации через капиллярную стенку (Andreeva, 2019)).
Особенности капиллярного обмена у наземных позвоночных и рыб
Основные положения гипотезы Старлинга разработаны на представителях наземных позвоночных – млекопитающих и, отчасти, земноводных (Michel, 1997). Применение положений гипотезы к рыбам было проблематичным из-за наличия у них особых черт в процессах микроциркуляции (Olson et al., 2003; Soldatov, 2006). В работе Oлсона (Olson et al., 2003) отмечены этапы становления сердечно-сосудистой системы в эволюции позвоночных. Сердечно-сосудистая система водных низших позвоночных не имела противогравитационных приспособлений. Сохранив в относительно неизменном виде ряд функций, обеспечивающих конвективные процессы в организме (функцию миокарда, венозную емкость и вазорегуляторные сигнальные механизмы), наземные позвоночные выработали ряд противогравитационных приспособлений в виде повышенного давления крови и венозных рефлексов. Для поддержания высокого давления стенка капилляра млекопитающих выполняет в отношении белков функцию барьера.
Рыбы как водные обитатели за редким исключением (тунцы) не нуждаются в высоком давлении крови (Olson, 1997). Тестирование рыб по величинам концентрации белка в тканевых жидкостях, распределению белка относительно стенки капилляра и коэффициенту отражения (σ) выявило их “аномальный” характер (Andreeva et al., 2015а, 2017; Bushnell et al., 1998; Kiernan, Contestabile, 1980; Olson, 1992; Phillips, 2003). В тканевых жидкостях рыб содержание белка варьирует от “следов” до величин, превышающих концентрацию белка в плазме; вследствие этого, высока изменчивость и величины градиента концентрации белка между плазмой и интерстицием (Andreeva, 2012; Andreeva et al., 2015а, 2017, 2019). Эти “аномалии” могут быть следствием отсутствия у рыб настоящей лимфатической системы, снабженной клапанами для направленного оттока лимфы (Kotlowska et al., 2013), или низкой скорости кровообращения и сопутствующего усиления диффузии белка плазмы в тканевое пространство, или сезонной вариабельности КФ белка (Andreeva et al., 2019). Первые две особенности способствуют “скоплению” белка в интерстиции, что определяет невысокие величины градиента концентрации белка относительно стенки капилляра. Без учета роли гликокаликса этот феномен традиционно трактуется в контексте незначительности вклада белков плазмы в КФ жидкости (Olson et al., 2003). Но имеющиеся в настоящее время сведения позволяют считать гликокаликс неотъемлемой частью сосудистой системы всех позвоночных, включая рыб (Aamelfot et al., 2014; Gorsi et al., 2014; Harfouche et al., 2009), и предполагать его участие в КФ белков. Тем не менее гипотеза Старлинга не отвечает на вопрос, какие последствия может иметь скопление белка в интерстиции. Ответ на него дает “безальбуминовая” модель КФ. Однако ее представление требует предварительного рассмотрения структуры протеома плазмы рыб.
Организация протеома плазмы позвоночных
Современные технологии 2D-электрофореза, жидкостной хроматографии и масс-спектрометрии MALDI подтвердили существующие с середины прошлого столетия представления о консервативной структуре протеома плазмы всех позвоночных и высокий уровень совпадения аминокислотных последовательностей гомологичных белков (Anderson et al., 2004; Babaei et al., 2013; Liotta, Petricoin, 2006; Lucitt et al., 2008). Фракционный состав белков плазмы по Тизелиусу (Tiselius, 1937) считается единым для позвоночных и включает α-, β- и γ-глобулины и низкомолекулярную фракцию. Последняя демонстрирует значительное разнообразие: у млекопитающих она представлена альбумином и транстиретином, у рыб – высокогетерогенной, вариабельной и лишенной альбумина (у высших костистых) системой (Moore, 1945; Deutsch, McSchan, 1949; Кирпичников, 1987; Power et al., 2000; Wicher, Fries, 2006; Li et al., 2016).
До развертывания геномных исследований альбуминами считали высокогидратированные и высокоподвижные в электрофорезе белки, а в настоящее время их характеризуют как белки с определенными элементами структуры (домены) и строгой архитектуры S-S-связей, кодируемые гомологичными генами. По принципу гомологии в суперсемейство альбуминоидов попадают также афамин, фетопротеин, витамин D-связывающий белок и белок внеклеточного матрикса (Andreeva, 2019; Li et al., 2017). У рыб гены альбумина выявлены только в группах древних (Dipnoi), примитивных (Petromyzontiformes) и низших костистых рыб (Osteoglossiformes, Esociformes, Salmoniformes) (Andreeva, 2019; Byrnes, Gannon, 1990; Pasquier et al., 2016; Salem et al., 2010). В самой пластичной, с точки зрения экологии, группе высших Teleostei ген альбумина не обнаружен. Вероятной причиной этого может быть третья полногеномная дупликация, затронувшая из всех позвоночных только костистых, при этом ген альбумина потеряли только высшие Teleostei (Braasch et al., 2016; Noel et al., 2010; Pasquier et al., 2016).
“Истинные” и “транзитные”, мономерные и олигомерные белки плазмы
В гипотезе Старлинга под белками плазмы подразумеваются “истинные” белки плазмы, которые выполняют в системе кровообращения специфические функции и прежде всего создают онкотическое давление. Они присутствуют в плазме в достаточно высоких концентрациях и снабжены в структуре пробелка сигнальным пептидом, предопределяющим их внеклеточную локализацию (Schulz, Schirmer, 1979). “Транзитные” белки, как правило внутриклеточные, поступают в систему кровообращения вследствие разрушения клеток организма и микроорганизмов; их концентрация в крови незначительна, соответственно вклад в онкотическое давление плазмы не существенен (Anderson et al., 2004; Liotta, Petricoin, 2006).
По типу структурной организации белки разделяют на мономеры и олигомеры. Мономеры состоят из одной, или нескольких связанных ковалентно полипептидных цепей. Олигомеры состоят из нескольких цепей, связанных нековалентно; такая структура под влиянием среды может распадаться на отдельные субъединицы или, наоборот, агрегировать. Если “транзитные” белки могут иметь любую организацию (мономеры, олигомеры), то “истинные” белки плазмы организованы по типу крупных мономеров с Mr ≥ 60 кДа (Schulz, Schirmer, 1979). Это позволяет им не сразу фильтроваться в интерстиций, а задерживаться внутри сосудов, создавая КОД плазмы, регулирующее водный капиллярный трансфер (рис. 3). Олигомеры, в отличие от мономеров, не являются надежными факторами осморегуляции, поскольку при изменении условий могут распадаться на субъединицы, легко фильтрующиеся в интерстиций, вызывая нежелательные осмотические эффекты в виде снижения КОД плазмы, тканевых отеков и др. Однако именно белки-олигомеры доминируют в протеоме плазмы Teleostei (Andreeva et al., 2015b; Андреева, 2017; Andreeva, 2019). Они в обилии представлены на протеомных картах плазмы в зоне ЛПВП. Их содержание в плазме Teleostei достигает 30–36% всего белка плазмы (Andreeva et al., 2019; Babin, Vernier, 1987; Li et al., 2016), что выше концентрации альбумина (до 28%) в крови низших Teleostei (Metcalf et al., 1998a, 1998b; Xu, Ding, 2005). Олигомеры представлены структурными вариантами аполипопротеинов АроА-I и Apo-14 (14 kDa apolipoprotein), ассоциированных с липидами в составе ЛПВП (Andreeva et al., 2019). Описаны нативные ЛПВП с Mr 50, 60, 85, 90, 110, 120 и 125 кДа; в них АроА олигомеры организованы до октамеров включительно (Андреева, 2017; Andreeva et al., 2019); содержание свободных А-I, не связанных с ЛПВП, достигает ~7–10% от общего пула A-I (Brouilette, Anantharamaiah, 1995).
Рис. 3.
Разные сценарии участия белков в поддержании изотонии плазмы и интерстициальной жидкости
у гомойотермных (а) и пойкилотермных (б, в) позвоночных: а – Mammalia: плазма содержит
альбумин, в интерстиции белка нет; жидкости изотоничны, б – Teleostei: исходно плазма
содержит белки-олигомеры (показаны гексамеры), в интерстиции белка нет; жидкости изотоничны.
При изменении условий среды гексамеры диссоциируют на тримеры; изотония жидкостей
нарушена, в – Teleostei: исходно и плазма, и интерстиций содержат белки-олигомеры
– гексамеры и димеры соответственно; жидкости изотоничны. При изменении условий: в
одном случае гексамеры плазмы диссоциируют на тримеры, в интерстиции часть димеров
диссоциирует на мономеры; в другом случае гексамеры плазмы диссоциируют на димеры,
а в интерстиции димеры диссоциируют на мономеры; жидкости изотоничны.  – белки-мономеры,
– белки-мономеры, 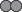 – белки-олигомеры,
– белки-олигомеры,  – небелковые осмолиты. Nпл – число осмотически активных частиц в плазме, Nиж – то же в интерстициальной жидкости.
– небелковые осмолиты. Nпл – число осмотически активных частиц в плазме, Nиж – то же в интерстициальной жидкости.
Доминирование олигомеров в крови Teleostei и скопление белка в интерстиции – факторы, не учитываемые “обновленной” гипотезой Старлинга, которая исходит из белков-мономеров и их низкого содержания в интерстиции.
“Альбуминовая” и “безальбуминовая” модели капиллярной фильтрации
“Альбуминовая” модель. Организация альбумина характеризует его как осмотически активный белок. В соответствии с уравнением Вант-Гоффа для коллоидных растворов (Детлаф, Яворский, 1989), создаваемое белком КОД зависит от значений концентрации и Mr: чем выше концентрация белка в плазме и ниже величина его Mr, тем выше КОД. Концентрация альбумина в плазме Mammalia достигает 50 г/л или ~60% общего белка (Anguizola et al., 2013; Dziegielewska et al., 1980; Majorek et al., 2012); сывороточный альбумин человека имеет Mr ~ 67 кДа и компактные размеры глобулы ~140 × 40 Å (Kragh-Hansen, 1990). Важный фактор осмотической активности альбумина – высокая плотность отрицательного заряда на гидрофильной поверхности глобулы. Вследствие этого он способен притягивать и удерживать неорганические катионы, создавая их “перевес” в плазме по сравнению с интерстициальной жидкостью из-за более высокого содержания белка во внутрисосудистом пространстве. Известный как эффект Гиббса–Доннана, этот, обеспеченный белками “перевес” катионов в пространстве, ограниченном полупроницаемой мембраной, позволяет удерживать воду внутри сосуда и создавать КОД плазмы (Nguyen, Kurtz, 2006). Все эти особенности обеспечили высокий вклад альбумина в осмотический эффект плазмы (~80%) (Levitt, Levitt, 2016), однако, реализуется он только при существенном перевесе содержания общего белка в плазме над таковым в интерстиции (рис. 3а).
“Безальбуминовая” модель. Для рыб характерен широкий диапазон значений содержания белка в интерстиции (Andreeva et al., 2019) – от почти полного его отсутствия (рис. 3б) до величин, сопоставимых с его содержанием в плазме (Duff, Olson, 1989; Bushnell et al., 1998; Olson, 1992; Olson et al., 2003; Phillips, 2003; Andreeva et al., 2017) и выше таковых (Andreeva et al., 2019). У высших Teleostei отмечен высокий уровень олигомеров в крови, реорганизация олигомеров по типу ассоциаций/диссоциаций под влиянием природных и экспериментальных факторов, распад олигомеров в плазме (интерстициальной жидкости) при снижении в ней концентрации общего белка (Andreeva et al., 2015b, 2017, 2019). Так, у серебряного карася сывороточные олигомеры перестраиваются по единому алгоритму и в ходе репродуктивной динамики, согласованной с сезонной динамикой (весна → лето → осень), и под влиянием критической солености 11.5‰ (пресная вода → критическая соленость → пресная вода): 125/110 кДа → 85/60 кДа → 125/110 кДа (Andreeva et al., 2019). Тот же алгоритм (с некоторыми отличиями в величинах Mr белков) описан у леща и плотвы (Andreeva, 2010; Andreeva et al., 2015b).
Анализ эффектов ассоциации и диссоциации олигомеров, сопутствующей им логики изменения общего числа осмотически активных частиц в жидкостях организма в сторону снижения или роста, а также анализ согласованности этих событий с распределением общего белка относительно стенки капилляра позволили предположить направленность реорганизаций олигомеров на “выравнивание” осмоляльности плазмы и интерстициальной жидкости и поддержание их изотонии (Andreeva, 2019).
Костистые рыбы представляют собой идеальную модель для изучения КФ в группах, имеющих альбумин (низшие Teleostei), и не имеющих его (высшие Teleostei). Однако при относительно высоком содержании белка в интерстиции (рис. 3в), наличие или отсутствие альбумина, вероятно, не играет определяющей роли для поддержания изотонии внеклеточных жидкостей. Из-за присутствия в этих жидкостях белков-олигомеров, механизм поддержания изотонии принципиально отличается от “альбуминового” сценария, и основывается на структурных реорганизациях олигомеров, направленных, предположительно, на “выравнивание” осмоляльности плазмы и интерстициальной жидкости (рис. 3в).
Из-за скопления белка в интерстиции, эффект Гиббса–Даннона у рыб ослаблен (Olson, 1992). Учитывая роль гликокаликса, можно предположить, что на эффективности КФ жидкости это не сказывается. Но высокое содержание белка в интерстиции может нарушить изотонию в системе плазма–интерстициальная жидкость. Выходом из этой ситуации может стать сценарий реорганизаций белков по разные стороны стенки капилляра, направленных на “выравнивание” осмоляльности жидкостей.
Сценарий, в котором для поддержания изотонии задействованы реорганизации олигомеров, традиционно относят к системе “клетка–интерстициальная жидкость”. Эта система подразумевает присутствие олигомеров только в клетке, но не в омывающей ее жидкости. Ассоциации и диссоциации олигомеров адаптируют осмоляльность внутриклеточной жидкости к осмоляльности внеклеточной жидкости (Schulz, Schirmer, 1979). Роль белков интерстициальной жидкости демонстрирует следующий пример. Если клетки погрузить в изотоничный раствор сильного электролита (NaCl) и начать повышать температуру, то это приведет к распаду олигомеров внутри клетки и последующему росту осмоляльности внутриклеточной жидкости (рис. 3б). В то же время в растворе сильного электролита под влиянием температуры изменится только активность ионов и броуновское движение, но не число осмотически активных частиц. Поэтому ожидаемым результатом эксперимента будет осмотический шок клетки. Предотвратить такие последствия может введение белка в омывающий клетки раствор. Будучи слабыми полиэлектролитами с низкой степенью электролитической диссоциации, белки реагируют на изменение факторов среды изменением степени ионизации молекул и последующими эффектами ассоциации и диссоциации. Такие эксперименты, выполненные на микроорганизмах, доказали их выживаемость при нагреве в содержащих белки биологических жидкостях (Морозов, 2010). Таким образом, в условиях нестабильной внешней среды наличие белка в межклеточной жидкости способно стабилизировать систему “клетка–интерстициальная жидкость”.
Однако, механизм реорганизаций олигомерных белков оказался эффективным не только в системе “клетка–интерстициальная жидкость”, но, вероятно, и у рыб в системе “плазма–интерстициальная жидкость”. Различие их заключается в том, что олигомеры в последней присутствуют не в одном, а в обоих компартментах – и в плазме, и в интерстиции. Это повышает устойчивость всей системы. Наличие или отсутствие альбумина в ней не играет решающей роли. Значение имеет только свойство слабых полиэлектролитов (белков) менять под влиянием факторов среды (температуры, солености) степень ионизации молекулы и способность к ассоциации и диссоциации, координация которых по разные стороны капиллярной стенки способствует поддержанию изотонии жидкостей. Эти эффекты и лежат в основе “безальбуминового” механизма стабилизации КФ у рыб.
Возможность участия этого механизма в гомеостазе рыб подтверждают следующие описанные в литературе эффекты. Так, распределение белка между плазмой и интерстицием варьирует в широком диапазоне значений. Минимальное содержание белка в интерстиции (“следы”) отмечено при голодании (лещ, плотва) (Andreeva, 2012); максимальное (выше, чем в плазме) – в летний период, перед нерестом (серебряный карась, красноперки рода Tribolodon) (Andreeva et al., 2015b, 2017, 2019). При минимальном содержании белка в интерстиции, КФ жидкости рыб, вероятно, может протекать по сценарию, подобному “альбуминовому”, в котором за счет белков плазмы реализуется эффект Гиббса–Доннана. При высоком содержании белка в интерстиции, у рыб, вероятно, запускается альтернативный “безальбуминовый” сценарий КФ с участием олигомеров. Высокий уровень белка и олигомеров в плазме и интерстиции обеспечивает систему плазма–интерстициальная жидкость беспрецедентно высоким потенциалом для поддержания изотонии жидкостей за счет реорганизаций белков в широком диапазоне варьирования средовых факторов.
Липопротеины высокой плотности – факторы оптимизации КФ у Teleostei
Точка зрения, согласно которой в крови рыб, лишенных альбумина, функцию последнего взяли на себя липопротеины, уже высказывалась ранее (De Smet et al., 1998; Metcalf et al., 1999; Noel et al., 2010), но только в контексте их участия в транспорте жирных кислот, а не в осморегуляции. Между тем, по соответствию критерию Вант-Гоффа, ЛПВП вполне могут претендовать на роль осмотически активных факторов, так как их содержание в крови Teleostei достигает 36% (Babin, Vernier, 1989), кроме того они имеют компактные размеры ~5–12 нм (Borhani et al., 1997; Brouillette, Anantharamaiah, 1995; Silva et al., 2008), а также гидрофильную отрицательно заряженную поверхность из полярных “головок” фосфолипидов и гидрофильных областей аполипопротеинов А (АроА). Все гидрофобные компоненты ЛПВП – неполярные “хвосты” жирных кислот фосфолипидов, триацилглицериды и эфиры холестерина – скрыты в гидрофобном “ядре” частицы. Все компоненты частицы связаны нековалентными связями, что делает ее подобной ассоциированным олигомерным комплексам.
Важно отметить, что и ЛПВП, и белки в их составе (АроА) представляют собой не статичные, а динамичные структуры. Спиральные области АроА постоянно разворачиваются и складываются за секунды или меньшие промежутки времени (Phillips, 2013; Sevugan et al., 2012); в ходе этой динамики происходит изменение числа аминокислотных остатков в области контакта с молекулами фосфолипидов, что приводит к усилению или ослаблению образования неупорядоченных петель во вторичной структуре цепи АроА. Поверхностно-диссоциированные и поверхностно-ассоциированные состояния ЛПВП существуют минутные или более длительные интервалы времени (Phillips, 2013; Sevugan et al., 2012). Вероятно, именно эти особенности структуры ЛПВП облегчают визуализированные в электрофорезе эффекты ассоциации/диссоциации частиц под влиянием факторов среды (Andreeva et al., 2015b, 2017, 2019).
Осморегуляция и энергетика рыб
Каковы причины обилия ЛПВП в крови Teleostei? Ведь даже при “удобной” структурной организации, ЛПВП не могли бы претендовать на роль значимых осмотических факторов, если бы их содержание в плазме было незначительным. Вероятная причина их обилия в крови кроется в том, что основной энергетический субстрат рыб – липиды (Шульман и др., 1978; Chen et al., 2009; Kondo et al., 2001, 2005; Shen et al., 2000), а липопротеины – их переносчики. Количественное доминирование ЛПВП над другими липопротеинами плазмы Teleostei объясняется, вероятно, востребованностью не только “обратного”, но и “прямого” транспорта холестерина и жирных кислот (Andreeva, 2019). Учитывая высокую потребность в липидах в период сезонной активации метаболизма и последующее за биосинтезом Аро их массовое поступление в составе ЛПВП в кровь, можно предположить возможность резких скачков КОД плазмы и нарушение баланса внеклеточной жидкости. Однако в литературе описаны снижающие опасность эффекты, а именно: “сброс” избыточного белка из плазмы в интерстиций, в результате чего концентрация белка в последнем превышает таковую в плазме; распад ЛПВП в плазме, что, может способствовать повышению ее осмоляльности до уровня интерстициальной жидкости (Andreeva et al., 2017, 2019). Мобильность, как особенность капиллярного белкового трансфера и реорганизаций ЛПВП, является важным фактором стабилизации КФ у рыб.
ЗАКЛЮЧЕНИЕ
Положения “безальбуминовой” модели КФ носят отчасти феноменологический характер и требуют верификации количественной оценки вклада структурных реорганизаций белков в осмоляльность жидкостей организма. Однако феноменология подразумевает лишь описание закономерностей, между тем как обсуждаемая модель, помимо закономерностей КФ, позволила выявить суть механизма стабилизации КФ у рыб, основанного на мобильном капиллярном трансфере белков и их структурных реорганизациях в ответ на изменения среды (Andreeva, 2010, 2019; Andreeva et al., 2015a, 2015b, 2017, 2019).
В основу модели заложена природа белковой молекулы. Будучи слабым полиэлектролитом, белок на любые изменения окружающей его среды (температуры, солености, рН и др.) отвечает изменением степени ионизации аминокислотных групп на поверхности белковой глобулы, контактирующей с микросредой, соответственно меняется и характер взаимодействия белков с другими компонентами микросреды – неорганическими ионами, аминокислотами, пептидами и др. В результате этого происходят изменения во взаимодействии белка с белком, приводящие либо к ассоциации, либо к диссоциации белковых структур. Однако в отличие от малых молекул, свободно осуществляющих капиллярный трансфер, белки, только находясь по разные стороны капиллярной стенки и отвечая на изменения среды сходным образом, обеспечивают жидкостям пойкилотермных организмов изотонию в широком диапазоне варьирования средовых факторов. Перманентный характер белковых реорганизаций позволяет рассматривать этот механизм как гомеостатический.
Ключевой белковый фактор КФ в “безальбуминовой” модели – липопротеины высокой плотности. Их высокое содержание в крови и способность реагировать на изменение факторов среды позволили предположить существование у рыб анцестрального и консервативного способа стабилизации обменных процессов на основе ЛПВП и без участия альбумина. В связи с тем, что спектр функций липопротеинов рыб включает не только липидный обмен, но и влияние на водный обмен (Andreeva, 2019), иммунную защиту (Concha et al., 2003, 2004; Ndiaye et al., 2000) и регенерацию (Harel et al., 1990), ЛПВП можно рассматривать как мультифункциональные структуры. Расширение их функций произошло, вероятно, в результате полногеномной дупликации (WGD, whole genome duplication). Появление множественных копий генов АроА, приобретших в ходе дивергенции новые свойства (Otis et al., 2015), возможно, позволило скомпенсировать потерю рыбами некоторых генов, в том числе альбумина. В ветви древа позвоночных, которая привела к Mammalia, могло произойти разделение функций между ЛПВП и альбумином: первые взяли на себя липидный транспорт, вторые – осморегуляцию. А в ветви высших Teleostei, потерявших альбумин, механизмы липидного и водного обмена могли совершенствоваться за счет расширения функционального диапазона ЛПВП. Учитывая доминирующую роль липидов в энергетике рыб, можно предположить, что эволюция липидного обмена и других функций на основе ЛПВП происходила параллельно, включая участие ЛПВП в стабилизации КФ.
“Безальбуминовая” модель, как дополнение к классической модели Старлинга, расширила возможности использования последней для объяснения оптимизации капиллярного обмена в группе низших водных позвоночных. В то же время она включает в себя все элементы классической модели, рассматривая капиллярную фильтрацию млекопитающих в контексте КФ у позвоночных. В отличие от классической, эта модель позволяет объяснить целесообразность высокого содержания белка в интерстиции рыб их протекторной функцией; несущественный осмотический эффект альбумина, – тем, что обилие белка в интерстиции “обесценивает” эффект Гиббса–Доннана и лишает альбумин ключевой роли регулятора капиллярного водного трансфера; высокую экологическую пластичность Teleostei – мобильностью капиллярного трансфера белка и реорганизаций белковых олигомеров, поддерживающих изотонию жидкостей организма в широком диапазоне варьирования средовых факторов.
Список литературы
Андреева А.М. 2017. Стехиометрия белковых агрегатов плазмы рыб // Тр. ИБВВ РАН. Генетика и биохимия водных животных. Вып. 80(83). С. 5.
Детлаф А.А., Яворский Б.М. 1989. Курс физики: Учеб. пособ. для вузов. Москва: Высшая школа.
Кирпичников В.С. 1987. Генетика и селекция рыб. Ленинград: Наука.
Мартемьянов В.И. 2013. Оценка статуса рыб по отношению к солености среды на основе типов осмотической ионной регуляции // Труды Зоологического института РАН. Приложение № 3. С. 175.
Морозов И.И. 2010. Осмотический гомеостаз как одна из критических мишеней поражения клеток некоторыми факторами внешней среды // Радиационная биология. Радиоэкология. Т. 50. № 5. С. 514.
Шульман Г.Е. 1978. Элементы физиологии и биохимии общего и активного обмена у рыб. Киев: Наукова думка.
Adamson R.H., Lenz J.F., Zhang X. et al. 2004. Oncotic pressures opposing filtration across non-fenestrated rat microvessels // J. Physiol. V. 557. № 3. P. 889. https://doi.org/10.1113/jphysiol.2003.058255
Aamelfot M., Dale O.B., Weli S.C. et al. 2014. The in situ distribution of glycoprotein-bound 4-O-Acetylated sialic acids in vertebrates // Glycoconjugate Journal. V. 31. P. 327. https://doi.org/10.1007/s10719-014-9529-7
Anderson N.L., Polanski M., Pieper R. et al. 2004. The human plasma proteome: a nonredundant list developed by combination of four separate sources // Mol. Cell. Proteomics. V. 3. P. 311. https://doi.org/10.1074/mcp.M300127-MCP200
Andreeva A.M. 2010. The role of structural organization of blood plasma proteins in the stabilization of water metabolism in bony fish (Teleostei) // J. Ichthyol. V. 5. № 7. P. 552. https://doi.org/10.1134/S0032945210070076
Andreeva A.M. 2012. Structural and functional organization of fish blood proteins. New York: Nova Science Publ.
Andreeva A.M. 2019. The Strategies of Organization of the Fish Plasma Proteome: with and without Albumin // Russ. J. Mar. Biol. V. 45. № 4. P. 263. https://doi.org/10.1134/S1063074019040023
Andreeva A.M., Lamash N.E., Serebryakova M.V., Ryabtseva I.P. 2015a. Seasonal dynamics in capillary filtration of 383 plasma proteins in eastern redfins of the genus Tribolodon (Cyprinidae) // J. Ichthyol. V. 55. P. 723. https://doi.org/10.1134/S003294521505001X
Andreeva A.M., Lamas N.E., Serebryakova M.V. et al. 2015b. Reorganization of low-molecular-weight fraction of plasma proteins in the annual cycle of cyprinidae // Biochemistry. V. 80. P. 208. https://doi.org/10.1134/S0006297915020078
Andreeva A.M., Serebryakova M.V., Lamash N.E. 2017. Oligomeric protein complexes of apolipoproteins stabilize the internal fluid environment of organism in redfins of the Tribolodon genus [Pisces; Cypriniformes, Cyprinidae] // Comp. Biochem. Physiol., Part D: Genomics Proteomics. V. 22. P. 90. https://doi.org/10.1016/j.cbd.2017.02.007
Andreeva A.M., Vasiliev A.S., Toropygin I.Yu. et al. 2019. Involvement of apolipoprotein A in maintaining tissue fluid balance in goldfish Carassius auratus // Fish Physiol. Biochem. V. 45. № 5. P. 1717. https://doi.org/10.1007/s10695-019-00662-1
Anguizola J., Matsuda R., Barnaby O.S. et al. 2013. Review: Glycation of human serum albumin // Clin. Chim. Acta. V. 425. P. 64. https://doi.org/10.1016/j.cca.2013.07.013
Babaei F., Ramalingam R., Tavendale A. et al. 2013. Novel blood collection method allows plasma proteome analysis from single zebrafish // J. Proteome Res. V. 12. № 4. P. 1580. https://doi.org/10.1021/pr3009226
Babin P.J., Vernier J.M. 1989. Plasma lipoproteins in fish // J. Lipid Res. V. 30. P. 467.
Bendayan M., Rasio E.A. 1996. Transport of insulin and albumin by the microvascular endothelium of the rete mirabile // J. Cell Sci. V. 109 ( Pt 7). P. 1857–1864.
Bendayan M., Rasio E.A. 1997. Evidence of a tubular system for transendothelial transport in arterial capillaries of the rete mirabile // J. Histochem. Cytochem. V. 45(10). P. 1365–1378. https://doi.org/10.1177/002215549704501005.
Bianchetti M.G., Simonett G.D., Bettinelli A. 2009. Body fluids and salt metabolism. Part I. // Ital. J. Pediatr. V. 35:36. P. 1. https://doi.org/10.1186/1824-7288-35-36
Borhani D.W., Rogers D.P., Engler J.A., Brouillette C.G. 1997. Crystal structure of truncated human apolipoprotein A-I suggests a lipid-bound conformation // Proc. Natl. Acad. Sci. U.S.A. V. 94. № 23. P. 12 291. https://doi.org/10.1073/pnas.94.23.12291
Braasch I., Gehrke A.R., Smith J.J. et al. 2016. The spotted gar genome illuminates vertebrate evolution and facilitates human-teleost comparisons // Nat. Genet. V. 48. № 4. P. 427. https://doi.org/10.1038/ng.3526
Brouillette C.G., Anantharamaiah G.M. 1995. Structural models of human apolipoprotein A-I // Biochim. Biophys. Acta. V. 1256. № 2. P. 103. https://doi.org/10.1016/0005-2760(95)00018-8
Bushnell P.G., Conklin D.J., Duff D.W., Olson K.R. 1998. Tissue and whole-body extracellular, red blood cell, and albumin spaces in the rainbow trout as a function of time: a reappraisal of the volume of the secondary circulation // J. Exp. Biol. V. 201. P. 1381.
Byrnes L., Gannon F. 1990. Atlantic salmon (Salmo salar) serum albumin: cDNA sequence, evolution, and tissue expression // DNA Cell Biol. V. 9. № 9. P. 647. https://doi.org/10.1089/dna.1990.9.647
Chappell D., Jacob M. 2014. Role of the glycocalyx in fluid management: Small things matter // Best Pract. Res. Clin. Anaesthesiol. V. 28. P. 227. https://doi.org/10.1016/j.bpa.2014.06.003
Chen J., Shi Yu.H., Hu H.Q. et al. 2009. Apolipoprotein A-I, a hyperosmotic adaptation-related protein in ayu (Plecoglossus altivelis) // Comp. Biochem. Physiol. Part B. V. 152. P. 196–201. https://doi.org/10.1016/j.cbpb.2008.11.005
Concha M.I., Molina S., Oyarzun C. et al. 2003. Local expression of apolipoprotein A-I gene and a possible role for HDL in primary defence in the carp skin // Fish Shellfish Immunol. V. 14. № 3. P. 259. https://doi.org/10.1006/fsim.2002.0435
Concha M.I., Smith V.J., Castro K. et al. 2004. Apolipoproteins AI and A-II are potentially important effectors of innate immunity in the teleost fish Cyprinus carpio // Eur. J. Biochem. V. 271. № 14. P. 2984. https://doi.org/10.1111/j.1432-1033.2004.04228.x
Curry F.E., Adamson R.H. 2012. Endothelial glycocalyx: permeability barrier and mechanosensor // Ann. Biomed. Eng. V. 40. P. 828. https://doi.org/10.1007/s10439-011-0429-8
De Smet H., Blust R., Moens L. 1998. Absence of albumin in the plasma of the common carp Cyprinus carpio: binding of fatty acids to high density lipoprotein // Fish Physiol. Biochem. V. 19. № 1. P. 71.
Deutsch H.F., McShan W.H. 1949. Biophysical studies of blood plasma proteins; electrophoretic studies of the blood serum proteins of some lower animals // J. Biol. Chem. V. 180. № 1. P. 219.
Dvorak A.M., Kohn S., Morgan E.S. et al. 1996. The vesiculo_vacuolar organelle (VVO): a distinct endothelial cell structure that provides a transcellular pathway for macromolecular extravasation // J. Leukocyte Biol. V. 59. P. 100. https://doi.org/10.1002/jlb.59.1.100
Duff D.W., Olson K.R. 1989. Response of rainbow trout to constantpressure and constant-volume hemorrhage // Am. J. Physiol. Regul. V. 257. P. R1307. https://doi.org/10.1152/ajpregu.1989.257.6.R1307
Duff D.W., Fitzgerald D., Kullman D. et al. 1987. Blood volume and red cell space in tissues of the rainbow trout, Salmo gairdneri // Comp. Biochem. Physiol. Part A. V. 87. P. 393. https://doi.org/10.1016/0300-9629(87)90141-1
Durliat M, André M., Babin P.J. 2000. Conserved protein motifs and structural organization of a fish gene homologous to mammalian apolipoprotein E. // Eur. J. Biochem. V. 26. № 2. P. 549. https://doi.org/10.1046/j.1432-1327.2000.01033.x
Dziegielewska K.M., Evans C.A., Fossan G. et al. 1980. Proteins in cerebrospinal fluid and plasma of fetal sheep during development // J. Physiol. V. 300. P. 441. https://doi.org/10.1113/jphysiol.1980.sp013171
Gorsi B., Liu F., Ma X., Chico T.J. et al. 2014. The heparan sulfate editing enzyme Sulf1 plays a novel role in zebrafish VegfA mediated arterial venous identity // Angiogenesis. V. 17. № 1. P. 77. https://doi.org/10.1007/s10456-013-9379-0
Harel A., Fainaru M., Rubinstein M. et al. 1990. Fish apolipoprotein-A-I has heparin binding activity: implication for nerve regeneration // J. Neurochem. V. 55. № 4. P. 1237. https://doi.org/10.1111/j.1471-4159.1990.tb03130.x
Harfouche R., Hentschel D.M., Piecewicz S. et al. 2009. Glycome and Transcriptome regulation of vasculogenesis // Circulation. V. 120. № 19. P. 1883. https://doi.org/10.1161/CIRCULATIONAHA.108.837724
Jacob M., Chappell D., Becker B.F. 2016. Regulation of blood flow and volume exchange across the microcirculation // Critical Care. V. 20:319. P. 3. https://doi.org/10.1186/s13054-016-1485-0
Kiernan J.A., Contestabile A. 1980. Vascular permeability accociated with axonal regeneration in the optic system of the goldfish // Acta Neuropathol. V. 51. P. 39. https://doi.org/10.1007/BF00688848
Koltowska K., Betterman K.L., Harvey N.L., Hogan B.M. 2013. Getting out and about: the emergence and morphogenesis of the vertebrate lymphatic vasculature // Development. V. 140. P. 1857. https://doi.org/10.1242/dev.089565
Kondo H., Kawazoe I., Nakaya M. et al. 2001. The novel sequences of major plasma apolipoproteins in the eel Anguilla japonica // Biochim. Biophys. Acta. V. 1531. P. 132. https://doi.org/10.1016/s1388-1981(01)00099-3
Kondo H., Morinaga K., Misaki R. et al. 2005. Characterization of the pufferfish Takifugu rubripes apolipoprotein multigene family // Gene. V. 346. P. 257. https://doi.org/10.1016/j.gene.2004.11.015
Kragh-Hansen U. 1990. Structure and ligand binding properties of human serum albumin // Dan. Med. Bull. V. 37. № 1. P. 57.
Levick J.R., Michel C.C. 2010. Microvascular fluid exchange and the revised Starling principle // Cardiovasc. Res. V. 87. P. 198. https://doi.org/10.1093/cvr/cvq062
Levitt D., Levitt M. 2016. Human serum albumin homeostasis: a new look at the roles of synthesis, catabolism, renal and gastrointestinal excretion, and the clinical value of serum albumin measurements // Int. J. Gen. Med. V. 9. P. 229. https://doi.org/10.2147/IJGM.S102819
Li C., Tan X.F., Lim T.K. et al. 2016. Comprehensive and quantitative proteomic analyses of zebrafish plasma reveal conserved protein profiles between genders and between zebrafish and human // Sci. Rep. V. 6. № 24 329. P. 1. https://doi.org/10.1038/srep24329
Li S., Cao Y., Geng F. 2017. Genome-wide identification and comparative analysis of albumin family in vertebrates // Evol. Bioinf. Online. V. 13. P. 1. https://doi.org/10.1177/1176934317716089
Liotta L.A., Petricoin E.F. 2006. Serum peptidome for cancer detection: spinning biologic trash into diagnostic gold // J. Clin. Invest. V. 116. № 1. P. 26. https://doi.org/10.1172/JCI27467
Lucitt M.B., Price T.S., Pizarro A. et al. 2008. Analysis of the zebrafish proteome during embryonic development // Mol. Cell. Proteomics. V. 7. № 5. P. 981. https://doi.org/10.1074/mcp.M700382-MCP200
Majorek K.A., Porebski P.J., Dayal A. et al. 2012. Structural and immunologic characterization of bovine, horse, and rabbit serum albumins // Mol. Immunol. V. 52. № 3–4. P. 174. https://doi.org/10.1016/j.molimm.2012.05.011
Metcalf V.J., Brennan S.O., George P.M. 1999. The Antarctic toothfish (Dissostichus mawsoni) lacks plasma albumin and utilises high density lipoprotein as its major palmitate binding protein // Comp. Biochem. Physiol. Part B: Biochem. Mol. Biol. V. 124. № 2. P. 147. https://doi.org/10.1016/s0305-0491(99)00051-6
Metcalf V., Brennan S., Chambers G., George P. 1998a. The albumins of Chinook salmon (Oncorhynchus tshawytscha) and brown trout (Salmo trutta) appear to lack a propeptide // Arch. Biochem. Biophys. V. 350. № 2. P. 239. https://doi.org/10.1006/abbi.1997.0509
Metcalf V.J., Brennan S.O., Chambers G.K., George P.M. 1998b. The albumin of the brown trout (Salmo trutta) is a glycoprotein // Biochim. Biophys. Acta. V. 1386. № 1. P. 90. https://doi.org/10.1016/S0167-4838(98)00060-0
Michel C.C. 1997. Starling: the formulation of his hypothesis of microvascular fluid exchange and its significance after 100 years // Exp. Physiol. V. 82. P. 1. https://doi.org/10.1113/expphysiol.1997.sp004000
Moore D.H. 1945. Species differences in serum protein patterns // J. Biol. Chem. V. 161. P. 21.
Ndiaye D., Katoh H., Ge Y.P. et al. 2000. Monoclonal antibodies to plasma high density lipoprotein (HDL) of eel (Anguilla japonica) // Comp. Biochem. Physiol. Part B: Biochem. Mol. Biol. V. 125. № 4. P. 473. https://doi.org/10.1016/s0305-0491(00)00159-0
Nguyen M.K., Kurtz I. 2004. New insights into the pathophysiology of the dysnatremias: a quantitative analysis // Am. J. Physiol. Renal Physiol. V. 287. P. F172. https://doi.org/10.1152/ajprenal.00106.2004
Nguyen M., Kurtz I. 2006. Quantitative interrelationship between Gibbs-Donnan equilibrium, osmolality of body fluid compartments, and plasma water sodium concentration // J. Appl. Physiol. V. 100. P. 1293. https://doi.org/10.1152/japplphysiol.01274.2005
Nguyen M.K., Ornek V., Kao L. et al. 2014. Defining the role of albumin infusion in cirrhosis-associated hyponatremia // Am. J. Physiol. Gastrointest Liver Physiol. V. 307. P. G229. https://doi.org/10.1152/ajpgi.00424.2013
Noel E.S., Reis M., Arain Z., Ober E.A. 2010. Analysis of the Albumin/ Fetoprotein/Afamin/Group specific component gene family in the context of zebrafish liver differentiation // Gene Expression Patterns. V. 10. № 6. P. 237. https://doi.org/10.1016/j.gep.2010.05.002
Olson K.R. 1992. Blood and extracellular fluid volume regulation: role of the renin-angiotensin system, kallikrein-kinin system, and atrial natriuretic peptides // Fish Physiol. V. 12. Part B. P. 136.
https://doi.org/10.1016/S1546-5098(08)60010-2
Olson K.R. 1997. The cardiovascular system // The Physiology of Fishes. Boca Raton: CRC Press. P. 129.
Olson K.R., Kinney D.W., Dombrowski R.A., Duff D.W. 2003. Transvascular and intravascular fluid transport in the rainbow trout: revisiting Starling,s forces, the secondary circulation and interstitial compliance // J. Exp. Biol. V. 206. P. 457. https://doi.org/10.1242/jeb.00123
Otis J., Zeituni E.M., Thierer J.H. et al. 2015. Zebrafish as a model for apolipoprotein biology: comprehensive expression analysis and a role for ApoA-IV in regulating food intake // Dis. Model. Mech. V. 8. № 3. P. 295. https://doi.org/10.1242/dmm.018754
Pasquier J., Cabau C., Nguyen T. et al. 2016. Gene evolution and gene expression after whole genome duplication in fish: the PhyloFish database // BMC Genomics. V. 17. № 368. P. 1. https://doi.org/10.1186/s12864-016-2709-z
Phillips K. 2003. Trout with tone // J. Exp. Biol. V. 206. P. 424.
Phillips M.C. 2013. New insights into the determination of HDL structure by apolipoproteins // J. Lipid Res. V. 54. P. 2034. https://doi.org/10.1194/jlr.R034025
Power D.M., Elias N.P., Richardson S.J. et al. 2000. Evolution of the thyroid hormone-binding protein, transthyretin // Gen. Comp. Endocrynol. V. 119. P. 241. https://doi.org/10.1006/gcen.2000.7520
Rosengren B.I., Carlsson O., Venturoli D. et al. 2004.Transvascular passage of macromolecules into the peritoneal cavity of normo- and hypothermic rats in vivo: active or passive transport? // J. Vasc. Res. V. 41. P. 123. https://doi.org/10.1159/000077131
Salem M., Xiao C., Womack J. et al. 2010. A microRNA repertoire for functional genome research in rainbow trout (Oncorhynchus mykiss) // Mar. Biotechnol. V. 12. № 4. P. 410. https://doi.org/10.1007/s10126-009-9232-z
Sarin H. 2010. Physiologic upper limits of pore size of different blood capillary types and another perspective on the dual pore theory of microvascular permeability // J. Angiogenes Res. V. 2. P. 1. https://doi.org/10.1186/2040-2384-2-14
Schatzki P.F., Newsome A. 1975. Neutralized lanthanum solution a largely noncolloidal ultrastructural tracer // Biotech. Histochem. V. 50. P. 71. https://doi.org/10.3109/10520297509117054
Schulz G.E., Schirmer R.H. 1979. Principles of Protein Structure. New York: Springer.
Sevugan Ch.P., Mayne L., Kan Z.Y. et al. 2012. Apolipoprotein A-I Helical Structure and Stability in Discoidal High-Density Lipoprotein (HDL) Particles by Hydrogen Exchange and Mass Spectrometry // Proc. Natl. Acad. Sci. U.S.A. V. 109. № 29. P. 11687. https://doi.org/10.1073/pnas.1209305109
Shaklai M., Tavassoli M. 1982. Lanthanum as an electron microscopic stain // J. Histochem. Cytochem. V. 30. P. 1325. https://doi.org/10.1177/30.12.6185564
Sharov V.G. 1981. Use of colloidal lanthanum as an electron-microscopic tracer // Bull. Exp. Biol. Med. V. 92. P. 1748.
Shen Y., Lindberg A., Olivecrona G. 2000. Apolipoprotein CII from rainbow trout (Oncorhynchus mykiss) is functionally active but structurally very different from mammalian apolipoprotein CII // Gene. V. 254. P. 189. https://doi.org/10.1016/s0378-1119(00)00268-7
Silva R.A., Huang R., Morris J. et al. 2008. Structure of apolipoprotein A-I in spherical high-density lipoproteins of different sizes // Proc. Natl. Acad. Sci. U.S.A. V. 105. № 34. P. 12176. https://doi.org/10.1073/pnas.0803626105
Soldatov A.A. 2006. Organ blood flow and vessels of microcirculatory bed in fish // J. Evol. Biochem. Physiol. V. 42. № 3. P. 193.
Starling E.H. 1896. On the absorption of fluids from the connective tissue spaces // J. Physiol. V. 19. P. 312. https://doi.org/10.1113/jphysiol.1896.sp000596
Tiselius A.E. 1937. Electrophoresis of serum globulin: Electrophoretic analysis of normal and immune sera // Biochem. J. V. 31. № 9. P. 1464. https://doi.org/10.1042/bj0311464
Ueda H., Takehana K., Eerdunchaolu I.K. et al. 2001. Electron microscopic cytochemical studies of anionic sites in the rat spleen // J. Vet. Med. Sci. V. 63. P. 287. https://doi.org/10.1292/jvms.63.287
Weinbaum S. 1998. Whitaker distinguished lecture: model to solve mysteries in biomechanics at the cellular level; a new view of fiber matrix layers // Ann. Biomed. Eng. V. 26. P. 627. https://doi.org/10.1114/1.134
Wicher K.B., Fries E. 2006. Haptoglobin, a hemoglobin-binding plasma protein, is present in bony fish and mammals but not in frog and chicken // Proc. Natl. Acad. Sci. U.S.A. V. 103. № 11. P. 4168. https://doi.org/10.1073/pnas.0508723103
Xu Y., Ding Z. 2005. N-terminal sequence and main characteristics of Atlantic salmon (Salmo salar) albumin // Prep. Biochem. Biotechnol. V. 35. № 4. P. 283. https://doi.org/10.1080/10826060500218081
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод


