Биология внутренних вод, 2020, № 6, стр. 562-572
Глобальное распространение цианобактерий: причины и последствия (Обзор)
В. И. Сухаревич a, Ю. М. Поляк a, *
a Санкт-Петербургский научно-исследовательский центр экологической безопасности Российской академии наук
Санкт-Петербург, Россия
* E-mail: yuliapolyak@mail.ru
Поступила в редакцию 20.01.2020
После доработки 26.03.2020
Принята к публикации 16.04.2020
Аннотация
Настоящий обзор посвящен глобальному распространению цианобактерий в водоемах, возможным причинам этого явления и его последствиям. Стремительное распространение цианобактерий в водоемах в последние десятилетия происходит повсеместно и сопровождается загрязнением воды опасными метаболитами – цианотоксинами, представляющими значительную угрозу для человека, животных и окружающей среды. Серьезные проблемы связаны не только с необходимостью очистки воды от цианотоксинов, но и с возникновением неприятного вкуса и запаха питьевой воды в результате образования цианобактериями одорирующих веществ, с борьбой с биокоррозией, вызванной цианобактериальным обрастанием. Цианобактериальные “цветения” становятся препятствием для водоснабжения, рыболовства, рекреационного использования водоемов, туризма. Среди многих факторов, способствующих распространению цианобактерий, – глобальное потепление и изменение климата, постоянно возрастающая эвтрофикация природных вод и антропогенное загрязнение, а также уникальные физиологические особенности цианобактерий, их способность адаптироваться к самым разным условиям среды, в том числе и экстремальным.
Цианобактерии (или синезеленые водоросли) относятся к числу первых фотосинтезирующих организмов. Повышенный интерес к этой группе организмов в последние десятилетия обусловлен их стремительным распространением по всему миру, колонизацией водоемов самых разных климатических зон – от тропиков до антарктического пояса.
Цианобактерии встречаются в пресной, солоноватой и соленой воде, составляют значительную долю планктона, формируют цианобактериальные маты на дне озер, живут в симбиозе с высшими растениями и грибами (Burford et al., 2018). Являясь прокариотами, они имеют сходство с высшими эукариотическими водорослями, однако существенно отличаются от них по строению и физиолого-биохимическим свойствам.
Цианобактерии образуют токсины, различающиеся по характеру биологического действия, в том числе гепатотоксины, нейротоксины, цитотоксины, дерматотоксины. В результате многочисленных исследований идентифицированы и изучены токсинообразующие виды таких родов, как Microcystis, Cylindrospermopsis (Raphidiopsis), Dolichospermum, Aphanizomenon, Planktothrix, Nodularia и др., однако значительное число видов пока исследовано недостаточно (O’Niel et al., 2012; Burford et al., 2016; Harke et al., 2016; Kurmaer et al., 2016; Li et al., 2016).
Массовое развитие токсинообразующих цианобактерий негативно влияет на водные экосистемы, приводит к изменению трофической структуры сообщества, гибели рыб, обеднению толщи воды кислородом и снижению ее качества (Robarts et al., 2005; Briland et al., 2020). Цианотоксины представляют реальную угрозу для здоровья человека, животных, многих представителей планктона, поэтому особое значение приобретают исследования потенциального синергетического действия различных биотических и абиотических факторов, оказывающих влияние на интенсивность распространения цианобактерий, образование токсинов, на соотношение токсигенных и нетоксигенных видов в пресноводном планктоне (Kaplan et al., 2012; Rastogi et al., 2015).
С цианобактериями связаны серьезные экономические и социальные проблемы. Основные экономические потери от цианобактериальных “цветений” определяются расходами на очистку воды от токсинов и устранение неприятного вкуса и запаха питьевой воды (Dodds et al., 2009). Многие авторы отмечают, что в глобальном масштабе эти проблемы со временем будут только усиливаться (Wagner, Adrian, 2009; Carey et al., 2012).
Несмотря на сложный характер данного природного явления, его интенсивно исследуют во всем мире. Уже достигнуты определенные успехи, однако многие вопросы, которые важны для эффективной защиты от негативных последствий массового развития цианобактерий, пока не решены (Scholz et al., 2017). Настоящий обзор посвящен глобальному распространению цианобактерий в пресноводных водоемах, возможным причинам этого явления и его последствиям.
Свойства цианобактерий, способствующие их доминированию в водоемах
Цианобактерии – важный компонент фитопланктонных сообществ, однако их массовое развитие приводит к снижению видового разнообразия и сопровождается доминированием лишь небольшого числа видов (Molot, 2014; Sulis et al., 2014).
В результате длительной эволюции цианобактерии приобрели способность адаптироваться к самым экстремальным климатическим и геохимическим условиям (Hallock, 2005; Paul, 2008). Благодаря наличию капсул, они способны выдерживать высокие температуры; пигменты цианобактерий выполняют фотозащитную функцию, а газовые вакуоли придают клеткам плавучесть, что позволяет им перемещаться в слое воды и легко адаптироваться к изменению уровня освещенности или концентрации питательных веществ (Reynolds, 2006). При наступлении неблагоприятных условий покоящиеся клетки цианобактерий – акинеты, опускаются на дно водоема, где зимуют, а весной прорастают и всплывают на поверхность (Zilius et al., 2016).
Цианобактерии участвуют в создании мутуалистических и симбиотических ассоциаций с другими микроорганизмами, растениями и животными, что также способствует их выживанию в неблагоприятных условиях (Paerl, 2017). Пример таких ассоциаций с грибами – широко распространенные в природе лишайники (Тарасова и др., 2012).
Эти и другие свойства цианобактерий позволяют им занимать такие экстремальные экологические ниши, как ледяные озера Антарктиды и горячие источники, доминировать в планктоне и бентосе многих регионов Северного и Южного полушария (Lopes, Vasconcelos, 2011; Carey et al., 2012; Quiblier et al., 2013).
Бентосные цианобактерии образуют толстые маты, в которых доминируют представители родов Oscillatoria и Phormidium (Поляк, Cухаревич, 2019б; Heath et al., 2011). К типичным представителям бентоса относятся и цианобактерии родов Nostoc, Anabaena (Dolichospermum), Scytonema (Smith et al., 2011). В отличие от планктонных цианобактерий, массовое развитие которых характерно, в основном, для мезо- и эвтрофных водоемов, образование цианобактериальных матов происходит и в олиготрофных водах (Scott, Marcarelli, 2012). Вода в олиготрофных водоемах обычно прозрачна, свет достигает дна, что способствует развитию бентосных цианобактерий.
Таким образом, уникальные морфологические и физиолого-биохимические свойства цианобактерий, их удивительная способность адаптироваться к любым факторам среды, выживать в экстремальных условиях, – одна из причин их глобального распространения, которую, как природное явление, устранить невозможно. Благоприятные условия среды, такие как увеличение среднегодовых температур, изменение климата, антропогенные факторы, способствуют проявлению этих свойств цианобактерий, и, как следствие, их стремительному распространению в мире.
Роль глобального потепления и изменения климата в распространении цианобактерий
Цианобактериальные “цветения” наблюдаются, главным образом, когда температура воды достигает 20–25°С, что превышает оптимальную температуру для развития других представителей пресноводного фитопланктона (Makhalanyane et al., 2015). Однако некоторые виды цианобактерий размножаются и в холодной воде, вызывая “цветение” воды в озерах подо льдом в зимний период, а Planktothrix agardhii (Gomont) Anagnostidis & Komárek вызывает “цветение” воды в водоемах круглый год (Halstvedt et al., 2007).
Изучение процессов, происходящих в 143 озерах Европы и Южной Америки, расположенных в различных климатических зонах, позволило установить, что с повышением температуры воды происходит увеличение частоты встречаемости цианобактерий (Kosten et al., 2012). Например, из европейских озер выявлена цианобактерия Cylindrospermopsis (Raphidiopsis) raciborskii (Woloszynska) Seenaya & Sabbaraju, типичный обитатель субтропических регионов (Briand et al., 2004). Авторы полагают, что широкое распространение C. raciborskii в европейских озерах, наблюдаемое с конца прошлого столетия, связано с глобальным потеплением и изменением климата.
Глобальное потепление и связанные с ним гидрологические изменения существенно влияют на многие физико-химические и биологические процессы, в том числе, на метаболизм и размножение цианобактерий. Потепление может способствовать росту цианобактерий, поскольку при увеличении температуры скорость роста возрастает (Paerl, Paul, 2012).
Кроме того, благодаря наличию фотозащитных пигментов (каротиноидов) и поглощающих ультрафиолет компонентов (микоспорин-подобные аминокислоты) цианобактерии сохраняют жизнеспособность даже при экстремально высоких уровнях радиации (Paul, 2008; Carreto, Carignan, 2011). В условиях УФ-стресса включаются и другие защитные механизмы, например, образование антиокислительных ферментов – супероксиддисмутазы, каталазы, глутатионпероксидазы, и антиоксидантов – аскорбата, токоферолов и др. (He, Häder, 2002; Xue et al., 2005).
В результате глобального потепления и связанных с ним колебаний климата продолжительность сезонов дождей и засух возрастает. Частые сильные засухи приводят к увеличению солености воды в озерах, реках и эстуарных зонах. В этих условиях многие виды цианобактерий способны длительное время сохраняться в донных отложениях в виде цист (Potts, 1994). Некоторые виды родов Anabaena, Anabaenopsis, Microcystis, Nodularia, толерантны к солености (Tonk et al., 2007).
Поскольку водные объекты различаются по размерам, морфологии, солености, гидрологическим условиям и другим параметрам, для контроля цианобактерий необходимы специальные системы, учитывающие комплекс различных воздействий, характерных для каждого водоема (Paerl, Paul, 2012).
Повышение среднегодовых температур может не только способствовать росту цианобактерий, но и оказывать влияние на образование токсинов и соотношение токсигенных и нетоксигенных видов в планктоне. Показано, что не образующие токсинов виды цианобактерий Planktothrix обладают генами, кодирующими синтез циклического гептапептида – микроцистина, и при повышении температуры могут начать синтезировать токсины (Christiansen et al., 2008). Другие авторы (Dziallas, Grossart, 2011) также отмечают, что с повышением температуры штаммы Microcystis aeruginosa Kiitz. em. Elenk., не обладающие токсическими свойствами, начинают синтезировать токсины, и приходят к выводу, что глобальное потепление способствует увеличению токсигенного потенциала цианобактерий. Сочетание повышенной температуры с другими абиотическими и биотическими факторами среды может оказывать синергетический эффект на процентное соотношение токсигенных видов в фитопланктоне (Rastogi et al., 2015).
Температура влияет и на другие особенности метаболизма цианобактерий, в том числе на образование различных структурных вариантов микроцистинов. Так, синтез высокотоксичного микроцистина LR коррелирует с температурой 25°C, а синтез менее токсичного микроцистина RR – с более высокой температурой (Поляк, Сухаревич, 2017). В последние годы значительное влияние температуры на физические, химические и биологические процессы в водоемах подчеркивается многими авторами (Paerl et al., 2016; Scholz et al., 2017).
Следует отметить, что в результате и регионального, и глобального потепления происходит преждевременное таяние льда, а замерзание воды задерживается (Hodgkins, 2013), что способствует высокой активности и росту цианобактерий (Kosten et al., 2012; Paerl, Paul, 2012).
Таким образом, глобальное потепление можно рассматривать как важнейший природный процесс, способствующий стремительному распространению и доминированию цианобактерий в водоемах. Однако необходимо отметить, что оценка влияния данного фактора на вероятность глобального распространения цианобактерий сделана пока лишь для небольшого количества видов (Scholz et al., 2017).
Роль антропогенного загрязнения водоемов в распространении цианобактерий
На протяжении последнего столетия наблюдается постоянный рост количества эвтрофированных водоемов, связанный с интенсивным развитием сельского хозяйства, ростом городов и развитием промышленности (Conley et al., 2009; Smith et al., 2015). За последние десятилетия удвоились объемы производства сельскохозяйственной продукции, выросли орошаемые посевные площади, которые, кроме того, удобряют биогенными соединениями – азотом и фосфором (Novotny, 1999; Scholz et al., 2017). Внесенные в почву азот и фосфор легко попадают в поверхностные воды.
Основным источником биогенных соединений считаются сточные воды (Paerl, Fulton, 2006). Рост численности населения, развитие экономики, урбанизация, несовершенные системы водоочистки становятся причиной увеличения концентрации азота и фосфора в водоемах многих стран (Van Drecht et al., 2009). Проблема загрязнения водоемов биогенными соединениями усугубляется еще и тем, что они играют значительную роль в развитии массовых видов цианобактерий. Роль азота и фосфора в процессах “цветения” водоемов подтверждается результатами многих исследований (Jiang et al., 2008; Moisander et al., 2009; Kahru et al., 2020).
Азот служит важным питательным веществом для цианобактерий, составляющим значительную часть их биомассы. Цианобактериям азот необходим не только для роста, но и для синтеза токсинов. В первую очередь это относится к цианобактериям, которые не являются азотфиксаторами (Lehtimäki et al., 1997). Так, представители рода Microcystis, не обладающие механизмом азотфиксации, способны использовать органические источники азота и, прежде всего, свободные растворимые аминокислоты – аланин, аргинин, лейцин, глютаминовую кислоту (Dai et al., 2009).
Помимо азота, существенным элементом для роста цианобактерий является фосфор – необходимый компонент клеточных фосфолипидов, АТФ, нуклеиновых кислот. Данные о влиянии фосфора на токсинообразование цианобактерий не однозначны. Результаты исследований одних авторов показывают, что фосфор значительно повышает синтез микроцистина LR (Kotak et al., 1995), по результатам других, он не оказывает на образование микроцистинов значимого действия (Watanabe, Oishi, 1985; Polyak et al., 2013). Имеются данные, что Microcystis aeruginosa образует максимальное количество микроцистина в условиях лимитации по фосфору (Oh et al., 2000).
Не только сами биогенные элементы, но и их соотношение – важный фактор, оказывающий влияние на доминирование цианобактерий (Булгаков, Левич, 1995). Массовое развитие цианобактерий связывают с относительно низким соотношением концентраций азота и фосфора в среде (N : P < 25). Вероятно, представления о фосфоре, как основном критерии контроля цианобактериальных “цветений”, требуют ревизии (Rastogi et al., 2015).
Цианобактерии – фотоавтотрофные организмы, для своей жизнедеятельности они используют энергию света. Кроме того, цианобактерии способны поглощать органические источники углерода и использовать их в качестве источника энергии. При низком, недостаточном для фотосинтеза уровне освещенности гетеротрофная утилизация органических субстратов становится важной составляющей стратегии выживания цианобактерий (Абдуллин, Багмет, 2016).
Некоторые из органических соединений, загрязняющих водные экосистемы, стимулируют рост и токсинообразование цианобактерий. Так, гербицид пентахлорфенол способствует росту M. aeruginosa, а антибиотик амоксилин стимулирует рост и образование микроцистина (De Morais et al., 2014; Liu et al., 2015). Значительное повышение синтеза микроцистина у M. aeruginosa отмечено и в присутствии неионогенного ПАВ – нонилфенола (Поляк, Сухаревич, 2016; Wang et al., 2007). Азольные соединения ингибируют рост цианобактерий, но могут способствовать образованию более токсичных структурных вариантов цианотоксинов (Поляк, 2015).
Антропогенные вещества, поступающие в водоемы, накапливаются в донных отложениях и становятся источником питательных веществ для бентосных цианобактерий (Paerl et al., 2016). При повышении концентрации биогенных элементов возрастает мутность воды, что ограничивает фотосинтетическую активность фитопланктона в верхних слоях. Такие условия благоприятны для цианобактерий, которые обладают плавучестью, и не являются азотфиксаторами. Так, представители рода Microcystis часто доминируют в загрязненных озерах с повышенной мутностью (Paerl, Fulton, 2006).
В загрязненных, богатых биогенными соединениями водоемах доминирование цианобактерий может быть связано и с фотосинтетическими процессами. Активное осуществление фотосинтеза при интенсивном размножении цианобактерий, сопровождается значительным потреблением углекислоты и резким увеличением рН (≥10). Такие изменения гидрологических условий неблагоприятно сказываются на других компонентах планктона (Paerl, Paul, 2012).
Основная часть исследований влияния антропогенных факторов на распространение цианобактерий выполнена для пресноводных цианобактерий и, значительно меньшая – для представителей морских экосистем. Тем не менее, авторы этих исследований полагают, что глобальное распространение цианобактерий в морях также во многом определяется увеличением содержания биогенных соединений (Glibert, Burford, 2017). Не вызывает сомнения тот факт, что глобальное потепление, изменение климата, обогащение водоемов биогенными соединениями и другими загрязняющими веществами антропогенного происхождения, оказывают совокупный эффект на распространение цианобактерий.
Распространение токсигенных цианобактерий
Основным негативным и опасным свойством цианобактерий является образование метаболитов, обладающих повышенной токсичностью – цианотоксинов. Глобальная экспансия токсигенных цианобактерий представляет наиболее серьезную угрозу для окружающей среды (Paerl, 2017). В пресноводных объектах к токсигенным относятся до 70% цианобактерий (Pham et al., 2015), и даже не образующие токсинов виды имеют гены, кодирующие синтез, например, микроцистинов (Christiansen et al., 2008).
По химической структуре токсины делят на III группы – пептиды, алкалоиды и липополисахариды. Токсины третьей группы являются структурным компонентом клеточных мембран (Волошко, Пиневич, 2014). Вопрос о роли токсинов двух первых групп в метаболизме цианобактерий пока остается дискуссионным. В клетках цианобактерий они могут выполнять различные функции, в том числе, функцию сидерофоров, участвовать в адаптации цианобактерий к изменяющимся условиям среды (освещенности, содержанию питательных веществ), в процессах quorum sensing регуляции, в аллелопатических взаимодействиях (Omidi et al., 2018). Аллелопатические взаимодействия, как одна из форм экологической конкуренции между организмами, широко распространены в природе, в том числе в водных биоценозах (Поляк, Сухаревич, 2019а). Экологическими последствиями аллелопатических эффектов и усиления синтеза цианотоксинов в присутствии других организмов являются накопление токсинов в пищевой цепи и снижение биоразнообразия (Pei et al., 2020).
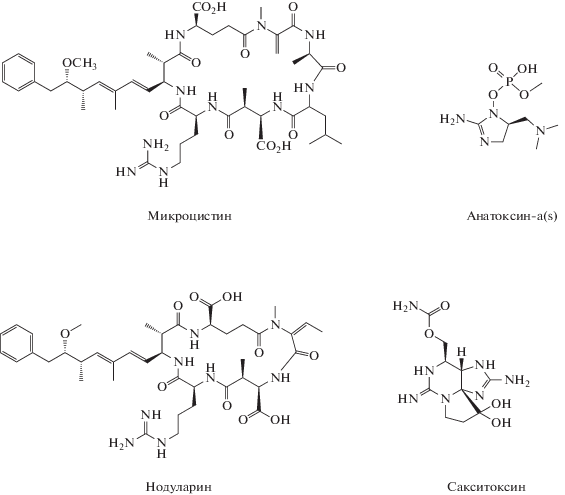
Циклические пептиды (микроцистины и нодуларины) растворимы в воде и легко проникают через липидные мембраны всех живых организмов (табл. 1). Их высокая токсичность объясняется наличием уникальной кислоты Adda (3-амино-9-метокси-2,6,8-тиметил-10-фенилдека-4,6-диеновой кислоты), которая выявлена только в токсинах цианобактерий (Harke et al., 2016), и циклической структурой (рис. 1). Линейные пептиды почти не проявляют токсических свойств, они в 100 раз менее токсичны, чем их циклические эквиваленты (Namikoshi, Rinehart, 1996).
Таблица 1.
Основные группы токсинов цианобактерий и их биологическая активность (по: Волошко, Пиневич, 2014; Поляк, Сухаревич, 2017; Dittmann et al., 2013)
| Токсины | Продуценты токсинов | Биологическая активность |
|---|---|---|
| Пептиды | ||
| Микроцистины | Microcystis, Anabaena, Nostoc, Oscillatoria, Phormidium и др. | Ингибируют протеинфосфатазы, нарушают цитоплазматическую мембрану, канцерогены |
| Нодуларины | Nodularia spumigena Mertens ex Bornet et Flahault | |
| Цилиндроспермопсины | Anabaena, Aphanizomenon, Cylindrospermopsis, Umezakia |
Ингибируют синтез белка, вызывают некротическое повреждение печени, почек, селезенки, легких, кишечника |
| Алкалоиды | ||
| Анатоксины | Anabaena, Oscillatoria, Aphanizomenon, Phormidium |
Нейротоксины, ингибируют ацетилхолинэстеразу |
| Сакситоксин и его аналоги | Anabaena, Lyngbya, Planktothrix, Aphanizomenon, Cylindrospermopsis | Нейротоксины, блокируют натриевые каналы |
| Липополисахариды | ||
| Липополисахариды | Вероятно, все цианобактерии | Эндотоксины, вызывают воспаления, раздражают желудочно-кишечный тракт |
К сильнодействующим токсинам относятся сакситоксин и его аналоги, известные под общим названием паралитические токсины моллюсков (paralytic shellfish toxins, PSTs). Они представляют собой группу разнообразных гетероциклических соединений (Carmichael, 1997). Анатоксины и PSTs обладают выраженным нейротоксическим действием (табл. 1). В последнее время наблюдается рост количества сообщений о выделении сакситоксин-продуцирующих цианобактерий из водоемов не только в тропических и субтропических, но и умеренных широтах (Белых и др., 2015).
С высокой токсичностью цианотоксинов связана повышенная опасность при использовании воды из пресноводных водоемов и резервуаров, в которых развиваются цианобактерии, для питьевых целей и полива, а также при купании и рыболовстве в пресных и морских водах (Carmichael, 2001).
По функциональным свойствам токсины разделяют на пять групп: гепатотоксины, нейротоксины, цитотоксины, дерматотоксины и внутриклеточные липополисахариды (Rastogi et al., 2014). К нейротоксинам относят и β-N-метиламино-L-аланин (BMAA). Эта небелковая аминокислота открыта сравнительно недавно, но уже обнаружена во многих странах Африки, Азии, Европы и Америки (Поляк, Сухаревич, 2017). ВМАА, который образуют почти все цианобактерии, отличается повышенной токсичностью и может быть причиной таких тяжелейших заболеваний, как болезни Альцгеймера и Паркинсона (Попова, Кокшарова, 2016; Merel et al., 2013).
При изучении токсигенных цианобактерий основное внимание уделяется представителям планктона и существенно меньшее – представителям бентосных сообществ пресноводных водоемов. В то же время известно, что бентосные цианобактерии образуют множество токсинов, в том числе, и токсичных метаболитов, характерных для планктонных форм (Quiblier et al., 2013). Токсинообразование и рост бентосных цианобактерий, как и планктонных, зависит от многих физико-химических, климатических и антропогенных факторов.
В процессе интенсивного роста бентосные цианобактерии образуют толстые маты (до 70 см в толщину) (Dasey et al., 2005). При достижении определенной толщины маты могут отделяться от субстрата и накапливаться в береговой зоне. В этом случае риски для человека и животных возрастают.
Поскольку цианобактериальные “цветения” становятся серьезной проблемой для многих отраслей хозяйства, в том числе водоснабжения, рыболовства, рекреационного использования водоемов, туризма (Carmichael, 2001; Paerl et al., 2018), цианотоксины и их воздействие на человека активно изучают. Установлено, что цианотоксины могут вызывать различные заболевания, в том числе лихорадку, нервные расстройства, гастроэнтерит, болезни печени и почек, злокачественные опухоли и многие другие (Drobac et al., 2013; Kamal, Ahmad, 2014).
В организм человека и животных цианотоксины попадают с питьевой водой, пищей, при купании в реках и озерах, особенно во время “цветения” воды. Многочисленные случаи заболеваний человека и животных, связанные с цианотоксинами, зафиксированы в Европе, Азии, Африке, Австралии и Америке (Turner et al., 1990; Ueno et al., 1996; Jochimsen et al., 1998; Codd et al., 2005; Falconer, 2005).
Программы мониторинга и управления рисками, возникающими при токсичных “цветениях”, приняты во многих странах, однако, почти все они касаются планктонных форм цианобактерий. Несмотря на то, что продуцентами обнаруженных в питьевой воде цианотоксинов во многих случаях являются представители бентоса (Izaguirre et al., 2007; Smith et al., 2012), руководства по мониторингу и управлению рисками, связанными с бентосными цианобактериями, пока разработаны только в двух странах – в Новой Зеландии и на Кубе (Quiblier et al., 2013).
В России, несмотря на интенсификацию исследований, посвященных развитию массовых видов цианобактерий, в последние годы, они по-прежнему носят единичный характер (Поляк и др., 2011; Румянцев и др., 2011; Волошко, Пиневич, 2014; Поляк и др., 2014; Чернова и др., 2017; Белых и др., 2020). В РФ отсутствует национальная программа по мониторингу токсичных “цветений” и изучению их возбудителей.
Одоранты цианобактерий и их негативный эффект на качество воды
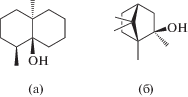
Следует отметить еще одно негативное свойство цианобактерий, а именно, синтез метаболитов, ухудшающих органолептические свойства (вкус и запах) питьевой воды (Lee et al., 2017). Самые известные и хорошо изученные одоранты – геосмин и 2-метилизоборнеол (рис. 2), каждый из них существует в виде, как (+), так и (–) энантиомеров. При этом наличие запаха связано, главным образом, с (–) энантиомерами (Watson et al., 2007).
Геосмин и 2-метилизоборнеол встречаются в природных условиях как одновременно, так и по отдельности, варьирует и концентрация каждого из них. Эти вещества нетоксичны, кроме того, их образование носит эпизодический характер, поэтому даже при ежегодном “цветении” водоема запах может не появляться годами.
Одорирующие вещества образуют многие бентосные и пелагические микроорганизмы, а также некоторые эукариоты – грибы, амебы, печеночники (Jüttner, Watson, 2007). Особенно активно их синтезируют актиномицеты из рода Streptomyces. Тем не менее основным источником одорантов в природе считаются цианобактерии (Lee et al., 2017).
Геосмин и 2-метилизоборнеол содержатся как внутри клеток цианобактерий, так и в растворенном виде в воде. Соотношение внутри- и внеклеточных одорантов варьирует в зависимости от вида цианобактерий, их физиологического состояния, фазы роста и условий среды (Watson et al., 2016). Основной механизм выделения одорантов в среду – это разрушение клеток в результате различных процессов (Jüttner, Watson, 2007).
Химически геосмин и 2-метилизоборнеол относительно стабильны, кроме того, они устойчивы к биодеградации (Peter, von Gunten, 2007). В связи с этим, они могут длительное время сохраняться в воде, что осложняет ее очистку (Li et al., 2012). Запах геосмина ощущается при концентрации 0.001–0.02 мкг/л, 2-метилизоборнеола – 0.002–0.04 мкг/л (Бутакова, 2013). Под действием стресса (снижение температуры, фотоокисление и др.), а также в конце лета и осенью количество образуемых цианобактериями и выделяемых в среду одорантов возрастает (Jüttner, Watson, 2007).
Таким образом, цианобактерии не только представляют угрозу для человека и животных, но и требуют значительных затрат на очистку воды от токсинов и одорантов, на создание условий, безопасных для туризма (Ibelings, Chorus, 2007; Dodds et al., 2009). Глобальное потепление и изменение климата может привести к тому, что эти расходы со временем существенно возрастут.
Значительные затраты требуются и при борьбе с биокоррозией (трубопроводов, оборудования электростанций, плотин и т.д.), вызванной цианобактериальным обрастанием в виде биопленок (Румянцев и др., 2011). Наносимый цианобактериями ущерб, проблемы в хозяйственной деятельности, негативное воздействие на окружающую среду и здоровье человека, свидетельствуют о необходимости интенсивных исследований процессов глобального распространения цианобактерий учеными разных стран.
ЗАКЛЮЧЕНИЕ
В настоящее время стремительное распространение токсигенных цианобактерий в пресноводных водоемах всего мира представляет значительную угрозу для человека, животных и окружающей среды в целом. Исследования, проведенные в последние десятилетия, позволили достичь реального прогресса в понимании этого явления и оценке действия различных факторов на развитие и распространение цианобактерий, однако многие вопросы пока не решены.
Результаты исследований свидетельствуют, что это опасное явление в значительной степени определяется уникальной физиологией цианобактерий и их уникальной способностью адаптироваться к разнообразным условиям среды, в том числе и экстремальным. Эти свойства обусловливают их доминирование в самых разных водоемах и климатических условиях.
Распространение цианобактерий в пресноводных и морских водоемах связано с постоянно возрастающей эвтрофикацией природных вод. Многие авторы полагают, что усиление процессов урбанизации и рост численности населения в будущем приведут к еще более активному размножению и увеличению частоты встречаемости цианобактерий.
Другая важнейшая причина этого природного явления – изменение климата, особенно, в совокупности с эвтрофикацией водоемов и физиологическими особенностями цианобактерий. Лабораторные и полевые наблюдения антропогенного загрязнения природных вод показывают, что сочетание повышенной температуры с увеличением содержания углекислого газа в атмосфере создают весьма благоприятные условия для доминирования цианобактерий в различных экосистемах.
В настоящее время предложено множество способов и подходов к решению этой проблемы, различных по степени сложности и затратам, как временным, так и экономическим. По мнению некоторых авторов, для контроля над ситуацией необходимы специальные системы, направленные на снижение скорости и степени потепления, глобальное “обуздание” парникового эффекта (Paerl, Paul, 2012). В противном случае глобальное потепление и изменение физико-химических параметров водоемов будут способствовать ускоренному распространению цианобактерий.
К важнейшим задачам относятся более обширные и глубокие исследования бентосных форм, от которых во многом зависят распространение и сохранение жизнеспособности цианобактерий (Quiblier et al., 2013; Burford et al., 2020).
Для снижения негативных последствий цианобактериальных “цветений” необходим эффективный экологический мониторинг водоемов, в том числе контроль степени их эвтрофикации, изучение качественного и количественного состава фитопланктона, определение содержания цианотоксинов. Ограничение дальнейшего распространения токсигенных цианобактерий может стать одной из сложнейших задач современного мира, для решения которой необходимы лабораторные и полевые исследования и объединенные усилия биологов, химиков, экологов и других специалистов разных стран.
Список литературы
Абдуллин Ш.Р., Багмет В.Б. 2016. Миксотрофия цианобактерий и водорослей в условиях пещер // Журн. общ. биол. Т. 77. № 1. С. 54.
Белых О.И., Гладких А.С., Сороковикова Е.Г. и др. 2015. Сакситоксин-продуцирующие цианобактерии в озере Байкал // Сибирский экол. журн. Т. 22. № 2. С. 229.
Белых О.И., Тихонова И.В., Кузьмин А.В. и др. 2020. Токсин-продуцирующие цианобактерии в озере Байкал и водоемах Байкальского региона // Теоретическая и прикладная экология. № 1. С. 21.
Булгаков Н.Г., Левич А.П. 1995. Биогенные элементы в среде и фитопланктон: отношение азота к фосфору как самостоятельный регулирующий фактор // Успехи соврем. биол. Т. 15. Вып. 1. С. 13.
Бутакова Е.А. 2013. Особенности одорирующих веществ (геосмина и 2-метилизоборнеола) как вторичных метаболитов цианобактерий // Физиол. раст. Т. 60. С. 537.
Волошко Л.Н., Пиневич А.В. 2014. Разнообразие токсинов цианобактерий // Астрах. вест. экол. обр. № 1(27). С. 68.
Поляк Ю.М. 2015. Азольные соединения как фактор воздействия на массовые виды цианобактерий // Вода: химия и экология. № 12. С. 10.
Поляк Ю.М., Сухаревич В.И. 2016. Влияние нонилфенола на цианобактерию Microcystis aeruginosa в различных окислительно-восстановительных условиях среды // Вест. биотех. и физ.-хим. биол. им. Ю.А. Овчинникова. Т. 12. № 3. С. 23.
Поляк Ю.М., Сухаревич В.И. 2017. Токсигенные цианобактерии: распространение, регуляция синтеза токсинов, способы их деструкции // Вода: химия и экология. № 11–12. С. 125.
Поляк Ю.М., Сухаревич В.И. 2019а. Аллелопатические взаимоотношения растений и микроорганизмов в почвенных экосистемах // Успехи соврем. биол. Т. 2. С. 147.
Поляк Ю.М., Cухаревич В.И. 2019б. Бентосные цианобактерии: особенности роста, физиологии и токсинообразования // Региональная экология. № 2(56). С. 57.
Поляк Ю.М., Зайцева Т.Б., Петрова В.H., Медведева Н.Г. 2011. Развитие массовых видов цианобактерий в условиях загрязнения тяжелыми металлами // Гидробиол. журн. Т. 47. № 1. С. 84.
Поляк Ю.М., Шигаева Т.Д., Кудрявцева В.А., Сухаревич В.И. 2014. Влияние аэрации и редокспотенциала на рост, фотосинтез и токсинообразование цианобактерии Microcystis aeruginosa 973 // Вода: химия и экология. № 11. С. 60.
Попова А.А., Кокшарова О.А. 2016. Нейротоксичная небелковая аминокислота – β-N-метиламино-L-аланин и ее роль в биологических системах // Биохимия. 2016. Т. 81. Вып. 8. С. 1021.
Румянцев В.А., Крюков Л.Н., Поздняков Ш.Р., Жуковский А.В. 2011. Цианобактериальное “цветение” воды – источник проблем природопользования и стимул инноваций в России // Общество. Среда. Развитие. № 2. С. 222.
Тарасова В.Н., Андросова В.И., Сонина А.В. 2012. Лишайники. Физиология, экология, лихеноиндикация. Петрозаводск: Изд-во Петрозавод. гос. ун-та.
Чернова Е.Н., Русских Я.В., Жаковская З.А. 2017. Токсичные метаболиты сине-зеленых водорослей и методы их определения // Вестник СПбГУ. Физика и химия. Т. 4(62). Вып. 4. С. 440.
Briand J.F., Leboulanger C., Humbert J.F. et al. 2004. Cylindropsermopsis raciborskii (Cyanobacteria) invasion at mid-latitudes: Selection, wide physiological tolerance or global warming? // J. Phycol. V. 40. № 2. P. 231.
Briland R.D., Stone J.P., Manubolu M. et al. 2020. Cyanobacterial blooms modify food web structure and interactions in western Lake Erie // Harmful Algae. V. 92. 101586. https://doi.org/10.1016/j.hal.2019.03.004
Burford M.A., Hamilton D.P., Wood S.A. 2018. Emerging HAB research issues in freshwater environments // Global Ecology and Oceanography of Harmful Algal Blooms, Ecological Studies 232. Cham: Springer. P. 381.
Burford M.A., Beardall J., Willis A. et al. 2016. Understanding the winning strategies used by the bloom forming cyanobacterium Cylindrospermopsis raciborskii // Harmful Algae. V. 54. P. 44.
Burford M.A., Carey C.C., Hamilton D.P. et al. 2020. Perspective: Advancing the research agenda for improving understanding of cyanobacteria in a future of global change // Harmful Algae. V. 91. 101601. https://doi.org/10.1016/j.hal.2019.04.004
Carreto J.I., Carignan M.O. 2011. Mycosporine-like amino acids: relevant secondary metabolites. Chemical and ecological aspects // Mar. Drugs. V. 9. P. 387.
Carey C.C., Ibelings B.W., Hoffman E.P. et al. 2012. Eco-physiological adaptations that favour freshwater cyanobacteria in a changing climate // Water Res. V. 46. P. 1394.
Carmichael W.W. 1997. The cyanotoxins // Adv. Bot. Res. V. 27. P. 211.
Carmichael W.W. 2001. Health effects of toxin producing cyanobacteria: the cyanoHABs // Human Ecol. Risk Assessment. V. 7. P. 1393.
Christiansen G., Molitor C., Philmus B., Kurmayer R. 2008. Nontoxic strains of cyanobacteria are the result of major gene deletion events induced by a transposable element // Mol. Biol. Evol. V. 25. P. 1695.
Codd G.A., Morrison L.F., Metcalf J.S. 2005. Cyanobacterial toxins: Risk management for health protection // Toxicol. Appl. Pharmacol. V. 203. P. 264.
Conley D.J., Paerl H.W., Howarth R.W. et al. 2009. Ecology. Controlling eutrophication: Nitrogen and phosphorus // Science. V. 323. P. 1014.
Dai R., Liu H., Qu J., Zhao X., Hou Y. 2009. Effects of amino acids on microcystin production of the Microcystis aeruginosa // J. Hazard. Mater. V. 30. № 161 (2–3). P. 730.
Dasey M., Ryan N., Wilson J. et al. 2005. Investigations into the taxonomy, toxicity and ecology of benthic cyanobacterial accumulations in Myall Lake, Australia // Mar. Freshwater Res. V. 56. P. 45.
De Morais P., Stoichev T., Basto M.C.P. et al. 2014. Cyanobacterium Microcystis aeruginosa response to pentachlorophenol and comparison with that of the microalga Chlorella vulgaris // Water Res. V. 52. P. 63.
Dittmann E., Fewer D.P., Neilan B.A. 2013. Cyanobacterial toxins: biosynthetic routes and evolutionary roots // FEMS Microbiol. Rev. V. 37. P. 23.
Dodds W.K., Bouska W.W., Eitzmann J.I. et al. 2009. Eutrophication of U.S. freshwaters: analysis of potential economic damages // Environ. Sci. Technol. V. 43. P. 12.
Drobac D., Tokido N., Simeunovic J. et al. 2013. Human exposure to cyanotoxins and their effects on health // Archives Indust. Hygiene Toxicol. V. 64. P. 305.
Dziallas C., Grossart H.-P. 2011. Increasing oxygen and water temperature select for toxic Microcystis sp. // PLoS ONE. V. 6. № 9. P. 1.
Falconer I.R. 2005. Prevention, mitigation and remediation of cyanobacterial blooms in reservoirs // Cyanobacterial Toxins of Drinking Water Supplies. London: CRC Press. P. 215.
Glibert P.M., Burford M.A. 2017. Globally changing nutrient loads and harmful algal blooms: Recent advances, new paradigms, and continuing challenges // Oceanography. V. 30. P. 58.
Hallock P. 2005. Global change and modern coral reefs: new opportunities to understand shallow-water carbonate depositional processes // Sedimentary Geol. V. 175. P. 19.
Halstvedt C.B., Rohrlack T., Andersen T. et al. 2007. Seasonal dynamics and depth distribution of Planktothrix spp. in Lake Steinsfjorden (Norway) related to environmental factors // J. Plankt. Res. V. 29. № 5. P. 471.
Harke M.J., Steffen M.M., Gobler C.J. et al. 2016. A review of the global ecology, genomics, and biogeography of the toxic cyanobacterium, Microcystis spp. // Harmful Algae. V. 54. P. 4.
He Y.-Y., Häder D.-P., 2002. Involvement of reactive oxygen species in the UV-B damage to the cyanobacterium Anabaena sp. // J. Photochem. Photobiol. B: Biology. V. 66. P. 73.
Heath M.W., Wood S.A., Ryan K.G. 2011. Spatial and temporal variability in Phormidium mats and associated anatoxin-a and homoanatoxin-a in two New Zealand rivers // Aquat. Microb. Ecol. V. 64. P. 69.
Hodgkins G.A. 2013. The importance of record length in estimating the magnitude of climatic changes: an example using 175 years of Lake ice-out dates in New England // Climate Change. V. 119. P. 705.
Ibelings B.W., Chorus I. 2007. Accumulation of cyanobacterial toxins in freshwater-seafood and its consequences for public health: A review // Env. Pollut. V. 150. P. 177.
Izaguirre G., Jungblut A.D., Neilan B.A. 2007. Benthic cyanobacteria (Oscillatoriaceae) that produce microcystin-LR, isolated from four reservoirs in southern California // Water Res. V. 41. P. 492.
Jiang Y., Ji B., Wong R.N.S., Wong M.H. 2008. Statistical study of the effects of environmental factors on the growth and microcystins production of bloom-forming cyanobacterium Microcystis aeruginosa // Harmful Algae. V. 7. P. 127.
Jochimsen E.M., Carmichael W.W., An J.S. et al. 1998. Liver failure and death after exposure to microcystins at a hemodialysis center in Brazil // The New England J. Medicine V. 338. P. 873.
Jüttner F., Watson S.B. 2007. Biochemical and ecological control of geosmin and 2-methylisoborneol in source waters // Appl. Environ. Microbiol. V. 73. P. 4395–4406.
Kahru M., Elmgren R., Kaisermc J. et al. 2020. Cyanobacterial blooms in the Baltic Sea: Correlations with environmental factors // Harmful Algae. V. 92. 101739. https://doi.org/10.1016/j.hal.2019.101739
Kamal A.A., Ahmad I.Z. 2014. Cyanobacteria the “blue green algae” and its novel applications: A brief review // Int. J. Innov. Appl. Stud. V. 7. P. 251.
Kaplan A., Harel M., Kaplan-Levy R.N. et al. 2012. The languages spoken in the water body (or the biological role of cyanobacterial toxins) // Front. Microbiol. V. 3. P. 1.
Kosten S., Huszar V.L.M., Becares E. et al. 2012. Warmer climates boost cyanobacterial dominance in shallow lakes // Glob. Change Biol. V. 18. P. 118.
Kotak B.G., Lam A.K.-Y., Prepas E.E. et al. 1995. Variability of the hepatotoxin microcystin-LR in hypereutrophic drinking water lakes // J. Phycol. V. 31. P. 248.
Kurmayer R., Deng L., Entfellner E. 2016. Role of toxic and bioactive secondary metabolites in colonization and bloom formation by filamentous cyanobacteria // Harmful Algae. V. 54. P. 69.
Lehtimäki J., Moisander P., Sivonen K., Kononen K. 1997. Growth, nitrogen fxation, and nodularin production by two baltic sea cyanobacteria // Appl. Environ. Microbiol. V. 63. № 5. P. 1647.
Lee J., Rai P.K., Jeon Y.J. et al. 2017. The role of algae and cyanobacteria in the production and release of odorants in water // Environ. Pollut. V. 227. P. 252.
Li Z., Hobson P., An W. et al. 2012. Earthy odor compounds production and loss in three cyanobacterial cultures // Water Res. V. 46. P. 5165.
Li X., Dreher T.W., Li R. 2016. An overview of diversity, occurrence, genetics and toxin production of bloom-forming Dolichospermum (Anabaena) species // Harmful Algae. V. 54. P. 54.
Liu Y., Wang F., Chen X. et al. 2015. Cellular responses and biodegradation of amoxicillin in Microcystis aeruginosa at different nitrogen levels // Ecotoxicol. Environ. Saf. V. 111. P. 138.
Lopes V.R., Vasconcelos V.M. 2011. Planktonic and benthic cyanobacteria of European brackish waters: a perspective on estuaries and brackish seas // Eur. J. Phycol. V. 46. № 3. P. 292.
Makhalanyane T.P., Valverde A., Velázquez D. et al. 2015. Ecology and biogeochemistry of cyanobacteria in soils permafrost, aquatic and cryptic polar habitats // Biodivers. Conserv. V. 24. P. 819.
Merel S., Walker D., Chicana R. et al. 2013. State of knowledge and concerns on cyanobacterial blooms and cyanotoxins // Environ. Int. V. 59. P. 303.
Moisander P.H., Ochiai M., Lincoff A. 2009. Nutrient limitation of Microcystis aeruginosa in northern California Klamath River reservoirs // Harmful Algae. V. 8. P. 889.
Molot L.A., Watson S.B., Creed I.F. et al. 2014. A novel model for cyanobacteria bloom formation: the critical role of anoxia and ferrous iron // Freshwater Biol. V. 59. P. 1323.
Namikoshi M., Rinehart K.L. 1996. Bioactive compounds produced by cyanobacteria // J. Industr. Microbiol. Biotechn. V. 17. P. 373.
Novotny V. 1999. Diffuse pollution from agriculture – A worldwide outlook // Water Sci. Technol. V. 39. P. 1.
Oh H.M., Lee S.J., Jang M.H., Yoon B.D. 2000. Microcystin production by Microcystis aeruginosa in a phosphorus-limited chemostat // Appl. Environ. Microbiol. V. 66. № 1. P. 176.
Omidi A., Esterhuizen-Londt M., Pflugmacher S. 2018. Still challenging: the ecological function of the cyanobacterial toxin microcystin – What we know so far // Toxin Reviews. V. 37. P. 87.
O’Neil J.M., Davis T.W., Burford M.A., Gobler C.J. 2012. The rise of harmful cyanobacteria blooms: the potential roles of eutrophication and climate change // Harmful Algae. V. 14. P. 313.
Paerl H.W., Fulton R.S. 2006. Ecology of harmful cyanobacteria // Ecology of Harmful Algae. Berlin: Springer. P. 95.
Paerl H.W., Paul V.J. 2012. Climate change: links to global expansion of harmful cyanobacteria // Water Res. V. 46. P. 1349.
Paerl H.W., Gardner W.S., Havens K.E. et al. 2016. Mitigating cyanobacterial harmful algal blooms in aquatic ecosystems impacted by climate change and anthropogenic nutrients // Harmful Algae. V. 54. P. 213.
Paerl H.W. 2017. Controlling cyanobacterial harmful blooms in freshwater ecosystems // Microb. Biotechnol. V. 10. P. 1106.
Paerl H.W., Otten T.G., Kudela R. 2018. Mitigating the expansion of harmful algal blooms across the freshwater-to-marine continuum // Environ. Sci. Technol. V. 52. P. 5519.
Paul V.J. 2008. Global warming and cyanobacterial harmful algal blooms // Cyanobacterial Harmful Algal Blooms: State of the Science and Research Needs. Advances in Experimental Medicine and Biology. V. 619. Springer. P. 239.
Pei Y., Xu R., Hilt S., Chang X. 2020. Effects of cyanobacterial secondary metabolites on phytoplankton community succession // Co-Evolution of Secondary Metabolites. Reference Series in Phytochemistry. Cambridge: Springer. P. 323.
Peter A., von Gunten U. 2007. Oxidation kinetics of selected taste and odor compounds during ozonation of drinking water // Environ. Sci. Technol. V. 41. P. 626.
Pham T.L., Shimizu K., Dao T.S. et al. 2015. Microcystin uptake and biochemical responses in the freshwater Clam Corbicula leana P., exposed to toxic and non-toxic Microcystis aeruginosa: Evidence of tolerance cyanotoxins // Toxicol. Reports. V. 2. P. 88.
Polyak Y., Zaytseva T., Medvedeva N. 2013. Response of toxic cyanobacterium Microcystis aeruginosa to environmental pollution // Water Air Soil Pollut. V. 224. № 4. P. 1.
Potts M. 1994. Desiccation tolerance of prokaryotes // Microbiol. Reviews. V. 58. P. 755.
Quiblier C., Wood S., Echenique-Subiabre I. et al. 2013. A review of current knowledge on toxic benthic freshwater cyanobacteria – ecology, toxin production and risk management // Water Res. V. 47. P. 5464.
Rastogi R.P., Sinha R.P., Incharoensakdi A. 2014. The cyanotoxin-microcystins: current overview // Reviews Environ. Sci. Biotechnol. V. 13. № 2. P. 215.
Rastogi R.P., Madamwar D., Incharoensakdi A. 2015. Bloom dynamics of cyanobacteria and their toxins: Environmental health impacts and mitigation strategies // Front. Microbiol. V. 6. P. 1.
Reynolds C.S. 2006. Ecology of Phytoplankton (Ecology, Biodiversity and Conservation). Cambridge: Cambridge University Press.
Robarts R.D., Waiser M.J., Arts M.T., Evans M.S. 2005. Seasonal and diel changes of dissolved oxygen in a hypertrophic prairie lake // Lakes and Reservoirs: Research and Management. V. 10. P. 167.
Scholz S.N., Esterhuizen-Londt M., Pflugmacher S. 2017. Rise of toxic cyanobacterial blooms in temperate freshwater lakes: causes, correlations and possible countermeasures // Toxicol. Environ. Chem. V. 99. № 4. P. 543.
Scott J.T., Marcarelli A.M. 2012. Cyanobacteria in freshwater benthic environments // The Ecology of Cyanobacteria. Dordrecht: Springer. P. 271.
Smith F.M.J., Wood S.A., van Ginkel R. et al. 2011. First report of saxitoxin production by a species of the freshwater benthic cyanobacterium, Scytonema Agardh. // Toxicon. V. 57. P. 566.
Smith F., Wood S.A., Wilks T. et al. 2012. Survey of Scytonema (Cyanobacteria) and associated saxitoxins in the littoral zone of recreational lakes in Canterbury (New Zealand) // Phycologia. V. 51. P. 542.
Smith D.R., King K.W., Williams M.R. 2015. What is causing the harmful algal blooms in Lake Erie? // J. Soil Water Conservation. V. 70. P. 27.
Sulis A., Buscarinu P., Soru O., Sechi G.M. 2014. Trophic state and toxic cyanobacteria density in optimization modeling of multi-Reservoir water resource systems // Toxins. V. 6. P. 1366.
Tonk L., Bosch K., Visser P.M., Huisman J. 2007. Salt tolerance of the harmful cyanobacterium Microcystis aeruginosa // Aquat. Microb. Ecol. V. 46. P. 117.
Turner P.C., Gammie A.J., Hollinrake K., Codd G.A. 1990. Pneumonia associated with contact with cyanobacteria // British Med. J. V. 300. P. 1440.
Ueno Y., Nagata S., Tsutsumi T. et al. 1996. Detection of microcystin, a blue-green algal hepatotoxin, in drinking water sampled in Haimen and Fusui, endemic areas of primary liver cancer in China, by highly sensitive immunoassay // Carcinogenesis. V. 17. P. 1317.
Van Drecht G., Bouwman A.F., Harrison J., Knoop J.M. 2009. Global Nitrogen and 1651 Phosphate in Urban Wastewater for the Period 1970 to 2050 // Global Biogeochem. Cycles. V. 23. № 4. P. 1.
Wagner C., Adrian R. 2009. Cyanobacteria dominance: quantifying the effects of climate change // Limnol., Oceanogr. V. 54. P. 2460.
Wang J. Wang J., Xie P., Guo N. 2007. Effects of nonylphenol on the growth and microcystin production of Microcystis strains // Environ. Res. V. 103. P. 70.
Watanabe M.F., Oishi S. 1985. Effects of environmental factors on toxicity of a cyanobacterium (Microcystis aeruginosa) under culture conditions // Appl. Environ. Microbiol. V. 49. № 5. P. 1342.
Watson S.B., Charlton M., Yerubandi R. et al. 2007. Off flavour in large waterbodies: physics, chemistry and biology in synchrony // Water Sci. Technol. V. 55. P. 1.
Watson S.B., Monis P., Baker P., Giglio S. 2016. Biochemistry and genetics of taste- and odor-producing cyanobacteria // Harmful Algae. V. 54. P. 112.
Xue L., Zhang Y., Zhang T. et al. 2005. Effects of enhanced ultraviolet-B radiation on algae and cyanobacteria // Crit. Rev. Microbiol. V. 31. P. 79.
Zilius M., De Wit R., Bartoli M. 2016. Response of sedimentary processes to cyanobacteria loading // J. Limnol. V. 75. P. 236.
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод