Биология внутренних вод, 2021, № 1, стр. 35-46
Эффективность переноса биологически ценных веществ от фитопланктона к планктонным ракообразным в мезотрофных условиях
И. Ю. Фенева a, *, Е. Г. Сахарова b, Ж. Ф. Бусева c, М. И. Гладышев d, Н. Н. Сущик d, e, З. И. Горелышева c, М. Карпович f, В. П. Семенченко c
a Институт проблем экологии и эволюции им. А.Н. Северцова Российской академии наук
Москва, Россия
b Институт биологии внутренних вод им. И.Д. Папанина Росиийской академии наук
Некоузский р-н, Ярославская обл., пос. Борок, Россия
c Научно-практический центр Национальной академии наук Беларуси по биоресурсам
Минск, Республика Беларусь
d Федеральный исследовательский центр Красноярский научный центр Сибирского отделения
Российской академии наук
Красноярск, Россия
e Сибирский федеральный университет
Красноярск, Россия
f Белостокский университет, Институт биологии, отделение гидробиологии
Белосток, Польша
* E-mail: feniova@mail.ru
Поступила в редакцию 27.01.2020
После доработки 03.02.2020
Принята к публикации 13.03.2020
Аннотация
Дана оценка эффективности переноса биологически ценных веществ (углерода, фосфора, азота, жирных кислот, включая полиненасыщенные жирные кислоты), от фитопланктона к планктонным ракообразным в экспериментальных мезокосмах в присутствии/в отсутствие рыб. Опыты проводили в мезотрофных условиях в 300-литровых мезокосмах. Получено, что разные вещества передаются от продуцентов к консументам с разной эффективностью. ЖК, включая ПНЖК, передавались менее эффективно, чем углерод. Эффективность переноса биогенных элементов, особенно фосфора, напротив, была выше, чем углерода. Это свидетельствует о способности планктонных ракообразных накапливать биогенные элементы, что повышает их качество как ресурса для последующих звеньев трофической сети. Рыбы значительно снижали эффективность переноса углерода от фитопланктона к планктонным ракообразным в единице объема, но не влияли на перенос веществ на единицу биомассы. Таким образом, качество планктонных ракообразных как пищевого ресурса для вышестоящих трофических уровней не снижалось в присутствии рыб, несмотря на сокращение эффективности переноса биологически ценных веществ в единице объема под их влиянием. Поскольку эффективность передачи биологически ценных веществ от фитопланктона к зоопланктону определяет функционирование всей трофической цепи, то следует искать способы ее повышения.
ВВЕДЕНИЕ
Планктонные сообщества представляют собой основу трофической пирамиды в пресноводных экосистемах. От того насколько эффективно передаются от фито- к зоопланктону биологически ценные вещества, к которым относятся, помимо углерода, фосфор, азот и ЖК, включая ПНЖК, зависит качество биологических ресурсов. Считается, что в среднем эффективность переноса углерода от одного трофического уровня к последующему составляет 10% (Lindeman, 1942). Эффективность передачи веществ может колебаться от 2–3 до 20% в зависимости от условий среды (Slobodkin, 1972). Показано, что в пресноводных озерах эффективность переноса углерода от фитопланктона к зоопланктону варьирует в широком диапазоне – от 5 до 30% (Lacroix, 1999).
Долгое время поток вещества и энергии рассматривался как одно целое, без разделения его на отдельные компоненты (Pauly, Christensen, 1995; Schulz et al., 2004). Однако показано, что разные вещества могут передаваться с разной эффективностью (Gladyshev et al., 2011). Сложность механизмов регуляции связана еще и с необходимостью поддержания гомеостаза у зоопланктонных организмов (Sterner, Hessen, 1994). Поэтому зоопланктон для поддержания постоянства вынужден накапливать вещества, находящиеся в недостатке и выделять вещества, содержащиеся в избытке, что отражается на скорости роста и репродукции зоопланктона (Schoo et al., 2013).
Один из факторов, влияющих на эффективность переноса биологически ценных веществ от фитопланктона к планктонным ракообразным, – планктоноядные рыбы. Они могут оказывать непрямое влияние на фитопланктон. Поскольку планктоноядные рыбы снижают численность ракообразных-фильтраторов, то повышается концентрация водорослей (Semenchenko et al., 2007). Кроме того, ракообразные потребляют узкий диапазон пищевых частиц, как правило <30 мкм (Sommer U., Sommer F., 2006), поэтому рыбы, снижая численность ракообразных, могут способствовать повышению доли мелких видов водорослей. Также они способны стимулировать развитие цианобактерий в результате своей жизнедеятельности, как показано на примере эвтрофного озера (Kolmakov, Gladyshev, 2003; Kolmakov, 2014) и в экспериментах (Feniova et al., 2019). Следует отметить, что содержание биологически ценных веществ неодинаково в разных видах водорослей (Gulati, DeMott, 1997; Muller-Navarra, 1995). Таким образом, в результате изменения видовой и размерной структуры фитопланктона под влиянием рыб, может изменяться их содержание в пищевых ресурсах планктонных ракообразных, что в свою очередь повлечет за собой изменение в эффективности переноса биологически ценных веществ от фитопланктона к зоопланктону, оцениваемой как отношение вторичной продукции к первичной.
Цель работы – определить эффективность переноса биологически ценных веществ (углерода, фосфора, азота, ЖК, включая ПНЖК) от фитопланктона к планктонным ракообразным в мезотрофных условиях. Исследования проведены в экспериментальных мезокосмах, где мы манипулировали фактором присутствие/отсутствие рыб для определения их влияния на структуру фитопланктона и, как следствие, на эффективность переноса биологически ценных веществ.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Наблюдения проводили в аквариумах объемом 300 л (0.94 × 0.64 × 0.50 м), заполняя их водой из мезотрофного оз. Майч (северо-восточная Польша, площадь 163.5 га, максимальная глубина 16.4 м, средняя 6 м) (Gliwicz et аl., 1981). Эксперимент включал два варианта в трехкратной повторности каждый – мезотрофные условия без рыб (контроль (К)) и мезотрофные условия с рыбами (Р). В мезокосмах с рыбами содержали по одной особи ерша Gymnocephalus cernuus (L., 1758) размером 7.5–11 см. Рыб помещали в 5-литровые контейнеры, подвешенные в аквариумах. Стенки контейнеров имели отверстия, которые не препятствовали свободному перемещению зоопланктона, но препятствовали выходу рыб. Один раз в сутки рыб выпускали на 1 ч из контейнеров для свободного поиска пищи. Таким образом, мы ограничивали влияние рыб на планктонных ракообразных, чтобы не происходила их избыточная эксплуатация рыбами. Эксперимент проводили в течение 30 сут.
Концентрацию хлорофилла а измеряли каждые 10 сут с помощью спектрофотометра FluoroProbe, который оценивал концентрацию суммарного хлорофилла и хлорофилла зеленых, криптофитовых, диатомовых водорослей и цианобактерий. Биомассу фитопланктона, выраженную в единицах углерода на литр (мг С/л), определяли расчетным методом по концентрации общего хлорофилла а (мкг/л), используя уравнения, предложенные Якоби и Зохари (Yacobi, Zohary, 2010).
Для более детального анализа таксономической структуры фитопланктона в эксперименте применяли микроскопический метод. Фитопланктон концентрировали с помощью осадочного метода и фиксировали раствором Утермеля с добавлением формалина (Кузьмин, 1975). Клетки водорослей подсчитывали под световым микроскопом (Nikon Optiphot 2). Биомассу отдельных видов или родов (мг/л) определяли с помощью счетно-объемного метода, приравнивая клетки водорослей к соответствующим геометрическим фигурам (Vinberg, Lavrenteva, 1982; Mikheeva, 1989). Размеры клеток водорослей измеряли окуляр-микрометром, размерная структура фитопланктона была представлена тремя фракциями (диапазонами): <30, 30–60 и >60 мкм.
Пробы планктонных ракообразных отбирали с интервалом в 10 сут 2.6-литровым батометром и фиксировали 4%-ным формалином (Błędzki, Rybak, 2016). Для оценки сырого веса зоопланктона использовали зависимость массы особей планктонных ракообразных от их средней длины. Для расчета биомассы планктонных ракообразных в единицах углерода использовали коэффициент, предложенный А.Ф. Алимовым (Alimov, 1989).
Содержание общих ЖК, ПНЖК (ЭПК (20:5n-3) и ДГК (22:6n-3)), углерода, азота и фосфора в сестоне и ракообразных определяли в начале и конце опыта, чтобы не нарушить ход эксперимента, поскольку для проведения биохимического и элементного анализа требуется до 100 л воды. Для подготовки проб на содержание общих ЖК, ПНЖК, углерода, азота и фосфора в сестоне воду фильтровали через газ с размером ячеи 110 мкм, чтобы удалить крупный зоопланктон и другие частицы, далее – через стекловолоконные фильтры GF/F (Whatman) до их интенсивного окрашивания. Затем фильтры на ЖК подсушивали, помещали в раствор хлороформа с метанолом (2 : 1 объемных частей) и хранили при температуре –20°С. Фильтры на углерод, азот и фосфор сушили при комнатной температуре в течение суток и помещали в эксикатор для дальнейшего анализа.
Для определения общего содержания ЖК, ПНЖК, углерода, азота и фосфора в планктонных ракообразных воду пропускали через газ с размером ячеи 110 мкм. Оставшийся на сетке зоопланктон высушивали с помощью фильтровальной бумаги и взвешивали. Пробы на ЖК хранили в растворе хлороформа с метанолом при температуре –20°С. Пробы на углерод, фосфор и азот выдерживали при температуре 75°С в течение суток, затем помещали в эксикатор для последующего анализа.
Общие ЖК и ПНЖК измеряли на газовом хроматографе с масс-спектрометрическим детектором (модель 6890/5975С, Agilent, США) (Kalachova, 2011). Содержание углерода, азота и фосфора определяли на элементном анализаторе Flash EA 1112 NC Soil/MAS 200 elemental analyzer (ThermoQuest, Italy) (Gladyshev et al., 2007). Содержание фосфора измеряли фотоколориметрическим методом (Murphy, Riley, 1962).
Для определения ПП фитопланктона использовали концентрацию хлорофилла а и потенциальную фотосинтетическую активность водорослей планктона, измеренную методом полихроматической диурон-индуцированной флуоресценции (DCMU-fluorescence, 3-(3,4-дихлорфенил)-1,1-диметилмочевина) c использованием спектрофотометра FluoroProbe. Подробно этот метод описан Н.А. Гаевским (Gaevsky et al., 2005) и В.И. Колмаковым (Kolmakov et al., 2008).
ВП определяли, используя регрессионные модели Стоквелла и Йоханссона (Stockwell, Johannsson, 1997):
P = 10(–0.23 lg(M) – 0.73) × 1.12 MN,
где P – суточная продукция (мкг сухой массы на 1 л в сутки), М – средняя масса особи (мкг), N – численность особей в 1 л.
Эффективность переноса углерода от продуцентов к консументам в единице объема воды определяли как отношение вторичной продукции к первичной, выраженное в % (Gladyshev et al., 2011). Поскольку в этом отношении использовали величины продукций, выраженных на единицу объема (1 л), то оно характеризовало эффективность переноса вещества в единице объема воды, т.е. в мезокосме. Продукцию на единицу биомассы оценивали как отношения ПП/Бphyto и ВП/Бcrust, а эффективность передачи углерода от фитопланктона к планктонным ракообразным на единицу биомассы определяли по формуле ВП/Бcrust : ПП/Бphyto (%). Это отношение характеризовало эффективность переноса веществ на единицу биомассы, т.е. оно не зависело от концентраций планктонных организмов в воде.
Скорость аккумуляции азота (N) и фосфора (P) в фитопланктоне и планктонных ракообразных на единицу объема воды и на единицу биомассы рассчитывали по формулам:
AP/Nphyto = (P/Nphyto : С) × ПП
А′P/Nphyto = (P/Nphyto: С) × (ПП/Бphyto)
AP/Ncrust = (P/Ncrust : С) × ВП
А′P/Ncrust = (P/Ncrust : С) × (ВП/Бcrust),
где А – скорость аккумуляции на единицу объема, A′ – скорость аккумуляции на единицу биомассы, P/N – фосфор или азот, phyto – фитопланктон, crust – ракообразные; единицы измерения Р/N : C – мг/мг, ВП и ПП – мг С/(л · сут), Бphyto и Бcrust – мг С/л.
Эффективность передачи азота и фосфора от сестона к планктонным ракообразным в литре и на единицу биомассы рассчитывали как отношение:
(АP/Ncrust/А P/Nphyto) × 100%
(А′P/Ncrust/А′P/Nphyto) × 100%.
Продукцию ПНЖК (ЭПК, ДГК) и общих ЖК в фитопланктоне и планктонных ракообразных, а также эффективность передачи ПНЖК (ЭПК, ДГК) и общих ЖК от фитопланктона к планктонным ракообразным на единицу объема и на единицу биомассы определяли с использованием таких же отношений, как и для биогенных элементов. Для удобства уравнения расчета продукции и эффективности передачи каждого вещества и элемента, а также их единицы измерения приведены в табл. 1 и 2.
Таблица 1.
Скорость аккумуляции азота и фосфора в фитопланктоне и планктонных ракообразных, эффективность передачи азота и фосфора от фитопланктона к планктонным ракообразным (М ± SE)
| Показатель | Формулa вычисления, размерность | Контроль | Вариант с рыбами в конце эксперимента |
F | р | |
|---|---|---|---|---|---|---|
| в начале эксперимента | в конце эксперимента | |||||
| Скорость аккумуляции в фитопланктоне: |
||||||
| азота | 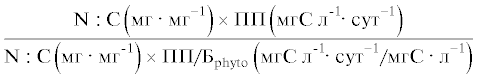 |
$\frac{{0.099 \pm 0.001}}{{0.280 \pm 0.036}}$ | $\frac{{0.062 \pm 0.018}}{{0.058 \pm 0.005}}$ | $\frac{{0.063 \pm 0.029}}{{0.041 \pm 0.007}}$ | $\frac{{1.01}}{{4.75}}$ | $\frac{{0.42}}{{0.97}}$ |
| фосфора | 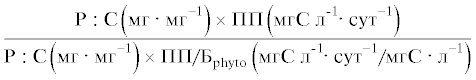 |
$\frac{{0.005 \pm 0.001}}{{0.015 \pm 0.003}}$ | $\frac{{0.004 \pm 0.002}}{{0.013 \pm 0.007}}$ | $\frac{{0.004 \pm 0.003}}{{0.019 \pm 0.015}}$ | $\frac{{0.16}}{{0.11}}$ | $\frac{{0.85}}{{0.89}}$ |
| Скорость аккумуляции планктонными ракообразными: | ||||||
| азота | 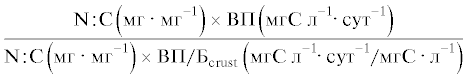 |
$\frac{{0.001 \pm {{{0.00}}^{{\text{a}}}}}}{{0.045 \pm 0.006}}$ | $\frac{{0.002 \pm {{{0.00}}^{{\text{б}}}}}}{{0.049 \pm 0.020}}$ | $\frac{{0.001 \pm {{{0.00}}^{{\text{а}}}}}}{{0.041 \pm 0.006}}$ | $\frac{{7.61}}{{0.12}}$ | $\frac{{0.02}}{{0.89}}$ |
| фосфора | 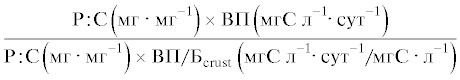 |
$\frac{{0.001 \pm 0.000}}{{0.005 \pm 0.000}}$ | $\frac{{0.0002 \pm 0.00}}{{0.005 \pm 0.02}}$ | $\frac{{0.0002 \pm 0.00}}{{0.006 \pm 0.002}}$ | $\frac{{3.17}}{{0.11}}$ | $\frac{{0.12}}{{0.90}}$ |
| Эффективность передачи от фитопланктона к зоопланктону: | Скорость аккумуляции планктонными ракообразными/скорость аккумуляции в фитопланктоне | |||||
| азота | % | $\frac{{1.174 \pm 0.195}}{{16.013 \pm 1.391}}$ | $\frac{{3.648 \pm 0.811}}{{48.404 \pm 33.872}}$ | $\frac{{4.618 \pm 3.399}}{{31.384 \pm 17.298}}$ | $\frac{{0.77}}{{0.54}}$ | $\frac{{0.50}}{{0.61}}$ |
| фосфора | % | $\frac{{2.801 \pm 0628}}{{38.070 \pm 5.813}}$ | $\frac{{8.655 \pm 4.445}}{{68.277 \pm 28.076}}$ | $\frac{{16.954 \pm 13.220}}{{113.820 \pm 69.093}}$ | $\frac{{0.78}}{{0.78}}$ | $\frac{{0.50}}{{0.50}}$ |
Таблица 2.
Продукция ПНЖК (ЭПК, ДГК) и ЖК в фитопланктоне и зоопланктоне, эффективность их едачи от фитопланктона к планктонным ракообразным (М ± SE)
| Показатель | Формула вычисления, размерность | Контроль | Вариант с рыбами в конце эксперимента |
F | р | |
|---|---|---|---|---|---|---|
| в начале эксперимента | в конце эксперимента | |||||
| П ЭПКphyto | 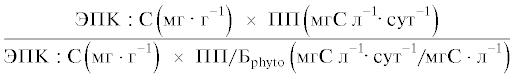 |
$\frac{{5.527 \pm 1.041}}{{15.77 \pm 3.38}}$ | $\frac{{2.056 \pm 0.688}}{{5.73 \pm 1.16}}$ | $\frac{{2.869 \pm 1.352}}{{12.63 \pm 7.60}}$ | $\frac{{2.92}}{{1.12}}$ | $\frac{{0.13}}{{0.39}}$ |
| П ДГКphyto | $\frac{{{\text{ДГК}}:{\text{C}}\,\left( {{\text{мг }}\cdot{\text{ }}{{{\text{г}}}^{{ - 1}}}} \right)\,\, \times \,\,{\text{ПП}}\,\left( {{\text{мгC }}{{{\text{л}}}^{{ - 1}}} \cdot {\text{су}}{{{\text{т}}}^{{ - 1}}}} \right)}}{{{\text{ДГК}}:{\text{C}}\,\left( {{\text{мг }}\cdot{\text{ }}{{{\text{г}}}^{{ - 1}}}} \right)\,\, \times \,\,{\text{ПП/}}{{{\text{Б}}}_{{{\text{phyto}}}}}\left( {{\text{мгC }}{{{\text{л}}}^{{ - 1}}}\,\,\cdot\,\,{\text{су}}{{{\text{т}}}^{{ - 1}}}{\text{/мгC}} \cdot {{{\text{л}}}^{{ - 1}}}} \right)}}$ | $\frac{{5.933 \pm {{{1.375}}^{{\text{а}}}}}}{{16.97 \pm {{{4.36}}^{{\text{а}}}}}}$ | $\frac{{0.417 \pm {{{0.275}}^{{\text{б}}}}}}{{0.99 \pm {{{0.52}}^{{\text{б}}}}}}$ | $\frac{{0.563 \pm 0.519{{{\text{б}}}^{{\text{б}}}}}}{{1.65 \pm {{{1.47}}^{{\text{б}}}}}}$ | $\frac{{13.25}}{{11.47}}$ | $\frac{{0.01}}{{0.01}}$ |
| П ЖКphyto | $\frac{{{\text{ЖК}}:{\text{C}}\,\left( {{\text{мг}} \cdot {{{\text{г}}}^{{ - 1}}}} \right)\,\, \times \,\,{\text{ПП}}\,({\text{мгC}}\,{{{\text{л}}}^{{ - 1}}}\cdot{\text{ су}}{{{\text{т}}}^{{ - 1}}})}}{{{\text{ЖК}}:{\text{C}}\left( {{\text{мг }}\cdot{\text{ }}{{{\text{г}}}^{{ - 1}}}} \right)\,\, \times \,\,{\text{ПП/}}{{{\text{Б}}}_{{{\text{phyto}}}}}\left( {{\text{мгC }}{{{\text{л}}}^{{ - 1}}}\,\cdot{\text{ су}}{{{\text{т}}}^{{ - 1}}}{\text{/мгC }}\cdot{\text{ }}{{{\text{л}}}^{{ - 1}}}} \right)}}$ | $\frac{{82.64 \pm 23.40}}{{236.34 \pm 72.41}}$ | $\frac{{48.80 \pm 13.02}}{{181.57 \pm 103.32}}$ | $\frac{{68.31 \pm 42.61}}{{324.31 \pm 243.11}}$ | $\frac{{0.34}}{{0.21}}$ | $\frac{{0.72}}{{0.82}}$ |
| П ЭПКcrust | $\frac{{{\text{ЭПК}}:{\text{C}}\left( {{\text{мг }}\cdot{\text{ }}{{{\text{г}}}^{{ - 1}}}} \right)\,\, \times \,\,{\text{ВП}}\left( {{\text{мгC }}{{{\text{л}}}^{{ - 1}}}\,\cdot{\text{ су}}{{{\text{т}}}^{{ - 1}}}} \right)}}{{{\text{ЭПК}}:{\text{C}}\left( {{\text{мг }}\cdot{\text{ }}{{{\text{г}}}^{{ - 1}}}} \right)\,\, \times \,\,{\text{ВП/}}{{{\text{Б}}}_{{{\text{crust}}}}}\left( {{\text{мгC }}{{{\text{л}}}^{{ - 1}}}\,\cdot{\text{ су}}{{{\text{т}}}^{{ - 1}}}{\text{/мгC }}\,\cdot{\text{ }}{{{\text{л}}}^{{ - 1}}}} \right)}}$ | $\frac{{0.006 \pm 0.000}}{{0.212 \pm 0.013}}$ | $\frac{{0.004 \pm 0.001}}{{0.117 \pm 0.064}}$ | $\frac{{0.005 \pm 0.001}}{{0.193 \pm 0.045}}$ | $\frac{{1.50}}{{1.21}}$ | $\frac{{0.30}}{{0.36}}$ |
| П ДГКcrust | $\frac{{{\text{ДГК}}:{\text{C}}\left( {{\text{мг }}\cdot{\text{ }}{{{\text{г}}}^{{ - 1}}}} \right)\,\, \times \,\,{\text{ВП}}\left( {{\text{мгC }}{{{\text{л}}}^{{ - 1}}}\,\cdot{\text{ су}}{{{\text{т}}}^{{ - 1}}}} \right)}}{{{\text{ДГК}}:{\text{C}}\left( {{\text{мг }}\cdot{\text{ }}{{{\text{г}}}^{{ - 1}}}} \right)\,\, \times \,\,{\text{ВП/}}{{{\text{Б}}}_{{{\text{crust}}}}}\left( {{\text{мгC }}{{{\text{л}}}^{{ - 1}}}\,\cdot{\text{ су}}{{{\text{т}}}^{{ - 1}}}{\text{/мгC\;\;}}\cdot\,\,{{{\text{л}}}^{{ - 1}}}} \right)}}$ | $\frac{{0.006 \pm 0.000}}{{0.212 \pm 0.013}}$ | $\frac{{0.004 \pm 0.001}}{{0.117 \pm 0.064}}$ | $\frac{{0.004 \pm 0.000}}{{0.140 \pm 0.032}}$ | $\frac{{3.95}}{{2.97}}$ | $\frac{{0.08}}{{0.13}}$ |
| П ЖКcrust | 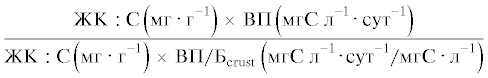 |
$\frac{{0.067 \pm {{{0.008}}^{{\text{а}}}}}}{{2.594 \pm {{{0.199}}^{{\text{а}}}}}}$ | $\frac{{0.033 \pm {{{0.006}}^{{\text{б}}}}}}{{0.857 \pm {{{0.410}}^{{\text{б}}}}}}$ | $\frac{{0.043 \pm {{{0.002}}^{{{\text{аб}}}}}}}{{1.603 \pm {{{0346}}^{{{\text{аб}}}}}}}$ | $\frac{{8.62}}{{6.96}}$ | $\frac{{0.02}}{{0.03}}$ |
| П ЭПКcrust/П ЭПКphyto | % | $\frac{{0.103 \pm 0.013}}{{1.442 \pm 0.244}}$ | $\frac{{0.218 \pm 0.017}}{{2.436 \pm 1.538}}$ | $\frac{{0.542 \pm 0.419}}{{3.567 \pm 2.173}}$ | $\frac{{1.22}}{{0.47}}$ | $\frac{{0.36}}{{0.64}}$ |
| П ДГКcrust/П ДГКphyto | % | $\frac{{0.068 \pm {{{0.006}}^{{\text{a}}}}}}{{0.953 \pm 0.129}}$ | $\frac{{0.474 \pm {{{0.076}}^{{{\text{аб}}}}}}}{{4.766 \pm 2.607}}$ | $\frac{{2.007 \pm {{{0.988}}^{{\text{б}}}}}}{{12.664 \pm 4.973}}$ | $\frac{{11.02}}{{3.39}}$ | $\frac{{0.01}}{{0.10}}$ |
| П ЖКcrust/ П ЖКphyto | % | $\frac{{0.092 \pm 0.023}}{{1.263 \pm 0.275}}$ | $\frac{{0.076 \pm 0.017}}{{1.022 \pm 0.721}}$ | $\frac{{0.210 \pm 0.159}}{{1.484 \pm 0.765}}$ | $\frac{{0.70}}{{0.14}}$ | $\frac{{0.53}}{{0.88}}$ |
Статистический анализ данных проводили в программе Past 3.20. Для проверки данных на нормальность распределения использовали тест Шапиро–Уилка. Концентрацию хлорофилла а, размерные группы водорослей, биомассу планктонных ракообразных, ПП, ВП, П/Б-коэффициенты и их соотношения сравнивали между вариантами опыта с помощью t-теста Стьюдента, в случае отсутствия нормального распределения данных использовали непараметрический U-тест Манна–Уитни. Для сравнения аккумуляции азота или фосфора, а также эффективности передачи ПНЖК и суммы ЖК между вариантами опыта применяли однофакторный дисперсионный анализ (Тьюки-тест). Начальные условия опытов были исключены из сравнительных анализов вследствие отсутствия какого-либо влияния рыб на параметры планктонных сообществ.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
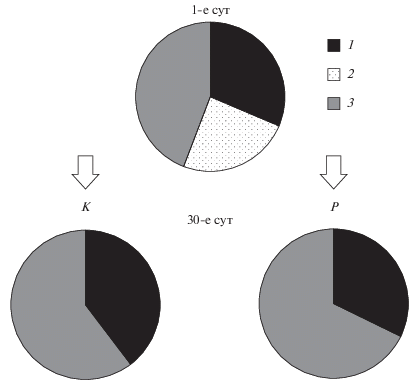
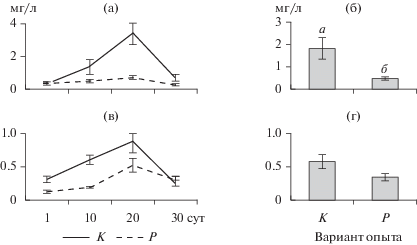
Концентрация общего хлорофилла и хлорофилла диатомовых водорослей была достоверно выше в варианте с рыбами по сравнению с контролем (t = 2.8, p = 0.01; t = 4.4, p < 0.01 соответственно) (рис. 1). В начале эксперимента в мезокосмах доминировали динофитовые Peridinium cinctum (O.F. Müller) Ehrenberg и золотистые водоросли Dinobryon bavaricum Imhof и Chrysidalis peritaphrena J. Schiller (рис. 2). На 10-е cут эксперимента в обоих вариантах опыта помимо золотистых и динофитовых водорослей обильно развивались диатомовые Fragilaria sp. На 20-е и 30-е сут в обоих вариантах стали преобладать зеленые (Oedogonium sp., Mougeotia sp.) и диатомовые водоросли (Ulnaria acus (Kützing) Aboal, Fragilaria crotonensis Kitton, Cyclotella sp.). Достоверных различий в биомассе отдельных таксономических групп фитопланктона между контролем и вариантом с рыбами не обнаружено (t-тест, р > 0.05). В обоих вариантах наблюдался сдвиг структуры фитопланктона от золотистых и динофитовых водорослей в сторону зеленых и диатомовых водорослей в процессе эксперимента. Биомасса каждой из трех размерных фракций не различалась между вариантом с рыбами и контролем (t-тест, р > 0.05). В обоих вариантах опыта преобладала размерная группа фитопланктона >60 мкм, в конце эксперимента группа 30–60 мкм отсутствовала (рис. 3).
Рис. 1.
Динамика хлорофилла зеленых (а), диатомовых (в) и криптофитовых (д) водорослей, цианобактерий (ж) и общего хлорофилла (и), (±SE), и сравнение средних между вариантами опыта (б, г, е, з, к). Здесь и на рис. 2‒6 К – контроль без рыб, Р – вариант с рыбами. Литерами (а, б) здесь и на рис. 4, 5 обозначены достоверные различия при р < 0.05 (t-тест Стьюдента).
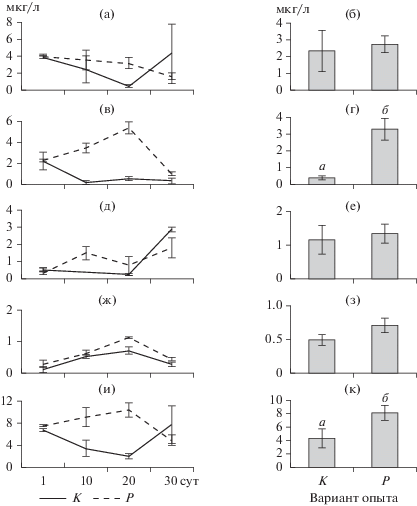
Рис. 2.
Соотношение биомасс таксономических групп фитопланктона (%). 1 – золотистые, 2 – диатомовые, 3 – зеленые, 4 – криптофитовые, 5 – динофитовые, 6 – другие (цианобактерии, эвгленовые, желто-зеленые) водоросли.
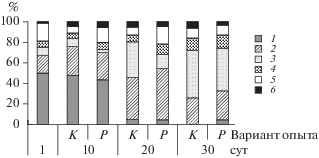
Рис. 3.
Соотношение биомасс размерных групп фитопланктона (%) в эксперименте. 1 – <30 мкм, 2 – 30–60 мкм, 3 – >60 мкм.
Биомасса ветвистоусых ракообразных была достоверно выше в контроле, чем в варианте с рыбами (t = 3.3, p < 0.01) (рис. 4). Статистически значимых различий в средней биомассе веслоногих ракообразных между вариантами опыта не найдено (р > 0.05).
Рис. 4.
Динамика биомассы ветвистоусых (а) и веслоногих (в) ракообразных и сравнение средних между вариантами опыта (б, г), (±SE).
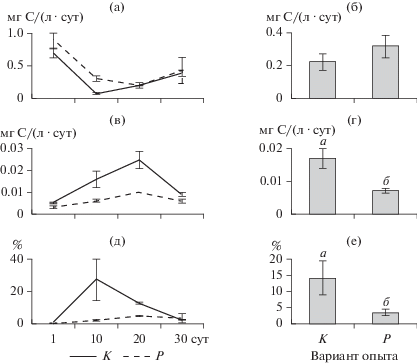
Рыбы не влияли на величину ПП (р > 0.05) (рис. 5). ВП была значимо ниже в варианте с рыбами, чем в контроле (t = 3.2, p = 0.01). Как результат этого, углерод передавался от фитопланктона к ракообразным в варианте с рыбами менее эффективно, чем в контроле и эффективность его передачи в среднем на единицу объема достигала 4 и 14% соответственно (t = 2.6, p = 0.02).
Рис. 5.
Динамика ПП (а), ВП (в), соотношения ВП и ПП (д) и сравнение средних величин этих показателей между вариантами опыта (б, г, е), (±SE).
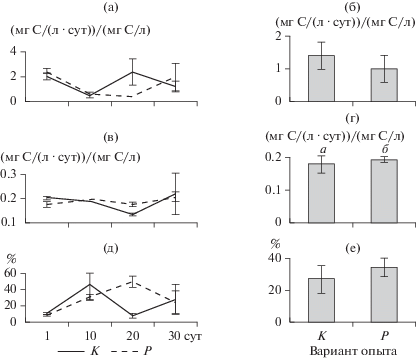
В варианте с рыбами отношение продукции ракообразных к биомассе повышалось относительно контроля (U = 18, p = 0.05) (рис. 6). Эффективность передачи углерода от фитопланктона к ракообразным на единицу биомассы достоверно не различалась между вариантами и составляла в среднем в контроле и в присутствии рыб 27 и 35% соответственно.
Рис. 6.
Динамика отношения ПП к Бphyto (а), ВП к Бcrust (в), эффективности передачи углерода от фитопланктона к ракообразным (д) и сравнение средних этих показателей между вариантами опыта (б, г, е), (±SE). Литерами (а, б) обозначены достоверные различия при р < 0.05 (U-тест Манна–Уитни).
Скорости аккумуляции азота и фосфора в сестоне и ракообразных были сходными в обоих вариантах опыта (табл. 1). Соответственно эффективности передачи азота и фосфора от фитопланктона к планктонным ракообразным не различались между вариантами, как в единице объема воды, так и на единицу биомассы. Эффективность передачи азота на единицу объема в среднем составляла 4 и 5%, эффективность его переноса на единицу биомассы – 48 и 31% в контроле и в варианте с рыбами соответственно. Эффективность передачи фосфора была выше – 9 и 17% на единицу объема, и 68 и 114% на единицу биомассы в контроле и в присутствии рыб соответственно. Таким образом, фосфор на единицу биомассы передавался от фитопланктона к планктонным ракообразным с большей эффективностью, чем углерод.
Биологически ценные ПНЖК и ЖК от фитопланктона к планктонным ракообразным передавались менее эффективно, чем углерод, азот и фосфор (табл. 2). Эффективность переноса ЭПК на единицу объема была <1%, а на единицу биомассы 2–3%. Эффективность переноса ДГК составляла 1–2% на единицу объема и 5–12% на единицу биомассы, а ЖК – <1% и немного >1% соответственно. Разницы между эффективностью переноса в контроле и варианте с рыбами не обнаружено.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Фитопланктон продуцирует не только органический углерод, но и биологически ценные полиненасыщенные жирные кислоты, к которым относятся ЭПК и ДГК. Производятся эти ценные молекулы, главным образом, определенными видами микроводорослей и далее по трофическим цепям транспортируются от продуцентов к консументам, вплоть до человека (Uttaro, 2006; Lands, 2009). Фитопланктон также является источником фосфора и азота для вышестоящих звеньев трофической сети, но не продуцирует их, а переводит неорганические биогенные вещества, растворенные в воде, в органические формы, усваиваемые животными. Чем эффективнее происходит перенос вещества от фитопланктона к зоопланктону, тем выше качество зоопланктона для вышестоящих трофических уровней.
Эффективность переноса углерода в варианте с рыбами не превышала 4%, тогда как в контроле этот параметр достигал 14%. Это связано с тем, что ветвистоусых ракообразных было больше в контроле, чем в варианте с рыбами. Различий в биомассе веслоногих ракообразных между вариантами опыта не наблюдалось. Концентрации ПНЖК, фосфора и азота в единице объема не различались между контролем и вариантом с рыбами, несмотря на менее эффективный перенос общего органического углерода в присутствии рыб, чем в контроле. Следовательно, эффективность переноса этих веществ не связана тесно с переносом углерода.
Полученные нами данные показывают, что разные вещества передавались с разной эффективностью. Эффективность переноса фосфора от фитопланктона к зоопланктону была выше, чем у других веществ и варьировала в диапазоне 9–17%, эффективность передачи азота составляла 4–5%, ПНЖК – ~2%, общих ЖК – <1%.
Эффективность переноса углерода и биологически ценных веществ в единице объема воды в наших экспериментах зависела не только от способности планктонных ракообразных эффективно преобразовывать потребленные вещества в биомассу, но и от количества фитопланктона и ракообразных, содержащихся в единице объема. Эффективность преобразования потребленного вещества в биомассу – это отношение продукции к биомассе (П/Б коэффициент). П/Б коэффициент рассматривается как основа продукционного потенциала и позволяет сравнивать между собой сообщества с разной численностью (Винберг, 1968; Ikeda et al., 2002). Эффективность передачи углерода от фитопланктона к планктонным ракообразным на единицу биомассы достигала в контроле и варианте с рыбами 27 и 35% соответственно, и достоверно не различалась между вариантами опыта. Эффективнее других жирных кислот в опыте передавалась ДГК (в среднем 4–12%), ЭПК передавалась с эффективностью 2–3%, общие ЖК – 1%. Фосфор и азот переносились с большей эффективностью – 68–113% и 31–48% соответственно. Таким образом, доли азота и фосфора, включавшиеся во вторичную продукцию, относительно их содержания в первичной продукции, были выше, чем эффективность передачи углерода, а доли передачи ЖК, включая ПНЖК, наоборот, ниже.
Результаты работы согласуются с данными других исследователей. Например, Худсон и др. (Hudson et al., 1999) отметил, что зоопланктон представляет собой важный источник биогенных элементов. Карпович и др. (Karpowicz et al., 2019) экспериментально подтвердили, что зоопланктон аккумулирует фосфор, содержание которого может быть выше, чем в фитопланктоне. Ранее нами экспериментально показано, что в мезотрофных условиях содержание фосфора в планктонных ракообразных превышало таковое в сестоне в среднем в 3–4 раза, однако содержание ПНЖК и ЖК в ракообразных, наоборот, было значительно ниже, чем в сестоне (Feniova et al., 2019). Таким образом, одни вещества могут аккумулироваться в биомассе, другие или расходоваться в процессе метаболизма, или меньше поглощаться из-за того, что их содержание ниже в потребляемой фракции фитопланктона (<30, 30–60 мкм) относительно непотребляемой (>100 мкм).
Общие короткоцепочечные насыщенные ЖК передавались с меньшей эффективностью, чем ПНЖК. Такой же результат получен М.И. Гладышевым и др. (Gladyshev et al., 2011). Это вызвано тем, что для поддержания высокого содержания n-3 ПНЖК дафнии преимущественно используют другие ЖК как энергетический ресурс и активно их катализируют (Brett et al., 2006). Мы ожидали эффективность переноса незаменимых ПНЖК в нашем эксперименте, превышающую таковую у углерода, однако эффективность переноса ПНЖК от фитопланктона к ракообразным была ниже. Это связано с тем, что в эксперименте преобладали крупные диатомовые и зеленые водоросли, которые по размерам превышали спектр потребляемых частиц. Кроме того, синтезировать ЭПК и ДГК в значительных количествах способны только некоторые группы микроводорослей, например, диатомовые, криптофитовые и динофитовые (Cohen et al., 1995; Harwood, 1996; Heinz, 1993; Tocher et al., 1988). Несмотря на то, что эксперимент длился только 30 сут, сообщество фитопланктона в мезокосмах постепенно трансформировалось в перифитонное, в результате в его составе большую долю составляли зеленые водоросли-обрастатели, которые, безусловно, ухудшали его качество как пищевого ресурса.
Итак, эффективность передачи ПНЖК может меняться в зависимости от состава фитопланктона и быть как выше (Gladyshev et al., 2011), так и ниже эффективности передачи углерода (как в наших экспериментах). От этого зависит качество зоопланктона как ресурса для вышестоящих трофических уровней. ЖК, включая ПНЖК, передавались менее эффективно, чем углерод. Напротив, аккумуляция биогенных элементов, особенно фосфора была более эффективной по сравнению с углеродом. Это свидетельствует о способности планктонных ракообразных выполнять роль резервуара для накопления биогенных элементов, выступая в трофической цепи важным источником биогенных элементов для вышестоящих трофических уровней. Рыбы значительно снижали эффективность переноса углерода от фитопланктона к ракообразным в единице объема, но не влияли на перенос веществ на единицу биомассы, т.е. качество планктонных ракообразных в мезотрофных условиях в присутствии рыб не менялось. Поскольку эффективность передачи биологически ценных веществ от фитопланктона к зоопланктону определяет функционирование всей трофической цепи, то следует искать способы ее повышения.
Выводы. Рыбы снижали перенос углерода от фитопланктона к ракообразным в единице объема воды, эффективность переноса других биологически ценных веществ не уменьшалась по сравнению с контролем. Эффективнее углерода передавался фосфор, что связано с его способностью накапливаться в тканях ракообразных. ЖК, включая ПНЖК, передавались менее эффективно, чем углерод, поскольку пищевые ресурсы на >50% были представлены несъедобными колониальными формами. Эффективнее других ЖК передавалась ДГК, далее следовала ЭПК и с наименьшей эффективностью общие ЖК. Это, вероятно, связано с тем, что общие короткоцепочечные насыщенные ЖК используются, главным образом, как поставщик энергии.
Список литературы
Винберг Г.Г. 1968. Методы определения продукции пресноводных животных. Минск: Вышэйшая школа.
Кузьмин Г.В. 1975. Фитопланктон // Методика изучения биогеоценоза внутренних водоемов. Москва: Наука. С. 73.
Alimov A.F. 1989. An introduction to production hydrobiology. Leningrad: Gidrometeoizdat.
Błędzki L.A., Rybak J.I. 2016. Freshwater crustacean zooplankton of Europe. Springer: Basel, Switzerland. https://doi.org/10.1007/978-3-319-29871
Brett M.T., Muller-Navarra D.C., Ballantyne A.P et al. 2006. Daphnia fatty acid composition reflects that of their diet // Limnol., Oceanogr. V. 51. P. 2428.
Cohen Z., Norman H.A., Heimer Y.M. 1995. Microalgae as a source of n-3 fatty acids // Plants in human nutrition. World review of nutrition and dietetics. Basel: Karger. V. 77. P. 1.
Feniova I., Sakharova E., Karpowicz M. et al. 2019. Direct and Indirect Impacts of Fish on Crustacean Zooplankton in Experimental Mesocosms // Water. V. 11(10). https://doi.org/10.3390/w11102090
Gaevsky N.A., Kolmakov V.I., Anishchenko O.V., Gorbaneva T.B. 2005. Using DCMU – fluorescence method for identification of dominating phytoplankton groups // J. Appl. Phycol. V. 17. P. 483.
Gladyshev M.I., Sushchik N.N., Kolmakova A.A. et al. 2007. Seasonal correlations of elemental and v-3 PUFA composition of seston and dominant phytoplankton species in a eutrophic Siberian Reservoir // Aquat. Ecol. V. 41. P. 9. https://doi.org/10.1007/s10452-006-9040-8
Gladyshev M.I., Sushchik N.N., Anishchenko O.V. et al. 2011. Efficiency of transfer of essential polyunsaturated fatty acids versus organic carbon from producers to consumers in a eutrophic reservoir // Oecologia. V. 165. P. 5211. https://doi.org/10.1007/s00442-010-1843-6
Gliwicz Z.M., Ghilarov A., Pijanowska J. 1981. Food and predation as major factors limiting two natural populations of Daphnia cucullata Sars // Hydrobiologia. V. 80. P. 205. https://doi.org/10.1007/BF00018359
Gulati R., DeMott W. 1997. The role of food quality for zooplankton: remarks on the state- of- the- art, perspectives and priorities // Freshwater Biol. V. 38. P. 753−768.
Harwood J.L. 1996. Recent advances in the biosynthesis of plant fatty acids // Biochimica et Biophysica Acta. V. 1301. P. 7.
Heinz E. 1993. Biosynthesis of polyunsaturated fatty acids // Lipid Metabolism in Plants. Boca Raton: CRC Press. P. 34.
Hudson J.J., Taylor W.D., Schindler D.W. 1999. Planktonic nutrient regeneration and cycling efficiency in temperate lakes // Nature. V. 400. P. 659. https://doi.org/10.1038/23240
Ikeda T., Hirakawa K., Shiga N. 2002. Production, metabolism and production/biomass (P/B) ratio of Metridia pacifica (Crustacea; Copepoda) in Toyama Bay, southern Japan Sea // Plankton Biol. Ecol. V. 49. № 2. P. 58.
Kalachova G.S., Gladyshev M.I., Sushchik N.N., Makhutova O.N. 2011. Water moss as a food item of the zoobenthos in the Yenisei River // Cent. Eur. J. Biol. V. 6. P. 236. https://doi.org/10.2478/s11535-010-0115-0
Karpowicz M., Feniova I., Gladyshev M.I. et al. 2019. The stoichiometric ratios (C:N:P) in a pelagic food web under experimental conditions // Limnologica. V. 77. P. 125 690. https://doi.org/10.1016/j.limno.2019.125690
Kolmakov V.I. 2014. Role of Microcystis aeruginosa passing through the digestive tracts of filter-feeding animals in eutrophic water reservoirs (review) // Contemporary Problems of Ecology. V. 7. P. 455. https://doi.org/10.1134/S1995425514040052
Kolmakov V.I., Gladyshev M.I. 2003. Growth and potential photosynthesis of cyanobacteria are stimulated by viable gut passage in crucian carp // Aquat. Ecol. V. 37. P. 237.
Kolmakov V.I., Anishchenko O.V., Ivanova E.A. et al. 2008. Estimation of periphytic microalgae gross primary production with DCMU-fluorescence method in Yenisei River (Siberia, Russia) // Journal of Applied Phycology. V. 20. P. 289–297. https://doi.org/10.1007/s10811-007-9246-8
Lacroix G. 1999. Biomass and production of plankton in shallow and deep lakes: are there general patterns? // Annales de Limnologie. V. 35. № 2. P. 111.
Lands W.E.M. 2009. Human life: Caught in the food web // Lipids in aquatic ecosystems. New York: Springer. P. 327.
Lindeman R.L. 1942. The trophic–dynamic aspect of ecology // Ecology. V. 23. P. 399.
Mikheeva T.M. 1989. Methods of quantitative estimates of nanophytoplankton (review) // Hydrobiol. J. V. 25. P. 3.
Müller-Navarra D. C. 1995. Evidence that a highly unsaturated fatty acid limits Daphnia growth in nature // Archiv für Hydrobiologie V. 132. P. 297–307.
Murphy J., Riley J.P. 1962. A modified single solution method for the determination of phosphate in natural waters // Analytica Chimica Acta. V. 27. P. 31.
Pauly D., Christensen V. 1995. Primary production required to sustain global fisheries // Nature. V. 374. P. 255.
Schoo K.L., Malzahn A.M., Krause E., Boersma M. 2013. Increased carbon dioxide availability alters phytoplankton stoichiometry and affects carbon cycling and growth of a marine planktonic herbivore // Mar. Biol. V. 160. P. 2145. https://doi.org/10.1007/s00227-012-2121-4
Schulz M., Koschel R., Reese C., Mehner T. 2004. Pelagic trophic transfer efficiency in an oligotrophic, dimictic deep lake (Lake Stechlin, Germany) and its relation to fisheries yield // Limnologica. V. 34. P. 264.
Semenchenko V.P., Razlutskij V.I., Feniova I.Yu., Aibulatov D.N. 2007. Biotic relations affecting species structure in zooplankton communities // Hydrobiologia. V. 579. № 1. P. 219. https://doi.org/10.1007/s10750-006-0411-x
Slobodkin L.B. 1972. On the inconstancy of ecological efficiency and the form of ecological theories // Growth by Intussusception: Ecological essays in Honor of G. Evelyn Hutchinson. Hamden, CT: Archon Books.
Sommer U., Sommer F. 2006. Cladocerans versus copepods: the cause of contrasting top-down controls on freshwater and marine phytoplankton // Oecologia. V. 147. P. 183. https://doi.org/10.1007/s00442-005-0320-0
Sterner R.W., Hessen D.O. 1994. Algal nutrient limitation and the nutrition of aquatic herbivores // Annual Rev. Ecol. Syst. V. 25. P. 1.
Stockwell J.D., Johannsson O.E. 1997. Temperature-dependent allometric models to estimate zooplankton production in temperate freshwater lakes // Can. J. Fish Aquat. Sci. № 54. P. 2350. https://doi.org/10.1139/f97-141
Tocher D.R., Sargent J.R., Frerichs G.N. 1988. The fatty acid compositions of established fish cell lines after longterm culture in mammalian sera // Fish Physiol. Biochem. V. 5. P. 219.
Uttaro A.D. 2006. Biosynthesis of polyunsaturated fatty acids in lower eukaryotes // IUBMB Life. V. 58. P. 563. https://doi.org/10.1080/15216540600920899
Vinberg G.G., Lavrenteva G.M. 1982. Guidelines for the collection and processing of materials for hydrobiological studies in freshwater bodies // Phytoplankton and its products. Leningrad: Gosniorkh. USSR. P. 1.
Yacobi Y.Z., Zohary T. 2010. Carbon: chlorophyll a ratio, assimilation numbers and turnover times of Lake Kinneret phytoplankton // Hydrobiologia. V. 639. P. 185. https://doi.org/10.1007/s10750-009-0023-3
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод


