Биология внутренних вод, 2021, № 1, стр. 47-54
Особенности строения чешуи байкальского хариуса Thymallus baicalensis в условиях измененного гидрологического режима
И. В. Зуев a, *, П. Ю. Андрущенко a, b, С. М. Чупров a, Т. А. Зотина a, b
a Сибирский федеральный университет
Красноярск, Россия
b Институт биофизики, Красноярский научный центр Сибирского отделения Российской академии наук
Красноярск, Россия
* E-mail: zuev.sfu@gmail.com
Поступила в редакцию 05.07.2019
После доработки 23.09.2019
Принята к публикации 15.05.2020
Аннотация
Исследовано количество склеритов в годовых кольцах чешуи хариуса Thymallus baicalensis Dybowski, 1874 из незамерзающего в зимнее время участка р. Енисей в нижнем бьефе Красноярской ГЭС, сравнительно с популяциями вида из крупных притоков р. Енисей (Амыл, Кан, Нижняя Тунгуска, Большая Хета). Выявлено, что обитающий в р. Енисей хариус имеет большее (в 1.5–2.0 раза, р < 0.01) количество склеритов во втором, третьем и четвертом годовых кольцах чешуи, чем рыбы из притоков, что соответствует более высокой скорости роста енисейской популяции хариуса. Высказано предположение о переходе хариусов, населяющих русло р. Енисей в нижнем бьефе ГЭС к оседлому образу жизни.
ВВЕДЕНИЕ
Зарегулирование водного стока гидротехническими сооружениями (прежде всего плотинами ГЭС) – одна из наиболее существенных форм воздействия на речные экосистемы (Nilsson et al., 2005). При очевидной трансформации водного объекта выше плотины, не менее масштабные процессы, вызванные изменением гидрологического режима, происходят и в нижнем бьефе (Gillespie et al., 2015; McCartney et al., 2001; Poff, Zimmerman, 2010).
Изменение гидрологического режима обычно приводит к негативному влиянию на демографические показатели и видовое разнообразие рыб (Poff, Zimmerman, 2010). Однако для рыб, обитающих в нижнем бьефе, данные показатели менее предсказуемы и зависят от вида рыб и конкретных характеристик стока (Freedman et al., 2014; Taylor et al., 2014). Во многом это относится к лососеобразным, популяционные ареалы которых могут включать помимо водотока с измененным гидрологическим режимом и его придаточную сеть.
Создание плотины Красноярской ГЭС привело к существенной перестройке экосистемы р. Енисей в ее нижнем бьефе. На фоне сглаживания сезонных объемов стока и изменения его температурных параметров произошло значительное увеличение биомассы зообентоса (Андрианова, 2013). Вероятным следствием этого стало увеличение скорости роста местного хариуса Thymallus baicalensis Dybowski, 1874 (Шадрин, 2006; Шадрин, Иванова, 2012), ставшего основным объектом любительского рыболовства на незамерзающем в зимнее время участке нижнего бьефа Красноярской ГЭС (Гадинов, Долгих, 2008).
Оценка скорости роста рыб основана на соотнесении линейных размеров особи с ее фактическим возрастом, определенным, как правило, по регистрирующей структуре (чешуе, отолитам и др.). Однако, в процессе формирования регистрирующие структуры накапливают в себе значительно больше информации, отражающей особенности жизненного цикла организма. Извлечение данной информации возможно при детальном исследовании морфологии и химического состава костных элементов и отолитов рыб (Francis, 1990; Campana, 1999; Cadrin, 2000; Elsdon et al., 2008). В рамках данной работы проверялась гипотеза о том, что рост хариуса в водотоке с измененным гидрологическим режимом приводит к формированию уникального строения чешуи. В качестве критерия уникальности использовали число склеритов в сформированных годовых кольцах.
Цель исследования ‒ поиск отличий в строении чешуи хариуса, обитающего на участке р. Енисей с измененным гидрологическим режимом, и в притоках р. Енисей с естественным гидрологическим режимом, находящихся в разных широтных зонах.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Выборка хариуса из р. Енисей собрана в 2007–2018 гг. на двух участках его среднего течения – вблизи с. Хлоптуново (412 экз.) и с. Овсянка (65 экз.) (рис. 1). Оба участка находятся на незамерзающем в зимнее время отрезке нижнего бьефа Красноярской ГЭС. Отлов рыб проводили жаберными сетями с размером ячеи 25–40 мм. У рыб измеряли TL (мм) и W (г). В работе использованы архивные материалы кафедры водных и наземных экосистем Сибирского федерального университета (г. Красноярск) в виде чешуи и результатов биологического анализа хариусов, отловленных в крупных притоках р. Енисей (рис. 1, табл. 1): р. Амыл, правом притоке второго порядка верхнего течения р. Енисей; р. Кан, правом притоке среднего течения р. Енисей; р. Нижняя Тунгуска, правом притоке нижнего течения р. Енисей; р. Большая Хета, левом притоке нижнего течения р. Енисей. В каждой из перечисленных выборок проанализировано ~50 экз. рыб (табл. 1).
Рис. 1.
Бассейн р. Енисей. ⚫ – места отлова хариуса в р. Енисей и его притоках: 1 – р. Енисей (с. Овсянка), 2 – р. Енисей (с. Хлоптуново), 3 – р. Амыл, 4 – р. Кан, 5 – р. Нижняя Тунгуска, 6 – р. Большая Хета, ГЭС – плотина Красноярской гидроэлектростанции.
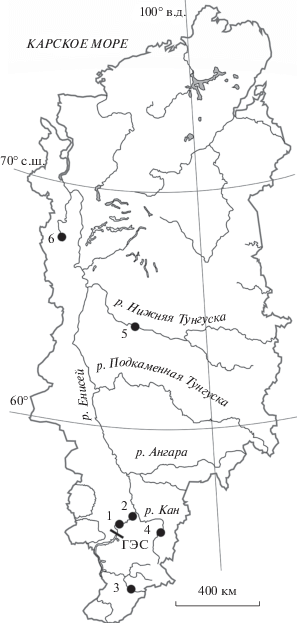
Таблица 1.
Характеристика проб хариуса, использованных для анализа
| Номер точки отлова |
Река | Координаты точки отлова, с.ш., в.д. | Период отлова | Число особей | TL, см | W, г |
|---|---|---|---|---|---|---|
| 1 | Енисей | 55°57′55.9″, 92°34′17.0″ | 2007–2018, в течение года | 412 | 132–375 | 23–413 |
| 2 | То же | 56°27′58.2″, 93°40′16.8″ | 2010–2012, в течение года | 65 | 195–300 | 61–293 |
| 3 | Амыл | 53°20′58.5″, 93°16′13.0″ | 2003, сентябрь | 50 | 172–370 | 36–466 |
| 4 | Кан | 55°44′43.0″, 95°42′15.4″ | 1990, сентябрь | 52 | 110–311 | 12–310 |
| 5 | Нижняя Тунгуска | 64°01′53.5″, 95°33′44.3″ | 2008, август | 50 | 112–402 | 10–640 |
| 6 | Большая Хета | 67°41′41.4″, 83°49′28.1″ | 2005, сентябрь 2006, июль, август | 51 | 152–428 | 48–750 |
Хариусы из среднего течения р. Енисей, а также из рек Амыл, Кан, Нижняя Тунгуска отнесены к виду Thymallus baicalensis Dybowski, 1874, согласно современным представлениям о разнообразии хариусов бассейна р. Енисей (Weiss et al., 2007; Knizhin, Weiss, 2009, Книжин, 2011). К данному виду (а не к Thymallus arcticus (Pallas, 1776)), вероятно, можно отнести и рыб из р. Большая Хета. Следует отметить, что ранее в опубликованных нами материалах (Зуев и др., 2011, 2017; Иванова и др., 2015; Zotina et al., 2019; Zuev et al., 2019) для обозначения хариусов из среднего течения р. Енисей использовали видовое название Thymallus arcticus.
В качестве потенциального маркера, позволяющего идентифицировать рыб с разной траекторией роста, использовали Ns. Поскольку основу уловов хариуса на исследованном участке составляют особи мелких и средних размеров, мы анализировали годовые кольца только 1–4 годов. Чешую изымали под спинным плавником рыб в первом–третьем рядах над боковой линией. Далее ее обрабатывали 10%-ным раствором аммиака, очищали и окрашивали в щелочном (2%-ном КОН) растворе ализарина красного. Все препараты просматривал один оператор. Склериты считали под стереомикроскопом в секторе между краниальным и дорсальным полем чешуи (Дгебуадзе, Чернова, 2009). В дальнейших расчетах использовали среднюю величину Ns, полученную при просмотре трех-пяти недеформированных чешуй от одной рыбы; различия между чешуями одной рыбы не превышали двух склеритов. Для нивелирования эффекта, связанного с разным сезоном отбора проб, подсчет склеритов проводили только в законченных годовых кольцах, латеральнее которых было сформировано ≤2–3 новых склеритов.
Поскольку бóльшая часть исследованных выборок имела тип распределения, отличающийся от нормального (по тесту Шапиро–Уилка), при сравнении средних величин Ns использовали непараметрический критерий Краскела–Уоллиса (H). Последующий post-hoc анализ проводили с помощью U-критерия Манна–Уитни. Соответствие Ns в смежных годовых кольцах оценивали через ранговый коэффициент корреляции Спирмена (rs). Все статистические расчеты выполняли в программе PAST 4.02 (Hammer et al., 2001).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
В первых четырех годовых кольцах хариуса из среднего течения р. Енисей Ns варьировало в больших пределах. Диапазон колебаний Ns в первом кольце был 6–13 склеритов (в среднем (арифметическое среднее M ± SD) – 8.1 ± 1.4), во втором – 12–22 (17.6 ± 1.1), в третьем – 12–20 (14.9 ± 1.4), в четвертом – 8–15 (11.3±1.8) (рис. 2а). Различия по исследованному показателю наблюдались между всеми парами годовых колец (H = 885, p < 0.01).
Рис. 2.
Число склеритов (M ± SD) (а) и частота встречаемости (%) числа склеритов (б) в первых четырех законченных годовых кольцах хариуса, отловленного на незамерзающем участке основного русла р. Енисей в нижнем бьефе Красноярской ГЭС.
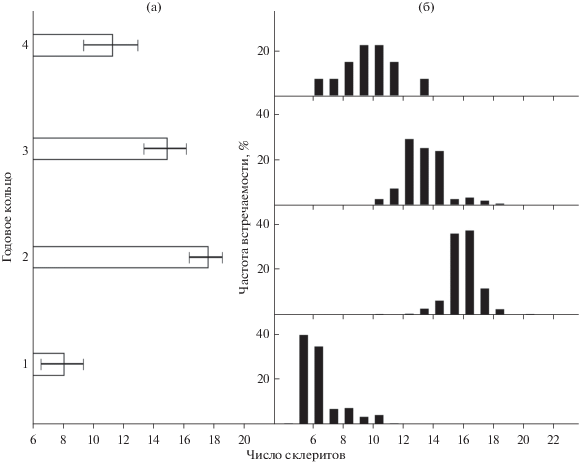
Число склеритов у рыб, отловленных в районе сел Хлоптуново и Овсянка статистически не различалось (p < 0.01). При дальнейшем анализе эти данные использовались как смешанная выборка. Распределение Ns в полученной выборке соответствовало нормальному типу только для четвертого годового кольца (рис. 2б). Для колец первого и третьего года была характерна левосторонняя асимметрия; для кольца второго года – повышенная плотность в районе средних значений (коэффициент эксцесса равен 2.7).
Между Ns в первом–втором и втором–третьем кольцах выявлена слабая положительная связь (rs(1–2) = 0.30, p < 0.01, n = 435; rs(2–3) = 0.22, p < 0.01, n = 146). Более сильно коррелировали между собой зоны третьего и четвертого года, однако объем выборки для этих лет был небольшим (rs(3–4) = = 0.60, p =0.03, n = 13).
Статистически значимые различия (p < 0.01) в Ns у хариусов из разных водотоков бассейна р. Енисей обнаружены для всех законченных годовых колец (табл. 2). В первом годовом кольце различия между средними величинами были в один–два склерита. В остальных случаях (во втором–четвертом кольцах) выделялась выборка из р. Енисей, где Ns превосходило аналогичный показатель рыб из других водотоков в 1.5–2 раза.
Таблица 2.
Среднее число склеритов Ns в первых четырех законченных годовых кольцах чешуи хариуса из притоков и основного русла р. Енисей
| Река | Номер годового кольца от центра чешуи | |||||||
|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | |||||
| M ± SD | n | M ± SD | n | M ± SD | n | M ± SD | n | |
| Енисей | 8.1 ± 1.4a | 477 | 17.6 ± 1.1a | 435 | 14.9 ± 1.4a | 146 | 11.3 ± 1.8a | 13 |
| Амыл | 8.2 ± 0.7b | 50 | 10.7 ± 0.8b | 50 | 9.0 ± 2.2b | 50 | 5.5 ± 1.4b | 38 |
| Кан | 7.8 ± 0.9a | 52 | 9.6 ± 1.3c | 52 | 8.8 ± 2.1b | 50 | 5.8 ± 1.9b | 39 |
| Нижняя Тунгуска | 7.5 ± 0.8a | 50 | 10.0 ± 0.9c | 50 | 9.0 ± 1.9b | 49 | 6.3 ± 2.1b | 38 |
| Большая Хета | 6.0 ± 0.7c | 51 | 8.7 ± 1.1d | 51 | 9.6 ± 1.5b | 51 | 9.0 ± 1.9c | 51 |
| H (p) | 137.1 (<0.01) | 437.4 (<0.01) | 256.0 (<0.01) | 84.1 (<0.01) | ||||
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Результаты исследования свидетельствуют о существенных различиях в строении чешуи байкальского хариуса, обитающего на незамерзающем участке р. Енисей в нижнем бьефе Красноярской ГЭС, в сравнении с популяциями этого вида из притоков. Последние гораздо больше сходны между собой по числу склеритов в годовых кольцах, чем с рыбами из нижнего бьефа Красноярской ГЭС, несмотря на обитание в достаточно большом диапазоне широт (53°–68° с.ш.).
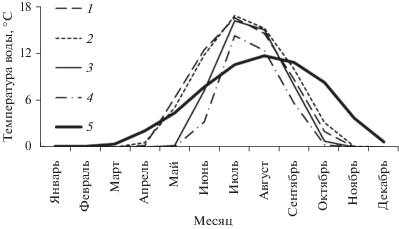
Естественный температурный режим притоков р. Енисей предполагает наличие ледового покрова в течение 5–6 мес., а в летний период вода может прогреваться до 14–18°С (рис. 3). Напротив, на исследованном нами участке р. Енисей ледовый покров не формируется на протяжении до 80 и 300 км от плотины ГЭС в холодные и теплые зимы, соответственно (ФГУ Енисейречтранс, 2008), а в летний период температура не превышает 12–13°С (рис. 3). Согласно ряду исследований, температура воды 17–18°С считается верхней границей физиологического оптимума для взрослых особей сибирского и европейского хариуса (Crisp, 1996; Liknes, Gould, 1987), а прогрев воды до верхней границы является одной из причин миграции половозрелых хариусов в притоки (Liknes, Gould, 1987). Таким образом, современный температурный режим р. Енисей в нижнем бьефе ГЭС благоприятствует нахождению здесь популяции хариуса в течение всего года.
Рис 3.
Сезонная динамика температуры воды на участке р. Енисей в нижнем бьефе Красноярской ГЭС после строительства плотины (по: Космаков, 2001) и в притоках р. Енисей (по: Шмидт, 1985): 1 – р. Кан, 2 – р. Амыл, 3 – р. Нижняя Тунгуска, 4 – р. Большая Хета, 5 – р. Енисей. Температуру воды измеряли на участках отлова рыбы.
На примере аквакультурных рыб показано, что количество склеритов, наряду с шириной краевого прироста чешуи, прямо коррелирует со скоростью их роста (Bilton, Robins, 1971; Cheung et al., 2007; Ibáñez et al., 2008). Эти данные подтверждают результаты сравнительных исследований роста хариуса в бассейне Енисея, согласно которым линейные размеры и масса рыб из нижнего бьефа Красноярской ГЭС (в возрасте от 1 до 4 лет) считаются одними из максимальных для бассейна реки в целом (Иванова и др., 2015; Шадрин, 2006). Исходя из соотношения числа склеритов в годовых кольцах (табл. 2), наиболее интенсивный рост хариуса на исследованном участке Енисея наблюдается на втором году жизни, до наступления половой зрелости. В меньшей степени данная закономерность проявляется и у рыб из притоков р. Енисей (табл. 2), а также у европейского хариуса из р. Печора (Скоринова, Зиновьев, 2015).
Хариусам, как и большинству видов лососеобразных, свойственны нерестовые миграции в придаточные водотоки (Heim et al., 2016; Hughes, Reynolds; 1994; Ibáñez et al., 2008). Вероятное наличие миграций ставит вопрос о том, насколько выявленные особенности чешуи связаны с обитанием исследованного хариуса именно в основном русле р. Енисей, а не в ее многочисленных притоках, среди которых реки Мана и Кан длиной >400 км (Шмидт, 1985) (рис. 1).
Показано, что протяженность нерестовой миграции европейского хариуса невелика (≤20 км), и он значительно уступает в мобильности лососевым (Meyer, 2001; Parkinson et al., 1999).
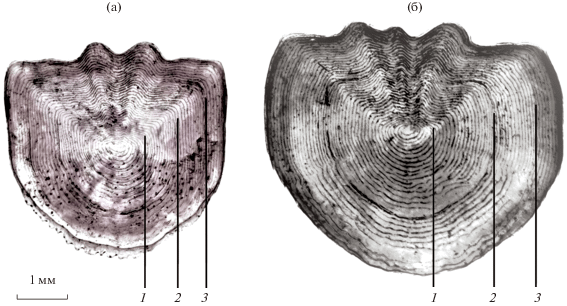
Напротив, протяженность обратной миграции сибирского хариуса к местам зимовки в реках Аляски составляет ≤100 км (West et al., 1992). Потенциальный обмен хариусами-мигрантами возможен между р. Енисей и его крупным притоком р. Кан. Доля особей с нетипичным (имеющим меньшее число склеритов) строением чешуи (рис. 4а) в выборках хариуса, отловленных в августе–октябре в р. Енисей вблизи устья р. Кан (рис. 1, т. 3), в среднем была 13% (неопубликованные данные). Вероятно, речь идет о рыбах, скатывающихся из реки Кан в р. Енисей. В выборке из р. Кан, отловленной на расстоянии ~300 км выше места впадения в р. Енисей (рис. 1), особи хариуса с чешуей, близкой по количеству склеритов к таковым у рыб из Енисея, не встречались.
Рис. 4.
Типичная чешуя предположительно мигрирующей в притоки (а) и жилой (б) особей хариуса, отловленного на незамерзающем участке основного русла р. Енисей в нижнем бьефе Красноярской ГЭС.
В обзорной работе Нордкоте (Northcote, 1995) выдвинуто предположение, что на участках рек с измененным гидрологическим режимом происходит трансформация мигрирующих популяций европейского хариуса в оседлые. Можно предположить, что сходные изменения характерны и для байкальского хариуса, использующего незамерзающий участок р. Енисей в нижнем бьефе Красноярской ГЭС в качестве нагульных и нерестовых площадей. Несмотря на то, что прямых наблюдений за размножением хариуса на участке среднего течения р. Енисей не проводили, особей, имевших гонады на преднерестовой стадии развития, отлавливали в его основном русле (Шадрин, Иванова, 2012).
Выводы. Выявлено, что относительно большое число склеритов во втором–четвертом годовых кольцах – отличительная особенность популяции хариуса, обитающей на незамерзающем участке р. Енисей, в нижнем бьефе Красноярской ГЭС, по сравнению с популяциями хариуса в притоках р. Енисей. Этот показатель может быть использован для быстрой идентификации рыб на данном участке в научных или практических целях.
Список литературы
Андрианова А.В. 2013. Динамика развития Енисейского зообентоса в нижнем бьефе Красноярской ГЭС // Вестник Томского государственного университета. Биология. № 1(21). С. 74. https://doi.org/10.17223/19988591/21/6
Гадинов А.Н., Долгих П.М. 2008. Пространственно-видовая структура ихтиоценоза, относительная численность и факторы, влияющие на распределение рыб р. Енисей // Вестник Красноярского аграрного ун-та. № 3. С. 169.
Дгебуадзе Ю.Ю., Чернова О.Ф. 2009. Чешуя костистых рыб как диагностическая и регистрирующая структура. Москва: Тов-во науч. изд. КМК.
Зуев И.В., Семенова Е.М., Шулепина С.П. и др. 2011. Питание хариуса Tymallus sp. в среднем течении р. Енисей // Журн. Сиб. фед. ун-та. Сер. Биология. Т. 4. № 3. С. 281.
Зуев И.В., Шулепина С.П., Трофимова Е.А., Зотина Т.А. 2017. Сезонные изменения в рационе питания и относительной упитанности сибирского хариуса Thymallus arcticus на участке среднего течения р. Енисей // Сибир. экол. журн. Т. 24. № 3. С. 287. https://doi.org/10.15372/SEJ20170306
Иванова Е.В., Оськина Н.А., Зуев И.В. 2015. Показатели роста и плодовитости сибирского хариуса Thymallus arcticus (Pallas, 1776) в среднем течении реки Енисей // Вопр. рыб-ва. Т. 16. № 1. С. 1.
Книжин И.Б. 2011. Разнообразие и таксономическая идентификация хариусов (Thymallus) бассейна реки Енисей // Журн. Сиб. фед. унив. Сер. Биология. Т. 4. № 3. С. 293.
Космаков И.В. 2001. Термический и ледовый режим в верхних и нижних бьефах высоконапорных гидроэлектростанций на Енисее. Красноярск: “Кларетианум”.
Скоринова А.В., Зиновьев Е.А. 2015. К склеритометрической характеристике чешуи хариуса бассейна р. Печоры // Вестник Пермского университета. Серия Биология. № 4. С. 327.
ФГУ Енисейречтранс. 2008. Карта реки Енисей от Красноярской ГЭС до устья реки Ангара. Санкт-Петербург: “Волго-Балт”.
Шадрин Е.Н. 2006. Питание сибирского хариуса Thymallus arcticus (Pallas, 1776) // Рыб-во и рыбн. хоз-во. № 8. С. 37.
Шадрин Е.Н., Иванова Е.В. 2012. Искусственное воспроизводство хариуса сибирского Thymallus arcticus (Pallas, 1776) в условиях временного рыбоводного комплекса, установленных на реках Енисей и Мана // Рыбн. хоз-во. № 5. С. 83.
Шмидт Т.С. 1985. Многолетние данные о режиме и ресурсах поверхностных вод суши. Т. 1. РСФСР. Вып. 12. Бассейны Енисея (без бассейна Ангары) и Пясины. Ленинград: Гидрометеоиздат.
Bilton H.T., Robins G.L. 1971. Effects of starvation, feeding, and light period on circulus formation on scales of young sockeye salmon (Oncorhynchus nerka) // J. Fish. Board Can. V. 28. № 11. P. 1749.
Cadrin S.X. 2000. Advances in morphometric identification of fishery stocks // Rev. Fish Biol. Fisheries. V. 10. P. 91. https://doi.org/10.1023/A:1008939104413
Campana S.E. 1999. Chemistry and composition of fish otoliths: pathways, mechanisms and applications // Mar. Ecol.: Prog. Ser. V. 188. P. 263. https://doi.org/10.3354/meps188263
Cheung C.H.Y., Chaillé P.M., Randall D.J. et al. 2007. The use of scale increment as a means of indicating fish growth and growth impairment // Aquaculture. V. 266. № 1–4. P. 102. https://doi.org/10.1016/j.aquaculture.2007.02.036
Crisp D.T. 1996. Environmental requirements of common riverine European salmonid fish species in fresh water with particular reference to physical and chemical aspects // Hydrobiologia. V. 323. P. 201. https://doi.org/10.1007/BF00007847
Elsdon T.S., Wells B.K., Campana S.E. et al. 2008. Otolith chemistry to describe movements and life-history parameters of fishes: hypotheses, assumptions, limitations and inferences // Oceanogr. Mar. Biol. Ann. Rev. V. 46. P. 297.
Francis R.I.C.C. 1990. Back-calculation of fish length: a critical review // J. Fish Biol. V. 36. № 6. P. 883. https://doi.org/10.1111/j.1095-8649.1990.tb05636.x
Freedman J.A., Lorson B.D., Taylor R.B. et al. 2014. River of the dammed: longitudinal changes in fish assemblages in response to dams // Hydrobiologia. V. 727. № 1. P. 19. https://doi.org/10.1007/s10750-013-1780-6
Gillespie B.R., Desmet S., Kay P. et al. 2015. A critical analysis of regulated river ecosystem responses to managed environmental flows from reservoirs // Freshwater Biol. V. 60. № 2. P. 410. https://doi.org/10.1111/fwb.12506
Hammer Ø., Harper D.A.T., Ryan P.D. 2001. PAST: Paleontological statistics software package for education and data analysis // Palaeontologia Electronica. V. 4. № 1. 9 p. https://palaeo-electronica.org/2001_1/past/issue1_01.htm
Heim K.C., Wipfli M.S., Whitman M.S. et al. 2016. Seasonal cues of Arctic grayling movement in a small Arctic stream: the importance of surface water connectivity // Environ. Biol. Fish. V. 99. № 1. P. 49. https://doi.org/10.1007/s10641-015-0453-x
Hughes N.F., Reynolds J.B. 1994. Why do Arctic Grayling (Thymallus arcticus) get bigger as you go upstream? // Can. J. Fish. and Aquat. Sci. V. 51. P. 2154. https://doi.org/10.1139/f94-216
Ibáñez A.L., Britton J.R., Cowx I.G. 2008. Relationship between scale growth checks, circuli formation rate and somatic growth in Rutilus rutilus (L.) a fish farm-reared cyprinid // J. Fish Biol. V. 72. P. 1023. https://doi.org/10.1111/j.1095-8649.2007.01781.x
Knizhin I.B., Weiss S.J. 2009. A new species of grayling Thymallus svetovidovi sp. nova (Thymallidae) from the Yenisei basin and its position in the genus Thymallus // J. Ichthyol. V. 49. № 1. P. 1. https://doi.org/10.1134/S0032945209010019
Liknes G.A., Gould W.R. 1987. The distribution, habitat and population characteristics of fluvial Arctic grayling (Thymallus arcticus) in Montana // Northwest Sci. V. 61. № 2. P. 122. https://hdl.handle.net/2376/1748
McCartney M.P., Sullivan C., Acreman M. 2001. Ecosystem impacts of large dams. Background Pap. 2. Washington: IUCN/UNEP/WCD, United Nations Foundation.
Meyer L. 2001. Spawning migration of grayling Thymallus thymallus (L., 1758) in a Northern German lowland river // Archiv für Hydrobiologie. V. 152. № 1. P. 99. https://doi.org/10.1127/archiv-hydrobiol/152/2001/99
Nilsson C., Reidy C.A., Dynesius M., Revenga C. 2005. Fragmentation and flow regulation of the world’s large river systems // Science. V. 308. № 5720. P. 405. https://doi.org/10.1126/science.1107887
Northcote T.G. 1995. Comparative biology and management of Arctic and European grayling (Salmonidae, Thymallus) // Rev. Fish. Biol. Fisheries. V. 5. № 2. P. 141. https://doi.org/10.1007/BF00179755
Parkinson D., Philippart J., Baras E. 1999. A preliminary investigation of spawning migrations of grayling in a small stream as determined by radio-tracking // J. Fish Biol. V. 55. P. 172. https://doi.org/10.1111/j.1095-8649.1999.tb00666.x
Poff N.L., Zimmerman J.K. 2010. Ecological responses to altered flow regimes: a literature review to inform the science and management of environmental flows // Freshwater Biol. V. 55. № 1. P. 194. https://doi.org/10.1111/j.1365-2427.2009.02272.x
Taylor J.M., Seilheimer T.S., Fisher W.L. 2014. Downstream fish assemblage response to river impoundment varies with degree of hydrologic alteration // Hydrobiologia. V. 728. № 1. P. 23. https://doi.org/10.1007/s10750-013-1797-x
Weiss S., Knizhin I., Romanov V., Kopun T. 2007. Secondary contact between two divergent lineages of grayling Thymallus in the lower Enisey basin and its taxonomic implications // J. Fish Biol. V. 71. P. 371. https://doi.org/10.1111/j.1095-8649.2007.01662.x
West R.L., Smith M.W., Barber W.E. et al. 1992. Autumn migration and overwintering of Arctic grayling in coastal streams of the Arctic national wildlife refuge, Alaska // Trans. Am. Fish. Soc. V. 121. P. 709. https://doi.org/10.1577/1548-8659(1992)121<0709:AMAOOA>2.3.CO;2
Zotina T.A., Trofimova E.A., Dementyev D.V. 2019. Time-dependent trends of artificial radionuclides in biota of the Yenisei River (Siberia, Russia) // J. Environ. Radioactiv. V. 208–209. P. 106028. https://doi.org/10.1016/j.jenvrad.2019.106028
Zuev I.V., Trofimova E.V., Zotina T.A. 2019. Seasonal variability of length-weight relationships of Arctic grayling (Thymallus arcticus) and Siberian dace (Leuciscus baicalensis) inhabiting the middle reaches of the Yenisei River, Siberia, Russia // Turk. J. Fish. Aquat. Sci. V. 19. № 10. P. 893. https://doi.org/10.4194/1303-2712-v19_10_09
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод


