Биология внутренних вод, 2021, № 1, стр. 77-84
Особенности изменения функционального состояния осетровых рыб при половом созревании в установках замкнутого водоснабжения
Е. Н. Пономарева a, b, П. П. Гераскин b, Г. Ф. Металлов a, А. Н. Неваленный b, В. А. Григорьев a, b, М. Н. Сорокина a, b, *, Ю. В. Федоровых b
a Федеральный исследовательский центр Южный научный центр Российской академии наук
Ростов-на-Дону, Россия
b Астраханский государственный технический университет
Астрахань, Россия
* E-mail: sor-marina@yandex.ru
Поступила в редакцию 16.01.2019
После доработки 07.11.2019
Принята к публикации 24.07.2020
Аннотация
Исследована динамика физиолого-биохимических показателей крови и мочи в процессе созревания гонад у самок гибрида стерлядь × белуга (Acipenser ruthenus L., 1758 × Huso huso L., 1758), выращиваемых по УЗВ-технологии. Показано, что при такой технологии гонадогенез самок гибрида сопровождается функциональными изменениями с появлением особенностей, отличающих его от такового у рыб из естественных популяций. Но, если в целом генеративный обмен, направленный на формирование гамет, такой же, как и у самок из природных популяций, то интенсивность этого процесса на разных этапах развития половых желез выражена не так отчетливо, как у самок, мигрирующих на нерест. Обсуждены возможные причины повышенного уровня исследуемых физиолого-биохимических показателей в крови у самок гибрида при выходе из искусственной зимовки.
ВВЕДЕНИЕ
В аквакультурной практике наиболее перспективными технологиями считают садковый и суперинтенсивный методы в УЗВ, предусматривающие формирование и эксплуатацию искусственно созданных репродуктивных стад (Пономарева и др., 2019). С развитием таких технологий появилась необходимость и в изучении процесса созревания гонад у самок в неестественных для них условиях.
Формирование продукционных стад в искусственных, т.е. в неадекватных условиях, резко отличающихся от природной среды их обитания, а также питание искусственными кормами, не являющимися всецело полноценными, может сказаться на их генеративной функции (Блинков, Кокоза, 2014; Гераскин и др., 2019).
Изучение генеративной функции ранее проводили в основном у осетровых из естественной среды обитания (Лукьяненко, Шелухин, 1970; Шелухин, 1974; Баденко и др., 1984; Гераскин и др., 1984; Лукьяненко, Кулик, 1994; Geraskin et al., 1999). Полученные в этих исследованиях сведения позволили сформировать, хотя и недостаточно полно, представление об изменениях функционального состояния самок в периоды репродуктивного цикла у осетровых рыб естественных популяций (Баденко и др., 1984; Гераскин и др., 2017), что позволяет выявлять отклонения в генеративном обмене на разных этапах созревания гонад, в том числе и на последних.
Функциональные изменения в половом цикле у искусственно сформированных репродуктивных стад в неестественной для них среде мало изучены и требуют фундаментальных исследований по закономерностям созревания самок в этих условиях.
Наиболее удобным модельным объектом изучения функционального состояния в разные периоды полового цикла самок является гибрид стерлядь × белуга, который достаточно быстро вступает в репродуктивный период, а длительность межнерестовых интервалов часто составляет менее года, при этом он обладает некоторыми преимуществами при выращивании в УЗВ, по сравнению с чистыми видами (Пономарев, Иванов, 2009; Насыров, Подушка, 2017; Ponomareva et al., 2020).
Цель работы – исследовать особенности изменений физиолого-биохимических показателей крови и мочи у самок гибрида стерлядь × белуга, созревающих в модульной установке замкнутого водоснабжения с регулируемым гидролого-гидрохимическим режимом.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Работа выполнена на научно-экспериментальной базе Южного научного центра Российской академии наук и в Астраханском государственном техническом университете. Самок гибрида стерлядь × белуга содержали в модульной установке замкнутого водоснабжения с регулируемым гидролого-гидрохимическим режимом при температуре 19–22°С. На завершающей стадии созревания половых желез самок вводили в режим искусственной зимовки, понижая в сутки температуру воды на 1 до 6°С. В режиме “зимовки” самок выдерживали от двух до четырех недель в зависимости от степени созревания ооцитов, а затем постепенно на 1оС в сут поднимали температуру воды до нерестовой – 14–15°С (Матишов и др., 2011). Зрелость половых желез определяли, применяя УЗИ диагностику (Чебанов, Галич, 2010) с уточнением биопсийным методом по шкале В.В. Трусова (1964). Кровь отбирали у самок гибрида, находящихся на различной стадии зрелости гонад из хвостовой вены, мочу из мочеточников катетером. Наряду с половозрелыми самками, исследовали молодых рыб на I СЗГ. В сыворотке крови исследовали содержание общего белка и липидов, β-липопротеидов, холестерина, в целой крови – концентрацию гемоглобина и скорость оседания эритроцитов. Величину общего белка определяли рефрактометрически (Филиппович и др., 1982), на рефрактометре ИРФ-454Б2М, общие липиды – колориметрическим методом на основе взаимодействия гидролизованных липидов с фосфорно-ванилиновым реактивом используя набор реактивов фирмы PLIVA – Lachema (Zöllner, N. and Kirsch, 1962), холестерин – энзиматическим колориметрическим методом с помощью наборов “Холестерин-Ольвекс”. Определение β‑липопротеидов вели турбидиметрическим методом по (Burstein, Samaille, 1958), СОЭ – методом Панченкова (Лиманский и др., 1984), содержание гемоглобина в крови – унифицированным цианметгемоглобиновым фотометрическим методом (Van Kampen, Zijlstra, 1961), осмоляльность сыворотки крови и мочи – криоскопическим методом на осмометре OSKR-1. Статистическая обработка полученных данных проводилась с помощью пакетов программ Microsoft Excel: описательной статистики и вычислением двухвыборочного t-теста с различными дисперсиями, в результате которого определяли уровень значимости (р) для сравниваемых неравночисленных малых выборок (Лакин, 1990).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Исследование физиолого-биохимических показателей, проведенное на самках гибрида стерлядь × белуга, выращиваемых в УЗВ, выявило изменчивость их величин, в зависимости от зрелости половых желез (табл. 1). Функциональному состоянию молодых самок на I СЗГ соответствовали низкие значения исследуемых параметров крови, за исключением общих липидов. Самки на II СЗГ – это взрослые рыбы, вступившие в репродуктивный период с закономерным повышением в крови общего белка в 1.4 раза и β-липопротеинов – в 1.7 раза при некотором снижении концентрации общих липидов в 1.2 раза и примерно одинаковых значениях содержания гемоглобина и холестерина, в сравнении с молодыми особями, при статистическом подтверждении таких изменений (р <0.05). Увеличение СОЭ в 1.5 раза, статистически не подтверждается (р >0.05). Такие изменения в физиолого-биохимических показателях крови свойственны переходу от неполовозрелых рыб к половозрелым.
Таблица 1.
Характеристика физиолого-биохимических показателей крови (М ± m) самок гибрида стерлядь × белуга на разных стадиях полового созревания
| Стадия зрелости гонад |
СОЭ, мм/ч |
Гемоглобин, г/л | Общий сывороточный белок, г/л | Холестерин, ммоль/л |
β-липопротеины | Общие липиды |
|---|---|---|---|---|---|---|
| г/л | ||||||
| I | $\frac{{2.7 \pm 0.6}}{5}$ | $\frac{{65.5 \pm 7.2}}{4}$ | $\frac{{22.8 \pm 2.6}}{5}$ | $\frac{{2.30 \pm 0.15}}{5}$ | $\frac{{2.40 \pm 0.14}}{5}$ | $\frac{{6.48 \pm 0.19}}{5}$ |
| II | $\frac{{4.1 \pm 0.4}}{{23}}$ | $\frac{{55.1 \pm 2.7}}{{23}}$ | $\frac{{31.0 \pm 2.1{\text{*}}}}{{22}}$ | $\frac{{2.60 \pm 0.22}}{{22}}$ | $\frac{{4.03 \pm 0.33{\text{*}}}}{{22}}$ | $\frac{{5.30 \pm 0.46{\text{*}}}}{{13}}$ |
| III | $\frac{{3.9 \pm 0.4}}{{14}}$ | $\frac{{63.7 \pm 5.2}}{{12}}$ | $\frac{{30.4 \pm 3.1}}{{14}}$ | $\frac{{3.47 \pm 0.33{\text{*}}}}{{15}}$ | $\frac{{5.10 \pm 0.66}}{{15}}$ | $\frac{{3.49 \pm 0.36{\text{*}}}}{{10}}$ |
| IVнез | $\frac{{4.3 \pm 0.3}}{{15}}$ | $\frac{{61.0 \pm 3.1}}{{15}}$ | $\frac{{41.0 \pm 3.2{\text{*}}}}{{16}}$ | $\frac{{2.80 \pm 0.20}}{{16}}$ | $\frac{{5.90 \pm 0.64}}{{15}}$ | $\frac{{4.30 \pm 0.52}}{{12}}$ |
| IVзав | $\frac{{2.9 \pm 0.5{\text{*}}}}{{11}}$ | $\frac{{76.7 \pm 3.8{\text{*}}}}{{11}}$ | $\frac{{44.6 \pm 1.6}}{{11}}$ | $\frac{{4.11 \pm 0.21{\text{*}}}}{{11}}$ | $\frac{{7.32 \pm 0.51}}{{11}}$ | $\frac{{8.40 \pm 0.70{\text{*}}}}{{11}}$ |
Примечание. Здесь и в табл. 2 над чертой – среднее и его ошибка, под чертой – количество рыб в группе; IVнез – самки до искусственной зимовки, IVзав – после искусственной зимовки. * p < 0.05 при сравнении с предыдущей стадией зрелости.
В динамике величин исследуемых показателей крови в половом цикле самок гибрида, выращиваемых в УЗВ, выявлена различная интенсивность изменений. Величина СОЭ и содержание в крови гемоглобина от II к IVнез (незавершенная) СЗГ у самок гибрида изменяется мало. Можно отметить лишь небольшой статистически незначимый подъем содержания в крови гемоглобина в этот период. В то же время концентрация общего сывороточного белка увеличивается, но только к IVнез СЗГ в 1.3 раза (p < 0.05) в отношении к предыдущей стадии полового цикла (III СЗГ). Несколько иная динамика содержания в крови холестерина. Его значение увеличивается у самок со II СЗГ к III в 1.3 раза и уменьшается к IVнез почти до прежней величины. Однако это снижение не находит свое подтверждение статистически (р > 0.05). В динамике содержания β-липопротеинов в крови самок хотя и прослеживается некоторое их увеличение при переходе от II СЗГ к IVнез в 1.5 раза, однако значимые различия (p < 0.05) появляются по этому параметру крови лишь между самками II и IVнез СЗГ. Изменения значений концентрации этого липопротеида в период между II и III, а также III и IVнез стадиями формирования половых желез оказываются несущественными (р > 0.05). Вариабельность содержания общих липидов в крови в половом цикле самок гибрида стерлядь × белуга по своей динамике схожа с таковой общего сывороточного белка. Также снижается содержание общих липидов в крови у самок от II к III СЗГ, а затем увеличивается к IVнез стадии, не достигая исходных значений. В первом случае концентрация липидов в крови снизилась в 1.5 раза (p < 0.01), во втором – повысилась в 1.2 при p > 0.05. Наиболее существенные изменения отмечены после проведения искусственной зимовки, при которой осуществляется переход от IVнез к IVзав (завершенной) стадии.
Дозревание ооцитов до IVзав СЗГ у весенне-нерестующих осетровых в естественной среде протекает при низких температурах. Имитацией этих условий служит этап “зимовки” при УЗВ выращивании, при которой синхронизируется морфофизиологическое состояние ооцитов (Сариев и др., 2019; Щербина и др., 2019).
В этот период наблюдаются наиболее существенные изменения исследуемых нами физиолого-биохимических показателей крови. Значения всех показателей, за исключением СОЭ, увеличились после выдерживания самок при низких температурах: содержание гемоглобина в крови – в 1.3 раза (p < 0.05), холестерина – в 1.5 раза (p < 0.001), общих липидов – почти в 2 раза (p < 0.001). При этом скорость оседания эритроцитов, наоборот, снизилась в 1.5 раза (p < 0.05). Величины остальных показателей крови – общего сывороточного белка и β-липопротеинов – хотя и увеличиваются соответственно в 1.1 и 1.2 раза, но недостоверно (p > 0.05).
Осмоляльность крови и мочи у самок гибрида также имеет определенную вариабельность, в зависимости от стадий зрелости гонад (табл. 2). У молодых самок, I СЗГ, уровень осмоляльности крови наибольший, при наименьшем в моче. У самок гибрида репродуктивного возраста в начале полового цикла (II СЗГ) величина осмоляльности крови несколько ниже, чем у молодых самок (p > 0.05). В то же время различия между осмоляльностями мочи у самок II и I СЗГ существенны и достигают 2.5 раза (p < 0.001).
Таблица 2.
Осмоляльность (ммоль/кг Н2О) крови и мочи у самок гибрида стерлядь × белуга на разных стадиях полового созревания
| Стадия зрелости гонад | Кровь | Моча |
|---|---|---|
| I | $\frac{{265 \pm 4.6}}{3}$ | $\frac{{19.60 \pm 4.6}}{5}$ |
| II | $\frac{{256 \pm 3.6}}{{32}}$ | $\frac{{49.67 \pm 3.0{\text{*}}}}{{20}}$ |
| III | $\frac{{247 \pm 3.8}}{{21}}$ | $\frac{{56.92 \pm 5.0}}{{13}}$ |
| IVнез | $\frac{{260 \pm 4.6{\text{*}}}}{{24}}$ | $\frac{{70.84 \pm 6.1{\text{*}}}}{{19}}$ |
| IVзав | $\frac{{224 \pm 5.4{\text{*}}}}{{11}}$ | $\frac{{41.0 \pm 2.2{\text{*}}}}{{11}}$ |
Переход самок в фазу трофоплазматического роста ооцитов сопровождается небольшим (~4%) статистически незначимым снижением осмоляльности крови на III стадии формирования половых желез, с последующим увеличением на 5% (p < 0.05) на IVнез по отношению к предыдущей стадии. Осмоляльность мочи недостоверно увеличивается от II к III СЗГ (на 14%), с дальнейшим увеличением на IVнез стадии в 1.2 раза (p < 0.05). Более существенные изменения в осмолярности мочи наблюдаются уже после прохождения самками этапа искусственной зимовки и перехода самок в IVзав стадию формирования ооцитов. Ее величина снижается в 1.7 раза. Осмолярность крови также снижается на этом этапе, но лишь на ~16%. Изменения в обоих случаях подтверждаются статистическим анализом (p < 0.05).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В условиях УЗВ изменения в функциональном состоянии самок, в зависимости от стадии зрелости гонад, имеют свои особенности, которые отсутствуют у самок из естественной популяции и чистых видов, и гибридов, выращиваемых при естественном (природном) температурном режиме. Исключением можно назвать переход самок гибрида в условиях УЗВ в репродуктивное состояние, т.е. с I во II СЗГ. По динамике большинства показателей крови такой переход соответствует подобному у естественных популяций (Лукьяненко, Гераскин, 1966; Шелухин, 1974; Субботкин, 1979). Однако рост содержания в крови белка и β-липопротеинов при переходе с I на II СЗГ в естественных популяциях отсутствует. Такие изменения наблюдаются на более ранних стадиях онтогенетического развития рыб по содержанию в крови белка и гемоглобина (Гершанович и др., 1987). Также отмечено увеличение концентрации β-липопротеинов в крови, но лишь на 15%, у самок I–II СЗГ, в сравнении с ювенальными особями, при исследовании русского осетра в море (Субботкин, 1979). Обращает на себя внимание и повышенный (более чем вдвое), в сравнении с белугой и другими видами осетровых рыб естественных популяций, уровень β-липопротеинов самок гибрида стерлядь × белуга на II СЗГ в условиях УЗВ. Относительно низкий уровень в крови гемоглобина, который отмечается на всем протяжении развития половых желез, видимо, также свойственен выращиванию осетровых рыб в УЗВ. Так, у ленского осетра при выращивании по технологии УЗВ также выявлено более низкое содержание гемоглобина (55.6 г/л), в сравнении с тем же видом рыб (87.9 г/л), но в условиях тепловодного бассейнового хозяйства (Корабельникова, 2009).
Однако наибольшие особенности выявлены в динамике исследуемых показателей крови СОЭ, содержание в крови гемоглобина и общих липидов в разных фазах полового цикла рыб, хотя направленность изменений была такой же, как у естественных популяций, за некоторым исключением. Это СОЭ, содержание в крови гемоглобина и общих липидов.
Для самок природных популяций естественно повышение значений у показателей крови, характеризующих уровень белкового и жирового обмена в фазе трофоплазматического роста ооцитов, а также увеличение концентрации гемоглобина, обеспечивающего повышенную интенсивность обменных процессов у рыб, при некотором увеличении СОЭ на конечных этапах созревания (Гапонов, 1974; Шелухин, 1974; Гераскин и др., 1984, 2017). Максимальные значения они приобретают на III и промежуточной III–IV стадиях формирования половых желез. У полностью созревших самок содержание в крови гемоглобина, белка, β-липопротеинов снижается, в зависимости от показателя, в 1.5–3 раза. Исключением является холестерин, его содержание остается высоким до предовуляционного периода – гомогенезации содержимого ооцита. Содержание в крови общих липидов самок естественных популяций остается высоким до предовуляционного периода, с дальнейшим снижением (Шелухин, 1974). Необходимо заметить при этом, что функциональное состояние самок осетровых рыб из природных популяций на завершающих стадиях созревания ооцитов различны. В одних случаях оно ближе к предовуляционному состоянию, в других, наоборот, ближе к III стадии созревания. Однако направленность изменений всегда одна и та же.
У исследуемых нами самок гибридов направленность изменений содержания в крови гемоглобина, белка, β-липопротеинов, общих липидов и холестерина в половом цикле такая же, как и у природных популяций. Их выраженность нечеткая из-за небольшой разницы в величинах этих показателей у самок различных стадий созревания гонад. Кроме того, максимум содержания этих биохимических компонентов в крови до перевода самок на искусственную зимовку приходится на IVнез СЗГ, кроме общих липидов и концентрации в крови гемоглобина. Обращает на себя внимание почти неменяющаяся скорость оседания эритроцитов у исследуемых самок вплоть до IVнез СЗГ, в то время как у более зрелых рыб она должна увеличиваться (Гапонов, 1974; Гераскин и др., 1984).
Совершенно другую направленность, в сравнении с естественными популяциями, показали исследуемые нами физиолого-биохимические показатели крови после искусственной зимовки, которая инициирует переход из IVнез в IVзав СЗГ. Если у естественных популяций содержание в крови гемоглобина, белка и β-липопротеинов снижается, при постоянно высоком уровне холестерина и общих липидов и небольшом повышении скорости оседания эритроцитов, то у самок гибрида после зимовки они имеют противоположную направленность. Это, по всей видимости, является результатом дегидратации (сгущения) крови, вследствие чего снижается скорость оседания эритроцитов и повышается содержание составляющих ее компонентов, но в неравной степени. Если принять во внимание, что содержание в крови холестерина, по нашим ранее проведенным исследованиям, почти не изменяется, то можно предположить, что уровень изменений других показателей крови, по отношению к таковому холестерина, показывает действительную направленность функциональных изменений. Если содержание холестерина увеличилось в 1.5 раза, то белка, β-липопротеинов и гемоглобина примерно в 1.1–1.3 раза. Из этого следует, что фактическое содержание белка, по расчетам, учитывающим сгущение крови, уменьшилось примерно на 25%, а β-липопротеинов и гемоглобина осталось на прежнем уровне, как и скорость оседания эритроцитов. Содержание в крови общих липидов, даже с учетом дегидратации, увеличилось, в отличие от естественных популяций рыб, у которых оно остается примерно на том же уровне, т.е. при переходе от IVнез к IVзав стадии появляются особенности функционального состояния самок, не свойственные рыбам в естественных условиях.
По мнению некоторых авторов (Щербина и др., 2019) традиционная практика выращивания осетровых в УЗВ не учитывает специфику созревания ооцитов, связанную с сезонными изменениями обмена веществ и, в частности генеративного обмена. Считается (Айзенштадт, 1977; Детлаф и др., 1981), что осеннее снижение температуры в естественных условиях, как и последующая зимовка, оказывает существенное влияние на генеративный обмен, изменения в котором способствуют дозреванию развивающихся яйцеклеток.
Сложные преобразования в процессе созревания самок осетровых рыб претерпевает и водно-солевой обмен. При этом изменения в осмоляльности крови и мочи при переходе самок в репродуктивный период (на II СЗГ) вписывается в общую закономерность этих перестроек, свойственную уже половому циклу (рис. 1). Подобные изменения в водно-солевом обмене, имеют место и у других видов осетровых рыб при их созревании в естественной среде (Металлов и др., 1997, 2010), которые инициированы влиянием половых гормонов (Magnin, 1962; Наточин и др., 1995).
Рис. 1.
Осмоляльность (ммоль/кг Н2О) сыворотки крови и мочи у гибрида стерлядь × белуга в различные периоды гонадогенеза в условиях установки замкнутого водообеспечения. 1 – сыворотка крови (полиномиальная), 2 – моча (линейная).
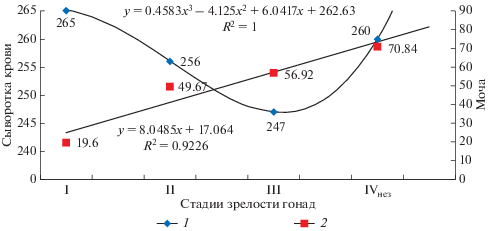
Неожиданным оказалось снижение осмоляльности крови и мочи у самок гибрида после прохождения искусственной зимовки. Исходя из полученных нами зависимостей, при их пролонгации должно быть повышение этих показателей. Кроме того, то же самое должно быть и при дегидратации крови. Это наводит на мысль, что в этом случае примешивается другой фактор, влияющий на водно-солевой обмен, по всей видимости, гормонального характера.
Проведенная серия опытов по влиянию гормонов гипофиза на осмоляльность крови неполовозрелых особей русского осетра (Металлов, 1977), однозначно свидетельствовала о снижении этого показателя в 1.3 раза. Та же направленность изменений наблюдалась и у пресноводных рыб при неблагоприятных внешних условиях, т.е. в условиях стресса (Мартемьянов, Борисовская, 2010; Мартемьянов, 2014).
Итак, снижение концентрации осмотически активных веществ в крови и моче самок гибрида, при их переходе в состояние искусственной зимовки и выхода из нее, является закономерным результатом интенсивной секреции через жабры во внешнюю среду ионов натрия, а значит снижения внутренней осмоляльности и повышения скорости диуреза (Мартемьянов, 2015). Последнее в совокупности с небольшой скоростью проникновения воды в тело рыб при низких температурах, по всей видимости, и приводит к сгущению крови.
ЗАКЛЮЧЕНИЕ
Исследование динамики физиолого-биохимических показателей у самок гибрида стерлядь × белуга на различных этапах формирования половых желез выявило ряд особенностей изменения их функционального состояния в сравнении с рыбами, созревающими в естественных условиях. Круглогодичное содержание осетровых рыб в установках замкнутого водоснабжения при достаточно высокой плотности и в отсутствие сезонных колебаний температуры, в условиях искусственного кормления и искусственной зимовки на завершающих этапах генеративного обмена оказывает влияние на естественную динамику метаболических процессов. В сравнении с рыбами из естественных популяций, интенсивность процессов несколько снижена, а вителлогенез растянут, со сдвигом максимальной интенсивности генеративного обмена в сторону следующей стадии формирования ооцитов, о чем свидетельствует уровень белка и β-липопротеинов в крови, максимум которого приходится на IVнез СЗГ. Заметим при этом, что в состав β-липопротеинов входит вителлогенин или иначе ововителин (Ипатов, Лукьяненко, 1979), принимающий непосредственное участие в формировании ооцитов. На пониженную интенсивность обмена веществ указывает и относительно низкий уровень гемоглобина в крови в этот период. Как известно, высокая интенсивность метаболизма обеспечивается соответственной напряженностью тканевого дыхания и окислительных процессов (Шульман, 1972). Полученные материалы исследований однозначно показывают необходимость в дальнейшем совершенствовании технологии выращивания в УЗВ, обеспечивающей большую физиологичность процесса созревания ооцитов, особенно для получения жизнестойкого потомства. К такому же выводу приходят авторы, предлагающие ввести в технологический процесс, наряду с зимовкой, “осенний нагул” при сохранении кормления, имитирующего сезонные изменения в содержании производителей (Щербина и др., 2019).
Список литературы
Айзенштадт Т.Б. 1977. Рост ооцитов и вителлогенез // Современные проблемы оогенеза. Москва: Наука. С. 5.
Баденко Л.В., Дорошева Н.Г., Корниенко Г.Г., Чихачева В.П. 1984. Эколого-физиологические основы повышения эффективности заводского разведения азовских осетровых // Воспроизводство рыбных запасов Каспийского и Азовского морей. Москва: ВНИРО. С. 88.
Блинков Б.В., Кокоза А.А. 2014. Особенности формирования репродуктивной функции в зависимости от режима кормления, на примере русского осетра, культивируемого в УЗВ // Рыбное хозяйство. № 4. С. 104.
Гапонов В.С. 1974. РОЭ у ходовых и инъецированных производителей осетровых // Тезисы отчетной сессии ЦНИОРХ (Посвящается 10-летию Института). Астрахань: ЦНИОРХ. С. 35.
Гераскин П.П., Металлов Г.Ф., Аксенов В.П. 1984. Физиолого-биохимическая характеристика самок севрюги, используемых для искусственного воспроизводства // Осетровое хозяйство водоемов СССР. Астрахань: Центрально-исследовательский институт осетрового хоз-ва. С. 81.
Гераскин П.П., Металлов Г.Ф., Григорьев В.А., Яицкая М.В. 2017. Физиолого-биохимические закономерности созревания самок осетровых рыб // Аквакультура: мировой опыт и российские разработки. Ростов-на-Дону: Южный научный центр РАН. С. 493.
Гераскин П.П., Ковалева А.В., Григорьев В.А. и др. 2019. Оценка физиологической подготовленности к репродуктивной функции доместицированных самок белуги и выращенных от икры в искусственных условиях // Вестник Астраханского государственного технического университета. Серия: Рыбное хозяйство. № 4. С. 95. https://doi.org/10.24143/2073-5529-2019-4-95-103
Гершанович А.Д., Пегасов В.А., Шатуновский М.И. 1987. Экология и физиология молоди осетровых. Москва: Агропромиздат.
Детлаф Т.А., Гинзбург А.С., Шмальгаузен О.И. 1981. Развитие осетровых рыб. Созревание яиц, оплодотворение, развитие зародышей и предличинок. Москва: Наука.
Ипатов В.В., Лукьяненко В.И. 1979. Сывороточные белки рыб: гетерогенность, структура и функции // Успехи соврем. биол. Вып. 1(4). Т. 88. С. 108.
Корабельникова О.В. 2009. Физиолого-биохимические показатели осетровых рыб (Acipenseridae Bonaparte, 1832) при выращивании в индустриальных хозяйствах: Автореф. дис. … канд. биол. наук. Москва: ВНИРО.
Лакин Г.Ф. 1990. Биометрия. Москва: Высш. шк.
Лиманский В.В., Яржомбек А.А., Бекина Е.Н., Андронников С.Б. 1984. Инструкция по физиолого-биологическим анализам рыбы. Москва: ВНИИПРХ.
Лукьяненко В.И., Гераскин П.П. 1966. Количественная характеристика гемоглобина крови у осетровых в морской и речной периоды жизни // Тезисы докладов на Отчетной сессии Центрально-исследовательского института осетрового хозяйства “ЦНИОРХ” (22–25 февраля 1966 года). Астрахань: Центрально-исследовательский институт осетрового хозяйства. С. 41.
Лукьяненко В.И., Кулик П.В. 1994. Физиолого-биохимическая и рыбоводная характеристика разновозрастных производителей волго-каспийских осетровых в связи с проблемой их искусственного воспроизводства. Рыбинск: Ин-т биологии внутренних вод РАН.
Лукьяненко В.И., Шелухин Г.К. 1970. Особенности функционального состояния осетровых в морской и речной периоды жизни // Биологические процессы в морских и континентальных водоемах: Тез. докл. II съезда ВГБО. Кишинев: Ред.-издат. отдел АН СССР. С. 227.
Мартемьянов В.И. 2014. Динамика содержания натрия и калия в плазме, эритроцитах и мышцах пресноводных рыб при продолжительном и комбинированном стрессе // Биол. внутр. вод. № 4. С. 78.
Мартемьянов В.И. 2015. Физиологические механизмы регуляции водного гомеостаза у пресноводных гидробионтов при адаптации к факторам среды // Труды ИБВВ РАН. Вып. 72(75). С. 99.
Мартемьянов В.И., Борисовская Е.В. 2010. Показатели водно-солевого обмена у вселившейся в рыбинское водохранилище тюльки Clupeonella cultriventris (Clupeiformes, Clupeidae) в сравнении с аборигенными морскими видами рыб // Рос. журн. биол. инвазий. Т. 3. № 2. С. 37.
Матишов Г.Г., Пономарева Е.Н., Журавлева Н.Г. и др. 2011. Практическая аквакультура. Ростов-на-Дону: Изд-во Южного научного центра РАН.
Металлов Г.Ф. 1977. Концентрация осмотически активных веществ и ионов в сыворотке крови осетровых в морской и речной периоды жизни: Автореф. дис. … к.б.н. Ленинград: Ин-т эволюц. физиол. биохим. им. И.М. Сеченова АН СССР.
Металлов Г.Ф., Гераскин П.П., Аксенов В.П. 1997.Физиолого-биохимические аспекты оценки рыбоводного “качества” самок севрюги Acipenser stellatus (Pall.) // Рыб. хоз-во. Cер. Аквакультура, информационный пакет. Москва: ВНИЭРХ. С. 4.
Металлов Г.Ф., Пономарев С.В., Аксенов В.П., Гераскин П.П. 2010. Физиолого-биохимические механизмы эколого-адаптационной пластичности осморегулирующей системы осетровых рыб: монография. Астрахань: Изд-во Астрахан. гос.-техн. ун-та.
Насыров Л.Ш., Подушка С.Б. 2017. Икорная продуктивность стербела – гибрида стерляди и белуги // Рыб. хоз-во. № 2. С. 80.
Наточин Ю.В., Лукьяненко В.И., Шахматова Е.И. и др. 1995. Двадцатилетний мониторинг (70–90-е годы) физико-химических параметров сыворотки крови у русского осетра Acipenser gueldenstaedtii // Вопр. ихтиол. Т. 35. Вып. 2. С. 253.
Пономарев С.В., Иванов Д.И. 2009. Осетроводство на интенсивной основе. Москва: Изд-во “Колос”.
Пономарева Е.Н., Ковалева А.В., Коваленко М.В. и др. 2019. Особенности роста различных гибридных форм осетровых видов рыб // Наука юга России. Т. 15. № 3. С. 81.
Сариев Б.Т., Туменов А.Н., Бакиев С.С. и др. 2019. Влияние совокупности различных технологических факторов на эффективность процессов созревания и получения прижизненной икры // Международный научно-исследовательский журнал. № 10(88). Ч. 1. С. 95. https://doi.org/10.23670/IRJ.2019.88.10.018
Субботкин М.Ф. 1979. Концентрация сывороточных бета-липопротеидов у каспийских осетровых в морской и речной периоды жизни // Осетровое хозяйство внутренних водоемов СССР. Астрахань: Типография издательства “Волга”.
Трусов В.З. 1964. Некоторые особенности созревания и шкала зрелости половых желез осетра // Труды ВНИРО: Осетровые Южных морей Советского Cоюза. Москва: Изд-во “Пищевая промышленность”. Т. 56. С. 69.
Филиппович Ю.Б., Егорова Т.А., Севастьянова Г.А. 1982. Практикум по общей биохимии. Москва: Просвещение.
Чебанов М.С., Галич Е.В. 2010. Ультразвуковая диагностика осетровых рыб. Краснодар: Просвещение-Юг.
Шульман Г.Е. 1972. Физиолого-биохимические особенности годовых циклов рыб. Москва: Пищ. пром-сть.
Шелухин Г.К. 1974. Физиолого-биохимические параметры осетровых в морской и речной периоды жизни: Автореф. дис. … к.б.н. Петрозаводск: Петрозаводcк. гос. ун-т им. О. В. Куусинена.
Щербина М.А., Бурлаченко И.В., Мышкин А.В. и др. 2019. О целесообразности специального предзимнего кормления самок осетровых рыб в индустриальных условиях // Труды ВНИРО. Т. 175. С. 175.
Burstein M., Samaille J. 1958. Determination of serum beta-lipoproteins after selective precipitation of heparin // La Presse Medicale. V. 66. P. 974.
Geraskin P.P., Shelukhin G.K., Metallow G.F., Aksenov V.P. 1999. Specific functional features of sexual maturation and quality of sevruga (Acipenser stellatus P.) females // J. Appl. Ichthyol. V. 15 (4–5). P. 339.
Magnin E. 1962. Recherches sur la sistematique et la biologie de Acipenserides (A. sturio, A. oxyrhynchus, A. fulvescens) // Ann. Stat. Centr. Hydrob. 9. P. 170–242.
Ponomareva E., Geraskin P., Sorokina M. et al. 2020. Features of the reproductive system development in the installations of closed water supply system // E3S Web Conf. XIII International Scientific and Practical Conference “State and Prospects for the Development of Agribusiness – INTERAGROMASH 2020”. V. 175. P. 8. https://doi.org/10.1051/e3sconf/202017502012
Van Kampen E.J., Zijlstra W.G. 1961. Standardization of hemoglobin metry. II. The hemoglobin cyanide method // Clin. Chim. Acta. V. 6. P. 538.
Zöllner, N. and Kirsch, K. 1962 Uber die quantitave Bestimmung von Lipoiden (Micromethode) mittels die vieles naturlischen Lipoiden (allen Bekannten plasmolipoiden) gemeinsamen Sulfophosphovanilin-Reaction // Zeitschrift Fur Die Gesamte Experimentelle Medicin. V. 135. № 6. P. 545.https://doi.org/10.1007/BF02045455
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод


