Биология внутренних вод, 2021, № 3, стр. 311-320
Опыт применения интегрального индекса для оценки дестабилизационных процессов в иммунной системе рыб
В. Р. Микряков 1, В. Г. Терещенко 1, *, Д. В. Микряков 1
1 Институт биологии внутренних вод им. И.Д. Папанина Российской академии наук
Некоузский р-н, Ярославская обл, пос. Борок, Россия
* E-mail: tervlad@ibiw.ru
Поступила в редакцию 06.09.2019
После доработки 02.10.2020
Принята к публикации 30.11.2020
Аннотация
Обобщен опыт применения интегрального индекса структуры лейкоцитов для анализа реакции иммунной системы рыб на различные стресс факторы. Получена новая информация о характере ответа клеточного звена иммунной системы на воздействие фенола, нафталина, солей тяжелых металлов, дихлофоса, аналога кортизона и лигулеза. Предложенные и апробированные индексы позволяют подойти к решению вопроса о структуре лейкоцитов в норме и о характере дестабилизационных процессов, происходящих в иммунной системе рыб при нарушающих воздействиях.
ВВЕДЕНИЕ
Иммунная система рыб на воздействие различных по природе и происхождению биотических и абиотических факторов реагирует нарушением структурно-функционального гомеостаза. Это приводит к нарушению функции защиты организма от чужеродных тел. Одна из основных структур, обеспечивающих защиту организма от всего “чужого” и видоизмененных антигенов своего, – лейкоциты во всем многообразии их форм. Состав и структура лейкоцитов в онтогенезе рыб в разные периоды годового цикла и под влиянием возмущающих факторов существенно изменяется. Исследованию изменения состава и структуры лейкоцитов у рыб в настоящее время придается огромное значение (Ellis, 1977; Иванова, 1983; Головина, Тромбицкий, 1989; Zapata et al., 1996; Микряков, 2004; Mazur, Pronin, 2006; Van Muiswinkel, Vervoorn-Van Der Wal, 2006; Моисеенко, 2009; Saglam, Yonar, 2009; Yakhnenko, Klimenlov, 2009; Микряков и др., 2013; Изергина и др., 2014; Abdullaeva et al., 2015; Zebral et al., 2015; Королева, 2016; Dezfuli et al., 2016; Басова, 2017; Головина, 2018; Samaï et al., 2018; Ahmed, Sheikh, 2019 и др.).
Для оценки влияния патологий различной природы на иммунный статус в клинической иммунологии в качестве индикаторного теста используется лейкограмма (Кудрявцев, Кудрявцева, 1974; Лебедев, Понякина, 1990). При изучении изменений в лейкоцитарной формуле анализируют большой объем информации. Задача усложняется при сравнительном изучении динамики ответа иммунной системы на действие нескольких негативных воздействий. Использование интегральных индексов позволяет сконцентрировать информацию об изменениях в лейкоцитарной формуле при воздействии на рыб разных по природе возмущающих факторов и получить наглядный способ представления о характере реагирования иммунной системы на дестабилизирующие факторы. Классические методы получили дальнейшее развитие благодаря подходам, основанным на свертке обширной информации в интегральный индекс, на более наглядном представлении результатов исследования о происходящих изменениях в биологических системах и применении разработок других наук.
Цель работы – обобщить опыт применения интегральных индексов структуры лейкоцитов, позволяющих более эффективно решать различные теоретические и практические задачи в иммунологии рыб на основе классических методов.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Материалом для исследования послужили литературные данные о результатах экспериментов по изучения влияния фенола, нафталина, дихлофоса, солей тяжелых металлов (ионы меди, ртути и кадмия), гормона и лигулеза на состав лейкоцитов периферической крови рыб.
Эксперименты по действию на иммунную систему фенола и нафталина проводили на годовиках обыкновенного карася Carassius carassius (L.). Концентрация фенола была 3 мг/л, нафталина 10 мг/л (Балабанова, Микряков, 2002). Влияние солей тяжелых металлов изучали на сеголетках (2 мес) сибирского осетра из р. Лена Acipenser baerii Brandt, в качестве токсических факторов использовали растворы солей меди в концентрации 0.015, ртути – 0.003, кадмия – 0.03 мг/л (Микряков, Лапирова, 1997). Опыты по влиянию дихлофоса и нафталина проводили на сеголетках мозамбикской тиляпии Oreochromis mossambicus (Peters). Концентрация дихлофоса достигала 0.46 мг/л, нафталина 1.5 мг/л. Экспозиция в токсиканте в последнем эксперименте была 60 сут, последующие 60 сут рыб содержали в чистой воде (Балабанова, Степанова, 2000). Во всех экспериментах контролем служили особи, находившиеся в воде без добавления токсиканта.
Влияние гормона дексаметазон-фосфата (аналог кортизона) изучали на двухлетках золотого карася Carassius carassius (L.). Обработку рыб гормоном проводили путем парентеральных инъекций в дозе 0.2 мл (0.8 мг) на одну особь (Микряков, 2004).
О влиянии инвазии Ligula intestinalis (Cestoda, Pseudophylidea) на клетки иммунной системы рыб судили по данным анализа состава лейкоцитов в крови, головной почке и селезенке инвазированных и неинвазированных трех- и четырехлеток лещей Abramis brama (L.) Рыбинского водохранилища. Инвазированных рыб в зависимости от интенсивности заражения и стадии развития червей на фазе плероцеркоида условно разделяли на две группы: в первой группе были рыбы, имеющие в теле одного паразита с длинной тела лигулы ≤10 см и не достигших инвазивной стадии, во второй – с большим числом лигулид (до 10 экз.) и размерами >10 см (Микряков и др., 2009).
Интегральный индекс. Нередко в длительных опытах воздействия различных стресс-факторов при описании изменений в лейкоцитарной формуле приходится сравнивать между собою материал многих таблиц, что затрудняет анализ. Свертка обширной информации в интегральный индекс позволяет наглядно представить динамику ответа иммунной системы, оценить силу влияния нарушающих факторов, анализировать одновременно действие различных стресс-факторов в сравнительном аспекте, представить все изменения на одном графике. Отыскать интегральный индекс, описывающий изменение, происходящее в биологической системе, непросто. Необходимо, чтобы он имел биологический смысл, а каждый анализируемый параметр входил в него составной частью. По существу, задача поиска интегрального индекса сводится к задаче снижения размерности исходных количественных данных, которая решается различными методами. В частности, на основе применения метода главных компонент, множественной регрессии и т.д. (Шитиков и др., 2003).
Если рассмотреть состояние здоровья особи или популяции рыб, то одна из важных характеристик, отражающая функционирование их иммунной системы, – лейкоцитарная формула. Рыбы на воздействие различных стресс-факторов реагируют изменением структурного разнообразия, количественных характеристик отдельных типов лейкоцитов и соотношением между ними. Изменения в лейкоцитарной формуле белой крови, почек или селезенке могут затрагивать как число форм лейкоцитов, так и их относительное обилие. С количественной точки зрения эта задача сходна с задачей отыскания разнообразия сообщества животных или растений. Для этого в синэкологии широко применяется интегральный индекс биологического разнообразия. Концентрируя информацию о видовой структуре сообщества, он позволяет выявить общую тенденцию развития системы. Таким образом, для описания изменения в лейкоцитарной формуле, т.е. в структуре лейкоцитов, предлагается использовать индекс разнообразия, основанный на функции Шеннона (Pielou, 1966; Джиллер, 1988; Терещенко и др., 1994):
(1)
$H = - \sum\limits_{i = 1}^N {\left( {{{n}_{{\text{i}}}}/N} \right)} \times lo{{g}_{2}}\left( {{{n}_{{\text{i}}}}/N} \right),$В дальнейшем под понятием “структура лейкоцитов” будет подразумеваться индекс, который зависит от числа форм лейкоцитов и их относительного обилия. Смысл функции Шеннона заключается в оценке неопределенности структуры лейкоцитов, т.е. неопределенности вероятности встречи той или иной формы лейкоцитов. При равной доле всех форм иммунная система по структуре полностью дезорганизована, а ее неопределенность максимальна и равна логарифму числа форм. Если некоторые формы лейкоцитов становятся доминантными, то закон равных вероятностей нарушается, увеличивается структурная организация системы, а неопределенность структуры снижается. Если требуется анализировать филогенетические изменения в крови рыб, когда изменяется и количество форм лейкоцитов, удобнее работать с относительным показателем “относительная организация” (R), зависящим в основном от доли различных форм (Антомонов, 1977):
Для детерминированной системы, состоящей из одной доминирующей формы лейкоцитов, этот показатель приближается к единице. Для полностью дезорганизованной, т.е. при равном вкладе всех форм лейкоцитов, показатель равен нулю.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Воздействие фенола и нафталина. Стандартными методами исследования выявлены изменения в соотношении отдельных типов клеток: лимфоцитов, нейтрофилов, моноцитов, эозинофилов и бластных форм. На 4-е сут после начала воздействия фенола наблюдали достоверные различия при уровне значимости р < 0.05 в доле лимфоцитов, нейтрофилов и моноцитов, по сравнению с контролем, на 7-е сут – только лимфоцитов и нейтрофилов (Микряков и др., 2002). Следовательно, анализ изменений в численности различных форм лейкоцитов при действии фенола позволяет только констатировать различие в лейкоцитарной формуле контрольных и опытных рыб на 4-е сут эксперимента. Описанные выше изменения показаны графически на рис. 1.
Рис. 1.
Динамика относительного обилия (%) различных форм лейкоцитов крови карпа в контроле (а) и при воздействии фенола (б): 1 – лимфоциты, 2 – нейтрофилы, 3 – моноциты, 4 – эозинофилы, 5 – бластные формы.
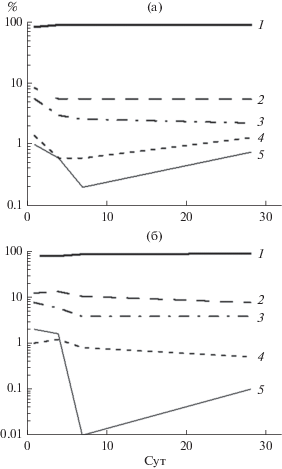
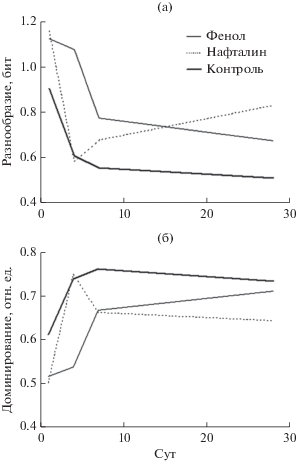
Интегральные индексы структуры лейкоцитов наглядно демонстрируют то, что реакция рыб на воздействие фенола во время всего опыта отличалась от таковой контроля (рис. 2). На 28-е сут структура лейкоцитов белой крови опытных рыб приближалась к таковой контрольных рыб. При воздействии же нафталина структура лейкоцитов крови опытных и контрольных рыб различалась. Таким образом, применение интегральных индексов позволило количественно оценить силу влияния различных нарушающих воздействий, визуализировать происходящие в иммунной системе изменения и получить новые результаты по сравнению с ранее применяемыми методами исследования.
Рис. 2.
(по: Микряков и др., 2002) Динамика индексов разнообразия (а) и относительной организации (б) состава лейкоцитов белой крови карася при воздействии фенола и нафталина.
Действие солей тяжелых металлов. Установлено, что под воздействием ионов ртути доля лимфоцитов в начале опытов достоверно снижалась, а по истечению двух недель достигла близких к контрольному уровню значений. Кроме того, отмечено увеличение содержания нейтрофилов и эозинофилов у опытных рыб по сравнению с контрольными. При изучении влияния ионов кадмия выявлены сходные по характеру и направленности клеточные перестройки. Однако, интенсивность отклонения содержания нейтрофилов были менее выраженными. В присутствии же ионов меди на первых двух этапах эксперимента доля лимфоцитов снижалась при увеличении нейтрофилов и эозинофилов.
Применение интегральных индексов подтвердило ранее сделанные выводы и позволило получить новые. Разнообразие и относительная организация структуры лейкоцитов опытных рыб к концу эксперимента приближались к состоянию контрольных рыб (рис. 3). Кроме того, обнаружены чередующиеся периоды уменьшения и увеличения (“дестабилизации”–“нормализации”–“дестабилизации”) различий отдельных форм лейкоцитов между контрольными и опытными рыбами. При действии ионов меди структура лейкоцитов опытных рыб и через 60 сут не приблизилась к структуре контрольных рыб. При действии солей ртути и кадмия отмечено уменьшение различий в состоянии лейкоцитов контрольных и опытных рыб (рис. 3).
Рис. 3.
Динамика индексов разнообразия (а) и относительной организации (б) состава лейкоцитов крови ленского осетра при воздействии солей тяжелых металлов.

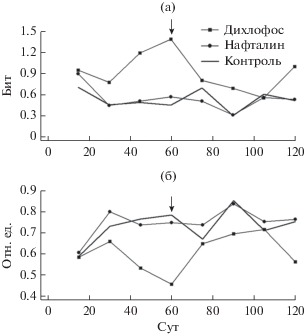
Действие дихлофоса и нафталина. Установлено, что экспозиция рыб в растворе нафталина не вызвала достоверных количественных изменений в численности и соотношении различных клеток периферической крови. При действии дихлофоса на 30-е сут эксперимента обнаружены изменения в составе клеток белой крови, а через 45 сут достоверно снизилось количество лимфоцитов и достоверно увеличилось количество моноцитов и нейтрофилов. Динамика интегральных показателей отражает описанные выше перестройки в структуре лейкоцитов крови (Степанова, Терещенко, 2001). При действии дихлофоса структура лейкоцитов больше отличается от структуры контрольных рыб по сравнению с действием нафталина (рис. 4). Более того, в ходе всего эксперимента отмечено увеличение различий по сравнению с контрольными рыбами. После помещения рыб в чистую воду наблюдалось уменьшение различий в структуре лейкоцитов опытных и контрольных рыб. При действии же нафталина различия в структуре лейкоцитов контрольных и опытных рыб невелики.
Рис. 4.
Динамика индексов разнообразия (а) и относительной организации (б) состава лейкоцитов крови тиляпии при воздействии дихлофоса и нафталина. Стрелкой указано время перемещения рыб в чистую воду.
Действие инъекции гормона. На введение дексаметазона караси реагировали снижением количества лимфоцитов и повышением нейтрофилов и моноцитов. Максимальный размах изменений в составе лейкоцитов зарегистрирован через сутки после начала опыта. Начиная с 3-х сут эксперимента, происходило постепенное снижение разбалансированности состава лейкоцитов между клетками опытных и контрольных рыб. К концу недели опытные и контрольные показатели имели небольшое различие, в последующие сроки наблюдения различия сглаживались.
Динамика индексов структуры лейкоцитов отражает описанные выше перестройки (рис. 5). В начале эксперимента отмечена максимальная дестабилизация в составе клеток иммунной системы рыб, которая исчезала через 2 нед. Изменения, происходящие в составе лейкоцитов после введения гормона носили более выраженный характер, чем у рыб в присутствии токсикантов, особенно в начале опыта.
Рис. 5.
Динамика индекса относительной организации состава лейкоцитов крови карася после инъекции гормона дексаметазон-фосфата.

Влияние лигулы. Данный анализ сложно провести в экспериментальных условиях. Однако можно накопить выборку рыб различной степени зараженности и взять информацию о лейкоцитарной формуле белой крови, головной почки и селезенки. У рыб на второй стадии лигулеза индексы “разнообразие” и “относительная организация” белой крови, головной почки и селезенки достоверно отличались от таковых у здоровых рыб. Наиболее достоверные различия получены при изучении селезенки рыб (рис. 6). Кроме того, максимальной на второй стадии болезни рыб оказалась и вариабельность интегральных индексов структуры лейкоцитов крови и головной почки (рис. 7).
Рис. 6.
Динамика индексов разнообразия (а, в, д) и относительной организации (б, г, е) состава лейкоцитов крови (а, б), головной почки (в, г) и селезенки (д, е) леща с различной степенью зараженности лигулой.

Рис. 7.
Вариабельность индекса разнообразия (бит) структуры лейкоцитов крови, головной почки и селезенки леща с различной степенью зараженности лигулой.

Анализ согласованности реакции различных звеньев иммунной системы рыб на действие стресс-факторов. Информация о структуре лейкоцитов позволяет наглядно представить на одном графике реакцию двух или трех звеньев иммунной системы на действие стресс-факторов с помощью двух- или трехмерного параметрического фазового портрета. Таким образом, появляется возможность анализа согласованности реакций различных звеньев иммунной системы.
В экологии параметрический фазовый портрет применяется широко (Одум, 1975). При этом в качестве параметров могут быть взяты численность отдельных видов, продукция, биомасса и т.д. Если изменения рассматриваемых параметров идут однонаправленно и синхронно, то траектория движения такой системы на фазовом портрете будет идти против часовой стрелки, в противном случае – по часовой (Gilpin et al., 1982; Knut, 1997; Portrait et al., 1999). Рассмотрим взаимодействие различных звеньев иммунной системы рыб, в частности, периферической крови и селезенки. Для этого по одной из координат откладываем разнообразие структуры лейкоцитов белой крови, а по другой – селезенки. Возьмем для примера результаты влияния сублетальных концентраций дихлофоса на структуру лейкоцитов тиляпии. На 30-е сут эксперимента обнаружены изменения в составе клеток белой крови и селезенки. В селезенке появились макрофаги, и снизилось число миелоцитов, а в белой крови увеличилось число нейтрофилов. Через 45-е сут в селезенке и периферической крови отмечено достоверное снижение количества лимфоцитов и увеличение моноцитов (макрофагов) и нейтрофилов (Балабанова, Степанова, 2000). Динамика индексов структуры лейкоцитов отражает описанные выше перестройки (Степанова, Терещенко, 2001). В ходе всего эксперимента отмечалось увеличение различия между опытными и контрольными особями. После пересадки в чистую воду наблюдали уменьшение различий в структуре лейкоцитов опытных и контрольных рыб. Траектория движения иммунной системы на фазовом портрете представляет собой кривую типа “гистерезиса” (рис. 8). Траектория движения системы при действии токсиканта отличается от траектории в чистой воде. Это говорит о наличии сдвига в реакции белой крови и селезенки.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
На примере изучения влияния токсикантов на состав лейкоцитов периферической крови рыб показана принципиальная возможность применения интегральных индексов для исследования динамики дестабилизационных процессов, происходящих в иммунной системе. Какую же новую информацию дало применение интегральных индексов структуры лейкоцитов по сравнению с ранее полученными выводами?
Обычно результаты экспериментов по изучению содержания лейкоцитов при действии различных факторов среды представляют в виде таблицы. Поскольку опыты проводят на нескольких рыбах, то есть возможность сравнить по критерию Стьюдента обилие различных форм лейкоцитов в эксперименте и контроле. Что исследователи и делают, отметив в таблице звездочкой достоверные различия в соотношении форм лейкоцитов. Однако при длительных экспериментах, в которых изучают влияние разных токсикантов, оперирование большим массивом информации становится затруднительным. Свернутая же информация в виде интегральных индексов структуры лейкоцитов позволяет наглядно представить ответ иммунной и кроветворной систем в виде графиков. Таким образом, использование количественных показателей лейкоцитов упрощает оперирование большим объемом информации, полученной в результате длительных экспериментов, и позволяет проводить сравнение реакции рыб при действии нескольких факторов.
Если анализировать только динамику относительной численности различных форм лейкоцитов при воздействии фенола (рис. 1), то можно сказать, что определенные изменения в соотношении форм лейкоцитов у опытных рыб по сравнению с контролем произошли на 4-е сут эксперимента. Свернутая информация об их относительной численности показала, что на протяжении всего периода исследования наблюдали различия в структуре лейкоцитов опытных и контрольных рыб, причем со временем при действии фенола происходило монотонное уменьшение этого различия, а при действии нафталина – нет. Таким образом, с одной стороны, применение интегральных индексов дает более наглядный и чувствительный метод оценки различия состояния лейкоцитов, с другой – позволяет получить дополнительную информацию об относительной силе воздействия и характере реагирования клеток иммунной системы. Кроме того, даже у контрольных рыб в течение эксперимента в составе клеток белой крови происходили определенные изменения (рис. 2). В первую неделю наблюдался рост индекса относительной организации и уменьшение индекса разнообразия, в дальнейшем отмечалась стабилизация обоих индексов структуры лейкоцитов. Возможно, это связано со стрессорной реакцией, обусловленной пересадкой рыб в аквариумы, и изменением условий содержания.
Следует отметить, что оба предложенных индекса дают сходную информацию, поэтому в исследованиях можно ограничиться только одним. В случаях, когда количество форм лейкоцитов не изменяется, достаточно анализировать только индекс “относительная организация” структуры лейкоцитов или доминирования. В случаях, когда идет изменение и в количестве форм лейкоцитов, индекс “разнообразие” структуры лейкоцитов даст дополнительную информацию о состоянии кроветворной и иммунной систем. Особый интерес представляет неожиданный вывод, что наибольшая разбалансировка в структуре клеток иммунной системы рыб к концу опыта наблюдалась при действии нафталина, а не фенола. Ранее на основании проведенных экспериментов был сделан противоположный вывод (Балабанова, Микряков, 2002). Вероятно, это связано с особенностями иммунотоксического воздействия на организм. Нафталин воздействует, главным образом, на компоненты крови и нейросекреторные органы (Di Michele, Taylor, 1978), тогда как фенол опосредованно влияет на иммунную систему рыб (Гончаров, Микряков, 1970). Это ставит задачу более тщательного анализа действия фенола и нафталина на структурно-функциональное состояние кроветворной и иммунной систем рыб, постановки дополнительных экспериментов и дальнейшего осмысления полученных результатов. В качестве гипотезы, объясняющей полученные результаты, можно предположить, что полиароматические углеводороды вызывают необратимые изменения в регуляции лейкопоэтической функции и, как следствие, дезорганизацию структурного разнообразия лейкоцитов рыб.
Информация о структуре лейкоцитов, свернутая в число с помощью предложенных индексов, позволяет подойти к анализу взаимосвязанности различных звеньев иммунной системы. Теперь можно наглядно представить их реакцию на действие стресс-факторов с помощью параметрического фазового портрета. Следовательно, можно ставить задачи, которые было весьма затруднительно решать при оперировании только табличными данными.
Кроме того, полученные результаты позволяют более обоснованно подойти к планированию последующих экспериментов. Из анализа интегральных индексов видно, что даже у контрольных рыб в первую неделю происходят изменения в составе лейкоцитов. Поэтому в дальнейшем при решении многих задач, связанных с оценкой последствий токсических и других стресс-факторов на рыб, следует начинать отбор проб по истечении этого срока. Вместе с тем, для изучения природы равновесного состояния иммунной системы и ее динамики после недельной экспозиции рыб в экспериментальных условиях необходимо оперировать более дробными по времени данными о соотношении различных форм лейкоцитов.
Имеющиеся данные позволяют сделать предварительный вывод об изменении равновесного состояния (нормы) соотношения форм лейкоцитов крови рыб в связи с их систематическим положением. Для молоди карася и тиляпии “норма” индекса “относительная организация” структуры лейкоцитов соответствует значениям 0.7–0.75, для сибирского осетра – 0.5–0.6. Для человека, судя по имеющимся данным (Сороко, 1984), – 0.4.
Выводы. Предложены и апробированы интегральные индексы описания структуры лейкоцитов крови рыб (разнообразие и относительная организация), позволяющие визуализировать изменения в функционировании их иммунной системы в ответ на воздействие токсических факторов, и оперировать большим массивом информации при анализе произошедших изменений. Получена новая информация о характере ответа клеточного звена иммунной системы карася на воздействие фенола и нафталина и тиляпии – на воздействие дихлофоса и нафталина. Установлено, что при воздействии фенола к 28-м сут состояние клеток иммунной системы опытных рыб карася приближается к состоянию контрольных рыб, а при воздействии нафталина – нет. В экспериментах с мозамбикской тиляпией показано, что после помещения рыб, подвергшихся действию нафталина, в чистую воду сохраняются отличия в структуре лейкоцитов селезенки опытных рыб по сравнению с контрольными особями (Степанова, Терещенко, 2001), тогда как после действия дихлофоса состояние клеток иммунной системы опытных рыб при помещении в чистую воду приближается к состоянию, характерному для контрольных рыб. Получена новая информация о дистабилизационных процессах в иммунной системе молоди сибирского осетра в ответ на действие солей тяжелых металлов. Ионы меди вызывают бóльшие изменения в структуре лейкоцитов белой крови осетра по сравнению с действием ионов ртути и кадмия. Кортикостероидные гормоны в организме рыб вызывают сходные с таковыми на токсиканты дестабилизационные процессы в составе лейкоцитов с той лишь разницей, что амплитуда колебаний между клетками после обработки гормонами была выражена сильнее, чем на токсические факторы, а изменения в картине крови наступали быстрее.
Идея свертки лейкоцитарной формулы в интегральный индекс, описывающий дестабилизационные изменения в иммунной системе рыб, принадлежит В.Р. Микрякову.
Список литературы
Антомонов Ю.Т. 1977. Моделирование биологических систем. Киев: Наукова думка.
Балабанова Л.В., Микряков В.Р. 2002. Сравнительная характеристика действия нафталина и фенола на показатели белой крови карася Carassius carassius (L.) // Биология внутренних вод. № 2. С. 100.
Балабанова Л.В., Степанова В.М. 2000. Хроническое действие нафталина и дихлофоса на иммунокомпетентные клетки мозамбикской тиляпии (Oreochromis mossambicus (Peters)) // Биол. внутр. вод. № 4. С. 146.
Басова М.М. 2017. Лейкоцитарная формула морского ерша Scorpaena porcus как биомаркер антропогенного загрязнения прибрежных вод Черного моря // Вопр. ихтиол. Т. 57. № 3. С. 347. https://doi.org/10.7868/S004287521703002X
Головина Н.А. 2018. Гематологические исследования и их использование для оценки здоровья рыб // Рыбоводство и рыб. хоз-во. № 5(148). С. 72.
Головина Н.А., Тромбицкий И.Д. 1989. Гематология прудовых рыб. Кишинев: Штиинца.
Гончаров Г.Д., Микряков В.Р. 1970. Влияние малых концентраций фенола на антителообразование у карпа (Cyprinus carpio L.) // Вопр. водной токсикол. Москва: Наука.
Джиллер П. 1988. Структура сообществ и экологическая ниша. Москва: Мир. (Giller P.S. 1984. Community Structure and the Niche. London: Chapman and Hall).
Иванова Н.Т. 1983. Атлас клеток крови рыб. Москва: Легк. и пищ. пром-сть.
Изергина Е.Е., Изергин И.Л., Изергин Л.И. 2014. Атлас клеток крови лососевых рыб материкового побережья северной части Охотского моря. Магадан: Кордис.
Королева И.М. 2016. Гематологические показатели сига обыкновенного Coregonus lavaretus L. в водоемах Кольского севера // Тр. Всерос. научно-исследовательского ин-та рыб. хоз-ва и океаногр. Т. 162. С. 36.
Кудрявцев А.А., Кудрявцева Л.А. 1974. Клиническая гематология животных. Москва: Колос.
Лебедев К.А., Понякина И.Д. 1990. Иммунограмма в клинической практике. Москва: Наука.
Микряков Д.В. 2004. Влияние некоторых кортикостероидных гормонов на структуру и функцию иммунной системы рыб: Дис. … канд. биол. наук. Москва.
Микряков В.Р., Лапирова Т.Б. 1997. Влияние солей некоторых тяжелых металлов на картину белой крови молоди ленского осетра Acipenser baeri Brandt // Вопр. ихтиол. Т. 37. № 4. С. 538.
Микряков В.Р., Терещенко В.Г., Микряков Д.В., Балабанова Л.В. 2002. Применение интегральных показателей структуры лейкоцитов для изучения реакции иммунной системы рыб на токсиканты // Биол. внутр. вод. № 4. С. 84.
Микряков Д.В., Балабанова Л.В., Терещенко В.Г., Микряков В.Р. 2009. Влияние инвазии плероцеркоида Ligula intestinalis на состояние лимфомиелоидной ткани и на клеточное звено иммунной системы леща Abramis brama (L.) // Проблемы ихтиопатол. в нач. XXI в: Сб. науч. тр. Санкт-Петербург: ГосНИИ озер. и реч. рыб. хоз-ва. Вып. 338. С. 120.
Микряков В.Р., Гудков Д.И., Микряков Д.В. и др. 2013. Сравнительная характеристика состава лейкоцитов золотого карася Carassius carassius (Cyprinidae) из водоемов Чернобыльской зоны отчуждения и Рыбинского водохранилища // Вопр. ихтиол. Т. 53. № 6. С. 741. https://doi.org/10.7868/S0042875213060076
Моисеенко Т.И. 2009. Водная экотоксикология: Теоретические и прикладные аспекты. Москва: Наука.
Одум Ю. 1975. Основы экологии. Москва: Мир. (Odum E.P. 1971. Fundamentals of Ecology. Philadelphia: WB Saunders Company.)
Сороко Е.М. 1984. Структурная гармония систем. Минск: Наука и техника.
Степанова В.М., Терещенко В.Г. 2001. Динамика индекса разнообразия лейкоцитов мозамбикской тиляпии Oreochromis mosambicus (Peters) при хроническом действии нафталина, дихлофоса и кадмия // Проблемы биологии, химии, экологии и экологического образования. Ярославль: Ярославский гос. ун-т. С. 216.
Терещенко В.Г., Терещенко Л.И., Сметанин М.М. 1994. Оценка различных индексов для выражения биологического разнообразия сообщества // Биоразнообразие: Степень таксономической изученности. Москва: Наука. С. 86.
Шитиков В.К., Розенберг Г.С., Зинченко Т.Д. 2003. Количественная гидроэкология: методы системной идентификации. Тольятти: Ин-т экологии волжск. бассейна РАН.
Abdullaeva N.M., Gabibov M.M., Asadulaeva P.A., Ramazanova M.G. 2015. Analysis of the leokogram of sturgeons (Acipenser baerii (Brandt) and A. gueldenstaedtii (Brandt)) grown in artificial reservoirs // Inl. Wat. Biol. V. 8. № 4. P. 421. https://doi.org/10.1134/S1995082915040033
Ahmed I., Sheikh Z.A. 2019. Hematological and serum biochemical parameters of five freshwater snow trout fish species from river Jhelum of Kashmir Himalaya, India // Comp. Clin. Pathol. V. 28. № 3. P. 771. https://doi.org/10.1007/s00580-019-02909-y
Dezfuli B.S., Giari L., Bosi G. et al. 2016. Fish innate immunity against intestinal helminths // Fish Shellfish Immunol. V. 50. P. 274. https://doi.org/10.1016/j.fsi.2016.02.002
Di Michele Z., Taylor M.Y. 1978. Histophathological and physiological responses of Fundulus heteroclitus to naphthalene exposure // J. Fish. Res. Board Canada. V. 35. № 8. P. 1060.
Ellis A.E. 1977. The leucocytes of fish: a review // J. Fish. Biol. V. 11. № 5. P. 453. https://doi.org/10.1111/j.1095-8649.1977.tb04140.x
Gilpin M., Case T., Bender E.A. 1982. Counterintuitive oscillations in systems of competition and mutualism // Amer. Nat. V. 119. P. 584.
Knut L. 1997. Defining and measuring species interactions in aquatic ecosystems // Can. J. Fish. Aquat. Sci. V. 54. P. 1513. https://doi.org/10.1139/f97-058
Mazur O.E., Pronin N.M. 2006. Parameters of the blood and immune system of Rutilus rutilus lacustris (Cypriniformes: Cyprinidae) during an invasion with pleurocercoids of Ligula intestinalis (Pseudophyllidae: Ligulidae) // J. Ichthyol. V. 46. № 5. P. 399. https://doi.org/10.1134/S0032945206050067
Pielou E.C. 1966. Shannon’s Formula as a Measure of Specific Diversity: Its Use and Misuse // Am. Nat. V. 100. № 914. P. 463.
Portrait V., Gendron-Gaillard S., Cottenceau G., Pons A.M. 1999. Inhibition of pathogenic Salmonella interitidis growth mediated by Escherichia coli microcin J25 producing strains PDF // Can. J. Microbiol. V. 45. P. 988. https://doi.org/10.1139/w99-106
Saglam N., Yonar M.E. 2009. Effects of sulfamerazine on selected haematological and immunological parameters in rainbow trout (Onchorhynchus mykiss, Walbaum, 1792) // Aquacult. Res. V. 40. № 4. P. 395. https://doi.org/10.1111/j.1365-2109.2008.02105.x
Samaï H.C., Delahaut L., Jubréaux J. et al. 2018. Procedures for leukocytes isolation from lymphoid tissues and consequences on immune endpoints used to evaluate fish immune status: A case study on roach (Rutilus rutilus) // Fish Shellfish Immunol. V. 74. P. 190. https://doi.org/10.1016/j.fsi.2017.12.040
Van Muiswinkel W., Vervoorn-Van Der Wal B. 2006. The immune system of fish // Fish Dis. Disord. V. 1. P. 678.
Yakhnenko V.M., Klimenlov I.V. 2009. Specific features of blood cell composition and structure in fishes from the pelagial and coastal zones of lake Baikal // Biol. Bul. V. 36. № 1. P. 37. https://doi.org/10.1134/S1062359009010063
Zapata A.G., Chiba A., Varas A. 1996. Cells and tissues of the immune system of fish. London: Acad. Press.
Zebral Y.D., Zafalon-Silva B., Mascarenhas M.W., Robaldo R.B. 2015. Leucocyte profile and growth rates as indicators of crowdingstress in pejerrey fingerlings (Odontesthes bonariensis) // Aquacut. Res. V. 46. P. 2270. https://doi.org/10.1111/are.12384
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод



