Биология внутренних вод, 2021, № 5, стр. 527-536
Нарушения в структуре тканей мышц и печени амурского осетра Acipenser schrenckii и калуги Huso dauricus (Acipenseridae)
В. Н. Кошелев a, Г. И. Рубан b, *
a Хабаровский филиал Всероссийского научно-исследовательского института рыбного хозяйства и океанографии
Хабаровск, Россия
b Институт проблем экологии и эволюции им. А.Н. Северцова Российской академии наук
Москва, Россия
* E-mail: georgii-ruban@mail.ru
Поступила в редакцию 15.12.2020
После доработки 10.03.2021
Принята к публикации 22.03.2021
Аннотация
Представлены результаты гистологического исследования состояния мышечной ткани и печени амурского осетра Acipenser schrenckii и калуги Huso dauricus. Материал собран в 2007 г. в устьевой части р. Амур. Анализ показал наличие патологических изменений у большинства особей обоих видов. Определена частота встречаемости наиболее характерных нарушений мышечной ткани (искривления волокон, расслоения волокон, липидные вставки, соединительнотканные включения, выпадение миофибрилл) и печени (воспалительные инфильтраты, некрозы, фиброз стенок сосудов, дискомплексация печеночных пластинок), вероятно, ставших следствием загрязнения р. Амур. Степень выраженности выявленных нарушений варьировала у отдельных особей от “слабо выраженной” до “сильно выраженной”. Проведено сравнение полученных результатов с аналогичными данными по осетровым, обитающим в Каспийском море и р. Волгe.
ВВЕДЕНИЕ
Большое хозяйственное значение осетровых рыб привело к перелову их природных популяций (Birstein et al., 1997; Billard, Lecointre, 2001), вследствие чего они занесены в Приложение к Конвенции СИТЕС, как находящиеся под угрозой исчезновения. Для сохранения этих видов необходимы жесткая охрана, принятие эффективных мер по восстановлению численности их популяций и контроль за состоянием среды обитания.
В настоящее время развитие промышленности и интенсивного сельского хозяйства привело к загрязнению мест обитания осетровых широким спектром поллютантов, принадлежащих к разным классам соединений. В последние десятилетия опубликованы многочисленные работы, посвященные анализу нарушений в развитии и функционировании различных систем органов осетровых рыб, в том числе на уровне тканей. Эти работы выполнены, в основном, на видах из Волго-Каспийского бассейна и рек Сибири. Обнаруженные аномалии обобщены в ряде работ (Алтуфьев и др., 1992; Акимова, Рубан, 1996; Евгеньева, 2000; Ruban et al., 2015). Осетровые р. Амур – калуга Huso dauricus Georgi, 1775 и амурский осетр Acipenser schrenckii Brandt, 1869 – в этом отношении менее изучены, но и у них отмечены различные гистоморфологические нарушения в строении и развитии воспроизводительной системы и жаберного эпителия, предположительно обусловленные масштабным загрязнением бассейна р. Амур (Кошелев и др., 2009; Кошелев, Седова, 2015), где проживает ~100 млн жителей. Однако исследований нарушений в строении мышц и печени у этих видов, в отличие от осетровых Волго-Каспийского бассейна ранее не проводили.
Цель работы – выявить нарушения в структуре тканей мышц и печени амурского осетра и калуги.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Исследовали БСМ и печень амурского осетра и калуги. Рыб отлавливали плавными сетями в сентябре 2007 г. в устье р. Амур на тоне у г. Николаевск-на-Амуре (рис. 1). Пойманных особей анализировали по общепринятой методике (Правдин, 1966) с измерением L и Q, у крупных особей определяли пол.
Пробы для гистологического анализа тканей рыб отбирали не позднее 10–15 мин после их отлова. Мышечную ткань брали с правой стороны спины, толщина фиксируемого фрагмента не превышала 1.0 см. Образцы мышц и печени фиксировали в жидкости Буэна (Роскин, Левинсон, 1957). От каждой рыбы отбирали не менее двух образцов мышц и печени. Фиксированный материал обезвоживали в этаноле возрастающих концентраций, проводили через хлороформ и заливали в парафин. Перед заливкой в парафин образцы предварительно выдерживали в целлоидин-касторовом масле в течение 3–5 сут. Срезы тканей толщиной 5–7 мкм окрашивали кислым фуксином с докрашиванием по Маллори, гематоксилином по Эрлиху с докрашиванием эозином (Меркулов, 1969). Препараты изучали с помощью светового микроскопа “Olympus”, оборудованного цифровой камерой, при различном увеличении.
Исследованы БСМ и печень 26 экз. амурского осетра (длина тела 119–162 см) и 8 экз. калуги (длина тела 59–208 см). Частоту встречаемости выявленных нарушений строения БСМ и печени у отдельных особей выражали в процентах от числа исследованных особей данного вида.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
БСМ рыб, в том числе осетровых, составляют основную массу их мускулатуры (до 80%), они отвечают за способность особи развивать крейсерские скорости при бросках и преодолевать силу течения реки во время нерестовых миграций (Евгеньева, 2000).
Проведенный гистологический анализ показал, что у всех исследованных особей амурского осетра и калуги присутствовали те или иные нарушения в строении БСМ. У амурского осетра наиболее частыми нарушениями были искривления волокон (изломы, перегибы) (65.4%) (рис. 2), расслоение волокон и появление липидных вставок (рис. 3), главным образом, в межмышечных пространствах (61.5%). Реже отмечали соединительнотканные включения (30.8%) (рис. 4), выпадение миофибрилл (30.8%), наличие форменных элементов крови (19.2%) и лимфоидного вещества (7.7%) (рис. 5).
Рис. 2.
Искривления и перегибы миофибрилл – “рисунок карельской березы” (отмечено стрелками) у амурского осетра (♂, L= 136 см, Q = 20 кг).

Рис. 3.
Липидные вставки в белых скелетных мышцах (отмечено стрелкой) амурского осетра (♂, L = 142 см, Q = 17.0).

Рис. 4.
Деформация миофибрилл, липидные и соединительнотканные включения (отмечены стрелкой) в белых скелетных мышцах: а – амурского осетра (♂, L = 122 см, Q = 15.4 кг); б – калуги (♀, L = 111 см, Q = 12.04 кг).

Рис. 5.
Искривления и перегибы миофибрилл, участок с включением лимфоидного вещества (отмечен стрелкой) в белых скелетных мышцах амурского осетра (♂, L = 163 см, Q = 32.6 кг).

Характер патологических изменений в БСМ калуги был таким же, как и у амурского осетра. Наиболее часто встречались искривления (75%) и выпадения миофибрилл (50%), их замещение жировой тканью (25%) (рис. 4б). В межмышечных пространствах также отмечены форменные элементы крови. Степень выраженности изменений варьировала от слабой до умеренной.
У исследованных особей амурского осетра и калуги не выявлен тотальный распад мышечной ткани, зарегистрированный у каспийских осетровых (Алтуфьев и др., 1992). В целом, отмеченные нарушения можно характеризовать, используя шкалу, разработанную Алтуфьевым с соавт. (1992), как носящие умеренный характер с варьированием у отдельных особей от “слабо выраженной” до “сильно выраженной” патологии. В среднем, степень поражения БСМ была 2.4 ± 0.12 балла. Это сопоставимо с оценкой степени поражения БСМ русского осетра Acipenser gueldenstaedtii (Brandt, 1833) в р. Волга, где этот показатель в 1988–1989 гг. варьировал от 2.3 до 2.8 балла. Степень патологии БСМ амурского осетра и калуги не зависела от пола и размеров исследуемых особей, как это отмечено у белуги Huso huso (L., 1758), севрюги Acipenser stellatus (Pallas, 1771) и русского осетра в Каспийском бассейне (Алтуфьев и др., 1992).
Мышечная ткань, в том числе осетровых рыб, регулярно подвергается периодической деструкции, поскольку в основном именно за счет мышечной ткани организм рыб восполняет белковый дефицит при любых стрессовых ситуациях (Love, 1980), в том числе нерестовых миграциях и периодах голодания, вызванных низкими температурами. Однако у особей, обитающих в нормальных экологических условиях, по мере выхода из голодания происходит восстановление структуры мышечных волокон с восстановлением количества мышечных белков, то есть процесс дегенерации сменяется процессом внутриклеточной физиологической регенерации (Евгеньева, 2010). Учитывая время сбора материала (сентябрь), можно утверждать, что восстановления структур после летнего теплого периода интенсивного питания и нагула не произошло, следовательно, причиной изменений могли быть иные факторы и, прежде всего, как отмечено у других видов (Кашулин, 1994; Ахундов и др., 2013), состояние среды обитания.
Между патологиями скелетных мышц и состоянием нервной системы осетровых существует взаимосвязь (Евгеньева, 2000, 2010) ‒ дегенеративные изменения периферической и центральной нервной систем являются сопутствующими при мышечных патологиях и наоборот. При этом потенциально снижается двигательная активность больной особи, поскольку скелетные мышцы лишаются нормальной иннервации. Для калуги и амурского осетра патология БСМ, возможность сочетания с заболеванием нервной системы имеют особое значение, так как оба вида совершают продолжительные и протяженные нерестовые миграции (с августа по май–июнь следующего года протяженностью до 1000–1500 км) (Юхименко, Беляев, 2002; Кошелев, 2010). Выявленные патологии мышечной ткани осетровых р. Амур могут снижать их плавательную способность и уменьшать миграционный путь.
Гистоморфологический анализ печени амурского осетра и калуги выявил изменения, выраженные в той или иной степени у всех исследованных особей и сходные с таковыми у каспийских осетровых. Спектр этих изменений включал компенсаторно-приспособительные реакции тканей, воспалительные процессы, нарушения микроциркуляции крови, дистрофические и некробиотические изменения. Наиболее частыми патологиями печени амурских осетровых были воспалительные инфильтраты (калуга – 74.1%, амурский осетр – 80.8%), некроз (калуга – 74.1%, амурский осетр – 76.9%), фиброз стенок сосудов (калуга – 57.1%, амурский осетр – 57.7%), наличие эозинофилов (амурский осетр – 38.5%), дискомплексация печеночных пластинок (калуга – 14%, амурский осетр – 26.9%).
Первыми признаками патологических процессов в печени обычно бывают расстройства микроциркуляции. В печени исследованных рыб чаще всего наблюдали застойные явления в капиллярах, геморрагии и, как следствие этого, кровоизлияния, представленные, как правило, небольшими по площади скоплениями форменных элементов крови (рис. 6а). Очень часто нарушения кровообращения сочетались с патологией гепатоцитов, например, с их дистрофией и некрозами (рис. 6б).
Рис. 6.
Множественные мелкие кровоизлияния (отмечены стрелками) (а), фиброз сосудов (показано стрелкой) и некроз гепатоцитов (темные клетки) (б) в печени амурского осетра (♀, L = 141 см, Q = 21.6 кг).

В обычных условиях печени свойственна высокая реактивность и большой резерв функциональной способности. Морфологическим признаком нарушения функции печени часто служат дистрофии. При жировой дистрофии в цитоплазме гепатоцитов амурского осетра и калуги видны светлые неокрашенные вакуоли различной величины. Мелкие вакуоли могут сливаться, образуя более крупные, а затем одну большую вакуоль, которая занимает всю цитоплазму и смещает ядро к периферии клетки. Часто ядра исчезают, появляются обширные участки безъядерных клеток. Жировые вакуоли нескольких клеток или, возможно, сами клетки при слиянии образуют жировые кисты (рис. 7).
Рис. 7.
Клетки паренхимы печени амурского осетра с вакуолями и жировые кисты (отмечены стрелками) (♀, L = 161 см, Q = 33.6 кг).
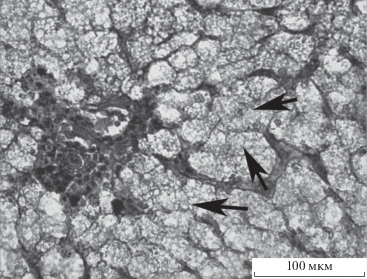
При различных поражениях, в том числе хронических, в печени возникают некрозы, наличие которых свидетельствует о тяжелом, обычно прогрессирующем течении патологического процесса. Зона некроза нередко окружена воспалительным валом, прилегающий участок ткани инфильтрован лейкоцитами. Вокруг зоны некроза гепатоциты могут быть подвержены дистрофическим или другим патологическим изменениям. У амурского осетра некротические изменения охватывали, чаще всего, небольшие локальные участки печени (рис. 6б, 8а, 8б), нередко регистрировали наличие эозинофилов. У исследованных особей амурского осетра отмечали, как правило, незначительные или близкие к умеренным нарушения, часто хронического характера. Возможной причиной поражения печени этого вида, как и в случае с каспийскими осетровыми, может быть хроническая интоксикация поллютантами (Алтуфьев и др., 1999).
Рис. 8.
Очаги некроза (отмечены стрелками) на разных участках печени амурского осетра и калуги: а, б – осетра (♀, L = = 149 см, Q = 22.35 кг); в – калуги (♀, L = 59 см, Q = 1.22 кг).

Аналогичная картина патологий печени отмечена в конце 1980-х гг. у осетровых Азовского бассейна в начале коллагеноза возникшем под влиянием загрязнения (Физиолого-биохимические…, 2004). В начале болезни в кровяном русле содержание эозинофилов было повышенным (индикатор аллергии) – у азовской севрюги до 30% при норме 6–7%, других симптомов не отмечали. Через 2–3 года содержание эозинофилов снижалось почти до нормы (5–9%) в периферической крови, но они накапливались в печени, где шло развитие коллагеноза, появляющегося при нарушении метаболизма и функции желудочно-кишечного тракта. Морфологически коллагеноз характеризуется дистрофией гепатоцитов, гистио-лимфоцитарной инфильтрацией и фиброзом портальной стромы печени. После нарушения структуры печени процесс постепенно захватывает все кроветворные органы, вызывая их дегенерацию. В последнюю очередь наступают изменения в гонадах (Физиолого-биохимические…, 2004).
В печени калуги около крупных сосудов встречались воспалительные инфильтраты, в паренхиме печени – одиночные лимфоциты и эритроциты, а также мелкие очаги некроза (рис. 8в). Степень выраженности была невысокой.
Причиной гистоморфологических изменений белых скелетных мышц и печени амурского осетра и калуги, как и в случае осетровых р. Волга и Азовского бассейна, по-видимому, был “кумулятивный политоксикоз” (Лукьяненко, 1990; Физиолого-биохимические…, 2004) вследствие значительного и продолжительного загрязнения р. Амур, обусловленного хозяйственной деятельностью человека в китайской и российской частях бассейна реки.
Для бассейна р. Амур характерна неравномерность освоения его территории. Всего на прилежащих территориях проживает ~100 млн человек, из них 95 млн на территории КНР в бассейне р. Сунгари – правого притока р. Амур (Воронов и др., 2008). Несмотря на высокий уровень промышленного освоения бассейна р. Сунгари, сеть очистных сооружений здесь почти не развита. По данным А.В. Лызовой (2007), при проведении в 2002 г. обследования государственной администрацией КНР по охране окружающей среды промышленных предприятий только 10% из них имели очистные сооружения водоотведения. С китайской стороны ежегодно сбрасывается в р. Сунгари от 6.5 до 15 млрд м3 промышленных и коммунальных сточных вод, из которых 90% без очистки (Воронов и др., 2008). Для сравнения ежегодно в воды р. Амур с российской стороны сбрасывается ~0.8 млрд м3 сточных вод, из которых 60% без очистки.
Отрицательное влияние р. Сунгари на бассейн Амура отмечают уже >100 лет (Чириков, 1905). Эта река, несущая промышленные, жилищно-коммунальные стоки и стоки с полей, формирует химический состав вод среднего и нижнего участков р. Амур (Шестеркин, 2000; Гаретова и др., 2007; Шестеркин, Шестеркина, 2020). Согласно литературным данным (Лызова, 2007; Воронов, Махинов, 2009), доля р. Сунгари в загрязнении вод р. Амур варьирует от 50 до 90% по отдельным показателям при доле стока 25–27%.
Существенно загрязнен участок Нижнего Амура от г. Хабаровска до устья реки. Так, в 2007 и 2008 гг. в водах реки и некоторых ее основных притоков отмечен 191 случай высоких значений БПК5, концентраций Mn, Fe, Cu, Pb, аммонийного и нитритного азота, неорганических фосфатов (Государственный…, 2009). Максимальное превышение ПДК достигало: БПК5 – в 16 раз, Mn – 80 раз, Fe – 18 раз, Cu – 55 раз, Pb – 12 раз и аммонийного (69 раз) и нитритного азота (10 раз), неорганических фосфатов (25 раз). Кроме того, отмечено превышение еще по нескольким показателям в том числе ДДД (1,1-ди(4'-хлорфенил)-2,2-дихлорэтан ‒ нерастворимый в воде инсектицид, являющийся продуктом восстановительного метаболизма ДДТ) – 7 ПДК (р-н г. Хабаровска). В целом качество воды на нижнем участке р. Амур по удельному комбинаторному индексу загрязнeнности воды (УКИЗВ) в 2007–2008 гг. варьировало в пределах 4–5 классов от “грязная” до “экстремально грязная” (Государственный…, 2009).
Особую опасность представляет накопление всевозможных загрязняющих веществ в донном грунте, где обитают основные кормовые объекты амурского осетра (Кошелев, 2010). Это приводит к повышенному содержанию ряда поллютантов (бензола, этилбензола и ксилола) в тканях и органах калуги и амурского осетра (Levshina et al., 2009).
Приведенные сведения о загрязнении Амурского бассейна позволяют считать среду обитания населяющих ее осетровых рыб неудовлетворительной. Описанные нами нарушения в строении мышц и печени амурского осетра и калуги не относятся к видоспецифическим. По-видимому, их наличие, как и у волжских и азовских осетровых, – следствие загрязнения вод р. Амур различными поллютантами.
Выводы. Гистологическое исследование белой скелетной мускулатуры амурского осетра и калуги из устья р. Амур выявило различного рода нарушения у всех анализированных особей. Наиболее частые из описанных нарушений – искривления волокон (изломы, перегибы), расслоение волокон и появление липидных вставок, соединительнотканные включения, выпадение миофибрилл и наличие форменных элементов крови. Выявленные нарушения носят умеренный характер и могут отразиться на плавательной способности особей. Нарушения в строении печени исследованных видов в той или иной степени встречались у всех исследованных рыб. Их спектр сходен с таковым у амурских и каспийских осетровых – воспалительные процессы, нарушения микроциркуляции крови, дистрофические и некробиотические изменения. Выявленные нарушения в строении мышц и печени на тканевом уровне, вероятно, связаны с постоянно ухудшающимся качеством вод реки Амур и Амурского лимана из-за их антропогенного загрязнения. Дальнейшее увеличение загрязненности р. Амур может привести к усилению выраженности выявленных патологий. Межвидовое сходство в спектрах этих нарушений у осетровых из различных бассейнов (Каспийского, Азовского и Амурского) может быть объяснено тем, что организмы отвечают на стрессовое воздействие с помощью ограниченного числа наиболее эволюционно успешных компенсаторных механизмов (Seleye, 1952).
Список литературы
Акимова Н.В. Рубан Г.И. 1996. Систематизация нарушений воспроизводства осетровых (Acipenseridae) при антропогенном воздействии // Вопр. ихтиологии. Т. 36. № 1. С. 65.
Алтуфьев Ю.В., Романов А.А., Шевелева Н.Н. 1992. Гистопатология поперечнополосатой мышечной ткани и печени каспийских осетровых // Вопр. ихтиологии. Т. 32. Вып. 2. С. 157.
Алтуфьев Ю.В., Романов А.А., Шевелева Н.Н., Дубовская А.А. 1999. Антропогенное воздействие и адаптационные возможности каспийских осетровых // Вестник МАНЭБ (Международная академия наук экологии и безопасности). № 9 (21). С. 12.
Ахундов А.Г., Касимов Р.Ю., Рустамов Э.К. 2013. Мышечная ткань рыб как биомаркер экологического состояния рек // Вест. Моск. гос. областного университета. Сер. Естественные науки. № 2. С. 17.
Воронов Б.А., Кондратьева Л.М., Ким В.И. 2008.Экологическая обстановка в бассейне Амура // Факторы формирования качества воды на Нижнем Амуре. Владивосток: Дальнаука. С. 13.
Воронов Б.А., Махинов А.Н. 2009. Современное состояние водных ресурсов Дальнего Востока и их антропогенное преобразование // Матер. Всерос. науч. конф. “100-летие Камчатской экспедиции Русского географического общества 1908–1910 гг.”. Петропавловск-Камчатский: Ин-ут вулканологии и сейсмологии Дальневост. отд. РАН. С. 40.
Гаретова Л.А., Левшина С.И., Юрьев Д.Н. 2007. Влияние р. Сунгари на загрязнение р. Амур органическими веществами: гидрохимическая и микробиологическая оценки // Вест. Дальневост. отд. РАН. Т. 4. С. 27.
Государственный доклад о состоянии и об охране окружающей среды Хабаровского края в 2008 году. 2009. Хабаровск: Принсити.
Государственный доклад о состоянии и об охране окружающей среды Хабаровского края в 2009 году. 2010. Хабаровск: Амурпринт.
Евгеньева Т.П. 2000. Патология мышечной ткани осетровых рыб. Москва: Изд. Ин-та проблем экологии и эволюции им А.Н. Северцова РАН.
Евгеньева Т.П. 2010. Анализ структурных преобразований мышечной ткани рыб, обитающих в нижнем течении Волги // Вопр. морфологии. XXI века. № 2. С. 129.
Кашулин Н.А. 1994. Реакция сиговых рыб на загрязнение субарктических водоемов тяжелыми металлами: Автореферат дис. … кандидата биологических наук: 03.00.10 // Москва: Ин-т эвол. морфологии и экологии животных им. А. Н. Северцова.
Кошелев В.Н. 2010. Амурский осетр Acipenser schrenckii Brandt, 1869 (распределение, биология, искусственное воспроизводство): Автореф. дис. … канд. биол. наук. Москва: Всерос. НИИ рыбн. хоз-ва и океанограф.
Кошелев В.Н., Седова М.А. 2015. Гистоморфологические изменения жаберного эпителия калуги Acipenser dauricus и амурского осетра Acipenser schrenckii (Acipenseridae) из устья Амура // Вопр. ихтиологии. Т. 55. № 2. С. 236.
Кошелев В.Н., Евтешина Т.В., Литовченко Ж.С., Хлопова А.В. 2009. Гистоморфологические нарушения репродуктивной системы амурских осетровых // Амурский зоол. журн. Т. 1. № 3. С. 258.
Лукьяненко В.И. 1990. Влияние многофакторного антропогенного пресса на условия обитания, воспроизводство, численность и уловы осетровых рыб // Физиолого-биохимический статус Волго-Каспийских осетровых норме и при расслоении мышечной ткани (кумулятивный политоксикоз). Рыбинск: Ин-т биологии внутр. вод АН СССР. С. 25.
Лызова А.В. 2007. Влияние трансграничного загрязнения реки Амур на водные биологические ресурсы. Известия ТИНРО. Т. 148. С. 262.
Правдин И.Ф. 1966. Руководство по изучению рыб (преимущественно пресноводных). Москва: Пищ. пром-сть.
Меркулов Г.А. 1969. Курс патогистологической техники. Ленинград: Медицина.
Роскин Г.И., Левинсон Л.Б. 1957. Микроскопическая техника. Москва: Сов. наука.
Физиолого-биохимические и генетические исследования ихтиофауны Азово-черноморского бассейна. 2005. Ростов-на-Дону: Эверест.
Чириков А.В. Реки Амурского бассейна (Шилка, Аргунь и Сунгари) в санитарном отношении. 1905. Санкт-Петербург: Управление внутр. водных путей и шоссейных дорог.
Шестеркин В.П. 2000. О влиянии р. Сунгари на качество вод Амура // Сб. научн.-техн. Совета при крайкомэкологии “Переход Хабаровского края на модель устойчивого развития: Экология. Природопользование”. Хабаровск: Ин-ут водных и экол. проблем Дальневост. отд. РАН. С. 19.
Шестеркин В.П., Шестеркина Н.М. 2020. Многолетняя динамика содержания и стока сульфатов в воде реки Амур в зимнею межень // Водн. хоз-во России. № 3. С. 82. https://doi.org/10.35567/1999-4508-2020-3-6
Юхименко С.С., Беляев В.А. 2002. Паразитофауна калуги р. Амур и использование паразитологических данных для изучения популяционной структуры вида// Вопр. рыболовства. Т. 3. № 1(9). С. 73.
Billard R., Lecointre G. 2001. Biology and conservation of sturgeon and paddlefish // Rev. of Fish Biol. and Fisheries. V. 10. P. 355.
Birstein V.J., Bemis W.E., Waldman J.R. 1997. The threatened status of Acipenseriform species: a summary // Env. Biol. Fish. V. 48. P. 427.
Levshina S.I., Efimov N.N., Bazarkin V.N. 2009. Assessment of the Amur River Ecosystem Pollution with Benzene and Its Derivatives Caused by an Accident at the Chemical Plant in Jilin City, China // Bull. Environ. Contam. Toxicol. № 83. Р. 776.
Love R. 1980. The chemical biology of fishes. Los Angeles: Acad. Press.
Ruban G.I., Akimova, N.V., Goriounova et al. 2015. Atlas of abnormalities in gametogenesis and early life stages of sturgeons // World Sturgeon Conservation Society: Special Publication Series. Special Publication n 7. Norderstedt: Books on Demand.
Seleye H. 1952. The story of the adaptation syndrome. Montreal: Acta.
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод



