Биология внутренних вод, 2021, № 6, стр. 548-562
Сравнительная морфология рода Hydrocharis L. (Hydrocharitaceae)
А. Н. Ефремов a, *, В. С. Гришина b, Ц. Тома c, А. Местерхази d, Э. Н. Чатчуанг e
a Научный центр фундаментальных и прикладных проблем биоэкологии и биотехнологии
Ульяновского государственного педагогического университета
Ульяновск, Россия
b Омский государственный педагогический университет
Омск, Россия
c Университет Казимира Великого
Быдгощ, Польша
d Дирекция национального парка Хортобадь
Дебрецен, Венгрия
e Национальный гербарий Камеруна Института сельскохозяйственных исследований
BP 1601 Яунде, Камерун
* E-mail: stratiotes@yandex.ru
Поступила в редакцию 09.03.2021
После доработки 19.04.2021
Принята к публикации 27.04.2021
Аннотация
Проведено сравнительно-морфологическое исследование видов рода Hydrocharis L. На основе результатов кластерного анализа по 77 морфологическим признакам продемонстрирована обособленность H. chevalieri (De Wild.) Dandy от других представителей рода Hydrocharis L., морфологическая самостоятельность рода Limnobium Rich. и обоснованность объединения Limnobium и Hydrocharis в подсемейство Hydrocharitoideae Eaton. Важными диагностическими признаками для видов рода Hydrocharis являются: форма апекса, форма и размер листовой пластинки, пропорция крупноклеточной аэренхимы, длина черешка, размеры плодов и семян, толщина перикарпия. Выделены две группы розеточных вегетативно-подвижных биоморф: низкие одно(мало)летние свободноплавающие турионовые гидатофиты (H. morsus-ranae L., H. dubia (Blume) Backer) и средневысокие (одно)малолетние укореняющиеся гидрогелофиты (H. chevalieri).
ВВЕДЕНИЕ
Род Hydrocharis L. (Hydrocharitaceae Juss.) включает три географически изолированных вида: евразийско-североамериканский умеренный Hydrocharis morsus-ranae L., юговосточноазиатско-австралийский преимущественно субтропическо-тропический H. dubia (Blume) Backer и центральноафриканский экваториальный H. chevalieri (De Wild.) Dandy (Cook, Lüönd, 1982; Bean, 2011; Symoens, 2015; Wang et al., 2016; Sosef, 2017; Efremov et al., 2020). Морфологически и филогенетически Hydrocharis наиболее близок с родом Limnobium Rich., объединяющим два американских аллопатрических вида: Limnobium laevigatum (Humb. et Bonpl. ex Willd.) Heine. и L. spongia (Bosc) Steud (Cook, Lüönd, 1982; Cook, Urmi-König, 1983; Les et al., 2006; Chen et al., 2012). Клада Hydrocharis + Limnobium (соответствует подсемейству Hydrocharitoideae Eaton (Les et al., 2006)), имеющая плавающие биоморфы, дивергировала от основной части Hydrocharitaceae <55 млн лет назад. Род Limnobium обособился от древних Hydrocharis ~16 млн лет назад, что моложе известных ископаемых находок Hydrocharis (Les et al., 2006; Chen et al., 2012). Чен и др. (Chen et al., 2012) считают, что большое морфологическое сходство между двумя родами связано с короткой эволюционной историей Limnobium. Известно ≥10 вымерших видов рода Hydrocharis, распространенных исключительно на территории Евразии. Палеонтологические остатки H. morsus-ranae известны из эоцен-плиоцена; семена, сходные с H. dubia, встречаются в отложениях позднего сенона-палеоцена (Кац и др., 1965; Красилов, 1976; Mai, 1988; Carrión, Dupré, 1996; Никитин, 2007; Yao et al., 2011).
Подробные морфологические описания Hydrocharis и Limnobium были выполнены в рамках ревизий (Cook, Lüönd, 1982; Cook, Urmi-König, 1983; Lowden, 1992). Основное внимание исследователей уделено типовому виду H. morsus-ranае. Изучены общие сведения по анатомии и морфологии этого вида (Arber, 1920, 1922; Ancibor, 1979; Tomlinson, 1982; Кривохарченко и др., 1995) и некоторые частные вопросы (Cutter, 1964; Kaul, 1968, 1970; Catling, Dore, 1982; Seago et al., 1999; Toma, 2003, 2008; Петухова, 2008). Исследована морфология цветка и репродуктивная биология (Daumann, 1931, 1970; Kaul, 1968; Serbanescu-Jitariu, 1972; Scribailo, Posluszny, 1984, 1985a, 1985b; Igersheim et al., 2001; Изместьева, Одинцова, 2010; Toma, 2013; Филоненко и др., 2014). Однако сведения по морфологии и биологии H. dubia (Shinobu, 1954; Den Hartog, 1957; Sun et al., 1997; Sun Chen J.-K. 1998; Haynes, 2001; Ru et al., 2015; Wang et al., 2016; Цыренова и др., 2018) и H. chevalieri (Symoens et al., 1984; Symoens, 2015; Sosef, 2017) остаются весьма ограниченными.
Hydrocharis dubia и H. morsus-ranae широко используются как декоративные растения, в связи с этим очень высок их потенциал инвазии. В некоторых регионах эти виды, наряду с Limnobium laevigatum и L. spongia, уже натурализовались, нанося существенный ущерб местным экосистемам (Catling et al., 2003; Bean, 2011; Zhu et al., 2018). Статус охраны видов рода Hydrocharis оценивается как не вызывающий опасения, хотя в регионах с активной хозяйственной деятельностью площадь местообитаний существенно сократилась, некоторые популяции сократились или исчезли (Efremov et al., 2020).
Таблица 1.
Основные морфологические показатели вегетативных органов видов рода Hydrocharis
| Показатель | H. chevalieria (0.8 ± 0.1) |
H. dubiab (0.7 ± 0.1) |
H. morsus-ranaec (0.7 ± 0.1) |
|---|---|---|---|
| Число крупных центральных проводящих элементов и латеральных проводящих пучков в столоне | 6–8 + 20–28 | 2–4 + 14–20 | 4 + 10–14 |
| Число крупных и мелких проводящих пучков в черешке | 7–9 + 20–28 | 3–5 +12–15 | 3 + 9–11 |
| Пропорция воздухоносных полостей и межклетников, % | |||
| в столоне | 25 ± 5c | 33 ± 9c | 49 ± 7ab |
| в черешке | 52 ± 11c | 49 ± 10c | 67 ± 7ab |
| Длина черешка, см | 19 ± 7bc | 8 ± 3a | 7 ± 3a |
| Ширина листовой пластинки, см | 7 ± 2bc | 4 ± 1ac | 3 ± 1ab |
| Длина листовой пластинки, см | 7 ± 2bc | 3 ± 1ac | 2.1 ± 0.6ab |
| Отношение длины листовой пластинке к ширине | 1.0 ± 0.1bc | 0.8 ± 0.1ac | 0.7 ± 0.1ab |
| Площадь листовой пластики, см2 | 48 ± 36bc | 14 ± 10a | 8 ± 5a |
| Доля площади крупноклеточной аэренхимы, % | 0bc | 21 ± 10ac | 16 ± 12ab |
| Угол апекса листовой пластинки | 104 ± 25bc | 153 ± 13a | 155 ± 14a |
| Коэффициент формы | 1.1 ± 0.0bc | 1.2 ± 0.1ac | 1.3 ± 0.1ab |
Примечание. Измерения выполнены на гербарном материале. В скобках указаны коэффициенты усыхания листвой пластинки, определенные экспериментально. Здесь и в табл. 2 a, b, c – величины, статистически достоверно различающиеся при попарном сравнении с использованием критерия Тьюки (p > 0.95).
Цель работы – сравнительно-морфологическое исследование рода Hydrocharis на основе анализа релевантной информации о морфологии видов рода Hydrocharis и близкородственного рода Limnobium, включая установление основных диагностических признаков листа, системы побегов, плода и семени, оценивая при этом уровень адаптации биоморф к условиям среды обитания. Полученные нами базы данных, содержащие сведения по сравнительной морфологии Hydrocharis и Limnobium (Приложение, табл. 2S) и основные результаты морфометрии Hydrocharis (Приложение, табл. 3S), представляют полезный ресурс для дальнейших исследований видов сем. Hydrocharitaceae.
Таблица 2.
Основные морфологические показатели эпидермы видов рода Hydrocharis
| Показатель | Тип эпидермы | Тип клетки | H. chevalieria | H. dubiab | H. morsus-ranaec |
|---|---|---|---|---|---|
| Периметр клетки, мкм | Н | О | 95 ± 34c | 100 ± 36c | 186 ± 57ab |
| Н | З | 62 ± 5b | 82 ± 7a | − | |
| Диаметр клетки, мкм | |||||
| наибольший | В | З | 24 ± 2c | 27 ± 3 | 27 ± 2a |
| Н | О | 24 ± 7bc | 28 ± 8ac | 44 ± 10ab | |
| Н | З | 27 ± 2b | 36 ± 3a | − | |
| наименьший | Н | О | 15 ± 5c | 15 ± 6c | 27 ± 7ab |
| Н | З | 3.5 ± 0.5b | 4.3 ± 0.7a | − | |
| Коэффициент формы | В | З | 0.50 ± 0.06bc | 0.41 ± 0.05a | 0.38 ± 0.05a |
| Н | З | 0.46 ± 0.04b | 0.36 ± 0.05a | − | |
| Форма клеток | В | О | КС 1-го порядка | КС 1-го и 2-го порядка | КС 2-го порядка |
| Н | О | КС 1–2-го порядка | КС 1-го порядка | ГС | |
| Степень округлости | В | З | 0.28 ± 0.04bc | 0.23 ± 0.04ac | 0.20 ± 0.04ab |
| Н | З | 0.29 ± 0.04b | 0.24 ± 0.04a | − | |
| Плотность устьиц, экз./мм2 | В | − | 80 ± 20b | 50 ± 10a | 70 ± 10 |
| Н | − | 72 ± 8bc | 7 ± 3ac | 1 ± 1ab |
Таблица 3.
Основные морфологические характеристики плодов и семян видов рода Hydrocharis
| Показатель | H. chevalieri | H. dubia | H. morsus-ranae |
|---|---|---|---|
| Размер плода, мм | 13–15 ×15 × 3(10) | 10–15 × 6–10 × 10 | 8–11 × 4–9 × 7 |
| Толщина перикарпа, мкм | 100 | 1200 | 500 |
| Размер семени, мм | 1.5 × 0.5 | 1.8 × 0.9 | 0.5 × 0.5 |
| Толщина семенной кожуры, мкм | 1 | 25 | 100 |
| Размер выроста семенной кожуры, мкм | − | 210 × 13 | 130 × 60 |
| Тип выроста семенной кожуры семени | − | Трихомы | Слизистые клетки |
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
География исследования. Основной объем морфологических исследований (общая морфология побега, морфология листа) проведен на образцах из различных частей ареала, охватывающих максимальный диапазон изменчивости (343 гербарных образца) (Приложение, табл. 3S). Для общей характеристики видов использованы материалы авторской базы данных, включающей сведения об изображениях 1947 гербарных образцов (Приложение, табл. 1S), для сравнительно-карпологических исследований – материал из коллекции ископаемых растений Ботанического института им. В.Л. Комарова РАН.
Морфолого-анатомические исследования вегетативных органов, плодов и семян проведены для образцов, полученных из следующих географических районов: H. morsus-ranae − Восточная Европа (Россия: Саратовская, Московская области, Краснодарский, Ставропольский края, Республика Башкортостан; Польша: Малопольское воеводство), Западная Сибирь (Россия: Курганская, Тюменская, Омская, Кемеровская, Новосибирская области, Ханты-Мансийский автономный округ; Казахстан: Северо-Казахстанская, Восточно-Казахстанская области); H. dubia − Дальний Восток (Россия: Хабаровский край); H. chevalieri – Центральная Африка (Камерун: Восточная провинция). Исследование эпидермы листа проведено на следующем материале: H. chevalieri (Камерун: Восточная провинция), H. dubia (Россия: Хабаровский край) и H. morsus-ranae (Россия: Омская, Московская области, Республика Башкортостан).
Морфологические исследования. Методологической базой для исследования послужил сравнительно-морфологический подход (Серебрякова, 1972; Свириденко, 2000). Для описания эпидермы использована традиционная схема (Анели, 1975). При описании поверхности плода основное внимание уделено форме клеток, первичной и вторичной скульптуре поверхности (Boesewinkel, Bouman, 1984). Анализ проведен на живом и фиксированном (гербарном, фиксированном в 70%-ном этаноле) материале по традиционной схеме (O’Brien, McCully, 1981). Отдельные органы исследованы светлопольным методом с помощью микроскопов проходящего света “Микмед-2-1600”, “Carl Zeiss Jena Jenamed 2” и стереомикроскопа “Микромед МС 2 Zoom. 2 CR”, методом сканирующей электронной микроскопии с помощью электронного микроскопа “Hitachi 3500N”. Фотосъемка проведена цифровыми камерами “Canon 6D” и “Canon PowerShot A640” с оптико-механическим адаптером. Срезы выполнены бритвой и с помощью ручного микротома “Euromex”. В качестве фонового красителя использован метиленовый синий (O’Brien, McCully, 1981), для детализации гистологических комплексов − метод комбинированной окраски (Михальцов, 2012) (рис. 1−4).
Рис. 1.
Морфологические особенности листа Hydrocharis chevalieri (а–в), H. morsus-ranae (г–е), H. dubia (ж–к): а – Камерун, Южный регион, 27 (номер соответствует образцу в Приложении, табл. 1S); б − Камерун, Отеле, 44; в – Камерун, Акок Бикеле, 34; г, е – Германия, Швайнфурт, 1817; д – Европа, 1947; ж – Новая Гвинея, 210; з – Китай, Юньнань, 221; и, к – Индия, Кашмир, 201.

Рис. 2.
Морфологические особенности черешка и столона Hydrocharis: chevalieri (а–в, е–з), H. morsus-ranae (г), H. dubia (д): а – латеральная зона черешка; б – медуллярная зона черешка; в, г, д – общий вид черешка; е – общий вид столона; ж – латеральная зона столона; з – медуллярная зона.
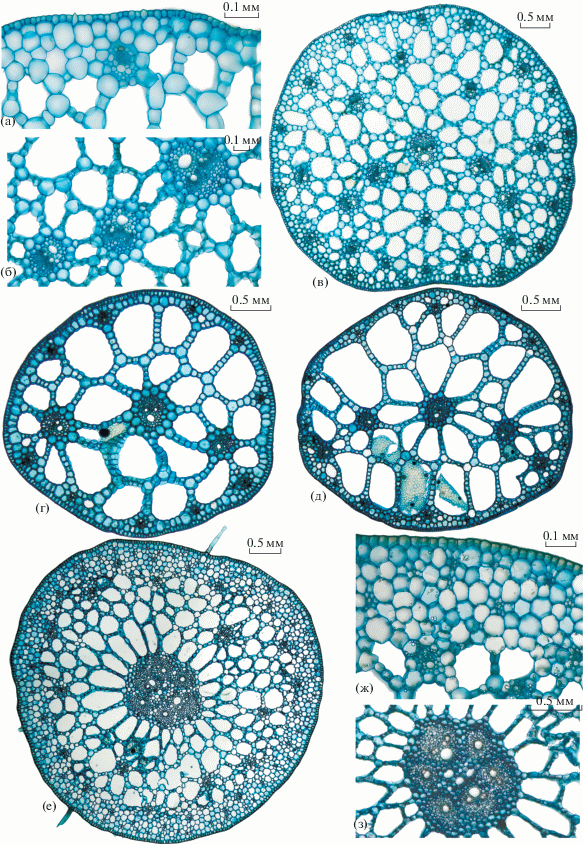
Рис. 3.
Эпидермис листа Hydrocharis chevalieri (а, б), H. dubia (в, г) и H. morsus-ranae (д): а, в – верхний эпидермис; б, г, д – нижний эпидермис.

Рис. 4.
Плод и семя Hydrocharis dubia (а–г), H. morsus-ranae (д, е) и H. chevalieri (ж–л): а – общий вид плода; б – поперечный срез плода; в, л – поперечный срез семени; г–е, и – общий вид семени (г – Хабаровский край, современный образец; д – Россия, Омская обл., Чернолучье-3, поздний плиоцен; е – Украина, Николаевская обл., Ак-Мечеть/Страшный, К433, верхний сармат; и – Камерун, современный образец); ж – скульптура экзокарпа; з – фрагмент поперечного среза плода; к – поперечный срез перикарпа.

Рис. 5.
Общая морфология Hydrocharis dubia (а–в) и H. chevalieri (г–з, фотографии J.-P. Ghogue и E. Ngansop Tchatchouang): а – рамета с тычиночными соцветиями; б, г – основание ортотропного побега; в – абаксиальная поверхность листовой пластинки; д – соцветие тычиночных цветков, бутонизация; е – редуцированное одноцветковое пестичное соцветие; ж – рамета с пестичным и тычиночными соцветиями; з – общий вид.

Измерения эпидермы проводили при помощи программы “ImageJ” с фотоснимка после его предварительной подготовки и калибровки, морфометрический анализ остальных показателей проведен с использованием “IC Measure”. Для измерений на гербарном материале (размеры листа) определен коэффициент изменения линейных размеров при высушивании (табл. 1, рис. 3).
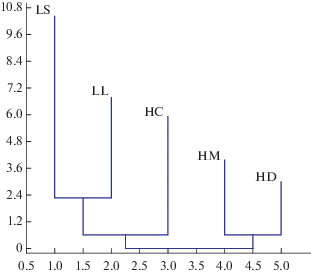
Анализ данных. Для оценки морфологического сходства родов Limnоbium и Hydrocharis использованы 77 ранжированных признаков (Приложение, табл. 1S), оценка проведена методом присоединения соседей c помощью программы Past ver. 2.17c (рис. 6). Статистическая обработка результатов включала проверку на нормальность распределения, описательную статистику, однофакторный дисперсионный анализ с использованием критерия Тьюки. В качестве показателей описательной статистики приведены средние значения и стандартные отклонения.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Побеговая система и лист. В системе побегов видов рода Hydrocharis выделяются вегетативные (вегетативно-генеративные) ортотропные укороченные (розеточные) побеги, состоящие из 3–5(10) метамеров, с адвентивными корнями, несущие побеги (n + 2)-порядка и репродуктивные структуры, (1) и вегетативные плагиотропные удлиненные (столоны) с терминальными почками, развивающиеся из узлов ортотропных побегов (2).
Ортотропные побеги умеренно разветвленные у основания – n + 1…n + (5–6). Hydrocharis morsus-ranae и H. dubia имеют относительно короткие черешки, несущие плавающие на поверхности воды или торчащие (чаще у H. dubia) листовые пластинки. Листовые пластинки H. chevalieri в 2–4 раза больше, чем у остальных видов рода; у H. dubia в среднем в 2 раза больше, чем у H. morsus-ranae. Характерные признаки – угол апекса листовой пластинки, доля крупноклеточной аэренхимы, длина черешка, форма и размер листовой пластинки (табл. 1, рис. 1а–1к, рис. 5в, 5з).
Васкулатура столона представлена группой центральных крупных проводящих элементов, разделенных паренхимой, крупными латеральными и мелкими инвертированными латеральными проводящими пучками (рис. 2е–2з). В черешке имеются группа дугообразно расположенных крупных проводящих пучков и многочисленные равномерно распределенные мелкие (рис. 2а–2д). В пропорции воздухоносных полостей проявляется некоторая видоспецифичность (табл. 1). В паренхиме побега присутствуют идиобласты, вероятно, содержащие танин (Ancibor, 1979; рис. 2г, 5д).
У всех видов тип устьичного аппарата парацитный дисектный, замыкающие клетки чечевицевидные равноутолщенные, тип расстановки устьиц разнонаправленный. У H. dubia и H. morsus-ranae в небольшом количестве присутствуют гидропоты. У H. chevalieri основные клетки верхнего эпидермиса обладают слабоизвилистой клеточной стенкой, нижнего эпидермиса – более извилистой (рис. 2а, 2б). Напротив, у H. dubia и H. morsus-ranae основные клетки верхнего эпидермиса – более извилистые, а нижний эпидермис H. morsus-ranae имеет наиболее гладкие клеточные стенки (рис. 3в–3д). Значения коэффициента формы у всех видов выше у верхнего эпидермиса (клетки более округлые) по сравнению с клетками нижнего эпидермиса в среднем на 30% (табл. 2).
Плод и семя. Морфологические описания плодов типового H. morsus-ranae и H. dubia проведены ранее (Toma, 2008; Филоненко и др., 2014). Результаты сравнительного анализа приведены в табл. 3. Плод H. dubia сходен с H. morsus-ranae, многосемянный, с гладкой поверхностью, шестикамерный, с нерегулярными рубцами от разрушившихся элементов околоцветника на верхушке (табл. 3, рис. 4а, 4б). Семя с носиком длиной 450 мкм. На внешней поверхности семян имеются трихомы с набухающими в воде клеточными оболочками (табл. 3, рис. 4в, 4г).
Плод H. chevalieri с сохраняющимися остатками чашелистиков, семена плотно упакованы по типу пчелиных сот, легко выпадают из гнезд. Перикарп многоклеточный, однородный. Поверхность экзокарпа со слабо выраженным ячеистым рисунком. Периклинальные стенки клеток складчатые, высокие, толстые антиклинальные стенки – до 10 мкм. Клетки экзокарпа квадратной или прямоугольной формы, покрытые воскообразным веществом. Сухие семена H. chevalieri с гладкой поверхностью и четким ячеистым пяти- и шестигранным рисунком. Семенная кожура тонкая и однослойная (рис. 4ж–4л, табл. 3). Во влажном состоянии экзотеста H. chevalieri имеет одноклеточные выросты, продуцирующие слизь (Sosef, 2017), которые разрушаются при высушивании.
У H. morsus-ranae вся периклинальная клеточная стенка экзотесты удлиняется и образует слизистую клетку, на высушенных семенах остаются характерные ямки (рис. 5д). Вероятно, эти образования у H. chevalieri имеют иную природу и требуют специального изучения.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Вегетативные органы. Корневая система исследованных видов гоморизная из кладогенных, мономорфных корней, ветвящихся (H. dubia и H. chevalieri) или нет (H. morsus-ranae), развивающихся на базальных метамерах ортотропных (у H. chevalieri и на плагиотропных) побегов, под основанием ассимилирующего листа (рис. 5б, 5г). У H. morsus-ranae и H. dubia корни 15–30(50) см длинной, с крупными корневыми волосками, молодые − фотосинтезирующие. Они погружены в воду, на мелководьях и у эфемерных наземных форм − в обводненный грунт. У H. chevalieri нефотосинтезирующие кладогенные корни до 30–60 см длиной, погружены в обводненный грунт (Cook, Lüönd, 1982; Sosef, 2017; данные авторов). Корневая меристема закрытого типа, трихобласты развиваются из проксимальных сестринских клеток, аэренхима лизигенная (для H. morsus-ranae отмечено Seago et al., 2005). У H. dubia волоски гидрокотиля формируются раньше первичного корня, рост которого останавливается при достижении 5 см (Ru et al., 2015).
В течение всего вегетационного периода в пазухе каждого второго листа закладываются пазушные почки. Пазушная почка ветвится и после начала роста кроющего листа, одна из почек развивается в столон, вторая не развивается или в ней развиваются зачатки цветков (соцветия) (Cook, Lüönd, 1982; Кривохарченко и др., 1995; данные авторов) (рис. 5б). Побеговая система формируется в результате регулярного и закономерного симподиального нарастания за счет вегетативно-генеративных побегов замещения (Петухова, 2008; Cutter, 1964).
Столоны H. morsus-ranae с чешуевидными листьями, удлиненным междоузлием первого метамера и укороченным второго, длиной до 0.3–0.5 м и толщиной 0.1–0.3 см (Кривохарченко и др., 1995; Петухова, 2008). Терминальные зачаточные побеги (почки) двух типов, подобно Stratiotes aloides L. (Ефремов, Свириденко, 2008; Петухова, 2008). Первый тип – это зимующие побеги (турионы), формирующиеся в конце вегетационного сезона или в неблагоприятных условиях, второй – формирующиеся в течение вегетационного сезона (побеги возобновления). Первые обеспечивают возобновление на следующий вегетационный сезон, вторые − горизонтальное разрастание. В некоторых случаях у H. morsus-ranae формируются более крупные терминальные почки (турионы) на верхушках ортотропных побегов (Петухова, 2008). Столоны H. chevalieri до 1–2 м длиной и 1.5 см толщиной, несут адвентивные, крупные, выполняющие фиксирующую функцию корни и рассеянные по поверхности крупные трихомы.
Формирующиеся в период вегетации у H. morsus-ranae и H. dubia терминальные зачаточные побеги 10–18 × 3–8 мм, без периода покоя и отделительного слоя. В обследованных популяциях H. morsus-ranae и H. dubia число турионов на одном розеточном побеге составило 3–6. Турионы эллипсоидные, изредка изогнутые, заостренные, размером 6–7(9) × 2–3 мм (у H. dubia – 9–20 × 2–4 мм), с периодом покоя и отделительным слоем. Терминальные почки содержат 5–12 листовых зачатков и коллатеральные пазушные почки, иногда зачатки соцветий, покрыты плотными чешуевидными прилистниками (чешуями) и накапливают в осевой паренхиме значительное количество крахмала (Cook, Lüönd, 1982; Петухова, 2008; собственные данные). У H. dubia образование турионов происходит, вероятно, только на северной границе ареала. У H. chevalieri терминальные почки узкоэллиптические, 20–25 × 2–5 мм, погруженные в обводненный грунт или лежащие на поверхности (Symoens, 2015; Sosef, 2017).
Соцветия и энтомофильные цветки Hydrocharis относительно менее специализированы по сравнению с другими родами семейства (Kaul, 1970). Соцветия существенно короче листьев, погружены в воду, над поверхностью располагаются дистальные участки цветоножек и цветков. Ортотропный побег несет от одного до трех–пяти соцветий. У мужских растений соцветия 2–6(9)-цветковые (у H. chevalieri до 9, а у видов Limnobium до 25), цимозные. Цветоносы 1–6(20) см длиной (у H. chevalieri до 10–15), цветоножки − до 2–8(10) см (рис. 5а, 5ж). Покрывало образовано парой пленчатых неравноразмерных, сросшихся в основании брактей, 1–2.5 см длиной (до 4.5 см у H. chevalieri). Как правило, брактеоли отсутствуют у H. morsus-ranae и H. dubia, имеются по одной у H. chevalieri. Женские соцветия одно-, двухцветковые (у Limnobium одно-шестицветковые). Цветоносы до 0.2–1.0 см, цветоножки до 0.5–5 см длиной (у H. chevalieri до 12–15 см), брактея одна, более мелкая, чем в мужских соцветиях, или отсутствует (рис. 5е) (Kaul, 1970; Cook, Lüönd, 1982; Haynes, 2001; Symoens et al. 2015; Sosef, 2017; данные авторов).
Листорасположение спиральное. Листья в густых или немного расставленных розетках, числом 2–6. Листья простые, дорсовентральные, дифференцированные на черешок и пластинку, амфистоматические или гипостоматические (H. morsus-ranae) (табл. 2), край листовой пластинки цельный. Черешки H. morsus-ranae и H. dubia тонкие, плавающие, реже прямостоячие и несколько вздутые; 20–30 × 0.3–0.5 см. H. chevalieri имеет толстые, жесткие, прямостоячие черешки, до 50 × 0.5–1.0 см (Cook, Lüönd, 1982). Продолжительность жизни листа H. dubia достигает 13.2–18.7 сут. (Tsuchiya, 1989). В пазухах листьев развиты выделяющие слизь структуры (squamulae intravaginales).
Листовая пластинка от сердцевидной до почковидной или почти округлой формы, у H. morsus-ranae 1.2–6 × 3–6.3 см, у H. dubia более крупная – (2.5)3.3–7 × 3.1–8 см (Cook, Lüönd, 1982; Wang et al., 2016; данные авторов). Основание листа от закругленного до сердцевидного, у H. dubia часто усеченное. Апекс от округлого до широко заостренного, угол 140°–160°. У H. morsus-ranae крупноклеточная аэренхима в области средней жилки на абаксиальной поверхности развита относительно слабо (≤20(40)% площади) или отсутствует. У H. dubia она нередко формирует “подушечку” и занимает 10–30(60)% (рис. 1з, 1к, 5в); у видов Limnodim до 90%, “подушечка” сильно вздутая. Первичные жилки числом 4(6–9), заканчиваются у апекса. Наружные парные жилки широко изогнутые, берут начало около основания пластинки, и каждая расходится от средней под острым (H. dubia) или широко заостренным (H. morsus-ranae) углом; поперечные жилки, восходящие под углом 70°–90°. Часть наружных пучков инвертирована. H. morsus-ranae имеет два свободных латеральных полупрозрачных, яйцевидных прилистника, H. dubia, как правило, один медианный, до 0.5–2.5(3) см длиной (Cook, Lüönd 1982; Haynes, 2001; Wang et al., 2016; собственные данные). У H. chevalieri листовая пластинка от яйцевидной до слабозакругленной или широкопочковидной, 4–13(25) × 3–13(15) см. Основание пластинки от округло-усеченного до глубоко сердцевидного, апекс часто заострен, угол 80°–120°. Первичные жилки числом 8–14(16), отходящие от нижней половины средней жилки, наружная пара образует острый угол со средней. Этот вид имеет один медианный прилистник до 5 см длиной (Symoens et al., 1984; Symoens, 2015; Sosef, 2017; данные авторов).
Для всех видов рода характерен единый план строения устьичного аппарата. Верхний эпидермис несет устьица, плотность устьиц на нижнем эпидермисе зависит от характера экспонирования листовой пластинки (табл. 2). Сходные данные получены Шинобу (Shinobu, 1954): у плавающих и воздушных листьев H. dubia количество устьиц в верхнем эпидермисе – 70–80 экз./мм2, на нижнем эпидермисе у плавающих листьев − 0.8, у располагающихся в воздушной среде – 30 экз./мм2. На ранних стадиях морфогенеза листа плотность устьиц достигает 380–400 экз./мм2. Как и у остальных видов Hydrocharitaceae устьица парацитные с небольшим количеством аномоцитных, у Hydrocharis и Stratiotes aloides до 5–7% (Ancibor, 1979; данные авторов). Клетки абаксиальной поверхности более прямые, как у Limnobium, Нalophila Thouras и Ottelia Pers. (Ancibor, 1979).
Количество проводящих элементов закономерно изменяется в зависимости от размера органа (табл. 1, рис. 2). Васкулатура Hydrocharis и Limnobium сходна, сосудистые пучки коллатеральные, крупные, расположены в центре, более мелкие – ближе к периферии. Ксилема образована кольцевидными, спиральными элементами или сетчатыми нелигнифицированными трахеидами, флоэма содержит ситовые трубки (Ancibor, 1979).
Генеративные органы. Цветки Hydrocharis однополые, женские обычно крупнее (рис. 5а, 5е, 5ж). Околоцветник с тремя свободными сегментами. Чашелистики яйцевидные, белые или зеленоватые, 5–11 × 3–5 см, в 1.5 раза короче лепестков. Лепестки почти округлые или широко обратнояйцевидные, лодочковидные, белые с желтым пятном в основании или желтоватые, иногда смятые (чаще у H. dubia), 9–15(19) × 5–10 см. Чашелистики H. chevalieri 8–10(16) × 4–5 мм, лепестки до 32 × 10–15 мм. Тычинки в четырех–шести кругах, тычиночные нити нерегулярно в основании сросшиеся, количество фертильных тычинок (до четырех кругов у H. chevalieri, у остальных − три) и стаминодиев варьируется в пределах вида. Пистиллодий с трехлопастными рыльцеподобными придатками, выполняющий функцию нектарника или несекретирующий. В женских цветках стаминодии, как правило, в двух кругах.
Завязь нижняя, одногнездная, обычно с шестью выступающими перегородками и многочисленными (50–60 в каждой карпелле) семязачатками, плацентация ламинальная диффузная, гипантий не выражен. Рылец 6, до 5 мм длинной, они разделены 1/4–2/3 (у H. dubia и H. chevalieri до 1/3–3/4) на две иногда неравные дорсовентральные лопасти, внутренние поверхности папиллезные (Cook, Lüönd 1982; Symoens, 1984; Igersheim et al., 2001; Изместьева, Одинцова, 2010; Symoens et al. 2015; Sosef, 2017). Гинецей Limnobium и Hydrocharis имеет общий план строения (Kaul, 1968): вентральные пучки располагаются около краев плодолистика, стенка плодолистика выступает к центру завязи и сливается своей абаксиальной поверхностью. Гинецей этих видов может быть рассмотрен как синкарпный (Scribailo, Posluszny, 1985b; Igersheim et al., 2001; Изместьева, Одинцова, 2010; Ru et al., 2015) или гемипаракарпный (Филоненко и др., 2014).
Плод от шаровидного до продолговато-эллиптического, ягодообразный (гексамерная гемипаракарпная ягода (Филоненко и др., 2014), 6–8 × × 10 мм (у H. chevalieri – 18–25 × 5–20 мм), заполненный слизистым содержимым (Cook, Lüönd, 1982; Symoens et al., 1984; Ru et al., 2015; Symoens, 2015; Sosef, 2017). Цветоножки женских цветков после цветения и оплодотворения изгибаются и погружаются вместе с созревающим плодом в воду или обводненный грунт. Высвобождение семян происходит при набухании слизей мезокарпия, при деструкции покровных тканей; разрыв перикарпия не имеет структурных предпосылок (Филоненко и др., 2014; Jacobs, McColl, 2011). У видов рода Limnobium плод – ягодообразная коробочка (Cook, Urmi-König, 1983).
Плод у H. morsus-ranae, H. dubia содержит 26–42(74) семян, у H. chevalieri, вероятно, 60–80. Семена широкоэллипсоидальные, мелкобугорчатые. У H. morsus-ranae семена 0.5–1.3 × 0.5–0.7 мм длиной, H. dubia – 1.4–2.0 × 0.5–0.7, у H. chevalieri 1.5–2.0 × 0.5. Семена лишены эндосперма, клетки эндотегмента неправильной формы, шероховатые, несколько ребристые. Экзотеста плотно покрыта толстыми тупыми мягкими выростами со спиральными утолщениями, продуцирующими слизь. Эти структуры улучшают флотацию, облегчают прикрепление к поверхности тела животного и выполняют защитную функцию (Cook, Lüönd, 1982; Sun et al., 1997; Toma, 2013; Ru et al., 2015). Сырая масса семени H. dubia – 0.5 мг (Ru et al., 2015). При высыхании семена Hydrocharis теряют всхожесть (Zhao et al., 2017).
Ископаемые семена H. morsus-ranae отличаются несколько большим размером, они дорсовентральные, с коротким клювом, придатки экзотесты не всегда дифференцируются (рис. 4д, 4е).
Экобиоморфа. Подобно Stratiotes aloides и Limnobium, для видов Hydrocharis характерна ранняя специализированная морфологическая дезинтеграция и вегетативная подвижность (Cook, Lüönd, 1982; Cook, Urmi-König, 1983; Свириденко, 2000; Ефремов, Свириденко, 2008; Петухова, 2008). Ввиду базитонного ветвления зона обогащения находится на уровне, позволяющем максимально эффективно использовать ресурсы хорошо прогреваемой и освещенной водной толщи и/или обводненных грунтов. Виды рода Hydrocharis являются SR-стратегами, толерантно-рудеральный эколого-фитоценотип.
В пределах рода выделяются растения двух розеточных вегативно-подвижных биоморф. Первая группа объединяет вегетативно-одно(мало)летние, свободноплавающие, изредка укореняющиеся, розеточные, турионовые, низкие гидатофиты с плавающими или торчащими из воды листьями (H. morsus-ranae и H. dubia). Вторая группа представлена несколько морфологически обособленным H. chevalieri – вегетативно-(одно)малолетним, укореняющимся, розеточным, средневысоким гидрогелофитом с торчащими из воды листьями. Формирующиеся на подводных столонах (погруженных в грунт у H. chevalieri, рис. 5ж, 5з) терминальные почки двух типов: одни обеспечивают возобновление (турионы, не известны у H. chevalieri), другие – расселение (побеги возобновления).
Филогенетические связи. Результаты кластерного анализа демонстрируют существенное таксономическое различие между H. chevalieri и остальной частью рода Hydrocharis, а также морфологическую обособленность рода Limnobium (рис. 6). С учетом известных палеонтологических находок (подробнее у (Efremov et al., 2020)), вероятный центр видообразования рода Hydrocharis – бореально-субтропические районы Евразии.
Выводы. Наиболее существенные диагностические признаки рода Limnobium, отличающие его от Hydrocharis: хорошо развитая крупноклеточная аэренхима, занимающая большую часть абаксиальной поверхности листа; более короткие лопасти основания листовой пластинки; более острый угол между средней и первичными жилками; более многоцветковые соцветия; узкие лепестки, которые лишь немного длиннее чашелистиков или вообще отсутствуют; длинные лопасти рылец, превышающие сегменты околоцветника (Catling, Dore, 1982; Cook, Urmi-König, 1983; данные авторов). Важные диагностические признаки для видов рода Hydrocharis: форма апекса, форма и размер листовой пластинки, пропорция крупноклеточной аэренхимы, длина черешка, размеры плодов и семян, толщина перикарпия. Побеговая система Hydrocharis симподиальная, состоящая из одно(мало)летних моноподиальных побегов главного и подчиненных порядков. Геометрия клеток эпидермы и плотность устьиц связаны с особенностями экспонирования листовой пластинки. В пределах рода наблюдаются некоторые различия в размере и структуре плодов, толщине перикарпия, размере и структуре семян.
Виды рода Hydrocharis имеют розеточные вегативно-подвижные биоморфы, однотипность плана строения свидетельствует о направленности отбора признаков условиями среды, а также демонстрирует ограниченные возможности морфологических перестроек. Формирование побеговых систем итеративного ветвления повышает степень автономности. Полученные результаты свидетельствуют о существенных морфологических различиях между Hydrocharis chevalieri и филогенетически близкими H. morsus-ranae и H. dubia.
Список литературы
Анели Н.А. 1975. Атлас эпидермы листа. Тбилиси: Мецниереба.
Ефремов А.Н., Свириденко Б.Ф. 2008. Экобиоморфа телореза обыкновенного Stratiotes aloides L. (Hydrocharitaceae) в Западносибирской части ареала // Биология. внутр. вод. № 3. С. 29.
Кац Н.Я., Кац С.В., Кипиани М.Г. 1965. Атлас и определитель плодов и семян, встречающихся в четвертичных отложениях СССР. Москва: Наука.
Красилов В.А. 1976. Цагаянская флора Амурской области. Москва: Наука.
Кривохарченко И.С., Жмылев П.Ю., Белякова Г.А. 1995. Водокрас лягушачий // Биологическая флора Московской области. Вып. 11. Москва: Аргус. С. 56
Изместьева С.В., Одинцова А.В. 2010. Сравнительная морфология гинецея Stratiotes aloides L. и Hydrocharis morsus-ranae L. (Hydrocharitaceae) // Біологічні Студії. Т. 4(1). С. 115.
Михальцов А.Н. 2012. Модификация нового метода полихромной окраски тканей растения // Природные ресурсы, биоразнообразие и перспективы естественнонаучного образования. Омск: Изд-во ООО “Омскбланкиздат”. С. 57.
Никитин В.П. 2007. Палеокарпология и стратиграфия палеогена и неогена Азиатской России. Новосибирск: Гео.
Петухова Д.Ю. 2008. Биоморфология столонно-розеточных гидрофитов: Дис. канд. биол. наук: 03.00.05. Киров: Вятский государственный гуманитарный университет.
Серебрякова Т.И. 1972. Учение о жизненных формах растений // Итоги науки и техники. Серия Ботаника. Т. 1. С. 84.
Свириденко Б.Ф. 2000. Флора и растительность водоемов Северного Казахстана. Омск: Изд-во Омского государственного педагогического университета.
Филоненко А.В., Ефремов А.Н., Toмa Ц. 2014. К вопросу о структуре гинецея и плода представителей род Hydrocharis L. (Hydrocharitaceae) // Карпология и репродуктивная биология высших растений. Москва: ООО “Астра-Полиграфия”. С. 144.
Цыренова Д.Ю., Варфоломеева А.С., Горошко Ю.М. 2018. Микроморфология водокраса сомнительного Hydrocharis dubia (Blume) Backer (Hydrocharitaceae) с Дальнего Востока России // Биология внутр. вод. № 3. С. 31.https://doi.org/10.31857/S0320965220050137
Arber A. 1920. Water plants: a study of aquatic angiosperms. Cambridge: University Press.
Arber A. 1922. Studies on intrafasicular cambium in monocotyledons // Ann. Bot. V. 36. P. 251.
Ancibor E. 1979. Systematic anatomy of vegetative organs of the Hydrocharitaceae // Bot. J. Linn. Soc. V. 78. P. 237.
Bean A.R. 2011. Hydrocharis dubia (Blume) Backer (Hydrocharitaceae) is an alien species in Australia // Austrobaileya. V. 8. P. 435.
Boesewinkel F.D., Bouman F. 1984. The seed: structure // Embryology of Angiosperms. Berlin: Springer. P. 567.
Carrión J.S., Dupré M. 1996. Late Quaternary vegetational history at Navarrés, Eastern Spain. A two-core approach // New Phytologist. V. 134. P. 177.
Catling P.M., Dore W.G. 1982. Status and identification of Hydrocharis morsus-ranae and Limnobium spongia (Hydrocharitaceae) in Northeastern North America // Rhodora. V. 84(840). P. 523.
Catling P.M., Mitrow G., Haber E. et al. 2003. The biology of Canadian weeds. 124. Hydrocharis morsus-ranae L. // Can. J. Plant Sci. V. 83. P. 1001.
Chen L.-Y., Chen J.-M., Gituru R., Wang Q.-F. 2012. Generic phylogeny, historical biogeography and character evolution of the cosmopolitan aquatic plant family Hydrocharitaceae // BMC Evol. Biol. V. 12(30). https://doi.org/10.1186/1471-2148-12-30
Cook C.D.K., Lüönd R. 1982. A revision of the genus Hydrocharis (Hydrocharitaceae) // Aquat. Bot. V. 14. P. 177. https://doi.org/10.1016/0304-3770(82)90097-3
Cook C.D.K., Urmi-König K. 1983. A revision of the genus Limnobium including Hydromystria (Hydrocharitaceae). Aquat. Bot. V. 17. P. 1. https://doi.org/10.1016/0304-3770(83)90015-3
Cutter E.G. 1964. Observations on leaf and bud formation in Hydrocharis morsus-ranae // Am. J. Bot. V. 51(3). P. 318. https://doi.org/10.1002/j.1537-2197.1964.tb06637.x
Daumann E. 1931. Zur phylogenie der Diskusbildung. Beiträge zur Kenntnis der Nektarie II. (Hydrocharis, Sagittaria, Sagina) // Beih. Bot. Zentralblatt. V. 48. P. 183.
Daumann E. 1970. Das Bliitennektarium der Monocotyledonen unter besonderer Berficksichtung seiner systematischen und phylogenetischen Bedeutung // Feddes Repert. Spec. Nov. Veg. V. 80. P. 463.
Den Hartog C. 1957. Hydrocharitaceae // Flora Malesiana. V. 5. P. 401.
Efremov A.N., Grishina V.S., Kislov D.E. et al. 2020. The genus Hydrocharis L. (Hydrocharitaceae): distribution features and conservation status // Botanica Pacifica. A J. Plant Sci. and Conserv. V. 9(2). P. 83. https://doi.org/10.17581/bp.2020.09215
Jacops S.W.L., McColl K.A. 2011. Hydrocharitaceae // Wilson A. (ed.) Flora of Australia. V. 39. Alismatales to Arales. Department of Sustainability, Environment, Water, Population and Communities. ABRS/CSIRO, Melbourne, Australia.
Haynes R.R. 2001. Hydrocharitaceae // Flora of Thailand. Bangkok. V. 7. P. 365.
Igersheim A., Buzgo M., Endress P.K. 2001. Gynoecium diversity and systematics in basal monocots // Bot. J. Linn. Soc. V. 136. P. 1.https://doi.org/10.1006/bojl.2000.0424
Kaul R.B. 1968. Floral morphology and phylogeny in the Hydrocharitaceae // Phytomorphology, V. 18. P. 13.
Kaul R.B. 1970. Evolution and adaptation of inflorescences in the Hydrocharitaceae // Am. J. Bot. V. 57. P. 708.
Les D.H., Moody M., Soros C.L. 2006. A reappraisal of phylogenetic relationships in the monocotyledon family Hydrocharitaceae (Alismatidae) // Aliso. V. 22. P. 211.
Lowden R.M. 1992. Floral variation and taxonomy of Limnobium L. C. Richard (Hydrocharitaceae) // Rhodora. V. 94(878). P. 111.
Mai D.H., Walther H. 1988. Die pliozänen Floren von Thüringen // Quartärpaläontologie. V. 7. P. 55.
O’Brien T.P., McCully M.E. 1981. The study of plant structure: principles and selected methods. Melbourne: Termarcarphi Pty.
Ru J., M. Liu, Cheng X., Wang C. 2015. The morphological study of the fruit, seed and seedling of Hydrocharis dubia (Hydrocharitaceae) // Pak. J. Bot. V. 47. P. 1467.
Scribailo R.W., Posluszny U. 1984. The reproductive biology of Hydrocharis morsus-ranae. I. Floral biology // Can. J. Bot. V.62(12). P. 2779. https://doi.org/10.1139/b84-370
Scribailo R.W., Posluszny U. 1985a. The reproductive biology of Hydrocharis morsus-ranae. II. Seed and seedling morphology // Can. J. Bot. V. 63. P. 492.
Scribailo R.W., Posluszny U. 1985b. Floral Development of Hydrocharis morsus-ranae (Hydrocharitaceae) // Am. J. Bot. V. 72 (10). P. 1578. https://doi.org/10.2307/2443308
Seago J.L. Jr., Peterson C.A., Enstone D.E. 1999. Cortical ontogeny in roots of the aquatic plant, Hydrocharis morsus-ranae L. // Can. J. Bot. V. 77(1). P. 113.https://doi.org/10.1139/b98-210
Seago J.L., Jr., Marsh L.C., Stevens K.J. et al. 2005. A re-examination of the root cortex in wetland flowering plants with respect to aerenchyma // Ann. Bot. V. 96. P. 565.
Serbanescu-Jitariu G. 1972. Contributions a connaissance du fruit et de la germination de quelques representants da la famille des Hydrocharitaceae // Bull. de la Société D’Histoire Naturelle de l’Afrique du Nord. V63 (1–2). P. 19.
Shinobu R. 1954. Studies on the stomata of Hydrocharis // Bot. Mag., Tokyo. V. 67. P. 73.
Sosef M.S.M. 2017. Hydrocharitaceae // Flore du Gabon. V. 50: Anacardiaceae, Hydrocharitaceae, Piperaceae. Leiden: Joseph Margraf. P. 52.
Symoens J.-J. 2015. Hydrocharitaceae // Flore d’Afrique Centrale. Meise: Jardin botanique Meise.
Symoens J.-J., Villiers J.-F., Satabie B. 1984. Flore du Cameroun. V. 26: Alismatidées. Yaoundé: Flagellariacées. P. 38.
Sun K., Chen J.-K. 1998. Micromorphological study of fruit coats of Hydrocharitaceae from China // Chinese Bulletin of Botany. V. 15(01). P. 63.
Sun K., Wang Q.-F., Chen J.-K. 1997. Micromorphological characters of seed coats of Chinese Hydrocharitaceae and their systematic significance // J. Syst. Evol. V. 35(5). P. 445.
Tsuchiya T. 1989. Growth and biomass turnover of Hydrocharis dubia L. cultured under different nutrient conditions // Ecol. Res. V. 4. P. 157.
Toma C. 2003.The development of Hydrocharis morsus-ranae fruit. XI International Conference on Plant Embryology. Plant Reproduction: from Mendel to Molecular Biology. Brno. Czech Republic.
Toma C. 2008. Studium karpologiczne gatunków z podklasy Alismatidae (rząd Helobiae) występujących w Polsce // Prace Zakładu Taksonomii Roślin Uniwersytetu im. A. Mickiewicza w Poznaniu. 17. Poznań: Bogucki Wydawnictwo Naukowe.
Toma C. 2013. Reproduction of Hydrocharis morsus-ranae taxa in an oxbow lake of the River Vistula // Limnological Review. V. 13(3) P. 171. https://doi.org/10.2478/limre-2013-0019
Tomlinson P.B. 1982. Helobiae (Alismatidae). V. VII // C.R. Metcalfe (Ed.) Anatomy of Monocotyledons. Oxford: Clarendon Press.
Yao Y.-F., Bruch A.A., Mosbrugger V., Li C.-S. 2011. Quantitative reconstruction of Miocene climate patterns and evolution in Southern China based on plant fossils // Palaeogeography, Palaeoclimatology, Palaeoecology. V. 304. P. 291. https://doi.org/10.1016/j.palaeo.2010.04.012
Zhao S., Huang W., Jiang H. et al. 2017. Hydrocharis dubia seeds maintain high seed vigor in ambient wet storagecondition through scavenging hydrogen peroxide by antioxidant systems // Aquat. Bot. V. 143. P. 18. https://doi.org/10.1016/j.aquabot.2017.08.001
Zhu B., Ottaviani C.C., Naddafi R., Dai Z., Du, D. 2018. Invasive European frogbit (Hydrocharis morsus-ranae L.) in North America: an updated review 2003–16 // J. Plant Ecol. V. 11(1). P. 17. https://doi.org/10.1093/jpe/rtx031
Wang Q., Guo Y., Haynes R.R., Hellquist C.B. 2016. Hydrocharitaceae // Flora of China. http://www.efloras.org/florataxon.aspx?flora_id=2&taxon_id=10426 (10 February 2021).
Дополнительные материалы
- скачать ESM_1.xls
- Таблица 1. Гербарные образцы видов рода Hydrocharis.
- скачать ESM_2.xlsx
- Таблица 2. Сравнительная морфология Hydrocharis и Limnobium.
- скачать ESM_3.xls
- Таблица 3. Морфометрия Hydrocharis (основные характеристики).
Инструменты
Биология внутренних вод