Биология внутренних вод, 2021, № 6, стр. 619-627
Сравнительные аспекты воздействия гипоксии и сероводорода на активность оксидоредуктаз в жабрах и мозге морского ерша Scorpaena porcus
И. В. Головина a, *, Е. Э. Колесникова a, **
a Институт биологии южных морей им. А.О. Ковалевского Российской академии наук
Севастополь, Россия
* E-mail: ivgolovina@mail.ru
** E-mail: dr-kolesnikova@mail.ru
Поступила в редакцию 16.09.2020
После доработки 20.05.2021
Принята к публикации 15.06.2021
Аннотация
Проведен сравнительный анализ изменения активности малатдегидрогеназы (L-малат: НАД-оксидоредуктаза; МДГ, 1.1.1.37) и лактатдегидрогеназы (лактат: НАД-оксидоредуктаза; ЛДГ, 1.1.1.27) в жабрах (первая жаберная дуга) и структурах головного мозга (продолговатый, средний, передний и промежуточный мозг) взрослых особей Scorpaena porcus L., 1758 при кратковременном раздельном воздействии гипоксии (90 мин при 1.7–3.7 и 0.3–1.0 мг О2/л) и сероводорода (5 мин при 37 и 74 мкМ Na2S). Нарастание в экспериментальных условиях гипоксической и сероводородной нагрузки способствовало усилению взаимодействия в системе “активность МДГ ↔ активность ЛДГ” в исследованных тканях: наибольшие величины коэффициента корреляции получены в жабрах (r = 0.87, p < 0.05) и продолговатом мозге (r = 0.96, p < 0.01). Рассмотрена функциональная связь между активностью ферментов в тканях, обсуждается схожесть метаболических последствий воздействия гипоксии и H2S на активность оксидоредуктаз и вероятные механизмы обнаруженных эффектов.
ВВЕДЕНИЕ
Гипоксия и высокое содержание сульфидов являются обычной проблемой прибрежных и эстуарных вод даже в ненарушенной человеком водной среде при отсутствии сквозной вертикальной конвекции. Черное море – внутреннее море с обширной природной сероводородной зоной и значительным антропогенным прессингом. Границы черноморской сероводородной зоны отличаются пространственно-временной нестабильностью, зависят от горизонтального и вертикального переноса, перемешивания и солнечной активности. Уже на глубинах 3–7 м наблюдаются газовые сипы с характерными детритно-бактериальными матами c повышенной концентрацией органического вещества, где рыбы могут питаться содержащимися в них организмами (Еремеев, Коновалов, 2006; Заика, Гулин, 2011). В естественных условиях черноморская скорпена Scorpaena porcus Linnaeus, 1758, или морской ерш, встречается на глубине до 45 м, ведет образ жизни донного хищника-засадчика, обладает толерантностью к гипоксии/аноксии и, вероятно, к локальным концентрациям сероводорода.
Выживание животных, обитающих в водной среде с низким содержанием О2, в значительной мере зависит от способности поддерживать баланс между энергетический обменом и запросом на макроэргические соединения. Реакции гликолиза, которые обеспечивают ферменты малатдегидрогеназа (L-малат: НАД-оксидоредуктаза; МДГ, 1.1.1.37) и лактатдегидрогеназы (лактат: НАД-оксидоредуктаза; ЛДГ, 1.1.1.27) – неотъемлемая часть нормального метаболизма, а также функционирования клеток в ходе адаптации к изменяющимся условиям окружающей среды.
Цитозольная форма МДГ задействована в аэробном гликолизе и принимает участие в малат-аспартатном шунте, окисляя поступающий из митохондрий малат в оксалоацетат с образованием НАДН; ЛДГ катализирует заключительный этап анаэробного гликолиза. Оба фермента вовлечены в производство энергии и регуляцию окислительно-восстановительного потенциала клеток, соотношение их активности используется в качестве показателя интенсивности и направленности окислительных процессов в тканях (Hochachka, Somero, 2002). Изменение гидрологических характеристик среды, прежде всего содержания кислорода, вызывает сдвиги между аэробным и анаэробным метаболизмом в тканях.
Цель работы – сравнить влияние гипоксии и сероводородной нагрузки на активность оксидоредуктаз в оксифильных тканях – жабрах и структурах головного мозга черноморской скорпены.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объектом исследования послужили взрослые особи морского ерша Scorpaena porcus (Scorpaenidae) в летний период (34 экз., длина тела – 12–17 см, масса тела – 70–130 г). Рыбу отлавливали в июле–августе ставным неводом и доставляли в лабораторию в пластиковых баках (объем 60 л) с аэрацией. Для снятия стресса после транспортировки ершей содержали одну неделю в проточном аквариуме, в работе использовали только подвижных и активно питающихся особей.
Эксперименты проводили в специально разработанной камере при температуре воды 21 ± 0.5°C (Soldatov et al., 2020). Рыб содержали при концентрации кислорода в воде от 4.5 до 6.7 мг/л (нормоксия), от 1.7 до 3.7 мг/л (опыт 1) и от 0.3 до 1.0 мг/л (опыт 2). Экспозиция особей к условиям гипоксии была 90 мин, содержание кислорода в воде контролировали с помощью оксиметра ELWRO PRL T N5221 (Польша). Кратковременную сероводородную нагрузку создавали, подвергая две экспериментальные группы рыб в течение 5 мин экспозиции к разным концентрациям сульфида натрия как донора сероводорода – 37 мкМ Na2S (опыт 3) и 74 мкМ Na2S (опыт 4), опираясь на данные других исследователей (Porteus et al., 2014). Нарушения внешнего дыхания и поведенческих реакций у рыб во всех проведенных опытах не происходило.
Препарирование тканей, гомогенизацию и центрифугирование проводили при охлаждении (0 ± 4°С). По окончанию эксперимента сразу после декапитации рыб забирали образцы тканей: жаберные лепестки первой жаберной дуги, ПМ, СПМ и хранили до анализа при температуре ‒80°С в морозильной камере (Farma 900 Series, Termo Scientific, USA).
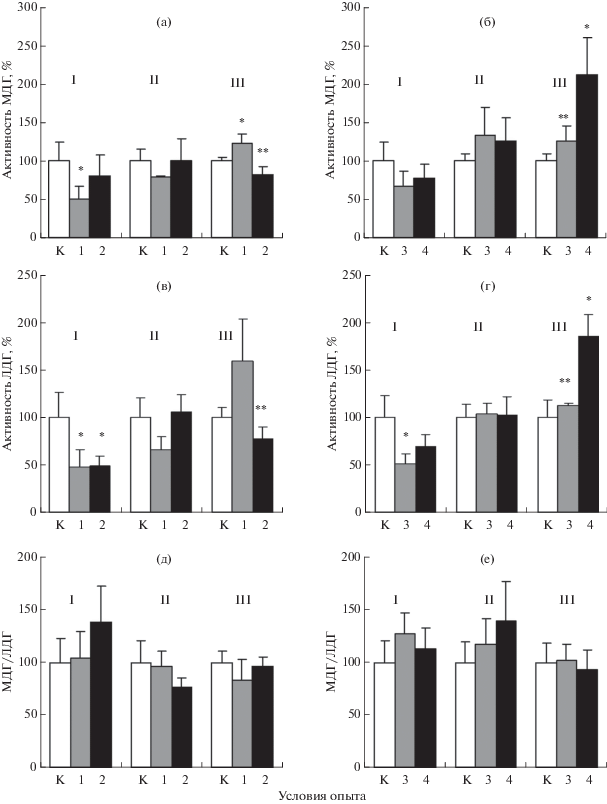
Удельную активность ЛДГ (лактат: НАД-оксидоредуктаза; ЛДГ, 1.1.1.27) и МДГ (L-малат: НАД-оксидоредуктаза; МДГ, 1.1.1.37) измеряли спектрофотометрически при 340 нм и 25оC по скорости окисления НАДН в цитоплазме тканей, содержание белка определяли микробиуретовым методом. Субстратом для определения активности ЛДГ служил пируват, для МДГ – оксалоацетат (Мильман и др., 1974). Активность ферментов в тканях контрольной группы рыб принимали за 100%. Диаграмма на рис. 1 отражает изменение активности ферментов в процентах по отношению к контролю. Результаты представлены как M ± m, достоверность различий средних оценивали по t-критерию Стьюдента, различия считали значимыми при p < 0.05. Статистическую обработку и графическое оформление полученной информации проводили при помощи стандартного программного обеспечения Microsoft Excel.
Рис. 1.
Активность МДГ (а, б) и ЛДГ (в, г), индекс МДГ/ЛДГ (д, е) при гипоксии (а, в, д) и сероводородной нагрузке (б, г, е) в тканях Scorpaena porcus. Здесь и на рис. 2: I – первая жаберная дуга, II – продолговатый мозг, III – средний, передний и промежуточный мозг; К – контроль, 1 – 1.7–3.7 мг О2/л, 2 – 0.3–1.0 мг О2/л; 3 – 37 мкМ Na2S, 4 – 74 мкМ Na2S.
* Достоверно различается с контролем, р < 0.05.
** Достоверно различается с другим опытом, р < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Раздельное воздействие кратковременной гипоксии и сероводородной нагрузки вызывало адаптивную флуктуацию активности ферментов углеводного обмена (рис. 1).
Опыт 1. Умеренная гипоксия (1.7–3.7 мг O2/л) привела к двукратному снижению активности МДГ и ЛДГ в жабрах (p < 0.05; рис. 1а, 1в). В ПМ отмечена тенденция к уменьшению активности обоих ферментов, в СПМ – к увеличению, которое для МДГ было достоверным (p < 0.05). Величина индекса МЛГ/ЛДГ относительно контроля в жабрах и отделах мозга не изменилась (рис. 1д). Корреляция между активностью МДГ и ЛДГ достигла максимума в ПМ (r = 0.96; p < 0.01) (рис. 2а).
Рис. 2.
Корреляция (r) между активностью МДГ и ЛДГ при гипоксии (а) и сероводородной нагрузке (б) в тканях Scorpaena porcus. * р < 0.05. ** р < 0.01.

Опыт 2. В условиях острой гипоксии (0.3–1.0 мг O2/л) незначительное увеличение активности МДГ в жабрах при снижении активности ЛДГ на 50% (p < 0.05) вызвало рост индекса на 40% (p > 0.05). В ПМ активность ферментов вернулась к уровню контроля. В СПМ активность обоих ферментов существенно снизилась по сравнению с опытом 1 (p < 0.05), что сохранило индекс МЛГ/ЛДГ на постоянном уровне. Корреляция между активностью МДГ и ЛДГ максимально возросла в жабрах (r = 0.87) и СПМ (r = 0.81), осталась высокой в ПМ (r = 0.94; p < 0.05–0.01) (рис. 2а).
Опыт 3. После умеренной сероводородной нагрузки (37 мкМ Na2S) обнаружена тенденция к снижению активности МДГ в жабрах, и, наоборот, к повышению в ПМ и СПМ (рис. 1б). По сравнению с контролем активность ЛДГ в жабрах уменьшилась на 50% (p < 0.05), в тканях мозга – не изменилась (рис. 1г). Появилась тенденция к росту индекса МДГ/ЛДГ в жабрах и ПМ (рис. 1е). Корреляция между активностью МДГ и ЛДГ достигла максимума в жабрах (r = 0.75; p < 0.05) (рис. 2б). Произошло потемнение ламелл жаберной ткани.
Опыт 4. Увеличение сероводородной нагрузки (74 мкМ Na2S) привело к незначительному повышению активности МДГ и ЛДГ в жабрах по сравнению с опытом 3. Потемнение жаберной ткани усилилось. В ПМ активность МДГ сохранилась на уровне опыта 3, активность ЛДГ оставалась стабильной. Однако в СПМ произошел резкий рост активности обоих ферментов по сравнению с контролем и опытом 3 (p < 0.05): активность МДГ достигла 212%, ЛДГ – 185%. Сохранилась тенденция к большей величине индекса МДГ/ЛДГ в жабрах и ПМ по сравнению с контролем, соотношение активности ферментов в СПМ не изменилось. Коэффициент r между активностью МДГ и ЛДГ в СПМ увеличился до 0.65 (p ≥ 0.05), в ПМ – до 0.94 (p < 0.01).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Гипоксия оказывает существенное влияние на численность и разнообразие макрофауны, структуру и функцию морских экосистем (Vaquer-Sunyer, Duart, 2010). Известно, что средовая гипоксия и соответствующий сдвиг анаэробного метаболизма могут серьезно угрожать энергетическому балансу и снижать способность животных вырабатывать достаточное количество АТФ для удовлетворения метаболических потребностей. Несмотря на критическую важность аэробного дыхания для поддержания метаболических функций, многие организмы обитают и процветают в различных гипоксических и даже бескислородных средовых условиях.
При биохимической адаптации к гипоксии в водной среде обитания (Almeida-Val, 1993) метаболическая реорганизация подчиняется двум обобщенным паттернам: либо происходит увеличение анаэробного синтеза АТФ (эффект Пастера), либо уровень АТФ снижается (метаболическая депрессия). Такого рода изменения метаболизма базируются на активации гликолиза с участием гликогена или глюкозы в качестве субстратов и лактатом как промежуточным продуктом. “Ферментная адаптация” к гипоксии также предполагает изменения аффинности отдельных ферментов, вовлекаемых в аэробный и анаэробный метаболизм (Lushchak et al., 1998).
Все эктотермные организмы, особенно рыбы, используют адаптивные биохимические стратегии для достижения метаболического гомеостаза при флуктуациях растворенного в воде кислорода (Hochachka, Somero, 1984). При гипоксии выживание костистых рыб в первую очередь зависит от способности поддерживать клеточный энергетический баланс (стабильный уровень АТФ), несмотря на падение аэробной продукции энергии (Richards, 2009).
Гипоксия vs. жабры. Жаберный аппарат скорпены, как и у других бентосных видов рыб, обладает небольшой площадью по сравнению с активными, быстро плавающими рыбами (Gray, 1954). Для изучения особенностей метаболического профиля скорпены нами использовалась ткань только первой жаберной дуги. Первые жаберные дуги многих видов костистых рыб, включая скорпену, получают иннервацию (IX) языкоглоточным и (X) блуждающим нервами. Эпителий филаментов упомянутой жаберной дуги включает НЭК, которые выполняют функцию своеобразного О2-сенсора. При снижении PwО2 стимуляция НЭК, реагирующих на концентрацию О2, запускает каскад кардиореспираторных рефлексов, обеспечивающих выживание и приспособление организма к условиям гипоксии. Кроме того, жаберный аппарат за счет жаберного эпителия обладает достаточно широким разнообразием и других физиологических функций. Помимо того, что жабры считаются основным органом дыхательного газообмена, они играют важную роль в ионном и осмотическом балансе, служат основным локусом выведения азотистых веществ (Mommsen, 1984б). За исключением обмена воды, кислорода и углекислого газа, которые, по-видимому, определяются простой диффузией, все остальные процессы, упомянутые выше, требуют приложения значительной метаболической активности. Ткани жабр характеризуются существенным “внутренним” поглощением О2 жаберными филаментами, которое не относится непосредственно к дыхательной функции жаберного аппарата (Johansen, Pettersson, 1981). Окислительная способность жаберной ткани также отражается в избытке митохондрий в специализированных жаберных клетках с определенными функциями. При высокой окислительной способности ткани жабр глюкоза и лактат служат наиболее важными источниками углерода (Mommsen, 1984a).
В нашем исследовании в жаберной ткани скорпены зарегистрирована вторая по величине после тканей мозга активность МДГ. При умеренной гипоксии активность МДГ и ЛДГ имела тенденцию к снижению, однако при жесткой гипоксии активность МДГ повышалась настолько, что давала достаточно высокие значения индекса МДГ/ЛДГ, почти в 2 раза превышавшие аналогичный индекс тканей мозга.
Гипоксия vs. мозг. Мозг – наиболее сложный, чувствительный к О2 орган, состоящий из множества структурных и функциональных компонентов с заметно различающимися и независимо регулируемыми уровнями функциональной и метаболической активности. Основной путь использования глюкозы мозгом – аэробное окисление, которое определяет крайне высокую чувствительность мозга к гипоксии. Кроме того, часть промежуточных продуктов окисления глюкозы мозг использует для образования медиаторов (ацетилхолина, ГАМК), которые, в частности ГАМК, cпособствуют поддержанию устойчивости мозга к действию гипоксии, а также для резервирования ацетильного остатка в виде ацетиласпартата (Marshal, 1995; Языкова, 2004).
В мозгу – CПМ и ПМ – костистых рыб выделяют пять основных отделов. ПМ принимает участие в образовании ствола мозга и содержит базовые рефлекторные центры, регулирующие дыхание, сердечную деятельность, тонус сосудов, и ядра шести пар (V–X) черепно-мозговых нервов, является местом прохождения восходящих и нисходящих проводящих путей. СПМ рыб включает центры обоняния, зрения, слуха, выполняет функции интегрирования и регулирования функций организма, координации движений, вовлекаются в контроль за питанием рыб (Смирнова, Кузьмина, 2020; Kotrschal, Kotrschal, 2020).
Исходно (нормоксия) в степени активности МДГ между СПМ и ПМ скорпены отмечали некоторую разницу, по-видимому, отражающую тенденцию большей интенсивности аэробных процессов в эволюционно более молодых структурах СПМ. По мере снижения РwО2 (умеренная гипоксии) активность МДГ возрастала в СПМ и сохранялась в пределах статистической погрешности в ПМ. При низких значениях РwО2 (острая гипоксия) в ПМ сохранялась высокая активность МДГ при заметном ее снижении в СПМ, что свидетельствует о выраженной метаболической устойчивости ПМ, необходимой для поддержания гомеостаза. Адаптационная стабильность ПМ при низких значениях РwО2 поддерживается высокой, в пределах контрольного уровня, активностью ЛДГ.
Исходно (нормоксия) ПМ и СПМ имели сопоставимые значения ЛДГ. Найденная нами высокая активность ЛДГ в структурах мозга скорпены определяет “анаэробизацию” путей энергетического метаболизма, поддерживающего продукцию макроэргов при изменении РwО2 в придонных слоях воды. При экспозиции к острой гипоксии такая степень активности ЛДГ в СПМ и ПМ стабильно удерживалась. В то же время умеренная гипоксия сопровождалась повышением активности ЛДГ в СПМ и снижением – в ПМ. Полученные нами данные по активности МДГ и ЛДГ в мозгу скорпены дополняют представления о предпочтительном использовании гликогена в мозгу некоторых бесчелюстных и бентосных костистых рыб в качестве ближайшего источника глюкозы, а также привлечении к метаболическим преобразованиям лактата или кетонов при дефиците глюкозы (Soengas, Aldegunde, 2002).
Следует отметить, что при экспозиции к гипоксии во всех изучаемых отделах мозга скорпены индекс МДГ/ЛДГ удерживался на относительно постоянном уровне в пределах статистической погрешности, а соотношению МДГ/ЛДГ в СПМ и ПМ свидетельствовало о сохранении окислительной способности тканей мозга при разных градациях кратковременной гипоксии. Сохранение высокой интенсивности аэробных и анаэробных процессов в СПМ и ПМ скорпены при острой гипоксии, очевидно, может предполагать наличие различных метаболических стратегий энергетического обмена для эволюционно разновозрастных структур мозга в таком диапазоне РwО2, который не критичен для данного вида. Кроме того, способность поддерживать стабильные уровни АТФ в тканях во время гипоксии, особенно в чувствительных тканях (как мозг), считается признаком толерантности к гипоксии (Hochachka et al., 1996), что согласуется с “сохранением” величины индекса МДГ/ЛДГ.
H2S как токсин и медиатор. Сульфиды (обобщенный термин для диссоциированных ионов H2S ↔ НS– ↔ S2–) всегда присутствуют в бескислородном (аноксическом) слое морских отложений, и их диффузия в придонные водные горизонты контролируется скоростью диффузии и потреблением кислорода в оксигенируемых наслоениях (Vaquer-Sunyer, Duart, 2010). Соответственно, количество сульфидов увеличивается во время гипоксии. В частности, массовая смертность гидробионтов в это время может быть следствием сульфидной токсичности и самой гипоксии (Vaquer-Sunyer, Duart, 2010). Содержание сульфидов в толще воды может достигать значительных концентраций и активно влиять на физиологию рыб, живущих на мелководье вдоль побережья морей (Bagarinao, Vetter, 1992). Токсичность сульфидов в основном обусловлена ингибированием цитохром с-оксидазы и интерференцией с другими важными ферментами (Bagarinao, Vetter, 1992).
Потенциальные механизмы, которые помогают рыбам выдерживать токсичность сульфидов, – взаимодействие с белками крови, анаэробный метаболизм, определенная нечувствительность к сульфидам цитохром c-оксидазы и метгемоглобинемия (Torrans, Clemens, 1982; Bagarinao, Vetter, 1989, 1990, 1992, 1993). Предполагают, что виды с высокой резистентностью к гипоксии обычно отличаются высокой H2S-переносимостью (Grieshaber, Völkel, 1998); вместе с тем, высокий анаэробный потенциал не может объяснить длительное выживание в среде с сульфидами (Völkel et al., 2001).
Известно, что кроме токсического действия H2S осуществляет функцию физиологически значимой сигнальной молекулы (Olson, 2012). В качестве медиатора эндогенный H2S синтезируется преимущественно из аминокислоты L-цистеина и/или гомоцистеина. Синтез Н2S осуществляется во многих (если не во всех) тканях организма двумя цитозольными энзимами: цистатионин β‑синтазой (ЦБС) и цистатионин γ-лиазой. Кроме того, H2S может генерироваться в митохондриях под действием цистеин аминотрансферазы и 3‑меркаптопируваттрансферазы (также присутствует в цитозоле). Показано, что ЦБС, основной фермент синтеза H2S, также интегрирует взаимодействие между H2S и другими газообразными сигнальными молекулами (CO, NO), способствуя регуляции энергетического метаболизма (Giuffréa et al., 2014).
Следует признать, что до настоящего времени физиологические и биохимические реакции рыб на действие сульфидов не изучены в полной мере. Кроме того, современные концепции, определяющие гипоксию, принимают во внимание только концентрацию кислорода в водной среде и не включают возможный синергетический эффект гипоксии и токсичности сульфидов (Vaquer-Sunyer, Duart, 2010).
В нашем исследовании использованы условно “физиологические” концентрации донора H2S – Na2S, кратковременная экспозиция к которым у рыб не сопровождалась нарушениями и депрессией внешнего дыхания (Porteus et al., 2014), что свидетельствовало об отсутствии выраженного токсического эффекта упомянутых доз.
H2S vs. жабры. Известно, что легко проникающие в эпителий жабр сульфиды могут препятствовать связыванию О2 с гемоглобином крови и способствовать развитию тканевой гипоксии, подобно той, которую вызывает цианид или снижение поступления О2 (Affonso et al., 2004). Согласно описанному механизму, при взаимодействии H2S с гемоглобином крови у скорпены также могла возникать определенная степень гипоксемии (снижение PO2 крови). Предполагают (Bagarinao, Vetter, 1989), что у рыб сульфид-окисляющая активность крови способствует минимизации количества потенциально токсичных соединений, которые с током крови достигают жизненно важных органов. Сульфид-окисляющая активность также отмечена в самой жаберной ткани, селезенке, печени и почках рыб (Bagarinao, Vetter, 1989).
Процессы, наблюдаемые при сероводородной нагрузке у скорпены в жаберной ткани, характеризовались некоторыми признаками метаболической депрессии. На это указывало снижение активности МДГ в первой жаберной дуге, что косвенно свидетельствовало о взаимодействии H2S с жаберной тканью.
H2S vs. мозг. Экспозиция скорпены к низкой концентрации Na2S не вызывала статистически значимых изменений активности оксидоредуктаз в тканях мозга, в то же время при двукратном увеличении концентрации Na2S в среде упомянутые изменения были более выражены. Подобный феномен почти отсутствующей реакции оксидоредуктаз (в пределах статистической погрешности) на низкую концентрацию Na2S на уровне целого организма мог быть реализован за счет сульфид-связывающей активности жаберной ткани и крови, обеспечивающих скорпене защиту от поступления в организм физиологически значимого количества сульфидов. В то же время, при высокой концентрации Na2S в СПМ происходило синхронное повышение активности МДГ и ЛДГ, что предполагает тесное согласование работы аэробных и анаэробных путей метаболизма, характерное для средовой гипоксии (Van Waarde, 1983). Исходя из предположения о возникновении гипоксемии/тканевой гипоксии при высокой дозе Na2S значительный подъем активности МДГ в наиболее О2-чувствительной части мозга (СПМ) мог быть в первую очередь связан с двойственной ролью МДГ при аэробном и анаэробном метаболизме (Hochachka, Somero, 1984). Известно, что за счет своей высокой активности по сравнению с другими ферментами энергетического метаболизма, МДГ вовлекается в анаэробные процессы и гликолиз. При экспозиции к H2S одновременное увеличение активности ЛДГ и МДГ в оксифильных структурах мозга, с одной стороны, указывает на наличие фактора гипоксемии/тканевой гипоксии, возникающего при высокой концентрации Na2S, с другой, свидетельствует о прямой “реакции” оксидоредуктаз на присутствие Н2S. Необходимо отметить, что условно менее О2-чувствительный ПМ на уровне оксидоредуктаз почти не реагировал даже на высокую концентрацию Na2S, что предполагает иной режим энергетического метаболизма в данном отделе мозга скорпены. Одним из процессов, возникающих при сероводородной нагрузке, может быть сульфид-окислительная активность при условно низких/нетоксических концентрациях H2S в ПМ, который обладает выраженной устойчивостью к колебаниям РО2 и/или к самому H2S.
Корреляционные отношения МДГ и ЛДГ при гипоксии и сероводородной нагрузке. Анализ корреляционных связей (r) между активностью МДГ и ЛДГ в оксифильных тканях показал их увеличение по мере снижения PwO2, что свидетельствует об усилении взаимодействия этих ферментов, проявляющемся при дефиците О2. Причем в тканях первой жаберной дуги и ПМ, которые в первую очередь обеспечивают кардиореспираторные реакции при гипоксии, значения r достигают наибольших величин по сравнению с СПМ, что косвенно служит подтверждением функциональной взаимосвязи этих структур в рамках контура регуляции сердечной и дыхательной функций. Полученные нами величины r предполагают более сбалансированное взаимодействие оксидоредуктаз ПМ по сравнению с СПМ, что предполагает большую устойчивость ПМ к гипоксии и согласуется с отсутствием резких изменений активности МДГ и ЛДГ в ткани ПМ при разных уровнях PwO2.
По-видимому, выраженное “смещение” корреляционной связи (r) между активностью МДГ и ЛДГ первой жаберной дуги при сероводородной нагрузке по сравнению с гипоксией опосредуется специфическим участием жаберной ткани в инактивации избытка H2S и сопутствующей экспозиции к H2S гипоксемии. При максимальной сероводородной нагрузке отмечалась достоверная положительная корреляционная связь оксидоредуктаз ПМ, которые обеспечивают сохранение уровня продукции макроэргов для обеспечения генерации кардиореспираторных «команд», направленных на выживание организма и усиливающихся на фоне возникшей гипоксемии/тканевой гипоксии.
Выводы. Полученные результаты свидетельствуют о сходстве перестроек энергетического метаболизма при гипоксии и сероводородной нагрузке в О2-чувстивтельных тканях мозга и жабр, что согласуется с ранее выдвинутым положением об идентичности реакций и метаболических последствиях воздействия гипоксии и H2S на активность оксидоредуктаз энергетического обмена (Oeschger, Storey, 1990; Olson et al., 2006). Основные проявления реакции оксифильных тканей скорпены на сероводородную нагрузку – перестройки активности оксидоредуктаз энергетического метаболизма (МДГ и ЛДГ), возникающие вследствие инактивации “избытка” H2S. Более функционально активные/О2-чувствительные или эволюционно молодые, требующие высоких затрат макроэргов оксифильные структуры могут быть более восприимчивы к действию H2S vs. гипоксия, исходя из конкурентных/взаимообратных отношений между О2 и H2S. Реакции оксидоредуктаз первой жаберной дуги на гипоксию и действие H2S обладают определенной идентичностью, что, по-видимому, связано с анатомической диспозицией жабр к средовым факторам. Первая жаберная дуга и ПМ, относящиеся к контуру регуляции кардиореспираторных функций, обладают наиболее тесным/выраженным сопряжением (r) активности МДГ и ЛДГ под действием гипоксии и сероводорода.
Список литературы
Еремеев В.Н., Коновалов С.К. 2006. К вопросу о формировании бюджета и закономерностях распределения кислорода и сероводорода в водах Черного моря // Морск. экол. журн. Т. 5. № 3. С. 5.
Заика В.Е., Гулин М.Б. 2011. Наибольшие глубины обитания рыб в Черном море и особенности их питания у границы сероводородной зоны // Морск. экол. журн. Т. 10. № 2. С. 39.
Мильман Л.С., Юровецкий Ю.Г., Ермолаева Л.П. 1974. Определение активности важнейших ферментов углеводного обмена // Методы биологии развития. Москва: Наука. С. 346.
Смирнова Е.С., Кузьмина В.В. 2020. Влияние холинолитиков на скорость пищевой реакции карпа Cyprinus carpio L. // Биол. внутр. вод. Т. 13. № 2. С. 192. (Для переводчика Smirnova E.S., Kuz’mina V.V. Effect of cholinolytics on the rate of feeding reaction of carp Cyprinus carpio L. // Inland Water Biology. 2020. V. 13. № 2. P. 308. https://doi.org/10.1134/S1995082920020121).https://doi.org/10.31857/S032096522002014X
Языкова М.Ю. 2004. Биохимия тканей. Саратов: Саратовский ун-т.
Affonso E.G., Polez V.L.P., Corrêa C.F. et al. 2004. Physiological responses to sulfide toxicity by the air-breathing catfish, Hoplosternum littorale (Siluriformes, Callichthyidae) // Comp. Biochem. Physiol. V. 139. № 4. P. 251. https://doi.org/10.1016/j.cca.2004.11.007
Almeida-Val V.M., Val A.V., Hochachka P.W. 1993. Hypoxia tolerance in Amazon fishes: status of an under-explored biological “goldmine”. Surviving Hypoxia: Mechanisms of Control and Adaptation. Boca Raton: CRC Press. P. 435.
Bagarinao T., Vetter R.D. 1989. Sulfide tolerance and detoxification in shallow-water marine fishes // Mar. Biol. V. 103. P. 291.
Bagarinao T., Vetter R.D. 1990. Oxidative detoxification of sulfide by mitochondria of the California killifish Fundulus parvipinnis and the speckled sanddab Citharichthys stigmaeus // J. Comp. Physiol. V. 160. P. 519.
Bagarinao T., Vetter R.D. 1992. Sulfide-hemoglobin interactions in the sulfide-tolerance salt marsh resident, the California killifish Fundulus parvipinnis // J. Comp. Physiol. V. 162. P. 614.
Bagarinao T., Vetter R.D. 1993. Sulphide tolerance in the California killifish, Fundulus parvipinnis, a salt marsh resident // J. Fish Biol. V. 42. P. 729. https://doi.org/10.1111/j.1095-8649.1993.tb00381.x
Giuffréa A., Colaço H.G., Mastronicola D. et al. 2014. Cystathionine β-synthase and the interplay between the bioenergetically relevant gasotransmitters NO, CO and H2S // BBA-Bioenergetics. 1837: e71.
Gray I.E. 1954. Comparative study of the gill area of marine fishes // Biol. Bull. V. 107. P. 219.
Grieshaber M.K., Völkel S. 1998. Animal adaptations for tolerance and exploitation of poisonous sulfide // Annu. Rev. Physiol. V. 60. P. 33.
Hochachka P.W., Somero G.N. 1984. Biochemical Adaptation. New Jersey: Princeton Univ. Press.
Hochachka P.W., Somero G.N. 2002. Biochemical Adaptation: Mechanism and Process in Physiological Evolution. Oxford: Oxford University Press.
Hochachka P.W., Buck L.T., Doll C.J., Land S.C. 1996. Unifying theory of hypoxia tolerance: molecular/metabolic defense and rescue mechanisms for surviving oxygen lack // Proc. Natl. Acad. Sci. U.S.A. V. 93. P. 9493. https://doi.org/10.1073/pnas.93.18.9493
Johansen K., Pettersson K. 1981. Gill O2 consumption in a teleost fish, Gadus morhua // Respir. Physiol. V. 44. P. 277. https://doi.org/10.1016/0034-5687(81)90023-2
Kotrschal A., Kotrschal K. 2020. Fish Brains: Anatomy, Functionality, and Evolutionary Relationships. The Welfare of Fish. Animal Welfare. V. 20. P. 129. Cham: Springer. https://doi.org/10.1007/978-3-030-41675-1_6
Lushchak V.I., Bahnjukova T.V., Storey K.B. 1998. Effect of hypoxia on the activity and binding of glycolytic and associated enzymes in sea scorpion tissues // Braz. J. Med. Biol. Res. V. 31. № 8. P. 1059. https://doi.org/10.1590/s0100-879x1998000800005
Marshal W.J. 1995. Clinical biochemistry. Churchill Livingstone: Elsevier Science.
Mommsen T.P. 1984a. Metabolism of the Fish Gill // Fish Physiology. V. 10. P. 203. https://doi.org/10.1016/S1546-5098(08)60186-7
Mommsen T.P. 1984b. Biochemical characterization of the rainbow trout gill // J. Comp. Physiol. V. 154. № 2. P. 191.
Oeschger R., Storey K.B. 1990. Regulation of glycolytic enzymes in the marine invertebrate Halicryptus spinulosus (Priapulida) during environmental anoxia and exposure to hydrogen sulfide // Mar. Biol. V. 106. P. 261.
Olson K.R., Dombkowski R.A., Russell M.J. et al. 2006. Hydrogen sulfide as an oxygen sensor/transducer in vertebrate hypoxic vasoconstriction and hypoxic vasodilation // J. Exp. Biol. V. 209. P. 4011. https://doi.org/10.1242/jeb.02480
Olson K.R. 2012. Mitochondrial adaptations to utilize hydrogen sulfide for energy and signaling // J. Comp. Physiol. V. 182. P. 881. https://doi.org/10.1007/s00360-012-0654-y
Porteus C.S., Abdallah S.J., Pollack J. et al. 2014. The role of hydrogen sulphide in the control of breathing in hypoxic zebrafish (Danio rerio) // J. Physiol. V. 592. № 14. P. 3075. https://doi.org/10.1113/jphysiol.2014.271098
Richards J.G. 2009. Metabolic and Molecular Responses of Fish to Hypoxia // Fish Physiol. V. 27. P. 443. https://doi.org/10.1016/S1546-5098(08)00010-1
Soengas J.L., Aldegunde M. 2002. Energy metabolism of fish brain // Comp. Biochem. Physiol. Biochem. Mol. Biol. V. 131. № 3. P. 271. https://doi.org/10.1016/s1096-4959(02)00022-2
Soldatov A.A., Golovina I.V., Kolesnikova E.E. et al. 2020. Activity of Energy Metabolism Enzymes and ATP Content in the Brain and Gills of the Black Sea Scorpionfish Scorpaena porcus under Short-Term Hypoxia // J. Evolut. Biochem. Physiol. V. 56. № 3. P. 224. https://doi.org/10.31857/S0044452920010143
Torrans E.L., Clemens H.P. 1982. Physiological and biochemical effects of acute exposure of fish to hydrogen sulfide // Comp. Biochem. Physiol. V. 71. № 2. P. 183. https://doi.org/10.1016/0306-4492(82)90034-x
Völkel S., Berenbrink M., Heisler N. et al. 2001. Effect of sulfide on K+ flux pathways in red blood cells of crusian carp and rainbow trout // Fish Physiol. Biochem. V. 24. P. 213.
Van Waarde A. 1983. Aerobic and anaerobic ammonia production by fish // Comp. Biochem. Physiol. V. 74. № 4. P. 675. https://doi.org/10.1016/0305-0491(83)90127-x
Vaquer-Sunyer R., Duart C.M. 2010. Sulfide exposure accelerates hypoxia-driven mortality // Limnol., Oceanogr. V. 55. № 3. P. 1075. https://doi.org/10.4319/lo.2010.55.3.1075
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод


