Биология внутренних вод, 2021, № 6, стр. 599-606
Показатели кардиоактивности и оксидативного стресса моллюска Anodonta cygnea при краткосрочной соленосной тест-нагрузке как биомаркеры для оценки состояния организма и качества среды обитания
С. В. Холодкевич a, b, Г. М. Чуйко c, *, А. Н. Шаров c, d, Т. В. Кузнецова a, Д. С. Песня c
a Санкт-Петербургский федеральный исследовательский центр Российской академии наук, Санкт-Петербургский научно-исследовательский центр экологической безопасности Российской академии наук
Санкт-Петербург, Россия
b Институт наук о Земле, Санкт-Петербургский государственный университет
Санкт-Петербург, Россия
c Институт биологии внутренних вод им. И.Д. Папанина Российской академии наук
пос. Борок, Некоузский р-н, Ярославская обл., Россия
d AquaBioSafe, Тюменский государственный университет
Тюмень, Россия
* E-mail: gchuiko@ibiw.ru
Поступила в редакцию 09.12.2020
После доработки 04.02.2021
Принята к публикации 04.06.2021
Аннотация
Исследована динамика сердечной активности и биомаркеров оксидативного стресса в жабрах пресноводных двустворчатых моллюсков Anodonta cygnea L. в течение кратковременного (1 ч) повышения солености воды до 3‰ и последующего ее восстановления до исходного уровня. Показано, что изменения солености сопровождаются быстрым синхронным ростом частоты сердечных сокращений моллюсков с последующим их возвращением к исходному уровню после снятия соленосного воздействия. Изменения биохимических маркеров состояния оксидативного стресса (активность каталазы, глутатион-S-трансферазы, содержание малонового диальдегида) моллюсков были сходного характера. Однако биохимический ответ имел латентный период продолжительностью до 60 мин при повышении солености и 15 мин – при ее возращении к первоначальному уровню. Полученные данные свидетельствуют, что такой режим воздействия солености не оказывает неблагоприятного влияния на моллюсков, поэтому может использоваться в качестве тестовой функциональной нагрузки при оценке состояния здоровья моллюсков и определении качества среды их обитания.
ВВЕДЕНИЕ
Двустворчатые моллюски – одна из наиболее экологически значимых групп беспозвоночных в водных экосистемах (Алимов, 1981). Они ведут малоподвижный или прикрепленный образ жизни и, будучи активными фильтраторами, выполняют важную роль в самоочищении и поддержании качества поверхностных вод (Ostroumov, 2005). Пропуская через мантийную полость значительные объемы воды, моллюски в значительных количествах аккумулируют в себе большинство растворенных в ней и адсорбированных на взвешенных частицах загрязняющих веществ без их заметной метаболической трансформации, даже тогда, когда они содержатся в воде в низких концентрациях (Turja et al., 2013, 2015; Binelli et al., 2015). Аккумулируя загрязняющие вещества, моллюски подвергаются их воздействию, отвечая на него изменением своего физиолого-биохимического состояния (De Pirro et al., 2001; Richardson et al., 2008; Yeats et al., 2008; Bakhmet et al., 2009; Falfushynska et al., 2009; Guidi et al., 2010 и др.). Все это позволяет использовать показатели функционального состояния моллюсков в качестве биомаркеров загрязнения водной среды (Huggett et al., 1992; Parolini et al., 2016; Magni et al., 2017).
Среди активно изучаемых в последнее время биомаркеров моллюсков – характеристики кардиоактивности, регистрируемой неинвазивно (Kholodkevich et al., 2009; Burnett et al., 2013; Bakhmet, 2017), и показатели состояния оксидативного стресса (СОС) (Manduzio et al., 2005; Cossu, 2000; Lushchak, 2011b; Klimova et al., 2020). Чтобы выявить скрытые изменения в организме, вызванные действием неблагоприятных внешних и внутренних факторов, принято подвергать животных функциональным нагрузкам в виде стандартизированных краткосрочных тест-воздействий в пределах толерантного (адаптивного) диапазона, не приводящим к патологическим нарушениям – изменение солености среды, механические, температурные и другие стимулы (Kholodkevich et al., 2009, 2017; Холодкевич и др., 2018). Крайне важно, чтобы тест-воздействие не доставляло тестируемым животным дискомфорта, было универсальным (применимым для разных видов животных), не обладало кумулятивным эффектом, и его можно было легко дозировать по силе и продолжительности (Kholodkevich et al., 2009). Именно таким критериям, на наш взгляд, отвечает краткосрочное изменение солености воды. Оно является одним из наиболее удобных тест-воздействий при использовании в качестве тест-организмов и морских, и пресноводных моллюсков.
Соленость – это важный абиотический экологический фактор, к варьированию которого в пределах толерантного диапазона водные организмы достаточно легко акклимируются. Вместе с тем колебания солености оказывают влияние на все жизненно важные процессы и функции водных животных. Известно, что они влияют на осморегуляцию, синтез белков, потребление кислорода, внутриклеточный кислотно-щелочной баланс и так далее (Хлебович, 1974; Wang et al., 2011). В результате этого наблюдаются сдвиги баланса электролитов и энергетического метаболизма, повышение концентрации стресс-гормонов в тканях, развитие СОС и другие изменения гомеостаза организма (Lushchak, 2011b; Pallavi et al., 2012; Carregosa et al., 2014; Песня и др., 2015). Быстрое (в течение 1–3 мин) экспериментальное снижение солености воды на >30–50% вызывает у морских моллюсков защитно-оборонительную реакцию: полное закрытие створок и быстрый переход на анаэробный обмен, сопровождающийся снижением ЧСС (Kholodkevich et al., 2009).
Однако, чтобы использовать метод функциональной нагрузки, необходимо знать реакцию на тест-воздействие организма, обитающего в условиях относительно чистой, референтной акватории. Ранее выполнены работы по сравнительному изучению реакции кардиоактивности и биомаркеров СОС на краткосрочное снижение солености как тест-воздействия у двустворчатых моллюсков из морских акваторий (Bakhmet et al., 2005; Kholodkevich et al., 2009; 2017; Холодкевич и др., 2018). Сведения о реакции этих биомаркеров у пресноводных моллюсков на повышение солености пока немногочисленны (Песня и др., 2015; Kholodkevich et al., 2019).
Цель работы – исследовать временную динамику показателей сердечной активности и биомаркеров СОС в жабрах пресноводных двустворчатых моллюсков беззубок (Anodonta cygnea L., 1758) при кратковременном изменении солености среды и выяснить возможности использования такого воздействия в качестве стандартизованной тестовой функциональной нагрузки при оценке состояния их здоровья и качества среды обитания.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Исследования проводили на взрослых особях двустворчатого пресноводного моллюска Anodonta cygnea Linnаeus, 1758 обоего пола с длиной раковины 70–100 мм. Животных собирали вручную с глубины 40–120 см в прибрежной зоне одного из заливов юго-западного побережья Волжского плеса Рыбинского водохранилища в районе впадения р. Сутка вблизи пос. Борок (58°03′45″ с.ш., 38°14′23″ в.д.) в начале августа 2012 г. После вылова и транспортировки в лабораторию моллюсков помещали в аквариум со 150 л природной речной воды, заменяемой каждые двое суток на 1/3 (по 50 л), и природным песчаным грунтом, отобранных в месте их обитания. Перед опытами животных не менее двух недель акклимировали к экспериментальным условиям. Концентрацию растворенного в воде кислорода поддерживали на уровне полного насыщения (9.1 ± 0.1 мг/л) за счет принудительной аэрации, температура воды была 19–21°С, рН 7.8–8.0, минерализация 126.9 ± 11.3 мг/л (соответствовала природному уровню в литоральной зоне водохранилища). Моллюсков кормили 2 раза в неделю в расчете на 150 л воды смесью из 50 г сухих кормовых дрожжей и 50 мл хлореллы из лабораторной культуры, концентрированной центрифугированием и промытой дистиллированной водой. За сутки до начала и во время эксперимента животных не кормили. Остальные условия содержания были, как в акклимационный период. Для измерения кардиоактивности и биохимических показателей использовали 8 и 24 моллюска соответственно.
Соленость воды в экспериментах повышали добавлением в аквариумы 10 л раствора NaCl (х.ч.) с таким расчетом, чтобы за 1 мин достичь конечной концентрации 3 г/л (3‰). Моллюсков экспонировали в солоноватой воде в течение 60 мин. Измерение ЧСС проводили индивидуально на каждой особи разработанным в Санкт-Петербургском научно-исследовательском центре экологической безопасности Российской академии наук (НИЦЭБ РАН) неинвазивным волоконно-оптическим методом, обеспечивающим многоканальную непрерывную длительную регистрацию ЧСС в режиме on-line (Kholodkevich et al., 2017). За сутки до начала эксперимента миниатюрные держатели волоконно-оптических датчиков кардиоактивности приклеивали к раковинам моллюсков в области расположения сердца. Кардиоактивность и расчет средних ЧСС анализировали с помощью оригинального программного обеспечения “VarPulse”, которое позволяет проводить многоканальную обработку сигнала в реальном времени, включая адаптивную цифровую фильтрацию, передачу, визуализацию и архивирование данных. Время восстановления ЧСС (tвосст) рассчитывали как время (мин) от начала возвращения солености к исходному уровню до момента устойчивого возвращения кардиоактивности к фоновым значениям и определяли индивидуально для каждого моллюска.
В биохимических экспериментах для измерения биомаркеров СОС отбирали одновременно по три моллюска в каждой временной точке по следующей схеме: при фоновой солености (контроль) – за 20 мин до и непосредственно перед повышением солености (0 и 20 мин), через 10, 45 и 60 мин после начала солевого воздействия и через 15, 45 и 100 мин после его прекращения и замены соленой воды на природную пресную.
Время отбора проб для биохимического анализа определяли в процессе регистрации кардиоактивности, исходя из отчетливых изменений величин ЧСС. Сразу после извлечения из воды моллюсков целиком помещали на 15 мин в жидкий азот (T 196°C) с целью быстрого прекращения биохимических изменений в их тканях. Для последующего анализа использовали жабры. Определяли следующие биомаркеры СОС: содержание продукта перекисного окисления липидов МДА (Владимиров, Арчаков, 1972), активность КАТ (КФ 1.11.1.6) (Королюк и др., 1988), активность ГSТ (КФ 2.5.1.18) (Habig et al., 1974). Температуру инкубационной среды при определении активности ферментов поддерживали на уровне 25.0 ± 0.5°С. Содержание общего водорастворимого белка определяли по методу Бредфорд (Bradford, 1976). Более подробно процедура пробоподготовки и проведения биохимических анализов описана ранее (Песня и др., 2015).
Результаты представляли в виде средних и их ошибок (M ± SE). Статистическую значимость различий между выборками оценивали методом однофакторного дисперсионного анализа (ANOVA, U-критерий Манна–Уитни, p = 0.05).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
До начала экспериментального повышения солености средняя фоновая ЧСС моллюсков была 12.3 ± 0.2 уд./мин (табл. 1). На добавление раствора NaCl все моллюски отреагировали через 2–3 мин резким повышением ЧСС, в среднем до 18.2 уд./мин (рис. 1).
Таблица 1.
Средние значения ЧСС и показателей СОС в жабрах Anodonta cygnea при изменении солености
| Экспозиция, мин | ЧСС, уд./мин |
Водорастворимый белок, мкг/мг |
МДА | ГSТ | КАТ |
|---|---|---|---|---|---|
| пкмоль/мкг белка | нмоль/(мкг белка · мин) | ||||
| Природная вода | |||||
| 0 | 12.3 ± 0.2 | 537.8 ± 35.8 | 0.98 ± 0.08 | 2.8 ± 0.09 | 24.6 ± 2.09 |
| 20 | 12.3 ± 0.3 | 599.1 ± 52.5 | 0.82 ± 0.06 | 2.0 ± 0.24 | 21.4 ± 2.43 |
| Замена природной воды на раствор NaCl | |||||
| 10 | 18.7 ± 0.5* | 553.9 ± 31.9 | 0.87 ± 0.03 | 2.9 ± 0.33 | 22.3 ± 1.16 |
| 45 | 16.8 ± 0.9* | 562.2 ± 29.5 | 0.98 ± 0.16 | 2.6 ± 0.28 | 26.5 ± 1.38 |
| 60 | 16.0 ± 0.9* | 501.1 ± 87.2 | 0.97 ± 0.13 | 2.8 ± 0.39 | 28.4 ± 6.57 |
| Замена раствора NaCl на природную воду | |||||
| 15 | 13.5 ± 0.8* | 539.3 ± 19.5 | 2.31 ± 0.42* | 5.3 ± 0.89* | 42.5 ± 7.51* |
| 45 | 13.3 ± 0.2* | 622.0 ± 21.6 | 0.99 ± 0.21 | 2.3 ± 0.29 | 19.4 ± 1.47 |
| 100 | 12.7 ± 0.4 | 609.4 ± 62.1 | 1.03 ± 0.19 | 2.5 ± 0.20 | 24.8 ± 4.32 |
Рис. 1.
Изменение средних значений ЧСС во время соленосного теста у Anodonta cygnea. Здесь и на рис. 2 стрелка вверх – повышение солености воды (до 3‰), стрелка вниз – начало снижения солености (замена воды на природную). По оси ординат – ЧСС; по оси абсцисс – время от начала эксперимента.
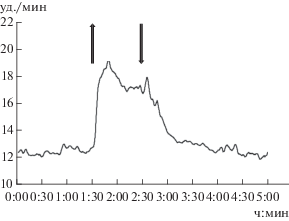
После замены соленой воды на пресную значения ЧСС моллюсков тестируемой выборки постепенно, в течение 90 ± 18 мин возвращались к их начальным фоновым величинам и оставались на этом уровне до конца эксперимента.
Значения биомаркеров СОС (Песня и др., 2015) не выходили за пределы физиологической нормы (фоновые), пока моллюски пребывали в пресной воде в течение 20 мин наблюдения.
Повышение солености воды и нахождение моллюсков при этих условиях в течение 60 мин не привело к статистически значимым отклонениям по сравнению с нормальным уровнем значений МДА, ГSТ и КАТ. Однако через 15 мин после замены соленой воды на природную у моллюсков наблюдали примерно двукратное повышение величин всех исследуемых показателей СОС. Тем не менее, в течение следующих 30 мин они вернулись к исходным значениям и находились на этом уровне до конца периода наблюдений. Содержание водорастворимого белка статистически значимо не изменялось на протяжении всего эксперимента.
Сравнение данных по динамике ЧСС и биомаркерам СОС во время соленосного теста (рис. 2) показало, что и при экспериментальном повышении солености воды, и при ее возврате к норме реакция сердечно-сосудистой системы моллюсков наступает значительно быстрее, а продолжительность дольше, чем реакция (или ответ) биомаркеров СОС.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Пресноводные моллюски являются гиперосмотичными по отношению к среде обитания. Содержание ионов, особенно Na+ и Ca2+, в гемолимфе у них существенно выше, чем в пресной воде. Вследствие этого между внутренней средой моллюсков и внешней средой создается осмотический градиент, способствующий диффузии воды внутрь организма. Повышение концентрации Na+ в воде приводит к снижению осмотического градиента между двумя средами, что сопровождается уменьшением поступления воды в организм. При выравнивании концентраций ионов Na+ в воде и гемолимфе пресноводные моллюски начинают повышать его уровень во внутренней среде, чтобы обеспечить определенный осмотический градиент для притока воды в организм (Хлебович, 1974; Towle, 1997). Это повышение происходит в пределах физиологической нормы для конкретного вида.
Гемолимфа беззубки в природных условиях имеет низкую концентрацию ионов и изотонична 0.1%-ному раствору NaCl. Для Anodonta sp. только совершенно пресная или слегка солоноватая вода (общая соленость ≤2‰) наиболее благоприятна для обитания. Превышение этого уровня солености приводит к нарушению гомеостаза внутренней среды организма моллюсков, что вызывает стресс и запускает процесс адаптации на физиолого-биохимическом уровне. При солености 9‰ большинство особей погибают (Шкорбатов, Старобогатов, 1990). Исходя из того, что критической границей для разделения большинства пресноводных и морских организмов принято считать 6–8‰ (Хлебович, 1974), толерантный диапазон солености для пресноводных двустворчатых моллюсков, включая беззубку, находится в пределах 2–6‰. В этом диапазоне они, по крайней мере на короткое время, способны адаптироваться к повышению солености без серьезных патологических нарушений и возвращаться к исходному морфофункциональному состоянию при ее снижении до нормального уровня.
Показано, что изменение значений различных природных стресс-факторов, включая соленость, вызывает реакцию как со стороны кардиоактивности двустворчатых моллюсков (Bakhmet et al., 2005; Braby, Somero, 2006; Kholodkevich et al., 2017; 2019), так и показателей СОС (Viarengo et al., 1991; Manduzio et al., 2005; Lushchak, 2011а; Klimova et al., 2017; 2020).
В нашем эксперименте при небольшом увеличении солености (до 3‰) у беззубки уже через 2–5 мин наблюдалось четко выраженное двукратное повышение ЧСС (тахикардия). Ранее показано (Kholodkevich et al., 2019), что такое же по продолжительности (60 мин), но большее по силе (до 6‰) экспериментальное повышение солености вызывает у беззубки, обитающей в пресной воде, быстрое прогрессирующее снижение ЧСС (брадикардия) до минимума, характерного для моллюсков с закрытыми створками (Kholodkevich et al., 2009; 2019). В обоих случаях после снятия соленосного воздействия значения ЧСС через определенное время, зависящее от функционального состояния моллюска, возвращается к исходному (фоновому) уровню.
Полученные результаты не противоречат друг другу, так как оба типа реакции ЧСС могут проявляться у одного вида моллюсков в ответ на воздействие внешних факторов разного уровня. Так, у другого вида пресноводных двустворчатых моллюсков из сем. Unionidae, а именно Unio pictorum, реакция на краткосрочное повышение солености до 4‰ выражалась у одних особей тахикардией, у других – брадикардией. Кроме того, было показано, что еще у одного вида пресноводных двустворчатых моллюсков дрейссены речной (Dreissena polymorpha) при краткосрочной глубокой гипоксии (концентрация растворенного кислорода 0.56–1.1 O2 мг/л, экспозиция 96 ч) ЧСС сначала повышается, а затем снижается по сравнению с фоновыми значениями. В отличие от D. polymorpha бугская дрейссена (D. bugensis) сразу реагирует на такую гипоксию брадикардией (Чуйко и др., 2019). Кроме того, даже когда общий ответ разных видов двустворчатых моллюсков на изменение солености выражается в снижении ЧСС, достаточно часто наблюдается первичная краткосрочная (3–5 мин) тахикардия (Kholodkevich et al., 2009; 2017).
Таким образом, можно предположить, что двустворчатые моллюски имеют две тактики адаптации на уровне кардиоактивности к изменению внешних факторов. При относительно низкой силе и короткой продолжительности воздействия стресс-фактора они способны повысить энергообмен и усилить сердечную деятельность, а также дыхательную и фильтрационную активность, чтобы пропустить через мантийную полость больше воды. Если такая тактика не дает результата, они переходят к другой тактике адаптации к изменению условий среды обитания: плотно закрывают створки, замедляют сердечную и дыхательно-фильтрационную активность, снижают энергообмен и переходят на анаэробное дыхание. В таком состоянии они могут находиться достаточно долгое время.
У беззубки в нашем эксперименте четко выраженные изменения наблюдали не только в ЧСС, но в биохимических параметрах. Известно, что у всех аэробных организмов в процессе окислительного фосфорилирования во время дыхания постоянно образуется в качестве побочных продуктов некоторое количество соединений кислорода с непарным электроном на внешней атомарной оболочке, обозначаемых общим термином “активные формы кислорода” (АФК) (Lushchak, 2011a, 2011b; Klimova et al., 2020). К ним относятся супероксид анион $\left( {{\text{O}}_{2}^{{\centerdot - }}} \right)$, гидроксил радикал (•OH), пероксид водорода (H2O2), синглетный кислород и др. АФК очень реакционноспособны и быстро вступают в реакцию с основными биологическими молекулами – белками, липидами и нуклеиновыми кислотами, а также надмолекулярными системами, в частности, биологическими мембранами, повреждая их структуру и нарушая нормальное функционирование. Для контроля образования АФК в организме на клеточном уровне существует система АОЗ, которая осуществляет их инактивацию. В ее состав входят ряд ферментов и низкомолекулярных соединений. В норме эти два процесса, генерирование и инактивация АФК, поддерживают их концентрацию на стабильно низком уровне. Установившийся уровень АФК – это динамический параметр, отражающий баланс между этими двумя процессами. Когда гомеостаз в организме по какой-то причине нарушается, то возможно усиление генерирования АФК и, как следствие, их взаимодействия с биологическими молекулами (липидов, белков, нуклеиновых кислот) – повышение концентрации продуктов их перекисной модификации, например МДА. В ответ происходит активация всех компонентов АОЗ. Такое состояние организма получило название “оксидативного стресса” (СОС). Если при окислительной нагрузке концентрации АФК под воздействием работы АОЗ быстро возвращается к исходному стационарному уровню, то эти события называются “острым окислительным стрессом”. Если эффективность АОЗ недостаточно высока для снижения уровня АФК до исходной стационарной концентрации, повышенный уровень АФК может поддерживаться в течение более длительного периода (так называемый “хронический оксидативный стресс”), и только дополнительное повышение эффективности системы АОЗ может вернуть концентрацию АФК в исходные пределы. При некоторых обстоятельствах АФК не возвращается к начальной концентрации, и она стабилизируется на повышенном уровне, называемом “квазистационарным”. В дальнейшем это может приводить к патологическим морфофункциональным нарушениям в организме.
Показано, что развитие СОС в тканях водных организмов, включая двустворчатых моллюсков, вызывается многими экологическими факторами как природного, так и антропогенного происхождения, в том числе и изменением солености (Lushchak, 2011b; Klimova et al., 2017; 2020). В нашем эксперименте наблюдалось изменение оксидативного статуса в жабрах моллюсков: возрастали концентрация МДА и активность ГSТ и КАТ, т.е. развивалось СОС. Однако эти изменения не совпадали по времени с началом повышения солености, а наблюдались через 15 мин после его окончания и носили краткосрочный характер, возвращаясь к исходному уровню показателей СОС через 30 мин после начала подъема, т.е. общая продолжительность реакции была ≤45 мин. Такой характер динамики показателей СОС предполагает у моллюсков развитие острого оксидативного стресса. Однако в отличие от кардиоактивности, биохимический ответ на воздействие данного фактора развивается не сразу, а имеет некоторый латентный период. Его продолжительность при повышении солености ~60 мин, а при возврате к пресной воде 15 мин. Продолжительность ответа в первом случае 15 мин, во втором – 30 мин. Исходя из протокола эксперимента, нельзя установить, был ли возврат к исходному уровню показателей СОС результатом естественного развития острого стресс-ответа, или это произошло в связи со снятием стресс-фактора. Вместе с тем, можно однозначно утверждать, что такое стресс-воздействие носит обратимый характер и не вызывает у моллюсков развитие хронического оксидативного стресса.
Ранее нами показано, что в сходных экспериментах на моллюсках из этой же популяции беззубки, отловленных в сентябре того же года, но при экспозиции к повышенной солености в течение 2 ч также наблюдалась задержка реакции параметров СОС (Песня и др., 2015). При этом содержание МДА возрастало, в то время как активность ГSТ и КАТ снижалась. Однако после прекращения гиперосмотического воздействия значения показателей возвращались к исходному уровню. Еще два параметра СОС, активность ГSТ и содержание восстановленного глутатиона, при повышении солености демонстрировали устойчивый рост по сравнению с исходными уровнями, достигая максимальных величин к концу эксперимента т.е., увеличение продолжительности воздействия стресс-фактора несколько меняло характер биохимического ответа. Тем не менее, и в том, и в другом случае наблюдаемые параметры возвращались к исходным уровням после снятия гиперосмотического воздействия.
Выводы. Проведенные эксперименты показывают, что краткосрочное повышение солености до 3‰ вызывает у беззубки изменения в ЧСС и исследуемых показателях СОС, но они носят обратимый характер и быстро возвращаются к исходному уровню после возвращения моллюсков обратно в пресную воду. Кратковременное изменение солености среды в пределах толерантности вида не приводит к устойчивым изменениям в физиологическом состоянии беззубки, а носит обратимый характер и, следовательно, такое воздействие может применяться в качестве тестовой функциональной нагрузки при оценке состояния организма моллюсков и качества среды их обитания.
Список литературы
Алимов А.Ф. 1981. Функциональная экология пресноводных двустворчатых моллюсков. Ленинград: Наука.
Владимиров Ю.А., Арчаков А.П. 1972. Перекисное окисление в биологических мембранах. Москва: Наука.
Королюк М.А., Иванова Л.И., Майорова И.Г., Токарев В.Е. 1988. Метод определения активности каталазы // Лабораторное дело. № 1. С. 16.
Песня Д.С., Романовский А.В., Чуйко Г.М. и др. 2015. Антиоксидантная система пресноводного двустворчатого моллюска Anodonta cygnea L. в условиях краткосрочного изменения солености в эксперименте // Вода: химия и экология. № 6. С. 80.
Хлебович В.В. 1974. Критическая соленость биологических процессов. Ленинград: Наука.
Холодкевич С.В., Кузнецова Т.В., Куракин А.С. и др. 2018. Новый методологический подход к оперативной оценке экологического состояния прибрежных морских акваторий // Известия Тихоокеанского научно-исследовательского рыбохозяйственного центра. Т. 194. С. 215. https://doi.org/10.26428/1606-9919-2018-194-215-238
Чуйко Г.М., Климова Я.С., Шаров А.Н., Холодкевич С.В. 2019. Реакция антиоксидантной защиты и сердечной системы двустворчатых моллюсков D. polymorpha и Dreissena bugensis на краткосрочную гипоксию // Моллюски: биология, экология, эволюция и формирование малакофаун: Тез. докл. Всерос. науч. конф. с междунар. участием (Борок, 14–18 октября 2019 г.). Ярославль: Филигрань. С. 101.
Шкорбатов Г.Л., Старобогатов Я.И. 1990. Труды Зоологического института АН СССР. Т. 219. Ленинград: Зоол. ин-т.
Bakhmet I.N. 2017. Cardiac activity and oxygen consumption of blue mussels (Mytilus edulis) from the White Sea in relation to body mass, ambient temperature and food availability // Polar Biol. V. 40. P. 1959. https://doi.org/10.1007/s00300-017-2111-6
Bakhmet I., Berger V.J., Khalaman V. 2005. The effect of salinity change on the heart rate of Mytilus edulis specimens from different ecological zones // J. Exp. Mar. Biol. Ecol. V. 318. P. 121. https://doi.org/10.1016/j.jembe.2004.11.023
Bakhmet I.N., Fokina N.N., Nefedova Z.A. et al. 2009. Physiological-biochemical properties of blue mussel Mytilus edulis adaptation to oil contamination // Environ. Monit. Assess. V. 155. P. 581. https://doi.org/10.1007/s10661-008-0457-5
Binelli A., Della Torre C., Magni S., Parolini M. 2015. Does zebra mussel (Dreissena polymorpha) represent the freshwater counterpart of Mytilus in ecotoxicological studies? A critical review // Environ. Pollut. V. 196. P. 386. https://doi.org/10.1016/j.envpol.2014.10.023
Braby C.E., Somero G.N. 2006. Following the heart: temperature and salinity effects on heart rate in native and invasive species of blue mussels (genus Mytilus) // The Journal of Experimental Biology. V. 209. P. 2554. https://doi.org/10.1242/jeb.02259
Bradford M.M. 1976. A Rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principal of protein dye binding // Anal. Biochem. V. 72. P. 248. https://doi.org/10.1016/0003-2697(76)90527-3
Burnett N.P., Seabra R., De Pirro M. et al. 2013. An improved noninvasive method for measuring heartbeat of intertidal animals // Limnol., Oceanogr.: Meth. V. 11. P. 91. https://doi.org/10.4319/lom.2013.11.91
Carregosa V., Velez C., Soares A.M.V.M. et al. 2014. Physiological and biochemical responses of three Veneridae clams exposed to salinity changes // Comparative Biochemistry and Physiology. Part B. V. 177–178. P. 1. https://doi.org/10.1016/j.cbpb.2014.08.001
Cossu C., Doyotte A., Babut M. et al. 2000. Antioxidant biomarkers in freshwater bivalves, Unio tumidus, in response to different contamination profiles of aquatic sediments // Ecotoxicol. Environ. Safety. V. 45. P. 106. https://doi.org/10.1006/eesa.1999.1842
De Pirro M., Chelazzi G., Borghini F. et al. 2001. Variation in cardiac activity following acute exposure to copper in three co-occurred but differently zoned Mediterranean limpets // Mar. Pollut. Bull. V. 42. № 12. P. 1390. https://doi.org/10.1016/S0025-326X(01)00169-2
Falfushynska H.I., Delahaut L., Stolyar O.B. et al. 2009. Multi-Biomarkers Approach in Different Organs of Anodonta cygnea from the Dnister Basin (Ukraine) // Arch. Environ. Contam. Toxicol. V. 57. P. 86. https://doi.org/10.1007/s00244-008-9234-2
Guidi P., Frenzilli G., Benedetti M. et al. 2010. Antioxidant, genotoxic and lysosomal biomarkers in the freshwater bivalve (Unio pictorum) transplanted in a metal polluted river basin // Aquat. Toxicol. V. 100. P. 75. https://doi.org/10.1016/j.aquatox.2010.07.009
Habig W.H., Pabst M.J., Jacoby W.B. 1974. Glutathion-S-transpherase: the first step in mercapture acid formation // J. Biol. Chem. V. 249. P. 7130.
Huggett R.J., Kimerle R.A., Mehrle P.M., Jr., Bergman H.L. 1992. Biomarkers: biochemical, physiological, and histological markers of anthropogenic stress. SETAC special publication series. Boca Raton: Lewis Publishers.
Kholodkevich S.V., Kuznetsova T.V., Trusevich V.V., Kurakin A.S. 2009. Peculiarities of valve movements and cardiac activity in bivalve mollusks under different stressors actions // J. Evol. Biochem. Physiol. V. 45. № 4. P. 524. https://doi.org/10.1134/S0022093009040100
Kholodkevich S.V., Kuznetsova T.V., Sharov A.N. et al. 2017. Applicability of a bioelectronic cardiac monitoring system for the detection of biological effects of pollution in bioindicator species in the Gulf of Finland // J. Marine Systems. V. 171. P. 151. https://doi.org/10.1016/j.jmarsys.2016.12.005
Kholodkevich S.V., Sharov A.N., Chuiko G.M. et al. 2019. Quality Assessment of Freshwater Ecosystems by the Functional State of Bivalved Mollusks // Water Resour. V. 46. № 2. P. 249. https://doi.org/10.1134/S0097807819020064
Klimova Y.S., Chuiko G.M., Gapeeva M.V., Pesnya D.S. 2017. The use of biomarkers of oxidative stress in zebra mussel Dreissena polymorpha (Pallas, 1771) for chronic anthropogenic pollution assessment of the Rybinsk Reservoir // Contemporary Problems of Ecology. V. 10. № 2. P. 178. https://doi.org/10.1134/S199542551702007X
Klimova Y.S., Chuiko G.M., Pesnya D.S., Ivanova E.S. 2020. Biomarkers of Oxidative Stress in Freshwater Bivalve Mollusks (Review) // Inland Water Biol. V. 13. № 4. P. 681. https://doi.org/10.1134/S1995082920060073
Lushchak V.I. 2011a. Adaptive response to oxidative stress: Bacteria, fungi, plants and animals // Comparative Biochemistry and Physiology. Part C. V. 153. P. 175. https://doi.org/10.1016/j.cbpc.2010.10.004
Lushchak V.I. 2011b. Environmentally induced oxidative stress in aquatic animals // Aquat. Toxicol. V. 101. P. 13. https://doi.org/10.1016/j.aquatox.2010.10.006
Magni S., Parolini M., Torre C.D. et al. 2017. Multi-biomarker investigation to assess toxicity induced by two antidepressants on Dreissena polymortha // Sci. Total Environ. V. 578. P. 452. https://doi.org/10.1016/j.scitotenv.2016.10.208
Manduzio H., Rocher B., Durand F. et al. 2005. The point about oxidative stress in mollusks // Information Systems Journal. V. 2. P. 91.
Ostroumov S.A. 2005. Some aspects of water filtering activity of filter-feeders // Hydrobiologia. V. 542(1). P. 275. https://doi.org/10.1007/s10750-004-1875-1
Pallavi P.N., Nagur Babu K., Reddy D.C., Kalarani V. 2012. Antioxidant Defenses and Oxidative Stress Parameters in Tissues of Penaeus monodon Acclimated to Different Salinities // World J. Fish and Marine Sciences. V. 4(5). P. 539. https://doi.org/10.5829/idosi.wjfms.2012.04.05.64103
Parolini M., Magni S., Castiglioni S., Binelli A. 2016. Amphetamine exposure imbalanced antioxidant activity in the bivalve Dreissena polymorpha causing oxidative stress and genetic damage // Chemosphere. V. 144. P. 207. https://doi.org/10.1016/j.chemosphere.2015.08.025
Richardson B.J., Mak E., De Luca-Abbott S.B. et al. 2008. Antioxidant responses to polycyclic aromatic hydrocarbons and organochlorine pesticides in green-lipped mussels (Perna viridis): do mussels “integrate” biomarker responses? // Mar. Poll. Bull. V. 57. P. 503. https://doi.org/10.1016/j.marpolbul.2008.02.032
Towle DW. 1997. Molecular approaches to understanding salinity adaptation of estuarine animals // Am. Zool. V. 37. P. 575.
Turja R., Soirinsuo A., Budzinski H. et al. 2013. Biomarker responses and accumulation of hazardous substances in mussels (Mytilus trossulus) transplanted along a pollution gradient close to an oil terminal in the Gulf of Finland (Baltic Sea) // Comp. Biochem. Physiol. Part C. V. 157. P. 80. https://doi.org/10.1016/j.cbpc.2012.09.006
Turja R., Lehtonen K.K., Meierjohann A. et al. 2015. The mussel caging approach in assessing biological effects of wastewater treatment plant discharges in the Gulf of Finland (Baltic Sea) // Marine Pollution Bulletin. V. 97(1–2). P. 135. https://doi.org/10.1016/j.marpolbul.2015.06.024
Viarengo A., Canesi L., Pertica M., Livingstone D.R. 1991. Seasonal variations in the antioxidant defence systems and lipid peroxidation of the digestive gland of mussels // Comp. Biochem. Physiol. V. 100C. P. 187. https://doi.org/10.1016/0742-8413(91)90151-I
Wang Youji, Menghong Hu, Wai Hing Wong et al. 2011. The combined effects of oxygen availability and salinity on physiological responses and scope for growth in the green-lipped mussel Perna viridis // Marine Pollution Bulletin. V. 63. P. 255. https://doi.org/10.1016/j.marpolbul.2011.02.004
Yeats P., Gagné F., Hellou J. 2008. Body burden of contaminants and biological effects in mussels: an integrated approach // Environ. Inter. V. 34. P. 254. https://doi.org/10.1016/j.envint.2007.08.009
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод



