Биология внутренних вод, 2021, № 6, стр. 640-650
Токсичность донных отложений Рыбинского водохранилища по многолетним данным биотестирования. Сообщение 1. Токсикологические исследования
И. И. Томилина a, *, Р. А. Ложкина a, М. В. Гапеева a
a Институт биологии внутренних вод им. И.Д. Папанина Российской академии наук
пос. Борок, Некоузский р-н, Ярославская обл., Россия
* E-mail: i_tomilina@mail.ru
Поступила в редакцию 17.11.2020
После доработки 16.06.2021
Принята к публикации 22.06.2021
Аннотация
Представлены многолетние данные по изменению токсичности водной вытяжки и нативных донных отложений Рыбинского водохранилища. Несмотря на высокую вариабельность токсикологических характеристик донных отложений, усредненные данные результатов биотестирования свидетельствуют об их стабильности. Токсичность донных отложений неоднородна: наиболее высока у населенных пунктов и на станциях, находящихся в зоне влияния Череповецкого индустриального комплекса. Для Шекснинского плеса отмечено снижение индекса токсичности по показателю “плодовитость” ветвистоусого рачка Сeriodaphnia dubia и по изменению размеров личинок Chironomus riparius. Проведен анализ зависимости между параметрами токсичности и показателями химического состава донных отложений. Выявлены достоверные корреляционные связи гибели и изменения размеров личинок хирономид от физико-химических характеристик грунта и содержания загрязняющих веществ в донных отложениях.
ВВЕДЕНИЕ
Поверхностные воды бассейна р. Волги по данным государственного доклада “О состоянии и использовании водных ресурсов Российской Федерации в 2017 году” испытывают антропогенную нагрузку источников загрязнения разного масштаба и разной степени опасности (Государственный…, 2018). В 2008–2017 гг. вода верхневолжских водохранилищ почти во всех створах наблюдений оценивалась как “загрязненная”; на участке Рыбинского вдхр. ниже г. Череповец, находящегося под влиянием сточных вод предприятий города в течение многолетнего периода, – как “сильно загрязненная”.
Рыбинское водохранилище – один из крупнейших пресноводных искусственных водоемов России, образованный в Молого-Шекснинской низине после строительства гидроузла выше г. Рыбинска на реках Шексна и Волга (Буторин и др., 1975). По морфологическим особенностям ложа и распределению глубин в водоеме выделено четыре плеса: Волжский, Моложский, Шекснинский и Центральный (Рыбинское…, 1972).
Водохранилище с момента его образования и по настоящее время подвергается антропогенному загрязнению ТМ и СОЗ, включающему их прямой локальный сброс с коммунально-промышленными сточными водами, диффузный смыв с прилегающих территорий и атмосферный перенос. Основной источник поступления токсических веществ – коммунально-промышленный комплекс г. Череповца, расположенный в северной части Шекснинского плеса водохранилища (Чуйко и др., 2010; Гапеева, 2013). В ДО происходит аккумуляция большей части органических и неорганических (в том числе наиболее опасных и токсичных) веществ, которые при определенных условиях (ветровое взмучивание, изменение pH и Eh, водности, проведение дноуглубительных работ и т.д.) могут переходить в водную толщу, вызывая ее вторичное загрязнение.
Загрязнение ДО Рыбинского вдхр. ТМ, полиароматическими углеводородами и СОЗ (количественно преобладают полихлорированные бифенилы) носит пространственно неоднородный характер. Наиболее высокие концентрации ЗВ зарегистрированы в Шекснинском плесе в черте г. Череповец. При этом максимальные различия содержания СОЗ между станциями достигают >1600 раз (Чуйко, Подгорная, 2018), в остальной части водохранилища они находятся в фоновых количествах. Донные отложения водохранилища по содержанию ТМ за годы наблюдений не отвечали стандартам, принятым в европейских странах, поскольку отмечено превышение концентраций Cd (1985–1997 гг.), Cr (1997, 2009, 2015 гг.), Cu, Ni, Pb (1985, 1996 гг.) и Zn (1985–1997, 2010 гг.). Максимальная кратность превышения была для Cd – 5.8, Cr – 1.94, Cu – 2.2, Pb – 1.4 и Zn – 3.6 раз (Томилина и др., 2018а).
Считается, что наилучшая интегральная оценка состояния водоемов может быть получена методами биотестирования с помощью живых тест-объектов (Гуревич, 2002; Schulze-Sylvester et al., 2016; Burton, 2018). Результатом биотестирования является сигнальная информация о месте и степени токсичности различных сред водного объекта (Juvonen et al., 2000; Baran, Tarnawski, 2015). В настоящее время оценка токсичности ДО пресноводных экосистем включена в число обязательно рассматриваемых характеристик экологического состояния водных объектов многих европейских стран и США (ASTM, 1994; MacDonald et al., 2000; Kalinowski, Zaleska-Radziwill, 2011; Batley et al., 2005). В Российской Федерации не существует единых федеральных нормативов содержания ЗВ и их смесей в ДО и законодательных основ для их установления (Михайлова, Степанова, 2017). Вместе с тем, информация о состоянии водных объектов без учета сведений о загрязненности и токсичности ДО будет неполной. Поэтому контроль состава ДО водоемов и проведение их биотестирования предусмотрены Единой государственной системой мониторинга водных объектов.
Сочетание данных химического анализа и исследований ответных реакций живых организмов позволяет установить причинно-следственные связи между антропогенным воздействием и наблюдаемыми откликами, определить устойчивость экосистемы, прогнозировать дальнейшее развитие и состояние района исследования (Олькова, 2014).
Цель работы – оценить изменения токсичности донных отложений Рыбинского водохранилища за длительный период и выявить возможную зависимость между токсикологическими и химическими показателями.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Для отбора проб ДО на различных участках Рыбинского водохранилища (рис. 1) в период 1994–2019 гг. использовали модифицированный дночерпатель Экмана-Берджи (ДАК-250) с площадью захвата 1/40 м2. Поверхностный слой ДО отбирали в трех повторностях. Высота колонки была 7–10 см. Проводили биотестирование ВВДО и нативных (цельных с естественной влажностью без дополнительной подготовки) проб грунта. Для этого необработанную пробу во влажном состоянии просеивали через сито с порами от 0.5 до 1.5 мм для удаления крупной гальки, живых и мертвых моллюсков, обломков растений и отмерших организмов. Интегральную пробу хранили в холодильнике в герметичных пластиковых пакетах при температуре +2…+4°С до начала биотестирования ≤14 сут. Для получения водной вытяжки к влажному грунту массой 100 г добавляли отстоянную артезианскую воду (рН 7.6 ± 0.4, перманганатная окисляемость <3.0 мг О/дм3, жесткость 4.9 мг-экв/дм3, железо общее 0.7 ± 0.23, нитраты 1.1 ± 0.31, хлориды 7.9 ± 0.80, сульфаты 17.9 ± 1.79 мг/л – по данным аналитического центра Института биологии внутренних вод им. И.Д. Папанина РАН) в соотношении 1 : 4 и готовили по стандартной методике (Проведение…, 2002).
Рис. 1.
Карта-схема исследованных станций Рыбинского вдхр. Волжский плес (I): 1 – дер. Крутец, 2 – г. Мышкин, против р. Юхоть, 3 – с. Еремейцево, 4 – с. Коприно, 5 – пос. Каменники; Моложский плес (II): 6 – дер. Противье, 7 – устье р. Себлы, 8 – г. Весьегонск; Центральный плес (III): 9 – русло р. Волга у затопленного г. Молога, 10 – дер. Наволок, 11 – Городок, 12 – дер. Измайлово, 13 – убежище Средний Двор, 14 – Центральный мыс, 15 – пос. Брейтово, 16 – устье р. Сить, 17 – пристань Первомайка, 18 – дер. Волково, 19 – дер. Милюшино, 20 – с. Всехсвятское, 21 – устье р. Ухры, 22 – устье р. Согожи, 23 – с. Ягорба; Шекснинский плес (IV): 24 – с. Мякса, 25 – с. Любец, 26 – остров Карагач, 27 – остров Ваганиха, 28 – р. Суда против турбазы Торово, 29 – р. Суда у ж/д моста, 30 – устье р. Кошта, 31 – р. Кошта у а/м моста, 32 – устье р. Серовки, 33 – дер. Кабачино.

Определение токсичности ВВДО проводили с использованием планктонных ветвистоусых ракообразных Ceriodaphnia dubia Richard, 1894. Критерий острой токсичности – гибель 50% особей за 48 ч, хронической – >20% за 7 сут или до вымета трех пометов на одну самку и достоверное снижение репродуктивных показателей за этот же период (Mount, Norberg, 1984; Методика…, 2007).
В качестве тест-организма при биотестировании нативных ДО использовали лабораторную культуру комара-звонца Chironomus riparius Meigen, 1804. Токсичность ДО оценивали по изменению смертности и линейных размеров личинок. Продолжительность эксперимента ~20 сут – до достижения 80% личинок стадии IV возраста.
Для получения сопоставимых результатов биотестирования рассчитывали ИТ – величину, выраженную в долях от единицы по каждому измеряемому показателю по формуле:
ИТ = ТПо/ТПк,
где ТПо – значение тест-параметра в опыте, ТПк – значение тест-параметра в контроле. Все эксперименты проводили в двух повторностях. В опытах поддерживали оптимальные условия среды: температуру воды – 21 ± 3°С, рН 7.5–8.0, растворенный кислород – на уровне насыщения, световой режим при освещении лампами дневного света – 16 ч свет: 8 ч ночь. Контролем служили интактные тест-организмы, содержащиеся в лабораторных условиях в отстоянной артезианской воде и илистом песке. В качестве контрольного грунта использовали ДО устья р. Сутки (приток Рыбинского вдхр.). При установлении корреляционных связей между результатами биотестирования и химико-аналитических исследований использовали собственные данные и имеющиеся в литературе (Гапеева, Цельмович, 1989, 1990; Гапеева, 1993; Законнов, 2007, 2018; Чуйко и др., 2010; Гапеева, 2013; Сигарева, Тимофеева, 2018; Петров и др., 2018; Томилина и др., 2018а, 2018б; Минеева и др., 2021).
Данные представляли в виде средних значений и их ошибок (D ± SE). Достоверность различий оценивали методом дисперсионного анализа (ANOVA, LSD-тест) при уровне значимости р ≤ 0.05 (Sokal, Rohlf, 1995). Если значения параметров не имели нормального распределения (Shapiro-Wilktest), использовали непараметрический коэффициент Спирмена (rs, р ≤ 0.05).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
За период наблюдений с 1994 г. по 2015 г. при биотестировании ВВДО не зарегистрировано острой токсичности проб ни на одной из станций, т.е. в течение 48 ч не отмечено гибели цериодафний ≥50%. Увеличение экспозиции до 7 сут приводило к достоверному относительно контроля повышению смертности рачков на отдельных станциях (ст. 27–32) Шекснинского плеса (рис. 1) в разные периоды наблюдений.
Усредненные значения плодовитости рачков, выраженные как ИТ, для всех плесов были ниже контрольных за весь период наблюдений, за исключением 2011 г. (табл. 1).
Таблица 1.
Индекс токсичности ВВДО по среднему количеству молоди на 1 самку Сeriodaphnia dubia для плесов Рыбинского водохранилища
| Год | Плес | ||||
|---|---|---|---|---|---|
| Моложский | Центральный | Волжский | Шекснинский | Cреднее | |
| 1993 | – | 1.18 ± 0.12 (3) | 1.13 ± 0.09 (7) | – | 1.15 ± 0.07 (10) |
| 1994 | – | 0.45 ± 0.05 (5) | 0.72 ± 0.17 (6) | 0.63 ± 0 (1) | 0.60 ± 0.09 (12) |
| 1996 | 0.74 ± 0 (1) | 0.73 ± 0.07 (2) | – | 0.70 ± 0.15 (7) | 0.71 ± 0.10 (10) |
| 1998 | – | 0.69 ± 0.08 (4) | – | 0.63 ± 0.03 (10) | 0.65 ± 0.03 (14) |
| 2007 | – | 0.78 ± 0.03 (2) | – | 0.92 ± 0.04 (3) | 0.86 ± 0.04 (5) |
| 2008 | 0.83 ± 0.10 (2) | 0.87 ± 0.08 (19) | 0.93 ± 0.27 (3) | 0.86 ± 0.12 (12) | 0.87 ± 0.06 (36) |
| 2009 | 0.76 ± 0b (1) | 0.50 ± 0.05ab (9) | 0.31 ± 0.07a (2) | 0.36 ± 0.05a (9) | 0.43 ± 0.04 (21) |
| 2010 | 0.85 ± 0 (1) | 0.93 ± 0.08 (8) | 0.80 ± 0.03 (2) | 0.83 ± 0.06 (5) | 0.88 ± 0.04 (16) |
| 2011 | – | 1.34 ± 0.18 (6) | 1.57 ± 0 (1) | 1.33 ± 0.34 (3) | 1.36 ± 0.14 (10) |
| 2012 | – | 0.70 ± 0.04b (7) | 0.32 ± 0a (1) | 0.44 ± 0.02a (2) | 0.61 ± 0.05 (10) |
| 2013 | 0.69 ± 0 (4) | 0.70 ± 0.06 (19) | 0.77 ± 0 (1) | 0.79 ± 0.05 (12) | 0.73 ± 0.03 (36) |
| 2014 | – | 0.70 ± 0.1 (2) | – | 0.67 ± 0.07 (12) | 0.68 ± 0.06 (14) |
| 2015 | – | 0.92 ± 0.09 (9) | 0.68 ± 0.13 (5) | – | 0.83 ± 0.08 (14) |
| Cреднее | 0.75 ± 0.04 | 0.80 ± 0.03 | 0.81 ± 0.07 | 0.72 ± 0.04 | 0.77 ± 0.02 |
Примечание. Здесь и в табл. 2 в скобках – количество проб. Значения, выделенные жирным шрифтом, достоверно различаются в строках.
При сравнении показателя между плесами наблюдали его выровненность, т.е. среднее количество молоди, полученное от одной самки, достоверно между плесами не различалось, за исключением 2009 и 2012 гг. В 2009 г. индекс токсичности ВВДО Волжского и Шекснинского плесов был достоверно ниже, чем Моложского плеса, в 2012 г. – Центрального. Самый низкий средний многолетний показатель (без учета года наблюдений) выявлен для Шекснинского плеса (табл. 1). Установлено, что ВВДО оказывала постоянное токсическое действие на плодовитость рачков, угнетая ее на 20–50%, кроме 2011 г., когда отмечали стимуляцию размножения на 36% (табл. 1).
При биотестировании нативных ДО за период наблюдений с 1998 по 2019 гг. 100%-ную гибель личинок хирономид ежегодно наблюдали лишь на грунтах, отобранных в устье р. Серовки (cт. 32). Гибель >40% особей регистрировали для всех плесов водохранилища, за исключением Моложского: в Шекснинском плесе на ст. 24–30, 33; Центральном – ст. 9–15; Волжском – ст. 2, 3 и 5 (рис. 1).
Средний ИТ нативных ДО по изменению размеров тела личинок хирономид в разные годы менялся незначительно, минимальное значение зарегистрировано в 2014 г. в Центральном плесе, максимальное – в 2009 г. в Моложском плесе (табл. 2). В 2009 г. отмечено недостоверное стимулирующее действие ДО на рост личинок хирономид для всех плесов – превышение в 1.19–1.35 раза. Зарегистрированы достоверные различия ИТ в 2008 г. между Моложским и Волжским плесами, 2010 г. – Волжским, Центральным и Шекснинским, 2013 г. – Моложским и Шекснинским (табл. 2). Средний индекс токсичности нативных ДО Шекснинского плеса без учета года наблюдений был ниже такового по сравнению с остальными плесами водохранилища, достоверно – с Центральным плесом.
Таблица 2.
Индекс токсичности нативных ДО по изменению размеров личинок Chironomus riparius на различных плесах Рыбинского водохранилища
| Год | Плес | ||||
|---|---|---|---|---|---|
| Моложский | Центральный | Волжский | Шекснинский | Cреднее | |
| 1998 | – | 0 ± 0 (1) | 1.06 ± 0.12 (2) | – | 0.71 ± 0.36 (3) |
| 2006 | – | 1.19 ± 0.11 (3) | – | 1.12 ± 0.11 (4) | 1.15 ± 0.07 (7) |
| 2008 | 0.83 ± 0.03а (2) | 1.07 ± 0.0ab (24) | 1.34 ± 0.16b (2) | 0.97 ± 0.13ab (9) | 1.05 ± 0.04 (37) |
| 2009 | 1.35 ± 0 (1) | 1.19 ± 0.05 (9) | 1.27 ± 0.06 (2) | 1.00 ± 0.19 (9) | 1.13 ± 0.09 (21) |
| 2010 | 0.81 ± 0ab (1) | 0.84 ± 0.04a (8) | 1.13 ± 0.26b (2) | 0.71 ± 0.07а (5) | 0.85 ± 0.05 (16) |
| 2011 | – | 0.90 ± 0.07 (6) | 0.68 ± 0 (1) | 0.91 ± 0.23 (2) | 0.87 ± 0.07 (9) |
| 2012 | 0.74 ± 0 (1) | 0.95 ± 0.07 (7) | 0.98 ± 0.01 (2) | 0.96 ± 0.07 (2) | 0.94 ± 0.05 (12) |
| 2013 | 1.07 ± 0.03b (4) | 0.86 ± 0.03ab (21) | 0.89 ± 0ab (1) | 0.68 ± 0.13а (11) | 0.83 ± 0.04 (37) |
| 2014 | – | 0.60 ± 0.06 (2) | – | 0.89 ± 0.13 (12) | 0.85 ± 0.13 (14) |
| 2015 | – | 0.94 ± 0.10 (9) | 0.83 ± 0.04 (5) | – | 0.91 ± 0.06 (14) |
| 2016 | 0.67 ± 0 (1) | 0.80 ± 0.04 (25) | 0.84 ± 0.06 (5) | 0.94 ± 0.04 (10) | 0.85 ± 0.03 (41) |
| 2017 | – | 0.75 ± 0.02 (7) | 0.88 ± 0.05 (4) | 0.76 ± 0.03 (17) | 0.79 ± 0.02 (28) |
| 2018 | 0.90 ± 0.07 (9) | 1.08 ± 0.04 (16) | 0.85 ± 0.13 (9) | 0.88 ± 0.07 (35) | 0.92 ± 0.04 (69) |
| 2019 | 0.99 ± 0.03 (13) | 1.03 ± 0.03 (24) | 1.00 ± 0.03 (8) | 0.97 ± 0.03 (18) | 1.00 ± 0.01 (63) |
| Cреднее | 0.95 ± 0.03ab | 0.95 ± 0.02b | 0.95 ± 0.04ab | 0.88 ± 0.03a | 1.0 ± 0.01b |
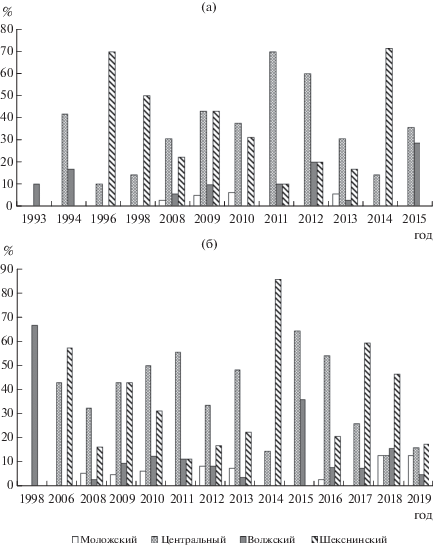
Рассматривая значения доли станций, на которых зарегистрировано ХТД, следует отметить, что доля станций с выявленной токсичностью нативных ДО выше, чем с токсичностью ВВДО (рис. 2). Для ВВДО (рис. 2а), как и для нативных ДО (рис. 2б), максимальная доля станций с ХТД отмечена для Шекснинского и Центрального плесов.
Доля станций с ХТД водной вытяжки донных отложений, отобранных в Моложском плесе, не превышала 6.5%, в Волжском – 29% (рис. 2а). Для Центрального плеса максимальные значения доли станций с ХТД зафиксированы в 2011 и 2012 гг. (70 и 60% соответственно), минимальные – в 1996 и 2014 гг. (10 и 14.3% соответственно). Максимальная доля станций с выявленной хронической токсичностью ВВДО Шекснинского плеса отмечена в 1996, 1998 и 2014 гг., минимальная – в 2011 г.
В Моложском плесе минимальная доля станций с ХТД нативных ДО, как и ВВДО, не превышала 12.7% (рис. 2б). Для Волжского плеса в 1998 и 2015 гг. зафиксированы максимальные значения доли станции с выявленной хронической токсичностью нативных ДО (66.7 и 35.7% соответственно). Для большинства станций Центрального плеса доля станций с ХТД была 30–60%, минимальные значения получены в 2014, 2018 и 2019 гг. Для Шекснинского плеса Рыбинского вдхр. максимальная доля станций с ХТД отмечена в 2014 г., в 2008, 2011–2013, 2016 и 2019 гг. она не превышала 17.5%.
Выявлены связи биологических параметров, применяемых при биотестировании тест-организмов, от некоторых веществ и физико-химических свойств ДО (табл. 3). При биотестировании водной вытяжки отмечены достоверные корреляционные связи (р ≤ 0.05) между содержанием ионов Ca, Mn и Sr в ДО и средним числом пометов на одну самку, содержанием K и Sr и средним количеством молоди, полученным от одной самки Ceriodaphnia dubia.
Таблица 3.
Коэффициент корреляции по Спирмену (в скобках) между содержанием химических элементов, гидрологическими показателями и биологическими параметрами тест-организмов при биотестировании водной вытяжки и цельных донных отложений Рыбинского водохранилища p ≤ 0.05
| Год | Параметр тест-организма | Химические элементы и гидрологические показатели |
|---|---|---|
| Ceriodaphnia dubia | ВВДО | |
| 2015 | Среднее число пометов | Ca (–0.62), Mn (–0.59), Sr (–0.67) |
| Среднее количество молоди на 1 самку | K (–0.55), Sr (–0.58) | |
| Chironomus riparius | ДО | |
| 2008 | Гибель | Ge (–0.58), Rh (–0.48) |
| Размеры тела | Rb (0.40), La (0.38), Ce (0.47), Pr (0.47), Nd (0.45), sum REE (0.47) | |
| 2013 | Размеры тела | Be (0.83), Mn (0.82), sum REE (0.83) |
| 2014 | Гибель | Mn (0.58), Fe (0.64), As (–0.64), естественная влажность (0.72), объемная сухая масса (–0.68), органическое вещество (0.68), хлорофилл + + феопигменты (0.67), средний диаметр частиц грунта (–0.62) |
| Размеры тела | Be (0.66), Sc (0.69), V (0.65), Mn (0.66), Fe (0.61), Ga (0.69), Y (0.65), Eu (0.69), Ho (0.63), Er (0.64), Tm (0.69), Yb (0.69), Lu (0.69), органическое вещество (0.61), хлорофилл + феопигменты (0.57) | |
| 2015 | Гибель | Cr (–0.54), Gd (–0.53), Dy (–0.53) |
| Размеры тела | Li (–0.6), Ti (–0.6), Ge (–0.6), Rb (–0.55), Zr (–0.69), Nb (–0.59), Mo (–0.64), Sb (–0.61), Cs (–0.57), Ba (–0.6), Lu (–0.58), Hf (–0.68), W (–0.54), Tl (–0.61), U (–0.75) | |
| 2016 | Гибель | Частицы грунта >1 мм (0.38) |
| Размеры тела | Частицы грунта >1 мм (–0.36) | |
Гибель и размеры личинок комара Chironomus riparius зависели от физико-химических характеристик тестируемых ДО (размер частиц грунта, их средний диаметр, влажность, объемная масса, содержание органического вещества) и от концентраций ЗВ. Получена корреляционная связь биологических параметров личинок хирономид с содержанием в ДО легких (Ce, Pr, Nd) и тяжелых (Gd, Dy, Er, Lu) редкоземельных элементов и их суммы. Выявлена корреляционная связь гибели личинок и их размеров от содержания хлорофилла и феопигментов в ДО (табл. 3).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Отсутствие острой токсичности проб и низкая смертность рачков Ceriodaphnia dubia за период 7–10 сут при биотестировании ВВДО дают основание утверждать, что большинство проб ВВДО безопасны по показателю выживаемости за весь период наблюдений. Исключение составляют пробы, отобранные на станциях Шекснинского плеса, где регистрировали хроническое токсическое действие ВВДО по показателю “выживаемость” рачков. Для прогноза развития популяции наиболее важным показателем является “плодовитость” (Александрова, 2009; Жмур, 2018). Несмотря на тенденцию сокращения количества молоди, полученного от одной самки при биотестировании ВВДО Рыбинского вдхр., усредненные значения данного показателя достоверно различались лишь в нескольких случаях: индекс токсичности ВВДО Шекснинского и Волжского плесов в 2009 г. был ниже такового для Моложского плеса, в 2012 г. – для Центрального плеса (табл. 1). Установлено, что индекс токсичности ВВДО по показателю “плодовитость” (без учета года наблюдения) для Шекснинского и Моложского плесов ниже контрольного значения, принятого за единицу, если при статистической обработке результатов биотестирования применять не достоверность различия результатов с использованием критерия ANOVA, как в нашем случае, а показатель отклонения параметра на ≥25% по сравнению с контролем (Оценка…, 2006).
Токсичность ВВДО для гидробионтов может быть обусловлена присутствием в них водорастворимых соединений, к которым относятся ионы ТМ, некоторые пестициды и полиароматические углеводороды и др. Прямых корреляционных связей между содержанием этих загрязняющих веществ в ДО Рыбинского вдхр. и изменениями биологических параметров цериодафний не выявлено (табл. 3). Все металлы, с которыми установлены корреляционные связи, активно участвуют в биологических процессах, входят в состав ферментов и необходимы для организма. Отмечено, что исходное поколение ветвистоусых рачков Sida crystallina O.F. Müller, 1776 и Сeriodaphnia affinis Lilljeborg, 1900 при действии минеральных веществ (калий, кальций, магний) реагирует снижением выживаемости, плодовитости и задержкой полового созревания (Пименова, 2002).
Несмотря на то, что ВВДО является репрезентативной фракцией для предсказания токсичности цельного грунта (Ankley et al., 1991), анализ токсичности только водной вытяжки дает представление о токсичности растворимых фракций загрязняющих веществ. Личинки хирономид Chironomus riparius относятся к наиболее экологически адекватным тест-организмам (по сравнению с Ceriodaphnia dubia) для оценки токсичности ЗВ, аккумулированных в нативных ДО.
Выживаемость хирономид, как и выживаемость цериодафний, в большинстве случаев сохранялась на уровне 80–100%. У личинок хирономид 100%-ную гибель ежегодно наблюдали лишь на грунтах, отобранных в устье р. Серовка, куда сбрасывают стоки несколько промышленных предприятий г. Череповец, включая ОАО “Северсталь”, и вода в реке соответствует категории “предельно грязная” (Петров и др., 2018). Гибель ≥40% особей (выше допустимого методикой 20%‑ного уровня) регистрировали для всех плесов водохранилища, за исключением Моложского.
Выживаемость тест-объектов – основной тестируемый параметр при установлении токсичности различных сред природных водоемов, хотя подобные тесты часто позволяют выявить лишь приблизительно токсичность исследуемых проб. Более перспективным в качестве показателей представляется использование физиологических (изменение размеров), и более того, морфологических отклонений от нормы (мальформации структур ротового аппарата), которым предшествуют определенные биохимические процессы, служащие первопричиной изменения физиологического состояния тест-организмов, ухудшения качества их потомства или гибели.
ИТ по изменению линейных размеров личинок хирономид без учета года наблюдений был ниже в Шекснинском плесе, достоверно отличаясь только от Центрального (табл. 2), т.е. за все годы наблюдений средние размеры личинок хирономид при экспозиции на ДО Шекснинского плеса были ниже, чем в других плесах и не достигали контрольных значений. Водные массы и донные отложения Шекснинского плеса подвергаются наибольшему антропогенному влиянию, исследования последних лет выявили значительное содержание ТМ в его ДО. По степени загрязнения Cu Шекснинский плес можно отнести к “очень сильно загрязненному”, Zn – “умеренно загрязненному” и “заметно загрязненному” (Томилина и др., 2018б). За период наблюдений 1985–2014 гг. отмечена тенденция снижения концентраций ТМ в ДО Шекснинского плеса, причем в период 1997–2014 гг. концентрации ТМ почти не изменялась, за исключением Zn и Pb (Томилина и др., 2018а, 2018б). Кроме того, последние 30 лет Рыбинское водохранилище подвергается загрязнению СОЗ: наиболее высокий уровень наблюдается в Шекснинском плесе водохранилища в черте г. Череповца, на остальной акватории он близок к фоновому (Чуйко и др., 2010; Чуйко, Подгорная, 2018). Наибольшие концентрации полиароматических углеводородов и полихлорированных бифенилов во всех элементах экосистемы отмечены в 1987–1990 гг. после аварийного сброса промышленно-коммунальных стоков г. Череповца. В последующие годы содержание этих веществ в биоте постепенно снижалось, в то время как в ДО существенно не изменялось (Чуйко, Подгорная, 2018).
Результаты корреляционного анализа показали, что ни ТМ, ни СОЗ не оказывали прямого воздействия на биологические параметры тест-организмов (табл. 3). Установлена корреляционная зависимость изменения биологических параметров тест-организмов от присутствия редкоземельных элементов в ДО. Один из основных факторов, определяющих экологическую опасность редкоземельных элементов, – это их биодоступность. Механизм их поглощения в биологических системах сходен с таковым для кальция. Во время линьки гидробионты активно поглощают кальций, что способствует проникновению элементов во внутреннюю среду и возникновению токсических эффектов для организма (Das et al., 1988). Кроме того, действие редкоземельных элементов, как и других элементов, на биоту пресноводных водоемов подчиняется закону экологического оптимума, согласно которому каждый экологический фактор имеет определенные пределы положительного влияния на организмы. Теоретически как недостаточные, так и избыточные концентрации ЗВ могут отрицательно сказываться на жизнедеятельности организмов.
Несмотря на то, что статистически значимых корреляционных зависимостей токсикологических показателей от содержания СОЗ в грунте выявить не удалось, в более ранних работах (Томилина и др., 2011) отмечено, что наиболее высокий процент деформаций ментума личинок хирономид, экспонированных на грунтах Рыбинского вдхр. совпадает с повышенным уровнем общего содержания полихлорированных бифенилов, включая и токсичные конгенеры. Также установлено, что токсичность нативного грунта для водных беспозвоночных (цериодафний и амфипод) на 78% обусловлена присутствием в нем органических загрязняющих веществ (Флеров и др., 2000).
Изменение размеров тела личинок хирономид зависело от содержания растительных пигментов (сумма хлорофилла а с феопигментами), которое можно рассматривать как остаточное количество новообразованного органического вещества в ДО. Подобную зависимость в водохранилищах р. Волги авторы отмечали и ранее (Томилина и др., 2018б). Косвенным подтверждением этого служит и выявленная достоверная положительная связь между биомассой макрозообентоса и концентрацией осадочных пигментов в ДО (Тимофеева и др., 2018; Перова, 2019).
Возможно, результаты биотестирования могут оказаться более адекватными, чем выявленные корреляции, поскольку они оценивают токсичность на основе биологических параметров и указывают на интегральное неблагоприятное воздействие ЗВ на водные организмы. Однако биотесты не проясняют, какое именно вещество вызывает наблюдаемую токсичность (Montero et al., 2013). В свою очередь метод корреляционного анализа имеет ряд недостатков, а именно: соединения, вызывающие наблюдаемую токсичность, могут быть не включены в список исследованных веществ; уровни содержания токсичных веществ могут варьировать; затруднена оценка биодоступности загрязняющих веществ; результаты биотестирования не всегда совпадают с химико-аналитическими данными, что, вероятно, связано с комбинированным воздействием компонентов загрязнения, когда в результате трансформации, антагонистических и синергических взаимодействий реальный токсический эффект отличается от прогностического (Wang et al., 2010); проблематична экстраполяция полученных результатов на природные водоемы при использовании одного-двух тест-объектов в лабораторных экспериментах.
Максимальная доля станций с ХТД как для ВВДО, так и для нативных ДО отмечена для Шекснинского и Центрального плесов (рис. 2). Рассчитанные средние значения не имели каких-либо годовых тенденций и не были связаны с гидрологическими или климатическими параметрами. Наибольшая доля станций с хроническим токсическим действием ВВДО и нативных ДО зарегистрирована для Шекснинского плеса в 2014 г. (рис. 2). В этом же году отмечен максимальный коэффициент загрязненности воды Шекснинского плеса медью. Суммарный коэффициент загрязненности воды, рассчитанный для шести тяжелых металлов, был выше в Шекснинском плесе, достоверно не отличаясь от остальных (Ложкина и др., 2020).
Для экотоксикологической оценки состояния водоемов используют ограниченное количество доступных показателей. Данные о токсичности ДО – необходимая составляющая в общей оценке состояния водной экосистемы (Степанова и др., 2004). Для природных водоемов характерна чрезвычайная вариабельность уровней загрязняющих веществ во времени и пространстве, которая может зависеть от множества факторов: сезонности, уровня паводка, гидрологических и морфометрических характеристик водоема и его водосбора и т.д.
Таким образом, ДО служат важным источником информации об условиях, существующих на водосборе и непосредственно в водоеме, и позволяют судить о состоянии водоема в целом. Ассортимент методов биологического тестирования, применяемых в настоящее время в исследовательских целях, достаточно обширен, однако список методов, используемых для практического биотестирования природных и сточных вод, ДО и почв в России, немногочислен (Жмур, 2018). Сопоставление результатов биотестирования с химико-аналитическими и гидробиологическими данными позволит наиболее информативно и комплексно оценить качество донных отложений как среды обитания гидробионтов.
Выводы. Результаты многолетних исследований токсичности ДО Рыбинского водохранилища свидетельствуют о том, что ситуация с их токсическим загрязнением, как и неравномерная токсичность, в целом сохраняются. К наиболее неблагоприятному участку Рыбинского водохранилища относится Шекснинский плес, где зарегистрированы самые низкие средние значения индексов токсичности (без учета года наблюдений) как для ВВДО, так и для нативных ДО, и высокие значения доли станций с выявленной хронической токсичностью. Выявлены достоверные корреляционные связи гибели и изменения размеров личинок комара Chironomus riparius с физико-химическими характеристиками грунта, содержанием металлов, редкоземельных элементов, хлорофилла и феопигментов в ДО.
Список литературы
Александрова В.В. 2009. Применение метода биотестирования в анализе токсичности природных и сточных вод (на примере Нижневартовского района Тюменской области). Нижневартовск: Изд-во Нижневарт. гуманитар. ун-та.
Бакаева Е.Н., Никаноров А.М., Игнатова Н.А. 2009. Место биотестирования донных отложений в мониторинге поверхностных вод суши // Вестник Южного научного центра. Т. 5. № 2. С. 86.
Буторин Н.В., Зиминова Н.А., Курдин В.П. 1975. Донные отложения Верхневолжских водохранилищ. Ленинград: Наука.
Гапеева М.В. 1993. Биогеохимическое распределение тяжeлых металлов в экосистеме Рыбинского водохранилища // Современное состояние экосистемы Рыбинского водохранилища. Санкт-Петербург: Гидрометеоиздат. С. 42.
Гапеева М.В. 2013. Тяжелые металлы в воде и донных отложениях Рыбинского водохранилища // Вода: химия и экология. № 5. С. 3.
Гапеева М.В., Цельмович О.Л. 1989. О распределении тяжелых металлов в донных отложениях Куйбышевского и Рыбинского водохранилищ // Вод. ресурсы. Т. 1. С. 170.
Гапеева М.В., Цельмович О.Л. 1990. Перераспределение тяжелых металлов в Шекснинском плесе Рыбинского водохранилища в связи с аварийными ситуациями // Гидрохимические материалы. Т. 109. С. 132.
Государственный доклад “О состоянии и использовании водных ресурсов Российской Федерации в 2017 году”. 2018. Москва: НИА-Природа.
Гуревич В.И. 2002. Современный седиментогенез и геоэкология Западно-Арктического шельфа Евразии. Москва: Научный мир.
Жмур Н.С. 2018. Экотоксикологический контроль. Приемы исследования и лабораторная практика. Москва: Издательство “АКВАРОС”.
Законнов В.В. 2007. Осадкообразование в водохранилищах Волжского каскада: Автореф. дис. … докт. геогр. наук. Москва.
Законнов В.В. 2018. Характеристика донных отложений // Структура и функционирование экосистемы Рыбинского водохранилища в начале XXI века. Москва: Изд-во РАН. С. 59. https://doi.org/10.31857/S9785907036185000001
Ложкина Р.А., Томилина И.И., Гапеева М.В. 2020. Долговременные изменения качества воды Рыбинского водохранилища по данным биотестирования // Трансформация экосистем. № 3. С. 125.
Методика определения токсичности воды и водных вытяжек из почв, осадков сточных вод, отходов по смертности и изменению плодовитости цериодафний. 2007. Федеральный реестр. ФР.1.39.2007.03221. Москва: АКВАРОС.
Минеева Н.М., Степанова И.Э., Семадени И.В. 2021. Биогенные элементы и их роль в развитии фитопланктона водохранилищ Верхней Волги // Биол. внутр. вод. № 1. С. 24. https://doi.org/10.31857/S0320965221010095
Михайлова Л.B., Степанова Н.Ю. 2017. Концепция разработки нормативов содержания загрязняющих веществ и смесей в донных отложениях и грунтах пресноводных объектов, имеющих рыбохозяйственное значение // Вестник рыбохозяйственной науки. Т. 4. № 3(15). С. 56.
Олькова А.С. 2014. Особенности и проблемы биотестирования водных сред по аттестованным методикам // Вода, химия и экология. №10. С. 87.
Оценка токсического загрязнения вод водотоков и водоемов различной солености и зон смешения речных и морских вод методами биотестирования. Р 52.24.690-2006. 2006. Ростов-на-Дону: Росгидромет.
Перова С.Н. 2019. Изменения структуры макрозообентоса Рыбинского водохранилища в условиях повышения температуры // Биол. внутр. вод. № 4. Вып. 2. С. 24.https://doi.org/10.1134/S0320965219040296
Петров Е.Л., Непорожняя И.А., Калинина Д.Н. 2018. Оценка экологического состояния донных отложений водоемов г. Череповца Вологодской области // International Student Research Bulletin. Биологические науки. № 4. С. 584.
Пименова И.В. 2002. Влияние минеральных компонентов горнорудного производства на планктонных ракообразных водоемов Карелии: Автореф. дис. … канд. биол. наук. Петрозаводск: Петрозаводск. гос. ун-т. 26 с.
Проведение наблюдений за токсическим загрязнением донных отложений в пресноводных экосистемах на основе биотестирования. 2002. РД 52.24.635-2002. Методические указания. Ростов-на-Дону: Росгидромет.
Рыбинское водохранилище и его жизнь. 1972. Ленинград: Наука.
Сигарева Л.Е., Тимофеева Н.А. 2018. Содержание растительных пигментов в донных отложениях водохранилищ Волги // Тр. Инст. биол. внутр. РАН. № 81(84). С. 105.
Степанова Н.Ю., Латыпова В.З., Яковлев В.А. 2004. Экология Куйбышевского водохранилища: донные отложения, бентос и бентосоядные рыбы. Казань: Изд-во академии наук РТ.
Томилина И.И., Гребенюк Л.П., Чуйко Г.М. 2011. Токсикологическая и тератогенная оценка донных отложений Рыбинского водохранилища // Биол. внутр. вод. № 3. С. 78. https://doi.org/10.1134/S1995082911030187
Томилина И.И., Гапеева М.В., Ложкина Р.А. 2018а. Изменение качества воды и донных отложений Шекснинского плеса Рыбинского водохранилища по химическим и токсикологическим показателям за период с 1961–2017 гг. // Тр. Инст. биол. внутр. РАН. Вып. 83(86). С. 32.
Томилина И.И., Гапеева М.В., Ложкина Р.А. 2018б. Экотоксикологическая оценка качества воды и донных отложений // Структура и функционирование экосистемы Рыбинского водохранилища в начале XXI века. Москва: Изд-во РАН. С. 371. https://doi.org/10.31857/S9785907036185000001
Флеров Б.А., Томилина И.И., Кливленд Л. и др. 2000. Комплексная оценка состояния донных отложений Рыбинского водохранилища // Биол. внутр. вод. № 2. С. 148.
Чуйко Г.М., Подгорная В.А. 2018. Пространственное распределение органических загрязняющих веществ в экосистеме водохранилища (ретроспективный аналитический обзор) // Структура и функционирование экосистемы Рыбинского водохранилища в начале XXI века. Москва: Изд-во РАН. С. 357.
Чуйко Г.М., Законнов В.В., Морозов А.А. 2010. Пространственное распределение и качественный состав полихлорированных бифенилов (ПХБ) и хлорорганических пестицидов (ХОП) в донных отложениях и леще (Abramis brama L.) Рыбинского водохранилища // Биол. внутр. вод. № 2. С. 98. https://doi.org/10.1134/S199508291002015X
Ankley G.T., Schubauer-Berigan M.K., Dierkes J.R. 1991. Predicting the toxicity of bulk sediments to aquatic organisms with aqueous test fractions: pore water vs. elutriate // Environmental Toxicology and Chemistry. V. 10. P. 1359. https://doi.org/10.1002/etc.5620101015
ASTM. American Society for Testing and Materials: ASTM/E 1383-94A – Standard guide for conducting sediment toxicity tests with freshwater invertebrates. 1994. https://doi.org/10.1520/E1383-94A
Baran A., Tarnawski M. 2015. Assessment of heavy metals mobility and toxicity in contaminated sediments by sequential extraction and a battery of bioassays // Ecotoxicology. V. 24(6). P. 1279. https://doi.org/10.1007/s10646-015-1499-4
Batley G.R., Stahl R.G., Babut M.P. et al. 2005. Scientific underpinnings of sediment quality guidelines // Use of sediment quality guidelines (SQGs) and related tools for the assessment of contaminated sediments. Pensacola: SETAC Press. P. 39.
Burton G.A., Jr. 2018. Breaking from tradition: establishing more realistic sediment quality guidelines // Environ. Sci. Pollut. Res. V. 25. P. 3047. https://doi.org/10.1007/s11356-016-8338-x
Das T., Sharma A., Taluder A. 1988. Effects of lanthanum in cellular systems // Biological Trace Element Research. V. 18. № 1. P. 201.
Juvonen R., Martikainen E., Schultz E. et al. 2000. A Battery of Toxicity Tests as Indicators of Decontamination in Composting Oily Waste // Ecotoxicol. Environ. Safety. V. 47. № 2. P. 156. https://doi.org/10.1006/eesa.2000.1943
Kalinowski R., Zaleska-Radziwill M. 2011. Ecotoxocological assessment of freshwater sediments // Pol. J. Environ. Stud. V. 20. № 5. P. 1181.
MacDonald D.D., Ingersoll C.G., Berge T.A. 2000. Development and Evaluation of Consensus-Based Sediment Quality Guidelines for Freshwater Ecosystems // Arch. Environ. Contam. Toxicol. V. 39. P. 20. https://doi.org/10.1007/s002440010075
Montero N., Belzunce-Segarra M.J., Gonzalez J.L. et al. 2013. Application of toxicity identification evaluation (TIE) procedures for the characterization and management of dredged harbor sediments // Mar. Pollut. Bull. V. 71(1–2). P. 259. https://doi.org/10.1016/j.marpolbul.2013.01.038
Mount D.I., Norberg T.J. 1984. A seven-day lifecycle cladoceran toxicity test // Environ. Toxicol. Chem. V. 3. P. 425. https://doi.org/10.1002/etc.5620030307
Schulze-Sylvester M., Heimann W., Maletz S. et al. 2016. Are sediments a risk? An ecotoxicological assessment of sediments from a quarry pond of the Upper Rhine River // J. Soils Sediments. V. 16. P. 1069–1080. https://doi.org/10.1007/s11368-015-1309-x
Sokal R.R., Rohlf F.J. 1995. Biometry. The principals and practice of statistics in biological research. New York: W.H. Freeman and Co.
Wang D., Wang Y., Shen L. Confirmation of combinational effects of calcium with other metals in a paper recycling mill effluent on nematode lifespan with toxicity identification evaluation method // J. Environ. Sci. 2010. V. 22(5). P. 731. https://doi.org/10.1016/S1001-0742(09)60170-4
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод