Биология внутренних вод, 2022, № 2, стр. 181-191
Генетическая изменчивость ротана Perсcottus glenii и его паразита, цестоды Nippotaenia mogurndae, за пределами естественного ареала
Г. В. Алямкин a, О. Н. Жигилева a, *, А. Е. Жохов a, b
a Лаборатория AquaBioSafe, Тюменский государственный университет
Тюмень, Россия
b Институт биологии внутренних вод им. И.Д. Папанина Российской академии наук
пос. Борок, Некоузский р-н, Ярославская обл., Россия
* E-mail: zhigileva@mail.ru
Поступила в редакцию 16.02.2021
После доработки 28.06.2021
Принята к публикации 16.07.2021
- EDN: LBUIGQ
- DOI: 10.31857/S0320965222010028
Аннотация
На основании полиморфизма мультилокусных ДНК маркеров (ISSR) дана оценка уровня генетической изменчивости и дифференциации популяций двух инвазивных видов, ротана Perсcottus glenii и его специфичного паразита цестоды Nippotaenia mogurndae, из пяти водоемов приобретенной части ареала – бассейна р. Иртыш (Западная Сибирь). У Perсcottus glenii выявлен достаточно высокий для данного вида маркеров уровень генетического полиморфизма: общая доля полиморфных фрагментов для всех исследованных выборок по трем изученным ISSR-локусам достигала 92%, средняя гетерозиготность – 0.32. В отдельных популяциях ротана эти показатели были меньше и варьировали в пределах 53–74% и 0.20–0.23 соответственно. Межпопуляционная дифференциация была 35% (GST = 0.35). У Nippotaenia mogurndae уровень общего полиморфизма по четырем ISSR-локусам равнялся 73.7% (пределы варьирования 18–45%), гетерозиготность – 0.18 (0.06–0.15). Генетическая дифференциация выборок N. mogurndae сходна с таковой P. glenii – 38% (GST = 0.38). Однако показатели полиморфизма и генетические дистанции между выборками паразита были ниже, чем у хозяина. Популяционно-генетическая структура P. glenii, в отличие от N. mogurndae, частично совпадает со строением гидрографической сети региона. Полученные данные свидетельствуют, что у ротана на приобретенной части ареала (юге Западной Сибири) наблюдается высокий уровень генетического полиморфизма и за несколько десятилетий сформировалась популяционно-генетическая структура, характерная для этого вида в нативном ареале.
ВВЕДЕНИЕ
Биологические инвазии представляют большую угрозу биоразнообразию: часто они необратимы, а успешно вселившиеся виды могут быстро наращивать численность с непредсказуемыми негативными последствиями для экосистем-реципиентов (Камакин, Ходоревская, 2018; Перова, 2020; Лазарева, 2021). Кроме того, инвазивный вид может стать распространителем несвойственных ранее экосистеме патогенных организмов и паразитов или включаться в циркуляцию местных видов паразитов (Соколов и др., 2012; Перова и др., 2018).
В связи с вышесказанным очень важно своевременно анализировать и прогнозировать жизнеспособность популяций видов-вселенцев во вновь приобретенных частях ареала. При оценке степени натурализации популяции помимо таких стандартных характеристик, как численность, соотношение полов и возрастная структура, большое значение имеет изучение генетической структуры популяции и ее динамики. Данные о генетическом полиморфизме чужеродных видов за пределами естественного ареала также могут быть полезны для уточнения их таксономического статуса (Пряничникова и др., 2019), выявления источников инвазии и реконструкции путей распространения.
Исследование структуры популяций паразита и хозяина в совокупности позволяет более полно оценить степень влияния инвазивного вида на биоценоз. Ротан-головешка Perccottus glenii Dubowski, 1877 (Perciformes: Odontobutidae) и цестода Nippotaenia mogurndae Yamaguti et Myiata, 1940 (Nippotaeniidea) представляют прекрасную модель для изучения закономерностей формирования популяционно-генетической структуры инвазивных видов на новой территории. Ротан-головешка, за последние десятилетия широко распространившийся на территории Евразии, относится к инвазивным видам рыб, негативно влияющим на аборигенную фауну гидробионтов (Кудерский, 2001). В 80-е гг. ХХ в. через Южно-Уральский инвазионный коридор он проник в Западную Сибирь, заселив Обь-Иртышский бассейн (Корляков, Нохрин, 2014). Ротан существенно угнетает местную фауну из-за неразборчивого хищничества и представляет опасность для естественных экосистем и объектов рыбного хозяйства (Orlova et al., 2006; Решетников, 2009; Халько и др., 2019).
Составляющая ядро паразитофауны ротана цестода N. mogurndae распространяется вслед за своим хозяином: этот паразит, начиная с 2004 года, отмечен в водоемах Европы (Košuthová et al., 2004, 2008; Mierzejewska et al., 2010; Reshetnikov et al., 2011; Kvach et al., 2013). За Уралом, в водоемах Тюменской и Свердловской областей, он встречается с 2011 года (Соколов и др., 2011б; Zhigileva, Kulikova, 2016), в водоемах Новосибирской обл. – с 2013 г. (Соколов и др., 2013). В то же время, в некоторых районах приобретенного ареала ротана N. mogurndae по невыясненным причинам отсутствует (Соколов, Мошу, 2013).
N. mogurndae характеризуется сложным жизненным циклом, в котором присутствует промежуточный хозяин. В исходном ареале промежуточным хозяином цестоды служит планктонная копепода Mesocyclops leuckarti (Claus, 1857). В приобретенных частях ареала число промежуточных хозяев шире: кроме M. leuckarti это планктонные копеподы Neutrodiaptomus incongruens (Poppe, 1888), Eucyclops serrulatus (Fischer, 1851), M. crassus (Fischer, 1853) (Reshetnikov et al., 2011). Заражение рачков паразитом происходит при заглатывании его зрелых яиц; переход к окончательному хозяину, рыбе, происходит при поедании копепод (Демшин, 1985). Вследствие наличия у цестоды сложного жизненного цикла считается, что обнаружение этого паразита может служить маркером происхождения инвазивных популяций ротана из рыбохозяйственных источников, а не аквариумных (Reshetnikov et al., 2017; Соколов, 2018).
Ротан сравнительно хорошо изучен в генетическом отношении. Исследован аллозимный полиморфизм вида в нативном ареале и изменения этого типа полиморфизма при интродукции (Golubtsov et al., 2009). Кроме того, для ротана определена нуклеотидная последовательность полного митохондриального генома (Xue et al., 2013), описаны три митохондриальные филогенетические линии, распространенные в разных частях Северо-Восточной Азии (Xu et al., 2014; Yang et al., 2020). Эти три линии митохондриальной ДНК (мтДНК) встречаются и на колонизированной территории Европы, подтверждая происхождение инвазионных популяций из трех независимых источников (Grabowska et al., 2020). Разработаны микросателлитные маркеры, при помощи которых описана популяционно-генетическая структура ротана в нативном ареале (Zhang et al., 2021). Имеются данные об изменчивости микросателлитных локусов и участков мтДНК вида на европейской части России (King et al., 2015). Для Западной Сибири, куда ротан проник не так давно (Решетников, Петлина, 2007), данные о его генетической изменчивости этого вида фрагментарны (Zhigileva, Kulikova, 2016). В отличие от хозяина, сведения о генетической изменчивости цестоды N. mogurndae немногочисленны и касаются уточнения ее филогенетического положения (Соколов и др., 2018).
Цель работы – изучить генетическую изменчивость ротана и его паразита, цестоды N. mogurndae, в водоемах бассейна р. Иртыш.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Ротана отлавливали в оз. Андреевское (Тюменский р-н, 57°02′ с.ш., 65°76′ в.д.) и р. Тобол (Ялуторовский р-н, 56°67′ с.ш., 66°37′ в.д.) в 2017 г.; в оз. Сундукуль (Нижнетавдинский р-н, 57°36′ с.ш., 65°73′ в.д.), оз. Оброчное (г. Тюмень, 57°15′ с.ш., 65°64′ в.д.) и р. Малый Емец (приток р. Вагай, Голышмановский р-н, 56°10′ с.ш., 68°41′ в.д.) в 2018 г. Все исследованные водоемы и водотоки лежат в пределах приобретенного ареала ротана и относятся к бассейну р. Иртыш. Озеро Оброчное соединяется протокой с р. Тура, оз. Сундукуль – с р. Капланка, оз. Андреевское – с р. Дуван, впадающей в р. Пышма (приток р. Тура) (рис. 1).
Рис. 1.
Карта-схема расположения мест отлова рыб: 1 – оз. Андреевское, 2 – р. Тобол, 3 – оз. Сундукуль, 4 – оз. Оброчное, 5 – р. Малый Емец. Выделены границы Тюменской обл.

Ротана отлавливали удочкой. Всего поймано 170 особей, по 40 особей из каждого водного объекта, кроме р. Малый Емец, где добыто 10 особей. У рыб определяли пол, возраст, абсолютную длину и массу тела (Правдин, 1966). Зараженность ротана цестодой N. mogurndae изучали методом неполного гельминтологического вскрытия желудочно-кишечного тракта (Быховская-Павловская, 1985). Цестод извлекали из кишечника рыб, отмывали в физиологическом растворе и микроскопировали.
Для генетических исследований использовали образцы мышечной ткани рыб, которые фиксировали в 96%-ном этаноле и хранили при –20°С. Цестод замораживали в 50 мкл ×0.1 Трис-Ацетат-ЭДТА буфера. ДНК рыб и цестод экстрагировали методом щелочного лизиса по (Bender et al., 1983) с авторскими модификациями).
Генотипирование рыб и цестод проводили методом полимеразной цепной реакции последовательностей, ограниченных простыми повторами (Inter simple sequence repeat polymerase chain reaction – ISSR-PCR) (Zietjiewicz et al., 1994). Всего генотипировано 67 экз. рыб и 60 экз. цестод.
Для ISSR-PCR в качестве участков отжига праймеров использовали динуклеотидные микросателлитные локусы. Перед исследованием проводили апробацию праймеров. Из восьми апробированных праймеров отбирали те, которые давали воспроизводимые спектры с хорошо различимыми фракциями в количестве от 5 до 20. При работе с образцами ротана удовлетворительные результаты показали праймеры (AG)8C (UBC-808), (AG)8G (UBC-809), (AG)8T (UBC-807), при работе с ДНК цестоды – праймеры (AG)8C (UBC-808), (AG)8G (UBC-809), (AG)8T (UBC-807) и (TC)8C (UBC-823), их использовали в дальнейшей работе (рис. 2). Амплификацию проводили в 25 мкл реакционной смеси, содержащей ПЦР буфер (0.01 M Трис-НCl, 0.05 M KCl, 0.1% тритон Х-100), 4 мМ MgCl2, 0.2 мМ каждого из dNTPs, 1 мкл раствора тотальной клеточной ДНК, 2.5 мМ праймера и 0.2 ед./мкл Taq-полимеразы (Thermo Fisher Scientific) в следующем режиме: 94°С – 7 мин, затем 94°С – 30 с, 52(56)°С – 45 с, 72°С – 2 мин (40 циклов); 72°С – 7 мин (Zhigileva et al., 2013). Продукты ПЦР разделяли стандартным методом электрофореза в 2%-ном агарозном геле в Трис-ЭДТА-боратном буфере, окрашивали этидиум бромидом.
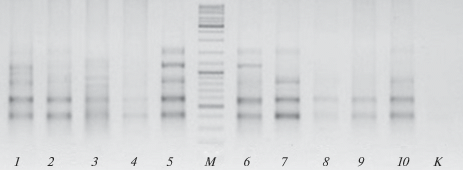
Рис. 2.
Электрофореграмма ISSR-паттернов ротана-головешки с праймером (TC)8C (UBC-823). Номера дорожек (1–10) соответствуют номерам особей из оз. Оброчное, М – маркер длины фрагментов ДНК GeneRuler Mix 100–10 000 п.н. (эталонные фрагменты с повышенной концентрацией имеют размер 500, 1000 и 3000 п.н.), К – отрицательный контроль.
С использованием программы POPGEN (Yeh et al., 1999) рассчитывали частоты бэндов, долю полиморфных бэндов (Р), генетическое разнообразие (среднюю ожидаемую гетерозиготность) (h), эффективное число аллелей (ne), индекс генетического сходства Нея (IN), генетическую дистанцию (D), показатели генетической дифференциации (HT, HS, GST) и потока генов (Nm). Дендрограммы строили на основании генетических дистанций Нея методом UPGMA с использованием программы POPGEN (Yeh et al., 1999). Для проверки модели изоляции расстоянием использовали тест Мантеля.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Размерно-возрастная структура и зараженность ротана. Основой всех изученных выборок ротана были особи возраста 3+. Соотношение полов варьировало от равного (1 : 1) в р. Тобол до полутора-двухкратного преобладания особей женского или мужского пола в остальных водных объектах. Поскольку половой диморфизм по размерно-массовым показателям у ротана выражен слабо (Сусляев и др., 2016), приведены средние величины абсолютной длины и массы тела рыб для наиболее распространенной возрастной группы без учета половой принадлежности особей (табл. 1).
Таблица 1.
Характеристика исследованных выборок ротана
| Выборка | Водоем | n | Соотношение ♂ : ♀ | Возрастная группа, % | Параметры тела* (3+) | ||||
|---|---|---|---|---|---|---|---|---|---|
| 1+ | 2+ | 3+ | 4+ | длина, см | масса, г | ||||
| 1 | оз. Андреевское | 40 | 1.0 : 1.2 | 0 | 17.5 | 82.5 | 0 | 16.40 ± 0.23 | 63.6 ± 2.2 |
| 2 | р. Тобол | 40 | 1.0 : 1.0 | 0 | 0 | 95.0 | 5.0 | 13.92 ± 0.19 | 68.0 ± 2.7 |
| 3 | оз. Сундукуль | 40 | 1.4 : 1.0 | 0 | 7.5 | 92.5 | 0 | 17.58 ± 0.32 | 83.9 ± 4.7 |
| 4 | оз. Оброчное | 40 | 1.0 : 2.0 | 2.5 | 10.0 | 82.5 | 5.0 | 16.79 ± 0.25 | 75.5 ± 2.8 |
| 5 | р. Малый Емец | 10 | 1.0 : 1.5 | 0 | 10.0 | 90.0 | 0 | 19.90 ± 0.29 | 105.4 ± 1.42 |
В результате гельминтологического исследования выявлена инвазия цестодой N. mogurndae всех изученных популяций ротана. Экстенсивность инвазии варьировала в пределах 88–95%, интенсивность – 1–42, индекс обилия – 5.1–11.8 (табл. 2).
Таблица 2.
Показатели зараженности ротана цестодой Nippotaenia mogurndae
| Выборка | Экстенсивность инвазии, % | Интенсивность инвазии | Индекс обилия | |
|---|---|---|---|---|
| Min–max | М ± SE | |||
| 1 | 87.5 ± 5.23 | 1–20 | 6.94 ± 0.85 | 6.08 ± 0.83 |
| 2 | 95.0 ± 3.45 | 1–32 | 12.42 ± 1.19 | 11.80 ± 1.21 |
| 3 | 92.5 ± 4.16 | 1–23 | 5.54 ± 1.32 | 5.13 ± 1.24 |
| 4 | 87.5 ± 5.23 | 2–42 | 11.97 ± 1.49 | 10.48 ± 1.45 |
| 5 | 90.0 ± 5.45 | 2–19 | 9.23 ± 1.26 | 9.64 ± 1.23 |
Генетический полиморфизм ротана. При генотипировании с применением трех ISSR-праймеров у ротана-головешки идентифицирован 41 амплифицированный фрагмент (табл. 3). Каждая популяция имеет специфический генетический профиль, обусловленный варьированием частот широко распространенных вариантов, а также наличием уникальных фракций. У ротана из оз. Андреевское выявлен один уникальный вариант (p1-1), из оз. Сундукуль – два (p1-6, p2-10), из р. Малый Емец – три (p2-4, p2-8, p3-9).
Таблица 3.
Характеристика полиморфизма ISSR-маркеров Perccottus glenii и Nippotaenia mogurndae
| Праймер | Нуклеотидная последовательность | Число ампликонов в спектре | Среднее число ампликонов на особь | Число уникальных ампликонов | Доля полиморфных ампликонов, % |
|---|---|---|---|---|---|
| Perccottus glenii | |||||
| UBC-808 | (AG)8C | 8 | 4.2 | 2 | 75 |
| UBC-809 | (AG)8G | 16 | 9.38 | 3 | 100 |
| UBC-807 | (AG)8T | 17 | 7.04 | 1 | 100 |
| Nippotaenia mogurndae | |||||
| UBC-808 | (AG)8C | 7 | 6.59 | 0 | 43 |
| UBC-809 | (AG)8G | 9 | 7.02 | 2 | 33 |
| UBC-807 | (AG)8T | 11 | 9.22 | 1 | 100 |
| UBC-823 | (TC)8C | 11 | 2.47 | 3 | 100 |
Суммарная доля полиморфных локусов по трем ISSR-маркерам для совокупной выборки ротана, объединяющей все исследованные нами популяции, достигала 92%, генетическое разнообразие – 0.32. В отдельных выборках ротана эти показатели были существенно меньше и варьировали в пределах 53–74% и 0.20–0.23 при средних значениях 61.7 ± 4.91% и 0.22 ± 0.01 соответственно (табл. 4). Выявленная особенность свидетельствует о выраженной локальной дифференциации популяции ротана исследованного региона, на что также указывают высокий показатель межпопуляционной дифференциации и низкий – потока генов между популяциями (табл. 5).
Таблица 4.
Показатели генетического полиморфизма в отдельных выборках ротана Perccottus glenii и его паразита Nippotaenia mogurndae
| Выборка | P. glenii | N. mogurndae | ||||||
|---|---|---|---|---|---|---|---|---|
| n | P, % | h | ne | n | P, % | h | ne | |
| 1 | 10 | 52.63 | 0.196 | 1.31 | 13 | 42.11 | 0.153 | 1.26 |
| 2 | 23 | 55.26 | 0.223 | 1.37 | 14 | 44.74 | 0.149 | 1.25 |
| 3 | 12 | 71.05 | 0.225 | 1.35 | 12 | 21.05 | 0.069 | 1.12 |
| 4 | 12 | 73.68 | 0.234 | 1.36 | 12 | 18.42 | 0.060 | 1.10 |
| 5 | 10 | 56.10 | 0.219 | 1.39 | 9 | 26.32 | 0.115 | 1.21 |
| Среднее | – | 61.74 | 0.219 | 1.36 | – | 30.53 | 0.109 | 1.23 |
Таблица 5.
Показатели генетической дифференциации популяций ротана Perccottus glenii и его паразита Nippotaenia mogurndae
| Вид | HT | HS | GST | Nm | IN | D |
|---|---|---|---|---|---|---|
| Perccottus glenii | 0.318 | 0.206 | 0.35 | 0.92 | 0.748–0.938 | 0.064–0.291 |
| Nippotaenia mogurndae | 0.177 | 0.109 | 0.38 | 0.81 | 0.828–0.981 | 0.019–0.188 |
Наименьшая генетическая дистанция (D = 0.06) у ротана-головешки наблюдается между популяциями оз. Андреевского и р. Тобол, наибольшая (D = 0.29) – между популяциями озер Сундукуль и Андреевское (табл. 6). Однако тест Мантеля не выявил наличия достоверной корреляции географических расстояний с генетическими дистанциями между популяциями ротана, связь между этими признаками слабая (r = 0.07, p = 0.848).
Таблица 6.
Показатели генетического сходства (выше диагонали) и генетические дистанции (ниже диагонали) между выборками Perccottus glenii и Nippotaenia mogurndae
| Выборка | оз. Андреевское | р. Тобол | оз. Сундукуль | оз. Оброчное | р. Малый Емец |
|---|---|---|---|---|---|
| Perccottus glenii | |||||
| оз. Андреевское | – | 0.9378 | 0.7477 | 0.7730 | 0.7788 |
| р. Тобол | 0.0642 | – | 0.8026 | 0.8174 | 0.7869 |
| оз. Сундукуль | 0.2907 | 0.2199 | – | 0.8943 | 0.8583 |
| оз. Оброчное | 0.2575 | 0.2016 | 0.1117 | – | 0.8410 |
| р. Малый Емец | 0.2500 | 0.2397 | 0.1528 | 0.1732 | – |
| Nippotaenia mogurndae | |||||
| оз. Андреевское | – | 0.8284 | 0.9016 | 0.8622 | 0.9291 |
| р. Тобол | 0.1883 | – | 0.8915 | 0.8441 | 0.8819 |
| оз. Сундукуль | 0.1036 | 0.1149 | – | 0.9696 | 0.9813 |
| оз. Оброчное | 0.1483 | 0.1695 | 0.0308 | – | 0.9544 |
| р. Малый Емец | 0.0735 | 0.1256 | 0.0189 | 0.0189 | – |
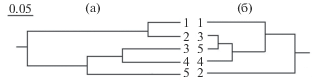
Дендрограмма генетических дистанций ротана частично отражает характер гидрографической сети (рис. 3). В один кластер объединяются выборки из оз. Андреевское и р. Тобол, расстояние между которыми ~190 км (по воде), во второй кластер – выборки из оз. Сундукуль и оз. Оброчное, также близко расположенные и принадлежащие бассейну одной реки. Исключение составляет выборка из р. Малый Емец, которая также входит во второй кластер, хотя находится на расстоянии >1000 км.
Рис. 3.
Дендрограмма генетических дистанций по ISSR-маркерам разных выборок ротана (а) и цестоды Nippotaenia mogurndae (б). 1 – оз. Андреевское, 2 – р. Тобол, 3 – оз. Сундукуль, 4 – оз. Оброчное, 5 – р. Малый Емец.
Генетический полиморфизм цестоды Nippotaenia mogurndae. У N. mogurndae в целом с использованием четырех праймеров описано 38 ампликонов (табл. 3). Выявлено по три уникальных варианта в выборках из р. Тобол (p2-1, p2-3, p7-11) и оз. Оброчное (p3-1, p7-1, p7-2).
Уровень дифференциации популяций паразита сопоставим с аналогичными показателями хозяина: межпопуляционная доля генетической изменчивости (GST) – 0.38, поток генов (Nm) – 0.81 (табл. 5). Однако уровень генетического полиморфизма цестоды в 2 раза ниже, чем у хозяина, особенно в отдельных гемипопуляциях (табл. 4). Уровень полиморфизма в выборках цестод от рыб из разных водных объектов варьирует в пределах 18–45%, генетическое разнообразие – 0.06–0.15 при средних значениях 30.5 ± 6.07% и 0.11 ± 0.02 соответственно. Генетическое сходство между выборками цестод из разных водоемов выше по сравнению с хозяином, в то время как генетические дистанции как минимум в 2 раза меньше, чем у рыб (табл. 5, 6). Наибольшая генетическая дистанция (D = 0.18) наблюдается между популяциями оз. Андреевское и р. Тобол, наименьшая (D = 0.0019) – между популяциями р. Малый Елец и озерами Оброчное и Сундукуль. Как и у хозяина, корреляция между географическими расстояниями и генетическими дистанциями у паразита недостоверна (r = 0.54, p = 0.110).
Дендрограмма генетических дистанций N. mogurndae не согласуется с географическими расстояниями между популяциями, а также не совпадает с дендрограммой окончательного хозяина – ротана (рис. 3). При этом выявлена средняя корреляция между генетическими дистанциями ротана и цестоды (rS = 0.648, p = 0.847).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Ротан-головешка, впервые зарегистрированный за Уралом в 80-е годы ХХ в., за несколько десятилетий сформировал устойчивые самовоспроизводящиеся популяции в водоемах и водотоках бассейна р. Иртыш. По литературным данным (Решетников, Чибилев, 2009; Корляков, Нохрин, 2014), имеется два водных пути, соединяющих бассейн р. Волга с Обь-Иртышским бассейном – через реки Чусовая и Миасс. Для выяснения точного источника проникновения ротана в Обь-Иртышский бассейн требуются дополнительные исследования популяций вселенца на территории Свердловской и Челябинской областей, в том числе, с использованием генетических маркеров. Поскольку обе эти реки соединяются с р. Исеть, можно предположить, что именно она служила “входными воротами” ротана в Западную Сибирь, и далее путь расселения проходил на восток в направлении Исеть–Тобол–Иртыш–Обь. Исходя из этого предположения, популяции из р. Тобол и ее бассейна можно считать наиболее близкими к исходной популяции в регионе. Наиболее молодой из исследованных следует считать популяцию р. Малый Емец, наиболее удаленную (>1000 км по воде) от исходной популяции.
Суммарные показатели генетического полиморфизма ротана (P = 92%, h = 0.32) в исследованной нами части Обь-Иртышского бассейна оказались довольно высокими, несмотря на его недавнюю интродукцию, что обычно подразумевает заселение небольшой группой (группами) особей, и неизбежно должно отражаться на уровне полиморфизма популяции вселенца вследствие “эффекта основателя”. Если сравнивать с другими видами рыб, то у ротана показатели ISSR полиморфизма не ниже, а в ряде случаев даже выше, чем у широко распространенных видов рыб Обь-Иртышского бассейна. Так, у карповых рыб (язя Leuciscus idus L., ельца Leuciscus idus L. и плотвы Rutilus rutilus Pallas, 1811) по сопоставимому набору маркеров полиморфность варьирует в пределах 83–86%, гетерозиготность – 0.26–0.36 (Zhigileva et al., 2013). У щуки Esox lucius L. и речного окуня Perca fluviatilis L. показатели полиморфизма равны 69.6 и 85%, гетерозиготности – 0.24 и 0.28 соответственно (Жигилева и др., 2017). Сохранение исходного генетического разнообразия ротана при расселении показано и в других работах. В частности, в Европе выявлены все три линии гаплотипов мтДНК этого вида, известные в нативном ареале (Grabowska et al., 2020). Более высокий уровень гетерозиготности и генетической дифференциации ротана на колонизированных территориях по сравнению с исходным ареалом выявлен по данным аллозимного анализа (Golubtsov et al., 2009). Таким образом, суммируя наши данные и данные по другим видам генетических маркеров, можно утверждать, что сокращение генетического разнообразия при расселении нехарактерно для этого вида.
В то же время, в локальных популяциях ротана показатели полиморфизма значительно ниже, и довольно сильно выражена генетическая дифференциация. Высокие уровни дифференциации и преобладание межпопуляционной составляющей генетической изменчивости, зарегистрированные у ротана в исследованной части Обь-Иртышского бассейна, характерны для этого вида и в исходном ареале, что показано с использованием других видов генетических маркеров – микросателлитов (Zhang et al., 2021) и маркеров мтДНК (Yang et al., 2020). Таким образом, можно заключить, что у ротана характерная для него генетическая структура популяций могла сформироваться за относительно короткое время – несколько десятилетий с момента заселения юга Западной Сибири.
Модель изоляции расстоянием, оцененная тестом Мантеля, для ротана оказалась несостоятельна. Это может быть связано с тем, что в процессе активного расселения ротана дифференцировка его локальных популяций, по-видимому, происходит главным образом в результате дрейфа генов. Наличие уникальных генетических вариантов в относительно недавно сформировавшихся популяциях вселенца озер Андреевское, Сундукуль и Оброчное также можно объяснить эффектами генетического дрейфа.
Паразит ротана, цестода N. mogurndae обнаружена во всех исследованных нами водных объектах бассейна р. Иртыш с достаточно высокими показателями встречаемости (до 88–95%) и обилия (5.1–11.8). Аналогичные высокие показатели зараженности этим паразитом описаны для размерной группировки ротана 80–130 мм в его первичном ареале (Ермоленко, 2004). Это, на наш взгляд, свидетельствует об успешной натурализации в водоемах юга Западной Сибири не только ротана, но и его паразита, N. mogurndae. Учитывая, что N. mogurndae имеет сложный жизненный цикл, включение паразита в местные трофические цепи можно рассматривать как признак успешной натурализации инвазивных видов – и паразита, и его хозяина. Наличие N. mogurndae в паразитофауне ротана бассейна р. Иртыш также указывает на рыбохозяйственный, а не аквариумный источник инвазии ротана в регионе, и подтверждает гипотезу о проникновении ротана через Южно-Уральский инвазионный коридор из Волжского бассейна, где оба инвайдера также успешно натурализовались (Соколов и др., 2011а; Kirilenko, Shemonaev, 2017).
У N. mogurndae выявлен более низкий уровень полиморфизма по сравнению с хозяином, что может быть обусловлено его узкой гостальной специфичностью, более стабильными условиями обитания паразита внутри организма хозяина и соответственно с этим меньшей необходимостью приспосабливаться к разным условиям обитания в разных водоемах. Наибольшие показатели инвазии и генетического полиморфизма, а также наличие редких генетических вариантов выявлены в выборке N. mogurndae из р. Тобол. Это может указывать на первичность тобольского очага инвазии этой цестоды в бассейне р. Иртыш и подтверждает выявленную ранее закономерность о ведущем значении этой реки в качестве “входных ворот” для многих инвазивных видов Обь-Иртышского бассейна: “Гидробионты, широко расселившиеся в пределах Обского бассейна, в первую очередь обнаруживаются на восточном склоне Урала в пределах бассейна р. Тобол, а в последствии расселяются по Оби в восточном направлении” (Корляков, Нохрин, 2014, с. 25).
В целом, несмотря на синхронность процессов заселения паразита и хозяина, на что указывают близкие значения показателей генетической дифференциации популяций ротана и цестоды, для них выявлен разный уровень полиморфизма. Влияние генетического дрейфа на популяции паразита выражено сильнее. В отличие от ротана, для цестоды отсутствует даже слабая корреляция генетических дистанций и географических расстояний между ее популяциями. Таким образом, процесс формирования генетической структуры популяций ротана и цестоды во вновь приобретенном ареале можно рассматривать как интересный пример коэволюции двух видов с изначально разным уровнем генетической изменчивости, который, однако, не мешает этим видам успешно осваивать новые территории. При этом необходимо учитывать, что на генетическую структуру популяций цестоды может также влиять популяционная динамика ее промежуточного хозяина – циклопа Mesocyсlops leuckarti (Демпшин, 1985; Košuthová et al., 2008). Однако этот аспект требует дальнейшего изучения.
Выводы. Полученные данные свидетельствуют, что у ротана на приобретенной части ареала (юг Западной Сибири) наблюдается высокий уровень генетического полиморфизма. За несколько десятилетий сформировалась популяционно-генетическая структура с выраженной межпопуляционной компонентой изменчивости, характерная для этого вида в нативном ареале. У паразита ротана, цестоды N. mogurndae, несмотря на более низкий по сравнению с хозяином уровень полиморфизма, процессы генетической дифференциации происходят синхронно с аналогичными хозяина.
Список литературы
Быховская-Павловская И.Е. 1985. Паразиты рыб. Руководство по изучению. Ленинград: Наука.
Демшин Н.И. 1985. Постэмбриональное развитие цестоды Nippotaenia mogurndae (Nippotaeniidea, Nippotaeniidae) // Паразитология. Т. 19. № 1. С. 39.
Ермоленко А.В. 2004. Фауна паразитов головешки ротана Perccottus glenii (Eleotridae) Приморского края // Паразитология. Т. 38. № 3. С. 253.
Жигилева О.Н., Егорова А.Г., Хохлов Д.А. 2017. Особенности генетики популяций некоторых видов хищных рыб Обь-Иртышского бассейна // Проблемы популяционной биологии: материалы XII Всероссийского популяционного семинара памяти Н.В. Глотова (1939–2016). Йошкар-Ола, 11–14 апреля 2017 г. Йошкар-Ола: ООО ИПФ “СПРИНГ”. С. 91.
Камакин А.М., Ходоревская Р.П. 2018. Влияние популяции вселенца Mnemiopsis leidyi A. Agassiz, 1865 на рыбное население Каспийского моря // Биология внутр. вод. № 2. С. 51. https://doi.org/10.7868/S0320965218020067
Корляков К.А., Нохрин Д.Ю. 2014. Тенденции возникновения инвазионного коридора Волга-Обь // Вест. Совета молодых ученых и специалистов Челябинской обл. № 2. С. 19.
Кудерский Л.А. 2001. Акклиматизация рыб в водоемах России: состояние и пути развития // Вопр. рыболовства. Т. 2. № 1. С. 6.
Лазарева В.И. 2021. Первая находка Thermocyclops taihokuensis (Crustacea, Copepoda) в бассейне р. Оки // Биология внутр. вод. № 1. С. 91. https://doi.org/10.31857/S0320965221010071
Перова С.Н. 2020. Расширение ареала каспийского вселенца пиявки Archaeobdella esmonti (Annelida: Clitellata: Hirudinida) в бассейне Верхней Волги // Биология внутр. вод. № 2. С. 198. https://doi.org/10.31857/S0320965220010155
Перова С.Н., Пряничникова Е.Г., Тютин А.В. 2018. О расширении ареала обитания причерноморского моллюска Lithoglyphus naticoides (C. Pfieffer, 1828) и ассоциированных с ним видов трематод в бассейне Верхней Волги // Биология внутр. вод. № 2. С. 91. https://doi.org/10.7868/S0320965218020122
Правдин И.Ф. 1966. Руководство по изучению рыб (преимущественно пресноводных). Москва: Пищ. пром-сть. 376 с.
Пряничникова Е.Г., Ворошилова И.С., Сабитова Р.З. 2019. Вселение Corbicula fluminea (Müller, 1774) (Mollusca: Bivalvia: Corbiculidae) в бассейн р. Волги // Биология внутр. вод. Т. 2. № 2. С. 95. https://doi.org/10.1134/s032096521903015x
Решетников А.Н. 2009. Современный ареал ротана Perccottus glenii Dybowski, 1877 (Odontobutidae, Pisces) в Евразии // Рос. журн. биол. инвазий. № 1. С. 22.
Решетников А.Н., Петлина А.П. 2007. Распространение ротана (Perccottus glenii Dybowski, 1877) в реке Оби // Сиб. экол. журн. Т. 14. № 4. С. 551.
Решетников А.Н., Чибилев Е.А. 2009. Распространение ротана (Perccottus glenii Dybowski, 1877) в бассейне р. Иртыш и анализ возможных последствий для природы и человека // Сиб. экол. журн. Т. 16. № 3. С. 405.
Соколов С.Г. 2018. Паразитофауна ротана Perccottus glenii Dybowski, 1877 (Actinopterygii, Odontobutidae) в хронологически первой точке интродукции вида // Биология внутр. вод. № 4. С. 90. https://doi.org/10.1134/S0320965218040137
Соколов С.Г., Мошу А.Я. 2013. Первые сведения о паразитах ротана Perccottus glenii Dybowski, 1877 (Actinopterygii: Odontobutidae) в водоемах республики Молдова // Известия Самарского научного центра Российской академии наук. Т. 15. № 3. С. 213.
Соколов С.Г., Протасова Е.Н., Решетников А.Н. 2011а. Паразитофауна ротана Perccottus glenii Dybowski, 1877 (Osteichthyes: Odontobutidae) в некоторых водоемах Европейской части России // Поволж. экол. журн. № 4. С. 507.
Соколов С.Г., Протасова Е.Н., Пельгунов А.Н. и др. 2011б. Данные о паразитофауне ротана Perccottus glenii Dybowski, 1877 (Osteichthyes, Odontobutidae) в бассейне Иртыша // Поволж. экол. журн. № 1. С. 103.
Соколов С.Г., Протасова Е.Н., Решетников А.Н., Шедько М.Б. 2012. Паразиты ротана Perccottus glenii (Actinopterygii: Odontobutidae), интродуцированного в водоемы европейской части России // Успехи соврем. биологии. Т. 132. № 5. С. 477.
Соколов С.Г., Лебедева Д.И., Ядренкина Е.Н. 2013. Первые данные о паразитофауне ротана Perccottus glenii Dybowski, 1877 (Actinopterygii: Odontobutidae) в водоемах лесостепной зоны западно-сибирской равнины // Паразитология. № 6. С. 448.
Соколов С.Г., Белькова Н.Л., Майкова О.О. 2018. Филогенетическое положение цестоды Nippotaenia mogurndae Yamaguti et Miyata, 1940 (Cestoda: Nippotaeniidae), паразита ротана Perccottus glenii Dybowski, 1877 (Actinopterygii: Odontobutidae), основанное на частичной последовательности гена 18s рРНК // Изв. Росс. акад. наук. Сер. биол. № 3. С. 275.
Сусляев В.В., Решетникова С.Н., Интересова Е.А. 2016. Биология ротана Perccottus glenii Dybowski, 1877 в водоемах южно-таежной зоны Западной Сибири // Вестник Новосиб. гос. аграр. ун-та). Т. 1. С. 78.
Халько В.В., Шемонаев Е.В., Кириленко Е.В., Халько Н.А. 2019. Физиолого-биохимические показатели сеголетков аборигенного Carassius auratus gibelio (Bloch, 1792) и инвазионного Perccottus glenii (Dybowski, 1877) видов рыб в пойменном озере круглое (Саратовское водохранилище) // Биология внутр. вод. № 1. С. 79. https://doi.org/10.1134/S0320965219010121
Bender W., Pierre S., Hognes D.S. 1983. Chromosomal walking and jumping to isolate DNA from Ace and rosy loci of bithorax complex in Drosophila melanogaster // J. Mol. Biol. V. 168. P. 17. https://doi.org/10.1016/S0022-2836(83)80320-9
Golubtsov A.S., Ilyin I.I., Mina M.V. 2009. Polymorphisms at two enzyme loci (Sod and Odh) in populations of the Amur sleeper, Perccottus glenii (Pisces, Eleotrididae), from its native range and the colonized area: the effect of introduction on genetic variation // J. Zool. Syst. Evol. Res. V. 31(4). P. 269. https://doi.org/10.1111/j.1439-0469.1993.tb00196.x
Grabowska J., Kvach Yu., Rewicz T. et al. 2020. First insights into the molecular population structure and origins of the invasive Chinese sleeper, Perccottus glenii, in Europe // NeoBiota. V. 57. P. 87. https://doi.org/10.3897/neobiota.57.48958
King T.L., Eackles M.S., Reshetnikov A.N. 2015. Rapid isolation of microsatellite DNAs and identification of polymorphic mitochondrial DNA regions in the fish rotan (Perccottus glenii) invading European Russia // Conserv. Genet. Res. V. 7. P. 363. https://doi.org/10.1007/s12686-015-0430-x
Kirilenko E.V., Shemonaev E.V. 2017. Distribution of the Chinese sleeper Perccottus glenii (Odontobutidae) in fish communities of floodplain waterbodies in the Samarskaya Luka National Park (Samara region, Russia) // Nature Conservation Research. V. 2. № 4. P. 90. https://doi.org/10.24189/ncr.2017.026
Košuthová L., Letková V., Koščo J., Košuth P. 2004. First record of Nippotaenia mogurndae Yamaguti and Miyata, 1940 (Cestoda: Nippotaeniidea), a parasite of Perccottus glenii Dybowski, 1877, from Europe // Helminthologia. V. 41. № 1. P. 55. https://doi.org/10.1007/s00436-009-1685-5
Košuthová L., Koščo J., Miklisová D. et al. 2008. New data on an exotic Nippotaenia mogurndae (Cestoda), newly introduced to Europe // Helminthologia. V. 45. P. 81. https://doi.org/10.2478/s11687-008-0015-2
Kvach Yu., Drobiniak O., Kutsokon Yu., Goch I. 2013. The parasites of the invasive Chinese sleeper Perccottus glenii (Fam. Odontobutidae), with the first report of Nippotaenia mogurndae in Ukraine // Knowledge and Management of Aquatic Ecosystems. V. 409 (05). https://doi.org/10.1051/kmae/2013048
Mierzejewska K., Martyniak A., Kakareko T., Hliwa P. 2010. First record of Nippotaenia mogurndae Yamaguti and Miyata, 1940 (Cestoda, Nippotaeniidae), a parasite introduced with Chinese sleeper to Poland // Parasitol. Res. V. 106. № 2. P. 451. https://doi.org/10.1007/s00436-009-1685-5
Orlova M.I., Telesh I.V., Berezina N.A. et al. 2006. Effects of nonindigenous species on diversity and community functioning in the eastern Gulf of Finland (Baltic Sea) // Helgol. Mar. Res. V. 60. P. 98. https://doi.org/10.1007/s10152-006-0026-7
Reshetnikov A.N., Sokolov S.G., Protasova E.N. 2011. The host-specific parasite Nippotaenia mogurndae confirms introduction vectors of the fish Perccottus glenii in the Volga River basin // J. Appl. Ichthyol. V. 27. № 5. P. 1226. https://doi.org/10.1111/j.1439-0426.2011.01792.x
Reshetnikov A.N., Sokolov S.G., Protasova E.N. 2017. Detection of a neglected introduction event of the invasive fish Perccottus glenii using parasitological analysis // Hydrobiologia. V. 788. P. 65. https://doi.org/10.1007/s10750-016-2987-0
Xue W., Hou G., Li C. et al. 2013. Complete mitochondrial genome of Chinese sleeper, Perccottus glenii // Mitochondrial DNA. V. 24. P. 339. https://doi.org/10.3109/19401736.2012.760081
Xu W., Yin W., Chen A. et al. 2014. Phylogeographical analysis of a cold-temperate freshwater fish, the amur sleeper (Perccottus glenii) in the amur and Liaohe River basins of Northeast Asia // Zool. Sci. V. 31. P. 671. https://doi.org/10.2108/zs130046
Yang P., Hu Z., Liu Y. et al. 2020. Mitochondrial genetic diversity and population structure of the Amur sleeper (Perccottus glenii) in Northeast China // Pakistan J. Zool. V. 52(4). P. 1531. https://doi.org/10.17582/journal.pjz/20190528220510
Yeh F.C., Yang R., Boyle T. 1999. Popgene. Version 1.31. University of Alberta and Centre for International Forestry Research. http://www.ualberta.ca/~fyeh/popgene_download.html
Zhang Y., Sun J., Shi L. et al. 2021. Population genetic pattern of the freshwater fish Amur sleeper (Perccottus glenii) across its native distribution area in China // Conserv. Genet. V. 22(1). P. 125. https://doi.org/10.1007/s10592-020-01323-0
Zhigileva O.N., Kulikova A.A. 2016. Specific biological features and genetic variation of Chinese sleeper Perccottus glenii (Odontobutidae) in aquatic bodies of Tyumen oblast // J. Ichthyol. V. 56. № 1. P. 124. https://doi.org/10.1134/S0032945216010173
Zhigileva O.N., Baranova O.G., Pozhidaev V.V. et al. 2013. Comparative analysis of using isozyme and ISSR-PCR markers for population differentiation of cyprinid fish // Turk. J. Fish. Aquat. Sci. V. 13. P. 159. https://doi.org/10.4194/1303-2712-v13_1_19
Zietjiewicz E., Rafalski A., Labuda D. 1994. Genome fingerprinting by simple sequence repeat (SSR)-anchored polymerase chain reaction amplification // Genomics. V. 20. P. 176.
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод


