Биология внутренних вод, 2022, № 2, стр. 127-134
Комплексное влияние интенсивности света и концентрации азота в среде на структурно-функциональные характеристики микроводорослей
Н. Ю. Шоман a, *, А. И. Акимов a
a Федеральный исследовательский центр “Институт биологии южных морей им. А.О. Ковалевского Российской академии наук”
Севастополь, Россия
* E-mail: n-zaichencko@yandex.ru
Поступила в редакцию 22.10.2020
После доработки 22.10.2021
Принята к публикации 29.10.2021
- EDN: WIGYXX
- DOI: 10.31857/S0320965222020139
Аннотация
Исследовано изменение световых зависимостей удельной скорости роста и внутриклеточного отношения углерода к хлорофиллу а (С/Хл а) от исходной концентрации азота в питательной среде у морской диатомовой водоросли Phaeodactylum tricornutum (Bohlin, 1897). Содержание азота (в нитратной форме) в среде в разных вариантах эксперимента было от 10 до 414 мкМ, интенсивность света изменялась от 14 до 1200 мкЭ м–2 с–1. Показано, что совокупное влияние интенсивности света и степени обеспеченности клеток азотом на исследуемые характеристики водорослей наблюдается при световом ингибировании роста. Снижение исходной концентрации азота в среде приводит к сужению диапазона оптимальной для роста водорослей интенсивности света, увеличению степени светового ингибирования их скорости роста и прогрессирующему снижению содержания хлорофилла в клетках. Константа полунасыщения, рассчитанная из уравнения Моно, возрастает при повышении интенсивности света по степенной зависимости. Полученные закономерности изменения удельной скорости роста и содержания Хл а в клетках водорослей в зависимости от концентрации азота в среде и световых условий культивирования могут быть использованы при разработке моделей оценки биомассы и первичной продукции фитопланктона, а также при интерпретации данных мониторинга природных вод и в биотехнологии массового культивирования микроводорослей.
ВВЕДЕНИЕ
Вопрос влияния факторов среды на физиологическое состояние водорослей привлекает огромный интерес исследователей на протяжении последних 50 лет. Тем не менее, раскрытие принципов и механизмов взаимодействия фотосинтезирующих растений с факторами внешней среды остается одной из основополагающих и в то же время нерешенных проблем в современной гидробиологии. К настоящему времени накоплен обширный материал по влиянию условий освещения (Sarthou et al., 2005; Schwaderer et al., 2011; Baird et al., 2013; Edwards et al., 2015) и степени обеспеченности азотом (Sakshaug et al., 1989; Sarthou et al., 2005; Litchman et al., 2006; Стельмах, Мансурова, 2021) на скорость роста и содержание хлорофилла в клетках водорослей. Однако большинство работ посвящено изучению эффекта, возникающего при изменении одного фактора, тогда как остальные остаются постоянными на оптимальном уровне. В то же время в природных условиях на рост водорослей влияет целый комплекс факторов и нередко при изменении одного из них изменяется действие другого. Исследований в этом направлении меньше (Finenko et al., 2003; Behrenfeld et al., 2005; Dickman et al., 2006; Shoman, 2015; Минеева и др., 2021) и они, как правило, ограничены узким диапазоном вариабельности изучаемых факторов.
Скорость роста – одна из основополагающих функциональных характеристик фитопланктона, определяющих пространственно-временную изменчивость его биомассы и продукции в морских и пресноводных экосистемах (Falkowski, Raven, 1997). Измерение концентрации Хл а – один из широко используемых методов для оценки биомассы фитопланктона в природных условиях. Для перехода от концентрации пигмента к биомассе водорослей применяется С/Хл а (Sathyendranath et al., 2009; Behrenfeld et al., 2005; Baird et al., 2013). Однако величина С/Хл а зависит от многих факторов: интенсивности света, температуры, обеспеченности водорослей минеральным питанием, таксономической структуры фитопланктона (Finenko et al., 2003; Cloern et al., 1995), что не позволяет вывести универсальный переходный коэффициент между концентрацией хлорофилла и биомассой фитопланктона. Поэтому выявление закономерностей изменения отношения С/Хл a в клетках водорослей в зависимости от условий их роста представляется актуальной задачей.
В большинстве районов Мирового океана продуктивность фитопланктона ограничивается концентрацией минерального азота в воде (Dodds et al., 1993; Glibert, 1988), и бо́льшая часть исследований, посвященных выявлению ответной реакции водорослей на изменение условий минерального питания, направлена на изучение изменчивости физиологических характеристик водорослей при дефиците азота. Однако для понимания физиологических процессов в клетках немаловажно исследование изменения структурно-функциональных показателей водорослей при концентрации биогенных элементов, которая еще не лимитирует рост, но изменяется в широких пределах. При этом возможно взаимодействие между уровнем биогенной обеспеченности клеток и световыми условиями их роста, поскольку скорость потребления биогенных элементов из среды зависит от многих внешних факторов, включая интенсивность света (Anderson, Roels, 1981; Lee et al., 2017). Так, ранее нами установлено, что влияние дефицита азота на изменение удельной скорости роста и содержания Хл а в клетках Phaeodactylum tricornutum (Bohlin, 1897) усиливается при повышении освещенности (Shoman, 2015).
Показано, что внесение избыточных концентраций минерального азота не оказывает существенного влияния на скорость его потребления фитопланктоном из среды (Кривенко, 2008). Микроводоросли, в отличие от макрофитов, способных запасать азот в тканях (Силкин, Хайлов, 1988), не накапливают его в клетках в избыточном количестве, а минимальное отношение углерода к азоту (C/N) у большинства представителей фитопланктона в условиях полной обеспеченности минеральным питанием достигает 6–8 (Sarthou et al., 2005). По этой причине изменение степени обеспеченности водорослей азотом будет находить отклик в изменении их структурно-функциональных показателей.
Цель работы – выявить основные закономерности изменения удельной скорости роста и внутриклеточного отношения С/Хл а в зависимости от исходной концентрации азота в среде и световых условий культивирования в широком диапазоне изменения каждого из факторов.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
В качестве объекта исследования выбрана альгологически чистая культура морской диатомовой водоросли P. tricornutum из коллекции культур микроводорослей и цианобактерий (IBSS) научно-образовательного центра коллективного пользования “Гидробионты мирового океана” (WDCM № 1201) Федерального исследовательского центра Института биологии южных морей. Вид часто используется в гидробиологических исследованиях в качестве модельного объекта, обладающего высокой жизнестойкостью при культивировании.
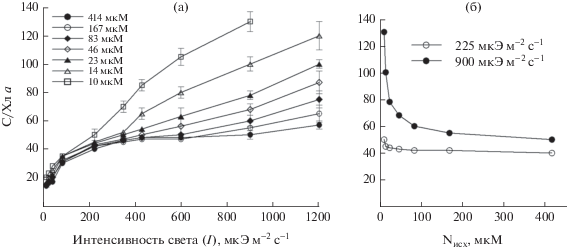
Nисх в разных вариантах эксперимента было 414, 167, 83, 46, 23, 14 и 10 мкМ. Среды с заданной Nисх готовили путем количественного разбавления питательной среды, содержащей 414 мкМ NaNO3, отношение N : P = 7 : 1, содержание остальных компонентов соответствовало прописи среды F/2 (Andersen, 2005). Исходное отношение N : P ≤7 в среде еще до эксперимента показало, что остановка роста водорослей в культуре произойдет из-за дефицита азота (Geider, Roche, 2002). Примененный в эксперименте подход количественного разбавления методически целесообразен, так как позволяет избежать изменения соотношения между азотом, фосфором и другими элементами среды, что само по себе может стать дополнительным фактором, влияющим на изменение структурно-функциональных характеристик водорослей (Левич и др., 1997).
Первые 7 сут эксперимента водоросли выращивали в полунепрерывном режиме на среде с Nисх при непрерывном освещении интенсивностью 35 мкЭ м–2 с–1 люминесцентными лампами белого света Oreol White/15 W. Разбавление культур свежей питательной средой проводили один раз в сутки до концентрации углерода в пробах 1300–1500 мкг л–1, содержание Хл а было 75–90 мкг л–1, С/Хл а – 14–20. Температуру поддерживали на уровне 20 ± 1°С. Для создания необходимых температурных условий использовали термостатированный бокс на базе холодильной витрины, оборудованной температурным регулятором W3230.
После периода адаптации водорослей к заданным условиям минерального питания на восьмые сутки эксперимента культуру переносили на различную интенсивность света – 14, 25, 42, 85, 225, 430, 600, 900 и 1200 мкЭ м–2 с–1. Для создания необходимых условий освещения использовали световую решетку, представляющую собой закрытую конструкцию с отдельными ячейками для склянок объемом 25 мл (высота 5 см, диаметр 2.5 см) и независимым источником освещения (светодиод) для каждой из них. Инкубационные склянки освещали снизу. Различную освещенность создавали с помощью металлических сетчатых фильтров, помещаемых между светодиодом и склянкой. Уровень освещенности определяли внутри склянок зондирующим 4П датчиком квантометра QSL 2101. Водоросли адаптировали к новым световым условиям в течение еще 3 сут (процедура та же, что и при адаптации к условиям минерального питания), после чего на 4-е сутки измеряли содержание углерода и Хл а в пробах. Эксперимент последовательно повторяли для каждой из исследуемых концентраций азота.
Определение концентрации Хл а в пробе проводили стандартным спектрофотометрическим методом. Для этого определенное количество суспензии водорослей фильтровали через стекловолокнистые фильтры Whatman (GF/C) диаметром 15 мм при вакууме ≤0.2 атмосфер. Осевшую на фильтре взвесь экстрагировали 90%-ным раствором ацетона при температуре 8–10°С в течение 18–24 ч. Экстракт осветляли центрифугированием при скорости 3000 об./мин в течение 10 мин. Оптическую плотность ацетоновых экстрактов определяли на двухлучевом регистрирующем спектрофотометре “Specord UV-VIS” (Karl Zeiss Jena). Концентрацию пигмента вычисляли по общепринятой формуле (Jeffrey, Humphrey, 1975).
Концентрацию углерода в пробе рассчитывали по оптической плотности суспензии клеток на длине волны 750 нм на спектрофотометре СФ-26 (Геворгиз, 2008). На длине волны 750 нм наблюдается поглощение света структурными элементами клеток и отсутствует селективное поглощение пигментами фотосинтетического аппарата водорослей. Предварительно для P. tricornutum получали калибровочную зависимость значений оптической плотности и содержания углерода, измеренного методом газо-адсорбционного хроматографического анализа на CHN-анализаторе (Grasshoff et al., 1983). Для интерполяции результатов использовали уравнение: С = 58 OD750 – 0.04, где C – концентрация углерода в мг л–1, OD750 – оптическая плотность суспензии на длине волны 750 нм, R2 = 0.99. Представленная зависимость применима для определения концентрации углерода в диапазоне 0.5–17 мг л–1. Калибровочные графики приведены ранее в работе (Шоман, Акимов, 2013). Для проверки достоверности получаемых результатов в ходе эксперимента для выборочных проб параллельно измеряли содержание углерода по оптической плотности и методом газо-адсорбционного хроматографического анализа на газоанализаторе CHN-1.
Удельную скорость роста микроводорослей рассчитывали по приросту углерода в пробе по уравнению в работе (Финенко, Ланская, 1971):
(1)
$\mu = \frac{{{\text{ln}}{{{\text{C}}}_{{\text{t}}}} - {\text{ln}}{{{\text{C}}}_{{\text{0}}}}}}{t},$Зависимость удельной скорости роста водорослей от интенсивности света описывали с помощью уравнения (Gallegos et al., 1983):
(2)
$\mu = \frac{{{{\mu }_{{{\text{max}}}}}}}{{\text{2}}}{\text{th}}\left( {\frac{{\alpha \cdot {\text{I}}}}{{{{\mu }_{{{\text{max}}}}}}}} \right)\left\{ {{\text{1}} - \frac{{{\text{I}} - {{{\text{I}}}_{{\text{b}}}}}}{{{{{{\text{[(I}} - {{{\text{I}}}_{{\text{b}}}}{{{\text{)}}}^{{\text{8}}}} + {\text{I}}_{{\text{t}}}^{8}{\text{]}}}}^{{{\text{1/8}}}}}}}} \right\},$РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Установлено, что изменение Nисх от 414 до 10 мкМ не влияло на величину удельной скорости роста P. tricornutum в световом диапазоне 14–150 мкЭ м–2 с–1 (рис. 1). Эффективность роста водорослей, рассчитанная из уравнения (1) и количественно равная тангенсу начального угла наклона µ-I зависимости, во всех вариантах эксперимента достоверно не изменялась и была в среднем 0.028 ± 0.007 сут–1 (мкЭ м–2 с–1)–1. Максимальная удельная скорость роста P. tricornutum равнялась 1.3 ± 0.1 сут–1. В то же время при интенсивности света >150 мкЭ м–2 с–1 снижение исходной концентрации азота в среде от 414 до 10 мкМ приводило к сужению диапазона оптимальной для роста водорослей интенсивности света и более раннему световому ингибированию их скорости роста: верхняя граница светового плато µ-I зависимости (It) снижалась от 900 до 150 мкЭ м–2 с–1, а коэффициент Ib, отражающий степень фотоингибирования удельной скорости роста, изменялся от 1700 до 580 мкЭ м–2 с–1 (рис. 2).
Рис. 1.
Изменение световой кривой удельной скорости роста Phaeodactylum tricornutum в зависимости от исходной концентрации азота в питательной среде: 414 (◼), 167 (⚪), 83 (⚫), 46 (◇), 23 (▲), 14 (△), 10 (+) мкМ.
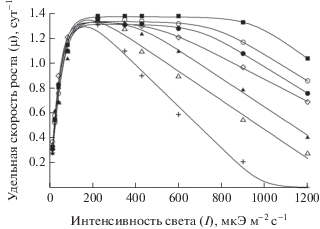
Рис. 2.
Изменение верхней границы светового плато It (⚪) и коэффициента степени фотоингибирования Ib (⚫) µ-I кривой у Phaeodactylum tricornutum в зависимости от исходной концентрации азота в среде (Nисх).

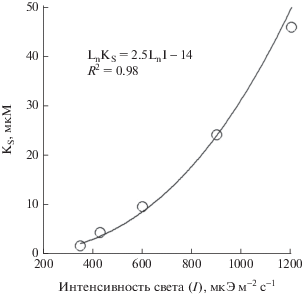
При каждой из исследуемых интенсивностей света в диапазоне от 150 до 1200 мкЭ м–2 с–1 зависимость удельной скорости роста от исходной концентрации азота в питательной среде с высокой точностью описывается уравнением Моно (Monod, 1942) (рис. 3). При этом константа полунасыщения, численно равная концентрации субстрата, при которой удельная скорость роста водорослей принимает значение половины от максимальной, возрастает от 1.8 мкМ при 350 мкЭ м–2 с–1 до 46 мкМ при 1200 мкЭ м–2 с–1 по степенной зависимости (рис. 4).
Рис. 3.
Зависимость удельной скорости роста водорослей от исходной концентрации азота в питательной среде (Nисх) при интенсивности света 225 (+), 350 (⚪), 430 (◼), 600 (◇), 900 (⚫), 1200 (△) мкЭ м–2 с–1.
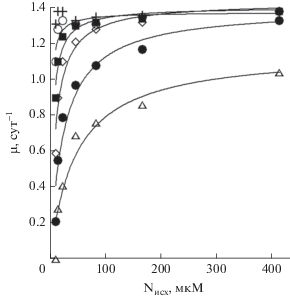
Рис. 4.
Зависимость константы полунасыщения (KS), рассчитанной из уравнения Моно (Monod, 1942), от световых условий роста водорослей.
При повышении интенсивности света от 14 до 150 мкЭ м–2 с–1 С/Хл а изменялось от 15 до 40 (содержание Хл а в суспензии снижалось при этом от 200 до 130 мкг л–1) и не зависело от исходной концентрации азота в питательной среде (рис. 5). При интенсивности света, превышающей 150 мкЭ м–2 с–1, наблюдалось различие в поведении параметра в зависимости от Nисх. Так, при Nисх в среде, равной 414 мкМ, выход световой зависимости С/Хл а на плато (Iplato) наблюдали при освещенности 350 мкЭ м–2 с–1, дальнейшее повышение интенсивности света вплоть до 1200 мкЭ м–2 с–1 не приводило к изменению величины отношения. При снижении Nисх от 414 до 10 мкМ содержание хлорофилла в клетках водорослей уменьшалось. При этом диапазон изменчивости отношения в зависимости от Nисх расширялся при увеличении освещенности. Так, при изменении исходной концентрации азота в среде от 414 до 10 мкМ отношение С/Хл а изменялось от 40 до 50 (содержание Хл а в суспензии уменьшалось от 150 до 112 мкг л–1) при интенсивности света 225 мкЭ м–2 с–1 и от 50 до 130 (концентрация Хл а снижалась от 114 до 14 мкг л–1) при I = = 900 мкЭ м–2 с–1.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Результаты исследования показали, что эффект совместного действия интенсивности света и обеспеченности водорослей азотом на удельную скорость роста и содержание Хл а в клетках превышает сумму влияния каждого из факторов. Так, в световом диапазоне от 14 до 150 мкЭ м–2 с–1 снижение исходной концентрации азота в среде от 414 до 10 мкМ не влияло на структурно-функциональные характеристики водорослей. В то же время, при I > 150 мкЭ м–2 с–1 наблюдалось изменение световых зависимостей удельной скорости роста и отношения С/Хл а по мере снижения Nисх, что указывает на повышение потребности водорослей в азоте при увеличении освещенности. Это, вероятно, обусловлено увеличением расхода биогенного элемента на восстановление фотоиндуцируемых повреждений фотосинтетического аппарата, а также синтез белков, необходимых для работы реакционных центров (Falkowski, Raven, 1997; Han et al., 2000). Кроме того, при повышении интенсивности света увеличивается количество фотопротекторных пигментов, для синтеза которых также необходим азот (Ben-Amotz et al., 1989). Очевидно, в условиях высокой освещенности для поддержания скорости фотосинтеза и роста на максимальном уровне водорослям необходим больший поток азота в клетку.
Известно, что кинетика потребления азота зависит от концентрации биогенного элемента в среде (Harrison, Hurd, 2001; Smit, 2002) и внутри клетки (Rosenberg, Ramus, 1982; Flynn, 2001), а также от влияния абиотических факторов, в частности интенсивности света (Nishihara et al., 2005; Lee et al., 2017). В настоящей экспериментальной работе скорость поглощения азота из среды не определяли, а в литературе по морским микроводорослям нам не удалось найти однозначный ответ о влиянии интенсивности света на ее величину. Так, в ряде исследований показано, что скорость потребления азота из среды возрастает при повышении интенсивности света (Nishihara et al., 2005; Lee et al., 2017), в других (Sinclair et al., 2006; Чербаджи, 2012) – интенсивность света не влияет на величину описываемого параметра. Кроме того, имеются данные об угнетающем влиянии света высокой интенсивности на скорость поглощения азота (Anderson, Roels, 1981).
Полученные нами результаты позволяют полагать, что скорость поглощения азота из среды повышается с увеличением интенсивности света. Так, повышение С/Хл а, наблюдаемое при постоянной освещенности (при I ≥150 мкЭ м–2 с–1) по мере снижения Nисх, свидетельствует об уменьшении удельного содержания азота в клетках водорослей. Ранее нами установлено, что при фиксированной интенсивности света отношение С/Хл а экспоненциально возрастает при повышении C/N в клетках. При этом влияние дефицита азота на величину С/Хл а усиливается при повышении интенсивности света, что обусловлено увеличением фотодеструкции Хл а при повышении облученности, наблюдаемой на фоне снижения скорости синтеза пигмента из-за недостатка азота (Shoman, 2015) В свою очередь, снижение внутриклеточной концентрации азота приводит к повышению скорости его потребления из среды: обедненные по азоту клетки с большей скоростью поглощают биогенный элемент из воды, чем водоросли с полным азотным пулом (Flynn, 2001).
Кроме того, рядом авторов показано, что снижение исходной концентрации азота в среде приводит к уменьшению потенциальной доступности биогенного элемента на единицу поверхности водорослей (Гончаров, Зотов, 2003), что также может рассматриваться как косвенный фактор, снижающий скорость поступления азота в клетку.
Основываясь на указанных фактах, мы полагаем, что в условиях высокой освещенности, несмотря на избыточное содержание нитратов в воде, количество азота, поглощаемое клеткой из среды, не позволяет обеспечить все внутренние потребности водорослей в биогенном элементе. Вследствие этого происходит своего рода перераспределение внутреннего запаса азота между клеточными компонентами. Количество биогенного элемента, используемое непосредственно на рост и синтез Хл а, значительно уменьшается, что отражается в снижении удельной скорости роста водорослей и повышении внутриклеточного отношения С/Хл а.
Полученные зависимости изменения удельной скорости роста и внутриклеточного С/Хл а у водорослей в зависимости от исходной концентрации азота в среде и световых условий культивирования могут быть использованы при разработке моделей оценки биомассы и первичной продукции фитопланктона, а также при интерпретации данных мониторинга природных вод и в биотехнологии массового культивирования микроводорослей. Выявленные закономерности, очевидно, характерны для большинства видов морских и пресноводных микроводорослей, поскольку в основе изменений лежат физиологические механизмы, присущие всем фотосинтезирующим организмам. Количественные показатели в этих зависимостях будут различаться для разных представителей фитопланктона, отражая видоспецифичность адаптации водорослей к уровню освещенности и условиям минерального питания. Полученные результаты вносят вклад в общее понимание физиологических процессов, протекающих в клетках водорослей, а также механизмов устойчивости и стратегий адаптации водорослей к меняющимся условиям роста.
Выводы. Эффект совместного действия интенсивности света и степени обеспеченности клеток азотом на исследуемые структурно-функциональные характеристики водорослей превышает сумму влияния каждого из факторов. При интенсивности света 14–150 мкЭ м–2 с–1 снижение исходной концентрации азота в среде от 414 до 10 мкМ не влияло на удельную скорость роста и внутриклеточное отношение С/Хл а у P. tricornutum. В то же время, при освещенности >150 мкЭ м–2 с–1 снижение Nисх приводило к сужению диапазона оптимальной для роста водорослей интенсивности света, увеличению степени светового ингибирования их скорости роста и прогрессирующему снижению содержания Хл а клетках. Потребность водорослей в азоте по мере увеличения плотности светового потока возрастает. Изменение µ-I и С/Хл-I зависимостей при высокой освещенности, вероятно, обусловлено увеличением расхода внутриклеточного азотного пула на репарацию фотоиндуцируемых повреждений фотосинтетического аппарата и синтез фотопротекторных пигментов, а также повышением константы полунасыщения по скорости роста и поглощению азота по мере увеличения интенсивности света.
Список литературы
Геворгиз Р.Г., Щепачев С.Г. 2008. Методика измерения оптической плотности суспензии низших фототрофов на длине волны света 750 нм. Севастополь: ИнБЮМ НАНУ.
Гончаров А.Ю., Зотов А.Б. 2003. Зависимость удельной продукции микроводорослей от обеспеченности поверхности клеток биогенными элементами // Экология моря. Т. 64. С. 51.
Кривенко О.В. 2008. Содержание и потребление неорганических соединений азота в Черном море // Морской экологический журнал. Т. 12. № 4. С. 13.
Левич А.П., Максимов В.Н., Булгаков Н.Г. 1997. Теоретическая и экспериментальная экология фитопланктона. Управление структурой и функциями сообществ. Москва: Изд-во НИЛ.
Минеева Н.М., Степанова И.Э., Семадени И.В. 2021. Биогенные элементы и их роль в развитии фитопланктона водохранилищ Верхней Волги // Биология внутр. вод. № 1. С. 24. https://doi.org/10.31857/S0320965221010095
Силкин В.А., Хайлов К.М. 1988. Биоэкологические механизмы управления в аквакультуре. Ленинград: Наука.
Стельмах Л.В., Мансурова И.М. 2021. Физиологический механизм выживания динофитовых водорослей в условиях биогенного лимитирования // Биология внутр. вод. № 2. С. 198. https://doi.org/10.31857/S0320965221020157
Финенко З.З., Ланская Л.А. 1971. Рост и скорость деления водорослей в лимитированных объемах воды // Экологическая физиология морских планктонных водорослей (в условиях культур). Киев: Наук. думка. С. 22.
Чербаджи И.И. 2012. Влияние факторов среды на скорость поглощения аммония и ортофосфата популяцией красной водоросли Ahnfeltia tobuchiensis в заливе Измены (о. Кунашир) // Известия Тихоокеанского научно-исследовательского рыбохозяйственного центра. Т. 168. С. 203.
Шоман Н.Ю., Акимов А.И. 2013. Действие света и температуры на удельную скорость роста диатомовых водорослей Phaeodactylum tricornutum и Nitzschia sp. № 3 // Морской экол. журнал. Т. 12. № 1. С. 85.
Andersen R.A. 2005. Algal culturing techniques. New York: Elsevier.
Anderson S.M., Roels O.A. 1981. Effects of light intensity on nitrate and nitrate uptake and excretion by Chaetoceros curvisetus // Mar. Biol. V. 62. P. 257. https://doi.org/10.1007/BF00397692
Baird M.E., Ralph P.J., Rizwi F. et al. 2013. A dynamic model of the cellular carbon to chlorophyll ratio applied to a batch culture and a continental shelf ecosystem // Limnol., Oceanogr. V. 58. № 4. P. 1215. https://doi.org/10.4319/lo.2013.58.4.1215
Behrenfeld M., Boss E., Siegel D.A., Shea D.M. 2005. Carbon-based ocean productivity and phytoplankton physiology from space // Global Biogeochem Cycles. V. 19. № 1. GB1006. https://doi.org/10.1029/2004GB002299
Ben-Amotz A., Shaish V., Avron M. 1989. Mode of action of the massively accumulated β-carotene of Dunaliella bardawil in protecting the alga against damage by excess irradiation // Plant Physiol. V. 91. P. 1040. https://doi.org/10.1104/PP.91.3.1040
Cloern J.E., Grenz C., Vidergar-Lucas L. 1995. An empirical model of the phytoplankton chlorophyll: carbon ratio - the conversion between productivity and growth // Limnology and Oceanography. V. 7. P. 1310–1313. https://doi.org/10.4319/lo.1995.40.7.1313
Dickman E.M., Vanni M.J., Horgan M.J. 2006. Interactive effects of light and nutrients on phytoplankton stoichiometry // Oecologia. V. 149. № 4. P. 676. https://doi.org/10.1007/s00442-006-0473-5
Dodds W.K., Strauss E.A., Lehmann R. 1993. Nutrient dilution and removal bioassays to estimate phytoplankton response to nutrient control // Arch. Hydrobiol. V. 128. P. 467. https://doi.org/10.1127/archiv-hydrobiol/128/1993/467
Edwards K.F., Thomas M.K., Klausmeier C.A., Litchman E. 2015. Light and growth in marine phytoplankton: allometric, taxonomic, and environmental variation // Limnol., Oceanogr. V. 60. № 2. P. 540. https://doi.org/10.1002/lno.10033
Falkowski P.G., Raven J.A. 1997. Aquatic Photosynthesis. First edition. Malden, Massachusetts: Blackwell Science.
Finenko Z.Z., Hoepffner N., Williams R., Piontkovski S.A. 2003. Phytoplankton carbon to chlorophyll a ratio: response to light, temperature and nutrient limitation // Mar. Ecol. J. V. 2. № 2. P. 40.
Flynn K.J. 2001. A mechanistic model for describing dynamic multi-nutrient, light, temperature interactions in phytoplankton // J. Plankton Res. V. 23. P. 977. https://doi.org/10.1093/plankt/23.9.977
Gallegos C.L., Platt T., Harrison W.G., Irwin B. 1983. Photosynthetic parameters of arctic marine phytoplankton: vertical variations and time scales of adaptation // Limnol., Oceanogr. V. 28. № 4. P. 698. https://doi.org/10.4319/LO.1983.28.4.0698
Geider R.J., La Roche J. 2002. Redfield revisited: variability of C : N : P in marine microalgae and its biochemical basis // European Journal of Phycology. V. 37. № 1. P. 1. https://doi.org/10.1017/S0967026201003456
Glibert P.M. 1988. Primary productivity and pelagic nitrogen cycling // Nitrogen cycling in coastal marine environments. New York: Wiley. P. 3.
Grasshoff K., Ehrhardt M., Kremling K. 1983. Methods of seawater analysis. Basel: Verlag Chemie.
Han P., Virtanen M., Koponen J., Straskraba M. 2000. Effect of photoinhibition on algal photosynthesis: a dynamic model // J. Plankton Res. V. 22. № 5. P. 865. https://doi.org/10.1093/PLANKT/22.5.865
Harrison P.J., Hurd C.L. 2001. Nutrient physiology of seaweeds: application of concepts to aquaculture // Cah. Biol. Mar. V. 42. № 1–2. P. 71.
Jeffrey S.W., Humphrey G.F. 1975. New spectrophotometric equations for determining chlorophylls a, b, c1 and c2 in higher plants, algae and natural phytoplankton // Biochem. Physiol. Pflanzen. V. 167. P. 191. https://doi.org/10.1016/S0015-3796(17)30778-3
Lee K.H., Jeong H.J., Kim H.J., Lim A.S. 2017. Nitrate uptake of the red tide dinoflagellate Prorocentrum micans measured using a nutrient repletion method: effect of light intensity // Algae. V. 32. № 2. P. 139. https://doi.org/10.4490/algae.2017.32.5.20
Litchman E., Klausmeier C.A., Miller J.R. et al. 2006. Multi-nutrient, multi-group model of present and future oceanic phytoplankton communities // Biogeosciences. V. 3. P. 585. https://doi.org/10.5194/bg-3-585-2006
Monod J. 1942. Recherches sur la croissance des cultures bacteriennes. Paris: Hermann.
Nishihara G.N., Terada R., Noro T. 2005. Effect of temperature and irradiance on the uptake of ammonium and nitrate by Laurencia brongniartii (Rhodophyta, Ceramiales) // J. Appl. Phycol. V. 17. № 5. P. 371. https://doi.org/10.1007/s10811-005-5519-2
Rosenberg C., Ramus J. 1982. Ecological growth strategies in the seaweeds Gracilaria foliifera (Rhodophyceae) and Ulva sp. (Chlorophyceae): soluble nitrogen and reserve carbohydrates // Mar. Biol. V. 66. № 3. P. 251. https://doi.org/10.1007/BF00397030
Sakshaug E., Andresen K., Kiefer D.A. 1989. A steady state description of growth and light absorption in the marine planktonic diatom Skeletonema costatum // Limnol., Oceanogr. V. 34. P. 198. https://doi.org/10.4319/lo.1989.34.1.0198
Sarthou G., Timmermans K.R., Blain S., Treguer P. 2005. Growth physiology and fate of diatoms in the ocean: a review // J. Sea Res. V. 53. № 1. P. 25. https://doi.org/10.1016/j.seares.2004.01.007
Sathyendranath S., Stuart V., Nair A. et al. 2009. Carbon-to-chlorophyll ratio and growth rate of phytoplankton in the sea // Mar. Ecol. Progr. Ser. V. 383. P. 73. https://doi.org/10.3354/meps07998
Schwaderer A.S., Yoshiyama K., de Tezanos Pinto et al. 2011. Eco-evolutionary differences in light utilization traits and distributions of freshwater phytoplankton // Limnol., Oceanogr. V. 56. № 2. P. 589. https://doi.org/10.4319/lo.2011.56.2.0589
Shoman N.Yu. 2015. The dynamics of the intracellular contents of carbon, nitrogen, and chlorophyll a under conditions of batch growth of the diatom Phaeodactylum tricornutum (Bohlin, 1897) at different light intensities // Rus. J. Mar. Biol. V. 4. № 5. P. 356. https://doi.org/10.1134/S1063074015050132
Sinclair G.A., Kamykowski D., Milligan E., Schaeffer B. 2006. Nitrate uptake by Karenia brevis. I. Influences of prior environmental exposure and biochemical state on diel uptake of nitrate // Mar. Ecol. Prog. Ser. V. 328. P. 117. https://doi.org/10.3354/meps328117
Smit A.J. 2002. Nitrogen uptake by Gracilaria gracilis (Rhodophyta): adaptations to a temporally variable nitrogen environment // Botanica Marina. V. 45. № 2. P. 196. https://doi.org/10.1515/BOT.2002.019
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод