Биология внутренних вод, 2022, № 3, стр. 247-255
Пространственно-временной анализ развития нанопланктонных динофитовых в оз. Байкал
Н. А. Бондаренко *
Лимнологический институт Сибирского отделения Российской академии наук
Иркутск, Россия
* E-mail: nina@lin.irk.ru
Поступила в редакцию 23.06.2021
После доработки 06.01.2022
Принята к публикации 14.01.2022
- EDN: QSISXA
- DOI: 10.31857/S0320965222030020
Аннотация
Проведен анализ динамики численности одной из основных групп современного планктона озера Байкал – миксотрофных нанофлагеллат из отдела динофитовых, максимальное количество которых по сравнению с концом прошлого века резко увеличилось (от 6 до 175 тыс. кл./л). В прошлом столетии пик численности нанопланктонных динофитовых приходился на май–начало июня (завершение вегетации весеннего комплекса водорослей) и на ноябрь‒первую половину декабря (конец развития осеннего фитопланктона). В настоящее время их повышенные концентрации зарегистрированы в период завершения развития позднелетнего фитопланктона, максимальных атмосферных осадков и наибольшей рекреационной нагрузки на экосистему озера.
ВВЕДЕНИЕ
Глобальные климатические колебания и интенсификация антропогенного влияния привели к структурным перестройкам в водных экосистемах, один из результатов которых – усиление значения в пищевых сетях нанопланктонных фитофлагеллат, что вызвало изменения и в других трофических звеньях (Dai et al., 2005; Honsell et al., 2013; Корнева, Соловьева, 2017; Корнева и др., 2018; Курашов и др., 2018; De Lima et al., 2019; Kang et al., 2019). Массовое развитие несвойственных данной акватории организмов является серьезной угрозой для любой водной экосистемы, в том числе крупных пресноводных водоемов и водотоков, важных источников питьевой воды (Barbiero, Tuchman, 2004; Schindler, 2006; Чекрыжева, 2008; Munawar et al., 2017; Корнева и др., 2018; Курашов и др., 2018).
В нынешнем столетии и в биоте оз. Байкал также наблюдаются масштабные структурные трансформации (Kravtsova et al., 2014; Timoshkin et al., 2016), в том числе в фитопланктоне (Hampton et al., 2008; Бондаренко, Логачева, 2016; Izmest’eva et al., 2016; Bondarenko et al., 2020). Последние привели, во-первых, к снижению роли криофильного байкальского комплекса и доминированию в весенний период широко распространенных водорослей, имеющих более мелкие размеры (Бондаренко, Логачева, 2016; Бондаренко и др., 2020), что, по мнению авторов, вызвано поздним наступлением и снижением длительности ледостава на озере. Во-вторых, в местах, где расположены населенные пункты, доступность легко минерализуемых органических веществ антропогенного происхождения, поступающих в воды озера с притоками, способствовала внедрению и интенсивному размножению в прибрежной зоне озера мелких жгутиконосцев, в первую очередь хламидомонад и криптофитовых (Бондаренко и др., 2020). Перечисленные факты свидетельствуют о стрессовом состоянии биоты оз. Байкал, что требует дальнейшего тщательного слежения за экосистемой. Именно такие наблюдения позволяют четко выявлять даже незначительные изменения в водных объектах, определять их природу естественного или антропогенного характера, и делать прогноз на будущее. Известно, что фитопланктон из-за своей высокой скорости размножения и быстрого ответа на условия окружающей среды, – информативный индикатор текущего состояния экосистемы (Reynolds, 2006).
В последние годы (2015–2020 гг.) режимные наблюдения за фитопланктоном оз. Байкал позволили выявить и другие изменения в его структуре, а также отметить увеличение роли мелкоклеточных динофлагеллат в летнем и осеннем планктоне. Составу и особенностям биологии крупноклеточных эндемичных байкальских динофитовых посвящено множество работ (Антипова, 1955; Кожова, 1956; Obolkin et al., 2019 и др.). Они относятся к организмам, которые начинают свое развитие в межкристаллической ледовой воде, а затем выходят в планктон (Оболкина и др., 2000). Размножаются эти крупные жгутиконосцы ранней весной подо льдом в таком огромном количестве, что вода приобретает буро-желтый оттенок, а на ее поверхности в проруби заметны полосы буро-желтой мути. Молекулярно-биологические исследования уточнили состав и происхождение динофитовых озера, развивающихся в подледный период (Анненкова и др., 2009; Annenkova, 2013). Оказалось, что они – ближайшие родственники динофлагеллат, обитающих в северных морях. В отличие от крупноклеточных, о мелкоклеточных динофитовых оз. Байкал до настоящего времени известно мало. Сообщалось, что в планктоне круглогодично во всей водной толще – от поверхности до придонных глубин (1400 м) – присутствуют две нанопланктонные формы Glenodinium sp. и Peridinium sp. В связи с малыми размерами клеток их роль в создании биомассы невелика (Бондаренко, 1995).
Цель работы – дать оценку количественных характеристик мелкоклеточных динофитовых озера, а также изучить межгодовую и сезонную динамику их развития на современном этапе.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
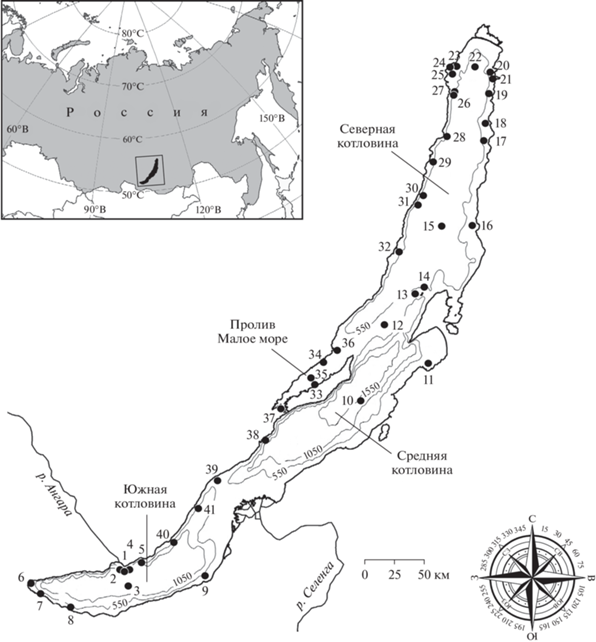
В основу работы положены материалы по исследованию структуры и количественных параметров планктонных альгоценозов, полученные в 2015–2020 гг. В подледный период исследования проводили на двух станциях, расположенных в зал. Лиственничный (Южный Байкал). В период открытой воды дважды (в июне и сентябре) в каждой котловине озера обследовали от 5 до 20 станций (рис. 1). Пробы отбирали в 100 м от берега в слое 0–1 м. Фоновыми служили станции, расположенные в прибрежной зоне, не прилегающей к населенным пунктам, и в пелагиали озера на глубинах 0–>1000 м. Более подробные исследования динамики численности мелкоклеточных динофитовых в летне-осенний период проводили в прибрежной зоне и пелагиали пролива Малое море. Для сравнения использовали архивные материалы автора за 1998–1999 гг.
Рис. 1.
Карта-схема станций отбора проб: 1, 2 – залив Лиственничный, 3 – центр разреза Листвянка-Танхой, 4 – мыс Березовый, 5 – бухта Большие Коты, 6 – пос. Култук, 7 – г. Слюдянка, 8 – г. Байкальск, 9 – г. Бабушкин, 10 – центр разреза Ухан-Турка, 11 – пос. Максимиха, 12 – центр разреза Хобой-Ушканий, 13, 14 – Большой Ушканий остров, 15 – центр разреза Елохин-Давша, 16 – поc. Давша, 17 – бухта Шегнанда, 18 – бухта Томпуда, 19 – Хакусы, 20 – бухта Фролиха, 21 – бухта Аяя, 22 – центр разреза Немнянка-Заречное, 23 – пос. Заречное, 24 – бухта Сеногда, 25 – бухта Слюдянская, 26 – мыс Лударь, 27 – мыс Красный Яр, 28 – мыс Котельниковский, 29 – мыс Мужинай, 30 – мыс Черемшаный, 31 – мыс Елохин, 32 – мыс Солонцовый, 33 – пос. Хужир, Малое море, 34 – бухта Карганте, 35 – центр Малого моря, 36 – пос. Зама, 37 – пос. Сахюрта, 38 – бухта Ая, 39 – пос. Бугульдейка, 40 – пос. Голоустное, 41 – бухта Песчаная.
Пробы фитопланктона объемом 1 л отбирали батометром Руттнера и фиксировали раствором Утермеля. В лаборатории пробы концентрировали методом седиментации, просматривали в двойной повторности в камере Нажотта объeмом 0.1 мл в световом микроскопе “Peraval” при увеличении ×720 и ×1200. Биомассу водорослей определяли с учетом индивидуальных объeмов их клеток (Макарова, Пичкилы, 1970). Идентификацию водорослей проводили по (Матвiенко, Литвиненко, 1977). Название динофитовых приведены согласно классификации (Guiry, Guiry, 2021).
Проанализировано ~530 количественных проб. При статистической обработке экспериментальных выборок использовали стандартные компьютерные программы, вычисляли средние значения выборок со стандартной ошибкой.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
В планктоне трех котловин озера встречаются от двух до четырех видов нанопланктонных динофитовых, представленных организмами, которых ранее относили к родам Glenodinium Ehr. и Peridinium Ehr. В проливе Малое море и в прибрежной зоне Большого Ушканьего острова количество видов больше (до пяти). По морфологическим характеристикам они близки к представителям современных родов Biecheleria Moestrup, Lindberg & Daugbjerg, Symbiodinium Freudenthal, Woloszynskia Thompson и Scrippsiella Balech ex Loeblich. Для точного установления видовой принадлежности необходимо специальное молекулярно-биологическое исследование.
Длина клеток фитофлагеллат 15–20 мкм, ширина 15–17 мкм. В подледный период доминируют жгутиконосцы, клетки которых содержат один небольшой хлоропласт, часто плохо заметный. Относительная численность представителей с хорошо выраженными дисковидными или пластинчатыми желто-бурыми хлоропластами не превышает 5% общего количества динофитовых. Их обилие повышается летом: в июне – 12.1 ± 4.3%, июле – 21.0 ± 8.1%, в августе – 49.4 ± 23.8% (при p = 0.05) общей численности динофлагеллат. В сентябре их количество начинает снижаться (31.1 ± 10.0%), а в октябре они единичны. Нанопланктонные жгутиконосцы размножаются в интерстициальной ледовой воде одновременно с Gymnodinium baicalense Antipova и G. baicalense var. minor Antipova, крупными эндемичными динофитовыми.
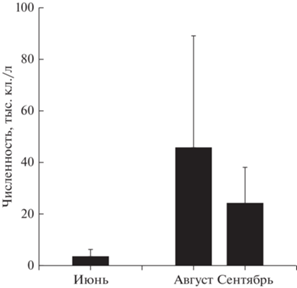
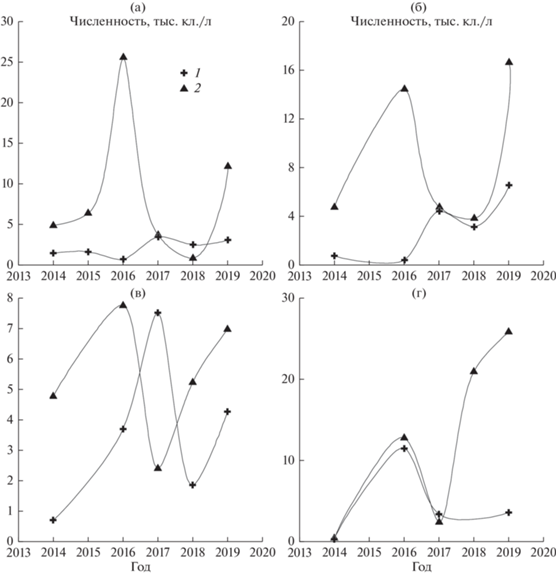
Межгодовая динамика. В прошлом веке количество нанопланктонных динофитовых было незначительным (рис. 2). Их среднегодовая численность в поверхностном слое воды (0–1 м) в 1998–1999 гг. достигала 1885 ± 691 кл./л (p = 0.05), при максимальных величинах 6.4–6.7 тыс. кл./л. В 2015–2020 гг. среднемноголетняя численность увеличилась почти на порядок (в 8.4 раза): до 15834 ± 11069 кл./л (p = 0.05). Наиболее обильными они были в 2016 г. и 2019 г. (рис. 3а–3г), с максимальными концентрациями в южной части озера (12.1–25.5 тыс. кл./л) и проливе Малое Море (20.9–25.8 тыс. кл./л). В связи с доминированием в летне-осенний период только мелкоклеточных представителей альгофлоры (объемы клеток 4–280 мкм3) роль более крупных (~1870–2000 мкм3) нанопланктонных динофитовых в создании биомассы фитопланктона оз. Байкал была значительна (23–71%), среднее значение численности в период максимального развития (август) достигало 45 748 ± 43 429 кл./л.
Рис. 2.
Сезонная динамика численности мелких видов динофитовых в 1998 (1) и 1999 (2) гг., Южный Байкал.
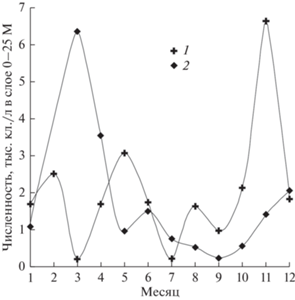
Рис. 3.
Динамика численности динофитовых в 2014–2020 гг. в прибрежной зоне оз. Байкал: 1 – июнь, 2 – сентябрь; a – южная котловина озера, б – центральная котловина, в – северная котловина, г – Малое море.
Сезонная динамика. В прошлом веке повышенную численность нанопланктонных динофлагеллат (рис. 2) отмечали в мае–начале июня (конец вегетации весеннего комплекса водорослей) и поздней осенью (ноябрь), иногда в начале зимы (начало декабря), время завершения развития осеннего фитопланктона. В подледный период (февраль–март) максимум, как правило, регистрировали в приповерхностном слое воды (0–10 см), в момент выхода динофлагеллат из интерстициальной ледовой воды в планктон, когда они еще не успели рассредоточиться в водном столбе.
В настоящее время эти жгутиконосцы стали не только постоянным обитателем планктона, но и достаточно многочисленными. Подо льдом концентрация мелких динофитовых была несущественной – 0.25–2.0 тыс. кл./л (рис. 4), в период открытой воды увеличивалась (рис. 3, рис. 5). В южной и центральной котловинах, а также в проливе Малое море более высокие количественные показатели чаще всего зарегистрированы в начале осени (рис. 3а, 3б, 3г). В северной котловине озера (рис. 3в), где в большей части прибрежной зоны происходит массовое развитие донных нитчатых водорослей рода Spirogyra и их отмирающие нити в большом количестве встречаются в планктоне, значительные концентрации жгутиконосцев отмечали в июне.
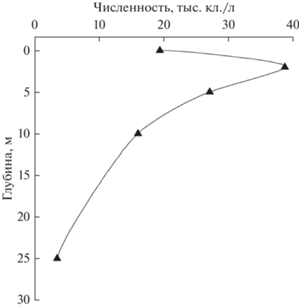
Рис. 4.
Вертикальное распределение динофитовых в подледный период 2019 г., залив Лиственничный. 1 – март, 2 – апрель.

В проливе Малое море обилие динофитовых увеличивалось от июня к августу и затем плавно начинало снижаться (рис. 5). В этой части озера, излюбленном месте отдыха туристов, зарегистрированы максимальные количества нанопланктонных динофлагеллат и в прибрежье, и в пелагиали (рис. 3г, рис. 5).
Вертикальное распределение. В период открытой воды нанопланктонные динофитовые наиболее обильны в верхнем слое 0–5 м (рис. 6). Чаще всего максимальные концентрации летом и осенью выявлены на глубине 1–2 м. В июле 2018 г. в центральной части Малого моря именно на этой глубине зафиксирована значительная численность нанопланктонных динофлагеллат (39.5 тыс. кл./л), хотя их максимальные количества за все время наблюдений (175.1 тыс. кл./л) отмечены в поверхностном слое воды в Малом море в августе 2019 г. Доминировали представители рода Scrippsiella, их доля достигала 59% общей численности динофлагеллат.
Подо льдом распределение нанопланктонных динофлагеллат в слое 0–25 м неравномерно (рис. 4). В марте они сконцентрированы в верхних слоях, в апреле по мере опускания фитопланктона распределяются по всему 25-метровому слою.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Первые структурные изменения в фитопланктоне оз. Байкал отмечали еще в середине прошлого века (Антипова, 1974; Поповская, 1987, 1991). Г.И. Поповская (1991) писала, что вследствие замены крупноклеточных форм водорослей на мелкоклеточные происходит увеличение численности фитопланктона, в дальнейшем в планктонных фитоценозах озера будет уменьшаться роль характерных видов специфического байкальского комплекса и увеличиваться таковая мелкоклеточного фитопланктона. Ее прогноз полностью сбылся.
В последние годы (2015–2020 гг.) в период открытой воды в планктоне пелагиали и прибрежной зоны оз. Байкал в массе развиваются мелкоклеточные миксотрофные жгутиконосцы (суммарная численность до 650–700 тыс. кл./л): криптофитовые, гаптофитовые, зеленые и динофитовые (Бондаренко, Логачева, 2016; Бондаренко и др., 2020; Bondarenko et al., 2020).
Динофитовые – одна из основных групп водорослей не только в оз. Байкал, но и в других морских и пресных водах, что связано с их способностью создавать большую биомассу. Это свойство обеспечивается не только скоростью размножения динофитовых, но и их чувствительностью к параметрам среды и высокой конкурентной способностью по отношению к другим микроводорослям (Антипова, 1955; Кожова, 1956; Матвiенко, Литвиненко, 1977; Honsell et al., 2013; Kang et al., 2019; Стельмах, Мансурова, 2021). Конкурентное преимущество миксотрофных водорослей, к которым относятся и динофитовые, обусловлено также их стратегией питания – способностью, осуществляя процесс фотосинтеза, в качестве дополнительного питания использовать органические вещества (Olrik, 1998).
С чем может быть связано увеличение численности нанопланктонных динофитовых в последние годы? В прошлом столетии их максимальные количества приходились на май или начало июня (конец вегетации весеннего комплекса водорослей) и позднюю осень, иногда начало зимы, – время завершения развития осеннего фитопланктона. В настоящее время максимальные численности зарегистрированы поздним летом (в августе) или в начале осени – не только во время завершения развития позднелетнего фитопланктона и максимальной рекреационной нагрузки на экосистему озера, но и максимальных атмосферных осадков. В последние годы в Прибайкалье произошло перераспределение осадков на позднее лето–осень, именно на время, когда обильны нанопланктонные миксотрофные динофитовые. Влияние дождевых осадков на локальное массовое развитие цианопрокариот поздним летом подробно рассмотрено в работе (Bondarenko et al., 2021). Оказалось, что содержание фосфатов, нитратов и ионов аммония в байкальской воде после дождей увеличивается в 3–30 раз по сравнению со среднемноголетними данными. Судя по результатам 2015–2020 гг., когда отмечено высокое количество и осадков в позднелетний период, и миксотрофных динофлагеллат, их максимальные концентрации могут быть связаны с увеличением притока биогенных элементов с дождевыми водами. Ранее показано (Obolkin et al., 2019), что крупные динофитовые, развивающиеся в подледный период, реагируют на дождевые осадки, богатые азотом. Учитывая биологию миксотрофных фитофлагеллат, следует отметить и факт увеличения содержания легкорастворимого органического вещества в воде озера в последние годы (Земская и др., 2019; Бондаренко и др., 2020). Четкая связь между численностью миксотрофных жгутиковых и концентрацией растворенного органического вещества в прибрежной воде озера выявлена ранее (Бондаренко и др., 2020). Основным источником растворенного органического вещества в воде озера служат сточные воды населенных пунктов, дополнительным может служить РОВ, образующееся при разложении микроводорослей планктона, а также макроводорослей и цианопрокариот, интенсивно развивающихся на дне мелководных участков оз. Байкал (Timoshkin et al., 2016). Еще одним источником служат прижизненные выделения фитопланктона. Установлено, что в оз. Байкал на долю внеклеточной продукции приходится 49–54% суммарной интенсивности фотосинтеза (Бондаренко и др., 2020).
Исследования многолетней динамики фитопланктона в других пресных водоемах и водотоках выявляют аналогичные перестройки. В настоящее время фитофлагеллаты доминируют в летнем планктоне многих водных экосистем: в Великих Американских озерах (Barbiero, Tuchman, 2004; Munawar et al., 2017), Онежском озере (Чекрыжева, 2008), водохранилищах р. Волги (Корнева, Соловьева, 2017; Корнева и др., 2018), северных реках Восточной Сибири (Габышев, Габышева, 2018). Авторы связывают их обилие с изменением химической составляющей водоемов и с климатическими колебаниями. Высказано предположение, что многолетнее увеличение богатства и обилия другой группы жгутиконосцев, золотистых водорослей, в Рыбинском вдхр., расположенном в гумидной зоне, может быть следствием изменения световых условий, что связано с ростом аллохтонного органического вещества при увеличении стока р. Волга. В результате создаются преимущественные условия для подвижных жгутиковых форм, которые свободно передвигаются в толще воды в поиске благоприятных условий. В другой работе по водохранилищам р. Волга (Корнева и др., 2018) авторы связывают перестройки в фитопланктоне с увеличением продолжительности безледного периода в XXI в. В работе (Габышев, Габышева, 2018) при изучении 12 крупных рек Восточной Сибири, в которых также отмечено повышенное содержание органики, выявлена тесная связь интенсивного развития миксотрофных фитофлагеллат с концентрациями ионов аммония, железа общего, фосфора общего и химическим потреблением кислорода. Авторы (Габышев, Габышева, 2018) делают вывод, что число видов жгутиконосцев зависит от содержания органических веществ в среде, а концентрация биогенных элементов определяет их численность. Для фитопланктона водных объектов Омского Прииртышья отмечено существенное возрастание обилия фитофлагеллат и зеленых водорослей, по сравнению с серединой ХХ в., что, по мнению исследователей, указывает на усиление загрязнения водных экосистем легко окисляемыми органическими веществами и возрастание уровня антропогенного эвтрофирования (Баженова и др., 2019).
В морских экосистемах интерес к изучению этой группы связан не только с их обилием, но и с экологической ролью: ближайшие родственники байкальских динофитовых, морские виды рода Scrippsiella – потребители инфузорий тинтиннид или их паразиты (Coats et al., 2020). Факт одновременного обильного развития тинтиннид и диатомовой водоросли Synedra acus subsp. radians (Kütz.) Skabitsch. в планктоне оз. Байкал известен с начала прошлого столетия (Оболкина, 2015), а синедра в оз. Байкал в последние годы стала доминантом весеннего планктона (Bondarenko et al., 2020). Возможно, увеличение обилия миксотрофных динофитовых в весенний период в оз. Байкал связано с этим явлением.
Также для морских вод установлено (Lavrentyev et al., 2015), что диатомовые, размножаясь в массе и выделяя ненасыщенные альдегиды, угнетают развитие динофитовых, обилие которых увеличивается сразу после завершения вегетации диатомей. Этот факт, по-видимому, может служить одной из причин обилия мелких динофитовых в конце весенней и осенней вегетации в оз. Байкал, поскольку увеличение их численности приходится на конец мая–начало июня и позднюю осень, когда диатомовые опускаются в глубокие слои воды и отмирают.
Все перечисленное позволяет сделать заключение, что на увеличение численности мелких динофитовых в оз. Байкал повлиял комплекс факторов, включающий не только изменение экологических условий в озере, но и особенности биологии самих организмов.
Как показало наше исследование, отмеченные в начале текущего столетия перестройки в структуре фитопланктона озера (Бондаренко, Логачева, 2016), продолжаются. Происходит резкое увеличение обилия миксотрофных фитофлагеллат, в том числе и динофитовых. Хорошо известно, что изменения в структуре продуцентов, находящихся в начале пищевой цепи, определяют функционирование ее дальнейших звеньев. Формирование новой пищевой цепи на основе динофлагеллат для морских экосистем рассмотрено в работах (Honsell et al., 2013; De Lima et al., 2019). По мнению этих авторов, увеличение количества динофлагеллат стало пусковым механизмом не только для дальнейших перестроек в структуре микропланктона, но и в трофических сетях. Изменения в кормовой базе не могли не вызвать структурные трансформации и в зоопланктоне оз. Байкал, где в настоящее время в весенний период в пелагиали повышается роль мелких инфузорий (Оболкина, 2018) и увеличивается обилие коловраток (Наумова, Зайдыков, 2017). По данным многолетних наблюдений, значительные перестройки в структуре зоопланктона произошли в прибрежной зоне пролива Малое море (Шевелева, Пенькова, 2018). Отмечена замена видов в доминантном ядре сообщества, увеличилась относительная доля коловраток (до 60%), уменьшилась относительная численность ветвистоусых (с 31–54 до 6–24%).
Выводы. Многолетние исследования (конец 1990-х гг., 2015–2020 гг.) структуры и количественных параметров фитопланктона оз. Байкал выявили, что в современный период продолжаются изменения в структуре альгоценозов. В прибрежной зоне и пелагиали озера резко возросло обилие нанопланктонных миксотрофных динофитовых, их среднегодовые концентрации за период 2015–2020 гг. увеличились в 8.4 раза – с 1885 ± 691 до 15 834 ± 11 069 кл./л. В 2015–2020 гг. максимальные количества этих организмов зарегистрированы поздним летом (август) или в начале осени – не только во время завершения развития позднелетнего фитопланктона и максимальных атмосферных осадков, но и максимальной рекреационной нагрузки на экосистему озера. На увеличение численности мелких динофитовых в оз. Байкал повлиял комплекс факторов, включающий изменение экологических условий в озере и особенности биологии самих организмов.
Список литературы
Анненкова Н.В., Белых О.И., Деникина Н.Н., Беликов С.И. 2009. Идентификация представителей динофлагеллят озера Байкал на основе молекулярно-генетических данных // Доклады Российской академии наук. Т. 426. № 4. С. 559.
Антипова Н.Л. 1955. Новые виды рода Gymnodinium (Gymnodiniaceae) Stein. из оз. Байкал // Доклады академии наук СССР. Т. 103. № 2. С. 325.
Антипова Н.Л. 1974. Межгодовые изменения в фитопланктоне Байкала в районе Больших Котов за период 1960–1970 гг. // Продуктивность Байкала и антропогенные изменения его природы. Иркутск: Изд-во Иркутск. ун-та. С. 75.
Баженова О.П., Барсукова Н.Н., Игошкина И.Ю. и др. 2019. Фитопланктон Омского Прииртышья. Омск: Изд-во Омск. гос. аграрного ун-та.
Бондаренко Н.А. 1995. Экология свободноживущих жгутиковых // Атлас и определитель пелагобионтов Байкала с краткими очерками по их экологии. Новосибирск: Наука. С. 179.
Бондаренко Н.А., Логачева Н.Ф. 2016. Структурные изменения в фитопланктоне прибрежной зоны озера Байкал // Гидробиол. журн. № 6. С. 17.
Бондаренко Н.А., Русанов И.И., Черницына С.М. и др. 2020. Функционирование микроводорослей подледного планктона и ледовой интерстициали в прибрежной зоне озера Байкал // Микробиология. Т. 89. № 3. С. 344. https://doi.org/10.31857/S0026365620030064
Габышев В.А., Габышева О.И. 2018. К изучению влияния концентрации органических и биогенных веществ на ценотическую и флористическую структуру сообществ миксотрофных фитофлагеллят крупных субарктических рек Восточной Сибири // Международный журнал прикладных и фундаментальных исследований. № 6. С. 93. https://doi.org/10.17513/mjpfi.12299
Земская Т.И., Захаренко А.С., Русанов И.И. и др. 2019. Экология приустьевых акваторий малых рек Южного Байкала по данным химических и микробиологических исследований в весенний период // Микробиология. Т. 88. № 6. С. 673. https://doi.org/10.1134/S002636561906020X
Кожова О.М. 1956. Фитопланктон озера Байкал: Автореф. дис. … канд. биол. наук. Иркутск.
Корнева Л.Г., Соловьева В.В. 2017. Золотистые водоросли (Chrysophyta) в планктоне Волжских водохранилищ: таксономическая структура, динамика разнообразия и обилия // Биология внутр. вод. № 2. С. 50. https://doi.org/10.7868/S0320965217020073
Корнева Л.Г., Соловьева В.В., Макарова О.С. и др. 2018. Распределение фитопланктона в волжских водохранилищах летом 2015 г. // Труды Ин-та биологии внутр. вод РАН. Вып. 82. № 85. С. 2.
Курашов Е.А., Барбашова М.А., Дудакова Д.С. и др. 2018. Экосистема Ладожского озера: современное состояние и тенденции ее изменения в конце 20–начале 21 веков // Биосфера. Т. 10. № 2. С. 65.
https://doi.org/10.24855/BIOSFERA.V1013.439
Матвiенко О.М., Литвиненко Р.М. 1977. Визначник прiсноводных водоростей Украiнськоi РСР. III. Частина 2. Пiрофитовi водоростi – Pyrrophyta. Киiв: Наукова думка.
Макарова И.В., Пичкилы Л.О. 1970. К некоторым вопросам методики вычисления биомассы фитопланктона // Бот. журн. Т. 55. № 10. С. 1488.
Наумова Е.Ю., Зайдыков И.Ю. 2017. Весенний зоопланктон пелагиали озера Байкал // Гидробиол. журн. Т. 53. № 5. С. 33.
Оболкина Л.А. 2015. Планктонные инфузории озера Байкал. Новосибирск: Наука.
Оболкина Л.А. 2018. Межгодовая динамика весенних инфузорий в Южном Байкале // Тез. Междунар. конф. “Пресноводные экосистемы – современные вызовы”. Иркутск, 10–14 сентября 2018. Иркутск. С. 264.
Оболкина Л.А., Бондаренко Н.А., Дорощенко Л.Ф. и др. 2000. О находке криофильного сообщества в озере Байкал // Доклады Российской академии наук. Т. 371. № 6. С. 815.
Поповская Г.И. 1987. Фитопланктон глубочайшего озера мира // Морской и пресноводный планктон. Ленинград: Наука. С. 107.
Поповская Г.И. 1991. Фитопланктон Байкала и его многолетние изменения (1958–1990 гг): Автореф. дис. … докт. биол. наук. Новосибирск. 32 с.
Стельмах Л.В., Мансурова И.М. 2021. Физиологический механизм выживания динофитовых водорослей в условиях биогенного лимитирования // Биология внутр. вод. № 2. С. 198. https://doi.org/ (Stelmakh L.V., Mansurova I.M. 2021. Physiological Mechanism of Dinoflagellate survival under a Biogenic Limitation // Inland Water Biology. V. 14. № 2. С. 222. https://doi.org/10.1134/S199508292102014010.1134/S1995082921020140).https://doi.org/10.31857/S0320965221020157
Чекрыжева Т.А. 2008. Изменения в структуре летнего фитопланктона Кондопожской губы Онежского озера в процессе антропогенного эвтрофирования // Труды Карельск. науч. центра РАН. Вып. 12. Сер. “Биогеография”. Петрозаводск. С. 156.
Шевелева Н.Г., Пенькова О.Г. 2018. Изменения в сообществе зоопланктона пролива Малое море за последние 20 лет // Тез. Междунар. конф. “Пресноводные экосистемы – современные вызовы”. Иркутск, 10–14 сентября 2018. Иркутск. С. 305.
Annenkova N.V. 2013. Dinoflagellates of the Baikal Region // Dinoflagellates: biology, geographical distribution and economic importance. Chapter III. New York: Nova Science Publishers. P. 86.
Barbiero R.P., Tuchman M.L. 2004. Long-term dreissenid impacts on water clarity in Lakes Erie // J. Great Lakes Res. V. 30. № 4. P. 2111.
Bondarenko N.A., Vorobyova S.S., Zhuchenko N.A., Golobokova L.P. 2020. Current state of phytoplankton in the littoral area of Lake Baikal, spring 2017 // J. Great Lakes Res. V. 46. P. 17. https://doi.org/10.1016/j.jglr.2019.10.0010380-1330/#2019
Bondarenko N.A., Tomberg I.V., Shirokaya A.A. et al. 2021. Dolichospermum lemmermannii (Nostocales) bloom in world’s deepest Lake Baikal (East Siberia): abundance, toxicity and factors influencing growth // Limnology and Freshwater Biology. V. 1. P. 1101. https://doi.org/10.31951/2658-3518-2021-A-1-1101
Coats D.W., Choi J., Jung J.H. et al. 2020. Mixotrophic scrippsielloid dinoflagellates prey on tintinnid ciliates // Aquat. Ecosyst. Health Manage. V. 23. № 1. P. 69. https://doi.org/10.1080/14634988.2020.1727275
Dai C.-J., He J.-F., Wang G.-Z., Li S.-J. 2005. A review of ecological research on mixotrophic plankton // Acta Ecologica Sinica. V. 25. № 9. P. 2399.
De Lima D.T., Moser O.G.A., Piedras F.R. et al. 2019. Abiotic changes driving microphytoplankton functional diversity in Admiralty Bay, King George Island (Antarctica) // Frontiers in Marine Science. V. 6. P. 1.
https://doi.org/10.3389/fmars2019.00638
Guiry M.D., Guiry G.M. 2021. AlgaeBase. World-wide electronic publication. Galway: National University of Ireland. https://www.algaebase.org; searched on 1 July 2021.
Hampton S.E., Izmest’eva L.R., Moore M.V. et al. 2008. Sixty years of environmental change in the world’s largest freshwater lake – Lake Baikal, Siberia // Global Change Biology. V. 14. P. 1947. https://doi.org/10.1111/j.1365-2486.2008.01616.x
Honsell G., Bonifacio A., de Bortoli M. et al. 2013. New insights on cytological and metabolic features of Ostreopsis cf. ovata Fukuyo (Dinophyceae): A multidisciplinary approach // PLoS ONE. № 8. e57291.
Izmest’eva L.R., Moore M.V., Hampton S.E. et al. 2016. Lake-wide physical and biological trends associated with warming in Lake Baikal // J. Great Lakes Res. V. 42. P. 6. https://doi.org/10.1016/j.glr.2015.11.006
Kang H.C., Jeong H.J., Ok J.H. et al. 2019. Spatial and seasonal distributions of the phototrophic dinoflagellate Biecheleriopsis adriatica (Suessiaceae) in Korea: quantification using qPCR // Algae. V. 34. № 2. P. 111. https://doi.org/10.4490/algae.2019.34.5.25
Kravtsova L.S., Izhboldina L.A., Khanaev I.V. et al. 2014. Nearshore benthic blooms of filamentous green algae in Lake Baikal // J. Great Lakes Res. V. 40. P. 441.
Lavrentyev P.J., Franzè G., Pierson J.J., Stoecker D.K. 2015. The effect of dissolved polyunsaturated aldehydes on microzooplankton growth rates in the Chesapeake Bay and Atlantic coastal waters // Marine Drugs. V. 13. P. 2834. https://doi.org/10.3390/md13052834
Munawar M., Fitzpatrick M., Niblock H. et al. 2017. Phytoplankton ecology of culturally eutrophic embayment: Hamilton Harbour, Lake Ontario // Aquat. Ecosyst. Health Manage. V. 20. № 3. P. 201. https://doi.org/10.1080/14634988.2017.1307678
Obolkin V.A., Volkova E.A., Ohira S.I. et al. 2019. The role of atmospheric precipitation in the under-ice blooming of endemic dinoflagellate Gymnodinium baicalense var. minor Antipova in Lake Baikal // Limnology and Freshwater Biology. V. 6. P. 345. https://doi.org/10.31951/2658-3518-2019-A-6-345
Olrik K. 1998. Ecology of mixotrophic flagellates with special reference to Chrysophyceae in Danish lakes // Hydrobiologia. V. 369. P. 329. https://doi.org/10.1023/A:1017045809572
Reynolds C.S. 2006. Ecology of phytoplankton. Cambridge: Cambridge University Press.
Schindler D.W. 2006. Recent advances in the understanding and management of eutrophication // Limnol., Oceanogr. V. 51. P. 356. https://doi.org/10.4319/lo.2006.51.1_part_2.0356
Timoshkin O.A., Samsonov D.P., Yamamuro M. et al. 2016. Rapid ecological change in the coastal zone of Lake Baikal (East Siberia): Is the site of the world’s greatest freshwater biodiversity in danger? // J. Great Lakes Res. V. 42. P. 487. https://doi.org/10.1016/jglr.2016.02.011
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод