Биология внутренних вод, 2022, № 3, стр. 264-277
Трофические взаимодействия в зоопланктоне Цимлянского водохранилища (Россия)
В. И. Лазарева *
a Институт биологии внутренних вод им. И.Д. Папанина Российской академии наук
пос. Борок, Некоузский р-н, Ярославская обл, Россия
* E-mail: lazareva_v57@mail.ru
Поступила в редакцию 20.11.2020
После доработки 23.10.2021
Принята к публикации 11.12.2021
- EDN: XPCKLG
- DOI: 10.31857/S0320965222030135
Аннотация
В августе–сентябре 2018 г. в полевых условиях изучена трофическая структура зоопланктона Цимлянского водохранилища (р. Дон), дана оценка продуктивности сообщества и пресса беспозвоночных хищников. Установлено, что количество зоопланктона вдвое снижается от Верхнего участка водохранилища (2.4 ± 0.8 г/м3) к плотине Цимлянской ГЭС (1.2 ± 0.6 г/м3), 70% биомассы формируют Copepoda. Доминируют понто-каспийская Heterocope caspia и вселенцы Calanipeda aquaedulcis, Thermocyclops taihokuensis и Acanthocyclops americanus. Суточная продукция зоопланктона варьирует в пределах 3.5–14.2 мг С/(м3 сут) (35–142 кал/(м3 сут)) и в среднем по водохранилищу достигает 8.4 мг С/(м3 сут) (84 кал/(м3 сут)). Проанализировано трофическое взаимодействие между девятью размерными группами зоопланктона. Показано, что наиболее эффективно потребляют зоопланктон (выедают 11–38% суточной продукции каждый) три вида – Thermocyclops taihokuensis, Acanthocyclops americanus и Heterocope caspia. Максимально уязвимы для хищников мелкоразмерные (<800 мкм) группы нехищных животных (коловратки, науплиусы и копеподиты Copepoda), выедание их продукции достигает 110–240%. В пищевой сети северной и южной частей водохранилища принципиально различаются пути передачи энергии от фильтраторов к верхнему трофическому уровню. В северной части поток энергии проходит через Cyclopoida, рыбам доступно 16–17% продукции зоопланктона, в южной части – в основном через Calanoida, для рыб доступно 45–64% продукции. Обсуждаются многолетние изменения обилия и продуктивности зоопланктона, а также значение понто-каспийских и чужеродных видов в функционировании трофической сети сообщества.
ВВЕДЕНИЕ
Изучение межвидовых взаимодействий и распределения потоков энергии в трофических сетях водоемов способствуют выявлению механизмов управления состоянием экосистем, пониманию важных факторов, влияющих на модификацию трофической структуры, внедрение и распространение чужеродных видов (Hart et al., 2000; Gliwicz, 2002; Казанцева, 2003; Науменко и др., 2012; Бульон, 2019). Зоопланктон озер и водохранилищ традиционно подразделяют на три большие трофические группы: мирные (нехищные) животные фито-детритофаги, всеядные виды и стадии развития со смешанным питанием, хищники-зоофаги (Монаков, 1998; Казанцева, 2003; Бульон, 2019). При построении трофической сети используют детализацию этих групп по таксономической принадлежности (нехищные Cladocera, Copepoda, Rotifera, всеядные Copepoda, Rotifera и т.д.) до уровня доминантных видов (Бульон и др., 1999; Казанцева, 2003; Lazareva, Kopylov, 2011; Науменко и др., 2012).
Определяющими параметрами для успешной охоты всех хищников служат размер и концентрация жертв (Brandl, 1998; Gliwicz, 2002; Petchey et al., 2008). В современных работах при анализе трофических взаимодействий большое внимание уделяют также характеру распределения в пространстве хищника и его потенциальных пищевых объектов, таксономической принадлежности, морфологии, способам поиска и захвата пищи хищником, характеристикам уязвимости жертв (Boukal, 2014). Экспериментально показано (Vincent et al., 2020), что важную роль в формировании пищевой сети играют не только размерная структура зоопланктона, особенности поведения хищника и жертвы, но и смена характера питания в онтогенезе (важно для копепод), а также филогенетические особенности морфологии видов, позволяющие хищникам успешно охотиться, а жертвам избегать атаки хищника.
Контроль “сверху” за развитием зоопланктона в пелагиали водоемов озерного типа часто осуществляют беспозвоночные хищники, особенно при относительно невысоком прессе рыб (Blumenshine, Hambright, 2003; Lazareva, Kopylov, 2011; Науменко и др., 2012). Существенным фактором смертности нехищного зоопланктона считают хищничество Cyclopoida (Brandl, 1998; Lazareva, Kopylov, 2011). В меньшей степени изучено влияние на сообщество хищных Calanoida. Отмечают (Монаков, 1998; Науменко и др., 2012), что ряд из них сохранили способность к фильтрации мелкого сестона (роды Heterocope и Eurytemora). В настоящей работе сделана попытка оценить воздействие хищной части популяций Cyclopoida (роды Thermocyclops и Acanthocyclops) и Calanoida (род Heterocope) на зоопланктон крупного водохранилища с учетом особенностей распределения хищников и жертв по акватории, способов захвата пищи хищником и доступности для него организмов зоопланктона по размеру и концентрации.
Цимлянское вдхр. заполнено в 1952–1953 гг. и функционирует уже >65 лет. Зоопланктон р. Дон до создания водохранилища не исследовали (Дзюбан, 1958). Однако его мониторинг проводят с первых лет существования водоема до настоящего времени. Установлено (Кафтанникова, 1965; Гламазда, 1971а, 1974), что в 1960-х годах при массовом развитии понто-каспийских видов биомасса зоопланктона снизилась с >4 до <1.5 г/м3. В 2015–2018 гг. произошло увеличение биомассы до уровня конца 1950-х годов (~2 г/м3) (Голоколенова и др., 2019; Lazareva, Sabitova, 2021). Трофические взаимодействия внутри зоопланктона водохранилища фактически не исследованы, эпизодически делали только оценку его продуктивности (Гламазда, 1982; Вехов и др., 2014).
Цель работы – исследовать таксономическую и трофическую структуры летнего зоопланктона водохранилища, оценить уровень его продуктивности, проанализировать трофические взаимодействия внутри сообщества и выявить значение понто-каспийских ракообразных и чужеродных видов в пищевой сети.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Район работ. Цимлянское вдхр. расположено в среднем течении р. Дон в ~200 км от устья (координаты центра 47°50ʹ с.ш., 42°50ʹ в.д.). При нормальном подпорном уровне (НПУ, 36 м БС) его площадь 2700 км2, средняя глубина 8.8 м, максимальная 30 м, скорость водообмена 1.05 год–1 (Авакян и др., 1987). На акватории водохранилища выделяют четыре участка: Верхний, Чирской, Потемкинский и Приплотинный (Вехов и др., 2014). По степени развития фитопланктона (~50 мг/л) и концентрации хлорофилла а в воде (67 мкг/л) трофический статус водоема оценивают как гиперэвтрофный (Вехов и др., 2014; Минеева и др., 2020).
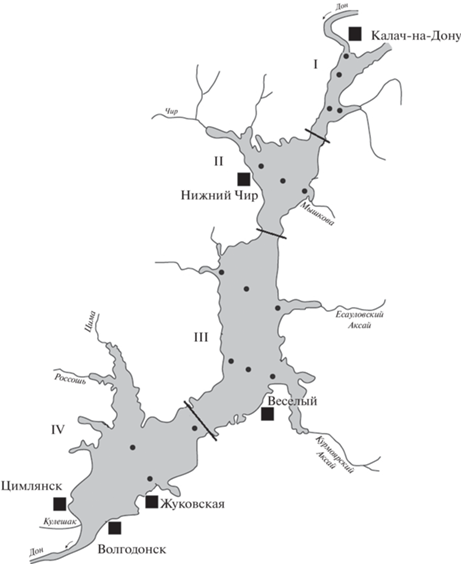
Методы сбора и лабораторного анализа. Зоопланктон собирали в конце августа–начале сентября 2018 г. с экспедиционного судна “Академик Топчиев” Института биологии внутренних вод им. И.Д. Папанина РАН, в прибрежье – с лодки. Обследованы все четыре плеса водохранилища (рис. 1). Тотальные пробы зоопланктона (Cladocera, Cyclopoida, Calanoida, Rotifera) отбирали сетью Джеди с диаметром входного отверстия 12 см и нейлоновым ситом с диагональю ячеи 105 мкм. Сборы фиксировали 4%-ным формалином и просматривали в лаборатории под стереомикроскопом “StereoDiscovery-12” (Carl Zeiss, Jena). Видовой состав ракообразных и коловраток идентифицировали с использованием руководств (Кутикова, 1970; Монченко, 1974; Мордухай-Болтовской, Ривьер, 1987; Боруцкий и др., 1991; Monchenko, 2008; Определитель…, 2010; Sukhikh, Alekseev, 2013). В пробах определяли численность и биомассу каждого вида, их суммарные значения для четырех таксономических групп и общие для всего зоопланктона. Биомассу рассчитывали по формулам связи индивидуальной массы с длиной тела животных (Ruttner-Kolisko, 1977; Балушкина, Винберг, 1979). Доминантные виды выделяли по их относительной биомассе (>10% общей биомассы зоопланктона).
Рис. 1.
Расположение станций (⚫) отбора проб зоопланктона в Цимлянском водохранилище. Участки: I – Верхний, II – Чирской, III – Потемкинский, IV – Приплотинный.
Выделение трофических групп. Трофические группы формировали с учетом размера доминантных видов зоопланктона, способа их питания и данных о составе пищи (Мордухай-Болтовская, 1960; Гунько, Алдакимова, 1963; Papinska, 1985; Yang, Brandl, 1996; Монаков, 1998; Lazareva, Kopylov, 2011). К фильтраторам фито-детритофагам относили все виды кладоцер, за исключением Leptodora kindtii (Focke, 1844), и все таксоны коловраток, кроме представителей рода Asplanchna. В эту группу включали также науплиусов всех видов Cyclopoida и Calanoida, копеподитов I–V стадий развития и взрослых особей Calanipeda aquaedulcis Kritschagin, 1873 (Гунько, Алдакимова, 1963; Монаков, 1998).
К всеядным животным (полифагам) хватателям и/или фильтраторам относили копеподитов I–III стадий развития всех Cyclopoida и копеподитов IV–VI стадий развития Calanoida родов Heterocope и Eurytemora, а также коловраток рода Asplanchna. Хищную часть сообщества представляли облигатные зоофаги кладоцеры рода Leptodora, а также взрослые особи и копеподиты IV–V стадий развития циклопоидных копепод. Заметим, что взрослые Cyclopoida и их копеподиты с третьей стадии развития при недостатке животной пищи переходят на потребление детрита (Монченко, 1974; Монаков, 1998). Поэтому при оценке хищничества Cyclopoida учитывали потребление детрита (в том числе животного происхождения), которое в водохранилищах достигает 13% рациона (Lazareva, Kopylov, 2011).
Расчетные характеристики сообщества. Суточную продукцию (Р) выделенных трофических групп рассчитывали на основании биомассы (В) и удельной скорости продукции (среднесезонных суточных Р/В-коэффициентов): Р = Р/В × В (Иванова, 1985; Lazareva, Kopylov, 2011). Продукцию хищных кладоцер оценивали по рациону (при коэффициенте использования животной пищи на рост k1 0.32), который летом достигает 40% массы тела Leptodora (Мордухай-Болтовская, 1960).
Суточный рацион (С) остальных животных рассчитывали по формуле: С = Р/k1. Принимали, что коэффициенты использования потребленной пищи на рост (k1) для мирных животных – 0.22, для хищных и всеядных копепод – 0.16 (Бульон и др., 1999; Hart et al., 2000), для всеядных Asplanchna – 0.28 (Lazareva, Kopylov, 2011).
Потребление (G) хищниками различных групп зоопланктона определяли как сумму частных рационов (Lazareva, Kopylov, 2011). Эти рационы для каждого хищника (в том числе всеядных форм) рассчитывали пропорционально биомассе в водоеме потенциальных пищевых объектов, учитывая избирательность питания и доступность трофических ресурсов (концентрацию, размер жертв и их распределение по акватории). Принимали, что в водохранилищах животная пища составляет ~30% рациона коловраток Asplanchna и ~25% рациона всеядных копеподитов I–III стадий развития (Lazareva, Kopylov, 2011). Половинa потребляемой Asplanchna животной пищи – инфузории (Lazareva, Kopylov, 2011), т.е. на метазоопланктон приходится ~15% рациона. Учитывали, что 43% рациона старших копеподитов Heterocope caspia (Sars, 1897) представляли водоросли, простейшие и мелкий сестон, потребляемые за счет фильтрационного типа питания. На основе этого рассчитывали реальное потребление (G) зоопланктона хищными и всеядными животными.
Уровень каннибализма копепод оценивали как отношение потребления собственной молоди хищной частью популяции к продукции всей популяции, выраженное в %. Считали, что крупные копеподы неизбирательно потребляют доступных по размеру мелких копеподитов и науплиусов. Как результат, более элиминирована молодь наиболее многочисленных видов.
Все расчеты проводили в единицах углерода. Принимали, что на долю сухой (беззольной) массы организмов планктона приходится 10% сырой, для коловратки Asplanchna – 5% (Обозначения…, 1972), в ней содержится 50% углерода (Dumont et al., 1975). При переходе от углерода к энергетическим эквивалентам считали, что 1 мг С = 10 кал. Средние значения характеристик зоопланктона и их ошибки рассчитывали с использованием соответствующих процедур пакета STATISTICA for Windows, v. 10 (StatSoft Russia).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Таксономическая структура. Доминантный комплекс зоопланктона Цимлянского вдхр. включал cемь видов преимущественно копепод, по два–три в каждом из четырех участков (табл. 1). В верхней части водоема выше устья р. Донская царица основу биомассы зоопланктона (90%) формировали кладоцера Moina micrura Kurz, 1874, а также недавние вселенцы копеподы Thermocyclops taihokuensis (Harada, 1931) и Acanthocyclops americanus (Marshall, 1893). В створе этой реки и Чирском плесе преобладали (75%) те же два вида копепод, а в мелководном заливе р. Чир до 14% биомассы образовывала кладоцера Diaphanosoma orghidani Negrea, 1982. Начиная от створа рек Аксеней–Аксай Есауловский, сначала на русле р. Дон, а ниже повсеместно, 65–95% биомассы образовывали Heterocope caspia и Calanipeda aquaedulcis. Коловратки Asplanchna priodonta Gosse, 1850 доминировали (70–75% биомассы зоопланктона) в устьях рек Аксай Курмоярский и Аксай Есауловский, в Потемкинском участке водоема их вклад в биомассу достигал в среднем 15%.
Таблица 1.
Доминантные виды зоопланктона различных участков Цимлянского водохранилища в августе–сентябре 2018 г.
| Таксон | Верхний | Чирской | Потемкинский | Приплотинный | ||||
|---|---|---|---|---|---|---|---|---|
| Вsp | % Вобщ | Вsp | % Вобщ | Вsp | % Вобщ | Вsp | % Вобщ | |
| Crustacea | ||||||||
| Moina micrura | 1004 | 41 | <10 | <1 | <10 | <1 | 0 | 0 |
| Thermocyclops taihokuensis | 809 | 33 | 563 | 55 | 99 | 5 | <10 | <1 |
| Acanthocyclops americanus | 398 | 16 | 210 | 20 | <10 | <1 | 30 | 3 |
| Diaphanosoma orghidani | 125 | 5 | 140 | 14 | <10 | <1 | <10 | <1 |
| Heterocope caspia | <10 | <1 | 21 | 2 | 1078 | 54 | 288 | 25 |
| Calanipeda aquaedulcis | <10 | <1 | 20 | 2 | 200 | 10 | 772 | 67 |
| Rotifera | ||||||||
| Asplanchna priodonta | <10 | <1 | 0 | 0 | 302 | 15 | <10 | <1 |
Трофическая структура. Обитающие в водохранилище фито-детритофаги с фильтрационным способом питания разделены на четыре группы. К первой группе (CladF) отнесены кладоцеры-фильтраторы, среди которых в водохранилище преобладали небольшие Moina micrura, Diaphanosoma orghidani (400–800 мкм) и в меньшем количестве присутствовали Bosmina longirostris (O.F. Müller, 1785) и Chydorus sphaericus (O.F. Müller, 1785) (200–300 мкм). Вторую группу (RotF) представляли мелкоразмерные (100–200 мкм) коловратки седиментаторы фито-детритофаги. Среди них были многочисленны Polyarthra luminosa Kutikova, 1962, P. major Bruckhardt, 1900, Keratella quadrata (O.F. Müller, 1786) и Conochilus unicornis Rousselet, 1892. В третью группу (CopFN) включены науплиусы всех видов Cyclopoida и Calanoida (150–400 мкм), относящиеся к мелкоразмерным копеподам фильтраторам фито-детритофагам. Копеподиты I–V стадий развития и взрослые особи Calanipeda aquaedulcis (600–1400 мкм) выделены в четвертую группу (CopFС) крупноразмерных копепод фильтраторов фито-детритофагов.
Всеядные животные (полифаги) разделены на три группы. Детрито- и зоофаги копеподиты I–III стадий развития Cyclopoida и Calanoida родов Heterocope и Eurytemora (CopOM) отнесены к хватателям и/или фильтраторам малого размера (400–800 мкм). Фито-детрито- и зоофаги коловратки Asplanchna priodonta (400–600 мкм), захватывающие пищу сравнительно крупного размера (до 250 мкм), выделены в группу мелкоразмерных всеядных седиментаторов (RotOM). Крупные (1100–1800 мкм) копеподиты IV–V стадий развития и взрослые особи Heterocope caspia включены в отдельную трофическую группу со смешанным способом питания (фильтрация + захват) (CopOMН). Наряду с захватом крупной пищи, виды родов Eurytemora и Heterocope способны фильтровать мелкие частицы (водоросли, простейших) (Монаков, 1998; Науменко и др., 2012). Наш подход обоснован предварительной оценкой пищевых потребностей H. caspia. Расчеты показали, что без учета фильтрационного питания для функционирования данной части популяции этого вида в исследованном водоеме недостаточно пищевых ресурсов, выедание доступных групп животных может достигать 400% их продукции. Крупные (1400–1800 мкм) взрослые особи H. caspia недоступны другим планктонным хищникам и входят в рацион рыб.
Среди потенциально хищных животных в водохранилище доминировали всеядные копеподы-хвататели Thermocyclops taihokuensis, Acanthocyclops americanus, а также Heterocope caspia. Взрослые особи всех трех видов и их копеподиты в третьей стадии развития могут потреблять животную пищу (коловраток, инфузорий, мелких ракообразных и собственную молодь), при недостатке которой переходят на потребление детрита (Монченко, 1974; Монаков, 1998). Из облигатных зоофагов в водохранилище была обычна, но немногочисленна, только Leptodora kindtii. Хищную часть сообщества подразделяли на две группы. Крупную (2000–9000 мкм) кладоцеру L. kindtii относили в группу верховных хищников (CladP), недоступных для потребления другим зоопланктерам. В состав пищи Leptodora входят в основном мелкие Cladocera (<0.6 мм) и коловратки (Мордухай-Болтовская, 1960). Сравнительно небольшие (700–1200 мкм) взрослые особи и копеподиты IV–V стадий развития Thermocyclops taihokuensis и Acanthocyclops americanus составляли вторую группу хищных Cyclopoida (CopP). Размеры животных, которых могут поедать небольшие Cyclopoida, в основном <250 мкм (коловратки, науплиусы копепод, мелкие Cladocera) (Papinska, 1985; Brandl, Yang, 1996; Монаков, 1998). Таким образом, в данной работе анализировали взаимодействие девяти трофических групп зоопланктона.
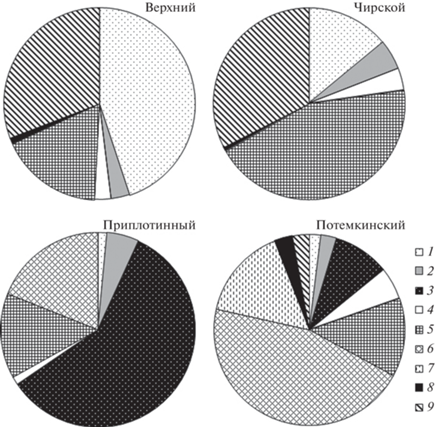
Вклад в Вzoo отдельных трофических групп заметно отличался в разных участках водохранилища (рис. 2). В Верхнем и Чирском участках преобладали фито-детритофаги кладоцеры (14–45% Вzoo), мелкие всеядные копеподиты (17–44%) и хищные Cyclopoida (>30%). В середине водоема в Потемкинском участке были четко представлены все девять трофических групп, среди которых доминировали копеподиты IV–VI стадий Heterocope caspia со смешанным способом питания (46% Вzoo), всеядные коловратки Asplanchna priodonta (16%) и мелкие всеядные копеподиты I–III стадий (13%). В Приплотинном участке наибольший вклад в биомассу вносили копеподы фильтраторы Calanipeda aquaedulcis (59%), менее обильны были копеподиты IV–VI стадий Heterocope (19%) и мелкие всеядные копеподиты (14%).
Рис. 2.
Соотношение трофических групп зоопланктона (% общей биомассы) в разных участках Цимлянского водохранилища. 1 – кладоцеры-фильтраторы (CladF), 2 – науплиусы копепод (CopFN), 3 – копеподиты I–VI cтадий Calanipeda фильтраторы (CopFC), 4 – коловратки фито-детритофаги (RotF), 5 – всеядные копеподиты I–III стадий Cyclopoida и Calanoida (CopOM), 6 – всеядные копеподиты IV–VI стадий Heterocope (CopOMH), 7 – всеядные коловратки Asplanchna (RotOM), 8 – хищные кладоцеры Leptodora (CladP), 9 – хищные копеподиты IV–VI стадий Acanthocyclops и Thermocyclops (CopP).
Обилие и продукция сообщества. Основу Вzoo в водохранилище формировали ракообразные: Calanoida (40%), Cyclopoida (29%) и Cladocera (20%). В разных участках водоема Вzoo варьировала более чем вдвое (1.0–2.4 г/м3). Максимальные ее значения регистрировали в Верхнем (≤ 4 г/м3) и Потемкинском (≤6 г/м3) участках, минимальные (<1.5 г/м3) – в Чирском участке и на большинстве станций у плотины ГЭС. В целом, наибольшую Вzoo наблюдали в Верхнем участке водоема, наименьшую – в Чирском и Приплотинном, максимальная численность зоопланктона отмечена в Верхнем участке (табл. 2). Количество меропланктона (личинок моллюсков рода Dreissena) в водохранилище невелико (в среднем 6.4 ± 2.9 тыс. экз./м3), их вклад в суммарную биомассу сообщества был <1%.
Таблица 2.
Численность (над чертой, тыс. экз./м3) и биомасса (под чертой, г/м3) зоопланктона Цимлянского водохранилища в августе–сентябре 2018 г.
| Участок | Cladocera | Cyclopoida | Calanoida | Rotifera | Сумма | Велигеры Dreissena |
|---|---|---|---|---|---|---|
| Верхний | $\frac{{87 \pm 45}}{{1.16 \pm 0.70}}$ | $\frac{{238 \pm 149}}{{1.21 \pm 0.69}}$ | $\frac{{0.6 \pm 0.3}}{{ < 0.01}}$ | $\frac{{69 \pm 49}}{{0.07 \pm 0.05}}$ | $\frac{{395 \pm 179}}{{2.44 \pm 0.77}}$ | $\frac{{ < 0.5}}{{ < 0.01}}$ |
| Чирской | $\frac{{12 \pm 5}}{{0.16 \pm 0.03}}$ | $\frac{{161 \pm 48}}{{0.77 \pm 0.24}}$ | $\frac{{8.3 \pm 3.7}}{{0.06 \pm 0.02}}$ | $\frac{{45 \pm 18}}{{0.04 \pm 0.01}}$ | $\frac{{226 \pm 63}}{{1.03 \pm 0.24}}$ | $\frac{{1.2 \pm 0.6}}{{ < 0.01}}$ |
| Потемкинский | $\frac{{4 \pm 2}}{{0.10 \pm 0.04}}$ | $\frac{{15 \pm 8}}{{0.14 \pm 0.01}}$ | $\frac{{69.0 \pm 23.3}}{{1.33 \pm 0.69}}$ | $\frac{{134 \pm 48}}{{0.42 \pm 0.17}}$ | $\frac{{223 \pm 64}}{{1.99 \pm 0.82}}$ | $\frac{{14.0 \pm 7.0}}{{0.02 \pm 0.01}}$ |
| Приплотинный | $\frac{{3 \pm 1}}{{0.02 \pm 0.01}}$ | $\frac{{24 \pm 10}}{{0.04 \pm 0.01}}$ | $\frac{{69.6 \pm 27.6}}{{1.07 \pm 0.64}}$ | $\frac{{24 \pm 12}}{{0.02 \pm 0.01}}$ | $\frac{{121 \pm 32}}{{1.16 \pm 0.65}}$ | $\frac{{4.7 \pm 1.3}}{{0.01 \pm 0.002}}$ |
| Все водохранилища | $\frac{{26 \pm 14}}{{0.36 \pm 0.19}}$ | $\frac{{100 \pm 42}}{{0.51 \pm 0.20}}$ | $\frac{{40.6 \pm 12.6}}{{0.71 \pm 0.31}}$ | $\frac{{80 \pm 24}}{{0.19 \pm 0.08}}$ | $\frac{{247 \pm 53}}{{1.77 \pm 0.38}}$ | $\frac{{6.4 \pm 2.9}}{{0.01 \pm 0.004}}$ |
Наибольшую суточную продукцию зоопланктона (Рzoo) наблюдали в Верхнем (14.2 мг С/(м3 сут)) и Потемкинском (9.1 мг С/(м3 сут)) участках водохранилища, в Чирском и Приплотинном участках она была в 2–4 раза ниже (табл. 3). В верхних двух участках 50–75% Рzoo формировали фильтраторы (кладоцеры и коловратки). В двух нижних участках на их долю приходилось только 15–35%. До 50% Рzoo здесь образовывали всеядные коловратки Asplanchna, а также всеядные и хищные копеподы. Средний по акватории уровень продуктивности сообщества достигал 8.4 ± 2.5 мг С/(м3 сут).
Таблица 3.
Суточная продукция (Рzoo, мг С/(м3 сут)) зоопланктона различных участков Цимлянского водохранилища в августе–сентябре 2018 г.
| Показатель | Верхний | Чирской | Потемкинский | Приплотинный | Все водохранилище |
|---|---|---|---|---|---|
| CladF | 9.1 | 1.2 | 0.3 | 0.2 | 2.6 |
| CopFN | 0.8 | 0.6 | 0.5 | 0.6 | 0.6 |
| CopFC | 0 | 0 | 0.4 | 1.5 | 0.5 |
| RotF | 1.7 | 0.9 | 2.9 | 0.4 | 1.8 |
| CopOM | 0.3 | 0.3 | 0.6 | 0.25 | 0.4 |
| CopOMH | 0 | 0 | 1.8 | 0.4 | 0.6 |
| RotOM | 0.01 | 0 | 1.9 | 0.03 | 0.7 |
| CladP | 0.2 | 0.1 | 0.4 | 0.03 | 0.2 |
| CopP | 2.1 | 1.3 | 0.3 | 0.1 | 1.0 |
| Сумма Рzoo | 14.2 | 4.4 | 9.1 | 3.5 | 8.4 |
| Рpred | 2.3 | 1.6 | 3.4 | 0.6 | 2.2 |
| Рn_pred | 11.9 | 2.8 | 5.7 | 2.9 | 6.2 |
| Рpred/Рn_pred, % | 29 | 59 | 57 | 21 | 35 |
Примечание. Здесь и в табл. 4–5 фильтраторы: CladF – кладоцеры, CopFN – науплиусы копепод, CopFC – копеподиты I–VI cтадий Calanipeda, RotF – коловратки; всеядные животные: CopOM – копеподиты I–III Cyclopoida и Calanoida, CopOMH – копеподиты IV–VI стадий Heterocope, RotOM – коловратки Asplanchna; хищники: CladP – кладоцеры Leptodora, CopP – копеподиты IV–VI стадий Acanthocyclops и Thermocyclops; Рpred – продукция хищников, Рn_pred – продукция нехищного зоопланктона.
Потребление зоопланктона хищными и всеядными животными. Czoo планктонных хищников в Чирском и Потемкинском участках водохранилища превышал Рzoo, даже за вычетом потребляемого детрита (Czoo/Pzoo 118–175%). Продукции зоопланктона, в целом, было достаточно для хищников в Верхнем и Приплотинном участках (Czoo/Pzoo 88 и 57% соответственно). В среднем по водоему отношение Czoo/Pzoo достигало 104%, рацион хищного зоопланктона превышал продукцию нехищного в 1.6–2.8 раза почти по всей акватории водохранилища. Факт, что в Цимлянском вдхр. рацион хищного зоопланктона превышает продукцию фильтраторов, отмечали уже в 1970-х годах (Гламазда, 1982). Однако не вся продукция зоопланктона доступна для планктонных беспозвоночных хищников. Также большинство хищников в планктоне водоема представлены видами, способными при недостатке животной пищи переходить на питание детритом, некоторые – водорослями. Поэтому реальное потребление зоопланктона с учетом доступности по размеру, распределения жертв по акватории и способности хищников к смене способа добывания пищи оказалось существенно ниже (табл. 4).
Таблица 4.
Суточное потребление зоопланктона планктонными хищниками (Gzoo, мг С/(м3 сут))* в различных участках Цимлянского водохранилища в августе–сентябре 2018 г.
| Показатель | Верхний | Чирской | Потемкинский | Приплотинный | Все водохранилище |
|---|---|---|---|---|---|
| CladF | 4.50 | 0.76 | 0.26 | 0.08 | 1.40 |
| CopFN | 0.70 | 0.83 | 0.56 | 0.54 | 0.66 |
| CopFC | 0 | 0 | 0.10 | 0.12 | 0.06 |
| RotF | 3.10 | 2.28 | 3.28 | 0.21 | 2.22 |
| CopOM | 0.81 | 1.15 | 1.57 | 0.36 | 0.97 |
| CopOMH | 0 | 0 | 0 | 0 | 0 |
| RotOM | 0 | 0 | 0.35 | 0 | 0.09 |
| CopP | 3.27 | 2.69 | 0.78 | 0.04 | 1.70 |
| CladP | 0 | 0 | 0 | 0 | 0 |
| Сумма Gzoo | 12.4 | 7.7 | 6.9 | 1.4 | 7.1 |
| Gzoo/Рzoo,% | 87 | 175 | 76 | 39 | 85 |
По концентрации (70 ± 15 тыс. экз./м3) и размерным характеристикам (длина тела 100–700 мкм) наиболее доступны для большинства планктонных хищников коловратки, науплиусы и мелкие копеподиты I–III стадий развития. В среднем по водохранилищу хищники выедали 110% продукции науплиусов, >240% продукции копеподитов и 123% продукции коловраток. В Верхнем и Чирском участках водоема высоким было потребление хищными Cyclopoida кладоцер-фильтраторов (≤50% их продукции), а также друг друга (156–207% их продукции). Последнее объясняется низкими продукционными возможностями копепод и широким спектром линейных размеров особей старших возрастных групп родов Thermocyclops и Acanthocyclops (0.7–1.8 мм), что при совместном обитании позволяет крупному виду поедать мелкого.
Тот факт, что хищники выедали >100% суточной продукции ряда групп зоопланктона, указывает на поглощение ими части биомассы жертв. Это способствует обычному осеннему снижению количества зоопланктона. Для сравнения, в Рыбинском вдхр. во второй половине лета также отмечено максимальное потребление хищниками Рzoo (Lazareva, Kopylov, 2011). Кроме того, в расчетах не учтено, что хищники могли использовать дополнительные ресурсы простейших и мейобентоса, что снижало их пресс на метазоопланктон. Также возможно, что доля детрита в питании хищных Cyclopoida в мелководном Цимлянском вдхр. была выше заложенной в расчеты (13%).
Пресс хищников. Оценка воздействия на сообщество отдельных видов хищников показала, что наиболее эффективными потребителями зоопланктона в водохранилище были три вида копепод. Многочисленные Thermocyclops taihokuensis (140–190 тыс. экз./м3), Heterocope caspia (20–50 тыс. экз./м3) и Acanthocyclops americanus (20–45 тыс. экз./м3) выедали в среднем 11–38% суточной Рzoo (табл. 5). Крупная, но малочисленная (10–500 экз./м3) Leptodora kindtii потребляла только 6% Рzoo. В Верхнем и Чирском участках водоема суммарное выедание зоопланктона двумя видами Cyclopoida достигало 80–150% Рzoo. В Потемкинском и Приплотинном участках, где массовым видом копепод была Heterocope caspia, потребление зоопланктона было существенно ниже (22–36% Рzoo). К тому же здесь основу фильтраторов составляла крупная (до 1.4 мм) Calanipeda aquaedulcis, ее копеподиты c IV стадии развития фактически не доступны перечисленным беспозвоночным хищникам. Индивидуальное суточное потребление зоопланктона копеподами было минимальным (6% массы тела) у Heterocope caspia. Для Eurytemora caspica Sukhikh et Alekseev, 2013 оно достигало 19% массы тела, для Thermocyclops и Acanthocyclops – 30–32%.
Таблица 5.
Вклад разных видов хищников в потребление зоопланктона Цимлянского водохранилища в августе–сентябре 2018 г. (среднее для четырех участков)
| Хищник | Потребление (G, мг С/(м3 сут)) хищником продукции трофических групп и уровень его воздействия (G/Рzoo, %) | |||||||
|---|---|---|---|---|---|---|---|---|
| CladF | CopFN | CopFC | RotF | RotOM | CopOM | CopP | Сумма G (% Рzoo) | |
| Leptodora kindtii | $\frac{{0.12}}{5}$ | $\frac{{0.03}}{5}$ | 0 | $\frac{{0.01}}{1}$ | $\frac{{0.09}}{{12}}$ | $\frac{{0.14}}{{34}}$ | $\frac{{0.15}}{{15}}$ | 0.53 (6) |
| Heterocope caspia | $\frac{{0.07}}{3}$ | $\frac{{0.13}}{{21}}$ | $\frac{{0.04}}{8}$ | $\frac{{0.25}}{{14}}$ | 0 | $\frac{{0.33}}{{83}}$ | $\frac{{0.15}}{{15}}$ | 0.96 (11) |
| Acanthocyclops americanus | $\frac{{0.53}}{{20}}$ | $\frac{{0.06}}{{10}}$ | $\frac{{0.02}}{4}$ | $\frac{{0.12}}{7}$ | 0 | $\frac{{0.10}}{{25}}$ | $\frac{{0.58}}{{58}}$ | 1.41 (17) |
| Thermocyclops taihokuensis | $\frac{{0.68}}{{26}}$ | $\frac{{0.29}}{{48}}$ | 0 | $\frac{{1.08}}{{60}}$ | 0 | $\frac{{0.38}}{{95}}$ | $\frac{{0.79}}{{79}}$ | 3.22 (38) |
| Eurytemora caspica | $\frac{{0.002}}{{ < 1}}$ | $\frac{{0.03}}{4}$ | 0 | $\frac{{0.07}}{4}$ | 0 | $\frac{{0.03}}{7}$ | $\frac{{0.02}}{2}$ | 0.14 (2) |
Примечание. Над чертой – потребление (G, мг С/(м3 сут)) хищником продукции трофических групп, под чертой – уровень его воздействия (G/Р, %) на каждую группу; сумма G (% Рzoo) – суммарное потребление хищником продукции зоопланктона. Нуль – вид не входит в рацион хищника или хищник и жертва разобщены в пространстве.
Потоки энергии в трофической сети зоопланктона и пищевая обеспеченность рыб-планктофагов. В Верхнем и Чирском участках водохранилища основной поток энергии от фильтраторов к верхнему трофическому уровню проходил через циклопоидных копепод (рис. 3а, 3б). Более 70% продукции их копеподитов потребляли взрослые особи двух видов Thermocyclops taihokuensis и Acanthocyclops americanus. Между ними формировались “циклические” взаимодействия (вид А потребляет вид Б и наоборот). Теоретически больший уровень хищничества свойственен крупному A. americanus, однако реально сравнительно небольшой, но многочисленный Thermocyclops taihokuensis выедал ~60% суммарной продукции обоих видов. Уровень каннибализма также был выше в многочисленной популяции T. taihokuensis (27–43% собственной продукции). В популяции Acanthocyclops americanus в результате каннибализма элиминировалось 12–16% продукции. Рыбам в Верхнем участке водоема было доступно 24 кал/(м3 сут) (17% Рzoo). В основном это кладоцеры-фильтраторы Moina micrura (16 кал/(м3 сут)), хищная Leptodora kindtii (2 кал/(м3 сут)) и часть продукции копеподитов IV–V стадий Cyclopoida (25%, или 6 кал/(м3 сут)). В менее продуктивном Чирском участке рыбы могли питаться кладоцерами Diaphanosoma orghidani (4 кал/(м3 сут)) и Leptodora kindtii (1 кал/(м3 сут)), а также очень небольшой частью Cyclopoida (10% продукции, или 1.6 кал/(м3 сут)) – в сумме <7 кал/(м3 сут) (16% Рzoo). Здесь рыбы-планктофаги были в 3.5 раза менее обеспечены кормовым зоопланктоном по сравнению с Верхним участком водохранилища.
Рис. 3.
Структура трофической сети основных участков Цимлянского водохранилища. а – Верхний, б – Чирской, в – Потемкинский, г – Приплотинный. Цифрами показаны основные потоки энергии (кал/(м3 сут)), обозначенные красными стрелками.
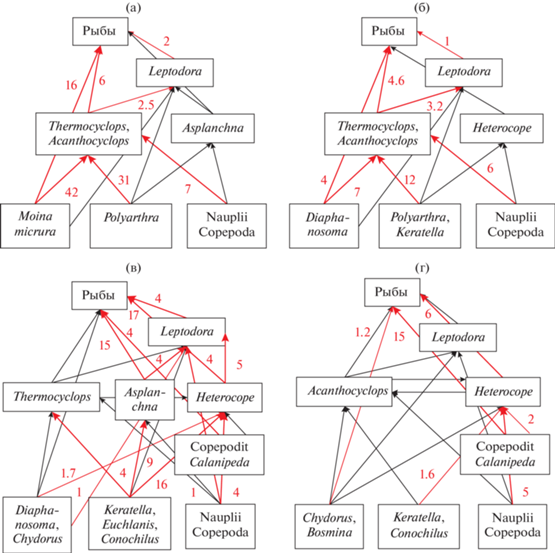
В Потемкинском и Чирском участках основной поток энергии от фильтраторов к рыбам проходил через каляноидных копепод, коловраток Asplanchna и кладоцеру Leptodora kindtii (рис. 3в, 3г). Даже с учетом того, что ~60% рациона Heterocope caspia приходилось на водоросли и детрит, количество съеденного этим видом зоопланктона достигало >30 кал/(м3 сут) (36% Рzoo). Уровень каннибализма у Н. caspia был существенно ниже (6–10%), чем у Cyclopoida. Наиболее сложные трофические взаимодействия наблюдали в продуктивном Потемкинском участке, здесь сравнительно многочисленная (100–500 экз./м3) Leptodora kindtii перехватывала на себя значительное количество энергии (9 кал/(м3 сут)) или 10% Рzoo) фито-детритофагов и всеядных животных (рис. 3в). Еще 10% Рzoo потребляла коловратка Asplanchna, ее продукция в основном доставалась рыбам (15.5 кал/(м3 сут)). Для рыб было доступно 45% Рzoo, или 41.1 кал/(м3 сут), основная часть (>60%) приходилась на взрослых особей Heterocope caspia (17 кал/(м3 сут)), Calanipeda aquaedulcis (4 кал/(м3 сут)) и кладоцер Leptodora kindtii (4 кал/(м3 сут)). В самом малопродуктивном Приплотинном участке рыбы могли потребить 22.3 кал/(м3 сут) (64% Рzoo), в основном, это копеподы последних стадий развития Calanipeda aquaedulcis (15 кал/(м3 сут)) и Heterocope caspia (~6 кал/(м3 сут)) (рис. 3г), недоступные беспозвоночным хищникам.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В 2018 г. биомасса зоопланктона (1.8 ± 0.4 г/м3) в гипертрофном Цимлянском вдхр. была сопоставима с таковой в эвтрофных водохранилищах Верхней Волги и Камы (1–2 г/м3) (Лазарева, Соколова, 2015; Лазарева, 2020), но существенно выше по сравнению с мезотрофными водохранилищами Нижней Волги (0.2–1.2 г/м3) (Малинина и др., 2016; Лазарева и др., 2018). Современный уровень биомассы зоопланктона более чем вдвое выше такового, наблюдавшегося в 1972–2013 гг. (0.8 ± 0.1 г/м3) (Гламазда, 1974; Шевлякова, 2002; Свистунова, Саяпин, 2010; Вехов и др., 2014). Увеличение биомассы сообщества в этом водоеме регистрируют с 2015 г. (Голоколенова и др., 2019; Lazareva, Sabitova, 2021). Вероятно, это связано с массовым развитием в водохранилище крупных (длина тела 1.1–1.6 мм) ракообразных Heterocope caspia, Calanipeda aquaedulcis и Acanthocyclops americanus (табл. 1).
В августе 2018 г. средняя суточная Рzoo в Цимлянском вдхр. (8.4 мг С/(м3 сут)) была близка к отмеченной в 2009–2013 гг. (~7 мг С/(м3 сут)), водоем характеризуют как среднекормный для рыб (Вехов и др., 2014). В современный период продукция зоопланктона водохранилища в 1.7 раза выше наблюдавшейся в 1970-х годах (~5.0 мг С/(м3 сут)) (расчет по данным (Гламазда, 1982)). Она сопоставима со средней для августа (8 мг С/(м3 сут)) в Рыбинском водохранилище (Лазарева, Соколова, 2015). Увеличение продуктивности зоопланктона связано с двукратным ростом продукции нехищных животных с 3 до 6 мг С/(м3 сут), продукция хищников фактически осталась прежней (~2 мг С/(м3 сут)) (табл. 3).
Значительную часть Рzoo Цимлянского водохранилища (36–84%) потребляют беспозвоночные хищники. Максимальное воздействие этих хищников на зоопланктон наблюдали в Верхнем и Чирском участках водоема, где Cyclopoida съедали >80% Рzoo. Рыбам было доступно 16–64% Рzoo, больше всего в Потемкинском и Приплотинном участках, где доминировали крупные Calanoida. На большей части акватории водохранилища рыбы могли потреблять сравнительно высокое количество Рzoo в абсолютном выражении (22–41 кал/(м3 сут)). Крайне низкой (<7 кал/(м3 сут)) обеспеченностью пищей рыб-планктофагов отличался Чирской участок. Причиной этого был высокий уровень развития Cyclopoida (75% биомассы зоопланктона). Продукционный потенциал этой группы очень мал, удельная суточная скорость продукции достигает 0.10–0.12 сут–1 (науплиусы 0.2 сут–1, копеподиты I–III стадии 0.06 сут–1 и копеподиты IV–VI стадий 0.04 сут–1) (Иванова, 1985; Петрович, 1973). Это определяет низкий уровень Рzoo (44 кал/(м3 сут)), основную часть которой выедают беспозвоночные хищники, в основном, сами циклопоидные копеподы (циклические взаимодействия и каннибализм). Основу промысловых рыб Цимлянского вдхр. составляют бентофаги: лещ – 51%, серебряный карась – 17% и густера – 9% (Вехов и др., 2014). В прибрежье зоопланктоном питается молодь этих видов, в пелагиали к ним добавляется планктофаг тюлька.
В Цимлянском вдхр. в 2018 г. обнаружены пять понто-каспийских ракообразных: всеядные копеподы Heterocope caspia и Eurytemora caspica, кладоцеры-зоофаги Cercopagis pengoi (Ostroumov, 1891), Cornigerius maeoticus maeoticus (Pengo, 1879) и Podonevadne trigona ovum (Zernov, 1901). В структуре зоопланктона максимальное значение имеет только многочисленная (до 128 тыс. экз./м3) Heterocope caspia, в нижних двух участках водоема вид формирует 25–54% биомассы и >25% продукции сообщества. В трофической сети сообщества этой части вохранилища H. caspia аккумулирует основной поток энергии (~25% Рzoo) от фильтраторов к хищным видам и образует 30–40% Рzoo, доступной для рыб. В водохранилище H. caspia стала многочисленной в начале 1960-х годов (Кафтанникова, 1965).
Копепода Eurytemora caspica обитает в водохранилище с середины 1970-х годов, ранее вид идентифицировали в составе E. affinis (Poppe, 1880) (Гламазда, 1982; Шевлякова, 2002; Свистунова, Саяпин, 2010; Вехов и др., 2014). В 2013 г. E. caspica выделена из комплекса криптических видов E. affinis s.l. (Sukhikh, Alekseev, 2013). В 2018 г. в зоопланктоне Цимлянского вдхр. повсеместно обнаружена только E. caspica (Lazareva, 2020). Численность вида локально достигает 18 тыс. экз./м3, но его значение в структуре сообщества невелико (<5% общей биомассы, <1% Рzoo и 2% Gzoo).
Три вида понто-каспийских кладоцер обнаружены в Верхнем и Потемкинском участках водохранилища единично (<100 экз./м3), в трофических взаимодействиях их не учитывали. Как и Heterocope caspia, они достигли заметного уровня развития в водоеме в 1960-х годах (Гламазда, 1969, 1971б). Все понто-каспийские виды обитают в Цимлянском вдхр. в пределах своего древнего ареала, охватывавшего нижние участки крупных притоков (рек Дон, Днепр, Буг и Дунай) Азовского и Черного морей (Мордухай-Болтовской, 1960).
Важную роль в зоопланктоне Цимлянского вдхр. играют два чужеродных вида копепод – Calanipeda aquaedulcis и Thermocyclops taihokuensis. Средиземноморская Calanipeda aquaedulcis вселилась в водоем из Азовского моря в конце 1950-х годов (Гламазда, 1971а). Вид относится к фильтраторам фито-детритофагам (Гунько, Алдакимова, 1963). В 2018 г. численность C. aquaedulcis достигала >90 тыс. экз./м3, в Приплотинном участке водохранилища она формировала 67% биомассы зоопланктона и >50% Рzoo, на этот вид приходилось ~70% доступной для рыб продукции сообщества. Восточно-азиатский Thermocyclops taihokuensis (sin. T. asiatiсus (Kiefer, 1932)) впервые отмечен в водохранилище в 2012 г. (Вехов и др., 2014). Значение этого вселенца чрезвычайно велико в зоопланктоне Верхнего и Чирского участков водоема, в 2018 г. его численность достигала >600 тыс. экз./м3. Здесь он формировал 33–55% биомассы зоопланктона и 7–28% Рzoo, хищная часть популяции выедала 55–70% Рzoo.
В 2018 г. в водохранилище впервые зарегистрировано массовое развитие копеподы Acanthocyclops americanus. Ранее вид находили в дельте р. Дон (Свистунова и др., 2014), он обычен в водоемах юга Европейской России (Монченко, 1974). Расселение A. americanus в водохранилище произошло в результате расширения ареала, вид считают чужеродным, он вселился в Палеарктику из Северной Америки в прошлом веке (Alekseev et al., 2021). Этот вид, как и Thermocyclops taihokuensis, преобладал в Верхнем и Чирском участках водохранилища (>80 тыс. экз./м3). Здесь он формировал 16–20% биомассы зоопланктона, 4–10% Рzoo и выедал 25–45% Рzoo.
Учет особенностей распределения хищников и жертв по акватории позволил выявить существенные различия в трофической сети отдельных участков водоема (рис. 3), которые не были бы обнаружены при глобальном объединении данных. Важность такого подхода отмечена в обзоре (Boukal, 2014). Наш анализ подтвердил большое значение фильтрационного типа питания для Heterocope caspia, ранее отмеченное для других представителей этого рода (Монаков, 1998). Если считать старшие возрастные стадии H. caspia исключительно хватателями-зоофагами (raptors), то доступной им пищи недостаточно для достижения видом доминирования в сообществе зоопланктона южной части водохранилища. К сожалению, в литературе не обнаружено сведений о прямых наблюдениях за питанием этого вида.
Смена характера питания в онтогенезе чрезвычайно важна для успешного поддержания численности популяций всеядных копепод, в первую очередь Cyclopoida (Монаков, 1998; Brandl, 1998; Vincent et al., 2020). В настоящей работе популяции Thermocyclops taihokuensis, Acanthocyclops americanus и Heterocope caspia разделены на три трофических группы по составу пищи, способу ее захвата, а также учтен вклад растительной пищи на разных стадиях их развития. Он составил 100% для науплиусов, 25% для копеподитов I–III стадий и от 13% для копеподитов IV–VI cтадий Cyclopoida до >50% для таковых Heterocope и Eurytemora. Подобный подход апробирован нами ранее при анализе трофических взаимодействий в зоопланктоне Рыбинского вдхр. (Lazareva, Kopylov, 2011). Он позволяет более точно оценить уровень пресса на зоопланктон хищной части популяций копепод и степень их каннибализма.
Выводы. По данным 2018 г. установлено, что основу численности летнего зоопланктона Цимлянского вдхр. формируют Copepoda (60%), доминируя и по биомассе (70%). Наиболее многочисленны понто-каспийская Heterocope caspia и вселенцы Calanipeda aquaedulcis, Thermocyclops taihokuensis и Acanthocyclops americanus. Биомасса зоопланктона вдвое снижается от Верхнего участка водохранилища (2.4 ± 0.8 г/м3) к плотине Цимлянской ГЭС (1.2 ± 0.6 г/м3). Средний по акватории уровень продуктивности сообщества достигает 8.4 мг С/(м3 сут) (84 кал/(м3 сут)), наибольшая суточная продукция отмечена в Верхнем (14.2 мг С/(м3 сут)) и Потемкинском (9.1 мг С/(м3 сут)) участках. Анализ взаимодействия девяти трофических групп зоопланктона показал, что планктонные хищники наиболее интенсивно потребляют организмы мелкоразмерных (<800 мкм) групп (науплиусов, копеподитов I–III стадий развития и коловраток). Наиболее эффективно выедают зоопланктон многочисленные виды копепод Thermocyclops taihokuensis, Acanthocyclops americanus и Heterocope caspia, каждый вид потребляет в среднем по акватории 11–38% суточной Рzoo. Максимальный уровень каннибализма характерен для Cyclopoida, он достигает >40% продукции собственной популяции Thermocyclops taihokuensis и 12–16% Acanthocyclops americanus. Принципиально различаются пути передачи энергии от фильтраторов к верхнему трофическому уровню в северной (Верхний и Чирской участки) и южной (Потемкинский и Чирской участки) частях водохранилища. В северной части поток энергии проходит через Cyclopoida, рыбам остается доступно от <7 до 24 кал/(м3 сут) (16–17% Рzoo), в южной – в основном через Calanoida, здесь для рыб доступно 22–41 кал/(м3 сут) (45–64% Рzoo).
Список литературы
Авакян А.Б., Салтанкин В.П., Шарапов В.А. 1987. Водохранилища. Москва: Мысль.
Балушкина Е.В., Винберг Г.Г. 1979. Зависимость между длиной и массой тела планктонных ракообразных // Экспериментальные и полевые исследования биологических основ продуктивности озер. Ленинград: Зоол. ин-т АН СССР. С. 58.
Боруцкий Е.С., Степанова Л.А., Кос М.С. 1991. Определитель Calanoida пресных вод СССР. Ленинград: Наука.
Бульон В.В. 2019. Моделирование биотического потока энергии в планктонном сообществе экосистемы озерного типа при участии микробиальных процессов // Биология внутр. вод. № 3. С. 3.https://doi.org/10.1134/S032096521904003X
Бульон В.В., Никулина В.Н., Павельева Е.Б. и др. 1999. Микробиальная “петля” в трофической сети озерного планктона // Журн. общ. биологии. Т. 60. № 4. С. 431.
Вехов Д.А., Науменко А.Н., Горелов В.П. и др. 2014. Современное состояние и использование водных биоресурсов Цимлянского водохранилища (2009–2013 гг.) // Рыбохозяйственные исследования на водных объектах Европейской части России. Санкт-Петербург: ГосНИИ озер. и реч. рыб. хоз-ва. С. 116.
Гламазда В.В. 1969. О полифемидах Цимлянского водохранилища // Гидробиол. журн. Т. 5. № 5. С. 97.
Гламазда В.В. 1971а. Динамика зоопланктона Цимлянского водохранилища (по материалам 1966–1968 гг. // Тр. Волгоградского отделения ГосНИИ озер. и реч. рыб. хоз-ва. Т. 5. С. 25.
Гламазда В.В. 1971б. О нахождении Cercopagis pengoi (Ostr.) в Цимлянском водохранилище // Гидробиол. журн. Т. 7. № 4. С. 70.
Гламазда В.В. 1974. Зоопланктон Цимлянского водохранилища в 1969–1971 гг. // Тр. Волгоградского отделения ГосНИИ озер. и реч. рыб. хоз-ва. Т. 8. С. 29.
Гламазда В.В. 1982. Современное состояние зоопланктона Цимлянского водохранилища и его продукция // Тр. НИИ озер. и реч. рыб. хоз-ва. Вып. 184. С. 30.
Голоколенова Т.Б., Горелов В.П., Шевлякова Т.П., Басько Ю.В. 2019. Кормовая база Цимлянского водохранилища в 2016–2018 гг. // Проблемы устойчивого развития и экономической безопасности региона: Матер. XIV Междунар. науч.-практ. конф. Волгоград; Волжский 10–11 апреля 2019 г. Волгоград: Изд-во Волгоград. гос. ун-та. С. 115.
Гунько А.Ф., Алдакимова А.Я. 1963. Материалы о питании Calanipeda aquae-dulcis Kritsch. (Crustacea, Calanoida) в Азовском море // Рыбохозяйственные исследования в Азовском бассейне по запасам рыб и условиям их обитания. Москва: Рыб. хоз-во. С. 3.
Дзюбан Н.А. 1958. Зоопланктон Цимлянского водохранилища // Изв. Всесоюз. НИИ озер. и реч. рыб. хоз-ва. Т. 45. С. 51.
Иванова М.Б. 1985. Продукция планктонных ракообразных в пресных водах. Ленинград: Зоол. ин-т АН СССР.
Казанцева Т.И. 2003. Балансовая модель экосистемы мелкого высокоэвтрофного озера // Журн. общ. биологии. Т. 64. № 2. С. 128.
Кафтанникова О.Г. 1965. Зоопланктон Цимлянского водохранилища по материалам 1955–1962 гг. // Тр. Волгоградского отделения Гос. НИИ озер. и реч. рыб. хоз-ва. Т. 1. С. 71.
Кутикова Л.А. 1970. Коловратки фауны СССР. Ленинград: Наука.
Лазарева В.И., Соколова Е.А. 2015. Метазоопланктон равнинного водохранилища в период потепления климата: биомасса и продукция // Биология внутр. вод. № 3. С. 30.https://doi.org/10.7868/S0320965215030092
Лазарева В.И., Сабитова Р.З., Быкова С.В. и др. 2018. Распределение летнего зоопланктона в каскаде водохранилищ Волги и Камы // Тр. Ин-та биологии внутренних вод РАН. Вып. 83(86). С. 62. https://doi.org/10.24411/0320-3557-2018-10030
Лазарева В.И. 2020. Многолетние изменения состава и обилия зоопланктона водохранилищ р. Камa // Биология внутр. вод. № 3. С. 260.https://doi.org/10.31857/S0320965220030110
Малинина Ю.А., Джаяни Е.А., Филинова Е.И. и др. 2016. Оценка темпов многолетних изменений качественных и количественных параметров экосистемы Саратовского водохранилища // Современное состояние биоресурсов внутренних водоемов и пути их рационального использования: Матер. Всерос. конф. Казань: Гос. ин-т реч. рыб. хоз-ва. С. 618.
Минеева Н.М., Сигарева Л.Е., Тимофеева Н.А., Семадени И.В. 2020. Растительные пигменты в воде и донных отложениях Цимлянского водохранилища // Биология внутр. вод. № 4. С. 364. https://doi.org/10.31857/S0320965220040130
Монаков А.В. 1998. Питание пресноводных беспозвоночных. Москва: Ин-т проблем экологии и эволюции РАН.
Монченко В.I. 1974. Щелепноротi циклопоподiбнi. Циклопи (Cyclopidae). Киев: Наук. думка.
Мордухай-Болтовская Э.Д. 1960. О питании хищных кладоцер Leptodora и Bythotrephes // Биология внутренних вод: Информ. бюл. Москва. Вып. 6. С. 21.
Мордухай-Болтовской Ф.Д. 1960. Каспийская фауна в Азово-Черноморском бассейне. Москва: Изд-во АН СССР.
Мордухай-Болтовской Ф.Д., Ривьер И.К. 1987. Хищные ветвистоусые Podonidae, Polyphemidae, Cercopagidae и Leptodoridae фауны мира. Ленинград: Наука.
Науменко Е.Н., Хлопников М.М., Рудинская Л.В. 2012. Потоки энергии в экосистеме Вислинского (Калининградского) залива Балтийского моря // Журнал Сиб. фед. ун-та. Биология. № 5. С. 184.
Обозначения, единицы измерения и эквиваленты, встречаемые при изучении продуктивности пресных вод. 1972. Ленинград: Советский комитет по МБП.
Определитель зоопланктона и зообентоса пресных вод Европейской России. 2010. Т. 1. Зоопланктон. Москва: Товарищество науч. изданий КМК.
Петрович П.Г. 1973. Озеро Мястро. Озеро Нарочь. Озеро Баторино // Многолетние показатели развития зоопланктона озер. Москва: Наука. С. 7.
Свистунова Л.Д., Саяпин В.В. 2010. Проблема эвтрофирования Цимлянского водохранилища (Ростовская область) и новые данные о его зоопланктоне // Вестник Южного научного центра РАН. Т. 6. № 4. С. 61.
Свистунова Л.Д., Брынько В.А., Набоженко М.В. 2014. Современное состояние летнего зоопланктона дельты реки Дон // Вестник Южного научного центра РАН. Т. 10. № 3. С. 75.
Шевлякова Т.П. 2002. Современное состояние зоопланктона Цимлянского водохранилища (по материалам 1996–2001 гг.) // Рыбохозяйственные исследования в бассейне Волго-Донского междуречья на современном этапе (к 50-летию Волгоградского отделения ГосНИОРХ). Санкт-Петербург: Квинта Северо-Запад. С. 46.
Alekseev V.R., Miracle M.R., Sahuquillo M., Vicente E. 2021. Redescription of Acanthocyclops vernalis (Fischer, 1853) and Acanthocyclops robustus (Sars, 1863) from neotypes, with special reference to their distinction from Acanthocyclops americanus (Marsh, 1892) and its invasion of Eurasia // Limnetica. V. 40. № 1. P. 57. https://doi.org/10.23818/limn.40.05
Blumenshine S.C., Hambright K.D. 2003. Top-down control in pelagic systems: a role for invertebrate predation // Hydrobiologia. V. 491. № 1–3. P. 347.
Brandl Z. 1998. Feeding strategies of planktonic cyclopoids in lacustrine ecosystems // J. Mar. Systems. V. 15. Is. 1–4. P. 87.
Boukal D.S. 2014. Trait- and size-based descriptions of trophic links in freshwater food webs: current status and perspectives // J. Limnol. V. 73 (S. 1). P. 171. https://doi.org/10.4081/jlimnol.2014.826
Dumont H.J., Van de Velde I., Dumont S. 1975. The dry weight estimate of biomass in a selection of Cladocera, Copepoda and Rotifera from the plankton, periphyton and benthos of continental waters // Oceologia. V. 19. P. 75.
Gliwicz Z.M. 2002. On the different nature of top-down and bottom-up effects in pelagic food webs // Freshwater Biol. V. 47. P. 2296.
Hart D.R., Stone L., Berman T. 2000. Seasonal dynamics of the Lake Kinneret food web: The importance of the microbial loop // Limnol., Oceanogr. V. 45. № 2. P. 350.
Lazareva V.I. 2020. Distribution of Eurytemora caspica Sukhikh et Alekseev, 2013 (Crustacea: Calanoida) in the water reservoirs of the Volga and Don River basins // Crustaceana. V. 93. № 3‒5. P. 261. https://doi.org/10.1163/15685403-00003982
Lazareva V.I., Kopylov A.I. 2011. Zooplankton productivity at the peak of eutrophication of the plain reservoir ecosystem: the role of invertebrate predators // Biol. Bull. Rev. V. 1. № 6. P. 542. https://doi.org/10.1134/S2079086411060041
Lazareva V. I., Sabitova R.Z. 2021. Zooplankton of the Tsimlyansk Reservoir and Volga–Don Shipping Canal // Biol. Bulletin. V. 48, №. 9. P. 1473.
https://doi.org/10.1134/S1062359021090132
Monchenko V.I. 2008. Redescription of the Oriental Thermocyclops taihokuensis (Harada, 1931) (Copepoda: Cyclopoida) from its westernmost population // Zoology in the Middle East. V. 43. № 1. P. 99. https://doi.org/10.1080/09397140.2008.10638274
Papinska K. 1985. Carnivorous and detritivorous feeding of Mesocyclops leuckarti Claus (Cyclopoida, Copepoda) // Hydrobiologia. V. 120. P. 249.
Petchey O.L., Beckerman A.P., Riede J.O., Warren P.H. 2008. Size, foraging, and food web structure // P. Natl. Acad. Sci. USA. V. 105. P. 4191.
Ruttner-Kolisko A. 1977. Suggestion for biomass calculation of planktonic rotifers // Arch. Hydrobiol. Ergebn. Limnol. Bd 8. P. 71.
Sukhikh N.M., Alekseev V.R. 2013. Eurytemora caspica sp. nov. from the Caspian Sea – one more new species within the E. affinis complex (Copepoda: Calanoida, Temoridae) // Proceedings of the Zoological Institute RAS. V. 317. № 1. P. 85.
Vincent F., Bertolo A., Lacroix G. et al. 2020. Trait-dependency of trophic interactions in zooplankton food webs // Oikos. Nordic Ecological Society. V. 129. № 6. P. 891. https://doi.org/10.1111/oik.06783
Yang Yu., Brandl Z. 1996. Feeding of Acanthocyclops robustus on zooplankton // Chin. J. Oceanol. Limnol. V. 14. № 1. P. 17.
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод


