Биология внутренних вод, 2022, № 5, стр. 480-492
Состав и структура фитопланктона оз. Светлояр (Россия)
А. Г. Охапкин a, Е. Л. Воденеева a, b, *, Е. М. Шарагина a, П. В. Кулизин a
a Нижегородский государственный университет им. Н.И. Лобачевского, Институт биологии и биомедицины
Нижний Новгород, Россия
b Нижегородский филиал Всероссийского научно-исследовательского института рыбного хозяйства и океанографии
Нижний Новгород, Россия
* E-mail: vodeneeva@mail.ru
Поступила в редакцию 23.03.2022
После доработки 10.04.2022
Принята к публикации 04.05.2022
- EDN: DJYIHE
- DOI: 10.31857/S0320965222050199
Аннотация
Дана характеристика таксономической, эколого-географической структуре и межгодовой динамике альгофлоры планктона и количественных показателей альгоценозов пелагиали уникального по морфометрии и происхождению оз. Светлояр (Нижегородская обл.), имеющего статус памятника природы федерального значения. Видовое богатство альгофлоры достигало 225 видовых и внутривидовых таксонов водорослей из восьми отделов, среди которых преобладали зеленые (36% общего состава), диатомовые (18%) водоросли и цианобактерии (15%). По составу структурообразующих видов и уровню средневегетационной биомассы трофический статус водоема определен как олиготрофный (биомасса <1 г/м3), в жаркие годы – как мезотрофный (>4 г/м3). К основным изменениям, вызванным прогрессирующей эвтрофикацией вод и потеплением климата, относили возрастание таксономического разнообразия эвгленовых водорослей и цианобактерий, а также усиление ценотической роли последних до уровня интенсивного “цветения” воды дизазотрофными представителями в условиях аномально жаркого года с антициклональным типом погоды.
ВВЕДЕНИЕ
Водные экосистемы, своеобразные по своим лимнологическим характеристикам и составу биоты, в том числе озера карстового и ледникового происхождения, обычно считаются объектами охраны как местообитания редких и исчезающих видов растений и животных. В бассейне Средней Волги к таким объектам, имеющим статус федерально охраняемых, относится уникальное по происхождению оз. Светлояр (Бакка, Киселева, 2009). Оно характеризуется рядом параметров (прежде всего морфометрических – аномально большая глубина при небольшой площади), позволяющих предположить своеобразие состава и организации водных сообществ, в том числе и фитопланктона. Экосистемы данного типа представляют несомненный интерес при выявлении закономерностей реагирования биоты на комплекс факторов, определяющих структуру биотических сообществ. Результаты комплексных исследований на похожих водоемах, расположенных в Испании, Литве (Kalytyte et al., 2002) и России (Среднее Поволжье) (Палагушкина, 2004), выявили ряд специфических особенностей гидрологического и гидрохимического режимов, оказывающих прямое влияние на их обитателей (Корнева и др., 2004). Изучение структурно-функциональных характеристик фитопланктона позволяет оценить многие показатели биологического разнообразия, уровень продуктивности, установить экологическое состояние водоема и оценить качество воды.
Исследования необычных по лимнологическим и биологическим параметрам озер в бассейне р. Волга немногочисленны (Озера…, 1976; Есырева, Юлова, 1977; Охапкин, 1981; Юлова, 2001; Воденеева, 2007, 2008; Гусев, 2007, 2011; Баянов, Юлова, 2001;). Предыдущие работы по составу и структуре альгоценозов планктона карстовых озер проводили преимущественно на высокоминерализованных водоемах, в том числе с сульфатным классом вод (Уникальные…, 2001; Тарасова, 2010; Genkal et al., 2019; Vodeneeva et al., 2020), однако низкоминерализованные озера в этом отношении мало изучены (Корнева, 2000; Gusev, 2008а, 2008b; Горохова, Паутова, 2009). В ряду этих исследований данных по структурно-функциональным показателям фитопланктона оз. Светлояр крайне недостаточно (Охапкин и др., 2004; Воденеева, 2008; Баянов и др., 2009; Воденеева и др., 2021).
Цель работы – определить состав фитопланктона, его таксономическую и экологическую структуру, сезонную и межгодовую динамику количественных показателей. Выявить изменения параметров альгоценозов в связи с изменением климата и ростом рекреационной нагрузки на экосистему оз. Светлояр.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
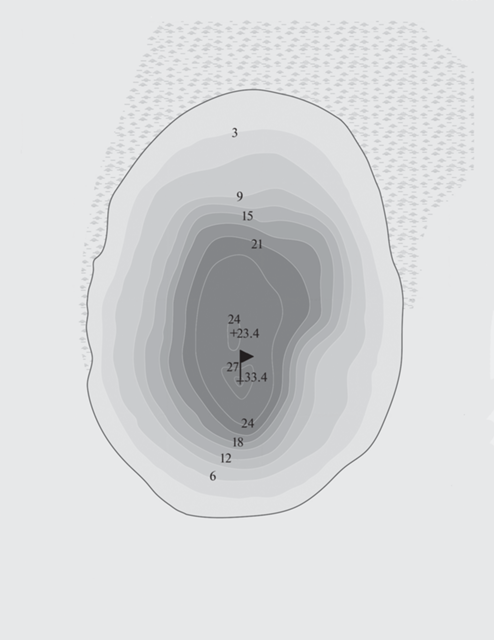
Озеро Светлояр расположено в низинном левобережном Заволжье, в 130 км к северо-востоку от г. Нижний Новгород и в 1–1.5 км западнее села Владимирского Воскресенского р-на (56°49′09″ с.ш., 45°05′30″ в.д.), в пределах природного парка Воскресенское Поветлужье. Озеро является памятником природы федерального значения, включено в Единый государственный реестр объектов культурного наследия (памятников истории и культуры) народов РФ (Бакка, Киселева, 2009). Светлояр – место активного паломничества христиан и интенсивного туризма.
Происхождение озера дискуссионно: в литературе обсуждается ледниковое, вулканическое, карстовое, аллювиальное, тектоническое и метеоритное (Баянов, Никишина, 2005). Уникальность озера в том, что при диаметре лишь ~350–400 м, его глубина достигает 33.4 м, что является явной аномалией, свидетельствующей в пользу метеоритной гипотезы, и выделяет его среди соседних озер (Енгалычев, 2009a, 2009б). Водоем расположен в правобережье р. Люнды, питается холодными водами родников и имеет постоянный уровень. Берега слабо заболочены. Объем котловины водоема – 1.5 км3, площадь водного зеркала 14.83 га, мощность донных отложений ~8 м (Енгалычев, 2009а, 2009б). Основные морфометрические характеристики озера по данным Баянова и др. (2009) и Науменко и др., (2014) приведены в табл. 1.
Таблица 1.
Основные морфометрические характеристики оз. Светлояр, по данным разных лет исследований
| Параметр | Литературный источник | |
|---|---|---|
| Баянов и др., 2009 | Науменко и др., 2014 | |
| Длина, м | 454 | 472 |
| Ширина, м (max/средняя) | 348/316 | 338/ – |
| Площадь зеркала, км | 0.13 | 0.12 |
| Объем, тыс. м3 | 1500 | 1150 |
| Глубина, м (max /средняя) | 33.2/10.3 | 32.7/9.5 |
| Длина береговой линии, м | 1324 | 1328 |
| Изрезанность береговой линии | 1.01 | 1.04 |
| Коэффициент формы | 1.02 | 1.40 |
Материалом для работы послужили пробы фитопланктона объемом 0.5 л, отобранные в пелагической части озера (рис. 1) в зоне максимальных глубин на нескольких горизонтах фотического слоя (поверхность, 0.5, 1.0, 2.0 и 3.0 величины прозрачности по диску Секки) в которых, как правило, концентрируется основная масса водорослей. Батометрические пробы отбирали 1–2 раза в месяц с мая по декабрь 2010 и с января по ноябрь 2011 г. Для оценки динамики показателей фитопланктона привлечены данные более ранних исследований (за 2000–2002 гг.) (Баянов и др., 2009). Всего проанализировано 90 проб. Одновременно измеряли температуру, прозрачность и рН воды. Методы отбора, качественной и количественной обработки альгологических проб даны в работе Воденеевой (Е.Л. Vodeneeva et al., 2020).
Изучены следующие структурные показатели фитопланктона: общее, относительное и удельное видовое богатство, численность и биомасса альгоценозов. Количественные показатели за период 2000–2002 гг. охарактеризованы для поверхностного (0–0.5 м) и фотического слоя (средневзвешенные численность и биомасса для слоя 0 м – величина прозрачности по диску Секки (м) умноженная на 3) (Методика…, 1975). Оценены состав и динамика структурообразующих видов (доминанты с биомассой ≥10% общей и субдоминанты с 5‒10% общей биомассы). Для определения трофности водоема применена шкала И.С. Трифоновой (1990). Размерную структуру альгоценозов оценивали по средним ценотическим объемам клетки в пробе (Vц, мкм3 × 10‒3, B/N). Для оценки межгодовых различий показателей использовали критерий Манна–Уитни (U‑критерий) (Шитиков и др., 2003). Также приведены статистически значимые (p < 0.05) коэффициенты корреляции Спирмена (Rsp) и коэффициенты аппроксимации (R2) уравнений линейной регрессии анализируемых параметров. Сходство альгоценозов оценивали по видовому составу и биомассе методом попарных сравнений с использованием качественной меры Серенсена.
Озеро относится к группе димиктических озер с короткими периодами весеннего и осеннего перемешивания и длительной зимней и летней стагнацией, с наличием четкой обратной и прямой температурной стратификации и анаэробного всегда холодного гиполимниона. Воды Светлояра гидрокарбонатного класса группы кальция летом или магния зимой с незначительной минерализацией и низкой цветностью, прозрачность порядка 5 м (табл. 2). Концентрация минерального азота свойственна мезотрофно-эвтрофным водам (особенно у дна), общего фосфора – гипертрофным (Баянов, 2008; Козлов и др., 2019).
Таблица 2.
Основные гидрохимические параметры вод озера (апрель 2000, январь и август 2001 г.)
| Показатель | Поверхность | Дно |
|---|---|---|
| Цветность, Pt-Co, град. | 9–40(25.3) | – |
| Взвешенные вещества, мг/л | 0.6–1.8(1.0) | 1.0–13.6(6.8) |
| Ca2+, мг/л | 6.1–12.2(9.6) | 5.8–13.8(10.3) |
| Mg2+, мг/л | 4.1–7.9(5.5) | 5.6–6.7(6.2) |
| Na+ + K+, мг/л | 0.0–20.7(9.4) | 6.8–33.2(17.1) |
| HC${\text{O}}_{3}^{ - }$, мг/л | 31.0–85.48(61.2) | 82.4–153.0(105.9) |
| S${\text{O}}_{4}^{{2 - }}$, мг/л | 2.0–5.0(3.6) | 1.0–2.2(1.7) |
| Cl–, мг/л | 1.1–3.7(2.6) | 1.2–4.0(3.0) |
| Сумма ионов, мг/л | 58.0–119.4(94.4) | 109.5–208.7(144.2) |
| Общая жесткость, мг-экв./л | 0.64–1.16(0.93) | 0.84–1.15(1.02) |
| N${\text{O}}_{3}^{ - }$, мг N/л | 0.00–1.15(0.43) | 0.01–0.12(0.05) |
| N${\text{O}}_{2}^{ - }$, мг N/л | 0.019–0.026(0.023) | 0.001–0.069(0.046) |
| N${\text{H}}_{4}^{ + }$, мг N/л | 0.00–1.05(0.05) | 0.14–3.26(2.10) |
| Сумма минеральных форм азота, мг N/л | 0.02–1.31(0.50) | 1.17–3.34(2.20) |
| P${\text{O}}_{4}^{{2 - }}$, мкг P/л | 16–30(25) | 10–536(272) |
| Pобщ., мкг P/л | 26–160(105) | 120–622(347) |
| Si, мг/л | 0.5–3.4(1.6) | 7.2–8.0(7.5) |
| ХПК, мг O2/л | 23.9–34.1(29.8) | 20–31.5(27.2) |
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Видовое богатство фитопланктона озера по обобщенным данным 2000‒2011 гг. представлено 225 таксонами водорослей рангом ниже рода из восьми отделов: Cyanobacteria, Euglenophyta, Dinophyta, Cryptophyta, Ochrophyta, Bacillariophyta, Chlorophyta и Charophyta (табл. 3). По богатству видами отделов альгофлора характеризуется как зелено-диатомово-цианофитная с высокой долей охрофитовых (золотистых) в ее формировании.
Таблица 3.
Видовое богатство водорослей отделов альгофлоры оз. Светлояр
| Отдел | Число видов | ||
|---|---|---|---|
| 2000–2002 г. | 2010–2011 г. | 2000–2011 г. | |
| Cyanobacteria | 15 | 26 | 34 |
| Euglenophyta | 10 | 15 | 18 |
| Dinophyta | 7 | 7 | 10 |
| Cryptophyta | 2 | 3 | 3 |
| Ochrophyta | 21 | 18 | 29 |
| Bacillariophyta | 30 | 24 | 40 |
| Chlorophyta | 48 | 52 | 80 |
| Charophyta | 7 | 7 | 11 |
| Общий состав | 140 | 152 | 225 |
Среди ведущих порядков выделялись Sphaeropleales (41 вид); Chromulinales (21), Synechococcales (18), Chlorellales, Euglenales (по 17) и Chlamydomonadales (15), другие порядки менее представлены (по 6–9). Перечень таксономически значимых родов водорослей включал Trachelomonas (15 видовых и внутривидовых таксонов), Dinobryon, Kephyrion, Monoraphidium (по 7), Aphanocapsa, Oocystis (по 5), Dolichospermum, Mallomonas, Scenedesmus, Cosmarium, Chlamydomonas и Desmodesmus (по 4). На виды этих родов приходилось 31.1% общего богатства флоры водорослей пелагических сообществ.
В фитопланктоне озера отмечены редкие и нечасто встречающиеся в водных объектах бассейна Средней Волги виды водорослей: Vacuolaria sp. (Raphidophyceae, Ochrophyta), Kephyrion amphorula Conr., K. cupuliforme Conr., K. parvulum (Schmid) Bourelly, Pseudokephiryon polonicum Conr., Dinobryon pediforme (Lemm.) Steineckle, D. koršikovii Matv. ex Kapustin, Lagynion scheffelii Pasch. (Chrysophyceae), Peroniella minuta M.F. Rich (Xanthophyceae), Gymnodinium simile Skuja (Dinophyta), Phacotus lenticularis (Ehr.) Dies., P. coccifer Korsch., Dictyochlorella reniformis (Korsch.) Silva, Desmatractum indutum (Geitl.) Pasch., Quadricoccus ellipticus Hortob. (Chlorophyta), Staurodesmus mammulatus (Nordst.) Teil., S. megacanthus (Lund.) Thurn. (Charophyta).
Число таксонов различного ранга в альгофлоре озера (табл. 3) имеет слабую тенденцию к возрастанию с 2000 к 2011 гг., более выраженную у цианобактерий и зеленых водорослей. На уровне отделов общая характеристика альгофлоры поменялась с зелено-диатомово-охрофитовой (с участием цианобактерий и эвгленовых) на зелено-цианобактериально-диатомовую (с участием охрофитовых и эвгленовых). Изменения претерпели и ранговые позиции ведущих таксонов флоры – порядков, семейств и родов, демонстрируя постепенный рост за 10 лет разнообразия цианобактерий и эвгленид и депрессию богатства охрофит (золотистых) и диатомей.
Характеристика индикаторных возможностей представителей альгофлоры наряду с таксономическим анализом видового состава позволили выявить многолетние изменения некоторых параметров среды обитания. Общая эколого-географическая структура видового состава водорослей пелагиали озера дана на рис. 2. По приуроченности к биотопу отмечено преобладание истинно планктонных форм (58% списка видов) и компонентов, встречающихся и в пелагиали, и в обрастаниях разных субстратов (16%). Доля бентосных, литоральных видов и эпибионтов невелика (0.03–0.07%), однако участие эвритопных водорослей оказалось весомым, достигая ~25% общего видового состава.
Рис. 2.
Доля основных экологических групп водорослей в альгофлоре оз. Светлояр в разные периоды исследования. Биотопические группы: пл. – планктонная, б. – бентосная, л. – литоральная, эп. – эпибионтная, эв. – эвритопная. Географический элемент флоры: косм. – космополит, бор. – бореальный, с-а – североальпийский, с-т – субтропический. Индикаторы солености: ог. – олигогалоб, гб. – галофоб, гл. – галлофил, инд. – индифферент. Индикаторы рН: ал. – алкалифил, ац. – ацидофил + ацидобионт, инд. – индифферент. Индикаторы сапробности: χ ‒ ксеносапроб, o – олигосапроб, o–β – олиго-бета-мезосапроб, β–o – бета-олиго-мезосапроб, β – бета-мезосапроб, α–β – альфа-бета-мезосапроб, α- – альфа-мезосапроб, α–ρ –альфа-поли-мезосапроб., β–α – бета-альфа-мезосапроб., неуст. – приуроченность к группе не установлена.

По отношению к содержанию NaCl в воде весь перечень индикаторов образован пресноводными видами с низкой соленостью – олигогалобами. Более 80% перечня индикаторных видов – индифференты – типичные обитатели пресных вод с заметным обилием, но в небольших количествах встречающиеся в водах с низкой соленостью. Галофилы, вегетирующие в пресноводных или слегка солоновато водных местообитаниях, а также галофобы, погибающие даже от незначительного повышения содержания NaСl в воде составляли 4–5% состава индикаторов солености воды, мезогалобы не отмечены.
По отношению к степени кислотности водных масс состав показательных в этом отношении видов водорослей на 67% сформирован индифферентами, одну его четверть образуют алкалифилы и только 8% – представителями кислых вод – ацидобионтами.
Доля видов индикаторов сапробности, развивающихся в водах среднего и низкого органического загрязнения (суммарно) за 10 лет изменилась незначительно (с 38% в 2000–2002 гг. до 36% в 2010–2011 гг.), тогда как относительное видовое богатство индикаторов более загрязненных вод (β–α-мезосапробных, α–β-мезосапробных, α‑мезосапробных и α-мезо-полисапробных вод) в сумме выросло в 1.44 раза – с 9 до 13%, что может свидетельствовать о возрастании эвтрофирования водоема. Анализ динамики географических элементов альгофлоры продемонстрировал почти полное преобладание широко распространенных в водоемах видов, достигающих 95% состава водорослей и неизменность этого показателя их состава в изученный период времени.
Количественное развитие планктонных альгоценозов фотической зоны озера во все годы (кроме 2010 г.) было свойственно водоемам олиготрофного типа (рис. 3, табл. 4). В начальный период исследований, как правило, численность фитопланктона не превышала 1.0 млн кл./л с подъемами в середине или конце лета из-за вегетации цианобактерий. В 2002 г. в поверхностном горизонте пелагиали отмечали весенний (за счет зеленых) и летний (за счет цианобактерий) пики фитопланктона. Аномально жаркий с антициклональным типом погоды 2010 г. отличался от других лет исследований интенсивным летним и осенним “цветением” воды, вызванном цианобактериями, их концентрация у поверхности превышала 900 млн кл./л. Численное развитие альгоценозов в 2011г. определялось вегетацией зеленых и было на один–два порядка выше, чем таковое в первые годы XXI в.
Рис. 3.
Многолетняя сезонная динамика биомассы (г/м3) разных систематических групп фитопланктона в поверхностном слое оз. Светлояр.

Таблица 4.
Значения чсленности (N) и биомассы (В) фитопланктона в поверхностном (I) и фотическом (II) горизонте озера
| I | II | ||
|---|---|---|---|
| N, млн кл./л | B, г/м3 | N, млн кл./л | B, г/м3 |
| 2000 г. | |||
| $\frac{{0.19 - 0.94\left( {0.54} \right)}}{{\begin{array}{*{20}{c}} {0.56 \pm 0.15} \end{array}}}$ | $\frac{{\begin{array}{*{20}{c}} {0.08 - 0.70\left( {0.16} \right)} \end{array}}}{{\begin{array}{*{20}{c}} {0.31 \pm 0.11} \end{array}}}$ | ||
| 2001 г. | |||
| $\frac{{0.01 - 1.03\left( {0.08} \right)}}{{0.25 \pm 0.10}}$ | $\frac{{0.01 - 2.54\left( {0.04} \right)}}{{0.57 \pm 0.28}}$ | ||
| 2002 г. | |||
| $\frac{{0.01 - 9.11(0.33)}}{{1.37 \pm 0.89}}$ | $\frac{{0.01 - 3.96(0.11)}}{{0.58 \pm 0.39}}$ | ||
| 2010 г. | |||
| $\frac{{0.03 - 969.7\left( {4.40} \right)}}{{865 \pm 57.8}}$ | $\frac{{0.03 - 32.9\left( {1.25} \right)}}{{3.19 \pm 1.88}}$ | $\frac{{0.03 - 262.0\left( {10.0} \right)}}{{40.3 \pm 20.3}}$ | $\frac{{0.03 - 4.0\left( {0.62} \right)}}{{1.06 \pm 0.27}}$ |
| 2011 г. | |||
| $\frac{{0.03 - 192.9\left( {0.61} \right)}}{{16.7 \pm 12.9}}$ | $\frac{{0.02 - 2.06\left( {0.13} \right)}}{{0.26 \pm 0.13}}$ | $\frac{{0.02 - 106.5\left( {0.79} \right)}}{{9.10 \pm 6.99}}$ | $\frac{{0.02 - 0.53\left( {0.16} \right)}}{{0.23 \pm 0.05}}$ |
Динамика биомассы фитопланктона в поверхностном слое в целом повторяла таковую численности (табл. 4), хотя ее структура отличалась. Наибольший вклад в структуру биомассы вносили, как правило, крупноклеточные динофитовые, формирующие летние подъемы (рис. 3). В первый год наблюдений за фитопланктоном озера его биомасса была крайне низка с более заметными значениями для золотистых (весной) и динофитовых (летом) водорослей. В 2010 г. в период позднелетнего–раннеосеннего “цветения” воды цианобактериями их биомасса превышала 30 г/м3 и была свойственна водоемам эвтрофного типа. Развитие динофитовых в поверхностном горизонте озера во второй период наблюдений отмечалось в конце весны – первой половине лета.
Структура количественных показателей фитопланктона, рассчитанная как средневзвешенная для фотического слоя, оказалась более сложной, чем в поверхностном горизонте водной толщи (0–0.5 м), что косвенно отразило наличие заметной его вертикальной стратификации в пределах зоны фотосинтеза. Концентрация фитопланктона, особенно цианобактерий, в поверхностном горизонте в период их наибольшего развития 2010 г. в 3.5 по численности и 8 раз по биомассе превышали средневзвешенные показатели для всей зоны фотосинтеза (табл. 4).
Уровень количественного развития водорослей планктона в первый период наблюдений был характерным для водоемов олиготрофно-мезотрофного типа и в поверхностном горизонте определялся золотистыми и зелеными или цианобактериями (численность 1–9 млн кл./л), золотистыми и диатомовыми, либо динофитовыми (биомасса 0.7–4.0 г/м3). Десятилетием позже численность водорослей достигала 193–970 млн кл./л (у поверхности) и 106–262 млн кл./л (средневзвешенная для фотического слоя) всегда в период массовой вегетации цианобактерий. Биомасса в отличие от численности наибольшими значениями характеризовалась в период максимального прогрева воды в аномально жарком 2010 г. (32.9 г/м3, цианобактерии). В 2011 г. биомасса – (0.53–2.1 г/м3) существенно не отличалась от таковой 2000–2002 гг. и определялась развитием динофитовых (у поверхности) с сопутствием эвгленовых и диатомовых (в столбе слоя фотосинтеза).
Весной 2010 г., когда максимальные показатели численности водорослей приходились на вторую половину мая и были приурочены к нижней части металимниона, доминировала зеленая водоросль Dictyosphaerium subsolitarium Van Goor (60.4 млн кл./л – 0.21 г/м3). Основной вклад в формирование биомассы в этот период вносили динофитовые Ceratium hirundinella (1.39 г/м3) и Peridinium cinctum (0.16 г/м3), максимальные показатели их биомассы были приурочены к поверхностному горизонту. Присутствие этих структурообразующих видов в весенних и летних альгоценозах отмечали и в 2000–2002 гг. (табл. 5).
Таблица 5.
Сезонная сукцессия состава доминирующих видов фитопланктона в разные периоды исследований
| Доминанты | |||
|---|---|---|---|
| зима | весна | лето | осень |
| 2000–2002 г. | |||
| Peridinium cinctum (0.03), Trachelomonas volvocina (0.03), Pandorina mourn (0.03), Chlamydomonas sp. (0.02) |
Dinobryon divergens (0.36), Trachelomonas volvocina (0.03),
Chrysococcus biporus (0.02), Mallomonas sp. (0.02), Chlamydo-monas sp. (0.02) |
Ceratium hirundinella (2.61), Peridinium cinctum (1.03), P. willei (0.29) | Ceratium hirundinella (0.16), Trachelomonas spp. (0.05) |
| 2010–2011 г. | |||
| Trachelomonas volvocina (0.45),
Trachelomonas oblonga (0.09), T. bacillifera (0.06),
T. hispida (0.06), Ceratium hirundinella (0.26) |
Ceratium hirundinella (1.39), Cyclotella sp. (0.31), Dinobryon spp. (0.21), Dictyosphaerium subsolitarium (0.21), Peridinium cinctum (0.16), Chlamydomonas sp. (0.12), Asterionella formosa (0.11) |
Dolichospermum circinale (31.4),
Ceratiumhirundinella (2.82), Dictyosphaerium subsoiltarium 0.64), Cyclotella sp. (0.42), Trachelomonas volvocina (0.42), Аsterionella formosa (0.32), Peridinium cinctum (0.23), Snowella spp. (0.30), Microcystis aeruginosa (0.12), Microcystis wesenbergii (0.12), Chlamydomonas sp. (0.12) |
Ceratium hirundinella (1.23), Microcystisaeruginosa (0.61), Uroglena sp. (0.58), Ochromonas sp. (0.23), Trachelomonas volvocina (0.18), Peridinium cinctum (0.14), Cyclotella sp. (0.11) |
Летний сезон 2000–2002 гг. в развитии фитопланктона отличался вегетацией цианобактерий Snowella sp. (в июле–августе), видов рода Microcystis (в августе – первой декаде сентября) и Aphanothece clathrata (по численности, в первой декаде сентября). В 2010 г. впервые за период исследований фитопланктона озеро “зацвело” Dolichospermum circinale (Rabenh. ex Born. et Flah.) Wacklin et al., максимальная биомасса которого от лета к осени возрастала с 4.06 до 31.4 г/м3 (рис. 2). В июне и июле 2010 г. в качестве сопутствующих по биомассе видов выступали динофитовые (в июле до 2.82 г/м3 за счет Ceracium hirundinella). В предыдущие годы C. hirundinella и Peridinium cinctum относились к преобладающим по биомассе компонентам (в сумме до 3.98 г/м3) летнего фитопланктона. Осенью руководящая роль цианобактерий постепенно переходила к динофитовым, эвгленовым или золотистым.
Состав массовых видов фитопланктона и его сезонные изменения (табл. 5) имел свои особенности в различные периоды исследований озера. В 2000–2002 гг. он был сформирован, главным образом, водорослями монадной структуры (динофитовыми, эвгленовыми, золотистыми и зелеными вольвоксовыми). Десятилетием позже он заметно обогатился, особенно в летне-осенний период за счет диазотрофных цианобактерий, а также хлорококковых и диатомовых, увеличивших не только разнообразие массовых форм в альгоценозах, но и их количественное развитие.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Озеро Светлояр относится к группе димиктических с хорошо выраженными периодами весеннего и осеннего перемешивания, зимней обратной и летней прямой температурной стратификацией (Баянов, 2008; Баянов, Ананьев, 2015). Его водная толща четко делится на две части: примерно до половины глубины – освещенная, заметно прогреваемая летом с хорошим кислородным режимом зона развития фитопланктона и продуцирования органического вещества, и вторая – аноксигенная, с восстановительными условиями и признаками наличия сероводорода, гиполимниальная афотическая зона. За десятилетие граница аэробной и анаэробной частей пелагиали озера сдвинулась вверх, к поверхности, примерно на 3 м (Баянов, Ананьев, 2015).
Особенность термического режима озера – отсутствие весеннего и осеннего перемешивания водной толщи до дна и наличие всегда холодного (4°С) стабильного анаэробного гиполимниона. Это препятствует активному выносу биогенных элементов на поверхность (разница поверхностных и придонных концентраций общего фосфора достигает 3.3–4.6 раз, минеральных форм азота – 2.3–58.5 раз, кремния – 2.4–14.4 раз), что длительное время определяло незначительный или средний уровень продуктивности фитопланктона. Косвенным доказательством этого была величина максимальной прозрачности вод пелагиали, достигавшая в 1970-х–начале 2000 гг. 6.0–6.2 м (Баянов, 2008).
Ретроспективный анализ динамики таксономической структуры альгофлоры планктона озера доказывает наличие значительных сукцессионных изменений, связанных с прогрессирующей эвтрофикацией и потеплением климата. Состав фитопланктона в 2010–2012 гг. по общему видовому богатству (152 вида, разновидностей и форм водорослей из восьми отделов) незначительно отличался от такового (140 таксонов из восьми отделов) десятилетием ранее, в 2000–2002 годы (Охапкин и др., 2004; Воденеева, 2008; Баянов и др., 2009). Для каждого периода наблюдений состав водорослей характеризовался относительной бедностью. Это может служить показателем достаточно небольшой экологической емкости (способности поддерживать жизнедеятельность не любого, а определенного числа видов со свойственными для их популяций уровнем и динамикой численности) пелагиали озера. При незначительных изменениях качественного состава ведущих порядков и семейств, перечень ведущих родов претерпел более серьезные трансформации.
За первое десятилетие 21-го века состав альгофлоры заметно поменялся (коэффициент флористической общности Серенсена 0.45), сменившись более чем наполовину (57%). Отмечался заметный рост разнообразия цианобактерий (в 1.73 раза) и эвгленовых (в 1.5 раза), и отчетливое обеднение состава охрофит (Chrysophyceae) (на 24%). Наблюдалась тенденция к росту числа таксонов с монадной организацией таллома (в 1.33 раз) – представителей с миксотрофным, в том числе и голозойным типами питания.
Среди экологических характеристик альгофлоры ее оценка по типу местообитания и географическому распространению из всех прочих (галобность, рН, сапробность, органическое загрязнение и др.) оказались наиболее стабильными. За десятилетний период соотношение видов по типу местообитаний не изменилось. Основу списка индикаторов формировали планктонные формы – обитатели пелагиали, доля которых варьировала крайне незначительно: 60% 2000–2002 гг. и 58% спустя десять лет. Доля бентосных, литоральных и эпифитных форм водорослей была от 3% (эпибионты) до 7% (литоральные) в общем списке. Такие небольшие межгодовые колебания отражали стабильность биотопической структуры озера, косвенным подтверждением которой может быть постоянство основных морфометрических параметров озера, оцененных разными авторами и в разные годы (табл. 1).
На фоне малой изменчивости во времени относительного видового богатства галофилов разнообразие олигогалобов за 10 лет выросло в 2.5 раза, значимость индифферентов и галофобов снизилась в 1.06 и в 2.5 раза соответственно). Такие изменения могут быть связаны с постепенным ростом минерализации и эвтрофирования водных масс озера. Анализ индикаторных видов по отношению к рН водных масс показал, что доля индифферентов – наиболее многочисленной по составу группы водорослей планктона озера – имела тенденцию к слабому возрастанию (в 1.2 раза), алкалифилов, наоборот, к снижению (в 1.16 разa) на фоне более заметного уменьшения доли ацидобионтов (в 3.7 раз). За десять лет заметно (в 1.44 раза) увеличилось относительное видовое богатство водорослей, развивающихся в водах с более высокой, чем β-мезосапробной степенью загрязнения вод органическими соединениями. Эта тенденция, несомненно, определялась постепенным ростом эвтрофирования и загрязнения вод пелагиали легко окисляемым органическим веществом, в основном, планктоногенного происхождения.
Состав доминант в начале века был сформирован главным образом крупными жгутиковыми формами с незначительными показателями обилия в подледный период и возрастанием биомассы весной (золотистые, вольвоксовые) и особенно летом за счет развития динофлагеллят (Ceratium, Peridinium). Десятилетием позже он стал разнообразнее с заметным усилением ценотической роли трахеломонад зимой, динофитовых, диатомей и коккоидных зеленых весной, развитием цианобактерий и динофитовых летом, золотистых и эвгленовых осенью.
Устойчивая температурная стратификация способствовала постоянному направленному выносу биогенов в составе планктоногенного детрита с поверхности на дно и формированию мощных жидких органических отложений, толщина которых достигала 8 м (Енгалычев, 2009а, 2009b). Наличие хорошо развитой системы фильтраторов в составе метазойного планктона (Баянов, Макеев, 2016; Кузнецова и др., 2017) способствовало селективному преимуществу крупноклеточных и колониальных форм в альгоценозах и снижению их биомассы. Это сдерживало развитие фитопланктона на уровне слабо продуктивных водоемов и заметного «цветения» воды, как правило, не отмечалось. Усиление рекреационного использования озера (интенсивный туризм и паломничество), особенно в жаркий 2010 г. (до 100 тыс. человек за летний сезон) (Баянов, Ананьев, 2015) постепенно привело к развитию процессов типичного антропогенного эвтрофирования за счет поступления фосфора и азота с площади водосбора в водоем в период максимального его прогрева. Рост средних за безледный период температур (с 14.4 ± 3.5°С в 2000 г. до 18.1 ± 2.1°С в 2011г.) имел линейный характер (R2 = 0.66). Эти факторы, на фоне увеличения продолжительности и интенсивности солнечных дней в летний сезон 2010 г., способствовало формированию в поверхностных слоях водоема “цветения” воды диазотрофными цианобактериями Dolichospermum) и общей перестройке комплекса альгоценозов. Количественные показатели фитопланктона в целом и отдельных его групп были положительно связаны с температурой (численность (Rsp= 0.73), биомасса (Rsp= 0.53)), кроме эвгленовых, доля которых в численности и биомассе (Rsp= –0.67) усиливалась в более низкотемпературных условиях. При этом прозрачность за безледный период статистически значимо снижалась с 4.78 ± 0.63 м в 2000 г. до 3.38 ± 0.24 м в 2011 г. (U = 57). Прозрачность продемонстрировала слабую отрицательную связь с общей численностью фитопланктона (Rsp= –0.5) и развитием цианобактерий (Rsp= –0.42 (с численностью) и Rsp= –0.37 (с биомассой)), с данными 2010 г. эта связь проявлялась более четко.
Постепенное уменьшение размеров клеток водорослей (с 5880.34 ± 1672.9 мкм3 в 2000–2002 гг. до 2737.54 ± 418.6 мкм3 в 2010–2011 гг.) и увеличение суммарной фотосинтетической поверхности к биомассе при сохранении тенденции формирования жизненной формы крупных колониальных мелкоклеточных (сетный планктон, >64 мкм – цианобактерии, золотистые, ценобиальные хлорококковые) типично для антропогенного эвтрофирования (Reynolds, 2006).
При резком (в >40 раз) достоверном снижении (U = 302) среднеценотического объема клетки водорослей отмечался отчетливый рост внутригодовых изменений количественных показателей альгоценозов. Так, отношение максимальных значений численности к средним за 10 лет выросло в 2.8 раз, к минимальным – в 75 раз, аналогичные изменения в динамике биомассы были соответственно в 2.5 и 2.7 раза. Известно, что эти соотношения можно рассматривать как показатель стабильности функционирующих в водоемах сообществ, а их направленный рост свидетельствует о постепенной дестабилизации экологического равновесия из-за влияния эвтрофирования (Алимов, 2017).
Преобладание монадных представителей фитопланктона, осуществляющих заметные вертикальные миграции в пределах фотического слоя, косвенно свидетельствует о наличии высокой трофической базы (бактериопланктона, планктоногенного детрита, растворенного органического вещества) для водорослей-миксотрофов и фаготрофов и постепенного перехода характера пищевых цепей от пастбищных к детритным с усилением выноса органического углерода и биогенов в зону их депонирования.
Незначительная, по сравнению с другими глубокими озерами (Jasprica, Hafner, 2005; Ternjej et al., 2010; Udovič et al., 2017), роль диатомовых в формировании видового богатства и обилия фитопланктона (доля диатомей в средневегетационной биомассе была 4.64–30.42%), по всей видимости, также связана с четким разделением водной толщи на оксигенную и аноксигенную составляющие, выносом кремния, находящегося в составе панцирей Bacillariophyta, из трофогенного слоя на дно и незначительным его поступлением с водосбора. В летний сезон процессы биосилицификации могут сдерживаться в период цианобактериального “цветения” воды и возрастания в это время значений рН (Zepernick, 2021). Достаточно скромная роль диатомей как ценозообразователей и компонентов флористического разнообразия планктона известна для низкоцветных водных объектов с незначительной минерализацией (Лаврентьева, 1986; Гусев, 2007; Корнева, 2015). Кроме того, это может определяться неоптимальным для Bacillariophyta солевым и температурным режимами вод. В озере периоды перемешивания скоротечны (примерно две недели), прямая температурная стратификация устанавливается быстро и воды поверхностного слоя интенсивно прогреваются, т.е. нет протяженных для достижения заметных численности и биомассы Bacillariophyta периодов пониженной температуры (5–15°С) и турбуленции вод, характерных, например, для волжских водохранилищ, где диатомовые доминируют над остальными компонентами фитопланктона (Корнева, 2015).
Выводы. При относительно небольшом видовом богатстве (140–152 таксона) фитопланктона озера в отдельные периоды наблюдений отмечены его сильные межгодовые изменения, особенно заметные среди цианобактерий, зеленых, эвгленовых, харофитовых, динофитовых, охрофитовых и диатомовых. За первое десятилетие 21-го века в 1.33 раза возросло число таксонов с монадной организацией таллома – представителей с миксотрофным, в том числе и голозойным, типом питания (с 61 до 81), индикаторов высокой трофности и сапробности вод. Изменения экологических характеристик фитопланктона оказались менее выражены, особенно по типу местообитания и соотношению географических элементов флоры. Динамика показателей галобности, рН и сапробности водных масс отразила постепенные изменения этих индикационных свойств альгофлоры в связи с прогрессирующим антропогенным эвтрофированием. В составе фитопланктона оз. Светлояр отмечено семь видов водорослей, редко или единично встреченных в водоемах бассейна Чебоксарского водохранилища, что еще раз подтверждает его статус как охраняемого объекта. Усиление рекреационной нагрузки на пелагический комплекс озера и постепенное возрастание температуры поверхностных вод (с 14.4 до 18.1°С) привели к смене массовых видов и возрастанию численности, а в аномально жаркие годы и биомассы фитопланктона, и формированию интенсивного “цветения” воды диазотрофными цианобактериями. Трофический статус озера по средневегетационной биомассе оценивается как олиготрофный, в годы с антициклональным типом погоды – мезотрофный. Отмеченные негативные изменения состава и структуры фитопланктона озера служат основанием для ужесточения мероприятий по организации и ограничению туризма и паломничества на его водосборе и проведения дополнительных водоохранных мероприятий, которые позволят сохранить уникальный природный комплекс от общеизвестных катастрофических последствий.
Список литературы
Алимов А.Ф. 2017. Стабильность и устойчивость водных экосистем // Гидробиол. журн. Т. 53. № 1. С. 3.
Бакка С.В., Киселева Н.Ю. 2009. Особо охраняемые природные территории Нижегородской области. Аннотированный перечень. Нижний Новгород: Мин-во экологии и природных ресурсов Нижегородской обл.
Баянов Н.Г. 2008. Гидрохимические показатели оз. Светлояр и их межсезонная динамика // Известия Рос. гидробиол. общ-ва. Т. 140. Вып. 2. С. 28.
Баянов Н.Г., Ананьев П.Н. 2015. Температурный, кислородный режимы и динамика прозрачности вод озера Светлояр в 2010–2014 гг. // Тр. Гос. природ. биосф. заповедника “Керженский”. Т. 7. С. 60–75.
Баянов Н.Г., Макеев И.С. 2016. Межсезонная динамика массовых видов метазойного планктона озера Светлояр в 2000–2001 годах // Тр. Гос. природ. биосф. заповедника “Керженский”. Т. 8. С. 39.
Баянов Н.Г., Никишина В.И. 2005. Светлояр. По следам былых экспедиций. Нижний Новгород: Ком. охраны природы и упр. природопользованием Нижегородской. обл.
Баянов Н.Г., Юлова Г.А. 2001. К вопросу о происхождении и современном экологическом состоянии некоторых озер Нижегородского Заволжья // Вестник Нижегородского госуниверситета им. Н.И. Лобачевского. Сер. Биология. Нижний Новгород. Вып. 1(2). С. 91.
Баянов Н.Г., Макеев И.С., Воденеева Е.Л. 2009. Фитопланктон и продукционно-деструкционные процессы в озере Светлояр // Вест. Мордовского ун-та. Сер. Биол. науки. Саранск: Изд-во Мордовск. ун-та. № 1. С. 218.
Воденеева Е.Л. 2007. Динамика биомассы и доминирующие виды фитопланктона в водных объектах заповедника “Керженский” // Тр. Гос. природ. биосф. заповедника “Керженский”. Нижний Новгород. Т. 3. С. 172.
Воденеева Е.Л. 2008. Фитопланктон озера Светлояр // Водные экосистемы: трофические уровни и проблемы поддержания биоразнообразия. Матер. Всерос. конф. с международным участием “Водные и наземные экосистемы: проблемы и перспективы исследований”. Вологда. С. 26.
Воденеева Е.Л., Охапкин А.Г., Генкал С.И. и др. 2020. Состав, структура и распределение фитопланктона высокоминерализованного карстового озера // Биол. внутр. вод. № 6. С. 573. https://doi.org/10.31857/S0320965220050150
Воденеева Е.Л., Шарагина Е.М., Кулизин П.В. и др. 2021. Суточная динамика летнего фитопланктона оз. Светлояр (Нижегородская область) // Вопросы современной альгологии. № 1(25). С. 25. URL: http://algology.ru/1636. https://doi.org/10.33624/2311-0147-2021-1(25)-25-31
Горохова О.Г., Паутова В.Н. 2009. Фитопланктон слабоминерализованных карстовых озер юга лесостепного Поволжья // Известия Самарского научного центра РАН. № 14. С. 671.
Гусев Е.С. 2007. Особенности структуры и функционирования фитопланктона стратифицированных озер карстового происхождения центральной России (Владимирская область): Автореф. дис. …канд. биол. наук. Борок.
Гусев Е.С. 2011. Вертикальное распределение фитопланктона в небольших карстовых озерах центральной России // Водоросли: таксономия, экология, использование в мониторинге. Екатеринбург: Уральское отделение РАН. С. 160.
Енгалычев С.Ю. 2009а. Озеро Светлояр – голоценовый метеоритный кратер на Востоке Нижегородской области // Региональная геология и металлогения. № 37. С. 40.
Енгалычев С.Ю. 2009б. “Светлояр” – новая импактная структура на территории Европейской России // Разведка и охрана недр. № 8. С. 3. ISSN № 034-26Х.
Есырeва В.И., Юлова Г.А. 1977. Современное состояние альгофлоры Пустынских озeр // Охрана природы Горьковской области и рациональное использование еe ресурсов. Горький. С. 44.
Козлов А.В., Маркова Д.С., Соколюк С.А., Тогузов В.И. 2019. Экспертиза эколого-гидрохимического состояния памятника природы – озера Светлояр Нижегородской обл. // Успехи соврем. естествознания. № 6. С. 74.
Корнева Л.Г. 2015. Фитопланктон водохранилищ бассейна Волги. Кострома: Костромской печатный дом.
Корнева Л.Г. 2000. Разнообразие и структура фитопланктона некоторых слабоминерализованных лесных озер Вологодской области // Гидробиол. вопросы. Якутск: Изд-во Якутск. ун-та. Ч. 2. С. 94.
Корнева Л.Г., Гусаков В.А., Гусев Е.С. и др. 2004. К вопросу об экологической характеристике слабоминерализованных карстовых озер Центральной России (Владимирская область) // Природное наследие России: изучение, мониторинг, охрана: Матер. междунар. конф. Тольятти: Ин-т экологии Волжск. бассейна РАН. С. 138–139.
Кузнецова М.А., Баженова Л.В., Баянов Н.Г. 2017. Динамика развития, продукция массовых видов и структурные характеристики пелагического зоопланктона озера Светлояр в летний период 2002–2003 годов // Гидробиологическая станция на Глубоком озере: Труды. Москва: Тов-во науч. изданий КМК. Т. 11. С. 76.
Лаврентьева Г.М. 1986. Фитопланктон малых удобряемых озер. Москва: Агропромиздат.
Методика изучения биогеоценозов внутренних водоемов. 1975. Москва: Наука.
Науменко М.А., Гузиватый В.В., Сапелко Т.В. 2014. Цифровые морфометрические модели малых озер // Уч. зап. Российского гос. гидрометеорол. ун-та. № 34. С. 26.
Озера Среднего Поволжья. 1976. Ленинград: Изд-во “Наука”.
Охапкин А.Г. 1981. Фитопланктон системы Пустынских озер Горьковской обл. // Биологические основы повышения продуктивности и охраны растительных сообществ Поволжья. Горький: Издание Горьковского гос. ун-та. С. 106.
Охапкин А.Г., Воденеева Е.Л., Юлова Г.А. 2004. Фитопланктон водоемов заповедника “Керженский” (Нижегородская область) // Ботан. журн. Т. 89. № 8. С. 1264.
Палагушкина О.В. 2004. Экология фитопланктона карстовых озер Среднего Поволжья. Автореф. дис. … канд. биол. наук. Казань. 25 с.
Тарасова Н.Г. 2010. Состав альгофлоры планктона озера Голубое Самарская обл. // Самарская Лука: проблемы региональной и глобальной экологии. Т. 19. № 2. С. 157.
Трифонова И.С. 1990. Экология и сукцессия озерного фитопланктона. Ленинград: Наука.
Уникальные экосистемы солоновато-водных карстовых озер Среднего Поволжья. 2001. Казань: Изд-во Казанского ун-та.
Шитиков В.К., Розенберг Г.С., Зинченко Т.Д. 2003. Количественная гидроэкология: методы системной идентификации. Тольятти: Ин-т экологии Волжск. бассейна РАН.
Юлова Г.А. 2001. Водоросли водоемов Керженского заповедника // Тр. Гос. природ. заповедника “Керженский”. Нижний Новгород. Т. 1. С. 172‒213.
Genkal S.I., Okhapkin А.G., Vodeneeva Е.L. 2019. On the morphology and taxonomy of Cyclotella distinguenda Bacillariophyta // Новости систематики низших растений Novosti sistematiki nizshikh rastenii. V. 53. № 2. P. 247. https://doi.org/10.31111/nsnr/2019.532.247
Gusev E.S. 2008a. Photosynthetic pigments of plankton in some karst lakes of central Russia // Inland Water Biology. V. 1. № 3. 217. https://doi.org/10.1134/S1995082908030048
Gusev, E.S. 2008b. Phytoplankton primary production in several karst lakes in central Russia Ю// Inland Water Biology. V. 1. P. 356. https://doi.org/10.1134/S199508290804007X
Jasprica N., Hafner D. 2005. Taxonomic composition and seasonality of diatoms in three Dinaric karstic lakes in Croatia // Limnologica. V. 35. P. 304.
Kalytyte D., Zvikas A., Paskauskas R. 2002. Spatial and temporal changes of microplankton structure in North Lithuanian karst lakes // Botanica Lithuanica. V. 8. № 4. P. 333.
Reynolds C.S. 2006. Ecology of Phytoplankton. Cambridge, UK: Cambridge Univ. Press. 535 p.
Ternjej I., Plenkoviĉ-Moraj A., Mihalieviĉ Z., Kerovec M. 2010. Spatial and temporal variation of plankton in a Mediterranean karstic lake // Ekológia (Bratislava). V. 29. № 1. P. 65. https://doi.org/10.4149/ekol_2010_01_65
Udovič M.G., Cvetkoska A., Žutinić P. et al. 2017. Defining centric diatoms of most relevant phytoplankton functional groups in deep karst lakes // Hydrobiologia. V. 788. № 1. P. 169. https://doi.org/10.1007/s10750-016-2996-z
Zepernick B.N., Gann E.R., Martin R.M. et al. 2021. Elevated pH conditions associated with Microcystis spp. blooms decrease viability of the cultured diatom Fragilaria crotonensis and natural diatoms in lake Erie // Front. Microbiol. V. 12. 598736. https://doi.org/10.3389/fmicb.2021.598736
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод