Биология внутренних вод, 2022, № 6, стр. 640-651
Абиотические факторы и их роль в развитии фитопланктона водохранилищ Средней Волги
Н. М. Минеева a, *, С. А. Поддубный a, И. Э. Степанова a, А. И. Цветков a
a Институт биологии внутренних вод им. И.Д. Папанина Российской академии наук
пос. Борок, Некоузский р-н, Ярославская обл., Россия
* E-mail: mineeva@ibiw.ru
Поступила в редакцию 22.08.2021
После доработки 19.04.2022
Принята к публикации 21.04.2022
- EDN: DFTPPD
- DOI: 10.31857/S0320965222060158
Аннотация
По данным полевых наблюдений в летний период 2015–2020 гг. рассмотрена межгодовая и многолетняя изменчивость абиотических характеристик и содержания хлорофилла в водохранилищах Средней Волги. Выявлено увеличение прозрачности воды от 1.2 ± 0.1 м в Горьковском водохранилище до 1.5 ± 0.1 м в Куйбышевском, электропроводности – c 206 ± 2 до 315 ± 7 мкСм/см и снижение цветности c 53 ± 1 до 38 ± 1 град, отражающие зональные особенности волжского каскада. Температура воды зависит от локальных погодных условий. Концентрация Pобщ увеличивается c 68 ± 3 мкг/л в Горьковском водохранилище до 145 ± 7 мкг/л в Куйбышевском, концентрация Nобщ (1.08 ± 0.05– 1.14 ± 0.06 мг/л) изменяется незначительно. Содержание Хл а в Горьковском, Чебоксарском и Куйбышевском водохранилищах достигает в среднем 10.9 ± 0.7, 26.7 ± 3.9 и 9.2 ± 1.0 мкг/л соответственно, характеризуется широким диапазоном величин и их межгодовой изменчивостью. Трофический статус Горьковского и Куйбышевского водохранилищ в разные годы меняется от мезотрофного до умеренно эвтрофного и эвтрофного, Чебоксарское водохранилище на протяжении всего шестилетнего периода характеризуется как эвтрофное. Невысокие коэффициенты корреляции между содержанием Хл а и абиотическими характеристиками свидетельствуют о сложном и многокомпонентном влиянии внешних условий на развитие фитопланктона.
ВВЕДЕНИЕ
Пространственно-временная динамика биологических сообществ находится в тесной связи с условиями внешней среды, влияние которой по-разному проявляется в водоемах разного типа. Изучение взаимосвязи биотических и абиотических факторов, необходимое для характеристики состояния водоемов, формирования их биологической продуктивности и изменения трофического статуса, становится особенно актуальным в период климатических изменений (Второй…, 2014), затронувших водные экосистемы мира (Adrian et al., 2009; Bertani et al., 2016; Özkan et al., 2016).
В комплексную оценку состояния водных экосистем входит обязательное изучение автотрофного звена. В крупных озерах и водохранилищах, в том числе и водохранилищах р. Волги, водоросли планктона продуцируют основной фонд автохтонного органического вещества, выполняя индикаторную и средообразующую функции (Романенко, 1985; Минеева, 2009). К приоритетным показателям развития и функционирования фитопланктона относится содержание основного пигмента зеленых растений Хл а – универсального эколого-функционального маркера, позволяющего оценивать также трофический статус водоема и качество воды (Китаев, 2007).
Для анализа и прогноза изменений, происходящих в биологических сообществах, необходимы регулярные наблюдения, которыми охвачены многие водоемы мира (Ruggiu et al., 1998; Kangur et al., 2002; Chen et al., 2003; Babanazarova, Lyashenko, 2007; Canfield et al., 2018; Lamont et al., 2019; Gao et al., 2020 и др.). На водохранилищах Средней Волги ведутся многолетние экологические исследования гидрологического и гидрохимического режима, а также продуктивности фитопланктона, в том числе – фотосинтетических пигментов (Охапкин, 1994; Паутова, Номоконова, 1994; Охапкин и др., 1997; Экология…, 1989; Минеева, 2004; Куйбышевское…, 2008). Полученные материалы дают представление о состоянии и развитии экосистем, демонстрируя стабильный трофический статус Чебоксарского водохранилища и его межгодовые изменения в Горьковском и Куйбышевском. Однако исследования связи продуктивности фитопланктона водохранилищ с абиотическими факторами единичны (Минеева, 2004; Минеева, и др., 2008; Копылов и др., 2020). В последние годы в ходе комплексных волжских экспедиций Института биологии внутренних вод РАН получены новые данные, которые дополняют наблюдения предыдущих лет и лежат в основе многолетнего мониторинга экосистем крупных искусственных водоемов.
Цель работы – анализ связи содержания Хл а с факторами среды в водохранилищах Средней Волги в современных условиях глобальных климатических изменений.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Материал собирали в августе 2015–2020 гг. на 13 станциях Горьковского, 9 станциях Чебоксарского и 14 станциях Куйбышевского водохранилищ, большинство которых расположено по руслу р. Волги (рис. 1). Хл а определяли стандартным спектрофотометрическим методом (SCOR-UNESCO, 1966) в пробах воды, отобранных батометром длиной 1 м интегрировано от поверхности до дна. Прозрачность воды измеряли диском Секки, цветность – по стандартной хром-кобальтовой шкале. Температуру и электропроводность определяли с помощью многопараметрического зонда YSI ProPlus (YSI Inc., USA, 2016) по всей водной толще от поверхности до дна с шагом 1 м. Содержание БЭ определяли в пробах воды из верхнего 0.5-метрового слоя, согласно методикам в работе (Минеева и др., 2021). Данные по притоку в водохранилища взяты с сайта11, по температуре воздуха и количеству осадков – из архива погоды https://rp5.ru/. Средние многолетние климатические, гидрофизические и гидрохимические характеристики водохранилищ приведены по материалам работ (Охапкин, 1994; Охапкин и др., 1997; Куйбышевское…, 2008).
Для статистической обработки данных (дисперсионного, регрессионного, парного и множественного корреляционного анализов), а также построения графиков использовали стандартные компьютерные программы. Вариабельность признаков оценивали с помощью Cv, значения которого <0.3, 0.3–0.7 и >0.7 отражали соответственно слабую, умеренную или сильную степень изменчивости. При сравнении малых выборок (n < 30) использовали коэффициент ранговой корреляции Спирмена.
Горьковское, Чебоксарское и Куйбышевское водохранилища, общая протяженность которых ~1280 км (от 58°03′ с.ш., 38°50′ в.д. до 53°31′ с.ш., 49°25′ в.д), занимают внутрикаскадное положение, относятся к очень крупным неглубоким проточным водоемам (площадь зеркала соответственно 1591, 1270 и 6150 км2, объем 8.70, 12.60 и 57.30 км3, средняя глубина 5.5, 4.7, 9.3 м, коэффициент условного водообмена 6.1, 20.9 и 4.2 год–1) (Авакян и др., 1987). Горьковское водохранилище и левый берег Чебоксарского расположены в подзоне южной тайги в условиях избыточной увлажненности, правый берег Чебоксарского и верхняя часть Куйбышевского водохранилища − в подзоне смешанных хвойных и широколиственных лесов, основная акватории последнего южнее г. Казань – в лесостепной зоне (Гидрометеорологический…, 1975, 1978; Волга…, 1978).
Среднегодовой объем притока в Горьковском водохранилище равен 55.4 км3 и на 70–90% сформирован волжскими водами, поступающими из вышележащего Рыбинского водохранилища. В Чебоксарском водохранилище ~44% притока, общий объем которого 119 км3, приходится на сток р. Волги, 40% – р. Оки и 13.5% – рек Ветлуга и Сура. Более минерализованный окский поток, не смешивающийся с волжским, прижат к правому берегу и прослеживается на большом протяжении ниже устья р. Оки. В Куйбышевском водохранилище при среднем объеме притока 254 км3 сток р. Камы составляет 41.2% и близок к волжскому (45.5%). Средняя за многолетний период температура воды в июле–августе в Горьковском, Чебоксарском и Куйбышевском водохранилищах достигает соответственно 19.7, 18.5–19.5 и 20.6°С (Гидрометеорологический…, 1978; Литвинов, Законнова, 1994; Охапкин, 1994; Охапкин и др., 1997; Куйбышевское…, 2008). Водохранилища расположены в густонаселенных промышленных регионах Европейской России и испытывают значительную антропогенную нагрузку (Rivers…, 2021).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Шестилетний период наблюдения в многолетнем ряду в целом характеризовался как теплый, однако региональные климатические условия определили межгодовые погодные различия. В бассейне Средней Волги температура воздуха летом была выше средней многолетней в 2016 и 2018 гг. и ниже этого показателя в 2019 г. для всего региона, а в 2017 г. – для района Горьковского водохранилища (пункт г. Кострома). Локальное количество осадков за летние месяцы и вегетационный сезон (май–октябрь) в 2015–2017, 2019, 2020 гг. превышало норму в 1.2–1.9 раза и составляло 62–85% нормы в 2018 г. Годы исследования характеризовались различной водностью. Объем притока в мае–октябре был ниже среднего многолетнего (65–84% нормы) для Горьковского водохранилища в 2015 г., Чебоксарского в 2015 и 2019 гг., Куйбышевского – в 2019 г., на 25–30% превышал норму в 2017 и 2020 гг. в Горьковском водохранилище, в 2017 г. – в Куйбышевском и был близок к средним показателям в остальные сроки.
В годы с различными погодными условиями в водохранилищах выявлены различия гидрологических и гидрохимических характеристик. Средняя температура воды в августе 2015, 2019 и 2020 гг. (18.3–18.6°С) была ниже многолетних показателей и существенно ниже, чем в 2016–2018 гг. (21.2–23.2°С). При близких предельных значениях и невысокой изменчивости в каждом водохранилище (табл. 1) ход температуры на всем исследованном участке в годы наблюдения различен. В 2015 и 2018 гг. температура мало менялась в трех водохранилищах; в 2016, 2017 гг. возрастала, а в 2020 г. снижалась вниз по течению; в 2019 г. увеличивалась от Горьковского водохранилища к Чебоксарскому и снижалась в Куйбышевском. Межгодовые различия нарушают осредненный температурный ход, для которого получен невысокий R2 (рис. 2а).
Таблица 1.
Содержание хлорофилла и абиотические характеристики водохранилищ Средней Волги за шестилетний период исследований
| Показатель | Горьковское (n = 78) |
Чебоксарское (n = 61) |
Куйбышевское (n = 82) |
||||||
|---|---|---|---|---|---|---|---|---|---|
| min–max | М ± SE | Cv | min–max | М ± SE | Cv | min–max | М ± SE | Cv | |
| Хлорофилл, мкг/л | 3.2–25.8 | 10.9 ± 0.7 | 53 | 3.2–155 | 26.7 ± 3.9 | 113 | 2.1–59.0 | 9.2 ± 1.0 | 101 |
| Температура, °С | 16.5–24.0 | 20.3 ± 0.2 | 10 | 16.5–24.4 | 20.5 ± 0.3 | 10 | 16.9–25.4 | 20.5 ± 0.3 | 12 |
| Прозрачность, м | 0.2–1.8 | 1.2 ± 0.1 | 25 | 0.4–2.2 | 1.2 ± 0.1 | 32 | 0.5–3.0 | 1.5 ± 0.1 | 30 |
| Цветность, град | 35–80 | 53 ± 1.0 | 22 | 20–75 | 42 ± 2.0 | 34 | 20–60 | 38 ± 1.0 | 23 |
| Электропроводность, мкСм/см | 181–269 | 206 ± 2.0 | 7 | 177–930 | 355 ± 25.0 | 53 | 247–736 | 315 ± 7.0 | 20 |
| N-N${\text{O}}_{3}^{ - }$, мг/л | 0.00–0.20 | 0.06 ± 0.01 | 68 | 0.00–0.17 | 0.08 ± 0.01 | 56 | 0.01–0.24 | 0.09 ± 0.01 | 64 |
| Nобщ, мг/л | 0.20–2.99 | 1.09 ± 0.05 | 40 | 0.62–3.35 | 1.14 ± 0.06 | 35 | 0.40–3.28 | 1.08 ± 0.05 | 38 |
| P-P${\text{O}}_{4}^{{3 - }}$, мкг/л | 12–71 | 35 ± 1.0 | 34 | 24–176 | 87 ± 5.0 | 38 | 30–342 | 107 ± 5.0 | 38 |
| Pобщ, мкг/л | 26–195 | 68 ± 3.0 | 39 | 47–270 | 124 ± 6.0 | 36 | 54–460 | 145 ± 7.0 | 38 |
| Nобщ/Pобщ | 4–43 | 17 ± 1.0 | 40 | 3–24 | 10 ± 1.0 | 47 | 3–35 | 8 ± 1.0 | 52 |
Рис. 2.
Изменение температуры воды (T) (a), прозрачности (Пр) (б), цветности (Цв) (в) и электропроводности (Эл) (г) в водохранилищах Средней Волги в годы исследования. Сплошная линия – линия тренда для осредненного за 2015–2020 гг. показателя.
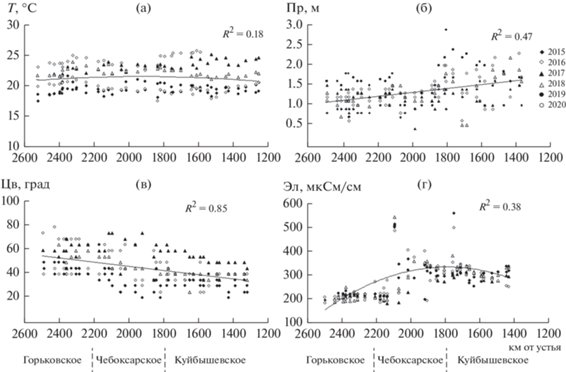
Прозрачность воды увеличивалась от 1.2 м в Горьковском водохранилище до 1.5 м в Куйбышевском. Четкий линейный тренд прозрачности выявлен для отдельных лет и при осреднении данных за весь период исследования. Цветность воды монотонно снижалась от Горьковского водохранилища к Куйбышевскому, изменяясь в среднем от <40 град в 2015, 2016 и 2019 гг. до >50 град в 2017 и 2020 гг. Электропроводность, средние величины которой достигали 250–290 мкСм/см, резко возрастала в Чебоксарском водохранилище за счет поступления высокоминерализованных окских вод и незначительно снижалась в Куйбышевском, куда поступает второй крупнейший волжский приток – р. Кама (рис. 2б–2г). Величины Cv были 10–12% для температуры воды, не превышали 34% для прозрачности и цветности, а в Горьковском и Куйбышевском водохранилищах – для электропроводности, более изменчивой в Чебоксарском (табл. 1).
Основные биогенные элементы по-разному распределялись в водохранилищах Средней Волги. Количество Nобщ сохранялось на относительно стабильном уровне – в среднем для всего участка 1.1–1.3 мг/л. При близких средних показателях верхний предел Nобщ увеличивался в Чебоксарском и Куйбышевском водохранилищах. Единичные подъемы Nобщ > 2 мг/л отмечены в Горьковском водохранилище (табл. 1, рис. 3а). Среднее для всего участка содержание Pобщ менялось от 80 мкг/л в 2016 и 2019 гг. до ~120 мкг/л в 2015, 2017 и 2018 гг. В Чебоксарском и Куйбышевском водохранилищах оно в 1.8 и 2.1 раза превышало таковое в Горьковском (табл. 1). В 2018 и 2019 гг. содержание Pобщ линейно от Горьковского водохранилища увеличивалось к Куйбышевскому, в остальные годы отмечен его значительный рост в Чебоксарском водохранилище по сравнению с Горьковским, и затем небольшое снижение в Куйбышевском (рис. 3б). Локальный подъем Pобщ зафиксирован ниже впадения крупных и средних притоков – рек Ока, Кама, Ветлуга, Сура, Свияга. Отношение Nобщ/Pобщ (по массе) во всех водохранилищах характеризовалось сходным широким диапазоном, но средние для отдельных лет величины снижались от 12–23 в Горьковском водохранилище до 8–13 в Чебоксарском и 6–11 в Куйбышевском. Вклад N-N${\text{O}}_{3}^{ - }$ в фонд Nобщ не превышал 6–8%, средняя доля P-P${\text{O}}_{4}^{{3 - }}$ достигала ~50% Робщ в Горьковском водохранилище и 70–74% в Чебоксарском и Куйбышевском. Судя по величинам Cv (34–68%), содержание общих и минеральных форм биогенов во всех водохранилищах характеризуется умеренной изменчивостью (табл. 1).
Рис. 3.
Содержание Nобщ (а), Pобщ (б) и хлорофилла (в) в водохранилищах Средней Волги в годы исследования. Сплошная линия – линия тренда для осредненного за 2015–2020 гг. показателя.
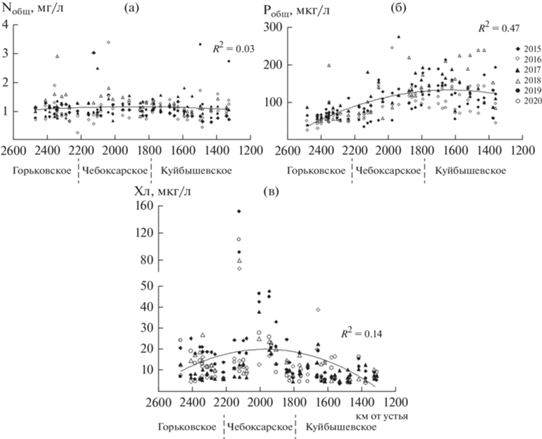
Результаты дисперсионного анализа свидетельствуют о значимых различиях температуры, а также цветности, содержания N-N${\text{O}}_{3}^{ - }$ и Pобщ в годы наблюдения в каждом из трех водохранилищ (F > Fкр). Межгодовые изменения прозрачности и содержания Nобщ не выявлены в Чебоксарском водохранилище, электропроводности – в Чебоксарском и Куйбышевском, содержания P-P${\text{O}}_{4}^{{3 - }}$ – в Куйбышевском (F < Fкр) (табл. 2).
Таблица 2.
Межгодовые различия содержания хлорофилла и абиотических характеристик в водохранилищах Средней Волги с помощью однофакторного дисперсионного анализа ANOVA
| Показатель | Горьковское | Чебоксарское | Куйбышевское | |||
|---|---|---|---|---|---|---|
| F | p | F | p | F | p | |
| Хлорофилл | 13.5 | 0.00 | 0.59 | 0.71 | 1.41 | 0.23 |
| Температура | 52.10 | 0.00 | 111.00 | 0.00 | 202.00 | 0.00 |
| Прозрачность | 13.40 | 0.00 | 1.52 | 0.20 | 8.58 | 0.00 |
| Цветность | 80.30 | 0.00 | 28.50 | 0.00 | 38.00 | 0.00 |
| Электропроводность | 2.96 | 0.02 | 1.01 | 0.42 | 1.75 | 0.13 |
| N-N${\text{O}}_{3}^{ - }$ | 7.44 | 0.00 | 7.92 | 0.00 | 17.10 | 0.00 |
| Nобщ | 2.71 | 0.04 | 0.55 | 0.70 | 2.43 | 0.06 |
| P-P${\text{O}}_{4}^{{3 - }}$ | 4.05 | 0.01 | 7.75 | 0.00 | 1.68 | 0.16 |
| Pобщ | 2.86 | 0.03 | 3.61 | 0.01 | 5.20 | 0.00 |
| Nобщ/Pобщ | 5.27 | 0.00 | 3.06 | 0.03 | 4.14 | 0.00 |
Концентрация Хл а в каждом водохранилище изменялась в широком диапазоне (табл. 1). При этом, судя по величинам Cv, изменчивость Хл а была умеренной в Горьковском водохранилище и высокой в двух других (Cv 53% и >100%, соответственно). В каждом водохранилище выявлены межгодовые различия Хл a, однако по результатам дисперсионного анализа (табл. 2) они значимы в Горьковском водохранилище, но не существенны в Чебоксарском и Куйбышевском. Самая высокая средняя величина в Горьковском водохранилище (18.4 мкг/л) получена в 2015 г., в Чебоксарском – в 2019 г. (44.0 мкг/л), в Куйбышевском – в 2016 г. (14.8 мкг/л) (рис. 4).
Рис. 4.
Содержание хлорофилла (мкг/л) в Горьковском (a), Чебоксарском (б) и Куйбышевском (в) водохранилище в годы исследования. Даны средние величины со стандартной ошибкой.
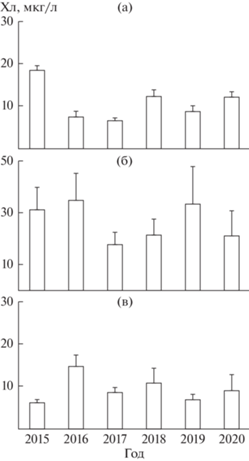
Распределение фитопланктона по акватории каждого водохранилища в годы наблюдения не менялось. Подъем Хл a, как правило, отмечен в мелководном Костромском расширении Горьковского водохранилища и повсеместно – ниже впадения притоков. Максимум Хл a постоянно фиксируется в устьевом участке р. Оки и в окской водной массе Чебоксарского водохранилища. В целом, на протяжении всего периода исследований наблюдали увеличение Хл а в Чебоксарском водохранилище по сравнению с Горьковским, и снижение в Куйбышевском (рис. 3в). Трофический статус Горьковского водохранилища, оцененный по среднему содержанию Хл а, варьировал от эвтрофного в 2015 г. до мезотрофного в 2016, 2017 гг. и умеренно эвтрофного в 2018–2020 гг.; Куйбышевского – от умеренно эвтрофного в 2016, 2020 гг. до мезотрофного в остальные годы; Чебоксарское водохранилище оставалось эвтрофным на протяжении всего шестилетнего периода (рис. 4).
Теснота и направленность связи содержания Хл а с факторами среды изменялись в разные годы (рис. 5а–5е). Парный корреляционный анализ показал, что Хл а постоянно коррелирует с прозрачностью воды, в пяти случаях из шести – с электропроводностью, в двух случаях – с Nобщ (2018 и 2020 гг.) и Pобщ (2016 и 2018 гг.), в 2015 г. – с N-N${\text{O}}_{3}^{ - }$, в 2016 г. – с P-P${\text{O}}_{4}^{{3 - }}$, в 2020 г. – с отношением Nобщ/Pобщ. Теснота связи в основном умеренная (абсолютные значения r = 0.38–0.68) и только для Nобщ в 2020 г. – сильная (r = 0.75).
Рис. 5.
Коэффициенты корреляции Пирсона между содержанием хлорофилла и факторами среды для трех водохранилищ Средней Волги в годы исследования (2015–2020 гг. а–е соответственно) и для каждого водохранилища (ж – Горьковское, з – Чебоксарское, и – Куйбышевское) за указанный период, (r0.05 < 0.21). Факторы среды: T – температура, Пр – прозрачность; Цв – цветность; Эл – электропроводность.
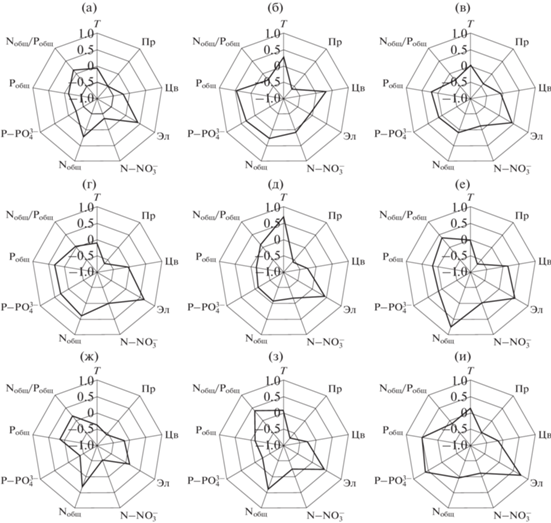
По совокупности шестилетних данных, связь содержания Хл а с абиотическими факторами в каждом водохранилище слабая или умеренная (r < 0.70), лишь в Куйбышевском водохранилище отмечена более тесная сопряженность Хл а с электропроводностью (r = 0.75). Во всех водохранилищах развитие фитопланктона (содержание Хл а) отрицательно связано с прозрачностью воды, в Горьковском водохранилище – отрицательно с температурой, содержанием N-N${\text{O}}_{3}^{ - }$ и P-P${\text{O}}_{4}^{{3 - }}$, положительно – с Nобщ. В Чебоксарском водохранилище выявлено самое большое количество достоверных связей: обратных с цветностью, содержанием N-N${\text{O}}_{3}^{ - }$ и P-P${\text{O}}_{4}^{{3 - }}$, прямых – с электропроводностью, Nобщ и Nобщ/Pобщ. В Куйбышевском водохранилище содержание Хл а положительно связано с электропроводностью, Pобщ и P-P${\text{O}}_{4}^{{3 - }}$ (рис. 5ж–5и).
Результаты множественного корреляционного анализа показывали, что совокупность рассмотренных абиотических параметров обусловливает высокую долю вариации Хл а в водохранилищах Средней Волги (R2 = 0.71–0.75). Из результатов пошаговой регрессии следует, что в число приоритетных факторов развития фитопланктона во всех водохранилищах входит прозрачность, в Горьковском водохранилище – также температура и содержание N-N${\text{O}}_{3}^{ - }$, в Чебоксарском – электропроводность, минеральные формы N и P, соотношение их общих форм; в Куйбышевском – цветность и электропроводность (табл. 3).
Таблица 3.
Связь хлорофилла с абиотическими факторами в водохранилищах Средней Волги
| Водохранилище | R2* | Приоритетные факторы** |
|---|---|---|
| Горьковское | 0.72 | Прозрачность (–0.59), N-N${\text{O}}_{3}^{ - }$ (–0.32), температура (–0.26) |
| Чебоксарское | 0.75 | Прозрачность (–0.72), Nобщ/Pобщ (0.46), электропроводность (0.46), P-P${\text{O}}_{4}^{{3 - }}$ (–0.35), N-N${\text{O}}_{3}^{ - }$ (0.35) |
| Куйбышевское | 0.71 | Электропроводность (0.72), прозрачность (–0.29) |
* Для совокупности факторов, приведенных в табл. 1.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Бассейн Средней Волги расположен в разных географических зонах, что определяет специфику климатических условий, водосборной площади водохранилищ и возможность проследить влияние зональных, азональных и региональных факторов на формирование их режима и элементы экосистемы. При большой протяженности и сложной морфометрии водохранилищ абиотические характеристики, от которых зависит развитие и распределение гидробионтов, изменчивы во времени и пространстве. Региональные погодные особенности лет наблюдения обусловливают межгодовые температурные различия и нарушают общий температурный ход, который можно было бы ожидать при географической зональности в каскаде по мере продвижения с севера на юг. Температура в данном случае выступает азональным фактором и определяется локальными условиями.
Прозрачность, цветность и электропроводность представлены типичными для водохранилищ величинами. Их динамика отражает зональные особенности волжского каскада, наглядно проявляющиеся при сравнении с аналогичными показателями на Верхней Волге (Минеева и др., 2021). Четкий линейный тренд прослеживается для прозрачности воды, растущей с увеличением глубины водохранилищ, и для цветности, уменьшающейся со снижением заболоченности водосборного бассейна (Гидрометеорологический…, 1975, 1978). Зависимость межгодовых изменений цветности от климатических условий (Pace, Cole, 2002) объясняет ее увеличение в дождливом 2017 г. за счет выноса с водосборной площади окрашенных органических веществ.
Сток р. Волги в основном формируется в лесной зоне при избыточной увлажненности и содержит относительно низкое количество солей. Рост электропроводности в Чебоксарском водохранилище обусловлен поступлением высокоминерализованных вод р. Оки, водосбор которой характеризуется залеганием карбонатных пород и наличием карста. Повышенная электропроводность присуща и другим правобережным притокам р. Волги (в частности, рекам Сура, Свияга). Верхняя часть Куйбышевского водохранилища принимает воды Чебоксарского водохранилища, а далее – р. Камы, сток которой формируется на Урале и тоже более минерализован, чем волжские воды. Колебания ионного стока в зависимости от водности года, а также от гидрологических и метеорологических условий на разных реках бассейна обусловливает межгодовые изменения электропроводности (Волга…, 1978).
Содержание биогенных веществ, которое относят к азональным факторам, в водохранилищах Средней Волги характеризуется высокими величинами, типичными для эвтрофных водоемов (Китаев, 2007). Оно более вариабельно, чем гидрологические показатели (табл. 1), особенно – содержание N-N${\text{O}}_{3}^{ - }$, потребляемого водорослями. Среднее количество Nобщ в Чебоксарском и Куйбышевском водохранилищах сопоставимо с полученным во второй половине ХХ в., а в Горьковском оно повысилось. Среднее количество Pобщ осталось на прежнем уровне в Горьковском и Чебоксарском водохранилищах, но стало выше в Куйбышевском (Охапкин, 1994; Охапкин и др., 1997; Минеева, 2004; Куйбышевское, 2008). Содержание Nобщ в водохранилищах Средней Волги мало меняется по сравнение с водохранилищами Верхней Волги (Минеева и др., 2021), а количество Pобщ становится выше в Чебоксарском и Куйбышевском водохранилищах. Доля минеральных форм в общем фонде БЭ также увеличивается: незначительно для N-N${\text{O}}_{3}^{ - }$ (от 4 до 8%) и существенно для P-P${\text{O}}_{4}^{{3 - }}$ (48–70%). Увеличение содержания биогенных веществ обусловлено высокой антропогенной нагрузкой на экосистему водохранилищ, расположенных в густонаселенных промышленных регионах Европейской России (Rivers…, 2021). Отношение Nобщ/Pобщ служит не только показателем биогенного лимитирования фитопланктона (Sakamoto, 1966; Claesson, 1978), но и самостоятельным фактором, регулирующим развитие водорослей (Булгаков, Левич, 1995). Средняя величина Nобщ/Pобщ указывает на возможный дефицит фосфора в Горьковском водохранилище, дефицит азота в Куйбышевском и сбалансированное для развития фитопланктона соотношение этих элементов в Чебоксарском.
Развитие летних планктонных сообществ отражает состояние водоема, поскольку в условиях наибольшего прогрева проявляются негативные тенденции, вызванные эвтрофированием или изменениями климата. В период исследования содержание Хл a было типичным для летнего максимума фитопланктона Средней Волги. Оно характеризовалось широким диапазоном величин и их межгодовой изменчивостью, сохраняя особенности пространственного распределения по акватории отдельных водоемов, а также в масштабах всего каскада. На фоне незначительной изменчивости гидрологических условий в каждый период наблюдений и достаточной обеспеченности клеток минеральным питанием, неоднородность распределения фитопланктона по акватории водохранилищ (высокие величины Сv) обусловлена их морфометрическими особенностями и наличием разнородных водных масс. Повышенные концентрации Хл а, как и в других водохранилищах каскада (Минеева, 2004), отмечены на мелководных участках (Костромское расширение в Горьковском водохранилище), в устьях рек (Сура, Ветлуга, Свияга), в водах самих притоков, фитопланктон которых формируется в специфических условиях (Охапкин и др., 2013). Максимальным количеством Хл а, как и в предыдущие годы (Минеева, 2004; Минеева и др., 2008), характеризуется акватория в черте г. Нижний Новгород ниже впадения р. Оки. Согласно многолетним данным (Минеева, 2004), количество Хл а увеличивается в Чебоксарском водохранилище, по сравнению с Горьковским, и снижается в Куйбышевском. Развитие фитопланктона в трех водохранилищах, каждое из которых представляет собой уникальный водный объект со своими условиями, контролирующими биоту, чаще происходит независимо. Лишь в 2015 и 2018 гг., при близкой температуре воды содержание Хл а скоррелировано в сопредельных Горьковском и Чебоксарском, Чебоксарском и Куйбышевском водохранилищах (rs = 0.54–0.88, p < 0.05).
Межгодовые изменения условий формирования биологических сообществ определяют различия в развитии и состоянии альгоценозов, а также вариации трофического статуса водохранилищах. Последний меняется от мезотрофного до умеренно эвтрофного и эвтрофного в Горьковском и Куйбышевском водохранилищах, в Чебоксарском остается эвтрофным на протяжении не только последних шести лет, но и всего периода его существования (Минеева, 2004; Минеева и др., 2008). Межгодовые колебания трофии в зависимости от глобальных и региональных гидроклиматических факторов выявлены для водоемов разных регионов (Ruggiu et al., 1998; Kangur et al., 2002; Babanazarova, Lyashenko, 2007 и др.) и особенно наглядны на фоне многолетних наблюдений (Жукова, 2013; Минеева, 2016; Структура…, 2018).
Биота водохранилищ, водный режим которых регулируется не только погодными условиями и климатом, но и работой гидросооружений, испытывает комплексное внешнее воздействие, в том числе – неконтролируемое или неучтенное. Поэтому в водохранилищах Средней Волги отмечена лишь умеренная теснота связи Хл а с факторами среды, которая меняется в разные годы, а высокую долю вариации Хл а обусловливает разный набор абиотических показателей. Для фитопланктона основными факторами могут быть водность, гидроклиматический режим, внутриводоемные процессы, биогенные элементы, температура, подводный световой режим (Chen et al., 2003; Reynolds, 2006; Yang et al., 2016). Многокомпонентное и комплексное внешнее влияние зависит от морфометрии водоема, гидрологической структуры, биотопического разнообразия. Самое большое число достоверных связей Хл а с факторами среды получено для фитопланктона Чебоксарского водохранилища, в котором присутствуют водные массы с контрастными характеристиками, обусловленными пространственными изменениями физико-химических условий на водосборе. По-видимому, при максимальных для волжского каскада проточности и степени антропогенной нагрузки (Минеева, 2004) здесь формируется автотрофное сообщество, в значительной степени зависящее от внешнего влияния.
Современный период характеризуется продолжающимся повышением приземной температуры воздуха и температуры воды (Второй …, 2014). Повышение температуры влияет на доступность питательных веществ, способствует росту внутренней фосфорной нагрузки, эвтрофированию и развитию цианопрокариот, меняет конкурентные отношения между видами этого отдела (Jeppesen et al., 2005; Chu et al., 2007; Winder, Hunter, 2008). Увеличение обилия цианопрокариот и продолжительности их вегетации в настоящее время наблюдается и в волжских водохранилищах (Корнева, 2015; Минеева, 2016; Минеева и др., 2021). Из трех исследованных водохранилищ только в Горьковском выявлена связь Хл а с температурой, которая, как и в водохранилищах Верхней Волги, оказывает лишь умеренное влияние на фитопланктон, хотя и входит в число приоритетных факторов его развития. Водосбор Верхней Волги, водохранилища которой характеризуются высокой степенью сходства планктонных альгоценозов (Корнева, 2015), расположен в пределах лесной зоны с избыточной увлажненностью и относительно низким содержанием солей в воде водоемов. При изменении условий водосборного бассейна, для которого на Средней Волге характерно наличие горных пород, актуальным фактором развития фитопланктона становится электропроводность. Это наблюдается в более минерализованных Чебоксарском и Куйбышевском водохранилищах, фитопланктон которых имеет высокое флористическое сходство (Корнева, 2015).
Во всех водохранилищах содержание хлорофилла достоверно и отрицательно связано с прозрачностью воды. Это подтверждает заметную роль водорослевой взвеси в формировании подводного светового режима (Минеева, 2009), а также служит полезным инструментом при анализе спутниковых данных (Bohn et al., 2018). Поскольку хлорофилл относится к оптически активным компонентам водной среды, прозрачность снижается при избыточном развитии водорослей.
Волжские водохранилища характеризуются высоким содержанием БЭ, типичным для эвтрофных вод. Концентрации минеральных форм N и P превосходят порог, необходимый для развития водорослей (Reynolds, 2012). При небольшой вариабельности общих и минеральных форм БЭ в отдельные сроки наблюдения, фитопланктон на всей акватории водохранилищ в достаточной степени должен быть обеспечен минеральным питанием. Однако, в зависимости от наличия доступных форм N и P, световых условий (Torremorell et al., 2018), гидрологической фазы водности (Cardoso et al., 2017), связь Хл а с БЭ прослеживается не всегда и при невысоких значениях коэффициента корреляции. Обратная связь Хл а с минеральными формами N и P в Горьковском и Чебоксарском водохранилищах свидетельствует об их активном потреблении клетками водорослей, а прямая зависимость от P-P${\text{O}}_{4}^{{3 - }}$ в Куйбышевском водохранилище – о нехватке этого элемента, несмотря на соответствие величин Nобщ/Pобщ дефициту азота. Однако, это отношение не всегда точно отражает биогенное лимитирование, особенно при концентрациях Pобщ до 200 мкг/л (Seip et al., 2000), характерных для водохранилищ р. Волги. Тот факт, что по совокупности шестилетних данных в каждом водохранилище выявлена лишь умеренная связь содержания Хл а с абиотическими показателями, включая БЭ, свидетельствует о существенном влиянии на развитие фитопланктона других факторов: климата, гидрологических условий, динамики вод, интенсивности водообмена, особенностей водосборной территории.
Выводы. Бассейн Средней Волги представляет интерес как регион с меняющимися условиями водосборной территории при смене природных зон и характеризуется высокой антропогенной нагрузкой на экосистемы водохранилищ. Изменение прозрачности, цветности и электропроводности воды от Горьковского водохранилища к Куйбышевскому отражает зональные особенности волжского каскада. Температура воды и содержание биогенных веществ относятся к азональным факторам. Величины Nобщ/Pобщ указывают на возможный дефицит фосфора в Горьковском водохранилище, дефицит азота в Куйбышевском и сбалансированное для развития фитопланктона соотношение этих элементов в Чебоксарском. Содержание Хл а типично для летнего максимума фитопланктона Средней Волги, характеризуется широким диапазоном величин и их межгодовой изменчивостью. Трофический статус Горьковского и Куйбышевского водохранилищ, оцененный по среднему содержанию Хл а, в разные годы меняется от мезотрофного до умеренно эвтрофного и эвтрофного, а Чебоксарское водохранилище на протяжении всего периода существования относится к эвтрофному типу. Невысокие коэффициенты корреляции между содержанием Хл а и абиотическими характеристиками свидетельствуют о сложном и многокомпонентном влиянии внешних условий на развитие фитопланктона.
Список литературы
Авакян А.Б., Салтанкини В.П., Шарапов В.А. 1987. Водохранилища. Москва: Мысль.
Булгаков Н.Г., Левич А.П. 1995. Биогенные элементы в среде и фитопланктон: соотношение азота и фосфора как самостоятельный фактор регулирования структуры альгоценоза // Успехи совр. биол. Т. 115. № 1. С. 13.
Волга и ее жизнь. 1978. Ленинград: Наука.
Второй оценочный доклад Росгидромета об изменениях климата и их последствиях на территории Российской Федерации. Общее резюме. 2014. Москва: Росгидромет.
Гидрометеорологический режим озер и водохранилищ СССР. Водохранилища Верхней Волги. 1975. Ленинград: Гидрометеоиздат.
Гидрометеорологический режим озер и водохранилищ СССР. Куйбышевское и Саратовское водохранилища. 1978. Ленинград: Гидрометеоиздат.
Жукова Т.В. 2013. Многолетняя динамика фосфора в Нарочанских озерах и факторы, ее определяющие // Водные ресурсы. Т. 40. № 5. С. 468. https://doi.org/10.7868/S0321059613050088
Китаев С.П. 2007. Основы лимнологии для гидробиологов и ихтиологов. Петрозаводск: Карельский науч. центр РАН.
Копылов А.И., Лазарева В.И., Минеева Н.М., Заботкина Е.А. 2020. Планктонное сообщество крупного эвтрофного водохранилища в период аномально высокой температуры воды // Биология внутр. вод. № 4. С. 315. https://doi.org/10.31857/S0320965220040099
Корнева Л.Г. 2015. Фитопланктон водохранилищ бассейна Волги. Кострома: Костромской печатный дом.
Куйбышевское водохранилище (научно-информационный справочник). 2008. Тольятти: Ин-т экологии волжск. бассейна РАН.
Литвинов А.С., Законнова А.В. 1994. Характеристика гидрологических условий в Чебоксарском водохранилище в первые годы заполнения // Водные ресурсы. Т. 21. № 3. С. 365.
Минеева Н.М., Литвинов А.С., Степанова И.Э., Кочеткова М.Ю. 2008. Содержание хлорофилла и факторы его пространственного распределения в водохранилищах Средней Волги // Биология внутр. вод. № 1. С. 68.
Минеева Н.М., Степанова И.Э., Семадени И.В. 2021. Биогенные элементы и их роль в развитии фитопланктона водохранилищ Верхней Волги // Биология внутр. вод. № 1. С. 24. https://doi.org/10.31857/S0320965221010095
Минеева Н.М. 2004. Растительные пигменты в воде волжских водохранилищ. Москва: Наука.
Минеева Н.М. 2009. Первичная продукция планктона в водохранилищах Волги. Ярославль: Принтхаус.
Минеева Н.М. 2016. Сезонная и межгодовая динамика хлорофилла в планктоне Рыбинского водохранилища по данным флуоресцентной диагностики // Систематика, морфология и экология водных растений. Тр. Ин-та биол. внутр. вод им. И.Д. Папанина РАН. Вып. 76(79). Ярославль: Филигрань. С. 75.
Охапкин А.Г. 1994. Фитопланктон Волги. Фитопланктон Чебоксарского водохранилища. Тольятти: Ин-т экологии волжск. бассейна РАН.
Охапкин А.Г., Микульчик И.А., Корнева Л.Г., Минеева Н.М. 1997. Фитопланктон Волги. Фитопланктон Горьковского водохранилища. Тольятти: Ин-т экологии волжск. бассейна РАН.
Охапкин А.Г., Шарагина Е.М., Бондарев О.О. 2013. Фитопланктон Чебоксарского водохранилища на современном этапе его существования // Поволжский экол. журн. № 2. С. 190.
Паутова В.Н., Номоконова В.И. 1994. Продуктивность фитопланктона Куйбышевского водохранилища. Тольятти: Ин-т экологии волжск. бассейна РАН.
Романенко В.И. 1985. Микробиологические процессы продукции и деструкции органического вещества во внутренних водоемах. Ленинград: Наука.
Структура и функционированием экосистемы Рыбинского водохранилища в начале XXI века. 2018. Москва: РАН.
Экология фитопланктона Куйбышевского водохранилища. 1989. Ленинград: Наука.
Adrian R., O’Reilly C.M., Zagareze H. et al. 2009. Lakes as sentinels of climate change // Limnol., Oceanogr. V. 54. № 6. Pt 2. P. 2283.
Babanazarova O.V, Lyashenko O.A. 2007. Inferring long-term changes in the physical-chemical environment of the shallow, enriched Lake Nero from statistical and functional analyses of its phytoplankton // J. Plankton Research. V. 29. № 9. P. 747. https://doi.org/10.1093/plankt/fbm055
Bertani I., Primicerio R., Rossetti G. 2016. Extreme climatic event triggers a lake regime shift that propagates across multiple trophic levels // Ecosystems. V. 19. Is 1. P. 16. https://doi.org/10.1007/s10021-015-9914-5
Bohn V.Y., Carmona F., Rivas R. et al. 2018. Development of an empirical model for chlorophyll-a and Secchi disk depth estimation for a Pampean shallow lake (Argentina) // The Egyptian Journal of Remote Sensing and Space Sciences. V. 21. P. 183. https://doi.org/10.1016/j.ejrs.2017.04.005
Canfield D.E., Bachmann R.W., Hoyer M.V. 2018. Long-term chlorophyll trends in Florida lakes // J. Aquat. Plant Manage. V. 56. P. 47.
Cardoso S.J., Nabout J.C., Farjalla V.F. et al. 2017. Environmental factors driving phytoplankton taxonomic and functional diversity in Amazonian floodplain lakes // Hydrobiologia. V. 802. P. 115. https://doi.org/10.1007/s10750-017-3244-x
Chen Y., Qin B., Teubner K., Dokulil1 M.T. 2003. Long-term dynamics of phytoplankton assemblages: Microcystis domination in Lake Taihu, a large shallow lake in China // J. Plankton Research. V. 25. № 1. P. 445.
Chu Z., Jin X., Iwami N., Inamori Y. 2007. The effect of temperature on growth characteristics and competitions of Microcystis aeruginosa and Oscillatoria mougeotii in a shallow, eutrophic lake simulator system // Hydrobiologia. V. 581. P. 217. https://doi.org/10.1007/s10750-006-0506-4
Claesson A. 1978. Research on recovery of polluted lakes. Algal growth potential and the availability of limiting nutrients // Acta University Uppsala. № 461. P. 1.
Gao N., Ma Y., Zhao M. et al. 2020. Quantile analysis of long-term trends of near-surface chlorophyll-a in the Pearl River Plume // Water. V. 12. P. 1662. https://doi.org/10.3390/w12061662
Jeppesen E., Sondergaard M., Jensen J.P. et al. 2005. Lake responses to reduced nutrient loading – an analysis of contemporary long-term data from 35 case studies // Freshwater Biol. V. 50. № 9. P. 1747. https://doi.org/10.1111/j.1365-2427.2005.01415.x
Kangur K., Milius A., Mols T. et al. 2002. Lake Peipsi: Changes in nutrient elements and plankton communities in the last decade // Aquatic Ecosystem Health & Management. V. 5. № 3. P. 363. https://doi.org/10.1080/14634980290001913
Lamont T., Barlow R.G., Brewin R.J.W. 2019. Long-term trends in phytoplankton chlorophyll-a and size structure in the Benguela upwelling system // JGR Oceans. V. 124. № 2. P. 1170. https://doi.org/10.1029/2018JC014334
Özkan K., Jeppesen E., Davidson T.A. et al. 2016. Long-term trends and temporal synchrony in plankton richness, diversity and biomass driven by re-oligotrophication and climate across 17 Danish Lakes // Water. V. 8. № 10. P. 427. https://doi.org/10.3390/w8100427
Pace M.L., Cole J.J. 2002. Synchronous variation of dissolved organic carbon and color in lakes // Limnol., Oceanogr. V. 47. № 2. P. 333.
Rivers of Europe. 2021. 2nd Edition. Amsterdam: Elsevier.
Reynolds C.S. 2006. The Ecology of Phytoplankton. Cambridge: Cambridge University Press.
Reynolds C.S. 2012. Environmental requirements and habitat preferences of phytoplankton: chance and certainty in species selection // Botanica Marina. V. 55. № 1. P. 1. https://doi.org/10.1515/bot.2011.121
Ruggiu D., Morabito G., Panzani P., Pugnetti A. 1998. Trends and relations among basic phytoplankton characteristics in the course of the long-term oligotrophication of Lake Maggiore (Italy) // Hydrobiologia. V. 369/370. P. 243.
Sakamoto M. 1966. Primary production by phytoplankton community in some Japanese lakes and its dependence on lake depth // Arch. Hydrobiol. V. 62. № 1. P. 1. https://doi.org/10.1371/journal.pone.0095757
SCOR-UNESCO Working Group № 17. 1966. Determination of photosynthetic pigments in sea water // Monographs on Oceanographic Methodology. Montreux: UNESCO. P. 9.
Seip K.L., Jeppesen E., Jensen J.P., Faafeng B. 2000. Is trophic state or regional location the strongest determinant for Chl-a/TP relationships in lakes? // Aquat. Sci. V. 62. P. 195. https://doi.org/10.1007/PL00001331
Torremorell A.M., Dieguez C., Queimalinos C. et al. 2018. Phytoplankton limitation in Patagonian and Pampean shallow lakes: effect of phosphorus and light // Hydrobiologia. V. 816. P. 91. https://doi.org/10.1007/s10750-017-3181-8
Winder M., Hunter D.A. 2008. Temporal organization of phytoplankton communities linked to physical forcing // Oecologia. V. 156. P. 179. https://doi.org/10.1007/s00442-008-0964-7
Yang Y., Pettersson K., Padisák J. 2016. Repetitive baselines of phytoplankton succession in an unstably stratified temperate lake (Lake Erken, Sweden): a long-term analysis // Hydrobiologia. V. 764. Is 1. P. 211. https://doi.org/10.1007/s10750-015-2314-1
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод



