Ботанический журнал, 2019, T. 104, № 11-12, стр. 1777-1791
НОВЫЙ МЕТОД ВИЗУАЛИЗАЦИИ МИКРОСКУЛЬПТУРЫ ПОВЕРХНОСТИ ЛИСТЬЕВ И ПЛОДОВ
А. В. Бабоша 1, *, А. С. Рябченко 1, Т. Х. Кумахова 2, **
1 ФГБУН Главный ботанический сад имени Н.В. Цицина Российской академии наук
127276 Москва, ул. Ботаническая, д. 4, Россия
2 Российский государственный аграрный университет – МСХА имени К.А. Тимирязева
127550 Москва, Тимирязевская ул., 49, Россия
* E-mail: phimmunitet@yandex.ru
** E-mail: tkumachova@yandex.ru
Поступила в редакцию 29.08.2019
После доработки 12.11.2019
Принята к публикации 12.11.2019
Аннотация
Предложен простой вариант сканирующей электронной микроскопии замороженных нативных нефиксированных содержащих влагу образцов (криоСЭМ) с металлизацией поверхности при небольших отрицательных температурах. Образцы плодов яблони и груши, листьев яблони, а также листьев пшеницы, инфицированных возбудителем мучнистой росы, закрепляли на медной пластинке при помощи компьютерной термопасты, помещали на металлический держатель – накопитель холода – и охлаждали при температуре –20°С, затем напыляли золотом в камере для катодного напыления в среде аргона. Образцы исследовали в камере сканирующего электронного микроскопа, оборудованной охлаждающим столиком с температурой –25…–30°С, в условиях высокого вакуума. Предлагаемый метод дал наилучшие результаты по сравнению с напылением при комнатной температуре или без металлизации. Для изученных объектов металлизация расширила диапазон доступных для криоСЭМ максимальных увеличений с 1000× до 10 000×. Это позволило различить детали восковых и кутикулярных отложений, а также получить достаточно качественные изображения конидий и гиф на поверхности плодов и листьев.
Сканирующая электронная микроскопия (СЭМ), являющаяся основным методом исследования поверхности различных биологических объектов, позволяет получать изображения с большой глубиной фокусирования. Широкое использование сканирующей (растровой) электронной микроскопии началось после появления первых коммерчески доступных микроскопов в конце 1960-х годов (Gouldstein et al., 1978; Goldstein et al., 2003).
При электронной микроскопии для создания тестирующего пучка электронов и сбора частиц, несущих информацию об исследованном объекте, необходимы условия вакуума (10–5 mbar). Образец должен быть к ним устойчив, не повреждаться тестирующим пучком и не накапливать заряд. Поэтому идеальным объектом для СЭМ является металлическая поверхность, однако применение этого метода к биологическим объектам требует решения ряда задач. Ткани живых организмов, как правило, содержат влагу. В камере микроскопа при нагреве электронным зондом в вакууме она усиленно испаряется, что приводит к нарушению вакуума и деформации структуры объекта. Разновидности метода СЭМ в приложении к биологическим структурам различаются, прежде всего, способами подготовки препарата к микроскопии (Pathan et al., 2008). Можно заранее высушить биологические ткани. Если они имеют жесткую структуру, достаточно высушивания на воздухе. Если структура более хрупкая, высушивание проводят из замороженного состояния. Лабильные ткани после предварительного фиксирования обезвоживают в серии растворителей, погружают в промежуточную жидкость (например, жидкую углекислоту) с относительно низкой критической температурой и сушат в специальной камере при повышенном давлении, что обеспечивает наилучшую сохранность микроструктур (Bray, 2000). Однако высушенный любым способом биологический объект становится диэлектриком. Чтобы под действием пучка электронов он не накапливал заряд, проводят металлизацию поверхности путем напыления, как правило, золота или платины. Таким образом, подготовка тканей для микроскопии при выполнении всех описанных выше процедур достаточно сложная и длительная, поэтому не всегда дает уверенность в полной сохранности микроструктур и отсутствии артефактов.
Некоторые современные приборы позволяют исследовать содержащие влагу биологические образцы при относительно низком вакууме (менее 2600 Па) – сканирующая электронная микроскопия в естественной среде (Environmental Scanning Electron Microscope – ESEM) (Stokes, 2008). Она лучше соответствует естественным для живых тканей условиям, при этом скорость испарения снижается, что позволяет получить изображение прежде, чем произойдет необратимое разрушение. Влажный препарат обладает достаточно высокой электропроводностью и не накапливает заряд. Живые ткани в таких условиях иногда даже сохраняют свои физиологические функции, как это показано для устьиц традесканции (McGregor, Donald, 2010). За простоту и скорость подготовки препарата приходится платить снижением качества изображения, доступных увеличений и разрешающей способности.
Наконец, объект можно охладить или даже заморозить (cryoSEM, low-temperature scanning electron microscopy, LTSEM), что снижает испарение, позволяя получать изображения более высокого качества как в условиях низкого, так и высокого вакуума (Echlin, 1978; Beckett, Read, 1986; Wergin & Erbe, 1989; Read, Jeffree, 1991; Read, 1991; Neděla et al., 2015). Для охлаждения объекта камеру микроскопа оборудуют специальным охлаждающим столиком с элементом Пелтье. Критическим для этого метода является нагревание ткани пучком электронов. При неглубоком замораживании (‒20…–30°С) это может привести к повреждению препарата при больших увеличениях или длительном времени сканирования. Охлаждение до температуры –90…–160°С дает лучшие результаты. Наконец, наиболее высокое качество изображения и большие увеличения можно получить при сочетании замораживания с металлизацией (Wei et al., 2015; Yao et al., 2015). В этом случае тонкий слой металла, который напыляется в условиях вакуума на замороженный образец, не только предотвращает накопление заряда, но и обеспечивает быстрое отведение тепла. Очевидно, что для каждой из описанных выше разновидностей СЭМ необходимо достаточно дорогостоящее оборудование. В частности, для исследования замороженных образцов с металлизацией требуется специальный способ объединения нескольких устройств в едином комплексе, который обеспечивает низкотемпературное охлаждение, поддержание вакуума и напыление металлами с последующим перемещением металлизированного замороженного образца на охлаждающий столик в камере микроскопа без контакта с окружающей средой. Все это сильно ограничивает объем и разнообразие рутинных исследований.
Структура большого числа биологических объектов обладает большим запасом прочности и позволяет существенно упростить процедуру подготовки образца. Так, H.J. Ensikat и M. Weigend (2013) замораживали биологический объект в жидком азоте на массивном металлическом держателе, который служил накопителем холода, что позволяло несколько часов исследовать замороженный влагосодержащий объект в условиях высокого вакуума вообще без дополнительного охлаждения в камере микроскопа.
Ранее нами показано, что применение компьютерной термопроводящей пасты, которая улучшает охлаждение препарата, позволяет получать изображения хорошего качества при исследовании широкого круга содержащих влагу растительных объектов с замораживанием при достаточно высокой (–25…–30°С) температуре охлаждающего столика (Ryabchenko, Babosha, 2012). В настоящей работе исследована возможность дополнить данный метод напылением поверхности растительных тканей в замороженном состоянии металлами при относительно небольших отрицательных температурах и минимальном наборе необходимого оборудования.
МАТЕРИАЛЫ И МЕТОДЫ
Подготовку биологических препаратов для криоСЭМ проводили тремя способами:
1. В варианте без напыления металлами нативные содержащие влагу фрагменты растительного образца без предварительной фиксации наклеивали на медную пластинку 2 × 4 см на тонкий слой термопасты АлСил-3 либо КПТ-8 (Ryabchenko, Babosha, 2012). Затем пластинку с препаратами укрепляли на столике замораживающей приставки “Deben Coolstage” (Великобритания) путем притирания с небольшим количеством той же термопасты. Использование дополнительной металлической пластинки позволяет увеличить охлаждающую поверхность для изучения в одном сеансе большего числа образцов с минимальным снижением эффективности охлаждения. Кроме того, пластинка позволяет удобно перемещать образцы в камеру микроскопа или между различными приборами при необходимости дополнительной их обработки.
2. В варианте с металлизацией аналогично подготовленную медную пластинку с образцами с помощью термопасты прикрепляли к массивному (200 г) стальному держателю и охлаждали при –20°С в течение 1 ч. Пластинку с замороженным образцом и охлажденным держателем помещали в камеру для катодного напыления (Bal-Tec SCD 005, Balzers, Liechtenstein). Напыляли образец золотом в среде аргона (0.1–0.2 mbar) в течение 170 сек. Затем пластинку с металлизированным образцом (без держателя) закрепляли на предварительно охлажденном столике замораживающей приставки. Контакт охлажденного образца с влажным воздухом помещения должен быть минимальным, поэтому в процессе первичного замораживания вне камеры микроскопа и при последующих перемещениях образец помещали в защитный контейнер, который минимизировал конденсацию влаги на поверхности препарата.
3. Металлизацию нативных образцов проводили при комнатной температуре.
Объектами исследования были фрагменты толщиной 2–3 мм: перикарпий зрелых плодов яблони (Malus domestica Borkh.) и груши (Pyrus communis L.), абаксиальная и адаксиальная поверхность листьев яблони, спороносящие колонии мучнистой росы Blumeria graminis f. sp. tritici (formerly Erysiphe graminis f. sp. tritici) на листьях пшеницы Triticum aestivum L. сорта Заря (7 сут после инфицирования). Образцы всех вариантов исследовали на сканирующем электронном микроскопе LEO-1430 VP (Carl Zeiss, Германия) в условиях высокого вакуума с использованием детектора отраженных (обратно-рассеянных, BSE – backscattered electrons) электронов 4QBSD или детектора вторичных электронов SE1 (SE – secondary electrons) при –25…–30°С, ускоряющем напряжении 20 кВ и рабочем расстоянии 9–12 мм (метод криоСЭМ).
РЕЗУЛЬТАТЫ
На табл. I представлены изображения поверхности плодов яблони, полученные методом криоСЭМ без металлизации. Поверхность плодов покрыта плотным восковым слоем. Детектор 4QBSD позволил получить изображения удовлетворительного качества при увеличениях не более 1000×. При использовании детектора вторичных электронов SE1 наблюдали сильное накопление заряда на отдельных участках поверхности (более светлые зоны на табл. I, 1) даже при относительно небольших увеличениях. С одной стороны, это не позволяет рассмотреть элементы топографии, с другой стороны несет информацию о неравномерности воскового слоя.
Таблица I. Микрографии воскового слоя на поверхности плодов яблони, полученные методом криоСЭМ без напыления золотом с использованием детекторов SE1 (1, 3) и 4QBSD (2, 4). В нижнем ряду (3, 4) представлены более детальные изображения центрального участка. 1, 2 – 300×; 3, 4 – 1000×.
Plate I. Micrographs of the wax layer on the apple fruit surface obtained by cryoSEM without gold coating using detectors SE1 (1, 3) and 4QBSD (2, 4). The lower row (3, 4) presents more detailed images of the central section. 1, 2 – 300×; 3, 4 – 1000×.

Металлизация замороженных образцов плодов яблони позволила получать изображения хорошего качества при увеличениях до 4000× (табл. II). При этом отдельные относительно четкие детали поверхности данного образца были видны даже при увеличении 9000× (фото не представлены). Детектор 4QBSD при больших увеличениях дал более четкие и прорисованные изображения. Однако при использовании SE1, особенно при небольших увеличениях (табл. II, 3), поверхность выглядела более объемной, что позволило составить представление о ее микрорельефе.
Таблица II. Микрографии одного и того же участка воскового слоя на поверхности плодов яблони, полученные методом криоСЭМ замороженных образцов с напылением золотом и использованием разных детекторов.
1, 3, 5 – SE1; 2, 4, 6 – 4QBSD. В нижних рядах представлены более детальные изображения центрального участка при увеличении: 1, 2 – 100×; 3, 4 – 1000×; 5, 6 – 4000×.
Plate II. Micrographs of the same area of the wax layer on the apple fruit surface obtained with cryoSEM of frozen samples coated with gold coating and using different detectors.
1, 3, 5 – SE1; 2, 4, 6 – 4QBSD. The lower rows show more detailed images of the central section at different magnifications: 1, 2 – 100×; 3, 4 – 1000×; 5, 6 – 4000×.

Помимо непрерывного слоя на поверхности плодов заметны восковые пластинки разных размеров, а при увеличении 4000× видны отложения в виде многочисленных мелких зернышек (табл. II, 5, 6). На поверхности плодов имеются почти прямолинейные борозды, возможно, механического происхождения. Мелкие зерна и некоторые чешуйчатые восковые отложения были расположены внутри борозд, что позволяет предположить, что они появились после образования борозд, возможно, в результате выделения воскового материала на поверхность через кутикулярные поры.
При напылении поверхности плодов яблони в условиях комнатной температуры (табл. III) на небольших увеличениях наблюдали сморщивание поверхности и, соответственно, металлической пленки на отдельных участках в результате подсыхания образца (табл. III, 1, 2). Однако те участки, которые не были затронуты такой деформацией, позволили получить изображения высокого качества при увеличениях примерно 2000×.
Таблица III. Микрографии одного и того же участка воскового слоя на поверхности плодов яблони, полученные методом криоСЭМ нефиксированных образцов с напылением золотом при комнатной температуре и использованием разных детекторов.
1, 3, 5 – SE1; 2, 4, 6 – 4QBSD. В нижних рядах представлены более детальные изображения центрального участка при увеличении: 1, 2 – 300×; 3, 4 – 1000×; 5, 6 – 2000×.
Plate III. Micrographs of the same area of the wax layer on the apple fruit surface obtained with cryoSEM of native samples with gold coating at room temperature and using different detectors.
1, 3, 5 – SE1; 2, 4, 6 – 4QBSD. The lower rows show more detailed images of the central section at different magnifications: 1, 2 – 300×; 3, 4 – 1000×; 5, 6 – 2000×.

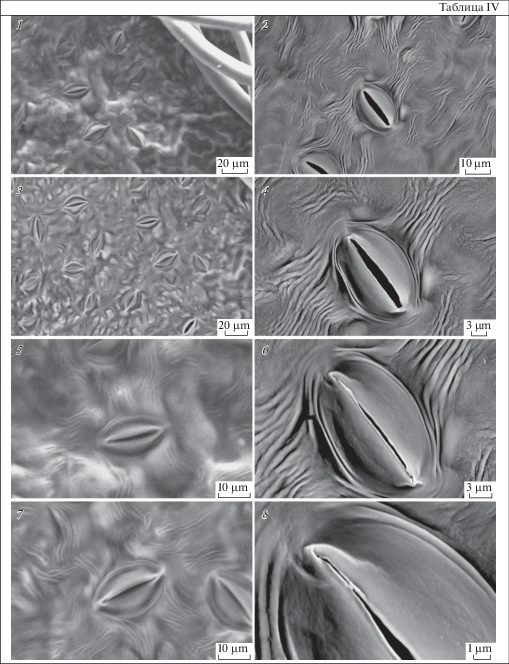
На абаксиальной стороне листьев яблони можно наблюдать устьица и выраженную околоустьичную кутикулярную складчатость разной морфологии: радиально расходящиеся складки в виде микротяжей и перистоматические кольца, которые опоясывают замыкающие клетки (табл. IV). Как и в случае плодов, металлизация существенно улучшает качество изображения. Из табл. IV видно, что у образцов без напыления изображения устьиц удовлетворительного качества получаются при увеличении, ненамного превышающем 1000×. При этом для не металлизированных образцов предпочтительнее использовать детектор 4QBSD. Напыление замороженных образцов позволяет не только улучшить качество изображения, но и повысить доступное увеличение до 7000×. Кроме того, в этом случае возможно использовать оба типа детекторов.
Таблица IV. Микрографии устьиц на абаксиальной стороне листа яблони, полученные методом криоСЭМ без напыления (1, 3, 5, 7) и с напылением золотом замороженного образца (2, 4, 6, 8).
1, 5 – SE1; 2–4, 6–8 – 4QBSD. В нижних рядах представлены более детальные изображения центрального участка при увеличении: 1, 3 – 500×; 2 – 1000×; 5, 7 – 1300×; 4 – 2000×; 6 – 3000×; 8 – 7000×.
Plate IV. Micrographs of stomata on the abaxial side of the apple tree leaf obtained with cryoSEM without (1, 3, 5, 7) and with gold coating of frozen samples (2, 4, 6, 8).
1, 5 – SE1; 2–4, 6–8 – 4QBSD. The lower rows show more detailed images of the central section at different magnifications: 1, 3 – 500×; 2 – 1000×; 5, 7 – 1300×; 4 – 2000×; 6 – 3000×; 8 – 7000×.
В табл. V и VI представлены изображения “чечевичек” на поверхности плодов груши. Вокруг полости “чечевички” заметен мицелий сапрофитного гриба, а в ее полости помимо мицелия наблюдаются спороношения гриба. Так же, как и у вышеописанных объектов, криоСЭМ без напыления позволила получать изображения с увеличением менее 1000×. Напыление даже без замораживания позволило наблюдать гифы и споры гриба при увеличении 4000×. Однако на столь больших увеличениях заметно, что эти структуры подвергались деформации и потеряли тургор. Напыление с замораживанием позволило получить увеличение объекта до 10 000× и заметно большую сохранность грибных структур, так же, как и на микрографии поверхности плодов яблони в табл. II и III, детектор 4QBSD дает более четкие изображения мелких деталей, а SE1 подчеркивает объем.
Таблица V. Сапрофитный гриб внутри “чечевички” на поверхности плода груши (криоСЭМ замороженных образцов с напылением золотом).
1, 3, 5 – SE1; 2, 4, 6 – 4QBSD. 1, 2 – 300×; 3, 4 – 2000×; 5, 6 – 10 000×.
Plate V. Saprophytic fungus inside “lenticellae” on the surface of a pear fruit (cryoSEM of frozen samples coated with gold).
1, 3, 5 – SE1; 2, 4, 6 – 4QBSD. 1, 2 – 300×; 3, 4 – 2000×; 5, 6 – 10 000×.

Таблица VI. Сапрофитный гриб внутри “чечевички” на поверхности плода груши (криоСЭМ нативных образцов с напылением золотом при комнатной температуре).
1, 3, 5 – SE1; 2, 4, 6 – 4QBSD. 1, 2 – 100×; 3, 4 – 1000×; 5, 6 – 4000×.
Plate VI. Saprophytic fungus inside “lenticel” on the pear fruit surface (cryoSEM of native samples coated with gold at room temperature).
1, 3, 5 – SE1; 2, 4, 6 – 4QBSD. 1, 2 – 100×; 3, 4 – 1000×; 5, 6 – 4000×.

Более качественные изображения поверхности были получены в варианте с напылением замороженных листьев пшеницы (табл. VII, 4). Однако нативность гиф мицелия B. graminis в этом варианте не удалось сохранить: гифы теряли влагу и сморщивались (табл. VIII, 1, 2). Наоборот, конидии возбудителя мучнистой росы лучше сохранялись именно в варианте с напылением. Металлизация позволяла получать изображения поверхности конидий с использованием обоих детекторов при увеличениях до 10 000× (табл. VIII, 4, 6, 8). Попытки получить более качественные микрографии не металлизированных конидий путем увеличения экспозиции или при большем увеличении приводили к заметному повреждению поверхности электронным пучком (табл. VIII, 7).
Таблица VII. Колонии мучнистой росы Blumeria graminis с гифами и конидиеносцами на листьях пшеницы (детектор 4QBSD).
1, 3 – без напыления; 2, 4 – с напылением золотом замороженного образца. 1, 2 – 100×; 3, 4 – 500×.
Plate VII. Colonies of powdery mildew (Blumeria graminis) with hyphae and conidiophores on wheat leaves (4QBSD detector).
1, 3 – without gold coating; 2, 4 – with gold coating of a frozen sample. 1, 2 – 100×; 3, 4 – 500×.

Таблица VIII. Конидии и мицелий мучнистой росы Blumeria graminis на листьях пшеницы.
1, 2, 4, 6, 8 – с напылением золотом замороженного образца; 3, 5, 7 – без напыления. 1, 3 – SE1; 2, 4–8 – 4QBSD. 1–3, 5, 7 – 500×; 4 – 2000×; 6 – 7000×; 8 – 10 000×.
Plate VIII. Powdery mildew (Blumeria graminis) conidia and mycelium on wheat leaves.
1, 2, 4, 6, 8 – with gold coating of a frozen sample; 3, 5, 7 – without gold coating. 1, 3 – SE1; 2, 4–8 – 4QBSD. 1–3, 5, 7 – 500×; 4 – 2000×; 6 – 7000×; 8 – 10 000×.

ОБСУЖДЕНИЕ
Образцы растительного и грибного происхождения обладают большим разнообразием свойств, которые способны оказывать влияние на качество изображений при применении СЭМ в различной конфигурации. Для большинства исследованных нами объектов вариант криоСЭМ с напылением замороженных тканей дал наилучшие результаты. Все образцы, кроме гиф возбудителя мучнистой росы, визуально сохраняли высокую степень интактности. Металлизация расширила диапазон доступных максимальных увеличений для изученных объектов с 1000× до 10 000×. Это позволило различить детали восковых и кутикулярных отложений, а также получить достаточно качественные изображения конидий и гиф грибов на поверхности плодов и листьев. Однако и при относительно небольших увеличениях металлизация обеспечивает большую четкость, контрастность и лучшую детализацию изображения, что оправдывает некоторое усложнение методики.
При использовании детектора вторичных электронов SE1 изображение возникает благодаря топографическому контрасту (Gouldstein et al., 1978; Goldstein et al., 2003). В получении изображения с помощью детектора обратно-рассеянных электронов 4QBSD участвует как топографический контраст, так и контраст материала. В большинстве исследованных нами объектов при криоСЭМ использование 4QBSD имело преимущества перед SE1. Металлизация поверхности сохраняет топографические детали, но маскирует различие химических особенностей отдельных участков – снижает контраст материала при использовании детектора 4QBSD. Очевидно, что в тех случаях, когда химические различия поверхности не являются предметом исследования, этот недостаток не является существенным и компенсируется более высоким качеством изображения.
Металлизация биологического образца снижает потери влаги препаратом при микроскопировании, но не предотвращает их полностью. О протекании такого процесса можно судить по состоянию устьиц. Как видно из таблицы IV (2, 4, 6, 8), при получении изображения одного и того же устьица с последовательно возрастающим увеличением потеря влаги проявляется в снижении тургора замыкающих клеток и постепенном уменьшении размеров устьичной щели на изображениях, полученных позднее.
Большая часть исследованных нами объектов имела жесткую структуру, обусловленную мощной клеточной стенкой и кутикулой. Помимо обеспечения жесткости каркаса, кутикула предохраняет живые ткани от излишнего испарения влаги с поверхности. Поэтому для поверхности плодов яблони оказалось возможным осуществить напыление даже при комнатной температуре. В этом случае относительно большей сохранностью обладали центральные участки экспланта. Для металлизации поверхности листьев большинства растений та или иная степень охлаждения образца является непреложным условием. Однако в некоторых случаях и для относительно легко теряющих воду структур, подобных конидиям грибов, может быть полезна использованная нами относительно простая методика криоСЭМ с напылением металлами.
В наших экспериментах при напылении использовали относительно небольшие отрицательные температуры. Камера для напыления не была оборудована дополнительными средствами охлаждения. Накопителем холода, который обеспечивал защиту образца в течение нескольких минут, необходимых для достижения нужной аргоновой среды и собственно напыления служил массивный металлический держатель. Эффективное выравнивание температур между образцом, который нагревается электронным пучком при микроскопировании или ионами металла при напылении, и охлаждающим столиком или накопителем холода осуществлялось благодаря использованию термопасты. Очевидно, что при условии более тщательной защиты образца от конденсации влаги из воздуха возможно использовать для напыления более низкие температуры и проводить оптимизацию условий температуры и времени напыления для каждого типа образца.
Список литературы
Beckett A., Read N.D. 1986. Low-Temperature Scanning Electron Microscopy. – In: Ultrastructure Techniques for Microorganisms. Springer, Boston, MA. P. 45–86. https://doi.org/10.1007/978-1-4684-5119-1_2
Bray D. 2000. Critical Point Drying of Biological Specimens for Scanning Electron Microscopy. – In: Supercritical Fluid Methods and Protocols. Methods in Biotechnology. Vol. 13. P. 235–243. https://doi.org/10.1385/1-59259-030-6:235
Echlin P. 1978. Low temperature scanning electron microscopy: a review. – J. Microsc. 112 (1): 47–61.
Ensikat H. J., Weigend M. 2013. Cryo-scanning electron microscopy of plant samples without metal coating, utilizing bulk conductivity. – Microsc. Anal. 27: 7–10.
[Goldstein] Гоулдстейн Д., Яковиц X., Ньюбэрн Д. 1978. Практическая растровая электронная микроскопия. М. 656 с.
Goldstein J.I., Newbury D.E., Joy D.C., Lyman C.E., Echlin P., Lifshin E., Sawyer L., Michael J.R. 2003. Scanning Electron Microscopy and X-Ray Microanalysis. New York. 688 p.
McGregor J.E., Donald A.M. 2010. ESEM imaging of dynamic biological processes: the closure of stomatal pores. – J. Microsc. 239: 135–141.
Neděla V., Tihlaříková E., Hřib J. 2015. The low temperature method for study of coniferous tissues in the environmental scanning electron microscope. – Microsc. Res. Tech. 78 (1): 13–21.
Pathan A.K., Bond J., Gaskin R.E. 2008. Sample preparation for scanning electron microscopy of plant surfaces–horses for courses. – Micron. 39 (8): 1049–61.
Read N.D., Jeffree C.E. 1991. Low temperature scanning electron microscopy in biology. – J. Microsc. 161 (1): 59–72.
Read N.D. 1991. Low-Temperature Scanning Electron Microscopy of Fungi and Fungus-Plant Interactions. – In: Electron Microscopy of Plant Pathogens. Springer, Berlin, Heidelberg. https://doi.org/10.1007/978-3-642-75818-8_2
[Ryabchenko, Babosha] Рябченко А.С., Бабоша А.В. 2012. Применение термопасты в качестве клеящего и теплопроводящего состава при исследовании биологических образцов на сканирующем электронном микроскопе с использованием замораживающей приставки. Патент РФ № 2445660 от 20.03.2012. Бюл. № 8.
Stokes D.J. 2008. Principles and practice of variable pressure/environmental scanning electron microscopy (VP/ESEM). Chichester, West Sussex, UK. 234 p.
Wergin W.P., Erbe E.F. 1989. Increasing the versatility of an EMscope SP2000A sputter cryo system on a Hitachi S-570 scanning electron microscope. – Scanning. 11 (6): 293–303.
Wei Z., Qu Z., Zhang L., Zhao S., Bi Z., Ji X., …, Wei H. 2015. Overexpression of poplar xylem sucrose synthase in tobacco leads to a thickened cell wall and increased height. – PLoS One. 10 (3): e0120669.
Yao Y., Zhang B., Dong C.J., Du Y., Jiang L., Liu J.Y. 2015. Comparative proteomic and biochemical analyses reveal different molecular events occurring in the process of fiber initiation between wild-type allotetraploid cotton and its fuzzless-lintless mutant. – PloS one. 10 (2): e0117049.
Дополнительные материалы отсутствуют.
Инструменты
Ботанический журнал


