Ботанический журнал, 2019, T. 104, № 11-12, стр. 1727-1739
ИЗМЕНЕНИЕ УЛЬТРАСТРУКТУРЫ ПЛАСТИД И ПИГМЕНТНОГО КОМПЛЕКСА В ПРОЦЕССЕ МОРФОГЕНЕЗА ПОДЗЕМНЫХ ПОБЕГОВ ACHILLEA MILLEFOLIUM (ASTERACEAE)
С. П. Маслова 1, *, О. В. Дымова 1, С. Н. Плюснина 1
1 Институт биологии Коми научного центра Уральского отделения РАН
167000 г. Сыктывкар, ул. Коммунистическая, 28, Россия
* E-mail: maslova@ib.komisc.ru
Поступила в редакцию 27.03.2019
После доработки 10.11.2019
Принята к публикации 12.11.2019
Аннотация
Впервые получены количественные данные об ультраструктурных изменениях пластид и содержании фотосинтетических пигментов в процессе фотоморфогенеза верхушки подземного побега при переходе от диагравитропной к ортотропной ориентации роста у растений Achillea millefolium. На фотофобном этапе в этиолированной верхушке корневища система внутренних мембран лейкопластов представлена периферическим ретикулумом, одиночными тилакоидами стромы, отмечены проламеллярные тела. Хлорофиллы и каротиноиды присутствовали в следовых количествах, из каротиноидов обнаружены ксантофиллы, в основном лютеин (70%). С переходом от фотофобного к фотофильному этапу морфогенеза в зеленеющей верхушке сармента (зачатки листьев) отмечены хлоропласты с активно развивающейся гранальной системой. Содержание фотосинтетических пигментов составляло 1.0–1.2 мг/г сухой массы, что на порядок больше по сравнению с этиолированными корневищами. Выявлено увеличение фонда Хл а1 в большей степени, чем Хл б, что отражает становление фотосистем и увеличение числа реакционных центров в процессе зеленения. В верхушке сармента среди каротиноидов обнаружены β-каротин, лютеин, виолаксантин, неоксантин и в небольшом количестве зеаксантин. Листья сарментов содержали значительное количество хлорофиллов и каротиноидов (5.3 мг/г сухой массы), что коррелировало с увеличением числа хлоропластов с развитой системой фотосинтетических мембран.
ВВЕДЕНИЕ
Конус нарастания подземных побегов длиннокорневищных травянистых многолетников периодически формирует почки, которые затем переходят в надземный побег – сармент. Апикальная часть сармента в процессе подземного горизонтального роста дифференцируется, образуя зачатки ассимилирующих листьев (Markarov, Golovko, 1995а). Экспериментально доказано, что ориентация роста подземных побегов контролируется фитохромной системой (Markarov, Golovko, 1995б). Фитохром в форме красного контролирует горизонтальный рост корневищ под поверхностью почвы, а фитохром в форме дальнего красного препятствует выходу верхушки побегов на поверхность почвы. Регуляторные функции фитохрома реализуются в зависимости от процессов органообразования в конусе нарастания подземного побега. Фотофобный период развития подземного побега характеризуется образованием метамеров с чешуевидными листьями, диагравитропизмом и отрицательным фототропизмом. В фотофильный период происходит образование зеленых развитых листьев, побеги проявляют положительный фототропизм.
Гетерогравитропность подземных почек, обеспечивающая ветвление корневища и образование надземных ассимилирующих побегов, является уникальным биологическим свойством, которое сформировалось и закрепилось на этапах филогенетической трансформации жизненных форм растений (Maslova, Golovko, 2017). К настоящему времени мало что известно о механизмах регуляции гетерогравитропизма подземных вегетативных меристем. Слабо изучен морфогенез подземных побегов – корневищ (Markarov, Golovko, 1995а, б; Maslova et al., 2007, 2013; Maslova, Golovko, 2017; Yoshida et al., 2016). Показано, что в процессе фотоморфогенеза корневищ Achillea millefolium, при переходе верхушки побега от диатропного к ортотропному росту, повышается уровень гормональной активности, содержание олигосахаридов (Maslova et al., 2007; 2013).
Результаты исследования латеральных подземных меристем многолетних злаков р. Leymus свидетельствуют о полиморфизме экспрессируемых генов, вовлеченных в гравитропический ответ подземных почек, проявляющих отрицательный гравитропизм (короткокорневищные травы) и диагравитропизм (длиннокорневищные травы) (Kaur et al., 2008). В гетеротрофных тканях верхушки корневища тростника (Phragmites australis) выявлено присутствие генов белков фотосистемы I и II, хлорофилла а, апопротеина А1 и фототропина-2 (Ruifeng et al., 2012). Механизмы формирования фотосинтетического аппарата в процессе деэтиоляции довольно полно изучены у проростков растений (Reinbothe et al., 2010; Solymosi, Schoefs, 2010; Garmash et al., 2013). Сведения о фотоморфогенезе подземных побегов единичны (Markarov, Golovko, 1995а; 1995б; Maslova, Golovko, 2017), а работ по изучению структуры и физиологического состояния верхушки корневища при переходе от фотофобного к фотофильному этапу развития практически нет.
Целью данной работы было изучить изменения ультраструктуры пластид и пигментного комплекса в процессе фотоморфогенеза верхушки подземного побега длиннокорневищного вида Achillea millefolium.
МАТЕРИАЛЫ И МЕТОДЫ
Achillea millefolium L. (тысячелистник обыкновенный) – многолетний летнезеленый травянистый тонко-длиннокорневищный симподиально нарастающий поликарпик с удлиненным прямостоячим побегом (Bezdelev, Bezdeleva, 2006). Растения A. millefolium формируют корневища – подземные побеги с диатропной (горизонтальной) ориентацией роста. Конус нарастания корневищ периодически формирует почки, которые переходят в надземный побег – побег закрепления (Serebryakov, Serebryakova, 1965). Такой тип побега называют также сарментом – подземным побегом, способным переходить из диатропного в ортотропный (ассимилирующий) побег, минуя период покоя (Markarov, Golovko, 1995). Апикальная часть сармента в процессе определенного периода подземного горизонтального роста дифференцируется и формирует фотофильный гистологический комплекс, происходит образование зеленых листьев. В фазу цветения растение A. millefolium образует до 30 подземных побегов, из которых 25% составляют сарменты (Maslova et al., 2013).
Растения выращивали из корневищ в вегетационном опыте при площади питания 0.4 × 0.7 м2. Верхушки подземных побегов (0.3–1 см) отбирали в период генеративного развития растений (август). Верхушки побегов исследовали на разных этапах органогенеза апикальной почки. На фотофобном этапе изучали этиолированные верхушки корневищ, на фотофильном – зеленеющие верхушки сарментов и формирующиеся листья сарментов (рис. 1). Опыты проводили в 2016–2018 гг.
Рис. 1.
Фотоморфогенез подземного побега Achillea millefolium. 1 – верхушка побега (корневища) на фотофобном этапе, 2 – зеленеющая верхушка сармента, 3 – формирование листьев сармента, 4 – сформированные листья сармента. Линейка: 10 см.
Fig. 1. Photomorphogenesis of the Achillea millefolium underground shoot. 1 – the etiolated rhizome apex, 2 – the greening rhizome apex, 3 – formation of sarment leaves, 4 – developed leaves of sarment. Bar: 10 cm.

Для электронно-микроскопических исследований фрагменты верхушек 5–7 подземных побегов на разных стадиях морфогенеза фиксировали в течение 4.5 ч в 2.5%-ном глутаральдегиде, приготовленном на фосфатном буфере с рН 7.4. Постфиксацию проводили в 1%-ном водном растворе осмиевой кислоты в течение 8 ч. После дегидратации в серии растворов спирта и ацетона образцы заключали в смолу Эпон-812. Ультратонкие срезы были получены с помощью ультрамикротома PowerTome PC (Boeckeler Instruments, США). Просмотр и фотосъемку поперечных срезов первого междоузлия и листовых органов (кроющей чешуйки и листа) подземных побегов проводили на трансмиссионном электронном микроскопе Tesla BS 500 (Чехословакия). Измерения клеточных органелл проводили в 10–30-кратной повторности.
Содержание хлорофиллов и каротиноидов в исследуемых образцах определяли на спектрофотометре UV–1700 (Shimadzu, Япония) в ацетоновой вытяжке при максимумах поглощения – 662 и 644 нм для хлорофилла a и b соответственно, 478 нм – для каротиноидов. Для анализа состава каротиноидов зафиксированные в жидком азоте пробы хранили при –80°С. Разделение индивидуальных Кар проводили с помощью ВЭЖХ с обращенной фазой (“Knauer”, Германия) в соответствии с модифицированным методом (Gilmore, Yamamoto, 1991) после экстрагирования элюентом А (ацетонитрил: метанол: вода = 75:12:4). Для построения градуировочных кривых использовали стандарты чистых веществ (пигментов) (“Sigma” и “Fluka”, США). Определение пигментов проводили в 3–5 биологических и 2 аналитических повторностях.
В таблицах представлены средние арифметические величины и их стандартные ошибки. Статистическую значимость различий между независимыми выборками оценивали с помощью t-критерия Стьюдента или теста Дункана. Р-величину рассчитывали при заданном уровне значимости α 0.05.
РЕЗУЛЬТАТЫ
Ультраструктура пластид верхушек подземных побегов – корневищ и сарментов. Исследование ультраструктуры пластид в клетках верхушек подземных побегов показало различия между корневищами и сарментами, между междоузлиями побегов и листовыми органами. Показано, что первые от верхушки междоузлия корневища и сармента имели одинаковую схему строения и содержали структурные элементы, характерные для сформированного междоузлия подземного побега: эпидерму, коровую паренхиму, схизогенные секреторные каналы в ней, коллатеральные проводящие пучки по периферии центрального цилиндра, сердцевину, заполненную паренхимными клетками (Plyusnina et al., 2013). В клетках паренхимы основной объем занимала центральная вакуоль, цитоплазма имела пристеночное положение, содержала ядро и небольшое количество органелл, параметры которых значительно варьировали (табл. 1). Отмечены хорошо развитые митохондрии, число которых было выше в сарментах по сравнению с корневищами.
Таблица 1.
Сравнительная характеристика митохондрий и пластид паренхимных клеток междоузлий верхушек подземных побегов Table 1. Comparative characteristics of mitochondria and plastids of parenchymal cells of internodes of underground shoot apexes
| Параметры Characteristics |
Корневище Rhizome |
Сармент Sarment |
|---|---|---|
| Число митохондрий на срез клетки Number of mitochondria per cell section |
$\frac{{5.4 \pm 2.1}}{{1{\kern 1pt} --{\kern 1pt} 10}}$ | $\frac{{8.6 \pm 3.1}}{{4{\kern 1pt} --{\kern 1pt} 21}}$ |
| Площадь митохондрий, мкм2 Mitochondria section area, μm2 |
$\frac{{0.41 \pm 0.10}}{{0.21{\kern 1pt} --{\kern 1pt} 0.81}}$ | $\frac{{0.44 \pm 0.03}}{{0.39{\kern 1pt} --{\kern 1pt} 0.49}}$ |
| Число пластид на срез клетки Number of plastids per cell section |
$\frac{{0.7 \pm 0.7}}{{0{\kern 1pt} --{\kern 1pt} 4}}$ | $\frac{{1.1 \pm 0.8}}{{0{\kern 1pt} --{\kern 1pt} 3}}$ |
| Площадь лейкопласта, мкм2 Leucoplast section area, μm2 |
$\frac{{0.80 \pm 0.31}}{{0.46{\kern 1pt} --{\kern 1pt} 1.35}}$ | $\frac{{1.34 \pm 0.11}}{{1.18{\kern 1pt} --{\kern 1pt} 1.50}}$ |
| Площадь амилопласта, мкм2 Amyloplast section area, μm2 |
$\frac{{1.83 \pm 0.59}}{{0.59{\kern 1pt} --{\kern 1pt} 2.73}}$ | $\frac{{5.16 \pm 1.37}}{{3.06{\kern 1pt} --{\kern 1pt} 9.36}}$ |
В паренхимных клетках междоузлий этиолированной верхушки корневищ пластиды встречались единично и были представлены лейкопластами и амилопластами неправильной формы (табл. 1; таблица I, 1). Система внутренних мембран лейкопластов состояла из периферического ретикулума и/или 1–3 одиночных тилакоидов стромы. На поперечных срезах кроющих чешуек в паренхимных клетках число пластид с площадью сечения около 2 мкм2 варьировало от 1 до 9. В лейкопластах встречались проламеллярные тела, в цистернах внутренних мембран показано накопление осмиофильного вещества (таблица I, 2). Крахмал присутствовал у трети пластид. В них одновременно могли накапливаться включения белковой природы и/или пластоглобулы. Схожие пластиды описаны для запасающих клеток молодых корней сахарной свеклы Beta vulgaris L. (Atlas…, 1980).
Таблица I. Пластиды в верхушках подземного побега Achillea millefolium. 1 – лейкопласт в коровой паренхиме междоузлия корневища; 2 – лейкопласты в паренхимных клетках кроющей чешуйки корневища; 3 – амилопласты в паренхимной клетке междоузлия сармента; 4 – хлоропласты в мезофилле молодого листа сармента; 5 – хлоропласты в мезофилле зрелого листа сармента. A – амилопласт, V – вакуоль, CW – клеточная оболочка, S – крахмал, L – лейкопласт, IS – межклетник, Ch – хлоропласт, N – ядро, * – проламеллярное тело. Масштабные линейки, мкм: 1 – 0.5, 2 – 1, 3 – 1, 4 – 2, 5 – 2.
Plate I . Plastids in the apexes of underground shoot tissues of Achillea millefolium. 1 – leucoplast in the cortical cells of rhizome internode; 2 – leucoplasts in parenchymal cells of the renal scales of the rhizome; 3 – amyloplasts in the cortical cell of sarment internode; 4 – chloroplasts in the mesophyll of young leaf of sarment; 5 – chloroplasts in the mesophyll of mature leaf of sarment. A – amyloplast, V – vacuole, CW – cell wall, S – starch, L – leucoplast, IS – intercellular space, Ch – chloroplast, N – nucleus, * – prolamellar body. Scale bars, µm: 1 – 0.5, 2 – 1, 3 – 1, 4 – 2, 5 – 2.
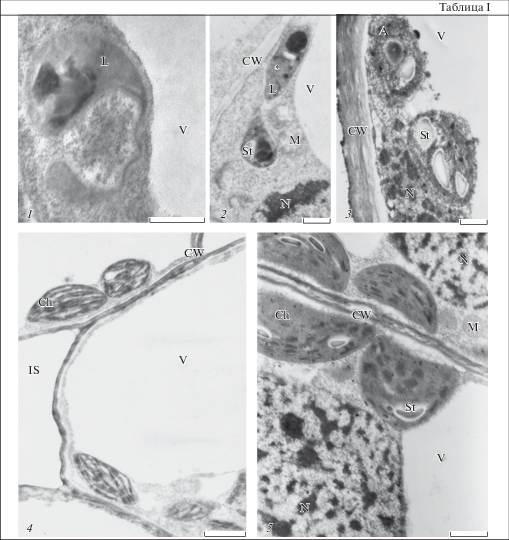
Как и следовало ожидать, при переходе верхушек подземных побегов от фотофобного к фотофильному этапу развития в ультраструктуре пластид происходят существенные изменения. Междоузлия зеленеющей верхушки характеризовались наличием лейкопластов и амилопластов с бóльшей площадью сечения, чем у этиолированной верхушки корневищ (табл. 1, таблица I, 3). Система внутренних мембран была представлена одиночными тилакоидами, изредка встречались плохо развитые граны. В зачатках листьев верхушек зеленеющих сарментов пластиды были представлены хлоропластами (табл. 2). При дальнейшем формировании листа число и размер пластид в клетках мезофилла практически не изменялись. В хлоренхиме молодых листьев показано увеличение суммарного количества тилакоидов на срез хлоропласта вдвое за счет роста числа гран. Крахмальные зерна встречались редко и составляли 5–7% от объема пластиды. Строма хлоропластов характеризовалась низкой электронной плотностью (таблица I, 4).
Таблица 2.
Структурные параметры хлоропластов в верхушках подземных побегов – сарментов растений Achillea millefolium Table 2. Parameters of chloroplasts in the underground shoot (sarment) apexes of Achillea millefolium plants
| Параметры Characteristics |
Зеленеющая верхушка сармента Greening apex of sarment |
Молодой лист сармента Young leaf of sarment |
Сформированный лист сармента Developed leaf of sarment |
|---|---|---|---|
| Число хлоропластов на срез клетки Number of chloroplasts per cell section |
3.0 ± 1.2 | 3.6 ± 1.5 | 13.3 ± 3.1** |
| Доля пластид с крахмалом, % Share of plastids with starch, % |
– | – | 66.4 ± 13.1 |
| Парциальный объем крахмального зерна, % Partial volume of starch grain, % |
– | 7.7 ± 1.5 | 20.1 ± 8.8 |
| Площадь сечения хлоропласта без крахмала, мкм2 Chloroplast section area without starch, μm2 |
4.5 ± 1.5 | 4.4 ± 1.1 | 4.5 ± 1.0 |
| Площадь сечения хлоропласта с крахмалом, мкм2 Chloroplast section area with starch, μm2 |
– | 5.3±0.9 | 13.1 ± 3.3 |
| Число гран на срез хлоропласта Number of grains per chloroplast section |
16.7 ± 3.1 | 27.8 ± 9.7* | 30.8 ± 4.2** |
| Число тилакоидов в гране Number of thylakoids per grain |
2.9 ± 0.8 | 3.9 ± 1.5 | 6.4 ± 2.9** |
Примечание. “–” – прочерк означает единичное присутствие пластид с крахмалом. Представлены средние арифметические значения и стандартные ошибки (n = 10–30). Различия между зеленеющей верхушкой и листьями сармента статистически значимы при * – P < 0.05; ** – P < 0.001.
Note. The dash (“–”) marks the presence of single plastids with starch. The averages and their standard errors are shown (n = 10–30). Differences between the greening apex of sarment and sarment leaves are significant at P < 0.05 (*) and P < 0.001 (**).
В более зрелых листьях сармента отмечено увеличение числа хлоропластов в 3 раза по сравнению с молодыми листьями (табл. 2; таблица I, 5). Суммарное число фотосинтетических мембран на срез хлоропласта увеличивалось в 2 раза за счет возрастания числа тилакоидов в гране. Около 70% хлоропластов содержали крахмал, парциальный объем которого составлял в среднем 20%. Площадь сечения хлоропласта с крахмалом в клетках мезофилла зрелых листьев увеличивалась более чем в два раза по сравнению с молодыми. Отмечено увеличение электронной плотности стромы пластид в зрелых листьях.
Следует отметить, что в клетках растущей хлоренхимы постепенно увеличивалось число митохондрий: от 7 в зеленеющих верхушках до 11 органелл на срез клетки сформированного листа. С развитием пластидома и хондриома повышалась электронная плотность и объем цитоплазмы.
Содержание фотосинтетических пигментов в верхушках подземных побегов – корневищ и сарментов. В верхушках корневищ фотосинтетические пигменты присутствовали в незначительном количестве (табл. 3). В пигментном фонде преобладал хлорофилл, его концентрация составляла менее 0.1 мг/г сухой массы. Следует отметить, что на фотофобном этапе развития корневищ Хл а и Хл б присутствовали примерно в равном количестве. Абсолютное и относительное содержание каротиноидов было довольно низким.
Таблица 3.
Содержание хлорофиллов, каротиноидов и их соотношений в верхушках подземных побегов растений Achillea millefolium на разных этапах морфогенеза Table 3. Content of chlorophyll, carotenoids and their ratio in the underground shoot apexes at different morphogenesis stages of Achillea millefolium plants
| Этапы развития Development stages |
хлорофилл а + b, мг/г сухой массы chlorophyll a+b, mg/g DW |
$\frac{{{\text{хлорофилл}}\,а}}{{{\text{хлорофилл}}\,b}}$ $\frac{{{\text{chlorophyll}}\,a}}{{{\text{chlorophyll}}\,b}}$ |
сумма каротиноидов, мг/г сухой массы carotenoids, mg/g DW |
$\frac{{{\text{хлорофилл}}}}{{{\text{каротиноид}}}}$$\frac{{{\text{chlorophyll}}}}{{{\text{carotenoid}}}}$ |
|---|---|---|---|---|
| Верхушка корневища Top of rhizome |
0.080 ± 0.002 a | 0.7 ± 0.1 b | 0.020 ± 0.002 a | 4.3 ± 0.6 a |
| Зеленеющая верхушка сармента Greening top of sarment |
1.06 ± 0.01 b | 2.2 ± 0.1 c | 0.18 ± 0.01 b | 6.1 ± 0.4 b |
| Молодые листья сармента Young leaves of sarment |
3.36 ±0.28 c | 2.6 ± 0.2 a | 0.57 ± 0.03 c | 5.9 ± 0.2 b |
| Сформированные листья сармента Developed leaves of sarment |
5.28 ± 0.58 d | 2.6 ± 0.1 a | 0.90 ± 0.11 d | 5.9 ± 0.1 b |
Примечание. Для анализа образцы зафиксированы жидким азотом; представлены среднее арифметическое значение и стандартная ошибка (n = 5); латинскими буквами (a, b, c, d) обозначена достоверность различий между этапами органогенеза, одинаковые буквы обозначают отсутствие достоверных различий (тест Дункана, при уровне P < 0.05).
Note. The rhizome and sarment samples for the analysis were frozen in liquid N2; the averages and their standard errors are shown (n = 5); significant differences between organogenesis stages are indicated by Latin letters (a, b, c, d), lack of significant differences is indicated by identical letters (ANOVA Duncan’s test, P < 0.05).
По сравнению с этиолированными корневищами, зеленеющие верхушки сарментов содержали на порядок больше фотосинтетических пигментов. При этом фонд Хл а увеличивался в большей степени, чем Хл б, о чем свидетельствует соотношение хлорофиллов. Интенсивное накопление фотосинтетических пигментов продолжалось и в формирующихся листьях сарментов. При этом по соотношению Хл а/Хл б и Хл/Кар молодые листья сарментов мало отличались от зеленеющей верхушки с зачатками листьев. В более зрелых листьях ортотропного побега (сармента) на фоне увеличения содержания фотосинтетических пигментов их соотношение практически не изменялось.
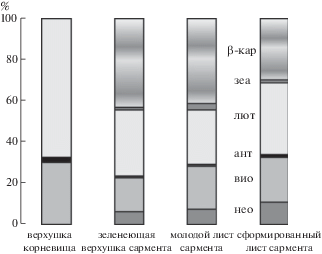
В тканях этиолированной верхушки корневищ фонд каротиноидов был представлен ксантофиллами (рис. 2). β-каротин, если и присутствовал, то в следовых количествах. Среди ксантофиллов бóльшую часть составлял лютеин (до 70%), присутствовали компоненты виолаксантинового цикла – виолаксантин и антероксантин. На долю Вио приходилось около 30%, Ант – 2% фонда желтых пигментов. В зеленеющей верхушке сарментов состав фонда каротиноидов был богаче. Среди каротиноидов обнаружены β-каротин (43%), лютеин (32%), виолаксантин (17%), неоксантин (6%) и в небольшом количестве зеаксантин. Сформированные листья не отличались от зеленеющих верхушек по составу каротиноидов, но их соотношение менялось. В листьях заметно увеличивалась доля пигментов виолаксантинового цикла.
Рис. 2.
Относительное содержание каротиноидов в тканях подземного побега на разных этапах его морфогенеза у растений Achillea millefolium. β-кар – β-каротин, зеа – зеаксантин, лют – лютеин, ант – антераксантин, вио – виолаксантин, нео – неоксантин.
Fig. 2. Relative content of carotenoids in the underground shoot tissues at different morphogenesis stages of Achillea millefolium plants: β-кар – β-carotene, зеа – zeaxanthine, лют – lutein, ант – antheraxanthine, вио – violaxanthine, нео – neoxanthine.
ОБСУЖДЕНИЕ
Формирование подземных меристем – одно из важных приобретений многолетних травянистых растений в процессе их адаптивной эволюции. Подземное ветвление корневища и образование надземных ассимилирующих побегов является результатом непрерывных морфогенетических преобразований, связанных с гетерогравитропностью подземных вегетативных почек (Maslova, Golovko, 2017).
Результаты нашего исследования на модели Achillea millefolium выявили, что становление фотосинтетического аппарата происходит в процессе фотоморфогенеза апикальной почки подземного побега, при переходе от фотофобного к фотофильному этапу развития. Изучение фотосинтетических пигментов в верхушках подземных побегов A. millefolium выявило существенные различия в содержании хлорофиллов и каротиноидов в процессе фотоморфогенеза апикальной почки. В тканях верхушек корневищ обнаружены хлорофиллы и каротиноиды в низких концентрациях (табл. 3). Ультраструктурные исследования показали, что слаборазвитая мембранная система пластид в верхушках этиолированных корневищ существенно преобразуется при переходе от фотофобного к фотофильному этапу морфогенеза. В зачатках листьев зеленеющей верхушки наблюдаются хлоропласты с развитой гранальной системой (табл. 2), существенно возрастает фонд фотосинтетических пигментов (табл. 3). Присутствие зеленых и желтых пигментов в небольшом количестве было отмечено и в этиолированных верхушках корневищ, растущих диатропно на глубине 3–7 см под поверхностью почвы. Свет низкой интенсивности может проникать на глубину 1–5 см в зависимости от типа почвы (Tester, Morris, 1987; Mo et al., 2015). Наши определения показали, что в зоне расположения основной массы корневищ освещенность может достигать 1–2 Вт/м2. С другой стороны, возможен синтез хлорофиллов и в отсутствии света. Так, темновой биосинтез хлорофиллов описан для эукариот (зеленые водоросли, некоторые виды мхов и папоротников, хвойные) и покрытосеменных растений (Hordeum vulgare, Tradescantia albiflora, Pisum sativum) (Adamson et al., 1997). Синтез хлорофилла происходит благодаря светонезависимой протохлорофиллидоксидоредуктазе (тПОР), что определяется наличием трех хлоропластных генов (ChlB, ChlL и ChlN) (Reinbothe et al., 2010; Armstrong, 1998).
В этиолированных верхушках корневищ нами обнаружены только ксантофиллы, в основном лютеин и виолаксантин (рис. 2). По данным работы (Garmash et al., 2013), содержание лютеина в этиолированных проростках пшеницы составляло более 50% фонда каротиноидов. Считают, что при зеленении он участвует в защите слаборазвитой мембранной системы хлоропластов от фотоокисления (Baroli, Niyogi, 2000). Известна также роль лютеина как структурного пигмента (Ladygin, Shirshikova, 2006). Каротиноиды, в том числе лютеин, участвуют в сборке трубчатых элементов проламеллярных тел в этиопластах, что способствует зеленению при выходе проростков на свет (Cuttriss et al., 2007). С каротиноидами связан синтез фитогормонов (Nambara, Marion-Poll, 2005). В частности, АБК синтезируется из виолаксантина в присутствии зеаксантинэпоксидазы. Ранее нами было обнаружено повышение уровня АБК в молодых корневищах Achillea millefolium в период их подземного диатропного роста (Maslova et al., 2013). АБК ингибирует интенсивность транскрипции пластидных генов, подавляет накопление мРНК ядерных генов ферментов биосинтеза хлорофилла (alad, hemAl, hemA3, DCUP) (Kravtsov et al., 2011; Kuznetsov, 2018). Возможно, что накопление виолоксантина и АБК в гетеротрофных тканях корневищ способствует поддержанию диагравитропной ориентации роста верхушки корневищ.
Формирование хлоропластов с развитой гранальной системой и накопление фотосинтетических пигментов ожидаемо у зеленеющей верхушки сарментов (табл. 3, рис. 2). Тот факт, что фонд Хл а увеличивался в большей степени, чем Хл б, отражает становление фотосистем и увеличение числа реакционных центров. Накопление фотосинтетических пигментов продолжалось в формирующихся листьях сарментов. В них значительно возрастало содержание зеаксантина (рис. 2), ключевого пигмента виолаксантинового цикла, участвующего в тепловой диссипации световой энергии и защите фотосинтетического аппарата от фотодеструкции (Baroli, Niyogi, 2000; Ladygin, Shirshikova, 2006; Tardy, Havaux, 1997). Функционально зрелые листья сарментов накапливали значительное количество фотосинтетических пигментов, что коррелирует с увеличением числа хлоропластов и интенсивным развитием мембранной системы в них.
Таким образом, нами впервые получены количественные данные об ультраструктурных изменениях пластид, содержании и соотношении фотосинтетических пигментов в процессе фотоморфогенеза верхушки подземного побега – сармента при переходе от диагравитропной к ортотропной ориентации роста. Выявлено преобладание ксантофиллов в фонде каротиноидов, что согласуется с представлениями об их защитной роли. Полученные данные углубляют представления о становлении фотосинтетического аппарата при переходе подземных побегов длиннокорневищных травянистых многолетников от фотофобного к фотофильному этапу развития.
Список литературы
Adamson H.Y., Hiller R.G., Walmsiley J. 1997. Protochlorophyllide reduction and greening in angiosperms – an evolutionary perspective. – J. Photochem. Photobiol. B. Biol. 41: 201–221.
Armstrong G.A. 1998. Greening in the dark: light-independent chlorophyll biosynthesis from anoxygenic photosynthetic bacteria to gymnosperms. – J. Photochem. Photobiol. B. Biol. 43 (2): 87–100.
[Atlas] Атлас ультраструктуры растительных тканей. 1980. Петрозаводск. 456 с.
Baroli I., Niyogi K.K. 2000. Molecular genetics of xanthophyll-dependent photoprotection in green algae and plants. – Philos. Trans. R. Soc. Lond. B. Biol. Sci. 355 (1402): 1385–1394. https://doi.org/10.1098/rstb.2000.0700
[Bezdelev, Bezdeleva] Безделев А.Б., Безделева Т.А. 2006. Жизненные формы семенных растений российского Дальнего Востока. Владивосток. 296 с.
Cuttriss A.J., Chubb A.C., Alawady A., Grimm B., Pogson B.J. 2007. Regulation of lutein biosynthesis and prolamellar body formation in Arabidopsis. – Funct. Plant Biol. 34: 663–72. https://doi.org/10.1071/FP07034
Garmash E.V., Dymova O.V., Malyshev R.V., Plyusnina S.N., Golovko T.K. 2013. Developmental changes in energy dissipation in etiolated wheat seedlings during the greening process. – Photosynthetica. 51 (4): 497–508.https://doi.org/10.1007/s11099-013-0044-z
Gilmore A.M., Yamamoto H.Y. 1991. Resolution of lutein and zeaxanthin using a non-endcapped, lightly carbon loaded C18 high performance liquid chromatographic column. – J. Chromatogr. 35: 67–78.
Kaur P., Mott I.W., Larson S.R., Bushman B.S., Hernandez A.G., Kim W.R., Liu L., Mikel M.A. 2008. Gene expression polymorphisms and ESTs associated with gravitropic response of subterranean branch meristems and growth habit in Leumus wildryes. – Plant Science. 175: 330–338.https://doi.org/10.1007/s00438-014-0817-5
Kravtsov A.K., Zubo Y.O., Yamburenko M.V., Kulaeva O.N., Kusnetsov V.V. 2011. Cytokinin and abscisic acid control plastid gene transcription during barley seedling de-etiolation. – Plant Growth Regul. 64 (2): 173–183.https://doi.org/10.1007/s10725-010-9553-y
[Kuznetsov] Кузнецов В.В. 2018. Гормональная регуляция биогенеза хлоропластов. М. 112 с.
[Ladygin, Shirshikova] Ладыгин В.Г., Ширшикова Г.Н. 2006. Современные представления о функциональной роли каротиноидов в хлоропластах эукариот. – Журнал общей биологии. 67 (3): 163–190.
[Markarov, Golovko] Маркаров А.М., Головко Т.К. 1995а. Ростовая ориентация подземных побегов многолетних травянистых растений. 3. Морфофизиология подземных побегов и развитие сарментов. – Физиология растений. 42 (5): 709–713.
[Markarov, Golovko] Маркаров А.М., Головко Т.К. 1995б. Ростовая ориентация подземных побегов многолетних травянистых растений. 2. Влияние света на ориентацию роста корневищ и столонов. – Физиология растений. 42 (5): 533–538.
[Maslova, Golovko] Маслова С.П., Головко Т.К. 2017. Тропизмы подземных побегов – столонов и корневищ. – Журнал общей биологии. 78 (2): 47–60. https://doi.org/10.1134/S207908641803009X
[Maslova et al.] Маслова С.П., Табаленкова Г.Н., Куренкова С.В., Плюснина С.Н. 2007. Сезонная динамика анатомо-морфологической структуры и содержания фитогормонов и сахаров в подземных побегах Phalaroides arundinacea. – Физиология растений. 54 (4): 555–561.
[Maslova et al.] Маслова С.П., Табаленкова Г.Н., Малышев Р.В., Головко Т.К. 2013. Сезонные изменения роста и метаболической активности подземных побегов тысячелистника обыкновенного. – Физиология растений. 60 (6): 865–873. https://doi.org/10.7868/S0015330313060079
Mo M., Yokawa K., Baluska F. 2015. How and why do root apices sense light under the soil surface. – Front. Plant Sci. 6: 1–8. https://doi.org/10.3389/fpls.2015.00775
Nambara E., Marion-Poll A. 2005. Abscisic acid biosynthesis and catabolism. – Ann. Rev. Plant Biol. 56: 165–185. https://doi.org/10.1146/annurev.arplant.56.032604.144046
[Plyusnina et al.] Плюснина С.Н., Маслова С.П., Козырева Ю.В. 2013. Сезонные и возрастные изменения анатомической структуры подземных побегов корневищных травянистых растений. – Бот. журн. 98 (5): 596–604. http://elibrary.ru/item.asp?id=18971449
Reinbothe C., Bakkouri M.E., Buhr F., Muraki N., Nomata J., Kurisu G., Fujita Y., Reinbothe S. 2010. Chlorophyll biosynthesis: spotlight on protochlorophyllide reduction. – Trends in Plant Science. 15 (11): 614–624. https://doi.org/10.1016/j.tplants.2010.07.002
Ruifeng H., Min-Jeong Kim, Nelson W., Babuena T.S., Kim R., Kramer R., Crow J.A., May G.D., Thelen J.J., Soderlund C.A., Gang D.R. 2012. Next-generation sequencing-based transcriptomic and proteomic analysis of the common reed, Phragmites australis (Poaceae), reveals genes involved in invasiveness and rhizome specificity. – Ann. J. Bot. 99 (2): 232–247.
[Serebryakov, Serebryakova] Серебряков И.Г., Серебрякова Т.И. 1965. О двух типах формирования корневищ у травянистых многолетников. – Бюл. МОИП. Отд. биологии. 70 (1): 67–81.
Solymosi K., Schoefs B. 2010. Etioplast and etio-chloroplast formation under natural conditions: the dark side of chlorophyll biosynthesis in angiosperms. – Photosynth. Res. 105: 143–166. https://doi.org/10.1007/s11120-010-9568-2
Tardy F., Havaux M. 1997. Thylakoid membrane fluidity and thermostability during the operation of the xanthophylls cycle in higher-plant chloroplasts – Biochim. Biophys. Acta. 1330: 179–193.
Tester M., Morris C. 1987. The penetration of light through soil. – Plant Cell Environ. 10 (4): 281–286.
Yoshida A., Terada Y., Toriba T., Kose K., Ashikari M., Kyozuka J. 2016. Analysis of Rhizome Development in Oryza longistaminata, a Wild Rice Species. – Plant Cell Physiol. 57 (10): 2213–2220. https://doi.org/10.1093/pcp/pcw138
Дополнительные материалы отсутствуют.
Инструменты
Ботанический журнал


