Ботанический журнал, 2019, T. 104, № 4, стр. 528-568
РАЗВИТИЕ СЕМЕНИ У НЕКОТОРЫХ ВИДОВ СЕКЦИЙ LATHYRIS, HOLOPHYLLUM И MYRSINITEAE ПОДРОДА ESULA РОДА EUPHORBIA (EUPHORBIACEAE)
Г. Е. Титова 1, *, О. В. Яковлева 1, Н. А. Жинкина 1, М. А. Нюкалова 1, Д. В. Гельтман 1
1 Ботанический институт им. В.Л. Комарова РАН
197376 Санкт-Петербург, ул. Профессора Попова, 2, Россия
* E-mail: galina_titova@mail.ru
Поступила в редакцию 21.02.2018
После доработки 11.03.2019
Принята к публикации 12.03.2019
Аннотация
Прослежено развитие семени у трех видов из секций подрода Esula Pers. рода Euphorbia, относящихся к его разным кладам, выделенным на основании молекулярно-генетического анализа, но занимающих на филогенетическом древе близкое базальное положение: Euphorbia lathyris из секции Lathyris (базальная клада, сестринская по отношению к остальным кладам подрода), E. komaroviana и E. myrsinites из секций Holophyllum и Myrsiniteae, лежащих в основании двух крупных продвинутых клад. Установлено, что при всей общности основной схемы формирования семян Euphorbia исследованные виды отличаются рядом специфических признаков. К ним относятся: формирование эндопахихалазы и системы постхалазального ветвления проводящего пучка рафе в семени; наличие тегмена, дифференцированного на экзотегмен (из слоя макросклереид), мезотегмен (слои клеток паренхимы) и эндотегмен (слой трахеидоподобных клеток с кольчатыми утолщениями стенок); развитие халазального гаустория эндосперма, внедряющегося в ткань прилегающего нуцеллуса. В то же время, выявлены различия в степени выраженности этих признаков. E. lathyris и E. komaroviana свойственно наличие достаточно типичной эндопахихалазы (по большинству признаков сопоставимой с таковой ряда родов сем. Euphorbiaceae), более развитой системы постхалазального ветвления проводящего пучка рафе (с проникновением его окончаний в основание тегмена, гипостазу, а также в подиум нуцеллуса – в виде особых клеток, предположительно млечников) и крупного, хорошо обособленного халазального гаустория эндосперма (с клиновидными врастаниями в ткань нуцеллуса). E. myrsinites свойственно наличие менее массивной эндопахихалазы, менее развитой системы постхалазального ветвления проводящего пучка рафе (с проникновением его окончаний лишь в основание тегмена и гипостазу) и менее обособленного гаустория эндосперма (без врастаний в нуцеллус). Установлены различия в строении семенной кожуры: по числу слоев клеток тегмена (до 15–16 слоев у E. lathyris и 11–12 у E. komaroviana и E. myrsinites); по структуре макросклереид экзотегмена (одинаковых по длине у E. komaroviana и неоднородных – у E. lathyris и E. myrsinites); по числу слоев клеток тесты и наличию в них сферокристаллов (от 4 до 6–7 слоев клеток тесты со сферокристаллами у E. lathyris и E. myrsinites, и 4 слоев клеток без сферокристаллов у E. komaroviana).
Установлено, что виды подрода Esula различаются: 1) по степени массивности структур семязачатка и семени – нуцеллуса, внутреннего интегумента/тегмена и эндопахихалазы (большей у видов секций Lathyris, Holophyllum, Helioscopia и Myrsiniteae, чем у видов секции Esula); 2) по степени развития системы постхалазального ветвления проводящего пучка рафе (вхождение его окончаний в гипостазу, основание тегмена и подиум нуцеллуса – в виде клеток-“млечников”, у видов секций La-thyris, Holophyllum и Helioscopia, и лишь в гипостазу и основание тегмена – у видов секций Myrsiniteae и Esula; 3) по характеру развития халазальной части эндосперма (образование специализированных выростов его гаустория в нуцеллус у видов секций Lathyris, Holophyllum и Helioscopia и их отсутствие у видов секций Myrsiniteae и Esula); 4) по глубине погружения семядолей зародыша и халазального конца эндосперма в ткань эндопахихалазы на поздних стадиях развития семени (выраженного у видов секций Lathyris и Holophyllum и почти отсутствующего у видов секций Helioscopia, Myrsiniteae и Esula); 5) по организации тегмена – более сложной у видов секций La-thyris, Holophyllum и Myrsiniteae (выделение экзо-, мезо- и эндотегмена, не характерное для видов остальных секций, исключая E. palustris из секции Helioscopia); 6) по признаку наличия/отсутствия сферокристаллов в клетках тесты (их отсутствие в тесте у видов секций Holophyllum и Helioscopia и наличие у видов секций Lathyris, Myrsiniteae и Esula). На основании анализа распределения признаков в разных кладах подрода Esula сделан вывод о логичности его молекулярно-филогенетического древа. Это проявляется как в большом сходстве признаков у видов секций, лежащих в основании древа, так и в четких различиях видов продвинутых клад I и II по комбинации двух устойчивых признаков – степени массивности эндопахихалазы и развития системы постхалазального ветвления проводящего пучка рафе семени и наличию/отсутствию сферокристаллов в тесте. Проведена оценка древа подрода Esula с позиций классических представлений об эволюции семени цветковых растений. Высказано предположение, что эта эволюция шла по пути постепенной редукции его структур, в том числе, эндопахихалазы и системы постхалазального ветвления проводящего пучка семени – от достаточно типичной эндопахихалазы у видов, лежащих в основании древа (вероятно унаследованной от предковых форм подрода Esula и рода Euphorbiа с сосудистым снабжением нуцеллуса и тегмена семени) – до редуцированной у видов, расположенных на вершине древа, причем с меньшей степенью редукции у видов клады I и значительно большей у видов клады II. Обсуждена предложенная ранее гипотеза о причинах возникновения различий между видами двух крупных продвинутых клад подрода Esula, основанная на результатах сравнительного анализа морфогенетических корреляций в развитии структур их семени, в частности, на выявленной зависимости между глубиной проникновения окончаний проводящего пучка рафе в структуры халазальной части семени и появлением сферокристаллов в тесте.
Подрод Esula Pers. – один из 4 подродов рода Euphorbia L. (Euphorbiaceae), выделенных (наряду с подродами Athymalus Neck. ex Rchb. (= Rhizanthium (Boiss.) Wheeler), Euphorbia и Chamaesyce Raf.) на основании молекулярно-филогенетического анализа (Steinmann, Porter, 2002; Bruyns et al., 2011; Horn et al., 2012). Недавно система подрода Esula была существенно пересмотрена с использованием ядерных (ITS) и хлоропластных (ndhF) маркеров (Geltman et al., 2011; Geltman, 2013; Riina et al., 2013). На основании построения филогенетического древа выделены 21 секция, объем и признаки которых в ряде случаев существенно отличаются от принятых ранее (Prokhanov, 1949, 1964, и др.). Две из них – секции Lagascae Lázaro и Lathyris Dumort., образуют базальные клады, а остальные секции объединены в две крупные продвинутые клады: клада I – секции Holophyllum (Prokh.) Prokh. и Helioscopia Dumort., клада II – секции Myrsiniteae (Boiss.) Lojac., Pithyusa (Raf.) Lázaro, Tithymalus (Gaertn.) Roep., Paralias Dumort., Esula (Pers.) Dumort. и др. (всего 17 секций).
В настоящее время молекулярно-генетические методы признаны наиболее объективными методами систематики. Однако окончательная оценка созданных с их помощью новых молекулярно-филогенетических систем различных таксонов растений достигается лишь при их сопоставлении с данными других ботанических дисциплин (морфологии, анатомии, эмбриологии и т.д.). Морфология (в широком понимании) “… должна служить инструментарием для распознавания недостатков в молекулярных классификациях, и наоборот” (“Morphology must serve as a tool of recognition of weaknesses in moleclular classifications and vice versa”; Deep morphology …, 2003: Weber: P. 17).
К числу важнейших признаков, традиционно используемых в систематике растений, относятся характеристики развития семени, а также строение зрелого семени и анатомия его семенной кожуры. Согласно большинству сводок по сравнительной эмбриологии и анатомии семян сем. Euphorbiaceae, различия между видами рода Euphorbia по признакам развития семени выражены незначительно; более существенны различия в строении семенной кожуры (Corner, 1976; Batygina, Kolesova, 1983; Komar, 1992; Kapil, Bhatnagar, 1994; Tokuoka, Tobe, 1995, 2002; Kamelina, 2009, и др.). При этом, согласно обобщениям Т. Tokuoka и Н. Tobe (2002), наиболее полезными для систематики рода Euphorbia являются, вероятно, такие признаки как толщина интегументов и наличие/отсутствие карункулы, но главным образом – толщина внутреннего интегумента. Следует, однако, отметить, что полноценное сравнение признаков развития семени у видов рода Euphorbia и его подрода Esula ограничивается их относительно слабой изученностью в этом отношении (из примерно 2000 видов рода Euphorbia изучено не более 50, а из 480 видов подрода Esula – не более 20). Кроме того, данные авторов не всегда сопоставимы – часто исследованы лишь отдельные процессы или признаки.
Проведенное нами исследование развития семени у 7 видов из секций Helioscopia и Esula подрода Esula, относящихся к двум крупным продвинутым кладам его молекулярно-филогенетического древа (кладам I и II, соответственно) и занимающих наиболее удаленное от его основания положение, позволило существенно дополнить эмбриологическую характеристику рода Euphorbia, а также список признаков, полезных для его систематики (Titova et al., 2018а). В частности, было показано, что виды секций Helioscopia и Esula различаются по массивности структур семени (нуцеллуса, тегмена, эндопахихалазы), степени развития системы постхалазального ветвления проводящего пучка рафе, а также особенностям специализации клеток тесты (наличие/отсутствие в них сферокристаллов). При этом наличие эндопахихалазы и системы постхалазального ветвления проводящего пучка (хотя и находящихся в разной степени редукции) у видов рода Euphorbia было отмечено впервые: согласно некоторым авторам (Сorner, 1976; Tokuoka, Tobe, 1995, 2002), пахихалазия и наличие сосудистых пучков в интегументах и нуцеллусе для видов этого рода не характерны. Также нами (Titova et al., 2018а) была выявлена корреляция между степенью развития системы постхалазального ветвления проводящего пучка рафе (глубиной проникновения его окончаний в структуры халазальной части семени), степенью накопления в клетках нуцеллуса и тесты особых сферических включений, а также последующим образованием в клетках зрелой тесты сферокристаллов11.
На основании обобщения полученных данных нами была предложена гипотеза об основных различиях между видами двух крупных клад подрода Esula рода Euphorbia, а также возможных причинах их возникновения. В частности было предположено, что основные различия между видами клад I и II состоят в степени массивности структур их семени, а также в особенностях развития эндопахихалазы и системы постхалазального ветвления проводящего пучка рафе, обусловливающих различия в структуре клеток тесты (наличие/отсутствие сферокристаллов). Более мощное развитие эндопахихалазы у видов клады I, сопровождающееся проникновением окончаний проводящего пучка в подиум нуцеллуса (в виде специфических клеток – предположительно млечников или флоэмы) и обеспечивающее интенсификацию транспорта веществ к зародышевому мешку, зародышу и эндосперму, вероятно, приводит к избыточному накоплению продуктов метаболизма семени в нуцеллусе. В ходе эволюции, для преодоления негативного действия этих веществ на эндосперм и зародыш, у видов клады II произошла значительная редукция эндопахихалазы и системы постхалазального ветвления семени (блокирование вхождения окончаний проводящего пучка на уровне гипостазы и их проникновения в подиум). Следствием этого является преимущественное накопление продуктов метаболизма в клетках тесты – в виде особых сферических включений, преобразующихся на поздних стадиях развития в сферокристаллы, а у ряда видов – их последующее выведение на поверхность семени через систему “поверхностных межклетников” (Titova et al., 2018а).
Для проверки предложенной гипотезы необходимо дальнейшее исследование развития семязачатка и семени у видов разных секций подрода Esula, особенно лежащих вблизи основания его молекулярно-филогенетического древа, в частности, базальной секции Lathyris и расположенных близко к ней секций Holophyllum (клада I) и Myrsiniteae (клада II), данные по которым практически отсутствуют в литературе. Исключение составляют лишь отдельные сведения по E. lathyris Dumort. и E. myrsinites L., главным образом в работах ранних авторов (Mandl, 1926; Schweiger, I905, и др.).
Цель настоящей работы состояла в анализе развития семени у Euphorbia lathyris Dumort., E. komaroviana Prokh. и E. myrsinites L. (секции Lathyris, Holophyllum, и Myrsiniteae соответственно), в сравнении с изученными ранее видами секций Helioscopia и Esula (с особым акцентом на морфогенетические корреляции в развитии структур). Предварительное сообщение по развитию семени E. lathyris сделано нами ранее (Titova et al., 2018b); данная работа направлена на более детальный анализ этого процесса.
МАТЕРИАЛ И МЕТОДЫ
Материал по Euphorbia komaroviana и E. myrsinites собирали в условиях естественного произрастания (окр. Ботанического сада-института ДВО РАН и Никитского Ботанического сада, г. Ялта, Крым, соответственно, апрель-июнь 2015 г.); по E. lathyris (и дополнительно по E. myrsinites) – в условиях интродукции на территории Перкальского дендрологического парка (Эколого-ботанической станции “Пятигорск”) Ботанического института им. В.Л. Комарова РАН, в г. Пятигорске и Ботанического сада Петра Великого БИН РАН (июнь-август 2016 и 2017 гг.). Для эмбриологических целей материал фиксировали в смеси FAA. Постоянные препараты изготавливали по общепринятой цитоэмбриологической методике (Pausheva, 1980). Срезы толщиной 12 мкм окрашивали сафранином и алциановым синим; анализ препаратов и микрофотосъемку осуществляли на световом микроскопе Axioplan 2с ПО AxioVision (Carl Zeiss, Germany). Тонкие детали строения семенной кожуры выявляли с помощью сканирующего электронного микроскопа JSM-6390 LA (“Jeol Ltd”, Japan) и трансмиссионного электронного микроскопа Libra 120 (“Zeiss”, Germany) Центра коллективного пользования научным оборудованием БИН РАН. Для анализа с помощью СЭМ образцы напыляли смесью палладия с золотом. Для анализа с помощью ТЭМ материал фиксировали в смеси глутаральдегид-формальдегид на 0.1 М фосфатном буфере (рН 7.4), промывали фосфатным буфером и дофиксировали 2% четырехокисью осмия; обезвоживали в серии ацетонов возрастающих концентраций (от 30 до 100%) и заливали в смесь эпона и аралдита; полутонкие (0.5–4.0 мкм) и ультратонкие (60 нм) срезы получали на ультрамикротоме Ultracat E (Reichert-Jung, Vienna); полутонкие срезы окрашивали толуидиновым синим О, ультратонкие – цитратом свинца.
РЕЗУЛЬТАТЫ
Гинецей у Euphorbia lathyris, E. komaroviana и E. myrsinites синкарпный, из 3 плодолистиков – как и у исследованных нами ранее видов секций Esula и Helioscopia подрода Esula рода Euphorbia. В каждом гнезде их 3-гнездной завязи формируется по одному семязачатку, который к моменту опыления расположен на верхушке центрального колончатого выроста плаценты вблизи массивного плацентарного обтуратора. Сформированные семязачатки гемитропные, крассинуцеллятные, битегмальные, с коротким фуникулусом (1–2 слоя клеток); ось микропиле–халаза ориентирована под углом ~ в 25° к плаценте и в области микропиле слегка изогнута в направлении обтуратора (рис. 1, 1–3; табл. I, 1, 3, 5).
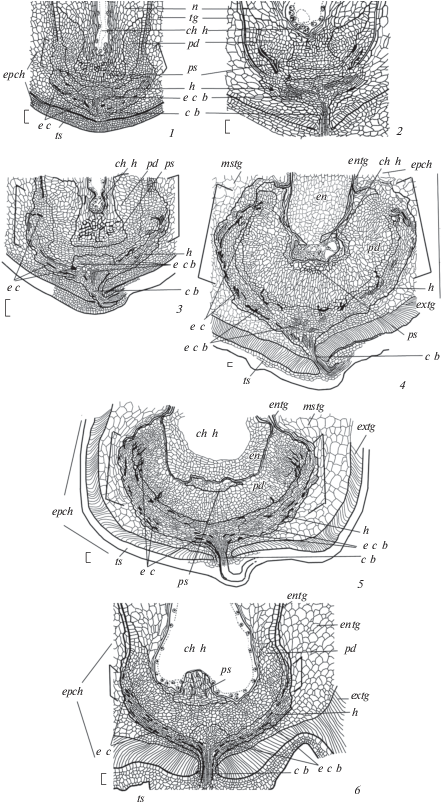
Рис. 1.
Строение сформированного семязачатка, его нуцеллуса и халазы у Euphorbia lathyris (1, 4), E. komaroviana (2, 5) и E. myrsinites (3, 6).
1–3 – строение семязачатка схематизировано, 4–6 – зональность строения нуцеллуса и халазы семязачатка, продольные срезы; а – антиподы, с – карункула, c b – проводящий пучок рафе, epch – эндопахихилаза, e а – яйцевой аппарат, e s – зародышевый мешок, h – гипостаза, i i – внутренний интегумент, n – нуцеллус, n b – нуцеллярный клюв, n с – нуцеллярный колпачок, о – обтуратор, o i – наружный интегумент, p – перикарпий, pd – подиум, ps – постамент, p n – полярные ядра, p t – париетальная ткань, скобками показана вставка клеток в основании внутреннего интегумента и нуцеллуса (объяснения в тексте). Масштабная линейка, мкм: 1–3 – 100, 4–6 – 50.
Fig. 1. The structure of formed ovule, its nucellus and chalaza in Euphorbia lathyris (1, 4), E. komaroviana (2, 5) and E. myrsinites (3, 6).
1–3 – the structure of ovule, schematized, 4–6 – structural zonality of its nucellus and chalaza, longitudinal sections; а – antipodals, с – caruncle, c b – conductive bundle of raphe, epch – endopachyhalaza, e а – egg apparatus, e s – embryo sac, h – hypostase, i i – inner integument, n – nucellus, n b – nucellar beak, n с – nucellar cap, о – obturator, o i – outer integument, p – pericarpium, pd – podium, ps – postament, p n – polar nuclei, p t – parietal tissue, brackets shows the cell insertion in the bases of nucellus and inner integument (see the text for explanations). Scale bars, µm: 1–3 – 100, 4–6 – 50.
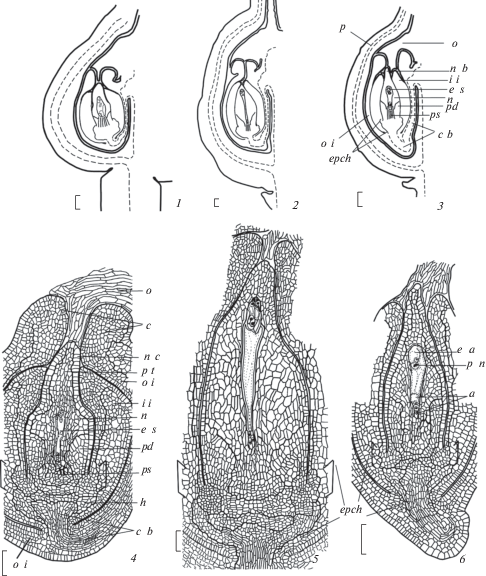
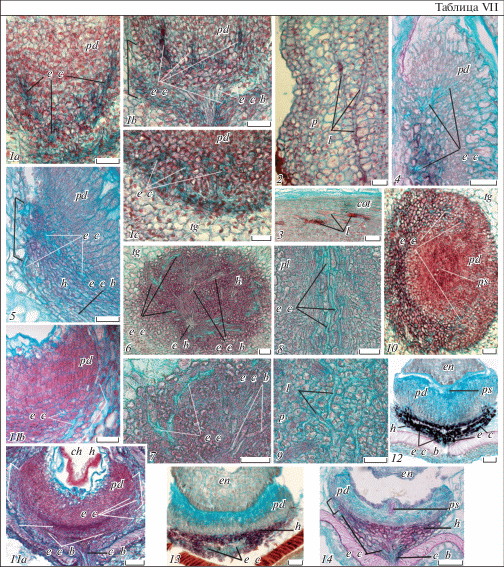
Таблица I. Строение семязачатка, зародышевого мешка и интегументов у Euphorbia lathyris (1–2d), E. komaroviana (3–4c, 8) и E. myrsinites (5–6b, 9), продольные срезы.
1, 3, 5 – семязачаток, 2а–d, 4a–c, 6a–b – зародышевый мешок; 7–9 – интегументы (2a–d – последовательные срезы, иллюстрирующие строение элементов зародышевого мешка (на дет. 2с и 2d виден дегенерирующий дополнительный зародышевый мешок; 4b, с – фрагменты зародышевого мешка E. komaroviana с 3 линейными (4b) или T-образными (4с) антиподами; 6c – аналогичный фрагмент с линейными антиподами E. myrsinites); a – антиподы, a e s – дополнительный зародышевый мешок, с – карункула, c b – проводящий пучок, e c – яйцеклетка, e s – зародышевый мешок, i i – внутренний интегумент, h – гипостаза, m e s – основной зародышевый мешок, n – нуцеллус, n b – нуцеллярный клюв, n c – нуцеллярный колпачок, о – обтуратор, o i – наружный интегумент, p – перикарпий, pd – подиум, ps – постамент, p n – полярные ядра, p t – париетальная ткань, s – синергиды, s i – сферические включения (объяснения в тексте). Масштабная линейка, мкм: 1, 3, 5 – 100, 2a–d, 4a–c, 6a–9 – 50.
Plate I . Structure of ovule, embryo sac and integuments in Euphorbia lathyris (1–2d), E. komaroviana (3–4c, 8) and E. myrsinites (5–6b, 9), longitudinal sections.
1, 3, 5 – ovules, 2а–d, 4a–c, 6a–b – embryo sacs, 7–9 – integuments (2a–d – successive sections to illustrate the structure of embryo sac elements, the degenerating additional embryo sac is observed on the details 2с and 2d; 4b, с – the fragments of the embryo sac of E. komaroviana with 3 linear (4b) or T-shaped (4с) antipodals; 6c – similar fragment with 3 linear antipodals in E. myrsinites); a – antipodals, a e s – additional embryo sac, с – caruncle, c b – conductive bundle, e c – egg cell, e s – embryo sac, i i – inner integument, h – hypostase, m e s – main embryo sac, n – nucellus, n b – nucellar beak, о – obturator, o i – outer integument, p – pericarpium, pd – podium, ps – postament, p n – polar nuclei, p t – parietal tissue, s – sinergids, s i – sphaerical inclusions (see the text for explanations). Scale bar, µm: 1, 3, 5 – 100, 2a–d, 4a–c, 6a–9 – 50.
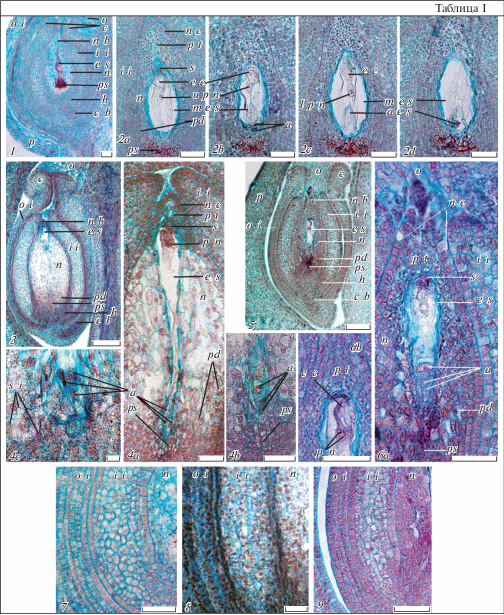
Зародышевый мешок у всех трех видов 7-клеточный 8-ядерный, состоит из яйцевого аппарата (яйцеклетка и две синергиды с типичной полярной организацией), центральной клетки с двумя не слитыми полярными ядрами (в контакте друг с другом вблизи яйцевого аппарата) и трех клеток антипод. В семязачатках Е. lathyris обычно присутствуют несколько зародышевых мешков – один развитый, округлой формы, с полностью сформированными элементами, и два недоразвитых. Недоразвитые мешки могут находиться на разных стадиях развития, например, на стадии 4-ядерного ценоцита (см. Titova et al., 2018b) или в состоянии почти полной деструкции. Антиподы в развитом зародышевом мешке также быстро дегенерируют (табл. I, 2a–d). Сформированные семязачатки E. komaroviana и E. myrsinites наоборот, содержат единственный зародышевый мешок удлиненной формы с функциональными клетками вакуолизированных антипод (табл. I, 4а–b, 6a, b). По литературным данным, развитие зародышевого мешка Е. lathyris происходит по моноспорическому Polygonum-типу (Modilewski, 1911); развитие зародышевого мешка у E. komaroviana и E. myrsinites не изучено.
Зональность строения нуцеллуса в сформированных семязачатках E. lathyris, E. komaroviana и E. myrsinites во многом сходна с таковой других изученных нами видов подрода Esula (Titova et al., 2018а). Это сходство проявляется в дифференциации в апикальной части их нуцеллуса хорошо выраженной клювовидной структуры (париетальная ткань и нуцеллярный колпачок), а в его базальной части – массивного подиума и постамента. Клетки париетальной ткани также расположены столбцами над микропилярным полюсом зародышевого мешка и покрыты с поверхности клетками 1–3-слойного нуцеллярного колпачка – продукта периклинальных делений клеток эпидермы апикальной части нуцеллуса. Для средней части нуцеллуса также характерно наличие четких рядов вакуолизированных клеток, ориентированных в направлении от эпидермы к халазальному концу зародышевого мешка и постаменту. Подиум бокаловидный, состоит из мелких, активно делящихся клеток с плотной цитоплазмой, отличающихся от остальных клеток нуцеллуса более интенсивной окраской сафранином. Колонковидный постамент, в который погружен халазальный конец зародышевого мешка, состоит из осевого ряда клеток – в нижней части таблитчатых, а в верхней части (возле антипод) – удлиненных (рис. 1, 4–6; табл. I, 1–6b). Клеткам нуцеллуса этих видов также свойственно накопление многочисленных сферических включений. Этот процесс наиболее выражен в клетках париетальной ткани E. myrsinites (табл. I, 6a) и, особенно, у E. lathyris, у которого они имеют особо крупные размеры (табл. I, 2a, c). Для E. komaroviana характерно накопление сферических тел и в клетках постамента, что не свойственно этой стадии развития другим исследованным нами видам. Отличительной чертой этого вида также является отсутствие окрашивания сафранином оболочек лизирующих клеток его постамента (в области прилегания к зародышевому мешку) в ярко-красный цвет (табл. I, 4b, c), характерного для E. lathyris, E. myrsinites (табл. I, 1, 2с, 5, 6а) и видов секций Esula и Helioscopia.
Наружный интегумент у E. lathyris, E. komaroviana и E. myrsinites устроен одинаково. Он 4-слойный в средней части, 5–7-слойный в базальной части и более многослойный в апикальной части (в области формирования карункулы, рост в ширину которой происходит за счет периклинальных делений клеток внутренней эпидермы). Внутренний интегумент 7–8-слойный в средней части, однако, у Е. lathyris и E. komaroviana несколько более массивный в базальной части (до 11 слоев). Для клеток внутренней эпидермы внутреннего интегумента (как и для эпидермы нуцеллуса) также характерны периклинальные деления, за счет которых происходит его рост в толщину, в отличие от клеток его наружной эпидермы, делящихся лишь антиклинально и уже на этой стадии выделяющихся столбчатой формой и плотной цитоплазмой. Рост наружного интегумента в длину, особенно в апикальной части, преобладает с антирафальной стороны, в результате чего он слегка обрастает нуцеллярный клюв, формируя экзостом, ориентированный к плацентарному обтуратору. Клетки обтуратора врастают в экзостом, контактируя с нуцеллярным клювом. Внутренний интегумент короче наружного и на стадии семязачатка не участвует в формировании микропиле (строение семязачатка у E. komaroviana удалось наблюдать лишь в прогамной фазе, когда интегумент уже обрастал нуцеллярный клюв, образуя эндостом) (табл. I, 1, 3, 5, 7–9).
Халаза семязачатка всех трех видов имеет необычное строение, обладая нетипичным положением окончания проводящего пучка рафе и гипостазы – как и у остальных исследованных видов рода Euphorbia и сем. Euphorbiaceae (Corner, 1976; Bor, Bouman, 1974; Boesewinkel, Bouman, 1984). Массивный проводящий пучок рафе их семязачатка входит в относительно широкое основание наружного интегумента и далее – в узкое основание внутреннего интегумента (“гетеропиле”), куда смещена и чашевидная гипостаза, ограничивающая здесь лишь основание (подиум) нуцеллуса. На этой стадии развития в проводящем пучке рафе у исследованных нами видов уже присутствуют дифференцированные элементы ксилемы, тогда как на уровне внутреннего интегумента и гипостазы его окончания представлены лишь клетками прокамбия. Клетки прокамбия вместе с клетками гипостазы слегка заходят в основание внутреннего интегумента, где находятся в контакте с периклинально делящимися клетками его внутренней эпидермы, а также наружной эпидермы основания нуцеллуса. При этом в результате этих делений также образуется небольшая вставка клеток, распространяющаяся между гипостазой и подиумом нуцеллуса. Меристематические клетки этой вставки в совокупности с тонкостенными таблитчатыми клетками гипостазы и пронизывающими ее клетками прокамбия образуют единое целое – халазу, имеющую на этой стадии лишь отчетливые внешние границы. Однако, несмотря на значительное сходство строения, халазальная часть семязачатков E. lathyris, E. komaroviana и E. myrsinites различается по массивности составляющих ее структур. В частности, семязачатки E. lathyris и E. komaroviana имеют более многослойные нуцеллус и халазу, чем E. myrsinites. Их подиум достигает 10–12, постамент – до 10 и халаза – до 13 слоев клеток в высоту (включая 5–6-слойную гипостазу и вставку клеток между гипостазой и подиумом) (рис. 1, 4, 5; табл. II, 1, III, 1). В отличие от этого, у E. myrsinites эти структуры менее развиты: подиум – до 7–8, постамент – до 7–8 и халаза – до 10 слоев клеток в высоту (включая 3–4-слойную гипостазу и вставку клеток между гипостазой и подиумом) (рис. 1, 6; табл. IV, 1). Таким образом, по приведенным выше показателям E. lathyris и E. komaroviana достаточно близки к видам секции Helioscopia (клада II), тогда как E. myrsinites – к видам секции Esula (клада II). Определенное исключение составляет париетальная ткань, массивность которой у всех трех видов примерно одинакова (около 12 слоев в высоту) и близка к таковой видов секции Helioscopia (у видов секции Esula париетальная ткань к моменту опыления значительно тоньше – 5–6 слоев клеток в высоту).
Таблица II. Развитие халазы в семени Euphorbia lathyris.
1–7 – строение халазы в семязачатке (1) и на стадиях проэмбрио (2), глобулярного (3, 4а–b), сердечковидного (5, 6) и торпедовидного зародыша (6); 1–3, 5–7 – продольные срезы в дорсовентральной плоскости, 4а – в билатеральной, 4b – поперечный срез (на дет. 4a и 4b видно начало проникновения специфических клеток окончаний проводящих пучков в подиум; 6 – фрагмент подиума с тяжами специфических клеток; на дет. 7 видно погружение эндосперма в эндопахихалазу). e c b – окончания проводящего пучка, epch – эндопахихалаза, e c – особые клетки окончаний проводящего пучка, ch h – халазальный гаусторий эндосперма, en – эндосперм, tg – тегмен, ts – теста, скобками выделена вставка клеток между подиумом и гипостазой, остальные обозначения те же, что и на табл. I (объяснения в тексте). Масштабная линейка – 50 мкм.
Plate II . Development of chalaza in Euphorbia lathyris seed.
1–7 – chalaza structure in ovule (1) and at the stages of proembryo (2), globular (3, 4а–b), heart-shaped (5, 6) and torpedo-shaped embryo (6); 1–3, 5–7 – longitudinal sections in dorsoventral plane, 4а – in bilateral one, 4b – cross section (the beginning of entering the especial cells of conductive bundle endings into nucellar podium is observed on the details 4а and 4b; 6 – podium fragment with especial cells; detail 7 shows the sinking of endosperm in endopahychalaza). e c b – endings of conductive bundle, epch – endopachychalaza, e c – especial cell of conductive bundle endings, ch h – chalazal haustorium of endosperm, en – endosperm, tg – tegmen, ts – testa, brackets show the cell insertion between podium and hypostase; for the other designations see Plate I (see the text for explanations). Scale bar – 50 µm.
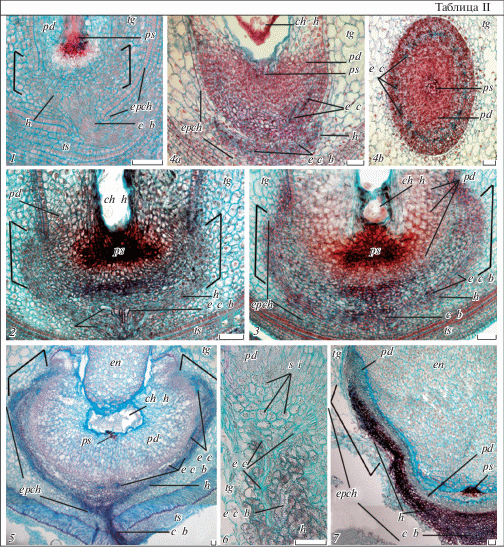
Таблица III. Развитие халазы в семени Euphorbia komaroviana.
1–6 – строение халазы в семязачатке (1) и на стадиях проэмбрио (2), глобулярного (3, 4a–c), сердечковидного (5a, b) и торпедовидного (6) зародыша; 1–3, 5–6 – продольные, 4a–b – поперечные срезы (4b, 5b – фрагменты подиума и гипостазы с проникающими в них специфическими клетками окончаний проводящих пучков, 4с – клетки подиума со сферическими включениями; на дет. 6 видно погружение эндосперма в эндопахихалазу). Обозначения те же, что и на табл. I и II (объяснения в тексте). Масштабная линейка – 50 мкм.
Plate III . Development of chalaza in Euphorbia komaroviana seed.
1–6 – chalaza structure in ovule (1) and at the stages of proembryo (2), globular (3, 4а–с), heart-shaped (5a, b) and torpedo-shaped (6) embryo; 1–3, 5–6 – longitudinal sections, 4a–b – cross sections (4а, 5b – fragments of nucellar podium and hypostase with penetrating especial cells of conductive bundle endings; 4с – podium cells with spherical inclusions; the sinking of endosperm in endopahychalaza is observed on the detail 6). For designations see Plates I and II (see the text for explanations). Scale bar – 50 µm.
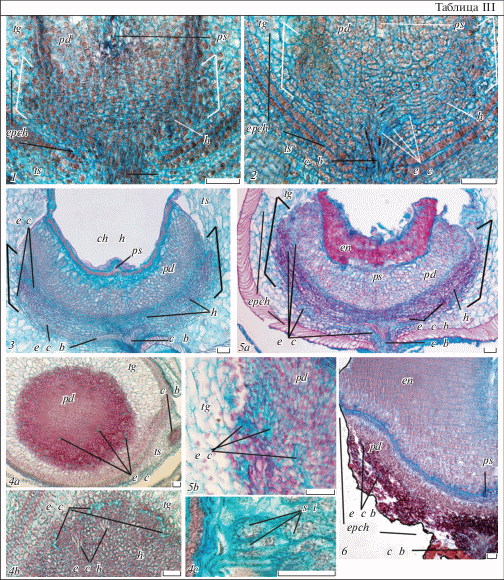
В ходе прогамной фазы у всех трех видов происходит рост пыльцевых трубок по проводниковому тракту столбика и их вхождение в микропиле семязачатков (порогамия). Пыльцевая трубка проникает в одну из синергид, которая подвергается дегенерации (табл. V, 1a, b; VI, 1a–c). Слияние полярных ядер происходит в процессе оплодотворения (табл. IV, 2a–c); первичная клетка эндосперма делится раньше зиготы, полностью окруженной полисахаридной оболочкой; у E. komaroviana и E. myrsinites с узким зародышевым мешком производные этого деления расходятся в направлении его полюсов (табл. V, 1a; VI, 1a, b; IV, 3a–c). Отличительной особенностью E. lathyris является длительное сохранение пыльцевой трубки в синергиде, которую можно наблюдать даже на стадии позднего проэмбрио при отделении в нем инициалей протодермы (табл. V, 2a). Кроме того, для этого вида характерно более медленное обрастание внутренним интегументом массивного нуцеллярного клюва, которое завершается лишь на стадии зиготы (табл. V, 1a), тогда как у остальных видов – уже в прогамной фазе (табл. IV, 2a, c; VI, 1a). E. komaroviana и E. myrsinites свойственно длительное функционирование антипод: у E. komaroviana их остатки еще заметны на первых этапах развития эндосперма (табл. VI, 1b), а у E. myrsinites отмечается увеличение их числа (до 4–5 клеток) и затем деструкция (табл. IV, 2b, d, 3b).
Таблица IV. Строение структур семени Euphorbia myrsinites на разных стадиях развития.
1 – халазальная часть семязачатка; 2а–3с – нуцеллус и халаза на стадии зиготы (на дет. 2a и 3а видна зигота, 2с – синергиды и сливающиеся полярные ядра, 3b – два первых ядра эндосперма; дет. 2d и 3с иллюстрируют увеличение числа антипод в ходе оплодотворения и их лизис в ходе деления первичной клетки эндосперма); 4a–7с – фрагменты микропилярной и халазальной части семени на стадиях проэмбрио (4a–b), глобулярного (5a–6b), сердечковидного (7a–с) и торпедовидного (8, 9) зародыша (на дет. 6b видны включения в клетках подиума, дет. 8, 9 иллюстрируют фрагмент эндопахихалазы с отсутствием погружения в нее эндосперма (8) и случаи проникновения специфических клеток в подиум (9)); 10a–c – внешний вид зрелого зародыша и его строение на срезах в семядольной и межсемядольной плоскостях. e – зародыш, en n – ядра эндосперма, z – зигота, остальные обозначения те же, что и на табл. I–III (объяснения в тексте). Масштабная линейка, мкм: 1–6b, 7c–9 – 50, 7a–b, 10b–c – 100, 10a – 500.
Plate IV . Seed structure of Euphorbia myrsinites at different stages of its development
1 – chalazal part of ovule; 2а–3с – nucellus and chalaza at the stage of zygote (zygote is observed on the details 2a and 3а, sinergids and fusing polar nuclei – on detail 2с, two first endosperm nuclei – on detail 3b; the details 2d и 3с illustrate the increase of antipodals number during fertilization and their lysis during primary endosperm cell division); 4a–7с – fragments of mycropylar and chalazal seed parts at the stages of proembryo (4a–b), globular (5a–6b), heart-shaped (7a–с) and torpedo-shaped (8, 9) embryo (inclusions in the podium cells are observed on the detail 6b; the details 8 and 9 show the fragment of endopachychalaza without sinking endosperm (8) and the cases of penetration of especial cells into nucellar podium (9)); 10a–c – outer view of mature embryo and its structure on the sections in the cotyledonary and intracotyledonary planes. e – embryo, en n – endosperm nuclei, z – zygote; for the other designations see Plates I–III (see the text for explanations). Scale bars, µm: 1–6b, 7c–9 – 50, 7a–b, 10b–c – 100, 10a – 500.
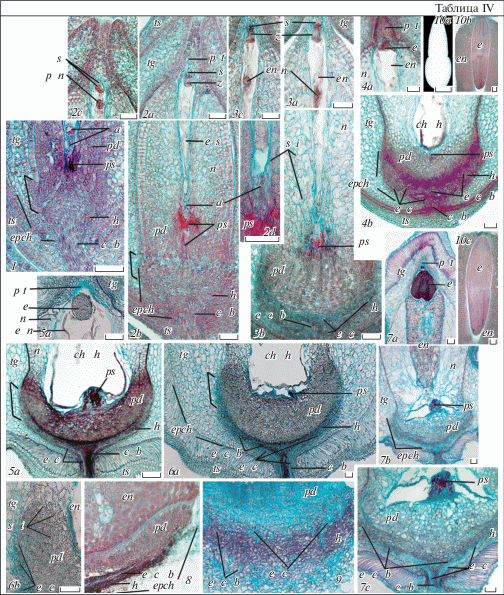
Таблица V. Развитие эндосперма и зародыша у Euphorbia lathyris.
1a–5b – строение эндосперма на стадиях зиготы (1a, b), проэмбрио (2a, b), глобулярного (3a, b), сердечковидного (4a, b, d) и торпедовидного (5а, b) зародыша (2a, 3a, 4a, 5a – микропилярная, 2b, 3b, 4b, 5b – халазальная часть эндосперма; на дет. 1b и 2а видна сохраняющаяся пыльцевая трубка в синергиде, на дет. 4d – задержка клеткообразования в халазальном гаустории эндосперма); 4с, 5а, 6a, b – строение сердечковидного (4с), торпедовидного (5а) и зрелого зародыша (6a, b), продольные срезы. p tb – пыльцевая трубка, остальные обозначения те же, что и на табл. I–IV (объяснения в тексте). Масштабная линейка, мкм: 1a–5b, 6b – 50, 6a – 500.
Plate V . Endosperm and embryo development in Euphorbia lathyris.
1a–5b – endosperm structure at the stages of zygote (1a, b), proembryo (2a, b), globular (3a, b), heart-shaped (4a, b, d) and torpedo-shaped (5а, b) embryo (2a, 3a, 4a, 5a – micropylar, 2b, 3b, 4b, 5b – chalazal part of the endosperm; the details 1b and 2а illustrate preserving pollen tube in sinergid, the detail 4d – delay of cell formation in the endosperm chalazal haustorium); 4с, 5а, 6a, b – the structure of heart-shaped (4с), torpedo-shaped (5а) and mature embryo (6a, b). p tb – pollen tube; for the other designations see Plates I–IV (explanations see in the text). Scale bar, µm: 1a–5b, 6b – 50, 6a – 500.
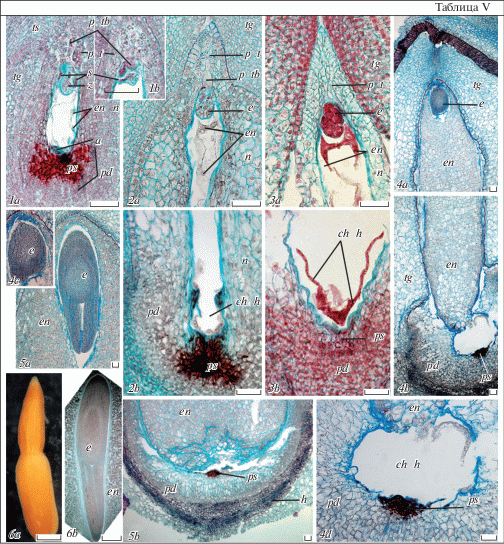
Развитие семени у E. lathyris, E. komaroviana и E. myrsinites по многим характеристикам сходно с таковым изученных нами видов секций Esula и Helioscopia подрода Esula (Titova et al., 2018а). В ходе этого процесса у всех трех видов также происходит дальнейшее искривление оси микропиле–халаза: вследствие преобладания роста структур с антирафальной стороны семена становятся геми-кампилотропными, а затем – кампилотропными (легкий изгиб нуцеллуса, эндосперма и зародыша). Также происходит полное обрастание внутренним интегументом нуцеллярного клюва с образованием эндостома, а наружным интегументом – внутреннего интегумента, с окончательным формированием в его апикальной части карункулы. При этом более сильный рост наружного интегумента в длину с антирафальной стороны приводит к еще большему смещению экзостома к плаценте, вследствие чего микропиле становится зигзагообразным. Всем трем видам также свойственно формирование дифференцированного на органы зародыша и массивного эндосперма. Эмбриогенез включает стадии зиготы, проэмбрио, глобулярного, сердечковидного, торпедовидного и морфологически сформированного зародыша. Интегументы после оплодотворения также преобразуются в тесту и тегмен, входящие в состав кожуры зрелого семени (рис. 2, 1a–3e).
Рис. 2.
Развитие семени у Euphorbia lathyris (1a–e), E. komaroviana (2a–e) и E. myrsinites (3a–e), продольные срезы, схематизировано.
1a–3e – строение семени на стадиях зиготы (1a, 2a, 3a), проэмбрио–ранне-глобулярного (1b, 2b, 3b), сердечковидного (1c, 2c, 3c), торпедовидного (1d, 2d, 3d) и морфологически сформированного зародыша (1e, 2e, 3e); e – зародыш, en – эндосперм, entg – эндотегмен, extg – экзотегмен, e c – специфические клетки окончаний проводящего пучка рафе, m – микропиле, tg – тегмен, ts – теста; стрелкой показано направление искривления оси микропиле-халаза относительно плаценты; остальные обозначения те же, что и на рис. 1 (объяснения в тексте). Масштабная линейка – 100 мкм.
Fig. 2. Seed development in Euphorbia lathyris (1a–e), E. komaroviana (2a–e) and E. myrsinites (3a–e), longitudinal sections, schematized.
1a–3e – the seed structure at the stages of zygote (1a, 2a, 3a), proembryo: early-globular (1b, 2b, 3b), heart-shaped (1c, 2c, 3c), torpedo-shaped (1d, 2d, 3d), and morphologically formed embryo (1e, 2e, 3e); e – embryo, en – endosperm, entg – endotegmen, extg – exotegmen, e c – especial cells of the raphe conductive endings, m – micropyle, tg – tegmen, ts – testa; for the other designations see Fig. 1. The arrow signs the direction of the micropyle-chalaza axis curving (see the text for explanations). Scale bar – 100 µm.
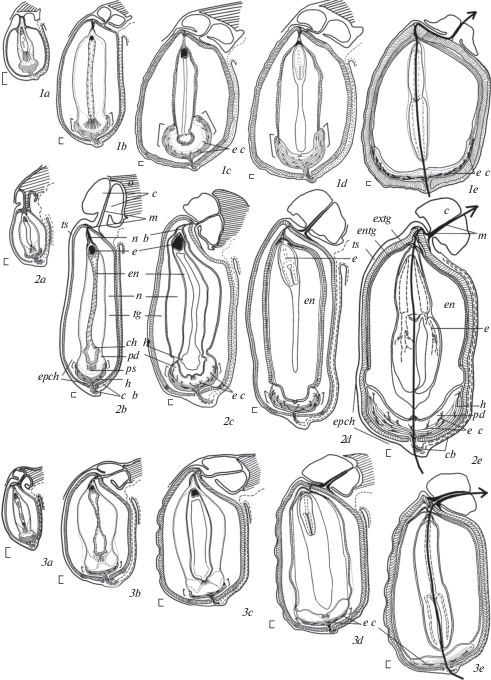
Эндоспермогенез нуклеарного типа и в целом характеризуется теми же общими закономерностями, что и у видов секций Esula и Helioscopia. Это проявляется в расширении микропилярной и халазальной частей эндоспермального ценоцита со стадии проэмбрио (табл. IV, 4a, b; V, 2a, b, 3a, b; VI, 2a, b), развитии гаусториальной активности его халазального конца, переходе эндосперма к клеткообразованию на стадии глобулярного зародыша и далее (на стадиях сердечковидного и торпедовидного зародыша) – постепенном заполнении эндосперма клетками и аккумуляции в них запасных веществ (табл. IV, 7a, b, 8, 10b, c; V, 4a, b, 5a, b, 6b; VI, 5a–c, 6b, c). В то же время, развитие эндосперма у E. lathyris и E. komaroviana характеризуется рядом специфических черт. В частности, для них характерно формирование особо крупного, пузыревидного халазального гаустория, значительно обособленного от остальной части эндосперма. При этом клеткообразование в этой части эндосперма также идет с задержкой (табл. V, 4a, b, d; VI, 2a, b). У E. komaroviana форма халазального гаустория в процессе развития становится еще более специализированной. Начиная со стадии проэмбрио, нижняя часть его пузыревидного расширения, в пристенном слое плотной цитоплазмы которого сосредоточено большое количество ядер, становится уплощенной, а по всей его поверхности формируются клиновидные выросты в ткань прилегающего постамента (табл. VI, 3a–c), как и у изученных нами ранее видов секции Helioscopia. На стадии глобулярного зародыша, при инициации образования клеток в средней части эндосперма, уплощенная нижняя часть гаустория E. komaroviana по-прежнему содержит плотную цитоплазму (с “цитоплазматическими шарами”) и задерживается в клеткообразовании. Эти же характеристки свойственны и микропилярной части эндосперма, в плотной цитоплазме которой также концентрируется большое количество ядер (табл. VI, 4a–f). На стадии сердечковидного зародыша гаусториальная часть эндосперма, полностью приобретающая клеточное строение, сохраняет свою своеобразную форму – округлую, расширенную в верхней части и сужающуюся, уплощенную в самой нижней части, что хорошо видно на продольных срезах этой части эндосперма (табл. VI, 5b, c). Развитие же халазального гаустория у E. myrsinites более сходно с таковым видов секции Esula: несмотря на несколько более крупные размеры, его форма является достаточно сглаженной; клиновидных врастаний гаустория в нуцеллус почти не наблюдается (табл. IV, 5b, 6a).
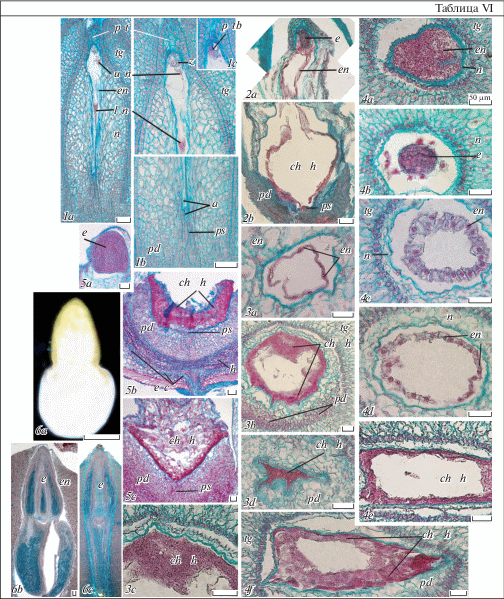
Таблица VI. Развитие эндосперма и зародыша у Euphorbia komaroviana.
1a–с – строение эндосперма на стадии зиготы (1a – общий вид эндосперма, 1b – его микропилярная и халазальная части увеличены, 1с – пыльцевая трубка в синергиде на следующем срезе); 2a–b, 5a–c – продольные срезы эндосперма на стадиях проэмбрио (2a–b) и сердечковидного (5a–c) зародыша, (2a, 5a – микропилярная часть эндосперма, 2b, 5b, 5c – его пузыревидный халазальный гаусторий; 5b, c – срезы гаустория в его центральной (5b) и боковой (5с) части); 3а–4f – поперечные срезы эндосперма на стадии проэмбрио (3а–d) и глобулярного (4а–f) зародыша (3a, 4a, b – срезы через микропилярную часть эндосперма, 3b–d, 4d–f – через его халазальный гаусторий; дет. 3с иллюстрирует плотную цитоплазму гаустория с большим числом ядер, 3d – его клиновидные выросты в нуцеллус, 4e, f – начало образования клеток в гаустории); 6a–с – внешний вид зрелого зародыша (6а) и его строение в межсемядольной (6b) и семядольной (6с) плоскости (виден легкий изгиб гипокотиля). l n – нижнее ядро эндосперма, u n – его верхнее ядро, остальные обозначения те же, что и на табл. I–V (объяснения в тексте). Масштабная линейка, мкм: 1a–5с – 50, 6a – 500, 6b, 6c – 100.
Plate VI . Endosperm and embryo development in Euphorbia komaroviana.
1a–с – endosperm structure at the stage of zygote (1a – geberal view of endosperm, 1b – its mycropylar and chalazal parts, magnified, 1с – pollen tube in sinergid on the next section); 2a–b, 5a–c – longitudinal sections of endosperm at the stage of proembryo (2a–b) and heart-shaped (5a–c) embryo (2a, 5a – micropylar part of the endosperm, 2b, 5b, 5c – its bubble-like chalazal haustorium; 5b, c – sections of haustorium in its central (5b) and lateral (5с) parts); 3а–4f – cross sections of endosperm at the stage of proembryo (3а–d) and globular (4а–f) embryo (3a, 4a, b – sections over the micropylar part of endosperm, 3b–d, 4d–f – over its chalazal haustorium; the detail 3с illustrates the dense cytoplasm of haustorium with numerous nuclei, 3d – its cuneate outgrowths into nucellus, 4e, f – the beginning of cell formation in haustorium); 6a–с – outer view of mature embryo (6а) and its structure on the sections in the intracotyledonary (6b) and cotyledonary (6с) planes (the light curve of hypocotyl is seen). l n – lower endosperm nucleus, u n – its upper nucleus, for the other designations see Plates I–V (see the text for explanations). Scale bar, µm: 1a–5с – 50, 6a – 500, 6b, 6c – 100.
Как и у видов секций Helioscopia и Esula, различия в характере развития эндосперма у E. lathyris и E. komaroviana, с одной стороны, и у E. myrsinites с другой, также коррелируют с различиями в характере развития окружающих его тканей нуцеллуса и халазы, хотя и несколько иным способом. Точно также развитие эндосперма у этих видов на стадиях проэмбрио и глобулярного зародыша сопровождается продолжающимся лизисом прилегающих к нему клеток нуцеллуса. Однако различия в поведении париетальной ткани существенно не выражены: у всех трех видов она остается одинаково массивной (до 12 слоев), длительно сохраняется (до стадии сердечковидного зародыша включительно), а в ее клетках постепенно исчезают сферические включения. При этом длительное функционирование париетальной ткани коррелирует со значительным увеличением размеров клеток местами двуслойной эпидермы нуцеллуса, что особенно характерно для E. lathyris и E. myrsinites (табл. IV, 2a, 3a, 4a, 7a; V, 2a, 3a, 4a; VI, 1a, 2a, 5a). Постамент у всех трех видов к стадии глобулярного зародыша значительно увеличивается в размерах, после чего подвергается деструкции (как и у видов секций Helioscopia и Esula). У E. lathyris он имеет особо крупные размеры и интенсивно окрашивается сафранином, у E. myrsinites окрашивается слабее, а у E. komaroviana – почти не окрашивается (табл. IV, 2b, d, 3b, 4b, 7b; V, 2b, 3b, 4b; VI, 1b, 2b, 5b, c).
Развитие эндосперма и изменения, наблюдаемые в нуцеллусе у E. lathyris, E. komaroviana и E. myrsinites сопровождаются определенными изменениями халазальной части семени, состоящими в продолжении периклинальных делений клеток гипостазы и, что особенно важно, клеток вставки в основании нуцеллуса и внутреннего интегумента (как и у видов секций Helioscopia и Esula). Эти процессы приводят к увеличению массивности халазы в целом и к меньшей длине тегмена со стороны нуцеллуса. У E. lathyris и E. komaroviana с крупным, обособленным гаусторием эндосперма деления клеток продолжаются вплоть до стадии сердечковидного зародыша (аналогично видам секции Helioscopia). Толщина их гипостазы к этой стадии достигает до 15 слоев клеток в высоту, вставки клеток – до 40 слоев (в латеральной части), подиума – до 20 и более слоев клеток в высоту. Одновременно с ростом массивности халазы и подиума нуцеллуса происходит проникновение в гипостазу и основание тегмена окончаний проводящего пучка рафе в виде дифференцирующихся элементов ксилемы и особых удлиненных клеток, оболочки которых интенсивно окрашиваются на полисахариды алциановым синим с образованием своеобразной системы постхалазального ветвления. А со стадии позднего проэмбрио – ранне-глобулярного зародыша (при отделении в нем инициалей протодермы) происходит проникновение этих клеток (без ксилемы) и в подиум нуцеллуса. При этом халаза E. lathyris и E. komaroviana характеризуется той же зональностью строения, что и у видов секции Helioscopia, а проникновение специфических клеток в подиум у этих видов также осуществляется в области расширяющейся вставки клеток между подиумом и гипостазой (рис. 3, 1–5; табл. II, 2–6; III, 2–5b). В отличие от этого, у E. myrsinites с менее обособленным гаусторием эндосперма, деления клеток продолжаются лишь до стадии глобулярного зародыша, а перечисленные структуры менее массивны. Толщина гипостазы достигает 8 слоев клеток, вставки клеток – до 15 (в латеральной части), подиума – до 10 слоев клеток в высоту. При этом у данного вида (как и у видов секции Esula) вхождения особых клеток в подиум почти не наблюдается. Несмотря на их обилие в проводящем пучке рафе в области гетеропиле, развитие их большей части, как правило, также блокируется на уровне гипостазы (рис. 3, 6; табл. IV, 3a–7c), хотя иногда наблюдалось незначительное проникновение этих клеток в подиум (табл. IV, 9).
Рис. 3.
Развитие зональности строения халазальной части семени у Euphorbia lathyris (1–4), E. komaroviana (5) и E. myrsinites (6).
1–4 – строение базальной части нуцеллуса и халазы семени E. lathyris на стадиях проэмбрио (1), глобулярного (2, 3) и сердечковидного зародыша (4) (2 – продольный срез халазы в дорсивентральном сечении, 3 – в билатеральном); 5, 6 – строение базальной части нуцеллуса и халазы семени E. komaroviana (5) и E. myrsinites (6) на стадии сердечковидного зародыша (продольныe срезы халазы в дорсивентральном сечении), e c b – окончания проводящего пучка, mstg – мезотегмен, скобками указана вставка клеток в основании тегмена и нуцеллуса остальные обозначения те же, что и на рис. 1 и 2 (объяснения в тексте). Масштабная линейка – 50 мкм.
Fig. 3. Development of structural zonality of seed chalazal part in Euphorbia lathyris (1–4), E. komaroviana (5) and E. myrsinites (6).
1–4 – the structure of the nucellus basal part and chalaza of E. lathyris seed at the stages of proembryo (1), globular (2, 3) and heart-shaped (4) embryo; 2 – longitudinal section of chalaza in the dorsoventral plane and 3 – in the bilateral one; 5, 6 – the structure of the nucellus basal part and chalaza of E. komaroviana (5) and E. myrsinites (6) seeds at the stage of heart-shaped embryo (longitudinal section of chalaza in the dorsoventral plane); e c b – endings of conductive bundle, mstg – mesotegmen; brackets show the cell insertion in the bases of nucellus and tegmen; for the other designations see Figs. 1 and 2 (see the text for explanations). Scale bar – 50 µm.
Таким образом, особенности развития халазы у E. lathyris, E. komaroviana и E. myrsinites позволяют определить ее как тегминальную пахихалазу (по Сorner, 1976), или эндопахихалазу (по Boesewinkel, Bouman, 1984), как и у изученных видов секций Helioscopia и Esula. При этом у E. lathyris и E. komaroviana эндопахихалаза является более развитой, чем у E. myrsinites, а по ряду признаков существенно отличается от остальных видов подрода Esula. Во-первых, из всех изученных видов, E. lathyris и E. komaroviana обладают наиболее массивной и глубокой эндопахихалазой вследствие образования наиболее многослойной вставки клеток в основании тегмена и нуцеллуса. Во-вторых, вследствие значительной глубины эндопахихалазы у этих видов, особенно у E. lathyris, большая часть их подиума оказывается погруженной внутрь этой структуры. В-третьих, формирование массивной эндопахихалазы коррелирует у этих видов с достаточно глубоким погружением в нее семядолей зародыша и эндосперма (после завершения в нем клеткоообразования): у E. lathyris – на две трети, а у E. komaroviana – на треть (табл. II, 7; III, 6). У E. myrsinites (табл. IV, 8) и остальных изученных видов данного подрода это погружение незначительно. В-четвертых, в отличие от видов секции Helioscopia, где тяжи специфических клеток окончаний проводящего пучка следуют или в латеральную часть подиума, или в постамент, у E. lathyris и E. komaroviana их проникновение в подиум происходит относительно равномерно, что, очевидно, связано со значительной массивностью их эндопахихалазы. Независимо от перечисленных различий, у всех видов клетки эндопахихалазы на поздних стадиях развития полностью заполняются танинами, что сопровождается окончательным лизисом подиума.
Особого внимания заслуживает строение специфических клеток, иннервирующих подиум нуцеллуса. Помимо характерного окрашивания их оболочек алциановым синим, следует также отметить, что тяжи этих клеток следуют вдоль проводящей системы семени, ветвятся, образуют анастомозы и очень напоминают млечники перикарпия и зародышей этих видов. Рост этих клеток, как и клеток млечников, осуществляется в акропетальном направлении и на ранних стадиях формирования плотная цитоплазма их растущих кончиков одинаково интенсивно окрашивается сафранином (табл. VII, 1a–3). По мере развития производные этих клеток (отделяющиеся базипетально) вытягиваются, становятся вакуолизированными и более окрашивающимися алциановым синим – как и более зрелые млечники перикарпия (табл. VII, 4–9). Однако, отличие этих клеток от млечников перикарпия молочаев состоит в том, что последние обычно являются нечленистыми, хотя сходные членистые клетки мы наблюдали и в области плацены завязи, например, у E. komaroviana (табл. VII, 8).
Таблица VII. Строение специфических клеток окончаний проводящего пучка рафе семени и млечников перикарпия у E. lathyris и E. komaroviana; вхождение этих клеток в структуры халазальной части семени у видов некоторых других секций подрода Esula.
1a–c, 2, 3 – специфические клетки окончаний проводящего пучка рафе на ранних стадиях проникновения в подиум нуцеллуса (1a–c) и развивающиеся млечники молодого перикарпия (2) и семядолей зародыша (3); 4–9 – специфические клетки в гипостазе, подиуме (4–7) и плаценте (8) и млечники перикарпия (9) на поздних стадиях развития (видно сходство строения обоих типов клеток по окраске, способности к ветвлению и анастомозированию) (1a–c, 2, 3, 4, 9 – E. lathyris, 5–8 – E. komaroviana); строение халазы в семени E. procera (10), E. rupestris (11a,b), E. paralias (12), E. stepposa (13) и E. peplus (14) (видно вхождение специфических клеток в массивную эндопахихалазу и подиум нуцеллуса у E. procera и E. rupestris). 1a, b, 2–5, 8, 9, 11a–14 – продольные срезы структур, 1с, 6, 7, 10 – поперечные срезы. l – млечники, pl – плацента, остальные обозначения те же, что и на табл. I–V (объяснения в тексте). Масштабная линейка, мкм: 1a–10, 11b–14 – 50, 11b – 100.
Plate VII . The structure of especial cells of raphe conductive bundle endings in seed and lacticifers of pericarpium in Euphorbia lathyris and E. komaroviana; the entering of these cells in the structures of seed chalazal part in the species of some other subgenus Esula sections.
1a–c, 2, 3 – especial cells of raphe conductive bundle endings at early stages of their entering in the nucellar podium (1a–c), and the developing lacticifers in young pericarpium (2) and embryo cotyledons (3); 4–9 – especial cells in hypostase, podium (4–7) and placenta (8), and lacticifers of pericarpium (9) at later developmental stages (the similarity of the both cell types in the staining, ability to branch and anastomose is observed) (1a–c, 2, 3, 4, 9 – E. lathyris, 5–8 – E. komaroviana); the structure of seed chalaza in E. procera (10), E. rupestris (11a, b), E. paralias (12), E. stepposa (13) and E. peplus (14) (the entering of especial cells in large endopachychalaza and nucellar podium is observed in E. procera and E. rupestris). 1a, b, 2–5, 8, 9, 11a–14 – longitudinal sections of structures, 1с, 6, 7, 10 – cross sections. l – lacticifers, pl – placenta, for the other designations see Plates I–V (see the text for explanations). Scale bar, µm: 1a–10, 11b–14 – 50, 11b – 100.
Как и у исследованных нами видов секций Helioscopia и Esula (Titova et. al., 2018a), по мере вхождения окончаний проводящих пучков в структуры халазальной части семени в клетках подиума E. lathyris, E. komaroviana и E. myrsinites также наблюдается накопление сферических включений, сходных с таковыми клеток апикальной части нуцеллуса. Наибольшее накопление этих включений отмечалось в клетках подиума E. komaroviana и E. myrsinites, в меньшей степени – у E. lathyris, причем появление этих включений в небольшом числе также наблюдалось и в эндопахихалазе (табл. II, 6; IV, 6b; VII, 5).
Семенная кожура у всех трех видов в целом формируется по той же схеме, что и у видов секций Helioscopia и Esula, что проявляется в ряде общих структурных и временных закономерностей. К их числу относятся:
– увеличение числа слоев внутреннего интегумента (тегмена) в ходе прогамной фазы – за счет продолжения периклинальных делений клеток его внутренней эпидермы (у E. lathyris до 14–16, а у E. komaroviana и E. myrsinites – до 12–14 слоев клеток в толщину);
– радиальное удлинение клеток наружной эпидермы тегмена и начало их преобразования в макросклереиды (с выделением слоя экзотегмена), а также начало дифференциации тесты на экзо-, мезо- и эндотесту в ходе формирования проэмбрио;
– окончательное оформление слоя экзотегмена из макросклереид на стадии сердечковидного зародыша и деструкция большей части остальных слоев тегмена в ходе дальнейшего развития; характерная специализация клеток экзо-, мезо- и эндотесты.
К общим закономерностям также относится и специфическая ориентация макрослереид экзотегмена – их “встречный” характер в периферической области халазы (табл. II, 5; III, 5a; IV, 6a) (см. Titova et al., 2018a).
В то же время E. lathyris, E. komaroviana и E. myrsinites свойственны и определенные особенности формирования семенной кожуры. Во-первых, существенной особенностью этих видов является более сложная организация их тегмена, клетки самого внутреннего слоя которого (в области прилегания к нуцеллусу, а затем и к эндосперму) в ходе развития семени не подвергаются деструкции и приобретают кольчатые утолщения клеточных стенок (табл. VIII, 1e, 2e, 3d, e). У всех трех видов такие трахеидоподобные (гидроцитные) клетки сохраняются на протяжении дальнейшего развития и наряду с экзотегменом входят в состав зрелой семенной кожуры (табл. IX, 7); промежуточные слои клеток паренхимы тегмена при этом разрушаются. Таким образом, в структуре тегмена E. lathyris, E. komaroviana и E. myrsinites можно выделить экзо-, мезо- и эндотегмен, а не только экзо- и эндотегмен, как у видов секций Helioscopia и Esula.
Таблица VIII. Развитие семенной кожуры у Euphorbia lathyris (1a–f), E. komaroviana (2a–e) и E. myrsinites (3a–e).
1a–3c – строение тесты и тегмена в ходе прогамной фазы (1a, 2a, 3a), раннего (1b, 2b, 3b) и среднего (1c, 2c, 3c) эмбриогенеза; 1d–f, 2c, e, 3c, e – строение тесты и тегмена на стадиях сердечковидного (1d–f, 2c, e) и торпедовидного (3c, e) зародыша увеличено (начало выделения эндотегмена из трахеидоподобных клеток, специализации клеток тесты и увеличения в отдельных участках (1f, 3d) числа ее слоев); продольные срезы; entg – эндотегмен, extg – экзотегмен, mstg – мезотегмен, t c –трахеидоподобные клетки; остальные обозначения те же, что и на табл. I–V (объяснения в тексте). Масштабная линейка – 50 мкм.
Plate VIII . Seed coat development in Euphorbia lathyris (1a–f), E. komaroviana (2a–e) and E. myrsinites (3a–e).
1a–3c – testa and tegmen structure during the progamous phase (1a, 2a, 3a), early (1b, 2b, 3b) and middle (1c, 2c, 3c) embryogenesis; 1d–f, 2c, e, 3c, e – structure of testa and tegmen at the stage of heart-shaped (1d–f, 2c, e) and torpedo-shaped (3c, e) embryo, magnified (beginning of separation of endotegmen from tracheoid-like cells, specialization of testa cells and increase of the number of its layers in some seed parts (1f, 3d)); longitudinal sections; entg – endotegmen, extg – exotegmen, mstg – mesotegmen, t c – tracheoid-like cells; for the other designations see Plates I–V (see the text for explanations). Scale bar – 50 µm.
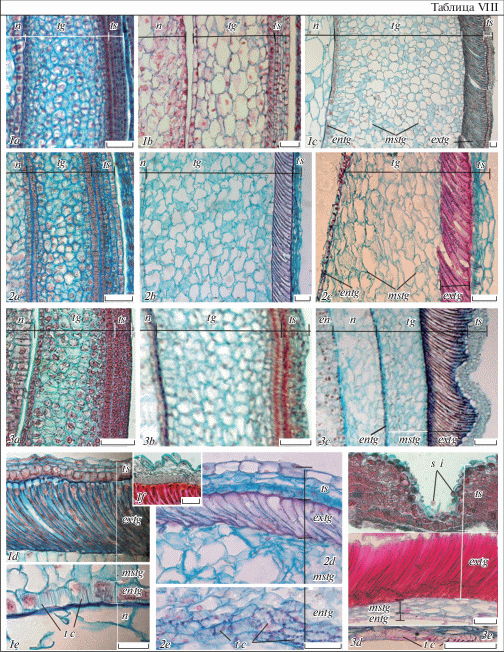
Во-вторых, E. lathyris и E. myrsinites гетероморфны по длине макросклереид экзотегмена: в отдельных участках их семени регулярно формируются группы более длинных макросклереид (табл. VIII, 1e, d, 3c, d), тогда как у E. komaroviana (как и у видов секций Helioscopia и Esula) этого не наблюдается (табл. VIII, 2c, d).
В-третьих, E. lathyris и E. myrsinites характеризуются увеличением числа слоев клеток тесты в процессе развития. Вследствие дополнительных периклинальных делений клеток мезотесты на ранних стадиях число слоев клеток тесты в отдельных участках семени у E. lathyris увеличивается до 6–7, а у E. myrsinites – до 5–6 (табл. VIII, 1b, e, f, 3c, d). Это приводит к образованию на поверхности их семени складок и бугорков, что в сочетании с неравномерной длиной макросклереид экзотегмена создает характерную видоспецифичную скульптуру поверхности семян этих видов (табл. IX, 1–3, 8). Для E. komaroviana этот процесс не характерен (табл. VIII, 2d; IX, 11).
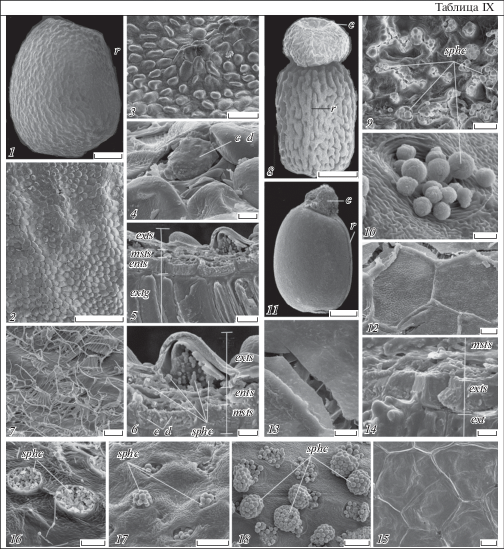
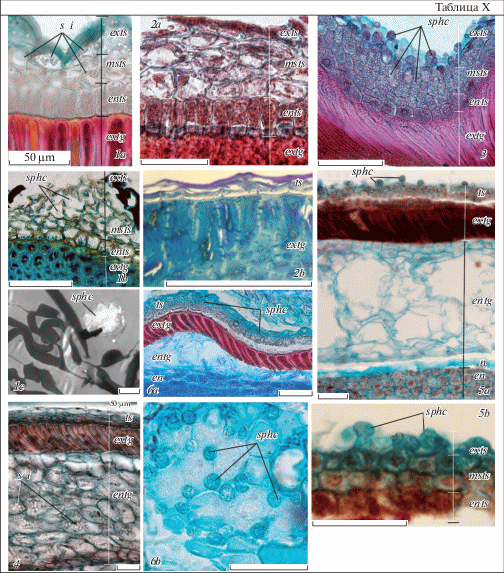
Таблица IX. Строение зрелого семени у Euphorbia lathyris, E. komaroviana и E. myrsinites; структура поверхности семени у видов некоторых других секций подрода Esula (СЭМ).
1, 8, 11 – внешний вид семени в латеральной (1, 11) и фронтальной (8) проекциях, 2, 3, 9, 12 – скульптура поверхности семени; 4, 10, 12, 13, 15–18 – скульптура поверхности клеток тесты, 5, 6, 7, 14 – строение клеток тесты (5, 6, 14) и тегмена (7) на сколах (3 – увеличенное изображение бугорка на складке поверхности семени, показанной на дет. 2, 4 – изображение того же бугорка после удаления наружной клеточной стенки экзотесты с крупным кристаллическим образованием в полости ее клетки; дет. 7 иллюстрирует трахеидоподобные клетки эндотегмена, дет. 5, 6, 9, 10, 16–18 – присутствие сферокристаллов в полостях клеток тесты и на их поверхности, а дет. 12, 13, 14, 15 – их отсутствие). 1–6 – E. lathyris, 8–10 – E. myrsinites, 11–14 – E. komaroviana, 15 – E. procera, 16 – E. paralias, 17 – E. stepposa, 18 – E. peplus; c d – кристаллические отложения, ents – эндотеста, exts – экзотеста, msts – мезотеста, r – рафе, sphc – сферокристаллы, остальные обозначения те же, что и на табл. I и VIII (объяснения в тексте). Масштабная линейка, мкм: 1, 8, 11 – 500, 2 – 200, 3, 7, 9 – 20, 5, 12, 15–18 – 10, 6, 10, 13, 14 – 5.
Plate IX . Mature seed structure in Euphorbia lathyris, E. komaroviana and E. myrsinites; the structure of seed surface in the species of some other subgenus Esula sections
1, 8, 11 – general view of seed in lateral (1, 11) and frontal (8) projections, 2, 3, 9, 12 – seed surface sculpture; 4, 10, 12, 13, 15–18 – testa cell surface sculpture, 5, 6, 7, 14 – the structure of testa (5, 6, 14) and tegmen (7) cells at the splits (3 – magnified image of tubercle at the seed surface fold, the latter is shown on the detail 2; 4 – the same tubercle after the removal of outer wall of exotesta cell with large crystalline deposits in its cavity; the detail 7 illustrates tracheid-like cells of endotegmen, the details 5, 6, 9, 10 and 16–18 – the presence of sphaerocrystals on testa cells surface and in its cavities, the details 12, 13, 14, 15 – their absence). 1–6 – E. lathyris, 8–10 – E. myrsinites, 11–14 – E. komaroviana, 15 – E. procera, 16 – E. paralias, 17 – E. stepposa, 18 – E. peplus; c d – crystalline deposits, ents – endotesta, exts – exotesta, msts – mesotesta, r – raphe, sphc – sphaerocrystals, for the other designations see Plates I and VIII (see the text for explanations). Scale bar, µm: 1, 8, 11 – 500, 2 – 200, 3, 7, 9 – 20, 5, 12, 15–18 – 10, 6, 10, 13, 14 – 5.
И наконец, специального рассмотрения заслуживает характер специализации клеток тесты. Как и у видов секций Helioscopia и Esula, клетки мезотесты E. lathyris, E. komaroviana и E. myrsinites в процессе развития подвергаются уплощению, а эндотесты – значительному радиальному расширению. Клетки экзотесты, особенно у E. lathyris, становятся выпуклыми. При этом у клеток экзотесты утолщены внешние, а у клеток эндотесты – внутренние периклинальные и антиклинальные стенки (табл. VIII, 1d, f, 2d, 3d). Примечательно, что после стадии глобулярного зародыша в клетках мезотесты E. lathyris и E. myrsinites появляются мелкие сферические включения, сходные визуально со сферическими телами клеток нуцеллуса, которые накапливаются в них в процессе дальнейшего развития семени (у E. lathyris похожие включения, но более крупных размеров, появляются и в клетках экзотесты). У E. lathyris они немногочисленны, тогда как у E. myrsinites обильны и на самых поздних стадиях начинают выделяться на поверхность семени через систему “поверхностных межклетников” (табл. X, 1a, 3). В тесте же E. komaroviana такие сферические включения не выявляются (табл. X, 2a).
Таблица X. Строение семенной кожуры зрелого семени у Euphorbia lathyris, E. komaroviana и E. myrsinites, а также видов некоторых других секций подрода Esula.
1a–c – E. lathyris; 2a, b – E. komaroviana, 3 – E. myrsinites; 1a, 2a, 3 – строение тесты созревающего семени, 1b, 2b – зрелого семени, на дет. 1a, b, 3 видно наличие сферокристаллов в клетках тесты, на дет. 1a, b – их отсутствие; 1c – фрагмент клетки зрелой тесты с отдельным сферокристаллом; 4–6b – фрагменты клеток семенной кожуры E. procera (4), E. stepposa (5a, b) и E. peplus (7a, b) на поздних стадиях развития семени, иллюстрирующие наличие или отсутствие сферокристаллов в клетках тесты этих видов (присутствие и выделение на поверхность тесты у E. stepposa и E. peplus, отсутствие у E. procera, у последнего вида также видно сильное накопление сферических включений в клетках эндотегмена, не наблюдаемых в тесте данного вида); 1a, b, 2a–6b – СМ (1a, 2a, 3–6a – продольные срезы, 1a, c, 2b – продольные срезы семенной кожуры, 6b – парадермальный срез экзотесты), 1с – ТЭМ. Обозначения те же, что и на табл. VIII и IX (объяснения в тексте). Масштабная линейка: 1a, 1b, 2a–6b – 50 мкм, 1c – 5 нм.
Plate X . Mature seed coat structure in Euphorbia lathyris, E. komaroviana and E. myrsinites, and also in the species of some others subgenus Esula sections.
1a–c – E. lathyris, 2a, b – E. komaroviana, 3 – E. myrsinites; 1a, 2a, 3 – testa structure in maturing seed, 1b, 2b – in mature seed, the details 1a, b, 3 show the presense of sphaerocrystals in testa cells, the details 1a, b – their absence; 1c – fragment of mature testa cell with separate sphaerocrystal; 4–6b – fragments of seed coat cells of E. procera (4), E. stepposa (5a, b) and E. peplus (7a, b) at the late stages of development, to illustrate presence or absence of sphaerocrystals in testa cells of these species (presence and excretion on the testa surface in E. stepposa and E. peplus, absence in E. procera, in the latter species, an intense accumulation of spherical inclusions is also observed in the endotegmen cells, but not in the testa); 1a, b, 2a–6b – LМ (1a, 2a, 3–6a – longitudinal sections, 1a, c, 2b – cross sections of seed coat, 6b – paradermal section of exsotesta), 1с – TEM. For designations see Plates VIII and IX (see the text for explanations). Scale bar: 1a, 1b, 2a–6b – 50 µm, 1c – 5 nm.
Зрелые семена у E. lathyris и E. komaroviana яйцевидные, у E. myrsinites – удлиненно-яйцевидные. У E. lathyris они неравномерно окрашены, с чередованием светло- и темно-коричневых участков, у E. komaroviana – блестящие, коричневатые, у E. myrsinites – со светлой матовой поверхностью. Семена уплощены в дорсивентральной плоскости и асимметричные в латеральной проекции, с карункулой и хорошо заметным проводящим пучком и рубчиком на рафальной стороне (табл. IX, 1, 8, 11), как и у остальных исследованных видов секций Helioscopia и Esula. У E. komaroviana поверхность семени ровная, у E. lathyris – с мелкими регулярными продольными ветвящимися складками-гребешками, в области которых выделяются отдельные бугорки (табл. IX, 2, 3, 9, 11). У семян E. myrsinites на поверхности имеются крупные и также в основном продольные и ветвящиеся складки (табл. IX, 8). Первичная скульптура поверхности семени E. komaroviana плитчатая, E. lathyris – бугорчатая, E. myrsinites – ямчатая; клетки эпидермы 5–6-гранные, у E. komaroviana и E. lathyris c четкими ровными границами, у E. myrsinites – с извилистыми и приподнятыми. Вторичная скульптура поверхности клеточных стенок у E. lathyris – от морщинистой до почти ровной, а у E. komaroviana и E. myrsinites – сетчато-морщинистая (табл. IX, 2, 9, 10, 12).
Семена кампилотропные (с легким изгибом всех частей семени), экзотегминальные, с хорошо дифференцированным зародышем и массивным эндоспермом; соотношение длины зародыш/эндосперм составляет 7 : 8 (рис. 2, 1e, 2e, 3e). Зародыш осевой, лопатчатый, с развитыми семядолями и слегка утолщеной, изогнутой гипокотиль-корневой осью. Семядоли E. lathyris и, особенно, E. komaroviana широкие и примерно равны по длине гипокотиль-корневой оси (как у видов секции Helioscopia), тогда как у E. myrsinites – более узкие и короче гипокотиль-корневой оси (как у видов секции Esula). Семядоли с четким палисадным слоем мезофилла, системами проводящих пучков и млечников. Апекс побега в виде конуса нарастания; апекс корня с массивным чехликом с многослойной колумеллой (табл. IV, 10a–c; V, 6a, b; VI, 6a–c). Экзотегмен состоит из макросклереид с мощными, утолщенными и импрегнированными танинами пористыми стенками, эндотегмен – в виде слоя трахеидоподобных клеток, прилегающих к эндосперму. Мезотегмен большей частью облитерирован и представлен несколькими рядами сжатых тонкостенных клеток. Теста в средней части семени у E. komaroviana 4-рядная, у E. lathyris и E. myrsinites – 4–7-рядная. Клетки однорядной экзотесты с выпуклыми, более толстыми наружными стенками; крупные клетки однорядной эндотесты с утолщенными внутренними тангентальными и радиальными стенками; промежуточные клетки мезотесты таблитчатые, при созревании семени часто сильно уплощаются (табл. X, 1a, b, 2a, b, 3). Специализированные структуры микропилярной и халазальной части зрелого семени у всех трех видов представлены эпистазой (лигнифицированные остатки оболочек клеток нуцеллярного колпачка), склерифицированными клетками внутренней поверхности эндостома и эндопахихалазой, клетки которой, включая гипостазу, содержат танины (рис. 2, 1e, 2e, 3e).
E. lathyris, E. komaroviana и E. myrsinites (как и виды секций Helioscopia и Esula) гетерогенны по признаку наличия/отсутствия сферокристаллов в клетках тесты. Так, E. lathyris и E. myrsinites свойственно присутствие в клетках тесты сферокристаллов. У обоих этих видов они локализованы главным образом в клетках мезотесты, хотя у E. lathyris выявляются и в клетках экзотесты. У E. lathyris они малочисленны и на сколах тесты выглядят либо как склеенные в массы тела, занимающие большую часть полостей клеток, либо как отдельные очень мелкие и рассеянные образования. При этом в клетках экзотесты нередко наблюдаются и крупные кристаллоподобные конгломераты, состоящие из более мелких включений (табл. IX, 4–6, X, 1a–c). У E. myrsinites сферокристаллы более крупные (до 5 мкм в диам.), обильные и выделяются на поверхность семени в виде склеенных масс через систему особых “поверхностных межклетников” (табл. IX, 9, 10; X, 3). Данные по генезису тесты у E. lathyris и E. myrsinites указывают на то, что сферокристаллы, очевидно, являются продуктами кристаллизации сферических включений, накапливающихся в ее клетках на ранних стадиях развития. В отличие от этого, сферокристаллы в тесте E. komaroviana не выявляются ни на сколах, ни на срезах ее клеток (табл. IX, 13; X, 2a, b). Характерно также, что на стенках клеток эндотесты всех трех видов (как и видов секций Helioscopia и Esula) также присутствуют неравномерные кристаллоподобные отложения (табл. IX, 5, 6, 14).
ОБСУЖДЕНИЕ
Как отмечено ранее (Titova et al., 2015, 2018а), развитие семени у видов подрода Esula рода Euphorbiа изучено недостаточно, причем большая часть исследованных видов принадлежит к его наиболее многочисленной секции Helioscopia (клада I): E. helioscopia L. (Singh R., 1969; Galeş et al., 2008), E. dulcis L. (Kapil, 1961), E. peltata Roxb. (= E. stricta L.) (Mukherjee, 1965), E. pilosa L. (Singh R., Jane, 1965), E. depauperata (Tokuoka, Tobe, 2002), E. palustris (Modilewski, 1911; Dang-Van-Liem, 1959). Во второй по численности секции Esula (клада II) изучено лишь 2 вида – E. oreophila Miquel. (= E. rothiana Spreng.) (Gopinath, Gopalkrishnan, 1949) и E. esula (Souѐges, 1924; Carmichael, Selbo, 199922), а в ряде незначительных по числу видов секциях этой же клады – E. peplus L (секция Tithymalus; Kordyum, Zayets, 1962; Devi, Rao, 1975), E. exigua L., E. dracunculoides Lamk. (cекция Exigua (Geltman) Riina et Molero; Souèges, 1925; Mukherjee, 1961), E. maddenii Boiss. (cекция Arwales (Geltman) Geltman; Bhanwra, 1987), E. mauritanica L. (секция Aphyllis Webb et Berthel.; Ventura, 1933) и E. myrsinites (секция Myrsiniteae; Schweiger, 1905). Развитие семени у видов базальных секций Lathyris и Lagasqae почти не исследовано: имеются лишь отдельные данные ранних авторов по E. lathyris (Baillon, 1858; Modilewski, 1910, и др.; подробнее см. Titova et al., 2018b). Более полно изучено строение семенной кожуры (Gram, 1895–1896; Mandl, 1926; Serwatka, 1972; Railyan, 1973, и др.), а также морфология зрелого семени, в анализ которых вовлечен широкий спектр видов (Khan, 1964; Simon et al. 1992; Pahlevani, Akhani, 2011; Salmaki et al., 2011; Pahlevani et. al., 2015; da Silva et al., 2015, Can, Küçüker; 2015, и др.)33. Данные перечисленных авторов, нередко исследовавших лишь отдельные процессы и признаки, не всегда сопоставимы и получены до создания молекулярно-филогенетической системы подрода Esula (Riina et al., 2013). Недавно этот пробел был в определенной степени восполнен целенаправленным, выполненным по единой схеме, исследованием развития семени у E. squamosa Willd., Е. soongarica Boiss., E. condylocarpa M. Bieb. и E. palustris L. из секции Helioscopia и E. virgatа Waldst. et Kit., E. iberica Boiss. и E. cyparissias L. из секции Esula (Titova et al., 2015, 2018а). Эти секции относятся к двум разным продвинутым кладам молекулярно-филогенетического древа подрода Esula (кладам I и II) и занимают на нем контрастное – наиболее удаленное от основания древа, положение.
Известно, что большинство изученных видов рода Euphorbiа, включая виды подрода Esula, имеют сходные характеристики развития семени. Считается, что все они обладают анатропными44, битегмальными, крассинуцеллятными семязачатками, с многослойной клювовидной структурой нуцеллуса (париетальная ткань и нуцеллярный колпачок), плацентарным обтуратором, коротким фуникулусом и зигзагообразным микропиле (как правило, формирующимся после оплодотворения). Всем видам также свойственно наличие экзотегминальных семян и нуклеарного типа эндоспермогенеза. Семена обычно с карункулой55, развитым зародышем и эндоспермом с обильными запасными веществами. Семенная кожура формируется с участием обоих интегументов, при этом карункула возникает за счет разрастания апикальной части наружного интегумента (Landes, 1946; Singh S., 1959; Kapil, 1961; Mukherjee, 1961, 1965; Singh R., Jane, 1965; Singh R., 1969; Bor, Bouman, 1974; Carmichael, Selbo, 1999; Tokuoka, Tobe, 2002; Galeş et al., 2008; Gagliardi et al., 2012; Vinogradova, 2017, и др.; см. также сводки по сравнительной эмбриологии и анатомии сем. Euphorbiaceae: Corner, 1976; Batygina, Kolesova (Titova), 1983; Komar, 1992; Kapil, Bhatnagar, 1994; Tokuoka, Tobe, 1995; Kamelina, 2009).
По мнению ряда авторов (Tokuoka, Tobe 1995, 2002 и др.), осуществивших ревизию данных по развитию семязачатка и семени у разных таксонов сем. Euphorbiaceae по системе G. L. Webster (1994), имеются 5 признаков, наиболее полезных для сравнения между его подсемействами и внутри подсемейств: наличие толстого/тонкого внутреннего интегумента; присутствие/отсутствие в нем сосудистых пучков; наличие/отсутствие в семязачатках или семенах пахихалазы; наличие/отсутствие ариллуса (карункулы); формирование фиброзного/нефиброзного экзотегмена. Различия между видами триб, подтриб и даже родов подсемейства Euphorbioideae, с их точки зрения, могут проявляться по 3 признакам – толщине внутреннего и наружного интегументов и наличию ариллуса (пахихалазия и присутствие сосудистых пучков в интегументах для них не характерны). При этом у видов рода Euphorbia они сводятся в основном к различиям в толщине внутреннего интегумента (более/менее 8 слоев клеток).
Наше предыдущее исследование по развитию семени у видов секций Helioscopia и Esula подрода Esula подтвердило это положение и, в то же время, внесло в него определенные дополнения (Titova et al., 2015, 2018а). В частности, было показано, что виды этих секций, проявляя значительное сходство с другими видами рода по основным признакам, различаются не только по толщине внутреннего, наружного интегумента и наличию ариллуса, но и по степени крассинуцеллятности семязачатков и семян, специфике развития эндосперма и характеру специализации клеток тесты. Так, виды секции Helioscopia отличаются большей массивностью нуцеллуса и большей толщиной тегмена (по сравнению с видами секции Esula), наличием врастаний халазального гаустория эндосперма в прилегающую ткань нуцеллуса (не свойственных видам секции Esula) и отсутствием в клетках тесты семени сферокристаллов (характерных для видов секции Esula). Кроме того, было установлено, что виды этих секций различаются и по признакам, выделенным Tokuoka и Tobe (1995, 2002) для сравнения таксонов в пределах разных подсемейств и внутри подсемейств сем. Euphorbiaceae – по наличию в семязачатках или семенах пахихалазы и присутствию сосудистых пучков в интегументах и нуцеллусе. В частности, анализ генезиса халазы с позиций критериев ее типизации (Periasamy, 1962; Сorner, 1976; Boesewinkel, Bouman, 1984; Shamrov, 2008), показал, что семена видов секций Helioscopia и Esula обладают эндопахихалазой и системой “постхалазального” ветвления проводящего пучка, хотя и редуцированными. Это проявляется в значительной массивности их халазы (создающейся за счет деления клеток вставки в основании внутреннего интегумента и нуцеллуса, образующейся на стадии семязачатка), ее определенном участии в построении семенной кожуры и развитии сети дополнительных проводящих пучков, проникающих в гипостазу, основание тегмена, а у ряда у видов – и в нуцеллус. Была выявлена разная степень выраженности этих признаков: бóльшая массивность эндопахихалазы у видов секции Helioscopia и вхождение окончаний проводящего пучка в подиум нуцеллуса (в виде особых клеток, предположительно, млечников или флоэмы), не характерное для видов секции Esula. При этом анализ морфогенетических корреляций в развитии структур семени показал, что все упомянутые признаки взаимосвязаны.
Данные по видам секций Lathyris, Holophyllum и Myrsiniteae подтвердили существование различий между ними по комплексу перечисленных признаков (при единстве общей схемы формирования семени у видов рода Euphorbia). Наряду с этим представлены новые доказательства в пользу наличия эндопахихалазы в семени видов рода Euphorbia.
Здесь нами показано, что E. lathyris из базальной секции Lathyris и E. komaroviana из близкой секции Holophyllum по признакам развития семени проявляют большее сходство с видами секции Helioscopia, чем с E. myrsinites из секции Myrsiniteae и видами секции Esula. Сходство состоит в большей массивности базальной части их нуцеллуса, тегмена и эндопахихалазы (наибольших из изученных видов подрода Esula), наличии клиновидных врастаний халазального гаустория эндосперма в ткань нуцеллуса и большей степени развития системы постхалазального ветвления проводящего пучка их рафе. Однако, эндопахихалаза E. lathyris и E. komaroviana также обладает более существенным участием в построении семенной кожуры и относительно глубоким погружением в нее семядолей зародыша и халазальной части эндосперма (у E. lathyris ~ на 2/3, у E. komaroviana ~ на 1/3), почти не выраженным у видов секций Helioscopia и Esula. Совокупность этих признаков свидетельствует о наличии в семени E. lathyris и E. komaroviana достаточно типичной эндопахихалазы, описанной у ряда родов Euphorbiaceae (Mallotus, Cleidion и др.) (Corner, 1976). Единственным признаком этой структуры, отсутствующим у данных видов, является ее функция “депо” запасных веществ, как дополнительного источника питания зародыша при прорастании, хотя на поздних стадиях развития в ней появляются сферические включения неясного назначения. Система же постхалазального ветвления этих видов (как и у видов секции Helioscopia) ограничена, т.е. представлена окончаниями проводящего пучка, помимо гипостазы, иннервирующих лишь основание тегмена и подиум нуцеллуса, причем в нуцеллусе также в виде специфических клеток (ксилема проникает лишь в основание тегмена и гипостазу).
В противоположность этому, развитие семени у E. myrsinites (секция Myrsiniteae) более сопоставимо с таковым видов секции Esula. Несмотря на несколько бóльшую массивность его структур, погружение эндосперма в эндопахихалазу у данного вида (как и его врастания в ткань нуцеллуса) почти не выражено, а вхождения окончаний проводящего пучка в подиум нуцеллуса не наблюдается (за исключением редких случаев вхождения в него специфических клеток этих окончаний).
Как и виды секций Helioscopia и Esula, E. lathyris, E. komaroviana и E. myrsinites различаются по признакам строения тесты, в частности, по признаку наличия/отсутствия в ее клетках сферокристаллов. E. myrsinites (как и видам секции Esula из той же клады II) свойственно формирование сферокристаллов в клетках тесты, что сочетается у данного вида с менее развитыми эндопахихалазой и системой постхалазального ветвления проводящего пучка. В отличие от этого, для клеток тесты E. komaroviana (как и для видов секции Helioscopia из клады I) они не характерны, что коррелирует у этих видов с большей степенью развития упомянутых структур. Однако эта корреляция нарушается у E. lathyris: для данного вида характерно присутствие сферокристаллов в тесте (хотя и в незначительном количестве) и, в то же время, наличие хорошо развитой эндопахихалазы и системы постхалазального ветвления проводящего пучка семени. Кроме того, в отличие от E. komaroviana, у E. lathyris и E. myrsinites в процессе развития наблюдается незначительное увеличение числа слоев клеток тесты – местами до 5–7, отмеченное также и у E. squamosa из секции Helioscopia (Titova et al., 2018а). При этом у данных видов это признак также коррелирует с неравномерностью длины макросклереид экзотегмена, удлинение которых с регулярностью происходит по всей поверхности семени и в сочетании с увеличением числа слоев клеток тесты обусловливает ее складчатую скульптуру. В то же время, все три вида объединяет сходная, более сложная организация их тегмена, дифференцирующегося в ходе развития на экзотегмен (из слоя макросклереид), эндотегмен (из слоя трахеидоподобных клеток с кольчатыми утолщениями) и мезотегмен (промежуточные слои клеток паренхимы). При этом, как и экзотегмен, эндотегмен входит в состав семенной кожуры зрелого семени, но вероятно выполняет иную функциональную нагрузку, возможно усиливая систему постхалазального ветвления проводящего пучка в процессе развития семени, а также способствуя проведению воды при его прорастании.
В этой связи, следует отметить, что K. Mandl (1926) выявил в семенной кожуре зрелого семени E. lathyris слой сосочковидных клеток наружной эпидермы (с утолщенными внешними оболочками и пигментированным содержимым), слой призматических клеток, палисадный слой (из склереид с утолщенными стенками) и слой остатков клеток нуцеллуса, прилегающих к эндосперму, а в семенной кожуре E. myrsinites (на ранних стадиях развития) описал наличие 4-слойного наружного и ~10–12-слойного внутреннего интегумента с выделяющимся слоем склереид. О сферокристаллах в тесте, наличии трахеидоподобных клеток в тегмене и неравномерности его склереид у этих видов автор не сообщал, хотя сходные детали были описаны им у видов других родов сем. Euphorbiaceae, например, у Sapium sebiferum (L.) Roxb. Сферокристаллы в клетках тесты E. lathyris, вследствие их мелких размеров и отстутствия выхода на поверхность семени, сложно обнаружить без применения специальных методов: их наличие было подтверждено нами и просмотром клеток тесты в поляризованном свете (Titova et al., 2018b). Но на поверхности тесты E. myrsinites эти структуры были отмечены некоторыми современными авторами (Can, Küçüker, 2015).
Резюмируя результаты сравнительного анализа развития семени у 10 изученных видов секций Lathyris, Holophyllum, Helioscopia, Myrsiniteae и Esula подрода Esula рода Euphorbiа, можно заключить, что они различаются по следующему комплексу:
1) по степени массивности структур семязачатка и семени – нуцеллуса (особенно базальной части), тегмена и эндопахихалазы (большей у видов секций Lathyris, Holophyllum, Helioscopia и Myrsiniteae, чем у видов секции Esula);
2) по степени развития системы постхалазального ветвления проводящего пучка рафе семени: вхождение его окончаний в гипостазу, основание тегмена и подиум нуцеллуса (в виде особых клеток) у видов секций Lathyris, Holophyllum и Helioscopia, и лишь в гипостазу и основание тегмена у видов секций Myrsiniteae и Esula;
3) по характеру развития халазальной части эндосперма: образование специализированных выростов его гаустория в нуцеллус у видов секций Lathyris, Holophyllum и Helioscopia и их отсутствие у видов секций Myrsiniteae и Esula;
4) по глубине погружения семядолей зародыша и халазального конца эндосперма в ткань эндопахихалазы (на поздних стадиях): выраженного у видов секций Lathyris и Holophyllum и почти отсутствующего у видов секций Helioscopia, Myrsiniteae и Esula;
5) по организации тегмена – более сложной у видов секций Lathyris, Holophyllum и Myrsiniteae (выделение экзо-, мезо- и эндотегмена, со специализацией клеток последнего по типу трахеидоподобных клеток и их вхождением в состав семенной кожуры) и почти не характерной для видов остальных секций (исключая E. palustris из секции Helioscopia);
6) по признаку наличия/отсутствия сферокристаллов в клетках тесты: их отсутствие в тесте у видов секций Holophyllum и Helioscopia и наличие у видов секций Lathyris, Myrsiniteae и Esula.
Анализ распределения признаков развития семени в пределах секций разных клад подрода Esula позволяет сделать следующие выводы.
Во-первых, изученные виды двух крупных продвинутых клад подрода Esula (клады I и II) четко различаются по комбинации двух устойчивых признаков: 1) степени массивности эндопахихалазы и развития системы постхалазального ветвления проводящего пучка рафе семени; 2) наличию/отсутствию сферокристаллов в тесте. Виды клады I характеризуются большей массивностью эндопахихалазы и вхождением окончаний проводящего пучка в массивный подиум нуцеллуса, что сопряжено с отсутствием сферокристаллов в тесте. Видам клады II свойственна меньшая массивность эндопахихалазы и блокирование вхождения окончаний проводящего пучка на уровне гипостазы (их проникновения в менее развитый подиум нуцеллуса не наблюдается), что сопряжено с присутствием сферокристаллов в тесте. При этом в пределах каждой клады наблюдается снижение массивности структур семени (от большей в секциях Holophyllum и Myrsiniteae к меньшей у видов секций Helioscopia и Esula), а в пределах клады II – и степени развития системы постхалазального ветвления проводящего пучка (от редких случаев вхождения его окончаний в нуцеллус у E. myrsinites до полного отсутствия этого процесса у видов остальных секций).
Во-вторых, виды секций, лежащих в основании филогенетического древа подрода Esula или близко к нему (секции Holophyllum, Myrsiniteae, Lathyris) проявляют значительное сходство по степени массивности структур семени и организации тегмена. Вместе с тем, они гетерогенны по признаку наличия/отсутствия сферокристаллов в тесте (отсутствие в секции Holophyllum, наличие в секциях Lathyris и Myrsiniteae) и степени развития системы постхалазального ветвления проводящего пучка (существенно ограниченной у E. myrsinites). При этом E. lathyris из секции Lathyris, занимающей базальное положение на деревьях, построенных с использованием хлоропластных маркеров и комбинированного анализа, но промежуточное положение между секциями Myrsiniteae и Pithyusa в кладе II – на деревьях, построенных с использованием ядерных маркеров (Riina et al., 2013), по большинству признаков сходен с E. komaroviana из близко расположенной секции Holophyllum клады I. С E. myrsinites из клады II его сближает лишь наличие сферокристаллов в тесте и сходная скульптура поверхности семени, связанная с неравномерностью длины макросклереид экзотегмена и увеличением числа слоев тесты.
Таким образом, в целом, результаты анализа распределения признаков в пределах разных клад подрода Esula рода Euphorbiа, с нашей точки зрения, достаточно логично укладываются в классические представления о направлениях эволюции структур семязачатка и семени у цветковых растений. Согласно этим представлениям, эволюция этих структур в пределах разных таксонов обычно идет по пути их редукции (см. например, Shamrov, 2008), что четко наблюдается и в пределах древа подрода Esula. С этих позиций, E. lathyris из секции Lathyris, с наибольшей степенью массивности структур семени, обоснованно занимает базальное положение в филогенетическом древе данного подрода, а виды остальных секций, с меньшей массивностью структур семени – продвинутое. Однако в эти представления не совсем укладывается точка зрения о продвинутости признака наличия эндопахихалазы в семени (см. например, Corner, 1992), наиболее развитой и типичной в секции Lathyris. Это противоречие снимается, если допустить возникновение признака у предковых форм подрода Esula и рода Euphorbiа, но претерпевшего в ходе эволюции определенную редукцию: эндопахихалаза E. lathyris выглядит как задержавшаяся в развитии эндопахихалаза Cleidion javanicum и Dalechampia roezliana Muell. Arg. (Schweiger, 1905, рис. 29 ; Corner, 1976, рис. 222, 226 ). Такое предположение усиливается и отсутствием у эндопахихалазы E. lathyris функции “депо”, и явной производностью строения семени видов двух крупных клад подрода от такового E. lathyris. К сказанному можно добавить, что наличие у E. lathyris ряда других особых эмбриологических признаков (пóзднее обрастание нуцеллуса внутренним интегументом, длительное сохранение пыльцевой трубки в синергиде) в сочетании с невскрывающимися плодами с губчатым перикарпием, перекрестнопарными листьями (Geltman, 2016) также свидетельствует и об обоснованности самостоятельного положения секции Lathyris в системе подрода Esula.
Особенно ярко логичность нового молекулярно-филогенетического древа подрода Esula проявляется в четких различиях видов его крупных продвинутых клад по комбинации двух устойчивых признаков. Существование этих различий также подтвердили и предварительные данные по развитию семени у видов других секций этих клад – E. procera M. Bieb. и E. rupestris Ledeb. (секции Helioscopia и Holophyllum, соответственно, клада I), а также E. stepposa Zoz, E. paralias L. и E. peplus L. (секции Pithyusa, Paralias и Tithymalus, соответственно, клада II). Анализ строения халазальной части семени этих видов на отдельных стадиях ее развития также выявил наличие вставки клеток в основании тегмена и нуцеллуса и, следовательно, наличие эндопахихалазы. При этом, E. procera и E. rupestris из клады I также имеют бóльшую степень развития эндопахихалазы, формирование которой сопровождается проникновением окончаний проводящего пучка рафе в подиум (табл. VII, 10, 11a, b), что коррелирует у этих видов с отсутствием сферокристаллов в клетках тесты (табл. IX, 15; X, 4). В противоположность этому, E. stepposa, E. paralias и E. peplus из клады II свойственны меньшая степень развития этой структуры и проникновение окончаний проводящего пучка лишь в гипостазу и основание тегмена (табл. VII, 12–14), что сопровождяется формированием сферокристаллов в тесте (табл. IX, 16–18; X, 5a–6b).
Ранее у видов секций Helioscopia и Esula мы выявили четкую зависимость между глубиной проникновения специфических клеток окончаний проводящего пучка рафе в структуры семени и характером накопления в них особых сферических включений в процессе развития (Titova et al., 2018а). Было предположено, что у видов клады II сферические включения в клетках тесты являются предшественниками образующихся в них сферокристаллов и представляют избыточные кристаллизующиеся продукты метаболизма семени, накапливающиеся в тесте в связи с блокированием вхождения специфических клеток в подиум из-за раннего прекращения в нем клеточных делений.
Анализ развития семени у видов секций Lathyris, Holophyllum и Myrsiniteae подтвердил наличие этой корреляции, хотя и с некоторой спецификой проявления. Так, E. komaroviana (как и изученным видам секции Helioscopia) свойственно проникновение специфических клеток окончаний проводящего пучка в подиум, интенсивное накопление сферических включений в клетках последнего и почти полное отсутствие этого процесса в клетках мезотесты. У E. lathyris наблюдается сходная картина, однако накопление сферических включений в подиуме выражено незначительно, а в клетках тесты, наоборот, несколько сильнее. У E. myrsinites (как и у изученных видов секции Esula) отсутствие вхождения специфических клеток в подиум нуцеллуса также коррелирует с активным накоплением сферических включений в клетках мезотесты, но при этом наблюдается их несколько большее накопление в подиуме. Слабое накопление сферических включений в подиуме E. lathyris (в сравнении с видами секции Helioscopia) может быть связано с быстрым лизисом этой структуры у этого вида после стадии сердечковидного зародыша, а их незначительное появление в тесте свойственно и ряду видов секции Helioscopia, например, E. soongarica (Titova et al., 2018а). Более же интенсивное накопление сферических включений в подиуме E. myrsinites может быть объяснено обилием специфических клеток в халазе и случаями их проникновения в подиум у данного вида.
Природа сферических включений в нуцеллусе (белковые тела, амилопласты и др.) и сферокристаллов в тесте (наличие липидных компонентов), как и природа специфических клеток в окончаниях проводящего пучка рафе семени (млечники, флоэма) у видов подрода Esula пока остается неясной (см. также Titova et al., 2018а), но между этими структурами прослеживается явная взаимосвязь. Интерпретация сферических включений в тесте как избыточных продуктов метаболизма семени усиливается значительным сходством специфических клеток с млечниками перикарпия изученных видов (по сходству окраски, способности к ветвлению, образованию анастомозов и другим признакам). Однако от млечников перикарпия молочаев они отличаются членистостью. Считается, что млечники у молочаев представлены единственной многоядерной клеткой (синцитием), берущей начало в меристеме побега еще в эмбриональном состоянии (Rudal, 1987, 2007; Lee, Mahlberg, 1999; Evert, 2015, и др.). Однако в сем. Euphorbiaceae в целом встречаются как членистые, так и нечленистые млечники (признак систематического значения) (Mahlberg et al., 1987); при этом у ряда видов, в частности, у Sapium haematospermum Müll. Arg., отмечены оба типа млечников: нечленистые млечники возникают вблизи промеристемы и листовых примордиев, а членистые – из узких извилистых млечников, образующихся в расширяющихся органах (Demarco et al., 2013). Возможность вхождения млечников в семена, на наш взгляд, реальна: млечники обычно являются продуктом меристем и следуют вдоль проводящей системы, давая ответвления в окружающие ткани; заложение же семязачатков связано с деятельностью меристем, а их проводящие пучки являются непосредственным продолжением сосудистых пучков плаценты. В то же время интерепретация специфических клеток как млечников, а сферических включений как избытков метаболизма семени находится в некотором противоречии с тем, что продукты метаболизма растительного организма обычно выделяются внутрь клеток млечников, а сферические тела накапливаются вне их – в подиуме. Возможно, млечники в семени изученных видов молочаев в связи с их локализацией в достаточно консервативном органе, являются модифицированными. Примечательно, что специфические клетки в семени изученных видов молочаев прослеживаются лишь вдоль пучка рафе и в области плаценты, но в самом перикарпии не выявляются.
Необходимо подчеркнуть, что процесс развития семени у видов рода Euphorbia нуждается в интенсивных исследованиях, с вовлечением в них широкого числа видов, что справедливо отмечалось ранее и Tokuoka и Tobe (2002). Особенно пристального внимания заслуживает развитие халазы семени, которая, как было установлено, у видов подрода Esula проявляет признаки эндопахихалазы – достаточно типичные у видов секций Lathyris и Holophyllum, но с разной степенью редукции у видов секций Helioscopia, Myrsiniteae и Esula (у многих видов клады II приближающейся по массивности к мезохалазе, однако с вхождением окончаний проводящего пучка в гипостазу и основание тегмена). В связи со сложностью и нетипичностью строения этой структуры у видов семейства Euphorbiaceae, а также противоречивостью мнений о ее распространении в пределах данного семейства (Corner, 1976, 1992; Boesewinkel, Bouman, 1984; Teichman, van Wyk, 1991; Tokuoka, Tobe, 2002, и др.) многие авторы часто уходят от подробного анализа ее развития. В немалой степени этому способствует и сложность вопроса об интерпретации структур халазальной части семени цветковых растений в целом (см. подробнее Titova et al., 2015, 2018а). Не исключено, что у ряда видов рода Euphorbia, особенно лежащих в основании его молекулярно-филогенетического древа, могут быть обнаружены эндопахихалаза и система постхалазального ветвления проводящего пучка рафе с полным проявлением их признаков, полностью сопоставимых с таковыми других родов Euphorbiaceae. На такую возможность указывают данные о наличии сосудистого снабжения в тегмене семени и трахеидоподобных клеток в его эндотегмене (“фиброзного слоя”) у E. geniculata Ortega (= E heterophylla L.) из подрода Chamaesyce (Singh S., 1959; Bor, Kapil, 1975), на что обращал внимание E. J. H. Corner (1976). Вместе с тем, именно анализ генезиса халазальной части семени у видов разных клад подрода Esula, с учетом точной интерпретации ее структур и во взаимосвязи с другими признаками (т.е. анализа морфогенетических корреляций в развитии структур), что мы здесь постарались показать, позволяет оценить различия в организации их семени и пути ее преобразования в онто- и филогенезе видов данного подрода.
Список литературы
Baillon E.H. 1858. Étude générale du groupe des Euphorbiacées. – Bull. Soc. Bot. France. 5: 776–780.
[Batygina, Kolesova (Titova)] Батыгина Т.Б., Колесова (Титова) Г.Е. 1983. Семейство Euphorbiaceae. – В кн.: Сравнительная эмбриология цветковых растений. Т. 2.: Phytolaccaceae – Thymelaeaceae. Л.: С. 267–277.
Bhanwra P.K. 1987. Embryology of Euphorbia maddeni and Euphorbia nivulia. – Curr. Sci. 56 (20): 1062–1064.
Boesewinkel F.D., Bouman F. 1984. The seed structure. – In: Embryology of angiosperms. Berlin etc. P. 567–610.
Bor J., Bouman F. 1974. Development of ovule and integuments in Euphorbia milii and Codiaeum variegatum. – Phytomorphology. 24 (3–4): 280–296.
Bor J., Kapil R.N. 1975. Euphorbia geniculata – ovule to seed. – Acta Bot. Neerl. 24 (3–4): 257–268.
Bruyns P.V., Mapaya R.J., Hedderson T. 2006. A new subgeneric classification for Euphorbia (Euphorbiaceae) in southern Africa based on ITS and psbA-trnH sequence data. – Taxon. 55 (2): 397–420. https://doi.org/10.2307/25065587
Can L., Küçüker O. 2015. Seed morphology and surface microstructure of some Euphorbia (Euphorbiaceae) taxa distributed in Turkey-in-Europe. – Turk. J. Bot. 39 (3): 449–457. https://doi.org/10.3906/bot-1405-82
Carmichael J.S., Selbo S.M. 1999. Ovule, embryo sac and endosperm development in leafy spurge (Euphorbia esula). – Can. J. Bot. 77 (4): 599–610.
Corner E.J.H. 1976. The seeds of Dicotyledons. Vol. 1–2. L., N. Y., Melbourne. 552 p.
Corner E.J.H. 1992. The pachychalaza in dicotyledons: primitive or advanced? – Bot. J. Linn. Soc. 108 (1): 15–19.
da Silva O.L.M., Cordeiro I., Caruzo M.B.R. 2016. Seed morphology in Euphorbia and its taxonomic applications: a case study in São Paulo, Brazil. – Braz. J. Bot. 39 (1): 349–358. https://doi.org/10.1007/s40415-015-0228-9
Demarco D., de Moraes Castro M., Ascensao L. 2013. Two lacticifer systems in Sapium haematospermum – new records for Euphorbiaceae. Botany. 91 (8): 545–554. https://doi.org/10.1139/cjb-2012-0277
Gagliardi K.B., Rosado A., de Souza L.A., Moscheta I.S., Albiero A.L.M. 2012. Structure and development of fruits and seeds of weed species of Euphorbiaceae. – Acta Bot. Bras. 26 (1): 38–45. https://doi.org/10.1590/S0102-33062012000100005
Galeş R.C., Toma C., Ivănescu L. 2008. Morphology and anatomy of the fruit and seed in development of Euphorbia helioscopia L. (Euphorbiaceae Juss.). – Studia Universitatis “Vasile Goldiş”, Seria Ştiinţele Vieţii (Life Sciences Series). 18: 17–20.
[Geltman] Гельтман Д.В. 2013. Молочаи (Euphorbia L., Euphorbiaceae) Восточной Европы и Кавказа в зеркале новой системы рода. – Turczaninowia. 16 (2): 30–40.
[Geltman] Гельтман Д.В. 2016. Подрод Esula рода Euphorbia (Euphorbiaceae): система, филогения, географический анализ: Дис. … д-ра биол. наук. СПб. 348 с.
Geltman D.V., Berry P.E., Riina R., Peirsson J. 2011. Typification and synonymy of the species of Euphorbia subgenus Esula (Euphorbiaceae) native to the United States and Canada. – J. Bot. Res. Inst. Texas. 5 (1): 143–151.
[Geltman et al.] Гельтман Д.В., Яковлева О.В., Медведева Н.А., Титова Г.Е. 2014. Значение признака наличия сферокристаллов в семенной кожуре для систематики подрода Esula Pers. (Euphorbia L., Euphorbiaceae). – В кн.: Карпология и репродуктивная биология высших растений. М. С. 136–139.
Gopinath D.M., Gopalkrishnan K. S. 1949. The ovule and the development of the female gametophyte in Homonia retusa Muell. and Euphorbia oreophila Miquel. – Am. Midland Naturalist. 41 (3): 759–764.
Gram B. (1895–1896). Om Fröscallens Bygning hos Euphorbiaceerne. – Bot. Tidsskr. 20: 358.
Horn J.W., van Ee B.W., Morawetz J.J., Riina R., Steinmann V.W., Berry P.E., Wurdack K.J. 2012. Phylogenetics and the evolution of major structural characters in the giant genus Euphorbia L. (Euphorbiaceae). – Mol. Phylogen. Evol. 63 (2): 305–326. https://doi.org/10.1016/j.ympev.2011.12.022
[Kamelina] Камелина О.П. 2009. Систематическая эмбриология цветковых растений. Т. 1. Двудольные. Барнаул. 501 с.
Kapil R.N. 1961. Some embryological aspects of Euphorbia dulcis L. – Phytomorphology. 11 (1): 24–36.
Kapil R.N., Bhatnagar A.K. 1994. The contribution of embryology to the systematics of the Euphorbiaceae. – Ann. Missouri Bot. Gard. 81 (2): 145–159.
Khan M.S. 1964. Taxonomic revision of Euphorbia in Turkey. – Notes Royal Bot. Gard. Edinburgh. 25 (2): 71–161.
[Komar] Комар Г.А. 1992. Семейство Euphorbiaceae. – В кн.: Сравнительная анатомия семян. Т. 4: Dilleniidae. CПб. С. 382–400.
[Kordyum, Zayets] Кордюм Е.Л., Заεць В.О. 1962. До эмбрiологii молочаю щербиковидного (Euphorbia peplis L.). – Укр. бот. журн. 19 (5): 42–48.
Landes M. 1946. Seed development in Acalypha rhomboidea and some other Euphorbiaceae. – Am. J. Bot. 33 (6): 562–568.
Lee K.B., Mahlberg P.G. 1999. Ultrastructure and development of nonarticulated laticifers in seedlings of Euphorbia maculata L. – J. Plant Biol. 42 (1): 57–62.
Mahlberg P.G., Davis D.G., Galitz D.S., Manners G.D. 1987. Laticifers and the classification of Euphorbia: the chemotaxonomy of Euphorbia esula L. – Bot. J. Linn. Soc. 94 (1–2): 165–180. https://doi.org/10.1111/j.1095-8339.1987.tb01044.x
Modilewski J. 1910. Weitere Beiträge zur Embryobildung einiger Euphorbiaceen. – Ber. Deutsch Bot. Gesells. 28: 413–418.
Modilewski J. 1911. Die anomale Embryosackentwicklung bei Euphorbia palustris. – Ber. Deutsch. Bot. Gesells. 29: 430–436.
Mukherjee P.K. 1961. Embryology of two Euphorbiaceae. – Proc. Nat. Acad. Sci. India. (B). 53: 217– 229.
Mukherjee P.K. 1965. Contribution to the embryology of Euphorbia peltata Roxb. – Proc. Nat. Acad. Sci. India. (B). 35: 327– 337.
Pahlevani A.H., Akhani H. 2011. Seed morphology of Iranian annual species of Euphorbia (Euphorbiaceae). – Bot. J. Linn. Soc. 167 (2): 212–234. https://doi.org/10.1111/j.1095-8339.2011.01165
Pahlevani A.H., Liede-Schumann S., Akhani H. 2015. Seed and capsule morphology of Iranian perennial species of Euphorbia (Euphorbiaceae) and its phylogenetic application. – Bot. J. Linn. Soc. 177 (3): 335–377. https://doi.org/10.1111/boj.12245
[Pausheva] Паушева З.П. 1980. Практикум по цитологии растений. М. 255 с
Periasamy K. 1962. The ruminate endosperm: development and types of ruminations. – In: Plant embryology. A symposium. New-Dehli. P. 62–74.
[Prokhanov] Проханов Я.И. 1949. Род молочай – Euphorbia L. – В кн.: Флора СССР. Т. 14. М., Л. С. 304–495.
[Prokhanov] Проханов Я.И. 1964. Конспект системы молочаев СССР. Добавления и изменения. – Новости сист. высш. раст. 1: 226–237.
[Railyan] Райлян А.Ф. 1973. О значении анатомического строения семенной кожуры для систематики рода Euphorbia L. – Бот. журн. 58 (2): 239–245.
Riina R., Peirson J.A., Geltman D.V., Molero J., Frajman B., Pahlevani A., Barres L., Morawetz J.J., Salmaki Y., Zarre S., Kryukov A., Bruyns P.V., Berry P.E. 2013. A worldwide molecular phylogeny and classification of the leafy spurges, Euphorbia subgenus Esula (Euphorbiaceae). – Taxon. 62 (2): 316–342. https://doi.org/10.12705/622.3
Rudall P.J. 1987. Lacticifers in Euphorbiaceae – a conspectus. – Bot. J. Linn. Soc. 94 (1–2): 143–163.
Rudall P.J. 2007. Anatomy of Flowering Plants: an introduction to structure and development. Cambridge, New York. 160 p.
Salmaki Y., Zarre Sh., Esser H.-J., Heubl G. 2011. Seed and gland morphology in Euphorbia (Euphorbiaceae) with focus on their systematic and phylogenetic importance, a case study in Iranian highlands. – Flora. 206 (11): 957–973. https://doi.org/10.1016/j.flora.2011.07.005
Serwatka J. 1972. Seed morphology and anatomy of the European species of the genus Euphorbia L. – Monogr. Bot. 37: 3–33.
Schweiger, J. I905. Beitrage zur Kenntnis der Samenentwicklung der Euphobiaceen. –Flora. 94: 339–382.
[Shamrov] Шамров И.И. 1994. Халаза. – В кн.: Эмбриология цветковых растений. Терминология и концепции. Т. 1. Генеративные органы цветка. СПб. С. 163–165.
[Shamrov] Шамров И.И. 2008. Семязачаток цветковых растений: строение, функции, происхождение. М. 350 с.
Simon J., Molero J., Blanche C. 1992. Fruit and seed morphology of Euphorbia aggr. Flavicoma. Taxonomic implications. – Collect. Bot. 21: 211–242.
Singh R.P. 1969. Structure and development of seeds in Euphorbia helioscopia. – Bot. Mag. (Tokyo). 82 (973): 287–293.
Singh R.P., Jane J.L. 1965. Development of female gametophyte in Euphorbia pilosa L. – Curr. Sci.34 (21). 611–612.
Singh S.P. 1959. Structure and development of seeds in Euphorbia geniculata Orteg. – J. Indian Bot. Soc. 38: 103–108.
Souèges R. 1924. Embryogenie des Euphorbiacées. Développement de l’embryon chez l’Euphorbia esula. – L. C. R. Acad. Sci. Paris 179: 989–991.
Souèges R. 1925. Developpement de l’embryon chez l’Euphorbia exigua L. – Bull. Soc. Bot. France 72: 1018–1031.
Steinmann V.W., Porter J.M. 2002. Phylogenetic relationships in Euphorbieae (Euphorbiaceae) based on ITS and ndhF sequence data. – Ann. Missouri Bot. Gard. 89 (4): 453–490. https://doi.org/10.2307/3298591
Tiechman I.V., van Wyk A. E.V. 1991. Trends in the evolution of dicotyledonous seeds based on character associations, with special reference to pachychalazy and recalcitrance. – Bot. J. Linn. Soc. 105 (3): 211–237.
[Titova et al.] Титова Г.Е., Яковлева О.В., Жинкина Н.А. 2015. Развитие семени у Euphorbia palustris (Euphorbiaceae). – Бот. журн. 100 (3): 226–248.
[Titova et al.] Титова Г.Е., Яковлева О.В., Жинкина Н.А., Гельтман Д.В. 2018а. Развитие семени у некоторых видов секций Helioscopia и Esula подрода Esula рода Euphorbia (Euphorbiaceae). – Бот. журн. 103 (11): 1355–1389. https://doi.org/10.7868/S0006813618110017
[Titova et al.] Титова Г.Е., Нюкалова М.А., Жинкина Н.А. 2018b. К репродуктивной биологии Euphorbia lathyris L. (Euphorbiaceae): развитие семени. – Вестник ТвГУ. Сер. Экология и биология. 3: 35–52.
Tokuoka T. 2007. Molecular phylogenetic analysis of Euphorbiaceae sensu stricto based on plastid and nuclear DNA sequences and ovule and seed character evolution. – J. Plant Res. 120 (4): 511– 522. https://doi.org/10.1007/s10265-007-0090-3
Tokuoka T., Tobe H. 1995. Embryology and systematics of Euphorbiaceae sens. lat.; a review and perspective. – J. Plant Res. 108 (1): 97–106. https://doi.org/10.1007/BF02344312
Tokuoka T., Tobe H. 2002. Ovules and seeds in subfamily Euphorbioideae (Euphorbiaceae); structure and systematic implications. – J. Plant Res. 115 (5): 361–374. https://doi.org/10.1007/s10265-002-0047-5
Ventura M. 1933. Sviluppo del gametofito femminile di Euphorbia mauritanica L. – Ann. Bot. (Roma). 20: 267–273.
[Vinogradova] Виноградова Г.Ю. 2017. Морфогенез женских репродуктивных структур у видов Euphorbia (Euphorbiaceae), различающихся по типу развития зародышевого мешка. – Бот. журн. 102 (8): 1060–1093.
Weber A. 2003. What is morphology and why is it time for its renaissance in plant systematics? – In: Deep morphology: toward a renaissance of morphology in plant systematics. Gantner, Vaduz, Liechtenstein. P. 3–32.
Webster G.L. 1994. Classification of the Euphorbiaceae. – Ann. Missouri Bot. Gard. 81: 3–32.
Дополнительные материалы отсутствуют.
Инструменты
Ботанический журнал


