Ботанический журнал, 2020, T. 105, № 3, стр. 211-235
ТИПЫ ОПЛОДОТВОРЕНИЯ У ЦВЕТКОВЫХ РАСТЕНИЙ
1 Российский государственный педагогический университет им. А.И. Герцена
191186 Санкт-Петербург, наб. р. Мойки, 48, Россия
2 Ботанический институт им. В.Л. Комарова РАН
197376 Санкт-Петербург, ул. Проф. Попова, 2, Россия
* E-mail: ivan.shamrov@gmail.com
Поступила в редакцию 05.12.2019
После доработки 09.01.2020
Принята к публикации 14.01.2020
Аннотация
Проведен анализ данных по процессам, происходящим до и во время оплодотворения у цветковых растений и животных, главным образом млекопитающих. Закономерности формирования гамет очень сходны. Основные различия обусловлены существованием в цикле воспроизведения высших растений гаметофита, во время которого из гаплоидных клеток (микроспор и мегаспор) в результате последующих делений формируются гаметы. У животных в них преобразуются клетки (сперматиды и яйца), возникшие в ходе мейоза. Сходным является сам половой процесс, при этом после плазмогамии закрывается доступ для вхождения в яйцеклетку (яйцо) дополнительных мужских гамет.
По-видимому, и растениям, и животным присущи сходные типы оплодотворения, различающиеся не только скоростью слияния половых ядер, но и поведением ядер спермиев. Исходя из этого, их число может быть увеличено. По нашему мнению, в классификацию типов оплодотворения следует добавить гемигамию и андрогенез. При премитотическом и постмитотическом типах оплодотворения ядра спермиев, как правило, объединяются с ядрами женских гамет (яйцеклетки и центральной клетки у цветковых растений). Ядро спермия у некоторых цветковых растений не контактирует и не сливается с ядром яйцеклетки, при этом спермий стимулирует яйцеклетку к эмбриогенезу, а его ядро делится автономно, как и ядро яйцеклетки, что приводит к формированию химерного зародыша (гемигамия). У ряда растений и животных входящее ядро спермия (сперматозоида) замещает ядро яйцеклетки, вызывая развитие зародыша без участия женского ядра (андрогенез). Премитотический тип оплодотворения происходит одинаково у животных и растений, при этом протопласты и ядра гамет объединяются до первого митоза ядра зиготы. Что касается постмитотического типа, то он осуществляется на совершенно разной базе. У животных при таком типе оплодотворения сперматозоид входит в развивающийся ооцит во время первого или второго делений мейоза. Он активирует формирующееся яйцо к дальнейшему развитию, затем происходит оплодотворение. Хроматин обоих ядер конденсируется в хромосомы, которые располагаются отдельно на общем митотическом веретене. У млекопитающих с постмитотическим оплодотворением диплоидный набор хромосом формируется не в зиготе, а на стадии двухклеточного зародыша. Заключение о слиянии ядер при постмитотическом оплодотворении у цветковых растений, по-видимому, нуждается в корректировке. Возможно, что и у растений хромосомы спермия и яйцеклетки объединяются не во время митоза. Ядра спермия и яйцеклетки далее самостоятельно делятся, и диплоидный набор хромосом создается не в зиготе, а в 2-клеточном зародыше. В отличие от животных, у цветковых растений особенности в прохождении постмитотического типа оплодотворения скрыты не в специфике мейоза и даже гаметогенеза, а, по-видимому, в строении клеток яйцевого аппарата. Это проявляется в незавершенности процессов специализации яйцеклетки и синергид к моменту вхождения пыльцевой трубки в зародышевый мешок.
Гаметы, представленные сперматозоидами (у некоторых голосеменных и большинства покрытосеменных растений спермиями) и яйцеклетками, в отличие от соматических клеток имеют гаплоидный набор хромосом. Места локализации, время возникновения гамет в ходе онтогенеза, особенности дифференциации и преобразования, а также некоторые другие структурные характеристики являются специфическими.
Значительный научный интерес представляет гипотеза о сходстве процессов оплодотворения у растений и животных, предложенная Е.Н. Герасимовой-Навашиной (Gerassimova-Navashina, 1947, 1957, 1969, 1990). Согласно этой гипотезе у растений, подобно животным, существуют два типа оплодотворения в зависимости от того, когда наступает объединение ядер половых клеток: премитотический (перед митозом ядра зиготы) и постмитотический (после начала или в ходе деления зиготы).
Особенности оплодотворения у цветковых и голосеменных растений и природа эндосперма. У хвойных (Goroschankin, 1880) и цветковых (Strasburger, 1884; Guignard, 1886), как и других высших растений, сначала было описано одинарное оплодотворение. Считалось, что второй спермий пыльцевой трубки разрушается и не участвует в оплодотворении. Однако позже у цветковых было обнаружено двойное оплодотворение, что является одной из отличительных характеристик этих растений. Оно включает объединение одного спермия с яйцеклеткой (в дальнейшем из возникшей зиготы формируется зародыш), а второго спермия (той же пары) с центральной клеткой зародышевого мешка (развивается эндосперм). Следует отметить, что понятие “тройное слияние”, используемое как эквивалент процесса слияния центральной клетки и спермия, не точно раскрывает его содержание, так как при этом сначала происходит плазмогамия, а затем лишь кариогамия. Хотя в процессе кариогамии обычно участвуют 3 ядра (2 полярных и одно ядро спермия Allium-, Adoxa-, Balsamita-, Drusa-, Polygonum-, Tulipa tetraphylla-типы развития зародышевого мешка), в центральной клетке может находиться иное число полярных ядер только одно (Oenothera-, Eriostemones-типы развития зародышевого мешка) или несколько (Penaea-, Plumbago-, Peperomia-типы развития зародышевого мешка). Следует подчеркнуть, что даже при наличии в центральной клетке 2 полярных ядер их плоидность может различаться: верхнее ядро гаплоидное, нижнее триплоидное (Fritillaria-, Plumbagella-типы развития зародышевого мешка) (Romanov, 1944, 1971, 1994; Maheshwari, 1950; Johri, 1963).
Феномен двойного оплодотворения был открыт при изучении оплодотворения у Fritillaria tenella M. Bieb. и Lilium martagon L. из сем. Liliaceae (Nawaschin, 1898a, b). Оба оплодотворения признавались настоящими половыми актами и сравнивались с полиэмбрионией. Кстати, термин “двойное оплодотворение” появился позже (Nawaschin, 1900).
В дальнейшем также на примере лилейных были подтверждены представления о двойном оплодотворении, при этом автор (Guignard, 1899) ссылается на результаты, полученные С.Г. Навашиным (Nawaschin, 1898b). Но французский исследователь не только подтвердил слияние двух мужских гамет одной пыльцевой трубки с яйцеклеткой и центральной клеткой, но и сопроводил описания иллюстрациями этого процесса. Именно поэтому первооткрывателем двойного оплодотворения часто, особенно в зарубежной литературе, считают французского ученого L. Guignard (1899). Некоторые иностранные исследователи (Friedman, 1990) правильно отражают факт открытия феномена двойного оплодотворения у цветковых растений, ссылаясь сначала на работу Навашина (Nawaschin, 1898b), а затем на статью Guignard (1899).
В конце XX столетия было показано, что двойное оплодотворение может происходить у некоторых голосеменных из порядка Gnetales (Ephedra, Gnetum) (Friedman, 1990, 1991; Carmichael, Friedman, 1995). Однако правомерно возникает вопрос, гомологичны ли процессы двойного оплодотворения у цветковых и голосеменных растений? При детальном исследовании было выявлено, что у Ephedra nevadens (Stapf) V. A. Nikitin и E. trifurca Torr. ex S. Watson второй спермий сливается с брюшной (вентральной) канальцевой клеткой, сохраняющейся в архегониальной полости, образуя дополнительный зародыш (Friedman, 1990, 1991). Подобное отмечали и у других голосеменных, но при этом второй зародыш не развивался. У голосеменных образование дополнительного зародыша в большей степени похоже на одновременное формирование двух зародышей цветковых растений, когда оплодотворяется не только яйцеклетка, но и одна из синергид. Синергиду покрытосеменных, вероятно, можно сравнить с брюшной канальцевой клеткой голосеменных, которая имеет общий генезис с яйцеклеткой, поскольку обе возникают из одной клетки. При оплодотворении яйцеклетки и синергиды двумя спермиями из одной пыльцевой трубки у цветковых растений теряется возможность оплодотворения центральной клетки, а без эндосперма зародыш разрушается (Lakshmanan, Ambegaokar, 1984). У мутантов Arabidopsis thaliana (L.) Heynh. (Brassicaceae) с нарушенным биосинтезом ауксина все клетки зародышевого мешка могут развиваться либо по пути синергид, либо по пути яйцеклеток (Pagnussat et al., 2009), либо в яйцевом аппарате формируются 2 яйцеклетки и 1 синергида, при этом после оплодотворения в последнем случае образуются 2 зародыша, а эндосперм не возникает (Berger, Twell, 2011).
Известно, что Навашин (Nawaschin, 1898a, b) сравнивал двойное оплодотворение с полиэмбрионией. Такой же точки зрения придерживается Friedman (1994, 1995), который считает, что у покрытосеменных растений в результате оплодотворения возникают 2 зародыша, один из которых стал постепенно выполнять функцию эндосперма. Эти представления развивались им в последующих работах (например, Friedman, Williams, 2004). Однако одновременно развивающиеся зародыши неизбежно вступают в конкуренцию за питательные вещества и трудно представить, чтобы один из зародышей “добровольно” стал осуществлять питание оставшихся зародышей. Если и могло это происходить, то только тогда, когда один или несколько зародышей переставали дальше развиваться, а образовавшиеся пластические вещества растение стало использовать для окончательного формирования единственного зародыша. Следует подчеркнуть, что эндосперм у покрытосеменных и голосеменных растений, выполняя сходную функцию, имеет разное происхождение. У голосеменных эндосперм является женским гаметофитом. Одна или несколько периферических клеток в его микропилярной части дают начало архегониям. Клетки, примыкающие к архегониям, трансформируются в обкладку. Остальные клетки женского гаметофита в период развития зародыша превращаются в запасающую ткань семени (Trenin, 1988). Подобная питательная ткань, называемая периспермом, формируется у цветковых растений после оплодотворения за счет накопления питательных веществ в сохраняющихся клетках мегаспорангия (нуцеллуса) крассинуцеллятного семязачатка. Перисперм выявлен в семенах примитивных (Cabombaceae, Cannaceae, Costaceae, Marantaceae, Nymphaeaceae, Zingiberaceae) и ряда продвинутых (Amaranthaceae, Caryophyllaceae, Phytolaccaceae, Portulaceae) семейств (Shamrov, 1997). В отличие от эндосперма голосеменных и перисперма цветковых, эндосперм покрытосеменных растений, имея половую природу, выполняет не только трофическую функцию, но и участвует в обеспечении и распределении сигналов, регулирующих процессы дифференциации и органогенеза зародыша (Chen et al., 2014). К числу таких сигналов относятся дипептиды (Costa et al., 2014) и фитогормоны, центральную роль среди которых играет ауксин (Locascio et al., 2014; Doll et al., 2017). В отсутствии эндосперма зародыш останавливается в развитии на глобулярной стадии. Таким образом, эндосперм у цветковых растений, вероятно, является структурой de novo. У цветковых растений он не дает начало новому организму. Его клетки очень рано становятся специализированными, и даже в условиях культуры in vitro не удалось убедительно доказать возникновение зародышей эндоспермального происхождения (Johri, Ambegaokar, 1984). Значимость эндосперма, возникающего при оплодотворении центральной клетки спермием, становится особенно актуальной у растений при апомиксисе (прежде всего, злаки). В этом случае партеногенетический зародыш не приступает самостоятельно к дифференциации и гистогенезу и вынужден ожидать момента, когда в результате псевдогамии сформируется половой эндосперм и запустит этот процесс (Yudakova et al., 2018). Значение эндосперма, возникшего в результате оплодотворения центральной клетки, особенно важно при рассмотрении адвентивной эмбрионии. Зародыши возникают из соматических клеток нуцеллуса или интегумента вблизи зародышевого мешка, но эмбриогенез начинается только после опыления, когда зиготический зародыш останавливается в развитии, и в развивающемся семени на смену амфимиксису приходит апомиксис, как альтернативная система. Имеющаяся система эндосперма половой природы позволяет нуцеллярным и интегументальным зародышам, вошедшим в полость зародышевого мешка, закончить нормальный ход развития (Shamrov, 2019).
Проблемы при изучении оплодотворения у растений. Оплодотворение центральной клетки спермием изучено у небольшого числа цветковых растений и этому процессу уделяется меньше внимания, чем исследованию сингамии. Поскольку у цветковых растений эндосперм, возникающий в результате тройного слияния, необходим для координации развития зародыша и прорастания семени, то его формирование обычно начинается раньше деления зиготы. Именно поэтому способ образования эндосперма не всегда соответствует типу слияния женских и мужских гамет при сингамии и чаще всего происходит по премитотическому типу либо характеризуется признаками премитотического и постмитотического типов. Так, для злаков (Triticum aestivum L., Zea mays L.) было показано, что, хотя двойное оплодотворение происходит по премитотическому типу, хромосомы спермия образующегося ядра первичной клетки эндосперма вступают в профазу раздельно от хромосом полярных ядер. Полное объединение хроматина спермия и полярных ядер осуществляется в метафазе, как при постмитомическом типе (Batygina, 1974; Korobova, 1982). У Zephyranthes candida Lindl., Z. grandiflora Lindl. и Z. macrosiphon Baker. (Amaryllidaceae) сингамия осуществляется по премитотическому типу, при этом у двух первых видов слияние центральной клетки и спермия также премитотическое, тогда как у Z. macrosiphon постмитотическое (Vorsobina, Solntseva, 1979). У Dioscorea caucasica Lipsky (Dioscoreaceae) тройное слияние подобно сингамии премитотического типа. У другого вида, D. nipponica Makino, выявлен промежуточный характер слияния спермия и полярных ядер (Torshilova, 2018).
Для ряда цветковых растений было показано, что процесс сингамии характеризуется одновременно чертами разных типов. При электронно-микроскопическом исследовании было выявлено, что слияние половых ядер осуществляется по единому плану, при этом они фактически представляют собой одно лопастное ядро, а картины при разных типах оплодотворения на светооптическом уровне представляют собой различия в скорости их полного объединения (Plyushch, 1992). При сравнительном анализе сингамии у растений и животных было выявлено, что при постмитотическом типе у растений спермий поступает в яйцеклетку, а у животных сперматозоид входит в развивающийся ооцит во время первого или второго деления мейоза и активирует его к дальнейшему развитию (Shamrov, 2015).
Именно наличие ряда противоречий в литературе побудило нас провести анализ имеющихся данных не только по сингамии у растений и животных, но и по особенностям формирования половых клеток, которые участвуют в ее прохождении.
Характеристика клеток, преобразующихся в гаметы у растений. Цикл воспроизведения высших растений включает в себя смену ядерных фаз (2n и n) и генераций (спорофита и гаметофита). Образование клеток, преобразующихся в дальнейшем в гаметы, начинается у них довольно рано и происходит в особых органах спороношения – спорангиях. В субэпидермальном слое любого спорангия на ранних стадиях дифференцируются особые клетки с плотной цитоплазмой и крупным ядром. У покрытосеменных растений они впервые описаны E. Warming (1873, 1878) как “инициальные (материнские) клетки зародышевого мешка и пыльцы”, а K. Goebel (1880) предложил их называть “археспорием” (греч. arché начало и sporá – семя, спора). Следует подчеркнуть, что Goebel (1881) обратил внимание на то, что клетки археспория эуспорангиатных споровых растений являются сестринскими по отношению к клеткам стенки спорангия, в то время как у многих семенных растений за счет археспориальных клеток формируются все слои этой стенки. Все это привело к тому, что во многих работах понятия “инициаль спорангия” и “археспорий” стали отождествляться. Часто клетки, которые первыми дифференцируются в углах формирующихся микроспорангиев пыльника или примордия семязачатка, называют археспорием. Проведенный анализ показал, что от инициации спорангия до обособления археспория в субэпидермальном слое происходит серия процессов. Археспорий появляется лишь после того, как закончится отделение слоев стенки спорангия с его внутренней и латеральных сторон (Shamrov, 2008b; Shamrov et al., 2019).
Мейоз у растений и животных. Возникновение половых клеток связано с мейозом, в результате которого из диплоидных ядер возникают гаплоидные ядра (Embryology…, 1984, 1994, 2002; Tokin, 1987; Gilbert, 2003; Afanas’ev et al., 2006; Danilov, Borovaya, 2018).
У растений выделяют три типа мейоза в зависимости от его места в жизненном цикле (Rodionova, 2000). Большинство зеленых водорослей в вегетативном состоянии гаплоидны, и диплоидна у них только зигота (вольвоксовые, хлорококковые, конъюгаты). Мейоз происходит при прорастании зиготы – зиготическая редукция, или зиготический мейоз. После цитокинеза образуются четыре гаплоидные клетки. У диатомовых водорослей и бурой водоросли фукуса талломы диплоидны. В их отдельных клетках после мейоза и последующего цитокинеза образуются гаметы – гаметическая редукция, или гаметический мейоз. Гаметы сливаются, образуя диплоидную зиготу, которая прорастает в новый диплоидный таллом. Слияние гамет может происходить при изогамии, анизо-, или гетерогамии (многие зеленые водоросли) или оогамии (харовые, многие бурые водоросли). Третий тип представляет собой спорическую редукцию, или спорический мейоз. Он характерен для растений с чередованием поколений. Спорофит – диплоидное поколение, в результате мейоза образуются гаплоидные неподвижные споры (у всех высших растений), жгутиковые споры, или зооспоры (у водорослей). Зооспоры образуются в обычных клетках таллома (некоторые водоросли) или в специализированных органах зооспорангиях (многие бурые водоросли). Из спор в результате делений развиваются многоклеточные гаплоидные организмы гаметофиты. Они продуцируют гаметы либо в обычных вегетативных клетках таллома (некоторые водоросли) либо в специализированных половых органах гаметангиях (низшие растения), архегониях и антеридиях (высшие растения, за исключением цветковых и голосеменных, у последних антеридии не образуются). После слияния гамет образуется зигота, из которой возникает диплоидный спорофит.
У цветковых растений начальные фазы формирования мужских половых клеток происходят в микроспорангиях пыльника. Спорогенные клетки, возникшие в результате делений археспориальных клеток, многократно делятся и затем становятся материнскими клетками микроспор, или микроспороцитами (рис. 1, 1, 7, 11). На их дальнейшее развитие влияют клетки слоев стенки микроспорангия, главным образом, тапетума, выстилающие полость микроспорангия. У млекопитающих репродуктивные клетки начинают формироваться в семенных канальцах, стенки которых состоят из соединительной ткани и слоя сертолиевых клеток, окружающих сперматогонии. Последние активно делятся и часть их (тип B) при делении не завершают цитокинез и остаются связанными цитоплазматическими мостиками, что приводит к образованию синцития, или групп сперматогоний (Gilbert, 2003; Afanas’ev et al., 2006). Сперматогонии становятся сперматоцитами 1-го порядка (рис. 2). Далее микроспороциты и сперматоциты вступают в мейоз. У цветковых растений во время первого деления образуется либо диада клеток (рис. 1, 2, 3) либо 2‑ядерная клетка (рис. 1, 8, 12), а у млекопитающих два сперматоцита 2-го порядка (рис. 2). В результате второго деления у растений возникает тетрада микроспор (сукцессивно рис. 1, 4–6; или симультанно рис. 1, 9, 10, 13–15), а у животных четыре сперматиды (рис. 2). Следует отметить, что у цветковых растений микроспороциты и формирующие микроспоры в тетрадах окружены каллозной оболочкой.
Рис. 1.
(а) Микроспорогенез и сукцессивный тип формирования тетрад микроспор у Ceratophyllum demersum (Ceratophyllaceae).
1–6 – стадии развития. c – каллоза, mc – микроспороцит, t m – тетрада микроспор.
(б) Микроспорогенез и симультанный тип формирования тетрад микроспор у Ceratophyllum platyacanthum (Ceratophyllaceae) (7–10) и Gentiana lutea (Gentianaceae) (11–15).
7–15 – стадии развития. c – каллоза, mc – микроспороцит, t m – тетрада микроспор.
Fig. 1. (a) Microsporogenesis and successive type of tetrad microspore formation in Ceratophyllum demersum (Ceratophyllaceae).
1–6 – stages of development. c – callose, mc – microsporocyte, t m – tetrad of microspores.
(b) Microsporogenesis and simultaneous type of tetrad microspore formation in Ceratophyllum platyacanthum (Ceratophyllaceae) (7–10) and Gentiana lutea (Gentianaceae) (11–15).
7–15 – stages of development. c – callose, mc – microsporocyte, t m – tetrad of microspores.
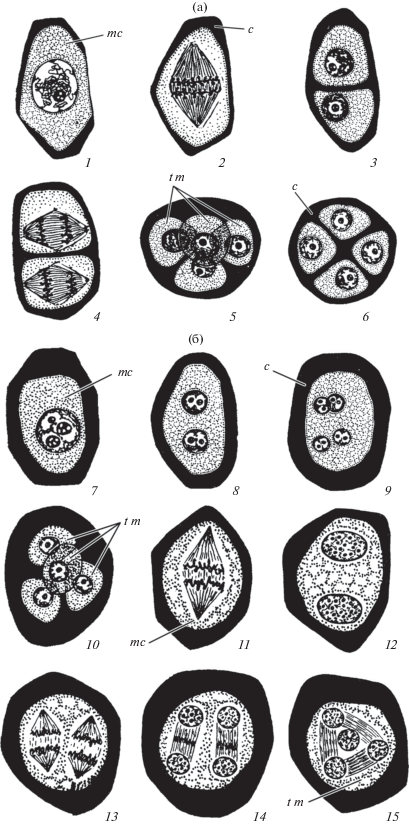
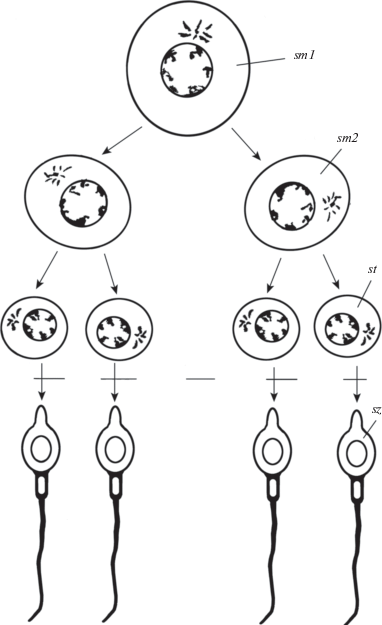
Рис. 2.
Мейоз сперматоцитов и гаметогенез у млекопитающих (схематизировано).
sm1, sm2 – сперматоциты 1-го и 2-го порядков. st – сперматида, sz – сперматозоид.
Fig. 2. Meiosis of spermatocytes and gametogenesis in mammals (scheme).
sm1, sm2 – spermatocytes of first and second orders. st – spermatid, sz – spermatozoid.
В женской репродуктивной сфере цветковых растений число образовавшихся спорогенных клеток и формирующихся мегаспороцитов не увеличивается в ходе развития. Однако оно может различаться в зависимости от типа археспория одноклеточного или многоклеточного. Развитие мегаспороцитов в нуцеллусе происходит под влиянием различных специализированных структур в зависимости от типа семязачатка: гипостазы, постамента, подиума, париетальной ткани, интегументального тапетума (Shamrov, 2008a). У большинства растений каждое деление мейоза при мегаспорогенезе сопровождается цитокинезом, в результате чего образуется линейная тетрада мегаспор (рис. 3, 2–5). Функциональной из них является самая крупная, часто халазальная мегаспора (в дальнейшем возникает моноспорический зародышевый мешок) (рис. 3, 6–9). У ряда растений в результате мегаспорогенеза возникают две 2-ядерные клетки (развивается биспорический зародышевый мешок) или одна 4-ядерная клетка (формируется тетраспорический зародышевый мешок). Как и в мужской генеративной сфере, мегаспороциты и мегаспоры в тетрадах у цветковых растений окружены каллозной оболочкой. У млекопитающих в яичнике формируются фолликулы с ооцитами. Каждое деление в мейозе ооцитов также сопровождается цитокинезом и возникновением только одной функциональной клетки, как при развитии моноспорического зародышевого мешка: при делении ооцита 1-го порядка возникает ооцит 2-го порядка почти такой же величины и маленькая клетка в области будущего анимального полюса яйца, называемая первым редукционным, или первым полярным тельцем. Последнее делится с образованием двух полярных телец, а ооцит 2-го порядка в ходе второго деления мейоза отделяет небольшое полярное тельце, а также яйцо (рис. 4), которое может считаться вполне зрелым, так как в нем у некоторых животных может произойти оплодотворение.
Рис. 3.
Строение семязачатка на стадии археспория (1), мегаспорогенез (2–5) и первые стадии развития зародышевого мешка (6–9) у Gentiana lutea (Gentianaceae).
1–9 – стадии развития. a c – археспориальные клетки, e s – зародышевый мешок, t mg – тетрада мегаспор.
Fig. 3. Ovule structure at archesporium stage (1), megasporogenesis (2–5) and first stages of embryo sac development (6–9) in Gentiana lutea (Gentianaceae).
1–9 – stages of development. a c – archesporial cells, e s – embryo sac, t mg – tetrad of megaspores.
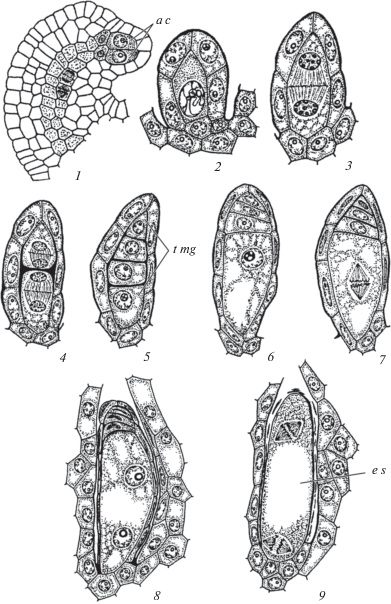
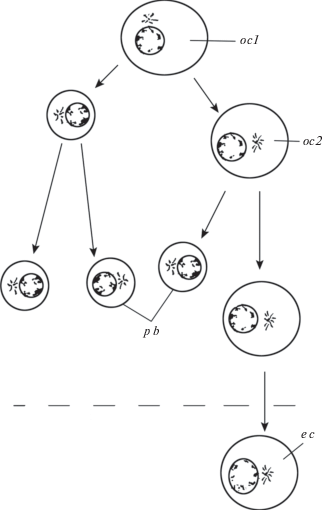
Рис. 4.
Мейоз ооцитов и гаметогенез у млекопитающих (схематизировано).
oc1, oc2 – ооциты 1-го и 2-го порядков, p b – полярные тельца, e c – яйцо (яйцеклетка).
Fig. 4. Meiosis of oocytes and gametogenesis in mammals (scheme).
oc1, oc2 – oocytes of first and second orders, p b – polar bodies, e c – egg cell.
Таким образом, как в мужской, так и женской репродуктивной сфере у цветковых растений происходит спорический, а у млекопитающих гаметический мейоз.
Гаметогенез и строение гамет у растений и животных. В гаметогенезе млекопитающих происходят преобразования сперматид в сперматозоиды (спермиогенез) (рис. 2) и созревание яиц (оогенез) (рис. 4). У цветковых растений гаметогенез осуществляется внутри специализированных гаметофитов. Мужской гаметофит представлен пыльцевыми зернами 2-клеточными или 3-клеточными (рис. 5, 9, 10). В 2-клеточных пыльцевых зернах гаметы еще не сформированы, и они образуются в ходе роста пыльцевой трубки (рис. 5, 1–8). В обоих вариантах гаметы – спермии. Женские гаметофиты представлены зародышевыми мешками разного строения в зависимости от типа их развития. Гаметами являются яйцеклетка и центральная клетка (рис. 6, 1, 2).
Рис. 5.
Формирование пыльцевого зерна и пыльцевой трубки.
1–4 – Ceratophyllum demersum, 5–8 – C. platyacanthum (Ceratophyllaceae), 9 – Gagea stipitata (Liliaceae), 10 – Hemerocallis citrina (Hemerocallidaceae). g c – генеративная клетка, m – микроспора, n v c – ядро вегетативной клетки, p g – пыльцевое зерно, sp – спермий, v c – вегетативная клетка.
Fig. 5. Formation of pollen grain and pollen tube.
1–4 – Ceratophyllum demersum, 5–8 – C. platyacanthum (Ceratophyllaceae), 9 – Gagea stipitata (Liliaceae), 10 – Hemerocallis citrina (Hemerocallidaceae). g c – generative cell, m – microspore, n v c – nucleus of vegetative cell, p g – pollen grain, sp – sperm, v c – vegetative cell.

Рис. 6.
Сформированный (1) и зрелый (2) зародышевые мешки, начало двойного оплодотворения (3) у Ceratophyllum submersum и завершение этого процесса (4) у C. platyacanthum (Ceratophyllaceae).
1–3 – билатеральные срезы, 4 – сагиттальный срез. s n – вторичное ядро центральной клетки, p n – полярные ядра, s – синергида, sp – спермий, c c – центральная клетка, nc – ядрышко спермия, e c – яйцеклетка.
Fig. 6. Formed (1) and mature (2) embryo sacs, beginning of double fertilization (3) in Ceratophyllum submersum, and completion of this process (4) in C. platyacanthum (Ceratophyllaceae).
1–3 – bilateral sections, 4 – sagittal section. s n – secondary nucleus of central cell, p n – polar nuclei, s – synergid, sp – sperm, c c – central cell, nc – nucleolus of sperm, e c – egg cell.
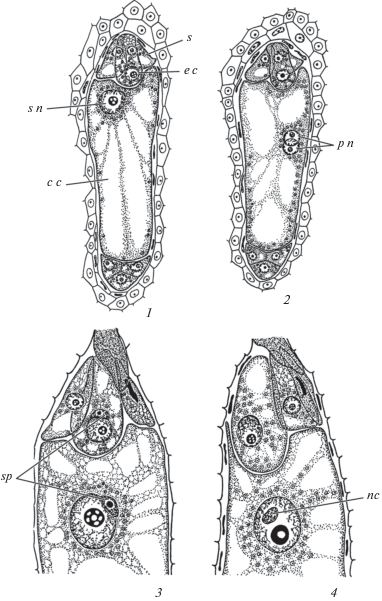
У цветковых растений спермии связаны между собой общей срединной клеточной пластинкой либо выпячиваниями их протопластов с помощью структур, напоминающих плазмодесмы (Russell, Cass, 1981). Были проведены детальные исследования по формированию спермиев. У видов Hordeum (Poaceae) в ходе деления генеративной клетки наблюдается перемещение органелл в периферические районы цитоплазмы. В области веретена деления выявляются микротрубочки, отдельные цистерны гранулярного эндоплазматического ритикулума и много свободных рибосом. В поздней телофазе пузырьки диктиосом и микротрубочки располагаются в центре фрагмопласта, где и формируется срединная клеточная пластинка между спермиями (Charzynska et al., 1988). У Nicotiana tabacum L. (Solanaceae) деление генеративной клетки также сопровождается образованием фрагмопласта между протопластами двух спермиев (Palevitz, 1993), тогда как у Tradescantia virginiana L. (Commelinaceae) этот процесс происходит без участия фрагмопласта и характеризуется образованием перетяжки (Palevitz, Cresti, 1989). У цветковых растений пара спермиев в свою очередь ассоциирована с ядром вегетативной клетки. Возникает мужская оплодотворяющая единица (англ. male germ unit MGU), которая перемещается в направлении зародышевого мешка (Dumas et al., 1985). Существует мнение, что подобный комплекс возникает уже в 2-клеточном пыльцевом зерне, при этом ядро вегетативной клетки контактирует с цитоплазматическим “хвостом” генеративной клетки (здесь находится большое число микротрубочек) (Yermakov et al., 2016).
У большинства цветковых растений спермии изоморфны, однако у некоторых отмечен их диморфизм, спермии одной пары различаются размерами, количеством цитоплазмы и объемом ядер. У Plumbago zeylanica L. (Plumbaginaceae) более крупный спермий контактирует с ядром вегетативной клетки (Russell, 1984). У Nicotiana tabacum спермий, не связанный с ядром вегетативной клетки, меньших размеров, богаче пластидами и беден митохондриями по сравнению с ассоциированным спермием (Yu et al., 1992). Диморфизм выявлен также у представителей других семейств цветковых растений: Chenopodiaceae Spinacia oleracea L. (Wilms, 1986), Brassicaceae Brassica campestris L. и B. oleracea L. (Dumas et al., 1985), Poaceae Zea mays L. (Rusche, Mogensen, 1988), Euphorbiaceae Euphorbia dulcis L. (Murgai, Wilms, 1988), Ericaceae Rhododendron macgregoriae F. Muell. (Taylor et al., 1989), Liliaceae Gagea lutea (L.) Ker Gawl. (Zhang et al., 1995). В цитоплазме MGU обнаружены сократительные белки миозин и актин, входящие в состав микрофиламентов. Миозин располагается на ядре вегетативной клетки и связан с мужскими гаметами с помощью коротких микрофиламентов из актина (Heslop-Harrison J., Heslop-Harrison Y., 1989; Russell, 1992).
Сформированные яйцеклетка и 2 синергиды имеют полные полисахаридные оболочки. В процессе созревания зародышевого мешка происходит потеря части оболочек (возможно, вещества клеточных оболочек перестают аккумулироваться в их апикальных частях) и перед оплодотворением протопласт этих клеток (со стороны центральной клетки) окружен только плазмалеммой. Центральная клетка в области контакта с яйцеклеткой также покрыта плазмалеммой. Здесь формируется экстрацеллюлярное пространство, или “щель”, куда попадают спермии. Ее обозначают как зону взаимодействия гамет (Sprunck et al., 2012). Роль синергид заключается в привлечении пыльцевой трубки для проведения в зародышевый мешок через микропиле (рис. 6, 3, 4). При вхождении ее в одну из синергид через нитчатый аппарат высвобождается содержимое, теряется связь между спермиями и ядром вегетативной клетки и образуются цитоплазматические тела (Russell, 1992). У Gossypium (Jensen, Fisher, 1968), Zea (Vazart, 1969), Spinacia (Wilms, 1981) одна из синергид начинает разрушаться еще до вхождения пыльцевой трубки. У Capsella (Schulz, Jensen, 1968), Helianthus (Newcomb, 1973) обе синергиды остаются неизменными, и только после попадания пыльцевой трубки в любую из них начинаются изменения в ультраструктуре рецептивной синергиды. Независимо от времени вхождения пыльцевой трубки в обоих случаях наблюдаются сходные преобразования в структуре синергид. Как при преждевременной дегенерации, так и при вхождении пыльцевой трубки в интактную синергиду изменения касаются уменьшения объема цитоплазмы, сжатия вакуолей, разрушения плазмалеммы и дезорганизации органелл клеток. В синергиде рост пыльцевой трубки прекращается, она лопается, и спермии высвобождаются. Цитоплазма трубки смешивается с цитоплазмой дегенерирующей рецептивной синергиды (Dresselhaus, Franklin-Tong, 2013). У Plumbago zeylanica при отсутствии синергид пыльцевая трубка в зародышевый мешок входит сбоку яйцеклетки, при этом происходит разрушение компонентов общей срединной клеточной пластинки, а также наружных и внутренних мембран пыльцевой трубки, как между спермиями, так и между яйцеклеткой и центральной клеткой в области возникающей щели (Russell, 1983).
У млекопитающих сперматозоиды имеют двигательный аппарат (хвостовая часть), головку (ядро, акросома) и шейку (рис. 2). Акросома содержит ферменты, необходимые для переваривания наружных оболочек яйца при оплодотворении. Шейка сперматозоида содержит митохондрии, а также центриоль, которая генерирует микротрубочки жгутика. Яйцо представляет собой одиночную клетку, окруженную оболочками различного происхождения, одна из которых, первичная (желточная), может быть очень массивной. У некоторых видов животных (например, у морских ежей, книдарий) к моменту вхождения сперматозоида яйцо является зрелым, а его ядро находится в гаплоидном состоянии. У других видов сперматозоид входит в ооцит 1-го порядка, т.е. еще до начала мейоза, когда его ядро еще диплоидное (круглые черви, некоторые полихеты, моллюски, а также собаки, лисицы) либо во время первого деления мейоза (многие насекомые, а также некоторые полихеты, моллюски), либо во время второго деления (ланцетник, амфибии, рыбы, большинство млекопитающих). Во всех этих случаях спермий проникает в яйцо до завершения мейоза, стимулируя его к дальнейшему развитию и созреванию (Gilbert, 2003). Подобная стимуляция наблюдается у растений после опыления. У орхидных, особенно примитивных представителей, прорастание пыльцы и рост пыльцевых трубок при длительном цветении заставляет их семязачатки завершить процесс развития и приступить к оплодотворению (Yeung et al., 1994; Vij et al., 1999). У Nicotiana tabacum зрелая пыльца 2‑клеточная, и образование спермиев происходит в пыльцевой трубке в тканях столбика. Зародышевый мешок в это время находится на 4- или 8‑ядерной стадии. Зародышевый мешок уже спустя 12 часов приобретает типичное строение и готов к оплодотворению. В микропиле пыльцевая трубка входит через 48 часов после опыления (Tian et al., 2005). У хвойных (кипарисовых, подокарповых и тиссовых) пыльцевая трубка подходит к женскому гаметофиту, в котором еще нет архегония и он находится на свободно-ядерной стадии (Trenin, 1988).
Оплодотворение у растений и животных. Движение спермиев при вхождении в зародышевый мешок цветковых растений осуществляется с помощью актина. В цитоплазме пыльцевой трубки формируются актиновые пучки, или актиновый матрикс. Оба спермия мигрируют с помощью актина до места слияния гамет, при этом одна его ветвь связана со спермием, который сливается с яйцеклеткой, а другая ветвь ассоциирована с другим спермием, объединяющимся с центральной клеткой (Russell, 1992). Возникает вопрос, какой из двух спермиев сливается с яйцеклеткой, а какой с центральной клеткой? Еще Nawaschin (1910) предположил, что в основе этого явления лежит разнокачественность, или энантиоморфизм спермиев. В оплодотворении участвует пара женских ядер (пара женских клеток), одно правое и одно левое, и пара мужских ядер (пара спермиев), также одно правое и одно левое. По его мнению, эта система является необходимым условием для “выбора” яйцеклеткой и полярным ядром (центральной клеткой) соответствующего спермия.
В дальнейшем, действительно у некоторых цветковых растений был выявлен диморфизм спермиев. Так, у Nicotiana tabacum спермий, не связанный с ядром вегетативной клетки, имеет меньшие размеры и сливается с яйцеклеткой, а более крупный с центральной клеткой (Yu et al., 1992). У Torenia fournieri Linden ex E. Fourn. (Scrophulariaceae) сначала один из спермиев сливается с яйцеклеткой. Чуть позже второй спермий перемещается к центральной клетке и размещается вблизи дегенерируюшей синергиды, чему предшествует миграция вторичного ядра из средней части центральной клетки в микропилярную часть. После тройного слияния оплодотворенное ядро первичной клетки эндосперма опускается вниз (Higashiyana et al., 1997). Подобное было отмечено и у других растений. У Galanthus nivalis L. (Amaryllidaceae) еще до вхождения пыльцевой трубки в зародышевый мешок вторичное ядро центральной клетки начинает мигрировать к яйцевому аппарату и оказывается напротив рецептивной синергиды, которая будет дегенерировать, и через нее войдет пыльцевая трубка. Первый из высвободившихся спермиев сливается с яйцеклеткой, а второй оказывается вблизи вторичного ядра и потому сливается с центральной клеткой (Erdelská, 1983). В зародышевом мешке Plumbago zeylanica при отсутствии синергид пыльцевая трубка входит сбоку яйцеклетки. Спермии располагаются по диагонали, при этом сначала с яйцеклеткой сливается удаленный спермий, а затем ближайший с центральной клеткой (Russell, 1983). Однако у растений Arabidopsis thaliana (генетические конструкты) было установлено, что “передний” спермий (связанный с ядром вегетативной клетки в составе MGU), как и “задний” (не связанный с ядром вегетативной клетки), с равной вероятностью оплодотворяли как яйцеклетку, так и центральную клетку. Сделано заключение, что изоморфизм спермиев характеризует общее правило, а их диморфизм скорее исключение (Hamamura et al., 2011).
У цветковых растений спермии очень мелкие, а процесс слияния мужских и женских гамет происходит очень быстро, поэтому не всегда удается увидеть их в области контакта. C помощью конфокального лазерного микроскопа было проведено специальное исследование растений Arabidopsis thaliana (генетические конструкты). Оно позволило выявить задержку спермиев на границе женских гамет под действием продукта гена HTR10-GFP и на поверхности яйцеклетки под действием продукта гена GFP-PIP2. Исходя из анализа представленных иллюстраций видно, что спермии также располагаются по диагонали, при этом спермий, более удаленный от места разгрузки пыльцевой трубки, после прохождения через синергиду объединяется с яйцеклеткой, а второй спермий с центральной клеткой (Igawa et al., 2013). Еще ранее был предложен механизм плазмогамии спермия и женской гаметы, сопровождающийся образованием между ними мостов, через которые проходят ядра клеток спермиев и, вероятно, их цитоплазма (Van Went, 1970; Plyushch, 1992). В дальнейшем было показано, что процесс плазмогамии включает несколько этапов: 1) контакт спермия и женской гаметы; 2) слияние плазматических мембран гамет; 3) объединение цитоплазмы спермия и женской гаметы (Igawa et al., 2013).
Исследования по индукции кариогамии in vitro с помощью электроимпульса были проведены на изолированных мужских и женских гаметах Zea mays (Faure et al., 1993). Кариогамия включает три стадии слияния ядер: 1) наружные мембраны ядерных оболочек тесно соприкасаются или контактируют через эндоплазматический ретикулум и затем сливаются; 2) внутренние мембраны ядерных оболочек сливаются и между ядрами образуются мостики; 3) мостики увеличиваются и могут захватывать некоторое количество цитоплазмы.
Наблюдения за вхождением пыльцевой трубки в зародышевый мешок и анализ строения центральной клетки позволили высказать предположение, что движение ее вторичного ядра еще в прогамной фазе в направлении яйцевого аппарата представляет собой сигнальный механизм, свидетельствующий о том, какая из двух синергид будет принимающей (Huang et al., 1993). Следует отметить, что высказанное предположение пока не подтвердилось, и механизм выбора рецептивной синергиды не ясен. Второй вывод, вытекающий из этого анализа, свидетельствует о том, что из женских гамет первой и предпочтительной для сингамии является яйцеклетка. После образования зиготы формируется полная полисахаридная оболочка, и в яйцеклетку прекращается доступ других спермиев. Именно после этого, даже если не завершились процессы кариогамии ядер яйцеклетки и спермия, поступает, по-видимому, сигнал на осуществление тройного слияния и образование первичной клетки эндосперма. Сходное поведение спермиев во время оплодотворения присуще также голосеменным. У видов Ephedra из двух спермиев, поступающих в яйцеклетку, первым сливается ядро спермия с ядром яйцеклетки в ее средней части. Ядро второго спермия перемещается из апикальной части яйцеклетки в центральную и далее входит в брюшную канальцевую клетку (Friedman, 1990).
У некоторых цветковых растений (амариллисовых, рудбекии, хлопчатника, кукурузы) обнаружена гемигамия, представляющая собой незавершенный половой процесс, при котором спермий проникает в яйцеклетку, однако кариогамия не происходит. Тем не менее, спермий стимулирует яйцеклетку к эмбриогенезу. Как ядро яйцеклетки, так и ядро спермия делятся автономно, образуя в дальнейшем химерный зародыш. Его клетки преимущественно гаплоидные, хотя в месте контакта ядер спермия и яйцеклетки возможно образование гибридной диплоидной ткани (Solntseva, 1973, 1979; Battaglia, 1981). Именно поэтому гемигамию предлагают называть гинандроэмбрионией (Battaglia, 1981). Гемигамия не является облигатным признаком растений и зависит от факторов внешней среды (температура, освещенность, влажность почвы и воздуха). У Zephyranthes candida она отмечалась иногда, а у Z. macrosiphon (Amaryllidaceae) обнаружена в 80% семязачатков в завязи, при этом в остальных семязачатках осуществляется сингамия по премитотическому типу (Vorsobina, Solntseva, 1979). Это явление близко к вторичным видоизменениям полового способа репродукции: андрогенезу, гиногенезу и гибридогенезу (Grebel’nyi, 2008). В случае андрогенеза входящее ядро спермия замещает ядро яйцеклетки, вызывая трансформированную яйцеклетку к развитию. Формирование гаплоидных и дигаплоидных особей обнаружено у кукурузы (Tyrnov, 2000) и пресноводных двустворчатых моллюсков (Grebel’nyi, 2008). При гиногенезе мужская гамета проникает в яйцеклетку, активирует ее к морфогенезу, но в дальнейшем развитии не принимает участия или участвует в незначительной степени. Гиногенез обнаружен у животных серебряного карася, хвостатых земноводных, пресноводной планарии (Grebel’nyi, 2008). У растений примеры гиногенеза не известны. При гибридогенезе (реверсивном партеногенезе, по Tyrnov, 2000; реверсивном гиногенезе, по нашему мнению, так как при партеногенезе спермий не входит в яйцеклетку) потомство развивается из оплодотворенных яиц и во многих случаях состоит из самок, при этом их клетки несут признаки обоих родителей. При половом созревании во время оогенеза отцовские хромосомы элиминируют живородящие рыбки, “съедобная” лягушка (Grebel’nyi, 2008). Очень близкое по генетическим последствиям явление описано у видов Allium (Alliaceae). У A. ramosum L. и A. tuberosum Rottler ex Spreng. обнаружена эндоредупликация хромосом во время премейотической интерфазы в мегаспороците или на самых ранних стадиях мейоза (соответствуют стадиям лептотены или пахитены нормального мейоза). В результате дальнейшей диплоспории плоидность возникающих спор и зародышевых мешков становится 4n, а не 2n, как при типичной диплоспории. Затем путем партеногенеза образуются тетраплоидные апомиктичные растения. Среди потомства таких растений, полученных при перекрестном опылении, возникали дигаплоиды, один из которых (KAD2) являлся диплоидным апомиктом (большинство диплоидных растений), а другой – преимущественно диплоидным амфимиктом (Håkansson, 1951; Kojima, Nagato, 1992, 1997). Таким образом, в ходе репродукции произошло сокращение числа хромосом вдвое до 2n, как это было у мегаспороцитов перед мейозом у тетраплодных растений.
У ряда цветковых растений (Podostemaceae) из-за аномалий во время тройного слияния эндосперм не образуется (Kapil, 1970). Функцию эндосперма выполняет так называемый “нуцеллярный плазмодий”. Он формируется из клеток халазальной области нуцеллуса. Уже на стадии 2‑ядерного зародышевого мешка происходит дезинтеграция клеток этой зоны и постепенно возникает ценоцитный симпласт (Arekal, Nagendran, 1975). У представителей сем. Trapaceae наблюдается выпадение процесса тройного слияния вследствие нарушения механизма расхождения спермиев – у Trapa astrachanica (Flerow) N.A. Winter происходит задержка одного из спермиев в синергиде или экстрацеллюлярном пространстве (Titova, 1988). У T. natans центральная клетка оплодотворяется, но первичное ядро эндосперма становится гипертрофированным и смещается в халазальную часть, контактируя с клетками нуцеллуса (постамента и подиума), в которых накапливаются белки и крахмал (Titova et al., 1997). У большинства орхидных сингамия и тройное слияние происходят без отклонений. Однако у некоторых видов (Oreorchis patens (Lindl.) Lindl., Listera nipponica Makino, Calanthe × veitchii R.H. Torr.) ядро спермия не сливается с ядром центральной клетки. У Calanthe × veitchii полярные ядра до оплодотворения обычно автономные и вместе с ядром антиподы образуют полярно-антиподальную группу, расположенную чаще всего около зиготы (Savina, 1979; Savina, Poddubnaya-Arnoldi, 1990). У Gymnadenia conopsea и Listera ovata тройное слияние происходит. Возникшее крупное ядро эндосперма находится вблизи клеток постамента, в которых обнаруживаются декстрины (Shamrov, 2008). Таким образом, виды с нарушениями в ходе тройного слияния и без эндосперма требуют дополнительных исследований. С одной стороны, очень важно выявить дублирующие механизмы в зародышевом мешке, которые выполняли бы не только трофическую функцию, но и участвовали в обеспечении и распределении сигналов, регулирующих процессы дифференциации и органогенеза зародыша, как это присуще эндосперму половой природы покрытосеменных растений (Chen et al., 2014; Costa et al., 2014; Locascio et al., 2014; Doll et al., 2017). С другой стороны, возможно, что аномалии в процессе слияния центральной клетки и спермия не дают формирующимся зародышам развиваться до конца. Образуются аберрантные семена. Поэтому требуются широкие подробные исследования на уровне популяций с привлечением статистических методов обработки данных. Одна из таких работ была посвящена изучению летальных отклонений в развитии зародыша у Dactylorhiza fuchsii (Druce) Soó (Orchidaceae). Было выявлено, что в большинстве формирующихся семян на ранних стадиях присутствуют глобулярные зародыши. Однако в дальнейшем выявляются различные аномалии в их строении (нерегулярность клеточных делений, отсутствие закономерностей в гистогенезе – всего 12 типов нарушений), что приводит к низкой реальной семенной продуктивности (Andronova, 2011).
У млекопитающих половой процесс включает контакт сперматозоида с яйцом и взаимное узнавание гамет; регуляцию проникновения сперматозоида в яйцо, вхождение в него только одного сперматозоида и образование твердой оболочки оплодотворения; последующее подавление способности других сперматозоидов проникать в это яйцо, объединение генетического материала сперматозоида и яйца, активацию метаболизма яйца и начало развития (Gilbert, 2003). У животных мужской пронуклеус мигрирует к женскому пронуклеусу с помощью микротрубочек с участием центросомы или ее производных центриолей (Schatten et al., 1986; Sathananthan et al., 1991). Последние структуры отсутствуют у растений.
Еще до осуществления полового процесса у цветковых растений на рыльце, а затем в тканях столбика и завязи происходит контакт между спорофитом и мужским гаметофитом. Все этапы прорастания пыльцы и роста пыльцевой трубки (вплоть до высвобождения из нее спермиев в принимающей синергиде) находятся под контролем молекулярных механизмов (Kanaoka, 2018). На основе физиолого-биохимических исследований по взаимодействию пыльцы и пыльцевых трубок с тканями рыльца, столбика, завязи, семязачатка и развивающегося зародыша выделяют 3 фазы оплодотворения (Polyakov, 1970): прогамная фаза длится вплоть до подхода пыльцевых трубок к семязачаткам (обычно все процессы до вхождения пыльцевой трубки в зародышевый мешок); фаза гамогенеза включает в себя взаимодействие пыльцевых трубок с тканями семязачатка, в том числе и двойное оплодотворение (эту фазу лучше называть сингамной, так как гаметогенез, особенно мужской, происходит еще до опыления или во время первых стадий прорастания пыльцы); постгамная фаза – процессы, происходящие после оплодотворения (начало развития зародыша и эндосперма).
Для осуществления оплодотворения у растений создается проводниковый тракт пестика, представляющий совокупность структурных элементов гинецея, обеспечивающих его взаимодействие с мужским гаметофитом в прогамной фазе оплодотворения. Он включает все ткани пестика (рыльца, столбика и завязи), с которыми контактируют пыльцевые зерна и растущие пыльцевые трубки (Vishnyakova, 1997). Роль рыльца заключается в восприятии пыльцы. Рыльца различаются по морфологии (головчатые, перистые) и строению воспринимающей поверхности: сухие покрыты сосочковидными клетками-папиллами, влажные – на их поверхности выделяется секрет или секреторная слизь. Столбики бывают открытыми (полые, имеется канал), закрытыми (сплошные) и полузакрытыми. Они приподнимают рыльце вверх, что связано с особенностями опыления. В пестике дистальную часть, образованную верхней частью завязи и столбиком, называют компитумом.
Проводниковый тракт образован клетками секреторного типа, которые выделяют на поверхность вещества различной природы (белки, липиды, полисахариды), участвующие в механизмах узнавания и являющиеся своеобразными аттрактантами, направляющими рост пыльцевых трубок. Для обеспечения прохождения пыльцевых трубок возникают специализированные ткани секреторного типа – обтураторы. Они локализованы в различных частях завязи и семязачатка и представлены эпидермальными удлиненными клетками, которые растут в направлении микропиле и часто закрывают вход в него. Существуют различные классификации обтураторов. В зависимости от происхождения и положения их в завязи и семязачатке следует различать два основных типа обтураторов: 1) овулярные обтураторы, формирующиеся из клеток семязачатка; 2) овариумные, формирующиеся из клеток завязи. Учитывая положение обтураторов в семязачатке или завязи в каждом типе можно выделить ряд вариантов: в овулярном типе интегументальный, фуникулярный и нуцеллярный, в овариумном типе – плацентарный, париетальный и септальный обтураторы (Shamrov, 2008a).
По времени действия генов и месту локализации их продуктов различают два типа самонесовместимости: гаметофитную и спорофитную. В пыльцевом зерне продукты генов самонесовместимости локализуются в спородерме. При гаметофитном типе контроля они поступают из протопласта микроспоры в интину, позднее переходя в создаваемую ею оболочку пыльцевой трубки, а при спорофитной самонесовместимости локализуются в экзине (Knox et al., 1975). Продуктами генов самонесовместимости являются гликопротеиды. Иммунохимическими тестами установлено, что местом их локализации в пестике при спорофитном контроле самонесовместимости являются оболочки эпидермальных клеток рыльца (Kandasamy et al., 1989). В случае гаметофитной самонесовместимости у Nicotiana alata специфические гликопротеиды выявляются как компонент межклеточного матрикса проводниковой ткани столбика и эпидермы плаценты (Cornish et al., 1987).
У цветковых растений после проникновения спермия в яйцеклетку образуется полная полисахаридная оболочка зиготы подобно тому, как возникает твердая оболочка у животных после проникновения сперматозоида в яйцо. У млекопитающих довольно сложный механизм регуляции проникновения спермия в яйцо. Только один спермий может оплодотворить яйцо, не вызывая аномалий в развитии. Предполагают два блока полиспермии. Быстрый блок электрический, связан с ионами натрия, при этом растет мембранный потенциал покоя. Медленный блок физический, обусловлен ионами кальция. Волна ионов кальция распространяется от точки проникновения спермия, вызывая слияние кортикальных гранул оболочки с плазматической мембраной яйца. Благодаря высвобождению содержимого этих гранул утолщается желточная оболочка, которая, затвердевая, превращается в оболочку оплодотворения. Сперматозоиды не могут больше сливаться с яйцом. При оплодотворении яйца двумя спермиями три набора хромосом не могут правильно распределиться между возникающими клетками, что обычно приводит к летальности (Gilbert, 2003). У цветковых растений вхождение дополнительных пыльцевых трубок в зародышевый мешок отмечали многие, однако случаи слияния женских гамет с более чем одним спермием не всегда регистрируются, поскольку это происходит только при отклонениях. Так, у Sternbergia lutea (L.) Ker Gawl. ex Spreng. (Amaryllidaceae) выявлены случаи, когда оба спермия задерживались в синергиде, останавливались около яйцеклетки либо входили в нее, при этом центральная клетка оставалась неоплодотворенной (Vorsobina, Solntseva, 1979). У Dioscorea nipponica наблюдали 2 спермия в центральной клетке. По мнению автора, мужские гаметы одной пыльцевой трубки не разошлись к разным женским гаметам, а оказались в одной, при этом яйцеклетка осталась неоплодотворенной (Torshilova, 2018). Подобное отмечали при апомиксисе у некоторых видов Poa (Poaceae). Эти виды характеризуются формированием нередуцированных зародышевых мешков и псевдогамией, при которой зародыш развивается партеногенетически, а эндосперм – в результате оплодотворения центральной клетки. Поскольку в центральной клетке плоидность ядра возрастает в 2 раза и становится 4n, то для достижения оптимального соотношения материнского и родительского геномов (2:1) необходимо вхождение в нее двух спермиев c гаплоидными ядрами. И, таким образом, при псевдогамии оба спермия из пыльцевой трубки входят только в центральную клетку, поскольку спермий оказывается не нужным для партеногенетического развития зародыша (Yudakova et al., 2018). Вхождение обоих спермиев пыльцевой трубки в центральную клетку при отклонениях и отсутствие сингамии в яйцеклетке можно рассматривать как одно из проявлений перехода от амфимиксиса к апомиксису, особенно к партеногенезу. Механизмы блокировки полиспермии у растений не известны.
Как мы уже отмечали, на основании сравнения процессов оплодотворения у цветковых растений и животных выделены два типа оплодотворения: премитотический (сложноцветные, сцилла, злаки, фукус – растения; морской еж – животные) и постмитотический (лилия, фритиллярия, сосна – растения; аскарида – животные) в зависимости от того, когда наступает объединение ядер половых клеток (Gerassimova-Navashina, 1947, 1957, 1969). Однако целесообразность такого сравнения требует внесения корректив и учета специфики прохождения процесса оплодотворения у некоторых растений и животных. Важно принимать во внимание не только время слияния половых ядер, но и состояние мужских и женских гамет в процессе объединения.
Прежде всего, предложенная гипотеза не полностью раскрывает различия в типах оплодотворения, так как в ней почти не рассматриваются особенности плазмогамии, первого из этапов сингамии. К тому же, в зарубежной литературе термины “премитотический” и “постмитотический” применительно к оплодотворению практически не применяются. Чаще всего описывают различия в скорости слияния половых ядер, исходя из стадий интерфазы, предшествующей делению зиготы, при этом типы оплодотворения приравниваются к типам кариогамии. Так, Van Went и Willemse (1984), ссылаясь на представления Gerassimova-Navashina (1960), описывают выделенные ею типы оплодотворения, как особенности слияния ядер мужских и женских гамет, при этом при постмитотическом типе, по их мнению, хроматин половых ядер остается полностью разделенным до деления зиготы. Подобным образом поступает в одной из работ и сама Е.Н. Герасимова-Навашина (Gerassimova-Navashina, 1971). Как мы увидим далее, автором, действительно, больше внимания уделено особенностям половых ядер в момент их вхождения в зародышевый мешок и в ходе сингамии. Однако оплодотворение включает не только кариогамию, но и плазмогамию. Исходя из этого, число типов оплодотворения может быть увеличено. По нашему мнению, в классификацию типов оплодотворения следует добавить гемигамию и андрогенез. В типах оплодотворения выявляются различия не только в скорости слияния половых ядер (премитотический и постмитотический типы), но и поведении ядер спермиев, которые, как правило, объединяются с ядрами женских гамет (сингамия), но могут не контактировать с ними и оставаться самостоятельными (гемигамия) либо заменить ядра женских гамет вообще (андрогенез).
Исходя из митотической гипотезы и особенностей спермиогенеза, было установлено (Gerassimova-Navashina, 1947, 1957), что спермии представлены телофатическими ядрами и характеризуются состоянием незаконченного митотического цикла (здесь и далее описание всех процессов, происходящих при оплодотворении, дано в авторской трактровке!). Женские половые клетки проходят полный митотический цикл, а их ядра находятся в состоянии митотического покоя. Прежде чем продолжить свое развитие спермий должен пройти состояние покоя, а женская клетка выйти из этого состояния. При премитотическом типе оплодотворения слияние половых ядер происходит перед началом митоза зиготы. Ядро спермия в состоянии телофазы, подойдя к женскому ядру, способно “растворить” оболочку последнего, погрузиться в него и закончить свой цикл впадением в покой, одним из признаков которого является выделение ядрышка (см. рис. 6, 4). Зигота после некоторого периода покоя, уже как одно целое, приступает к первому делению (сложноцветные). Второй тип оплодотворения (постмитотический) спермий попадает в зародышевый мешок на более поздней стадии, когда его ядро имеет собственную оболочку. Поэтому, придя в контакт с женским ядром, оно не может пройти фазу покоя. Объединение половых ядер наступает лишь в профазе зиготы, когда оба ядра лишаются оболочек (описание процессов дается в авторской версии). Было уточнено состояние ядер спермиев, входящих в женские гаметы: при премитотическом типе они находятся в G0 или G1-фазах клеточного цикла интерфазы, при постмитотическом типе – в G1, S или G2-фазах (Gerassimova-Navasina, 1969, 1971). Следует отметить, что типы оплодотворения не являются константными и могут изменяться в зависимости от окружающих факторов, например, при воздействии низкой температуры у Crepis capillaris (L.) Wallr. из сем. Asteraceae (Gerassimova-Navashina et al., 1968). У Epipactis atrorubens (Hoffm.) Besser (Orchidaceae) сингамия чаще всего происходит по постмитотическому типу, но иногда может осуществляться по премитотическому типу (Savina, 1979).
Как уже было отмечено, у животных при постмитотическом оплодотворении сперматозоид попадает не в зрелое яйцо, а в ооцит во время первого или второго делений мейоза. У цветковых растений к моменту оплодотворения женские гаметы уже прошли в своем развитии как мегаспорогенез, так и гаметогенез, при этом синергиды начинают выделять аттрагирующие вещества в микропиле, что позволяет пыльцевой трубке войти в зародышевый мешок. Следовательно, особенности в прохождении постмитотического типа оплодотворения у растений скрыты не в специфике мейоза, как у животных, и даже не в прохождении гаметогенеза, а, по-видимому, в строении женских гамет к моменту вхождения пыльцевой трубки в зародышевый мешок.
Развитие и строение зародышевого мешка описывают понятиями “сформированный зародышевый мешок” (после деления ядер происходит клеткообразование) и “зрелый зародышевый мешок” (завершились процессы дифференциации и специализации его элементов) (Batygina, 1994). По сравнению с другими клетками наибольшие различия выявлены в строении яйцевого аппарата: “отчетливо дифференцированный”, “слабо дифференцированный” и “недифференцированный”. При этом рассматриваются такие признаки, как размеры, форма, полярность и топография его элементов, наличие или отсутствие в синергидах нитчатого аппарата. На ультраструктурном уровне организации яйцевого аппарата учитывается не столько соотношение органелл, которое может быть одинаковым у яйцеклетки и синергид, сколько частота и характер их распределения, электронная плотность гиалоплазмы и нуклеоплазмы (Plyushch, 1992).
Отчетливо дифференцированный, или типично дифференцированный, яйцевой аппарат описан у видов Scilla, Crepis, Triticum, Rudbeckia (Ge-rassimova-Navashina, Batygina, 1958; Batygina, 1974; Plyushch, 1992). У видов этих растений обнаружен премитотический тип оплодотворения. Примерами недифференцированного яйцевого аппарата являются Lilium regale E.H. Wilson (Petrova, 1977), Tamarix kotschyi Bunge (Pluyshch, 1992). Такое же строение присуще, по-видимому, Fritillaria tenella и Lilium martagon, изученным Навашиным (Nawaschin, 1898a, b). Указанным видам характерен постмитотический тип оплодотворения.
Возможно, различия в клетках яйцевого аппарата связаны с типами развития зародышевого мешка (моноспорический, биспорический, тетраспорический), с наличием или отсутствием нитчатого аппарата в синергидах. Не исключено, что на скорость и время объединения половых ядер влияет стадия развития яйцеклетки и зиготы (Vasilyeva, Batygina, 1997). Это позволяет предположить у растений, как и у животных, наличие механизма стимуляции спермиями женских гамет, чтобы они завершили свое развитие еще до процессов кариогамии в яйцеклетке и центральной клетке.
На основе детальных исследований содержания ядерной ДНК в мужских и женских гаметах Gnetum gnemon с помощью флуоресцентной микроскопии выделены три типа кариогамии у семенных растений (Carmichael, Friedman, 1995): G1-кариогамия (ядра гамет содержат 1С ДНК во время оплодотворения, а зигота вступает в фазу синтеза ДНК перед митозом); S-кариогамия (ядра гамет содержат 1С ДНК в начале оплодотворения, репликация ДНК происходит перед концом слияния ядер гамет); G2-кариогамия (ядра гамет проходят S-период клеточного цикла и увеличивают содержание ДНК от 1С до 2С до оплодотворения). Согласно концепции контроля клеточного цикла, клетка не может вступать в митоз до тех пор, пока не произойдет репликация ДНК (Jacobs, 1992). При установленных типах кариогамии репликация ДНК происходит либо еще в гаметах (G2-кариогамия), перед концом слияния ядер гамет (S-кариогамия) или после кариогамии, но до деления зиготы (G1-кариогамия), т. е. в соответствии с премитотическим типом оплодотворения. У Nicotiana tabacum было показано, что если слияние гамет происходит в G1-фазе, то после кариогамии наступает S-фаза и деление зиготы. Если же гаметы сливаются в G2-фазе, то зигота вступает в митоз без дополнительного синтеза ДНК (Tian et al., 2005). Чтобы охарактеризовать постмитотический, а также промежуточный типы оплодотворения был предложен М-тип кариогамии, когда половые ядра объединяются в ходе митоза (Vasilyeva, Batygina, 1997). Кроме того, характеристика типов кариогамии была дополнена стадиями развития яйцеклетки и зиготы: G2-кариогамия – яйцеклетка (репликация ДНК перед началом сингамии), S-кариогамия – незрелая зигота (репликация ДНК в конце слияния ядер), G1- кариогамия – зрелая зигота (репликация ДНК после полной кариогамии), М-кариогамия – незрелая зигота (репликация ДНК перед окончанием кариогамии и перед митозом).
Таким образом, премитотический тип оплодотворения происходит одинаково у животных и растений, так как протопласты и ядра гамет объединяются до первого митоза ядра зиготы. Что касается постмитотического типа, то он осуществляется на совершенно разной базе. У животных сперматозоид входит в развивающийся ооцит во время первого или второго делений мейоза. Он активирует формирующееся яйцо к дальнейшему развитию, затем происходит оплодотворение, но хроматин обоих ядер конденсируется в хромосомы, которые располагаются отдельно на общем митотическом веретене и у млекопитающих с постмитотическим оплодотворением диплоидный набор хромосом формируется не в зиготе, а на стадии двухклеточного зародыша (Gilbert, 2003). Считается, что у цветковых растений гаметы и их ядра объединяются в ходе митоза ядра зиготы во время формирования метафазной пластинки (Gerassimova-Navasina, 1947, 1971). Однако, заключение о слиянии ядер при постмитотическом оплодотворении у растений, по-видимому, нуждается в корректировке. Обычно схематически показывают метафазу деления зиготы, но детальные картины объединения мужских и женских хромосом отсутствуют. Возможно, что и у растений хромосомы спермия и яйцеклетки объединяются не во время митоза. Они далее самостоятельно делятся, и диплоидный набор хромосом создается не в зиготе, а в 2-клеточном зародыше. Именно при такой трактовке объединения хромосом половых ядер понятие “постмитотический тип оплодотворения” приобретает первоначальный смысл – объединение половых ядер и включенных в них хромосом происходит после митоза в зиготе, а именно в процессе цитокинеза и образования 2- клеточного зародыша.
ЗАКЛЮЧЕНИЕ
Несмотря на кажущие различия между растениями (неподвижный образ жизни, клетки растений способны к фотосинтезу и имеют полисахаридные оболочки, пластиды, вакуоли и другие признаки) и животными (подвижный образ жизни, отсутствие клеточных оболочек, пластид, вакуоли, наличие центриолей и другие признаки), закономерности формирования половых клеток у них поразительно идентичны – в результате мейоза и последующего цитокинеза из одной диплоидной клетки образуются 4 гаплоидные клетки, при этом в женской репродуктивной сфере обычно только одна гаплоидная клетка способна в дальнейшем преобразоваться в гамету. Довольно сходны механизмы, предшествующие слиянию мужских и женских гамет, сам половой процесс, при котором после плазмогамии закрывается доступ для вхождения в яйцеклетку (яйцо) дополнительных мужских гамет. По-видимому, и растениям, и животным присущи сходные типы оплодотворения, различающиеся между собой темпом слияния половых ядер и фазой митоза, во время которой происходит кариогамия.
К настоящему времени накопился обширный фактический материал, который нуждается в уточнении и ревизии. Можно предложить ряд актуальных направлений по исследованию двойного оплодотворения.
1. При изучении оплодотворения важно характеризовать не только особенности кариогамии половых ядер, но и уделять внимание процессам, происходящим во время плазмогамии. Поэтому в классификацию типов оплодотворения к двум типам (премитотическому и постмитотическому) предложено включить явления гемигамии и андрогенеза, которые до этого рассматривались в рамках форм апомиксиса.
2. Заключение о слиянии ядер при постмитотическом оплодотворении у цветковых растений нуждается в корректировке. Возможно, что у растений, как и животных, хромосомы спермия и яйцеклетки объединяются после деления ядра зиготы. Поэтому нужны подробные исследования по состоянию ядер во время слияния, в ходе митоза и при образовании 2-клеточного зародыша.
3. В отличие от животных, у цветковых растений особенности в прохождении постмитотического типа оплодотворения скрыты не в специфике мейоза и даже гаметогенеза, а, по-видимому, в строении клеток яйцевого аппарата, что проявляется в незавершенности процессов специализации яйцеклетки и синергид к моменту вхождения пыльцевой трубки в зародышевый мешок. Необходимо выявить особенности стимуляции клеток яйцевого аппарата и те цитологические механизмы, которые обеспечивают полное объединение генетического материала мужских и женских половых ядер при постмитотическом оплодотворении.
4. Особенно следует обратить внимание на те объекты, у которых сингамия может происходит, как по постмитотическому, так и премитотическому типу.
5. У ряда цветковых растений из-за аномалий во время тройного слияния эндосперм не образуется. Таким образом, эти виды требуют дополнительных исследований. С одной стороны, очень важно выявить дублирующие механизмы в зародышевом мешке, которые выполняли бы не только трофическую функцию, но и участвовали в обеспечении и распределении сигналов, регулирующих процессы дифференциации и органогенеза зародыша, как это присуще эндосперму половой природы покрытосеменных растений. С другой стороны, возможно, что аномалии в процессе слияния центральной клетки и спермия не дают формирующимся зародышам развиваться до конца. Образуются аберрантные семена. Поэтому требуются широкие подробные исследования на уровне популяций с привлечением статистических методов обработки данных.
Список литературы
[Afanas’ev et al.] Афанасьев Ю.И., Кузнецов С.Л., Юрина Н.А., Котовский Е.Ф. и др. 2006. Гистология, цитология и эмбриология. М. 766 с.
[Andronova] Андронова Е.В. 2011. Летальные аномалии строения и развития зародыша у Dactylorhiza fuchsii (Orchidaceae). – Бот. журн. 96 (7): 858–863.
Arekal G.D., Nagendran C.R. 1975. Is there a Podostemon type of embryo sac in the genus Farmeria? – Caryologia. 28 (2): 229–235.
Battaglia E. 1981. Embrylogical questions: 3. Semigamy, hemigamy and gynandroembryony. – Ann. Bot. (London). 39 (2): 173–175.
[Batygina] Батыгина Т.Б. 1974. Эмбриология пшеницы. Л. 206 с.
[Batygina] Батыгина Т.Б. 1994. Зародышевый мешок: сформированный и зрелый. – В кн.: Эмбриология цветковых растений. Терминология и концепции. СПб. Т. 1. С. 188.
Berger F., Twell D. 2011. Germline specification and function in plants. – Annu. Rev. Plant Biol. 62: 113–121.
Carmichael J., Friedman W. 1995. Double fertilization in Gnetum gnemon: the relationship between the cell cycle and sexual reproduction. – The Plant Cell. 7: 1975–1988.
Charzynska M., Ciampolini F., Cresti M. 1988. Generative cell division and sperm cell formation in barley. – Sex. Plant Reprod. 1: 240–247.
Chen J., Lausser A., Dresselhaus T. 2014. Hormonal responses during early embryogenesis in maize. – Biochem. Soc. Trans. 42: 325–331.
Cornish E.C., Pettit J.M., Bonig I., Clarke A.E. 1987. Developmentally-controlled tissue-specific expression of a gene associated with self-incompatibility in Nicotiana alata. – Nature. 326: 99–102.
Costa L.M. Marshall E., Tesfaye M. et al. 2014. Flowering plants central cell-derived peptides regulate early embryo patterning in flowering plants. – Science. 344: 168–172.
[Danilov, Borovaya] Данилов Р.К., Боровая Т.Г. 2018. Гистология, эмбриология, цитология. СПб. 520 с.
Diboll A.G. 1968. Fine structure development of the megagametophyte of Zea mays following fertilization. – Amer. J. Bot. 55 (7): 787–806.
Doll N.M., Depege-Fargeix N., Rogowsky P.M., Widiez T. 2017. Signaling in early maize kernel development. – Mol. Plant. 10: 375–388.
Dresselhaus T., Franklin-Tong N. 2013. Male-female crosstalk during pollen germination, tube growth and guidance, and double fertilization. – Mol. Plant. 6: 1018–1036.
Dumas C., Knox R.B., Gaude T. 1985. The spatial association of the sperm cells and vegetative nucleus in the pollen grain of Brassica. – Protoplasma. 124 (3): 168–174.
Embryology of angiosperms. 1984. Berlin etc. 830 p.
[Embryology…] Эмбриология цветковых растений. Терминология и концепции. 1994. СПб. Т. 1. 508 с.
Embryology of flowering plants. Terminology and concepts, 2002. Vol. 1. Enfield, NH, USA. 421 p.
Erdelská O. 1983. Microcinematographical investigation of the female gametophyte, fertilization and early embryo and endosperm development. – In: Fertilization and embryogenesis in ovulated plants. Bratislava, Czechoslovakia. P. 49–54.
[Ermakov et al.] Ермаков И.П., Матвеева Н.П., Брейгина М.А. 2016. Физиология гаплоидного поколения семенных растений. М. 276 с.
Faure J.-E., Mogensen H.L., Dumas C., Lőrz H., Kranz E. 1993. Caryogamy after electrofusion of single egg and sperm cell protoplasts from maize: cytological evidence and time course. – Plant Cell. 5: 747–755.
Friedman W.E. 1990. Sexual reproduction in Ephedra nevadens (Ephedraceae): further evidence of double fertilization in a nonflowering seed plant. – Amer. J. Bot. 77 (12): 1582–1598.
Friedman W.E. 1991. Double fertilization in Ephedra trifurca, a nonflowering seed plant: The relationship between fertilization events and the cell cycle. – Protoplasma. 165: 106–120.
Friedman W.E. 1994. The evolution of embryogeny in seed plants and the developmental origin and early history of endosperm. – Amer. J. Bot. 81 (11): 1468–1486.
Friedman W.E., Williams J.E. 2004. Developmental evolution of the sexual process in ancient flowering plant lineages. – The Plant Cell. 16: 119–132.
[Gerassimova-Navashina] Герасимова-Навашина Е.Н. 1947. Митотическая гипотеза двойного оплодотворения. – Докл. Акад. наук СССР. 57 (4): 395–398.
[Gerassimova-Navashina] Герасимова-Навашина Е.Н. 1957. Оплодотворение как онтогенетический процесс. – Бот. журн. 42 (11): 1654–1673.
Gerassimova-Navashina H.N. 1960. A contribution to the cytology of fertilization in flowering plants. – Nucleus. 3 (1): 111–120.
Gerassimova-Navashina H.N. 1969. Some cytological aspects of double fertilization. – Rev. Cytol. Biol. Vég. 32 (3–4): 301–308.
[Gerassimova-Navashina] Герасимова-Навашина Е.Н. 1971. Двойное оплодотворение покрытосеменных и некоторые его теоретические аспекты. – В кн.: Проблемы эмбриологии. Киев. С. 113–152.
[Gerassimova-Navashina] Герасимова-Навашина Е.Н. 1990. Оплодотворение у покрытосеменных растений. – Бот. журн. 75 (8): 1061–1071.
[Gerassimova-Navashina, Batygina] Герасимова-Навашина Е.Н., Батыгина Т.Б. 1958. Процесс оплодотворения у Scilla sibirica Andr. – Бот журн. 43 (7): 958–988.
[Gerassimova-Navashina et al.] Герасимова-Навашина E.H., Капил Р.Н., Коробова С.Н., Савина Г.И. 1968. Процесс двойного оплодотворения при пониженных температурах. – Бот. журн. 53 (5): 614–627.
Gilbert S.F. 2003. Developmental biology. Sunderland, Massachusetts. 850 p.
Goebel K. 1880. Beiträge zur vergleichenden Entwicklungsgeschichte der Sporangien. – Bot. Zeit. 38: 32–33, 545–552, 561–571.
Goebel K. 1881. Beiträge zur vergleichenden Entwicklungsgeschichte der Sporangien. – Bot. Zeit. 39: 42–44, 681–694, 697–706, 713–719.
[Goroschankin] Горожанкин И.Н. 1880. О корпускулах и половом процессе у голосеменных растений. – Уч. зап. Моск. унив. Отд. ест.-ист. 1 (8): 1–177.
[Grebelnyi] Гребельный. С.Д. 2008. Клонирование в природе. Роль остановки генетической рекомбинации в формировании фауны и флоры. СПб. 287 с.
Guignard L. 1886. Observation sur les ovules et la fécondation des Cactées. – Bull. Soc. Bot. France. 33: 276–280.
Guignard L. 1899. Sur les anthérozoides et la double copulation sexuelle chez les végétaux angiosperm. – Rev. Gén. Bot. 11: 129–135.
Håkansson A. 1951. Parthenogenesis in Allium. – Bot. Notiser. 2: 143–179.
Hamamura Y., Saito C., Awai C., Kurihara D., Miyawaki A., Nakagawa T., Kanaoka M.M., Sasaki N., Nakano A., Berger F., Higashiyama T. 2011. Live-cell imaging reveals the dynamics of two sperm cells during double fertilization in Arabidopsis thaliana. – Curr. Biol. 21: 497–502.
Heslop-Harrisson J., Heslop-Harrisson Y. 1989. Myosin associated with the surfaces c organelles, vegetative nuclei and generative cells in angiosperm pollen grains and tubes. – J. Cell Sci. 94 (2): 319–325.
Higashiyama T., Kuroiwa H., Kawano S., Kuroiwa T. 1997. Kinetics of double fertilization in Torenia fournieri based on direct observation of the naked embryo sac. – Planta. 203 (1): 101–110.
Huang B.-Q., Strout G.W., Russell S.D. 1993. Fertilization in Nicotiana tabacum: ultrastructural organization of propanejet-frozen embryo sacs in vivo. – Planta. 191: 256–264.
Igawa T., Yanagawa Yu., Miyagishima Shin-ja, Mori T. 2013. Analysis of gamete membrane dynamics during double fertilization of Arabidopsis. – J. Plant. Res. 126 (3): 387–394.
Jacobs T.W. 1992. Control of the cell cycle. – Dev. Biol. 153: 1–15.
Jensen W.A., Fisher D.B. 1968. Cotton embryogenesis: The entrance and discharge of the pollen tube in the embryo sac. – Planta. 78 (2): 158–183.
Johri B.M. 1963. Female gametophyte. – In: Recent advances in the embryology of angiosperms. Delhi. P. 69–103.
Johri B.M., Ambegaokar K.B. 1984. Embryology: then and now. – In: Embryology of Angiosperms. Berlin etc. P. 28–40.
Kadsamy M.K., Paolillo D.J., Faraday C.D. et al. 1989. The S-locus specific glycoproteins in Brassica accumulate in the cell wall of developing stigma papillae. – Dev. Biol. 134: 462–472.
Kanaoka M.M. 2018.Cell-cell communications and molecular mechanisms in plant sexual reproduction. – J. Plant Res. 131 (1): 37–47. https://doi.org/10.1007/s10265-017-0997-2
Kapil R.N. 1970. Podostemaceae. – Bull. Indian Nat. Sci. Acad. 41: 104–109.
Knox R.B., Heslop-Yarrison J., Heslop-Harrison Y. 1975. Pollen wall proteins: localization and characterisation of gametophytic and sporophytic fractions. – Biol. J. Linn. Soc. 7 (1): 77–187.
Kojima A., Nagato Y. 1992. Diplosporous embryo sac formation and the degree in Allium tuberosum. – Sex. Plant Reprod. 5: 75–78.
Kojima A., Nagato Y. 1997. Discovery of highly apomictic and highly amphimictic dihaploids in Allium tuberosum. – Sex. Plant Reprod. 10: 8–12.
[Korobova] Коробова С.Н. 1982. Формирование женского гаметофита, оплодотворение, развитие зародыша и эндосперма кукурузы. – В кн.: Культурная флора СССР. М. С. 151–176.
Lakshmanan K.K., Ambegaokar K.B. 1984. Polyemb-ryony. – In: Embryology of Angiosperms. Berlin etc. P. 445–474.
Locascio A., Roig-Villanova I., Bernardi J., Varotto S. 2014. Current perspectives on the hormonal control of seed development in Arabidopsis and maize: a focus on auxin. – In: Frontiers in Plant Science. 5 (412): 1–22.
Maheshwari P. 1950. An introduction to the embryology of angiosperms. New York. 453 p.
Murgai M., Wilms H.L. 1988. Three dimensional image and mitochondrial distribution in sperm cells of Euphorbia dilcis. – In: Plant sperm cells as tools for biotechtology. Wageningen. P. 75–79.
[Nawaschin] Навашин С.Г. 1898a. Новые наблюдения над оплодотворением у Fritillaria tenella и Lilium martagon. – В кн.: Дневник X съезда русских естествоиспытателей и врачей. Киев. 6: 16–21.
Nawaschin S.G. 1898b. Resultate einer Revision der Befruchtungsvorgänge bei Lilium martagon und Fritillaria tenella. – Bull. Acad. Imp. Sci. St. Petersbourg. 9 (4): 377–382.
[Nawaschin] Навашин С.Г. 1900. Об оплодотворении у сложноцветных и орхидных. Изв. Импер. Акад. наук. 13 (3): 335–340.
Nawaschin S.G. 1910. Nőheres über die Bildung der Spermakerne bei Lilium martagon. – Ann. Jard. Bot. Buitenzorg. 3 (2): 871–904.
Newcomb W. 1973. The development of the embryo sac of sunflower Helianthus annuus after fertilization. – Canad. J. Bot. 51 (5): 879–890.
Pagnussat G.C., Alandete-Saez M., Bowman J.L., Sundaresan V. 2009. Auxin-dependent patterning and gamete specification in the Arabidopsis female gametophyte. – Science. 324: 1684–1689.
Palevitz B.A. 1993. Relationship between the generaqtive cell and vegetative nucleus in pollen tubes of Nicotiana tabacum. – Sex. Plant Reprod. 6: 1–10.
Palevitz B.A., Cresti M. 1989. Cytoskeletal changes during generative cell division and sperm cell formation in Tradescantia virginiana. – Protoplasma. 150: 54–71.
[Petrova] Петрова Т.Ф. 1977. Цитоэмбриология лилейных. Подсемейство Lilioideae. М. 216 с.
[Plyushch] Плющ Т.А. 1992. Ультраструктура зародышевого мешка покрытосеменных. Киев. 145 с.
[Polyakov] Поляков И.М. 1970. Три фазы процесса оплодотворения у цветковых растений. – Респ. межвед. темат. научн. сб. “Селекция и семеноводство”. Киев. 15: 3–12.
[Rodionova] Родионова Г.Б. 2000. Жизненные циклы. – В кн.: Эмбриология цветковых растений. Терминология и концепции. СПб. Т. 3. С. 69–71.
[Romanov] Романов И.Д. 1944. Эволюция зародышевых мешков цветковых растений: Дис. … д-ра биол. наук. Ташкент. 415 с.
[Romanov] Романов И.Д. 1971. Типы развития зародышевого мешка покрытосеменных растений. – В кн.: Проблемы эмбриологии. Киев. С. 72–112.
[Romanov] Романов И.Д. 1994. Принципы классификации типов развития зародышевого мешка. – В кн.: Эмбриология цветковых растений. Терминология и концепции. СПб. Т. 1. С. 213–216.
Rusche M.L., Mogensen H.L. 1988. The mail germ unit in Zea mays: quatative ultrastructure and three-dimensional analysis. In: Sexual reproduction in higher plants. Berlin, Heidelberg. P. 221–226.
Russel S.D. 1983. Fertilization in Plumbago zeyianica: gametic tusion and fate of the male cytoplasm. – Amer. J. Bot. 70 (3): 416–434.
Russel S.D. 1984. Ultrastucture of the sperm of Plumbago zeyianica: 2. Quantitative cytology and three-dimensional reconstruction. – Planta. 162 (4): 385–391.
Russel S.D. 1992. Double fertilization. – Int. Rev. Cytol. 140: 357–388.
Russel S.D., Cass D.D. 1981. Ultrastructure of the sperms of Plumbago zeyianica. I. Cytology and association with the vegetative nucleus. – Protoplasma. 107 (1): 85–107.
Sathananthan A.H., Kola I., Osborne J., Trounson A., Ng S.C., Bongso A., Ratham S.S. 1991. Centrioles in the beginning of human development. – Proc. Natl. Acad. Sci. USA. 88: 4806–4810.
[Savina] Савина Г.И. 1979. Особенности эмбриологии семейства Orchidaceae. – В кн.: Актуальные проблемы эмбриологии покрытосемянных растений. Л. С. 19–28.
[Savina, Poddubnaya-Arnoldi] Савина Г.И., Поддубная-Арнольди В.А. 1990. Семейство Orchidaceae. – В кн.: Сравнительная эмбриология цветковых растений. Butomaceae-Lemnaceae. Л. С. 172–179.
Schatten H., Schatten G., Mazia D., Balczon R., Simerly C. 1986. Behavior of centrosomes during fertilization and cell division in mouse oocytes and in sea urchin eggs. – Proc. Natl. Acad. Sci. USA. 83: 105–109.
Schulz R., Jensen W.A. 1968. Capsella embryogenesis: The synergids before and after fertilization. – Amer. J. Bot. 55 (5): 541–552.
[Shamrov] Шамров И.И. 1997. Перисперм. – В кн.: Эмбриология цветковых растений. Терминология и концепции. Т. 2. СПб. С. 279–281.
[Shamrov] Шамров И.И. 2008а. Семязачаток цветковых растений: строение, функции, происхождение. М. 356 с.
[Shamrov] Шамров И.И. 2008б. Формирование спорангиев высших растений. – Бот. журн. 93 (12): 1817–1845.
[Shamrov] Шамров И.И. 2015. Половые клетки и половой процесс у растений и животных. – В кн.: Тез. докл. III (XI) Международной ботанической конференции молодых ученых в Санкт-Петербурге. СПб. С. 90–92.
Shamrov I.I. 2019. Apomixis in plants and animal: embryological aspects. – In: Collection of scientific articles. Living systems-2019. Saratov. P. 51–52.
[Shamrov et al.] Шамров И.И., Анисимова Г.М., Бабро А.А. 2019. Формирование стенки микроспорангия пыльника и типизация тапетума покрытосеменных растений. – Бот. журн. 104 (7): 1001–1032. https://doi.org/10.1134/S0006813619070093
[Solntseva] Солнцева М.П. 1973. Семигамия и оплодотворение у Rudbeckia laciniata L. – Бот. журн. 58 (9): 1261–1277.
[Solntseva] Солнцева М.П. 1979. Гемигамия и возможности ее использования как одной из форм апомиксиса. – В кн.: Актуальные проблемы эмбриологии покрытосемянных растений. Л. С. 39–46.
Sprunck S., Rademacher S., Vogler F., Gheyselinck J., Grossniklaus U., Dresselhaus T. 2012. Egg cell-secreted EC1 triggers sperm cell activation during double fertilization. – Science. 338: 1093–1097.
Strasburger E. 1884. Neue Untersuchungen über den Befruchtungsvorgang bei den Phanerogamen als Grundlage für eine Theorie der Zeugung. Jena. 176 s.
Taylor F., Kenrick J., Li Y., Kaul V., Gunning B.E.S., Knox R.B. 1989. The male germ unit in Rhododendron: quantitative cytology, three-dimensional reconstruction, isolation and detection using fluorescent probes. – Sex. Plant Reprod. 2: 254–264.
Tian H.Q., Yuan T., Russell S.D. 2005. Relationship between double fertilization and the cell cycle in male and female gametes of tobacco. – Sex. Plant Reprod. 17: 243–252.
[Titova] Титова Г.Е. 1988. Эмбриология некоторых водных растений (Nelumbo nucitera Gaertn., Cabomba caroliniana A. Gray, Trapa astrachanica (Fler.) Winter): Дис. … канд. биол. наук. Л. 188 с.
Titova G.E., Zakharova A.A., Shamrov I.I. 1997. Ovule and seed development in Trapa natans L. in connection with the specific embryo sac structure, absence of endosperm and pseudomonocotyly. – Bull. Polish Acad. Sci. Biol. 45 (2–4): 81–92.
[Tokin] Токин Б.П. 1987. Общая эмбриология. М. 480 с.
[Torshilova] Торшилова А.А. 2018. Процесс двойного оплодотворения в роде Dioscorea (Dioscorea nipponica и D. caucasica). – Бот. журн. 103 (3): 283–296. https://doi.org/10.1134/S0006813618030018
[Trenin] Тренин В.В. 1988. Введение в цитоэмбриологию хвойных. Петрозаводск. 152 с.
[Tyrnov] Тырнов В.С. 2000. Партеногенез. – В кн.: Эмбриология цветковых растений. Терминология и концепции. Т. 3. СПб. С. 158–165.
Van Went J.L 1970. The ultrastructure of the fertilized embryo sac of Petunia. – Acta Bot. Neerl. 19 (4): 468–480.
Van Went J.L., Willemse M.T. 1984. Fertilization. – In: Embryology of Angiosperms. Berlin etc. P. 273–317.
Vasilyeva V.E., Batygina T.B. 1997. Cell cycle of zygote and possible types of caryogamy in flowering plants. – Bull. Pol. Acad. Sci. 45 (2–4): 167–182.
Vazart J. 1969. Degeration of a synergid and pollen tube entrance into the embryo sac of Linum usitatissimum L. – Ann. Univ. ARERS. 9: 89–97.
Vij S.P., Kaur P., Bhanwra R.K. 1999. Embryological studies in Epipactis gigantea (Orchidaceae). – Lindleyana. 14 (3): 160–167.
[Vishnyakova] Вишнякова М.А. 1997. Проводниковый тракт пестика. – В кн.: Эмбриология цветковых растений. Терминология и концепции. СПб. Т. 2. С. 107–113.
[Vorsobina, Solntseva] Ворсобина Л.И., Солнцева М.П. 1979. Особенности цветения и процесс оплодотворения у некоторых амариллисовых. – В кн.: Актуальные проблемы эмбриологии покрытосемянных растений. Л. С. 28–38.
Warming E. 1873. Untersuchungen über pollenbildende Phyllome und Kaulome. – Bot. Abh. Gebiet. Morphologie und Physiologie. 2 (2): 1–90.
Warming E. 1878. De l`ovule. – Ann. Sci. Natur. Bot. Sér. 6. 5: 175–266.
Wilms H.J. 1981. Pollen tube penetration and fertilization in spinach. – Acta Bot. Neerl. 30 (1–2): 101–122.
Wilms H.J. 1986. Dimorphic sperm cells in the pollen grain of Spinacia. – In: Biology of reproduction and cell motility in plants and animals. Siena. P. 193–198.
Yang H.Q., Bohdanowicz J., Pierson E.S., Li Y., Tiezzi A., Cresti M. 1995. Microtubular organization during asymmetrical division of the generative cell in Gagea lutea. – J. Plant Cell. 108: 269–276.
Yeung E.C., Zee S.Y., Ye X.L. 1994. Embryology of Cymbidium sinense: ovule development. – Phytomorphology. 44 (1): 55–63.
Yu H.S., Hu S.Y., Russell S.D. 1992. Sperm cells in pollen tubes of Nicotiana tabacum L.: three dimensional, cytoplasmic diminution and quantitative cytology. – Protoplasma. 168: 172–183.
[Yudakova et al.] Юдакова О.И., Шакина Т.Н., Кайбелева Э.И. 2018. Цитоэмбриологические особенности развития эндосперма при апомиксисе у некоторых видов рода Poa (Poaceae). – Бот. журн. 103 (7): 908–918.
Дополнительные материалы отсутствуют.
Инструменты
Ботанический журнал


