Ботанический журнал, 2020, T. 105, № 3, стр. 300-309
РАЗВИТИЕ ПЫЛЬНИКА У PLATYCODON GRANDIFLORUS (CAMPANULACEAE)
Н. А. Жинкина 1, *, Е. Е. Евдокимова 1, **
1 Ботанический институт им. В.Л. Комарова РАН
197376 Санкт-Петербург, ул. Проф. Попова, 2, Россия
* E-mail: nazh13@mail.ru
** E-mail: e.e.evdokimova@mail.ru
Поступила в редакцию 10.10.2019
После доработки 09.01.2020
Принята к публикации 14.01.2020
Аннотация
Впервые проведено подробное исследование мужских генеративных структур, развития пыльника и пыльцевого зерна у редкого охраняемого вида Platycodon grandiflorus. Отмечено значительное сходство строения мужских эмбриональных структур этого вида с таковыми у других представителей сем. Campanulaceae: наличие четырехгнездного пыльника, центробежное формирование стенки гнезда пыльника, клеточный секреторный тапетум с 2–4-ядерными клетками, симультанное образование тетрад микроспор, двуклеточные пыльцевые зерна. Выявлены основные отличительные признаки, характерные для этого рода (наличие 2-клеточного пыльцевого зерна с крупной генеративной клеткой, отсутствие орбикул в тапетуме, двуслойный эндотеций, мощно развитые плацентоиды, массивный связник с многочисленными пучками, дуговидно расположенная спорогенная ткань), примитивность большинства из которых свидетельствует о древности изученного вида.
Platycodon grandiflorus (Jacq.) A.DC. является единственным видом монотипного рода Platycodon, относящегося к семейству Campanulaceae. Его основной ареал находится в северо-восточном Китае. В нашей стране Platycodon произрастает в Западной Сибири, Забайкалье, при этом в ряде областей является редким и исчезающим, вследствие чего внесен в Красные Книги Амурской и Читинской областей, Благовещенска, Хабаровского и Забайкальского краев. Интродуцирован в Ботаническом саду Санкт-Петербурга, а в Ленинградской области выращивается в качестве декоративного растения. Понимание особенностей строения и размножения этого растения имеет большое значение, как для введения его в культуру, так и сохранения в местах естественного обитания. Между тем, его размножение затруднено в связи с низкой всхожестью семян, причина которой не установлена. Кроме того, изучение репродуктивных органов Platycodon важно для решения спорных вопросов систематики и положения этого малоизученного рода в сем. Campanulaceae. В связи с этим, целью настоящего исследования являлось изучение генезиса пыльника и пыльцевого зерна у Platycodon grandiflorus.
МАТЕРИАЛЫ И МЕТОДЫ
Цветки и бутоны на разных стадиях развития были собраны на территории Ботанического сада Петра Великого Ботанического института им. В.Л. Комарова РАН, где этот вид произрастает в качестве интродуцента. Постоянные препараты готовили по общепринятой методике (Prozina, 1960). Материал фиксировали в ФАА, после проводки через серию спирто-хлороформовых смесей различной концентрации заливали в парафин, блоки резали на микротоме Microm 325 (фирмы Carl Zeiss). Срезы 12 мкм окрашивали гематоксилином по Эрлиху, с подкраской алциановым синим и сафранином. Препараты исследовали на микроскопе Axioplan-2 mot (Zeiss), с использованием камеры AxioCam MRc 5 (Zeiss) и программы AxioVision 4.8 (Zeiss).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Platycodon grandiflorus представляет собой травянистое многолетнее прямостоячее растение. Цветок обычно одиночный, верхушечный, в некоторых случаях их может быть от двух до десяти. Цветки собраны в верхушечное соцветие (табл. I , a, b, d), до 25 см длиной; цветоножки прямые. Соцветие, согласно классификации Федорова и Артюшенко (1979) – кистевидный тирс (дихазий) (табл. I , d), венчик широковоронковидный (ширококолокольчатый), синего цвета, пятилопастный (табл. I , а). Тычинок пять. Они свободные, нити треугольно расширены у основания (табл. I , c); пыльники 6.7–7.0 мм длиной. Столбик у основания утолщенный, завязь пятигнездная. Плод – прямая, яйцевидная, вверх торчащая коробочка. Семена эллиптические или яйцевидные, уплощенные, черные или темно-коричневые, блестящие, гладкие (Fedorov, 1957; Kozhevnikov, 1996; Olonova, 1996).
Таблица. I. Строение соцветия и цветка у Platycodon grandiflorus.
а – цветок, b – соцветие, с – тычинки, d – продольный срез соцветия, e – тека, состоящая из двух микроспорангиев, f – поперечный срез пыльника, g – пыльник на ранней стадии развития. 1 – связник, 2 – микроспорангий, 3 – первичная покровная ткань, 4 – пыльцевые зерна в полости пыльника, 5 – cпорогенная ткань. Масштабные линейки, мкм: b – 1000; d, f – 200; e – 100; g – 50.
Plate I . Inflorescence and flower structure in Platycodon grandiflorus.
a – flower, b – inflorescence, c – stamens, d – longitudinal section of inflorescence, e – theca composed of two microsporangia, f – transverse section of anther, g – anther at the early stage of development. 1 – connective, 2 – microsporangium, 3 – primary covering tissue, 4 – pollen grains in the anther, 5 – sporogenous tissue. Scale bars, μm: b – 1000; d, f – 200; e – 100; g – 50.
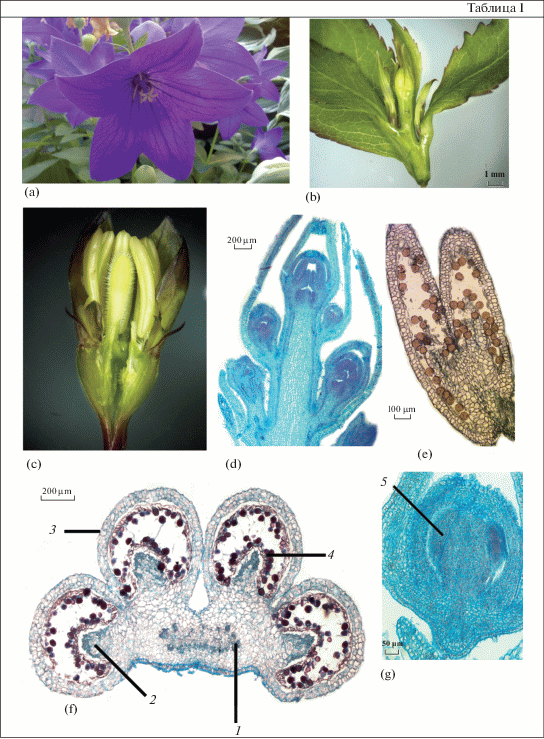
Пыльник у P. grandiflorus состоит из четырех микроспорангиев, расположенных симметрично и объединенных в две теки (табл. I , e). Связник сравнительно массивный, с плацентоидами – выростами стерильной ткани, вдающимися в каждое гнездо и обусловливающими дуговидную форму спорогенной ткани (табл. I , f).
Важное значение для формирования тетрад гаплоидных микроспор и пыльцевых зерен имеет стенка микроспорангия, в ходе развития которой происходят изменения в строении. Выделены три стадии ее формирования (Shamrov, 2015). Первая стадия – возникновение и дифференциация слоев стенки микроспорангия (от археспория до спорогенной ткани). Вторая стадия – окончательное формирование стенки микроспорангия, которая состоит из следующих слоев: эпидермы, эндотеция, среднего слоя и тапетума. Микроспороциты готовятся вступать в мейоз. Третья стадия – преобразование слоев стенки микроспорангия, формирование тетрад микроспор и созревание пыльцевых зерен (Shamrov et al., 2019).
На ранних стадиях премейотического периода развития пыльника из археспория – группы клеток субэпидермального слоя лопасти пыльника – формируются спорогенная ткань и слои стенки микроспорангия. Клетки археспория отличаются более плотной цитоплазмой и крупным ядром с ядрышком. В меристематическом бугорке выделяется тяж археспориальных клеток (табл. I , g; II, а, b), которые после ряда периклинальных делений образуют первичный париетальный и спорогенный слои (табл. II, d). Клетки первичного париетального слоя делятся также периклинально, в результате чего формируются вторичные париетальные слои.
Таблица II. Формирование стенки пыльника у Platycodon grandiflorus.
a – поперечный срез бутона на ранней стадии развития, b – меристематический бугорок с археспориальными клетками, c – формирование слоев стенки пыльника на раннем этапе развития, d – формирование вторичного париетального слоя, e – формирование вторичного париетального слоя и тапетума. 6 – тяж археспориальных клеток, 7 – эпидерма, 8 – вторичный париетальный слой, 9 – наружный тапетум, 10 – спорогенная ткань, 11 – внутренний тапетум, 12 – клетки меристемы плацентоида, 13 – клетки первичного париетального слоя периклинально делятся, 14 – первичный и вторичный париетальные слои. Масштабные линейки, мкм: a – 200; b – 10; c, d, e – 20.
Plate II . Anther wall formation in Platycodon grandiflorus.
a – transverse section of the flower bud at the early development stage, b – meristematic primordium with archesporial cells, c – formation of the anther wall layers at the early development stage, d – formation of the secondary parietal layer, e – formation of the secondary parietal layer and tapetum. 6 – archesporial cells, 7 – epidermis, 8 – secondary parietal layer; 9 – outer tapetum, 10 – sporogenous tissue, 11 – inner tapetum, 12 – meristematic cells of placentoid, 13 – the primary parietal cells divide periclinally, 14 – primary and secondary parietal layers. Scale bars, μm: a – 200; b – 10; c, d, e – 20.
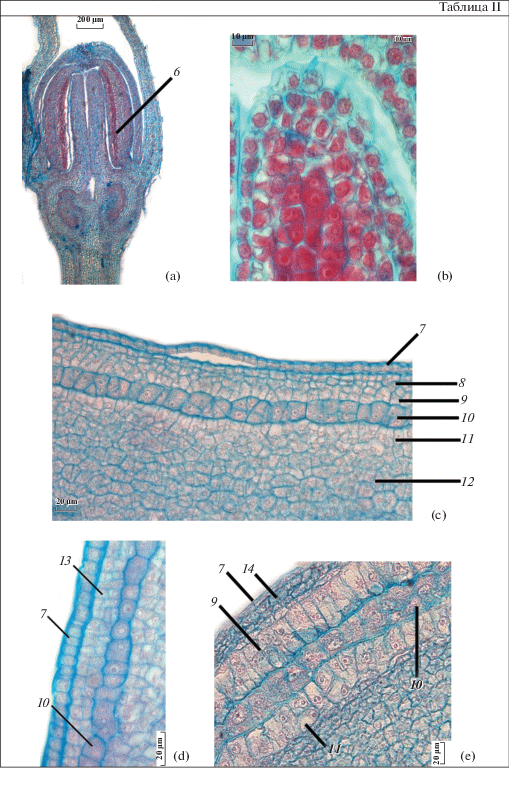
Клетки тапетума, вероятно, происходят из вторичного париетального слоя. Они имеют таблитчатую форму, расположены в ряд и отличаются крупными размерами, большими ядрами и сильной вакуолизацией. Эти клетки непрерывно делятся, их цитоплазма окрашивается сафранином более интенсивно по сравнению с окружающими клетками. Тапетум у P. grandiflorus – однослойный, окружает спорогенную ткань как с дистальной стороны, так и со стороны плацентоида. Часть тапетума, прилегающую к париетальному слою, мы условно называем “наружным” тапетумом, а ту, что прилегает к меристеме плацентоида, “внутренним”. Спорогенные клетки, окруженные с дистальной и проксимальной сторон пыльника тапетумом, также интенсивно делятся (табл. II, с). В клетках тапетума хорошо различимы два ядра, также встречаются клетки с четырьмя ядрами. Это свидетельствует об интенсивном метаболизме в тапетальных клетках, так как они снабжают питательными веществами клетки спорогенной ткани и способствуют, таким образом, их преобразованию в микроспороциты.
Клетки наружного париетального слоя делятся периклинально, в результате чего формируются средний слой и эндотеций (табл. III, а). Клетки эндотеция незначительно отличаются от соседних клеток. Клетки эпидермы вытянуты вдоль поверхности микроспорангия. По мере формирования стенки пыльника они постепенно увеличиваются в размерах, немного сплющиваются и становятся более крупными по сравнению с клетками эндотеция и среднего слоя. Клетки тапетума продолжают делиться антиклинально, местами тапетум становится иррегулярно-двуслойным (табл. II, e). Наружная часть тапетума формируется раньше, чем внутренняя. Ко времени вступления микроспороцитов в мейоз формирование всех слоев завершено (табл. II, e). Клетки среднего слоя существуют непродолжительное время, во время мейоза микроспороцитов они начинают разрушаться и к началу постмейотического периода полностью дегенерируют. В мейотический период клетки эпидермы, эндотеция и среднего слоя сильно вакуолизированы. В постмейотический период в стенке пыльника клетки эпидермы, покрытые тонким слоем кутикулы, лишаются своего содержимого (табл. III, d). Клетки эндотеция в постмейотический период увеличиваются в размерах. Со стадии двухклеточных пыльцевых зерен в них образуются фиброзные утолщения, которые, как правило, расположены перпендикулярно эпидермальному слою. Также были отмечены фиброзные утолщения в некоторых клетках плацентоидов (табл. III, d). У P. grandiflorus фиброзные утолщения окружают каждое гнездо пыльника. Фиброзные пояски отсутствуют на некоторых участках в местах будущего вскрывания гнезд. К моменту вскрывания пыльника ткань плацентоида сжимается и разрушается (Zhinkina, 1995).
Таблица III. Строение стенки гнезда пыльника и пыльцевого зерна у Platycodon grandiflorus.
а – формирование среднего слоя и эндотеция, b – фрагмент стенки пыльника на стадии мейоза, с – стадия образования тетрад, d – гнездо пыльника с пыльцевыми зернами, е – пыльцевое зерно с генеративной клеткой линзовидной формы (временный препарат с окраской ацетокармином), f – генеративная клетка вблизи ядра вегетативной в центре пыльцевого зерна, g – генеративная клетка перемещается к периферии пыльцевого зерна, h – шипики и борозды на поверхности зрелых пыльцевых зерен, i – зрелые пыльцевые зерна, j – аномальное пыльцевое зерно. 15 – средний слой, 16 – эндотеций, 17 – микроспороциты, вступившие в мейоз, 18 – 2-ядерный тапетум, 19 – тетрады, 20 – клетки тапетума с признаками деградации, 21 – ткань связника, 22 – клетки стенки пыльника с фиброзными утолщениями. Масштабные линейки, мкм: a, b, f–i – 10; c–e – 20.
Plate III . Structure of anther wall and pollen grain in Platycodon grandiflorus.
a – formation of the middle layer and endothecium, b – fragment of anther wall at the meiosis, c – phase of tetrad formation, d – anther loculus with pollen grains, e – lenticular generative cell of in the pollen grain (temporary slide stained by acetocarmine), f – generative cell close to the nucleus of vegetative cell in the center of pollen grain, g – generative cell moves to the periphery of pollen grain, h – spinules and sulculi on the surface of mature pollen grains, i – mature pollen grains, j – anomalous pollen grain. 15 – middle layer, 16 – endothecium, 17 – microsporocytes in meiosis, 18 – tapetum cells with two nuclei, 19 – tetrads, 20 – degenerating tapetal cells, 21 – connective tissue, 22 – cells of anther wall with fibrous thickenings. Scale bars, μm: a, b, f–i – 10; c–e – 20.
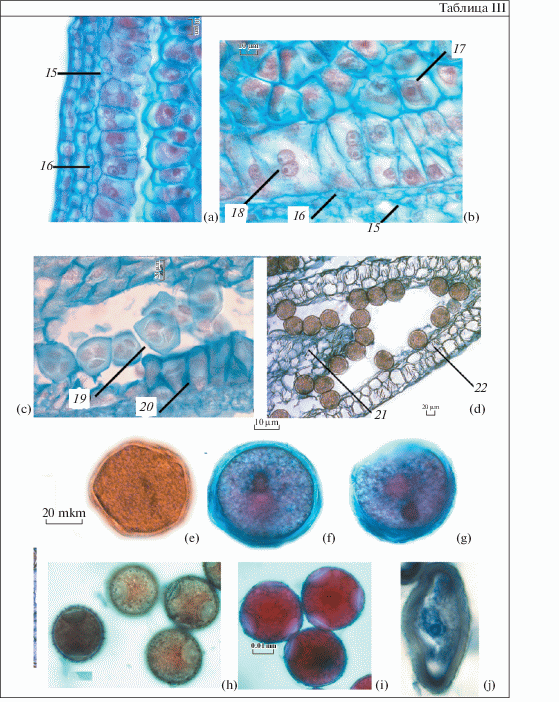
Таблица IV. Нормальные и аномальные пыльцевые зерна у Platycodon grandiflorus.
а – нормально сформированные многочисленные пыльцевые зерна в зрелом пыльнике, b – дегенерирующая аномальная пыльца и гипертрофированные клетки тапетума. 23 – зрелые пыльцевые зерна, 24 – тапетум, 25 – аномальные пыльцевые зерна. Масштабные линейки, мкм: a, b – 20.
Plate IV . Normal and abnormal pollen grains in Platycodon grandiflorus.
a – normal and abnormal pollen grains in mature anther, b – abnormal degenerating pollen grains, hypertrophied cells of tapetum. 23 – mature pollen grains, 24 – tapetum, 25 – abnormal pollen grains. Scale bars, μm: a, b – 20.
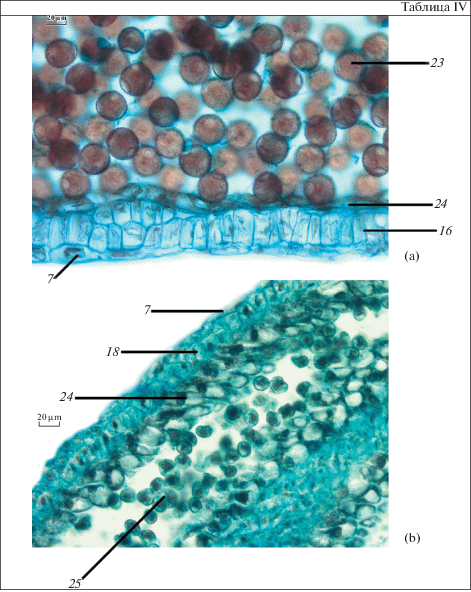
Тапетум секреторного типа, однослойный, гетероморфный. На ранних стадиях развития его клетки относительно мелкие, правильной формы, на протяжении мейотического периода они разрастаются, значительно увеличиваются в размерах и вытягиваются. В них происходят деления ядер, и тапетальные клетки становятся дву- и четырехъядерными (табл. III, b). Тапетум существует относительно долго. Первые признаки деградации отмечаются после стадии тетрад (табл. III, c). Клетки тапетума деформируются. Они сильно вакуолизированы, причем вакуоли в них достаточно крупные, ядра начинают дегенерировать. В постмейотический период тапетальные клетки уплощаются, сильно деформируются, их ядра окончательно дегенерируют. К моменту созревания пыльцевых зерен тапетум практически полностью исчезает (табл. III, d).
У Platycodon клетки спорогенной ткани располагаются в один или несколько рядов (табл. II, c; III, b). Ее формирование завершается одновременно со стенкой гнезда пыльника. Клетки спорогенной ткани заметно крупнее окружающих клеток, и их цитоплазма более плотная. После завершения митозов спорогенные клетки увеличиваются в размерах и преобразуются в микроспороциты – клетки, которые вступают в мейоз, в результате чего из каждой клетки с диплоидным набором хромосом образуются четыре гаплоидные клетки, образующие особую структуру – тетраду микроспор. Тетрады покрыты каллозной оболочкой и располагаются в гнезде пыльника вплотную к тапетуму. Объединенные в тетрады микроспоры, располагавшиеся в один слой в тесном контакте с тапетумом, в дальнейшем размещаются рыхло в увеличившемся пространстве гнезда пыльника (табл. III, с). Микроспорогенез в пыльнике проходит асинхронно. Тетрады микроспор тетраэдральные. После распада тетрад в каждой микроспоре происходит деление, в результате чего она преобразуется в пыльцевое зерно. У Platycodon оно двухклеточное. Ядро вегетативной клетки находится вблизи генеративной клетки. Впоследствии оно заметно увеличивается в объеме, его форма становится лопастной. Генеративная клетка первоначально прилегает к оболочке пыльцевого зерна и имеет линзовидную форму (табл. III, e). В дальнейшем она отходит от оболочки пыльцевого зерна и перемещается в направлении ядра вегетативной клетки, при этом ее форма становится округлой (табл. III, f). Некоторое время генеративная клетка располагается в непосредственной близости от ядра вегетативной клетки, а затем постепенно отходит от него (табл. III, g). Цитоплазма зрелого пыльцевого зерна плотная, заполнена запасными питательными веществами в виде липидных глобул, а также крахмала и белков, необходимых для роста пыльцевой трубки. Пыльцевые зерна по результатам световой микроскопии сфероидальные, на поверхности наблюдаются крупные борозды (табл. III, h, i; IV, a). Скульптура поверхности пыльцевого зерна шиповатая, шипы конические, расположены по поверхности достаточно равномерно, их высота немного превышает толщину экзины (табл. III, h).
В ряде случаев у Platycodon нами была отмечена массовая дегенерация и гибель пыльцы, при этом пыльцевые зерна часто деградировали на поздних стадиях. В таких случаях наблюдалось отклонение от нормального развития стенки гнезда пыльника. Если при нормальном ходе развития на стадии формирования пыльцевых зерен тапетальные клетки деформированы, их ядра окончательно дегенерировали, а к моменту созревания пыльцевых зерен тапетум практически полностью исчезал, то в случаях с абортивной пыльцой тапетальные клетки приобретали вытянутую форму и значительно увеличивались в размерах. Ядра тапетальных клеток сохранялись. Клетки среднего слоя и эндотеция также были деформированы. Фиброзные утолщения не образовывались. Сами пыльцевые зерна имели неправильную форму, их оболочка утолщалась, цитоплазма сжималась, кое-где сохранялись ядра, вероятно, вегетативных клеток (табл. III, j; IV, b). В случаях, когда пыльцевые зерна погибали на более поздних стадиях, иногда на поверхности таких дегенерирующих пыльцевых зерен могли образовываться поры. Такое явление, как массовая гибель пыльцы, отмечалось, как правило, в бутонах, расположенных на боковых осях соцветия, но и в пыльниках некоторых цветков, завершающих главную ось соцветия, также встречалась аномальная пыльца, и ее количество в некоторых образцах было примерно равно количеству нормальных пыльцевых зерен. Подобный факт описан у Chrysanthemum morifolium (Asteraceae) (Fei et al., 2016). У одного культивара со вскрывающимися пыльниками эндотеций с фиброзными утолщениями, а у другого культивара пыльники не вскрываются, так как в эндотеции не формируются фиброзные утолщения. Кроме того, у последнего долго сохраняются жизнеспособными клетки тапетума. Как было показано при изучении форм растений с ЦМС, при длительном существовании тапетума наблюдается абортирование пыльцы, клетки эндотеция не переходят к формированию фиброзных поясков, и пыльники не вскрываются (Chauhan, Gupta, 2006).
ОБСУЖДЕНИЕ
Сравнительный анализ признаков мужских эмбриональных структур Platycodon grandiflorus и других видов сем. Campanulaceae выявил их сходство. Однако имеются и различия. Развитие мужских репродуктивных структур наиболее подробно было изучено у следующих представителей: Ostrowskia magnifica (Zhinkina, 1995; Kamelina, Zhinkina, 1989), Azorina vidalii, Gadellia lactiflora (Zhinkina, Shamrov, 1997).
У всех исследованных видов пыльники интрорзные, четырехгнездные, гнезда попарно объединены в две теки. Перегородки между гнездами у некоторых видов разрушаются, но у Platycodon grandiflorus и Ostrowskia magnifica сохраняются. У Ostrowskia и Platycodon в пыльнике развиваются специфические структуры – плацентоиды, при этом формирующаяся спорогенная ткань и тапетум на поперечном срезе имеют подковообразную форму (Zhinkina, 1995, Kamelina, Zhinkina, 1989). У представителей сем. Campanulaceae формирование стенки гнезда пыльника проходит в премейотический период развития пыльника. В меристематическом бугорке под эпидермой выделяется тяж археспориальных клеток, которые после ряда периклинальных делений образуют париетальный и спорогенный слои. За счет делений клеток внутреннего париетального слоя образуется сначала тапетум с наружной стороны. У Platycodon grandiflorus одновременно с этим, за счет непрерывно делящихся клеток меристемы плацентоида, примыкающих к спорогенному слою, дифференцируется внутренняя часть тапетума. При периклинальном делении клеток наружного париетального слоя формируются средний слой и эндотеций. Сходным образом происходит формирование этих слоев пыльника и у Ostrowskia magnifica (Zhinkina, 1995, Kamelina, Zhinkina, 1989). Таким образом, формирование стенки гнезда пыльника у этих видов происходит по типу двудольных, согласно классификации Davis (1966).
Сформированная стенка пыльника состоит из эпидермы, эндотеция, среднего слоя и тапетума. Клетки эпидермы на ранних стадиях небольшие, по мере формирования стенки гнезда пыльника они постепенно разрастаются. Их оболочки заметно утолщаются. Со стадии двуклеточного пыльцевого зерна клетки эпидермы теряют правильную форму и сплющиваются. В стенке зрелого пыльника эпидерма представлена вытянутыми клетками. Сходным образом этот слой выглядит у O. magnifica (Zhinkina, 1995, Kamelina, Zhinkina, 1989). У Azorina vidalii и Gadellia lactiflora наружная стенка клеток эпидермы значительно кутинизирована и имеет зубчатую форму (Zhinkina, Shamrov, 1997). В эндотеции со стадии двуклеточных пыльцевых зерен образуются фиброзные утолщения. В зрелом пыльнике присутствует один или два слоя крупных клеток с фиброзными утолщениями, которые также формируются в двух-трех слоях плацентоида, примыкающих к гнезду. Подобный факт отмечен у O. magnifica (Kamelina, Zhinkina, 1989). Клетки среднего слоя постепенно уплощаются и в начале постмейотического периода полностью дегенерируют. Тапетум – клеточный (секреторный), однослойный. Его клетки вначале некрупные, правильной формы, затем разрастаются. Со стороны плацентоида клетки тапетума вытянутые. У O. magnifica эти клетки со стороны плацентоида имеют папиллообразную форму (Kamelina, Zhinkina, 1989). У P. grandiflorus клетки тапетума сильно вытягиваются и в них образуются крупные вакуоли. Как правило, клетки тапетума содержат 2–4 ядра. К моменту образования двуклеточного пыльцевого зерна тапетум почти полностью дегенерирует. У O. magnifica тапетум гетерогенный, незначительно гетероморфный, однослойный, представлен многоядерными клетками (Kamelina, Zhinkina, 1989). У Campanula ranunculoides он представлен двуядерными клетками, а у Azorina vidalii в клетках встречается 3 ядра (Zhinkina, 1995).
Спорогенная ткань является производным археспория. Ее формирование завершается одновременно с формированием гнезда пыльника. У Platycodon ее клетки располагаются в один или несколько рядов. У O. magnifica формируется однослойная, дуговидно изогнутая с утолщениями на концах многоклеточная спорогенная ткань, а у других исследованных видов клетки спорогенной ткани делятся и заполняют всю центральную часть пыльника (Zhinkina, 1995). Формирование тетрад микроспор у всех исследованных видов происходит по симультанному типу, тетрады микроспор тетраэдральные (Korobova, Zhinkina, 1987). У O. magnifica и P. grandiflorus тетрады микроспор распадаются довольно быстро (Zhinkina, 1995). Пыльцевые зерна этих двух видов характеризуются наличием борозд: у Platycodon их может быть четыре и более (Fedorov, Artyushenko, 1975). По данным Полевовой и Золала (Polevova, Zolala, 2008) у Platycodon grandiflorum пыльцевые зерна относительно крупные и в среднем имеют следующие размеры: полярная ось – 56 (52–61) мкм, экваториальный диаметр – 56 (53–63) мкм. Борозды короткие. Экзина толстая, 2.4 (1.8–3.0) мкм. Скульптура поверхности шипиковато-ямчатая, шипы достигают высоты 1.5 мкм. У представителей сем. Campanulaceae пыльцевые зерна могут быть поровыми, бороздными и бороздно-оровыми. Бороздные – в трибах Сodonopsideae и Platycodoneae, а также у Ostrowskieae, поровые – в трибе Campanuleae. Бороздные пыльцевые зерна также могут иметь 3 или большее количество апертур (Zolala et al., 2011).
ВЫВОДЫ
1. Развитие мужских эмбриональных структур у P. grandiflorum в целом такое же, как и у остальных представителей семейства Campanulaceae: наличие четырехгнездного пыльника, центробежное формирование стенки гнезда пыльника, клеточный секреторный тапетум с 2–4-ядерными клетками, симультанное образование тетрад микроспор, двуклеточные пыльцевые зерна.
2. Отличительными признаками, характерными для рода Platycodon, являются: отсутствие орбикул в тапетуме, двуслойный эндотеций, мощно развитые плацентоиды, массивный связник с многочисленными пучками, дуговидно расположенная спорогенная ткань, крупная генеративная клетка в пыльцевом зерне. Подобными признаками обладает и Ostrowskia magnifica, что позволяет сделать вывод о близости этих двух родов. Большинство этих отличительных признаков (наличие плацентоидов, массивного связника с сильно разветвленной проводящей системой и надсвязником) являются примитивными. Формирование и расположение фиброзных слоев в эндотеции пыльника можно рассматривать как черты специализации.
3. Отмеченная массовая гибель пыльцы на поздних стадиях развития, возможно, приводит к недоопылению и, как следствие этого, к низкой семенной продуктивности у P. grandiflorum. Однако для выяснения причин этого явления необходимы дополнительные исследования.
Список литературы
Chauhan S.V.S., Gupta H.K. 2006. Suppression of endothecium development by malformed tapetum in the anthers of chemically treated Lens culinaris. – Phytomorphology. 56 (1–2): 10–16.
Davis G.L. 1966. Systematic embryology of the Angiosperms. N.Y. – London – Sydney. 528 p.
[Fedorov, Artyushenko] Федоров Ал.А., Артюшенко З.Т. 1975. Атлас по описательной морфологии высших растений. Цветок. Л. 349 с.
[Fedorov, Artyushenko] Федоров Ал.А., Артюшенко З.Т. 1979. Атлас по описательной морфологии высших растений. Соцветие. Л. 294 с.
[Fedorov] Фёдоров Ал. А. 1957. Род 1447. Ширококолокольчик – Platycodon – В кн.: Флора СССР. Т. 24. М., Л. С. 438–441, 501, XVII.
Fei J., Tan S., Zhang F., Hua L., Liao Y., Fang W., Chen F., Teng N. 2016. Morphological and physiological differences between dehiscent and in dehiscent anthers of Chrysanthemum morifolium. – J. Plant Res. 129 (6): 1069–1082.
[Kamelina, Zhinkina] Камелина О.П., Жинкина Н.А. 1989. К эмбриологии Ostrowskia magnifica (Campanulaceae). Развитие мужских эмбриональных структур. – Бот. журн. 74 (1): 1293–1301.
[Kamelina] Камелина О.П. 2009. Систематическая эмбриология цветковых растений. Двудольные. Барнаул. 501 с.
[Korobova, Zhinkina] Коробова С.Н., Жинкина Н.А. 1987. Семейство Campanulaceae. – В кн.: Сравнительная эмбриология цветковых растений. Davidiaceae – Asteraceae. Л. С. 300–308.
[Kozhevnikov] Кожевников А.Е. 1996. Род Ширококолокольчик – Platycodon. – В кн.: Сосудистые растения советского Дальнего Востока: Плауновидные, Хвощевидные, Папоротниковидные, Голосеменные, Покрытосеменные (Цветковые). Т. 8. СПб. С. 273–274.
[Olonova] Олонова М.В. 1996. Platycodon – Ширококолокольчик. В кн.: Флора Сибири. Т. 12. Solanaceae – Lobeliaceae. Новосибирск. С. 164.
[Polevova, Zolala] Полевова С.В., Золала Х. 2008. Особенности палиноморфологии представителей семейства Campanulaceae s.l. – В сб.: Материалы Всероссийской научной конференции “Фундаментальные и прикладные проблемы ботаники в начале ХХI века”. ХII съезд РБО. Часть 1. Петрозаводск. С. 68–72.
[Prozina] Прозина З.П. 1960. Практикум по цитологии растений. М. 255 с.
[Shamrov et al.] Шамров И.И., Анисимова Г.М., Бабро А.А. 2019. Формирование стенки микроспорангия пыльника и типизация тапетума покрытосеменных растений. – Бот. журн. 104 (7): 1001–1032.
[Shamrov] Шамров И.И. 2015. Эмбриология и воспроизведение растений. СПб. 200 с.
Zhinkina N.A., Shamrov I.I. 1997. Embryology of Azorina vidalii and Gadellia lactiflora (Campanulaceae). – Bull. Polish Acad. Sci. 45 (2–4): 119–134.
[Zhinkina] Жинкина Н.А. 1995. Сравнительная эмбриология представителей семейства Campanulaceae Juss: Дис. … канд. биол. наук. СПб. 131 с.
[Zolala et al.] Золала Х.А., Полевова С.В., Северова Е.Э. 2011. Особенности ультраструктуры поровых пыльцевых зерен представителей подсемейства Campanuloidae. – Бот. журн. 96 (8): 1076–1084.
Дополнительные материалы отсутствуют.
Инструменты
Ботанический журнал


