Ботанический журнал, 2020, T. 105, № 6, стр. 610-619
ПРИМЕНЕНИЕ БИОТЕХНОЛОГИЧЕСКИХ МЕТОДОВ ДЛЯ СОХРАНЕНИЯ ГЕНОФОНДА РЕДКИХ ВИДОВ РАСТЕНИЙ
О. И. Молканова 1, *, Ю. Н. Горбунов 1, И. В. Ширнина 1, Д. А. Егорова 1
1 ФГБУН Главный ботанический сад им. Н.В. Цицина РАН
127276 Москва, ул. Ботаническая, 4, Россия
* E-mail: molkanova@mail.ru
Поступила в редакцию 31.10.2019
После доработки 13.01.2020
Принята к публикации 14.01.2020
Аннотация
Создание коллекций редких видов растений in vitro является одной из форм охраны растений природной флоры и эффективным методом сохранения генофонда ex situ. Впервые обобщены результаты по введению в культуру in vitro 82 редких видов растений Красной книги России. Разработаны протоколы клонального микроразмножения, позволяющие получить достаточное количество растений в целях восстановления численности природных популяций и сохранения редких видов растений. Для растений разных жизненных форм определены оптимальные типы эксплантов для длительного сохранения в условиях in vitro: для древесных и полудревесных растений – фрагменты побегов, содержащие один–два метамера, для травянистых – почки возобновления, для луковичных растений – микролуковички или их сегменты. Подобраны условия для длительного депонирования. Показана определяющая роль модификаций питательных сред и факторов культивирования для замедленного роста эксплантов исследуемых культур и сохранения их жизнеспособности.
В настоящее время общее признание получил тот факт, что биологическое разнообразие является основой для поддержания экологических условий существования и экономического развития человеческого общества, следовательно, оно является всемирным достоянием. В то же время угроза сохранению отдельных видов и экосистем еще никогда не была так велика, как сегодня. Причиной этого является рост населения, вырубка лесов, уничтожение естественной среды обитания, высокие темпы развития промышленности, широкое распространение сорных агрессивных видов и интенсивное развитие сельского хозяйства. Природоохранные организации при поддержке Международных агентств и Национальных правительств предпринимают значительные усилия по развитию практических мер по сохранению биоразнообразия. Несмотря на это, число видов, находящихся на грани исчезновения, продолжает расти и значительная часть генетического разнообразия уже потеряна. В настоящее время под угрозу исчезновения поставлено более 60 000 видов высших растений, т.е. около четверти общего числа их видов на планете. На XVI Международном ботаническом конгрессе, проходившем в августе 1999 г. в США, подчеркивалось, что если не принять в ближайшее время действенные меры по сохранению видового разнообразия растений, то к середине XXI века могут быть потеряны от 1/3 до 2/3 из 300 000 видов растений, обитающих в настоящее время на Земле (Revin, 2000).
Предпочтительным является сохранение редких видов в естественных условиях, но это не всегда возможно. Так, например, лишь около половины видов Красной книги РФ охраняется в природе (заповедниках, заказниках), генофонд другой половины видов федеральной охраны не обеспечен мерами сохранения in situ (Andreev, Gorbunov, 2003).
Методы сохранения ex situ могут быть использованы в качестве дополнения к мерам in situ, а для некоторых видов могут представлять единственно возможный способ их спасения. Важность сохранения генофонда растений ex situ получила международное признание включением в 9 статью “Конвенции о биологическом разнообразии” (Konvenciya…, 1995) и в 8 цель “Глобальной стратегии сохранения растений” (Globalnaya…, 2002). В этих документах рекомендуется использовать интегрированный подход для сохранения редких и исчезающих растений, сочетая методы ex situ и in situ.
Охрана растений в условиях ex situ включает в себя сохранение в живых коллекциях и банках семян. Однако и эти способы имеют свои ограничения. Например, в банках семян нельзя сохранять виды, имеющие рекальцитрантные семена, или вегетативно размножающиеся и не образующие семян. Не всегда удается вырастить и сохранять в живых коллекциях виды, характеризующиеся узкой экологической приуроченностью (меловые, болотные растения) или имеющие сложные трофические связи. Для таких видов единственно возможным способом сохранения ex situ является разработка технологии размножения и сохранения in vitro.
В последние десятилетия методы биотехнологии все шире применяются при охране редких и исчезающих растений (Butenko, 1999; Novikova, 2013; Molkanova et al., 2018). Они позволяют из небольшого количества исходного материала в короткие сроки получить большое число выровненного посадочного материала. Полученные растения можно использовать для пополнения живых коллекций, для реинтродукции и усиления ослабленных природных популяций редких видов.
Создание коллекций растений in vitro можно считать одной из форм охраны растений природной флоры и эффективным методом сохранения генофонда ex situ (Baranova et al., 2010; Vetchinkina et al., 2012). Согласно Е.Е. Бенсон (Benson et al., 2000) биотехнологические методы сохранения гермоплазмы должны быть интегрированы как дополнительная опция в существующие программы по сохранению биоразнообразия.
При формировании коллекции in vitro редких и исчезающих видов растений необходимо проводить строгую идентификацию растительного материала. В паспортные данные исходных образцов вносят информацию о месте сбора, включающую GPS координаты, фотографии места произрастания и сведения об экологических условиях (Reed et al., 2005). При возможности образцы должны быть взяты из разных природных популяций в количестве, достаточном для дальнейшей разработки протоколов сохранения in vitro (Vetchinkina et al., 2012; Trifonova et al., 2014). Паспортные данные образцов необходимы для формирования единой базы данных коллекций культур in vitro, что позволит не только использовать полученные клоны для пополнения живых коллекций и реинтродукции, но и включать их в программы международного обмена.
Большинство редких видов характеризуются меньшим генетическим разнообразием, чем широко распространенные, и, соответственно, они более подвержены угрозе исчезновения при изменении условий окружающей среды (Hamrick et al., 1996; Altuhov et al., 2004). Знания о генетическом разнообразии видов, очевидно, важны для разработки эффективных программ по их сохранению (Holsinger, 1997; Altuhov et al., 2004). Определить уровень внутри- и межпопуляционного генетического разнообразия и установить популяционно-генетическую структуру вида позволяют современные молекулярно-генетические методы, поэтому их применение очень важно при изучении редких видов растений и разработке стратегии их сохранения (Trifonova et al., 2014).
Использование современных молекулярно-генетических методов исследования генетической вариабельности не только позволяет контролировать стабильность хранящихся in vitro образцов, но также дает возможность для быстрой и точной идентификации видовой подлинности вновь поступающих растений и молекулярного маркирования растений на популяционном уровне (Vetchinkina, 2010).
МАТЕРИАЛЫ И МЕТОДЫ
Растительный материал для формирования коллекции in vitro был получен в результате экспедиционных выездов и непосредственно сбора семян и растений в естественных местах обитания или из обменных фондов ботанических садов, играющих важную роль в поддержании, сохранении и пополнении коллекций.
Подготовку эксплантов и введение их в культуру in vitro проводили в стерильных условиях согласно методикам, принятым в лаборатории биотехнологии ГБС РАН (Butenko, 1999; Molkanova, 2009). В качестве исходного материала при введении в культуру in vitro были использованы семена или вегетативные части растений. При стерилизации семян и вегетативных частей использовали раствор фунгицида системного действия “Фундазол” в концентрации 2%, экспозиция составляла 30–60 мин и 15–30 мин соответственно. Далее семена и вегетативные части помещали в 70%-й этанол. Для семян экспозиция составляла 2 мин, для вегетативных частей – 0.5–1 мин. В качестве основного стерилизатора использовали 7%-й раствор гипохлорита кальция, экспозиция составляла 1–25 мин. В качестве детергента использовали TWEEN-20.
Рис. 1.
Таксономический состав коллекции in vitro редких и исчезающих видов растений в ГБС РАН.
Fig. 1. Taxonomic composition of in vitro collection of rare and endangered plant species in N.V. Tsitsin Main Botanical Garden of RAS.
На стадии микроразмножения использовали питательные среды: Murashige & Skoog, Anderso, Quorin & Lepoivre, Woody Plant Medium, Gamborg & Eleleig.
В качестве регуляторов роста в питательную среду добавляли: 6-бензиламинопурин (BAP) 0.2–12 мг/л, 2-изопентениладенин (2-ip) 1.0–5.0 мг/л и сочетание этих препаратов с 3-индолил-уксусной кислотой (IAA) 0.05 мг/л, альфа-нафтилуксусной кислотой (NAA) 0.1 мг/л и гиббереловой кислотой (GA) 0.1–1 мг/л.
Депонирование (до 24 месяцев) проводили на питательных средах MS и 1/2 MS, содержащих BA (0.1–1 мг/л) и сахарозу (20–60 г/л), при температуре 5–7°C и освещенности 500–1500 лк.
РЕЗУЛЬТАТЫ
Генетический банк in vitro в ГБС РАН формировался с 1996 г. и в настоящее время является уникальным и наиболее представительным в России. Он содержит 1310 наименований. Особое внимание уделяется редким и исчезающим видам растений, коллекция которых насчитывает 82 вида, что составляет 17.3% от общего числа покрытосеменных растений Красной книги РФ. 54% коллекции in vitro редких и исчезающих видов растений составляют виды 1 и 2 категории редкости, 2 вида относятся к 0 категории. Большинство видов представлено образцами из разных популяций (Vetchinkina et al., 2012).
В ГБС РАН впервые разработаны методики клонального микроразмножения Gladiolus palustris Gaudin., имеющего статус 0 (Ex), Aristolochia manshuriensis Kom., Dioscorea caucasica Lipsky, Sanguisorba magnifica I. Schischk. et Kom., Euonymus nana Beib. – статус 1(E) (Krasnaya…, 2008).
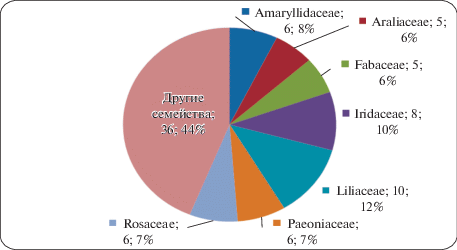
В коллекции in vitro ГБС РАН редких и исчезающих растений России наиболее представлены следующие семейства: Liliaceae (10 видов), Iridaceae (8 видов), Amaryllidaceae (6 видов), Paeoniaceae (6 видов), Rosaceae (6 видов), Araliaceae (5 видов), Fabaceae (5 видов). Большинство видов (90.2% от общего числа) составляют травянистые растения.
Успех введения в культуру in vitro во многом зависит от выбора экспланта, эффективности стерилизации и подбора питательных сред. В ходе многочисленных исследований в лаборатории биотехнологии растений ГБС РАН были оптимизированы схемы стерилизации на этапе введения в культуру in vitro редких и исчезающих видов растений. В качестве основного стерилизатора использовали 7%-й раствор гипохлорита кальция. Семена помещались в раствор на 7–20 мин, вегетативные части – на 3–7 мин соответственно. Время экспозиции зависит от физиологической зрелости экспланта.
Нередко трудностью для получения стерильной культуры и дальнейшего успешного культивирования является побурение тканей первичных эксплантов и питательных сред за счет экссудации фенольных соединений. Среди изученных представителей родов Aralia, Dioscorea, Paeonia, Pulsatilla часто встречались виды растений, отличающиеся повышенным синтезом вторичных метаболитов, приводящим к снижению жизнеспособности или гибели растений-регенерантов. Целесообразно для снижения отрицательного воздействия полифенолов на развитие эксплантов на этапе собственно микроразмножения в качестве антиоксидантов добавлять в питательную среду аскорбиновую кислоту в концентрации 50–100 мг/л, глицин (4 мг/л), поливинилпирролидон (5000 мг/л), снижать освещенность до 500 лк и уменьшать период беспересадочного культивирования в 2 раза.
Помимо этого, рекомендуется добавлять в состав питательной среды активированный уголь в концентрации 100 мг/л, так как он способствует абсорбции продуктов метаболизма (Vetchinkina et al., 2012).
В экспериментальной работе с семенами многих редких видов возникает такая проблема, как покой семян. В большинстве случаев метод культивирования in vitro позволяет значительно сократить срок выведения семян из покоя и оптимизировать семенное размножение. Необходимо учитывать биологию семян (тип покоя, гетероспермия, жизнеспособность, сезонные колебания в ритмах прорастания и т. д.) и другие характеристики размножаемых видов (жизненная форма, преобладающий способ размножения, устойчивость в культуре и др.) (табл. 1).
Таблица 1.
Типы покоя семян у представителей различных родов растений Table 1. Seed dormancy types of representatives of various of plants genera
| Тип покоя семян Type of seed dormancy | Представители родов Representatives of genera |
|
|---|---|---|
| Экзогенный/Exogenous | физический/physical | Iris, Medicago |
| Эндогенный Endogenous | морфологический/morphological | Allium, Crocus |
| физиологический неглубокий/physiological superficial | Dioscorea, Betula, Globularia, Sanguisorba | |
| физиологический промежуточный/physiological intermediate | Atropa | |
| физиологический глубокий/physiological deep | Staphylea, Acer, Ostrya | |
| морфофизиологический простой неглубокий/ morphophysiological simple superficial | Papaver, Scilla | |
| морфофизиологический простой глубокий/ morphophysiological simple deep | Bellevallia, Kalopanax | |
| морфофизиологический глубокий эпикотильный/ morphophysiological deep epicotyl |
Paeonia, Cordiocrinum | |
| морфофизиологический сложный промежуточный/ morphophysiological complex intermediate |
Aralia, Panax, Pulsatilla, Tulipa | |
| морфофизиологический сложный глубокий/ morphophysiological complex deep |
Fritillaria | |
| Комбинированный Combined |
различные сочетания экзо- и эндогенного типов покоя/ various combinations of exo- and endogenous types of dormacy |
Cotoneaster, Colchicum, Aristolochia |
В ходе исследований для ряда таксонов определены оптимальные режимы стратификации, позволяющие получать жизнеспособные проростки. Так, для проращивания семян Globularia punctata Lapeyr., Matthiola fragrans Bunge, Papaver bracteatum Lindl., Iris pumila L., Allium regelianum A. Beck. достаточно использование теплой стратификации (1–1.5 месяца при температуре 20–25°С). Сочетание теплой и холодной стратификации (1–1.5 месяца при 20–25°С и 3–4 месяца при 3–5°С) необходимо для Bellevalia sarmatica (Georgi) Woronow, Belamcanda chinensis (L.) DC., Dioscorea caucasica Lipsky. Наиболее сложные схемы стратификации необходимы для прорастания таких видов, как Tulipa tarda Stapf, Iris acutiloba C.A. Mey., Pulsatilla vernalis (L.) Mill. (1–1.5 месяца при температуре 20–25°С, 3–4 месяца при 3–5°С, 1–2 месяца при 20–25°С), а также видов рода Fritillaria L. (1–1.5 месяца при температуре 20‒25°С, 3–4 месяца при 3–5°С, 1– 2 месяца при 20–25°С, 3–4 месяца при 3–5 °С). Самым длительным периодом прорастания (около 30–40 суток) характеризуются семена Atropa bella-donna L., Pulsatilla vernalis, Hyssopus cretaceus Dubjan.
Использование семян при клональном микроразмножении имеет ряд особенностей. Например, семена Iris pumila и Belamcanda chinensis требуют культивирования на среде с добавлением 1 мг/л гиббереловой кислоты(GA). Кроме того, использовали несколько способов предобработки семян: замачивание в растворе GA в концентрации 1 и 10 мг/л в течение суток, холодная стратификация в течение 1 и 3 месяцев. В то же время семена видов рода Fritillaria культивируют на безгормональной питательной среде и питательных средах с добавлением 1 мг/л BA и 1 мг/л GA в течение 2-этапной стратификации: 5–7 недель при температуре 20–22°С, 2–9–12 недель при температуре 3–5°С. Использование культуры изолированных зародышей позволяет частично или полностью снять необходимость стратификации и соответственно сократить период прорастания семян (Vetchinkina, 2010).
Растения, относящиеся к разным таксонам, различаются уровнем тотипотентности клеток и регенерационным потенциалом. Это обусловливает необходимость дифференцированного подхода к разработке методик клонального микроразмножения для различных таксонов. При выборе стратегии сохранения in vitro каждого вида необходимо учитывать его биологические особенности. Поскольку основной целью при длительном депонировании является сохранение гермоплазмы и поддержание ее в стабильном состоянии были выбраны методы микроразмножения, минимизирующие риск сомаклональных вариаций (Molkanova et al., 2018). К числу таких технологий относится, прежде всего, метод активации уже существующих меристем, который считается надежным в плане генетической стабильности полученных регенерантов (Butenko, 1999; Rani, 2000; Molkanova et al., 2016).
Для каждой жизненной формы характерна, в частности своя активность верхушечной меристемы в онтогенезе и сроки перехода растения от вегетативного состояния к репродуктивному (Rostovceva, 1963). Для успешной регенерации меристем большинства исследованных таксонов необходимо наличие изолированного апекса с 2–3 листовыми примордиями.
Следующий этап после успешной инициации культур in vitro – это индукция побегообразования и собственно размножение. Успех применения любого метода определяется изучением условий, необходимых для его реализации. Это является важным для культуры изолированных органов, тканей и клеток, которые очень чувствительны к малейшим изменениям внешних условий. Для определения оптимальных условий культивирования и управления морфогенезом того или иного объекта in vitro, необходимо оценить морфогенетический потенциал культивируемых тканей и определить факторы, влияющие на эффективность регенерации.
Основные факторы, определяющие процесс органогенеза: эпигенетические характеристики клеток экспланта, физиологическое состояние интактных растений, сроки изоляции экспланта, состав питательной среды и условия культивирования (Molkanova, 2009).
Тканевая принадлежность эксплантов, использованных для получения культуры тканей различных видов в значительной степени определяют морфогенетический потенциал формирующихся регенерантов. Экспланты из разных органов одного вида существенно различались по способности к регенерации в условиях in vitro. Результаты сравнительного анализа морфологических процессов у Aristolochia manshuriensis in vitro показали, что при использовании апикальной меристемы почек развитие de novo зачатков аксиллярных побегов, а впоследствии и растений-регенерантов, происходило более интенсивно по сравнению с использованием апикальной меристемы из проростков (Molkanova, Egorova, 2017).
Экспланты, взятые с молодых растений A. manshuriensis (не старше 4–6 лет), характеризовались более высокой способностью к образованию побегов по сравнению с растениями, достигшими 12 лет. С увеличением возраста интактного растения A. manshuriensis жизнеспособность и органогенный потенциал меристемных комплексов in vitro резко падает, что согласуется с данными, полученными для представителей семейств Oleaceae, Rosaceae, Actinidiaceae (Molkanova, 2018).
Известно, что одним из существенных факторов, влияющих на поддержание устойчивой пролиферирующей культуры, является состав питательной среды.
Для оптимизации стадии размножения используют различные питательные среды, подбирают комбинации и концентрации регуляторов роста. В ходе исследований для модельных видов редких и исчезающих растений установлены оптимальные тип и концентрации фитогормонов, а также длительность беспересадочного выращивания (табл. 2).
Таблица 2.
Рекомендуемый состав питательных сред на этапе собственно размножения и продолжительность периода длительного беспересадочного выращивания редких и исчезающих видов растений в коллекции in vitro ГБС РАН Table 2. Recommended composition of nutrient medium at the propagation stage and subculture period duration of rare and endangered plant species in in vitro collection of N.V. Tsitsin Main Botanical Garden of RAS
| Семейство Family |
Вид Species |
Минераль-ная основа Mineral base |
Регулятор роста Plant growth regulator |
Концентрация фитогормона, мг/л Phytohormone concentration, mg/l |
Длительность беспересадочного выращивания, сут. Duration of continuous cultivation, day |
|---|---|---|---|---|---|
| Alliaceae | Allium grande Lipsky A. regelianum A. Beck. |
1/2 MS, MS | 2-ip | 1.0–3.0 | 45–60 |
| Amaryllidaceae | Galanthus angustifolius G. Koss G. caucasicus (Baker) Grossh. G. lagodechianus Kem.-Nath. G. plicatus Bieb. G. woronowii Losinsk. Leucojum aestivum L. |
MS | BA; NAA | 10.0 0.1 |
30–45 |
| Araliaceae | Aralia continentalis Kitag. A. cordata Thunb. Kalopanax septemlobus (Thunb.) Koidz. Oplopanax elatus (Nakai) Nakai Panax ginseng C.A. Mey. |
MS; QL | BA; IAA | 1.0 0.05 |
30–45 |
| Aristolochiaceae | Aristolochia manshuriensis Kom. | MS; QL | BA; IAA | 0.8 0.05 |
30–45 |
| Asteraceae | Artemisia salsoloides Willd. Jurinea cretacea Bunge |
MS | BA | 0.2–0.5 | 30 |
| Berberidaceae | Epimedium colchicum (Boiss.) Trautv. E. koreanum Nakai |
B5 | 2-ip | 0.5 | 30–40 |
| Betulaceae | Betula schmidtii Regel | WPM; B5 | BA; NAA; GA | 1.5 0.1 0.2 |
40–50 |
| Brassicaceae (Cruciferae) | Сrambe cordifolia Stev. Lepidium meyeri Claus Matthiola fragrans Bunge |
1/2 MS | BA | 0.1 | 15-30 |
| Campanulaceae | Campanula besenginica Fomin | MS | BA; IAA | 0.5 0.05 |
25–30 |
| Caprifoliaceae | Lonicera etrusca Santi L. tolmatchevii Pojark. |
QL | BA | 0.8 | 30–40 |
| Caryophyllaceae | Silene cretacea Fisch. ex Spreng. S. hellmannii Claus |
1/2 MS | BA | 0.2 | 25–30 |
| Celastraceae | Euonymus nana Bieb. | MS | BA | 1.0 | 30–45 |
| Crassulaceae | Rhodiola rosea L. | 1/2 MS, MS | 2-ip | 0.5–1.0 | 45–60 |
| Dioscoreaceae | Dioscorea caucasica Lipsky D. nipponica Makino |
MS | 2-ip | 1.0 | 30–45 |
| Ericaceae | Rhododendron fauriei Franch. R. schlippenbachii Maxim. |
Anderson | 2-ip; IAA | 5.0 1.0 |
40–60 |
| Fabaceae (Leguminosae) | Calophaca wolgarica (L. fil.) DC. Genista tanaitica P.A. Smirn. Hedysarum cretaceum Fisch. H. grandiflorum Pall. H. razoumovianum Fisch. et Helm |
1/2 MS | BA | 0.1 | 15 |
| Globulariaceae | Globularia punctata Lapeyr. | 1/2 MS | 2-ip; BA | 0.5 | 30–45 |
| Hyacinthaceae | Bellevalia sarmatica (Georgi) Woronow Muscari dolichanthum Woronow et Tron Scilla scilloides (Lindl.) Druce |
MS | BA; NAA | 10.0 0.1 |
30–45 |
| Hydrangeaceae | Deutzia glabrata Kom. Нydrangea petiolaris Siebold et Zucc. |
QL | BA; IAA | 0.5 0.1 |
40–50 |
| Iridaceae | Belamcanda chinensis (L.) DC. Gladiolus palustris Gaudin Iris acutiloba C.A. Mey. I. aphylla L. I. ensata Thunb. I. notha Bieb. I. pumila L. s. l. I. scariosa Willd. ex Link |
MS | BA; IAA | 12.0 0.1 |
40–50 |
| Lamiaceae | Hyssopus cretaceus Dubjan. | 1/2 MS | 2-ip | 0.5 | 15–30 |
| Liliaceae | Cardiocrinum cordatum (Thunb.) Makino Fritillaria caucasica Adams F. meleagris L. F. ruthenica Wikstr. Lilium callosum Siebold et Zucc. L. caucasicum (Miscz. ex Grossh.) Grossh. L. cernuum Kom. L. lancifolium Thunb. Tulipa lipskyi Grossh. T. schrenkii Regel |
MS | BA; NAA | 5.0 0.1 |
45–60 |
| Melanthiaceae (Colchicaceae) | Bulbocodium versicolor (Ker-Gawl.) Spreng. | MS | BA; NAA | 6.0–10.0 0.1 |
45–90 |
| Paeoniaceae | Paeonia caucasica (Schipcz.) Schipcz. P. lactiflora Pall. P. obovata Maxim. P. oreogeton S. Moore P. tenuifolia L. P. wittmanniana Hartwiss ex Lindl. |
MS | BA | 0.1 | 40–60 |
| Papaveraceae | Glaucium flavum Crantz Papaver lisae N. Busch |
1/2 MS | BA | 0.2 | 25–30 |
| Primulaceae | Cyclamen coum Mill. subsp. caucasicum (C. Koch) O. Schwarz Primula juliae Kusn. |
1/2 MS | BA | 0.1 | 20–30 |
| Rosaceae | Amygdalus pedunculata Pall. Armeniaca mandshurica (Maxim.) B. Skvortsov Cotoneaster lucidus Schltr. Potentilla volgarica Juz. Prinsepia sinensis (Oliv.) Bean Sanguisorba magnifica I. Schischk. et Kom. |
MS; QL | BA; IAA | 0.5 0.01 |
20–35 |
| Solanaceae | Atropa bella-donna L. | MS | BA | 0.3 | 25–30 |
Темпы развития эксплантов при культивировании разных видов существенно различаются. Выявлено, что регенерационная способность даже в пределах одного рода в культуре in vitro обусловлена видовыми особенностями и носит индивидуальный характер. Например, процесс выращивания из семян до взрослых особей длительный и занимает от 2–3 лет (например, Lilium regale) до 6–8 (например, L. martagon), в культуре in vitro этот период для L. martagon сокращается до 6 месяцев (Mamaeva, 2008).
Одним из эффективных способов сохранения генофонда растений является культивирование регенерантов в условиях замедленного роста. Хранение в условиях замедленного роста позволяет поддерживать биологический материал от нескольких месяцев до 2–3 лет без пересадки на питательную среду в зависимости от используемой технологии и вида растения (Cruz-Cruz et al., 2013). Замедление роста достигается за счет модификации сред или условий культивирования. Модификации сред включают снижение минеральной основы, содержания углеводов, изменение концентраций или подбор комбинаций регуляторов роста, добавление осмотически активных веществ, а также снижение температуры и интенсивности освещения (Molkanova et al., 2016). Сроки и специфика условий хранения растительного материала определяются биологическими особенностями таксонов. В процессе исследований показано, что совместное использование интенсивности освещения, состава питательной среды, концентрации осмотиков и ретардантов значительно увеличивало как беспересадочный период, так и жизнеспособность эксплантов в процессе хранения in vitro. Оптимальными условиями сохранения для большинства изученных редких и исчезающих видов являются: питательная среда, содержащая 1/2 MS, дополненая 0.3 мг/л BAP, пониженная температура (3–7°С) и слабая освещенность (500 лк) (Vetchinkina et al., 2012; Novikova, 2013).
Для растений разных жизненных форм на основе комплекса показателей определены оптимальные типы эксплантов для длительного сохранения в условиях in vitro. Для древесных и полудревесных растений – это фрагменты побегов, содержащие один-два метамера, для травянистых – почки возобновления. Для луковичных растений (представители семейств Alliaceae, Amarilidaceae, Hyacinthaceae, Liliaceae) – пазушные луковички или их сегменты.
ЗАКЛЮЧЕНИЕ
Представленные в настоящей статье материалы основаны на многолетнем опыте работы и направлены на то, чтобы раскрыть возможности биотехнологии в области сохранения редких и исчезающих видов растений.
Применение комплексного подхода к сохранению растений ex situ, когда редкие и исчезающие таксоны содержатся в дублирующих коллекциях (банках семян, живых коллекциях, банках культур in vitro), существенно повышает надежность сохранности генофонда. В ГБС РАН сформирована и сохраняется коллекция in vitro из 82 видов, что составляет 17.3% от общего числа покрытосеменных растений Красной книги РФ. 54% коллекции in vitro редких и исчезающих видов растений составляют виды 1 и 2 категории редкости, 2 вида относятся к 0 категории.
В каждом случае при выборе стратегии сохранения таксона in vitro необходимо учитывать его биологические особенности, оценивать возможности используемых подходов. При формировании коллекций in vitro необходимо обеспечивать представительность вида максимально возможным количеством образцов, происходящих из различных точек ареала.
Разработаны общие рекомендации на этапах введения в культуру in vitro исходного материала, собственно микроразмножения, укоренения и депонирования. При этом следует учитывать, что каждый вид имеет свои особенности при размножении in vitro. С учетом этих особенностей необходимо разрабатывать индивидуальные технологии клонального микроразмножения.
Биотехнологические методы позволяют с использованием небольшого количества исходного материала в короткие сроки получить большое число выровненного посадочного материала. Полученные растения можно использовать для пополнения живых коллекций, реинтродукции и усиления ослабленных природных популяций редких видов.
Особое внимание следует уделять выбору объектов для включения в состав коллекций in vitro. В первую очередь в национальном масштабе нужно выделить виды 1 и 2 категорий Красной книги Российской Федерации не обеспеченные мерами охраны in situ. Следует выделять также таксоны со сложными трофическими связями и характеризующиеся узкой экологической амплитудой.
Актуальной задачей является объединение существующих в РФ банков in vitro растений в единую сеть, работающую по единой программе. Это позволит избежать дублирования в работе и наладить обмен опытом и растительным материалом.
Список литературы
[Altuhov et al.] Алтухов Ю.П., Салменкова Е.А., Курбатова О.Л., Политов Д.В., Евсюков А.Н., Жукова О.В., Захаров И.А., Моисеева И.Г., Столповский Ю.А., Пухальский В.А., Поморцев А.А., Упелниек В.П., Калабушкин Б.А. 2004. Динамика популяционных генофондов при антропогенных воздействиях. М. 620 с.
[Andreev, Gorbunov] Андреев Л.Н., Горбунов Ю.Н. 2003. Роль ботанических садов России в сохранении биологического разнообразия растений. – В сб.: Биологическое разнообразие. Интродукция растений: Материалы 3-й Междунар. науч. конф. СПб. С. 5–7.
[Baranova et al.] Баранова О.Г., Дедюхина О.Н., Яговкина О.В. 2010. Стратегия создания и сохранения коллекционного фонда редких и исчезающих растений в Ботаническом саду Удмуртского университета. – Вестн. Удм. ун-та. Сер. Биология. Науки о Земле. 2: 48–54.
Benson E.E., Danaher J.E., Pimbley I.M. et al. 2000. In vitro micropropagation of Primula scotica: a rare Scotish plant. – Biodivers. Conserv. 9: 711–726. https://doi.org/10.1023/A:1008941726419
[Butenko] Бутенко Р.Г. 1999. Биология клеток высших растений in vitro и биотехнология на их основе. М. 160 с.
Cruz-Cruz C.A., Gonzalez-Arnao M.T., Engelmann F. 2013. Biotechnology and Conservation of Plant Biodiversity. – Resources. 2: 73–95. https://doi.org/10.3390/resources2020073
[Globalnaya…] Глобальная стратегия сохранения растений. 2002. М. 16 с.
Hamrick J.L., Godt M.J.W. Philosophical Transactions: Biological Sciences. 1996. – Plant Life Histories: Ecological Correlates and Phylogenetic Constraints. 351. 1345: 1291–1298.
Holsinger K.E., Vitt P. 1997. The future of conservation biology: What’s a geneticist to do? The ecological basis of conservation: Heterogeneity, ecosystems and biodiversity. New York. P. 202–206.
[Ishmuratova, Tkachenko] Ишмуратова М.М., Ткаченко К.Г. 2009. Семена травянистых растений: особенности латентного периода, использование в интродукции и размножении in vitro. Уфа. 115 с.
[Konvenciya] Конвенция о биологическом разнообразии. 1995. UNEP/CBD. 34 с.
[Krasnaya…] Красная книга Российской Федерации (растения и грибы). 2008. М. 855 с.
[Mamaeva] Мамаева Н.А. 2008. Сравнительный анализ морфологических и биологических признаков сортов садовых Бородатых ирисов: секция Iris рода Iris L.: Дис. … канд. биол. наук. М. 152 с.
[Molkanova et al.] Молканова О.И., Коновалова Л.Н., Стахеева Т.С. 2016. Особенности размножения и сохранения коллекции ценных и редких видов растений в условиях in vitro. – Бюллетень Никитского бот. сада. 120: 17–23.
[Molkanova] Молканова О.И. 2009. Генетические банки растений в ботанических садах России. – Сборник научных трудов Никитского бот. сада. Ялта. 131. С. 22–27.
[Molkanova, Egorova] Молканова О.И., Егорова Д.А. 2017. Некоторые аспекты культивирования in vitro Aristolochia manshuriensis Kom. – Вестник Удмуртского университета. Серия Биология. Науки о Земле. 27 (2): 151–157.
[Molkanova et al.] Molkanova O.I., Egorova D.A., Mitrofanova I.V. 2018. Preservation characteristics of valuable plant species in in vitro genebanks at russian botanical gardens. – In Vitro Cell. Dev. Biol. 54: 546–547. .https://doi.org/10.1007/s11627-018-9929-7
[Molkanova et al.] Molkanova O.I., Shirnina I.V., Mitrofanova I.V. 2018. Conservation and micropropagation of rare and endemic species in genepool collections of the Russian Federation. – J. Biotechnol. V. (280): S83–S84. https://doi.org/10.1016/j.biotec.2018.06.274
[Novikova] Новикова Т.И. 2013. Использование биотехнологических подходов для сохранения биоразнообразия растений. – Растительный мир Азиатской России. 2 (12): 119–128. https://doi.org/10.1007/BF00232274
Rani V., Raina S.N. 2000. Genetic fidelity of organized meristem derived micropropagated plants: A critical reappraisal. – In Vitro Cell. Dev. Biol. Plant. 36: 319–330. https://doi.org/10.1007/s11627-000-0059-6
Reed B.M., Engelmann F., Dulloo E., Engels J.M.M. 2004. Technical guidelines for the management of field and in vitro germplasm collections. IPGRI Handbooks for Genebanks No. 7. International Plant Genetic Resources Institute, Rome, Italy. 105 p.
[Revin] Ревин П. Речь на XVI Международном ботаническом конгрессе. 2000. – Информ. бюлл. Совета ботанических садов России и Отделения Международного совета по охране растений. 11: 38–47.
[Rostovceva] Ростовцева З.П. 1963. Верхушечная меристема высших растений. М. 59 с.
[Tihonova] Тихонова В.Л. 1999. Сохранение генофонда дикорастущих растений в банках семян. – В сб.: Семя: тез. Междунар. науч.-практ. конф. 14–16 дек. М. С. 111–113.
[Trifonova et al.] Трифонова А.А., Кочиева Е.З., Кудрявцев А.М. 2014. Анализ генетического разнообразия редкого и эндемичного вида Allium regelianum на основе данных NSB-профлайнинга. – В сб.: Материалы VII Международной научно-практической конференции “Биотехнология как инструмент сохранения биоразнообразия растительного мира (физиолого-биохимические, эмбриологические, генетические и правовые аспекты)”. Ялта. 192 с.
[Vetchinkina et al.] Ветчинкина Е.М., Ширнина И.В., Ширнин С.Ю., Молканова О.И. 2012. Сохранение редких видов растений в генетических коллекциях in vitro. – Вестн. Балт. гос. ун-та им. И. Канта. 7: 109–118.
[Vetchinkina] Ветчинкина Е.М. 2010. Биологические особенности культивирования in vitro семян и зародышей редких видов растений: Дис. … канд. биол. наук. М. 170 с.
Дополнительные материалы отсутствуют.
Инструменты
Ботанический журнал


