Ботанический журнал, 2020, T. 105, № 8, стр. 733-749
СТРОЕНИЕ ГИНЕЦЕЯ И СЕМЯЗАЧАТКА У НЕКОТОРЫХ ВИДОВ CRINUM (AMARYLLIDACEAE)
И. И. Шамров 1, 2, *, Г. М. Анисимова 2, А. А. Торшилова 2, И. Г. Левичев 2
1 Российский государственный педагогический университет им. А.И. Герцена
191186 Санкт-Петербург, наб. р. Мойки, 48, Россия
2 Ботанический институт им. В.Л. Комарова РАН
197376 Санкт-Петербург, ул. Проф. Попова, 2, Россия
* E-mail: ivan.shamrov@gmail.com
Поступила в редакцию 09.04.2020
После доработки 22.04.2020
Принята к публикации 28.04.2020
Аннотация
Изучено строение гинецея и семязачатка у 6 видов Crinum (Amaryllidaceae). Синкарпный гинецей образован 3 плодолистиками, которые полностью срастаются между собой и с окружающим гипантием. Нижняя завязь представлена синасцидиатной и закрытой симпликатной зонами. Дистальная и проксимальная области завязи узкие, лишены плацент и семязачатков. Для изученных видов характерна центрально-осевая иннервация семязачатков. В гинецее (детально изучены Crinum firmi-folium и C. bulbispermum) проводящие пучки из стелы ответвляются в околоцветник (6 пучков) и андроцей (6 пучков). Васкулярное снабжение гинецея обеспечивается 3 дорсальными и 6 вентральными, от которых в семязачатки отходят плацентарные пучки. В центре гипантия формируется полость, в которой проходит столбик до верхней части завязи. Рыльце – головчатое. В завязи образуется септальный нектарник. В средней части столбик плотно сомкнут с прилежащими тычинками и спирально изогнут, кроме C. flaccidum, у которого он прямой. У исследованных видов в нем проходит канал, эпидермальные клетки которого являются секреторными.
Семязачатки располагаются на центрально-угловых плацентах. В каждом гнезде на вентральных краях плодолистиков формируются по 2 ряда семязачатков, за исключением нижней и верхней областей завязи, где плаценты объединяются и образуют только по одному ряду семязачатков. У изученных видов Crinum семязачатки являются недифференцированными. Предполагаемую границу между интегументом и нуцеллусом можно провести лишь условно. Перед опылением центральную часть семязачатка занимает зародышевый мешок. Как семязачаток, так и зародышевый мешок характеризуются изогнутой морфологической осью. Зародышевый мешок состоит из яйцеклетки, двух синергид, трех антипод и центральной клетки с вторичным ядром. Клетки яйцевого аппарата располагаются под углом в 45° относительно антипод, при этом вторичное ядро центральной клетки находится вблизи антипод. Исходя из внутреннего строения семязачатка, можно предположить, что в недифференцированном семязачатке Crinum условно можно выделить интегумент (2–3-слойный) и нуцеллус (2–3-слойный в латеральной и 10–12-слойный в базальной частях; в апикальной части образуется париетальная ткань – 2 слоя у С. asiaticum, 3 у C. firmifolium и 4–5 у C. bulbispermum). Нуцеллус и интегумент объединены в единую структуру, возникшую в ходе конгенитального срастания. Ткани плаценты входят в состав базальной зоны семязачатка, напоминая плаценто-халазу. Семязачатки обращены апикальной частью к основанию завязи. Семязачаток является геми-ортотропным. Он характеризуется тем, что морфологическая ось, проходящая через плаценто-халазу, изгибается в направлении антиподального полюса зародышевого мешка, клетки которого сохраняют орто-положение. Однако микропилярный полюс зародышевого мешка и париетальная ткань не подходят к плаценте, а располагаются параллельно ей, как в геми-анатропном семязачатке.
Обсуждаются данные, полученные по организации гинецея и семязачатка у изученных видов Crinum. Изгибание столбика и смыкание его с пыльниками прилежащих тычинок, которые могут менять положение в цветке, вместе с другими особенностями строения гинецея (формирование компиума, септального нектарника, секреторного канала в столбике, участие гипантия в образовании нижней завязи и цветочной трубки) можно рассматривать как особую стратегию биологии опыления у этих видов. Семязачатки у Crinum являются недифференцированными и остановились в развитии на стадии примордия. Они схожи с ant мутантами Arabidopsis thaliana и редуцированными семязачатками некоторых паразитных растений из порядка Santalales, при этом, как свидетельствуют молекулярные исследования, нуцеллус приобрел свойства, которые стали ограничивать развитие интегументов у анцестральных видов.
Известно, что семязачатки цветковых растений по числу интегументов разделяют на битегмальные (двупокровные) и унитегмальные (однопокровные). Некоторые авторы предлагают различать еще одну категорию семязачатков – атегмальные (Hofmeister, 1858; Warming, 1878; Johow, 1885, 1889). Среди цветковых растений битегмальные семязачатки выявлены в 237 семействах, а унитегмальные – в 114 (Kamelina, 2011). Битегмальные семязачатки обнаружены почти у всех однодольных и многих двудольных. Унитегмальные семязачатки встречаются преимущественно у двудольных (спайнолепестные) и некоторых однодольных (Gymnostachys и Montrichardia, Araceae – Goebel, 1897; Buzgo, 1999; Thalassia, Hydrocharitaceae – Tomlinson, 1969). Атегмальные семязачатки отмечены у некоторых паразитных растений (Loranthaceae, Misodendraceae) (Hofmeister, 1861; Goebel, 1933; Fagerlind, 1937; Maheshwari, 1950).
Интегументы у цветковых растений развиты в разной степени. Крайняя степень их редукции до инициальных клеток характерна для ряда паразитных растений (Santalaceae – Ram, 1959; Shamrov et al., 2001; некоторые Gentianaceae – Bouman, Louis, 1989). В недифференцированном на структуры семязачатке интегументы не формируются (некоторые виды Opiliaceae, Loranthaceae, Santalaceae – Fagerlind, 1948; Dixit, 1955; Agarwal, 1961). Однако отсутствие интегументов наблюдается и у автотрофных видов. К таким растениям относятся виды рода Crinum, которые характеризуются так называемым голым семязачатком (Hofmeister, 1861; Goebel, 1897, 1933; Stenar, 1925; Fagerlind, 1937; Dutt, 1957a, b, 1959; Savchenko, Komar, 1965; Huber, 1969; Savchenko, 1973; Komar, 1985; Kamelina, 2011), Melocanna bambusoides Trin. из сем. Poaceae (Petrova, 1965), Cardiopteris quinqueloba (Hassk.) Hassk. из сем. Cardiopteridaceae (Tobe, 2016).
Вопросы объема и структуры сем. Amaryllidaceae, куда включают род Crinum (от 50 до 100 видов), обсуждаются (Darlington, Wylie, 1955; Traub, 1957; Artyushenko, 1970; Takhtajan, 1966, 2009), причем для анализа используются признаки строения семязачатка и семени, в том числе особенности организации интегументов и семенной кожуры (Snijman, Linder, 1996; Meerow et al., 2002). Так, на основании морфологических и молекулярных признаков была подтверждена естественность трибы Hymenocallideae (Amaryllidaceae), включающая 3 рода Hymenocallis, Ismene и Leptochiton. Leptochiton является сестринской группой к кладе Hymenocallis/Ismene, что подтверждается двумя общими морфологическими признаками – формированием 16–20 семязачатков в гнезде и наличием фитомеланиновой семенной кожуры (Meerow et al., 2002).
Чтобы оценить результаты структурной редукции у видов рода Crinum, важно изучить не только внутреннее строение семязачатка, но и его морфологический тип и положение в завязи. Морфологический тип семязачатка в этом роде, как, впрочем, и сем. Amaryllidaceae, до сих пор обсуждается в литературе (Vorsobina, Solntseva, 1990) – от ортотропного и анатропного до гемитропного и ана-кампилотропного (Davis, 1966; Dutt, 1957a, b, 1958, 1959, 1962, 1964, 1970a, b; Savchenko, Komar, 1965; Komar, 1985; Kamelina, 2011). Данные по гинецею кринума фрагментарны и малочисленны (Johri, 1966; Singh, 1972). В связи с этим нами было проведено исследование строения гинецея и семязачатка у ряда представителей рода Crinum.
МАТЕРИАЛ И МЕТОДЫ
Материалом для исследования послужили растения 6 видов кринума – Crinum (С. asiaticum L., C. flaccidum Herb., C. firmifolium Baker, Crinum bulbispermum (Burm.f.) Milne-Redh. et Schweick., C. latifolium L., C. thaianum J. Schulze), произрастающих в оранжереях Ботанического сада Петра Великого Ботанического института им. В.Л. Комарова РАН. Были изучены бутоны и цветки в период цветения. Материал фиксировали в смеси FАА (70% этиловый спирт, ледяная уксусная кислота и формалин в пропорции 100:7:7) и обрабатывали по общепринятой методике (Pausheva, 1974). Срезы толщиной 10–20 мкм окрашивали сафранином по Картису (ядра и цитоплазма) и алциановым синим (клеточные оболочки). Срезы изготовлены на микротоме Microm HM 325 (Carl Zeiss, Germany). Окраску препаратов проводили 1%-ным раствором сафранина, приготовленного на 50%-ном этиловом спирте, с подкраской 1%‑ным раствором алцианового синего, приготовленного на 3%-ной уксусной кислоте (Zhinkina et al., 2018). Время окраски в сафранине составляло 20 минут, а в алциановом синем – 5 минут. Готовые препараты заключали в канадский бальзам. Рисунки выполняли с применением рисовального аппарата на микроскопе Leica DM 1000, а микрофотографии – с помощью этого же микроскопа с использованием цифровой фотокамеры Leica EC3. Для получения изображений частей растений использовали микроскоп Stemi (Zeiss).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ОБСУЖДЕНИЕ
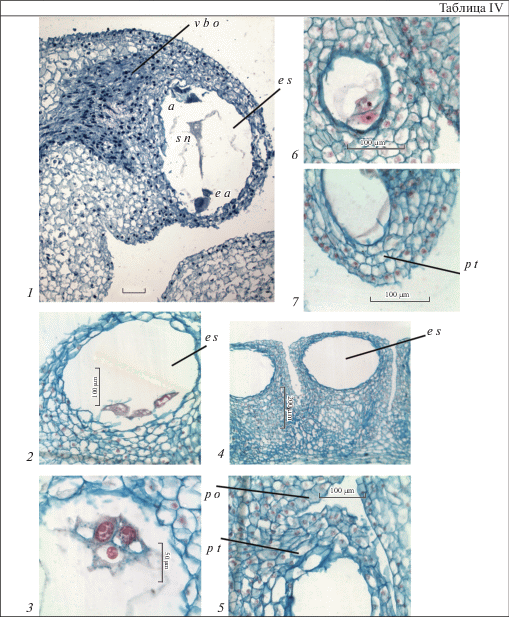
Цветок и гинецей. У видов Crinum, как и представителей других родов сем. Amaryllidaceae, формируются 3-членные, обоеполые, актиноморфные цветки (Vorsobina, Solntseva, 1979; Khaleel, Siemsen, 1989). Члены простого околоцветника, состоящего из 6 лепестковидных элементов, и андроцея из 6 тычинок, расположены в 2 кругах. Синкарпный гинецей образован 3 плодолистиками, которые полностью срастаются между собой. Завязь нижняя, и в ее формировании принимают участие элементы цветочной трубки, или гипантия (основания элементов простого околоцветника и тычинок). Она представлена синасцидиатной и закрытой симпликатной зонами. Последняя зона возникает в ходе постгенитального срастания. Перед опылением граница между зонами гинецея не выражена (рис. 1, 2–10; табл. I, 2–7), и выявить ее можно только в ходе всего морфогенеза, начиная с самых ранних стадий развития. Завязь кеглевидной формы. Наибольшая ее ширина характерна для средней области. Апикальная и базальная области узкие, лишены плацент и семязачатков, т.е. являются стерильными (рис. 1, 1; табл. I, 1). Для изученных видов характерна центрально-осевая иннервация семязачатков. Согласно существующим представлениям (Eyde, 1967), проводящие пучки, снабжающие семязачатки питательными веществами, происходят из центральных пучков стелы цветоножки. В гинецее (детально изучен Crinum firmifolium) проводящие пучки из стелы ответвляются в околоцветник и андроцей (6 – в лепестковидные элементы и 6 – в тычинки). Васкулярное снабжение гинецея обеспечивается 3 дорсальными (ими становятся крупные пучки, смежные с пучками внутренних тычинок) и 6 вентральными (ими становятся мелкие центральные пучки, по 2 от каждого плодолистика) пучками. От вентральных пучков в семязачатки отходят плацентарные пучки (рис. 1, 2–10; табл. I, 2–7). Полученные данные согласуются с литературными данными по C. asiaticum и C. moorei Hook.f. (Singh, 1972).
Рис. 1.
Строение гинецея перед опылением у Crinum bulbispermum.
1 – продольный срез гинецея, 2, 3 – нижняя часть завязи, плаценты и семязачатки отсутствуют; 4 – граница нижней и средней частей завязи, плаценты в каждом гнезде объединились в одну; 5 – средняя часть завязи, семязачатки расположены на плацентах в 2 ряда; 6 – граница средней и верхней частей завязи, плаценты объединились в одну; 7, 8 – верхняя часть завязи, плаценты и семязачатки отсутствуют; 9 – переход завязи в столбик; 10 – гипантий, в центре которого проходит столбик с каналом. d v b – дорсальный проводящий пучок, gp – гипантий, o l – гнездо завязи, ov – семязачаток, p – плацента, s n – септальный нектарник, st – столбик, v v b – вентральный проводящий пучок. Масштабные линейки, мкм: 50.
Fig. 1. Gynoecium structure before pollination in Crinum bulbispermum.
1 – longitudinal section of the gynoecium, 2, 3 – the lower part of the ovary; placentae and ovules are absent; 4 – the border of the lower and middle parts of the ovary, the placentae in each locule are combined into one; 5 – the middle part of the ovary, ovules located on the placenta in 2 rows; 6 – the border of the middle and upper parts of the ovary, the placentae are combined into one; 7, 8 – the upper part of the ovary, placentae and ovules are absent; 9 – transition of the ovary into a style; 10 – hypanthium with a channeled style in its center. d v b – dorsal vascular bundle, gp – gypanthium, o l – ovary locule, ov – ovule, p – placenta, s n – septal nectary, st – style, v v b – ventral vascular bundle. Scale bars, µm: 50.
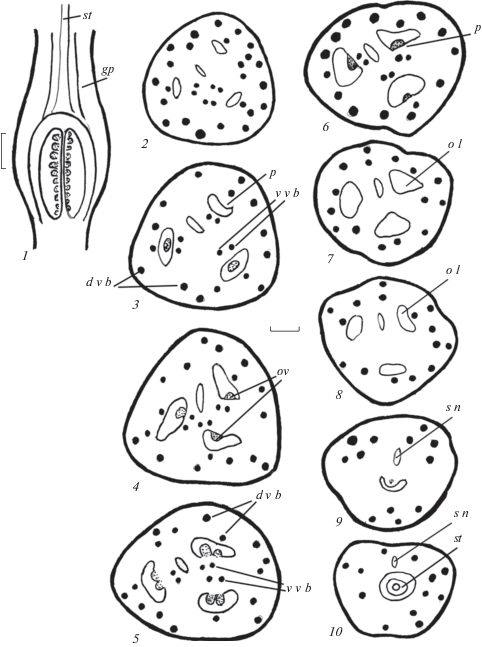
Таблица I. Строение гинецея у Crinum firmifolium (1–7).
1 – внешний вид завязи; 2–7 – разрезы завязи в области гипантия (1), при вхождении столбика в завязь (2), в верхней (4, 5), средней (6) и нижней (7) частях. o l –гнездо завязи, s n – септальный нектарник, st – столбик. Масштабные линейки, мкм – 80.
Plate I . Gynoecium structure in Crinum firmifolium (1–7).
1 – ovary appearance; 2–7 – sections of the ovary in the hypanthium (1), at the style entry in the ovary (2), in the upper (4, 5), middle (6) and lower (7) parts. o l – ovary locule, s n – septal nectary, st – style. Scale bars, µm: 80.
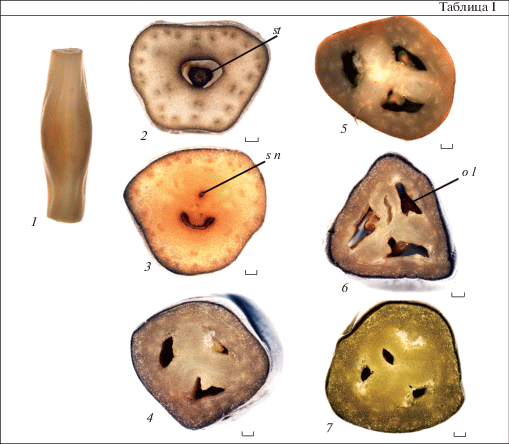
Асимпликатная зона гинецея у изученных видов очень своеобразна. В центре гипантия формируется полость, в которой до верхней части завязи проходит столбик (рис. 1, 9, 10; табл. I, 1, 2). Рыльце – головчатое, представлено 3 лопастями или слегка разрезано на 3 доли (табл. II, 1–5). Таким образом, в дистальной части гинецея, образованной верхней частью завязи, столбиком и рыльцем, формируется компиум, играющий важную роль в период опыления и оплодотворения. К этому следует добавить, что в завязи кринума образуется септальный нектарник, простирающийся по всей высоте завязи (рис. 1, 2–10).
Таблица II. Строение цветка перед опылением у Crinum tenuifolium (1–4) и C. flaccidum (5).
1 – завязь и часть столбика; 2, 3, 5 – строение тычинок, столбика и рыльца; 4 – строение столбика. a – пыльник, f – тычиночная нить, st – столбик, stg – рыльце. Масштабные линейки, мкм – 120.
Plate II . Flower structure before pollination in Crinum tenuifolium (1–4) and C. elacida (5).
1 – ovary and part of the style; 2, 3, 5 – the structure of stamens, style and stigma; 4 – the structure of style. a – anther, f – filament, st – style, stg – stigma. Scale bars, µm: 120.

Столбик характеризуется и другими специфическими структурными особенностями. Он является очень тонким и длинным. В средней части столбик плотно сомкнут с прилежащими тычинками. Последним присущи некоторые отличительные черты – тычиночные нити срастаются с теками не по всей длине, и связник не формируется в апикальной и базальной областях пыльников, в результате чего пыльники на полюсах приобретают вильчатую форму. Поэтому они могут изменять положение в цветке, отклоняясь в апикальной части и сцепляясь в базальной части со столбиком, который в области контакта оказывается спирально изогнутым (табл. II, 1–4), кроме C. flaccidum, у которого он прямой (табл. II, 5). У исследованных нами видов в нем проходит канал, эпидермальные клетки которого являются секреторными. Клетки подобного типа были описаны в столбике Crinum defixum Ker Gawl. Однако, в его верхней части был обнаружен канал, который ниже бифуркирует на 2 канала – крупный и маленький. Крупный канал еще раз разветвляется и, таким образом, в основании столбика образуется 3 канала (Johri, 1966).
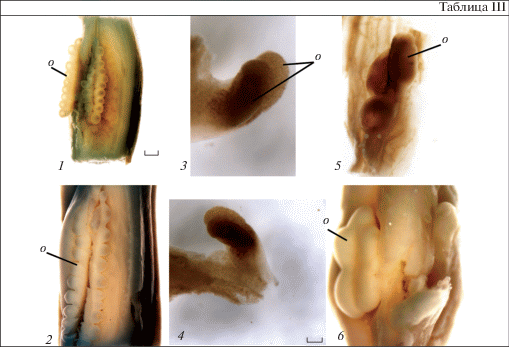
Семязачатки располагаются на центрально-угловых плацентах. В каждом гнезде на вентральных краях плодолистиков формируются по 2 ряда семязачатков (рис. 2, 1; 3, 1), за исключением нижней и верхней областей завязи, где плаценты объединяются и образуют только по одному семязачатку (рис. 1, 4, 6). Число семязачатков в рядах составляет 2–3 у большинства изученных видов, 3–4 у C. latifolium и 10–12 у C. bulbispermum. Семязачатки одного ряда располагаются со смещением относительно семязачатков соседнего ряда (табл. III, 1–6).
Рис. 2.
Строение семязачатка у Crinum bulbispermum.
1 – пара семязачатков на вентральных краях одного плодолистика; 2 – строение семязачатка и зародышевого мешка; 2а – апикальная часть семязачатка и плацентарный обтуратор. a – антиподы, e c – яйцеклетка, e s – зародышевый мешок, p o – плацентарный обтуратор, p t – париетальная ткань, v b o – проводящие пучки семязачатка, p v b – плацентарный проводящий пучок, s – синергида, v v b – вентральный проводящий пучок. Масштабные линейки, мкм: 1 – 30; 2, 3 – 10.
Fig. 2. Ovule structure in Crinum bulbispermum.
1 – two ovules on the ventral edges of one carpel; 2 – structure of the ovule and embryo sac; 2a – apical portion of the ovule and placentary obturator. a – antipodals, e c – egg cell, e s – embryo sac, p o – placentary obturator, p t – parietal tissue, v b o – vascular bundles of the ovule, p v b – placentary vascular bundle, s – synergid, v v b – ventral vascular bundle. Scale bars, µm: 1 – 30; 2, 3 – 10.
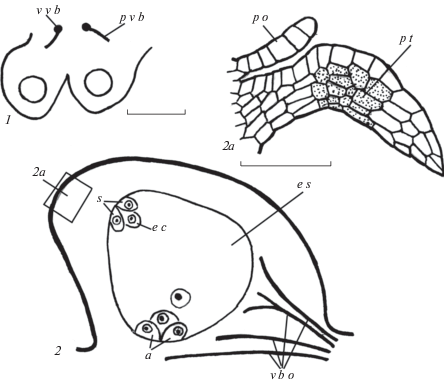
Таблица III. Строение плацент и расположение на них семязачатков у Crinum bulbispermum (1, 2), C. asiaticum (3–5) и C. thaianum (6).
1, 2, 5, 6 – ряды семязачатков на плаценте; 3, 4 – два семязачатка на вентральных краях одного плодолистика. o – семязачаток. Масштабные линейки, мкм: 1, 2, 5, 6 – 80; 3, 4 – 20.
Table III. Placenta structure and localization of ovules in Crinum bulbispermum (1, 2), C. asiaticum (3–5) and C. thaianum (6).
1, 2, 5, 6 – rows of ovules on the placenta; 3, 4 – two ovules on the ventral edges of one carpel. o – ovule. Scale bars, µm: 1, 2, 5, 6 – 80; 3, 4 – 20.
С применением кладистического анализа на основании строения чешуй луковицы, числа и продолжительности листьев, характера поверхности листовой пластинки, окраски цветков во время цветения, морфологии тычиночной нити, пыльцы и столбика предложена новая классификация трибы Amaryllideae сем. Amaryllidaceae. Часть признаков касаются строения семян и плодов (Snijman, Linder, 1996), которые в дальнейшем были использованы в разделении трибы на подтрибы. Было выявлено, что триба включает 2 подтрибы: Crininae (Boophone s. str. – Crinum, Ammocharis, Cybistetes) и Amaryllidinae (Amaryllis, Neerine, Brunsvigia, Crossyne, Hessea, Strumaria, Carpolyza). По сравнению с большинством видов сем. Amaryllidaceae, для которых характерны битегмальные семязачатки, видам трибы Amaryllideae присущи унитегмальные семязачатки. Подтриба Crininae в отличие от подтрибы Amaryllidinae характеризуется невскрывающимися плодами и семенами без интегумента. К такому выводу пришли авторы (Snijman, Linder, 1996), исходя из литературных эмбриологических данных (главным образом, Stenar, 1925, 1951; Dutt, 1957a,b, 1962, 1970a, 1970b). Они полагали, что интегумент у видов подтрибы Crininae есть на ранних стадиях и исчезает при переходе от семязачатка к семени, несмотря на то, что для Crinum ранее были описаны атегмальные семязачатки. По мнению этих авторов, наличие унитегмальных семязачатков является синапоморфным признаком для всей трибы Amaryllideae. В дальнейшем эта триба была разделена на 4 подтрибы: Amaryllidinae, Boophoninae, Crininae, Strumariinae. Из подтрибы Crininae был исключен род Boophone, при этом сохранились 3 рода: Crinum, Ammocharis и Cybistetes. Характеристика подтрибы Crininae почти не изменилась, при этом авторы без указания на первоисточники считают, что семена видов этой трибы лишены интегумента (в списке признаков он был назван, как “интегумент в семени во время диссеминации является недифференцированным” по сравнению с “массивным интегументом” в семенах видов других подтриб) (Meerow, Snijman, 2001).
Именно поэтому значительный научный интерес представляет анализ данных по строению семязачатка, и особенно интегумента, у видов рода Crinum. Как уже было отмечено, в литературе семязачатки видов этого рода описывают как голые, или атегмальные. Первые исследования по семязачатку были проведены у Crinum capense Herb. Было выявлено, что семязачаток имеет один интегумент (Hofmeister, 1861). Затем эти данные были подтверждены на примере C. asiaticum и C. defixum (Dutt, 1957a, b, 1962). Однако, у C. latifolium L., C. bulbispermum (Burm. f.) Milne-Redh. et Schweick. (= Crinum longifolium (L.) Thunb.) (Stenar, 1925; Tomita, 1931) и C. asiaticum (Huber, 1969) было показано, что семязачатки не имеют интегумента. Эту точку зрения поддержали и другие авторы (Savchenko, Komar, 1965; Savchenko, 1973; Kamelina, 2011). Семязачатки кринума описывают также как тенуинуцеллятные (Stenar, 1925; Tomita, 1931), крассинуцеллятные (Wunderlich, 1959; Savchenko, 1973) либо медионуцеллятные (Kamelina, 2011).
У C. asiaticum (Dutt, 1957b) и C. defixum (Dutt, 1962) семязачаток по строению представляет собой недифференцированное состояние. По мнению автора, он образован массивным интегументом и 1–2 клетками нуцеллуса, которые могут делиться периклинально. И, если у других видов трибы Amaryllideae с дифференцированными семязачатками расчленение тела семязачатка на интегументы и нуцеллус подтверждено иллюстрациями (Pancratium loongifolium Roxb., Zephyranthes citrina Baker: семязачаток с двумя интегументами, нуцеллусом, фуникулусом и рафе – Dutt, 1958, 1964, 1970 b), то для Crinum такая дифференциация семязачатка, а также время появления и исчезновения интегумента в статьях (Dutt, 1957b, 1962) не показано. К этому следует добавить, что об исчезновении интегумента в ходе морфогенеза можно судить только по динамике структур, входящих в состав семязачатка и семени. Так, одним из авторов настоящей статьи (Shamrov, 1997) при изучении унитегмального семязачатка Ceratophyllum demersum L. (Ceratophyllaceae) были выявлены стадии его формирования. До оплодотворения он 1–2-слойный в апикальной и 5–6-слойный в базальной частях семязачатка. После оплодотворения его клетки исчезают, и уже на стадии глобулярного зародыша от интегумента остается бесструктурная кутикулярная пленка. Функцию семенной кожуры выполняют наружные клетки нуцеллуса.
Из каких элементов состоит семязачаток у видов рода Crinum? Решению этого вопроса способствуют представления, которые разрабатываются при изучении семязачатков паразитных видов порядка Santalales. У них выявлены значительные структурные различия в организации семязачатков. Высказано предположение, что структурная эволюция у этих растений происходила, вероятно, от дифференцированных к недифференцированным на структуры семязачаткам, а затем к их полному исчезновению (Shamrov et al., 2001; Shamrov, 2008).
Мы уже отмечали, что по данным Dutt (1957b), семязачаток C. asiaticum представляет собой недифференцированное состояние и образован массивным интегументом и 1–2 клетками нуцеллуса. Первая часть утверждения, с нашей точки зрения, является верной и позволяет предположить, что семязачатки Crinum относятся к категории семязачатков, не дифференцированных на структуры. Они являются редуцированными семязачатками, в которых интегумент, нуцеллус, халаза не формируются в ходе развития. Поэтому странной является вторая часть утверждения, когда этот автор почему-то решил, что при недифференцированном состоянии семязачаток может состоять из интегумента и нуцеллуса, границы между которыми не видны. Также, по-видимому, поступают и другие авторы, которые, отмечая отсутствие интегумента (Stenar, 1925; Tomita, 1931; Wunderlich, 1959; Huber, 1969; Savchenko, Komar, 1965; Savchenko, 1973; Kamelina, 2011), тем не менее, полагают, что в семязачатке есть нуцеллус.
По нашему мнению, у изученных видов Crinum семязачатки являются недифференцированными и остановились в развитии на стадии примордия. Структуры в них не формируются ни на этой, ни на последующих стадиях морфогенеза семязачатка. Поэтому лишь условно мы можем провести предполагаемые границы между интегументом и нуцеллусом. Точно можно утверждать, что семязачаток не имеет выраженного фуникулуса (афуникулярный семязачаток, по представлениям Shamrov, 2008), а граница между халазой и плацентой отсутствует. Ткани плаценты входят в состав базальной зоны семязачатка, напоминая плаценто-халазу (Savchenko, 1973), как у видов семейств Poaceae (Petrova et., 1985) и Ceratophyllaceae (Shamrov, 1997).
Перед опылением центральную часть семязачатка Crinum firmifolium занимает зародышевый мешок. С его боков имеются 4–5 слоев вытянутых клеток. В базальной части число слоев составляет 10–12. У C. bulbispermum семязачаток имеет подобное строение, но над зародышевым мешком, в отличие от C. firmifolium, формируются не 4, а 5–6 слоев таблитчатых клеток (рис. 2, 2, 2а; 3, 1, 2; табл. IV, 5, 7). Менее массивный семязачаток у С. asiaticum: 2–3 слоя в латеральной, 8–9 слоев в базальной и 3 слоя в апикальной частях (рис. 3, 3). У C. bulbispermum формируется плацентарный обтуратор, граничащий с эпидермой семязачатка (рис. 2, 2а).
Рис. 3.
Строение семязачатка у Crinum firmifolium (1, 2) и C. asiaticum (3).
1 – пара семязачатков на вентральных краях одного плодолистика; 2, 3 – строение семязачатка и зародышевого мешка. a – антиподы, e c – яйцеклетка, e s – зародышевый мешок, p t – париетальная ткань, v b o – проводящие пучки семязачатка, p v b – плацентарный проводящий пучок, s – синергида, v v b – вентральный проводящий пучок. Масштабные линейки, мкм: 1 – 30; 2, 3 – 10.
Fig. 3. Ovule structure in Crinum firmifolium (1, 2) and C. asiaticum (3).
1 – two ovules on the ventral edges of one carpel; 2, 3 – structure of the ovule and embryo sac. a – antipodals, e c – egg cell, e s – embryo sac, p t – parietal tissue, v b o – vascular bundles of the ovule, p v b – placentary vascular bundle, s – synergid, v v b – ventral vascular bundle. Scale bars, µm: 1 – 30; 2, 3 – 10.
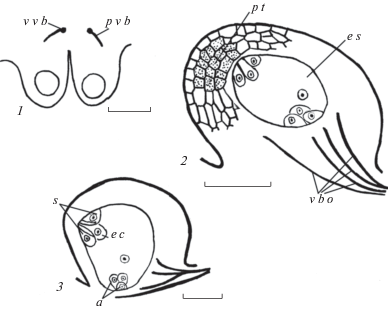
Таблица IV. Расположение семязачатков на плаценте и их строение у Crinum bulbispermum (1–5) и C. firmifolium (6, 7).
1, 4 – семязачатки на плаценте; 2, 6 – антиподы в зародышевом мешке; 3 – яйцевой аппарат; 5, 7 – фрагменты семязачатков. a – антиподы; e a – яйцевой аппарат; e s – зародышевый мешок; s n – вторичное ядро центральной клетки; p o – плацентарный обтуратор; p t – париетальная ткань; v b o – проводящий пучок семязачатка. Масштабные линейки, мкм: 1, 2, 5, 6, 7 – 100; 3 – 50; 4 – 200.
Table IV. Localization of ovules on placenta and their structure in Crinum bulbispermum (1–5) and C. firmifolium (6, 7).
1, 4 – ovules on the placenta; 2, 6 – antipodals in the embryo sac; 3 – egg apparatus; 5, 7 – fragments of ovules. a – antipodals; e a – egg apparatus; e s – embryo sac; s n – secondary nucleus of the central cell; p o – placentary obturator; p t – parietal tissue; v b o – vascular bundles of the ovule. Scale bars, µm: 1, 2, 5, 6, 7 – 100; 3 – 50; 4 – 200.
Как семязачаток, так и зародышевый мешок характеризуются изогнутой морфологической осью. Зародышевый мешок состоит из яйцеклетки, двух синергид, трех антипод и центральной клетки с вторичным ядром. Клетки яйцевого аппарата располагаются под углом в 45° относительно антипод, при этом вторичное ядро центральной клетки находится вблизи антипод (рис. 2, 2; 3, 2, 3; табл. IV, 1), что предполагает после оплодотворения развитие гелобиального эндосперма.
В сем. Amaryllidaceae семязачатки у большинства видов медионуцеллятные (термин понимается, исходя из представлений Shamrov, 2008), но у некоторых представителей они – крассинуцеллятные (Kamelina, 2011). В крассинуцеллятном семязачатке в ходе развития отмечают наличие 1‑слойной париетальной ткани (Wóycicki, 1929; Dutt, 1962, 1970a; Kamelina, 2011). Ультраструктурное исследование крассинуцеллятного, битегмального семязачатка Galanthus nivalis (Chiampo-rova et al., 1988) показало, что перед опылением клетки нуцеллуса почти полностью облитерируются в микропилярной и латеральной частях и сохраняются преимущественно в халазальной области. Исходя из внутреннего строения семязачатка изученных нами видов, можно предположить, что в недифференцированном семязачатке Crinum условно можно выделить интегумент (2–3-слойный) и нуцеллус (2–3-слойный в латеральной и 10–12-слойный в базальной частях; в апикальной части образуется париетальная ткань – 2 слоя у С. asiaticum, 3 у C. firmifolium и 4–5 у C. bulbispermum). Нуцеллус и интегумент не разделены на автономные структуры (соответственно нет и халазы, которая возникает в основании нуцеллуса и интегумента) и объединены в единую структуру, возникшую в ходе конгенитального срастания. Семязачатки обращены апикальной частью к основанию завязи.
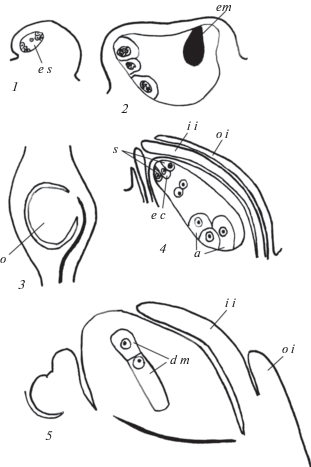
Обсудим морфологический тип семязачатка у видов рода Crinum. Его описывают как анатропный (Vorsobina, Solntseva, 1990), ана-кампилотропный (Dutt, 1957b) или ортотропный (Kamelina, 2011). Проведенное нами исследование показало, что семязачаток у исследованных нами видов является геми-ортотропным. Геми-ортотропный подтип гемитропного типа был выделен И.И. Шамровым (Shamrov, Anisimova, 2015; Shamrov, 2017, 2018). У видов кринума геми-ортотропный семязачаток характеризуется тем, что морфологическая ось, проходящая через плаценто-халазу изгибается в направлении антиподального полюса зародышевого мешка, клетки которого сохраняют орто-положение. Однако микропилярный полюс зародышевого мешка и париетальная ткань не подходят к плаценте, а располагаются параллельно ей, как в геми-анатропном семязачатке. По-видимому, семязачаток у Crinum asiaticum и C. defixum также является геми-ортотропным, а не ана-кампилотропным, что хорошо видно из представленных иллюстраций (Dutt, 1962, 1970a) (рис. 4, 1, 2). Подобный семязачаток встречается у видов семейств Ceratophyllaceae, Chloranthaceae, Circaeasteraceae, Cymodoceae, Hydrocharitaceae, Lardizabalaceae, Poaceae, Potamogetonaceae, Ruppiaceae, Zannichelliaceae, Zosteraceae и, вероятно, Polygonaceae, для которых ранее были указаны разные типы семязачатка, преимущественно ортотропные. Семязачатки и семена у всех занимают боковое положение в завязи, они висячие, к основанию завязи часто обращено микропиле, которое не подходит к плаценте. Геми-ортотропный морфологический тип семязачатка и его положение в завязи видов Crinum особенно сходны с таковыми у представителей сем. Poaceae (Batygina, Mametyeva, 1979; Petrova et al., 1985; Voronova et al., 2003) (рис. 4, 3–5). К этому следует добавить, что семязачаток одного из видов злаков (Melocanna bambusoides) описывается атегмальным, как и у Crinum. Он характеризуется как ана-кампилотропный, крассинуцеллятный, но с плаценто-халазой (Petrova, 1965). При сравнительном анализе данных по M. bambusoides c другими видами злаков видно, что его семязачаток похож на семязачаток Triticum aestivum L. и Festuca arundinacea Schreb., с той лишь разницей, что в семязачатке последних видов присутствуют 2 интегумента (Petrova et al., 1985). По нашему мнению, семязачаток у злаков геми-ортотропный, у M. bambusoides он не дифференцирован на структуры, в его условном нуцеллусе есть 1-слойная париетальная ткань, а антиподы занимают латеральное положение, как у видов Crinum. Также можно интерпретировать строение семязачатка, который был описан у Cardiopteris quinqueloba (Cardiopteridaceae) как прямой (автор уточняет, что не ортотропный!), атегмальный, тенуинуцеллятный, с фуникулусом и рафе (Tobe, 2016). Судя по иллюстрациям, приведенным в статье, семязачаток у этого вида геми-ортотропный, а такие структуры, как фуникулус и рафе отсутствуют.
Рис. 4.
Строение геми-ортотропного семязачатка и положение его в завязи (по литературным данным, схематизировано).
1, 2 – семязачатки до опыления (1) и в период развития зародыша (2) у Crinum defixum (по: Dutt, 1962); 3, 4 – положение семязачатка в завязи у Triticum aestivum (3) и его строение у Festuca arundinacea (по: Petrova et al., 1985); 5 – строение семязачатка у Zea mays (по: Voronova et al., 2003). a – антиподы, d m – диада мегаспор, em – зародыш, e c – яйцеклетка, e s – зародышевый мешок, i i – внутренний интегумент, o – семязачаток, o i – наружный интегумент, s – синергида.
Fig. 4. Structure of hemi-orthotropous ovule and its position in the ovary (after literature data, schematic).
1, 2 – ovules before pollination (1) and during embryo development (2) in Crinum defixum (after: Dutt, 1962); 3, 4 – ovule position in the ovary in Triticum aestivum (3) and its structure in Festuca arundinacea (after: Petrova et al., 1985); 5 – ovule structure in Zea mays (after: Voronova et al., 2003). a – antipodals, d m – dyad of megaspores, em – embryo, e c – egg cell, e s – embryo sac, i i – inner integument, o – ovule, o i – outer integument, s – synergid.
Варианты строения семязачатков у Crinum и Cardiopteris удивительным образом схожи с мутантами A. thaliana (Robinson-Beers et al., 1992; Gaiser et al., 1995; Schneitz et al., 1995; Angenent, Colombo, 1996; Groß-Hardt et al., 2002; Endress, 2011). Так, у ant мутантов семязачатки полностью лишены интегументов и напоминают собой спорангиофоры предков семенных растений. У мутантов ino A. thaliana возникает только внутренний интегумент, также происходит инициация наружного интегумента, который останавливается в развитии, при этом семязачаток напоминает по строению семязачаток голосеменных с одним интегументом. У мутантов bel1, bel2 и bel3 внутренний интегумент не инициируется и не формируется, а наружный интегумент развивается как аномальная структура в виде колокола, которая сначала становится лопастной, а затем образует систему разветвленных осей, в которых дифференцируются археспориальные клетки и мегаспороциты.
Мы уже отмечали, что при изучении семязачатков у паразитных видов из порядка Santalales было высказано предположение, что у этих растений структурная эволюция происходила, вероятно, от дифференцированных к недифференцированным на структуры семязачаткам, а затем к их полному исчезновению (Shamrov, 2008). Дифференцированные (унитегмальные и битегмальные семязачатки) характерны для видов семейств Olacaceae и некоторых Opiliaceae, Santalaceae. Недифференцированные на структуры, или редуцированные, семязачатки представляют собой остановившиеся в развитии примордии семязачатков (некоторые Loranthaceae, Misodendraceae, Opiliaceae, Santalaceae). В этом случае свободная центральная колонка в завязи образует лишь вырост, который был назван “mamelon” (англ.), или “сосочек”. Вырост может быть лопастным. Лопасти представляют собой недифференцированные семязачатки, в каждом из которых возникают археспориальные клетки, а затем зародышевые мешки (Teryokhin, 1977). Полное исчезновение семязачатков коррелирует с формированием эмбриональных структур в тканях плаценты или стенки завязи. Создается комплекс клеток вокруг археспориальных клеток и зародышевых мешков, который условно можно рассматривать как семязачаток. У Santalum album L. было показано, что интегумент и нуцеллус в семязачатке находятся в редуцированном состоянии. На ранних стадиях развития перед дифференциацией структур в апикальной части примордия семязачатка формируются лишь инициали интегумента и нуцеллярный колпачок. Высказано мнение, что большая часть интегумента и нуцеллуса в ходе конгенитального срастания образовали пахихалазу, в которой развиваются спорогенные структуры, зародышевый мешок и зародыш (Shamrov et al., 2001; Shamrov, 2008, 2018). Это предположение получило подтверждение в молекулярно-генетических исследованиях. По результатам сравнения экспрессии генов ANT и BEL1 у Arabidopsis thaliana (L.) Heynh. и представителей пор. Santalales было сделано заключение (Brown et al., 2010), которое, с нашей точки зрения, позволяет объяснить строение семязачатков 2 вариантов: – семязачатков с редуцированными органами (подобно S. album – семязачатки возникли, вероятно, при слиянии интегументов с нуцеллусом) (1) и не дифференцированных на структуры семязачатков (например, Crinum, Cardiopteris, Melocanna – нуцеллус приобрел свойства, которые стали ограничивать развитие интегументов у анцестральных видов) (2). Появление недифференцированных на структуры семязачатков у кринума, по-видимому, можно объяснить, исходя из общих представлений об эволюционном становлении структур. Процессы структурной редукции семязачатков обусловлены изменениями их морфологических типов (более плотной упаковкой в завязи вдоль плаценты, при этом семязачатки стали изгибаться и располагаться со смещением в смежных рядах) и снижением числа семян, формирующихся в плодах: от 10–12 у C. bulbispermum до 3–4 у C. latifolium и 2–3 у большинства изученных видов. Даже при минимальном числе семязачатков последние стали занимать только среднюю часть завязи, хотя ее размеры позволяют развиваться большему числу семязачатков. У видов Crinum в ходе эволюции возможно появление более крупных и немногочисленных семязачатков.
Список литературы
Agarwal S. 1961. The embryology of Strombosia Blume. – Phytomorphology. 11 (3): 269–272.
Angenent G., Colombo L. 1996. Molecular control of ovule development. – Trends in Plant Sci. 1 (7): 228–232.
[Artyushenko] Артюшенко З.Т. 1970. Амариллисовые (Amarylidaceae Jaume St.-Hilaire) СССР. Морфология, систематика и использование. Л. 180 с.
[Batygina, Mametyeva] Батыгина Т.Б., Маметьева Т.Б. 1979. К эмбриологии рода Poa L. – В кн.: Актуальные проблемы эмбриологии покрытосеменных растений. Л. С. 89–95.
Bouman F., Louis A. 1989. Seed structure in Voyria primuloides Baker (Gentianaceae): taxonomic and ecological implication. – In: Dedicatory volume to prof. A. Lebègue “Some aspects and actual orientations in plant embryology”. Université de Picardie, Amiens, France. P. 261–270.
Brown R.H., Nickrent D.L., Gasser C.S. 2010. Expression of ovule and integument-associated genes in reduced ovules of Santalales. – Evol. Dev. 12 (2): 231–240. https://doi.org/10.1111/j.1525-142X.2010.00407.x
Buzgo M. 1999. Flower structure and development of Acoraceae and basal Araceae and their systematic position among basal monocotyledons. Ph D Thesis. 340 p.
[Chiamporova et al.] Чиампорова М., Ахалкаци М.Ш., Гваладзе Г.Е. 1988. Ультраструктура стерильных тканей семяпочки Galanthus nivalis (Amaryllidaceae). – Бот. журн. 73 (12): 1722–1730.
Darlington C.D., Wylie A.P. 1955. Chromosome atlas of flowering plants. London. 520 p.
Davis G.L. 1966. Systematic embryology of angiosperms. New York. 528 p.
Dixit S.N. 1955. The morphology of Lepeostegeres gemmiflorus Bl. – Curr. Sci. 24 (8): 278–279.
Dutt B.S.M. 1957a. Morphology of the ovule of Crinum defixum. – Curr. Sci. 26 (1): 22–24.
Dutt B.S.M. 1957b. Ovule and embryo sac of Crinum asiaticum L. – Sci. and Culture. 22 (12): 688–690.
Dutt B.S.M. 1958. Morphology of the ovule of Zephyranthes citrina Baker. – Curr. Sci. 27 (12): 501–502.
Dutt B.S.M. 1959. Ovule and embryo sac of Crinum latifolium: a reinvestigation. – Curr. Sci. 28 (7): 293–294.
Dutt B.S.M. 1962. A contribution to the life-history of Crinum defixum Ker. – In: Plant embryology. A Symposium. New Delhi. P. 37–48.
Dutt B.S.M. 1964. Ovule and embryo sac of Pancratium maritimum L. – a reinvestigation. – Curr. Sci. 33 (5): 150–151.
Dutt B.S.M. 1970a. Amaryllidaceae. Symposium on comparative embryology of angiosperms. – Bull. Nat. Indian Sci. Acad. 41: 362–377.
Dutt B.S.M. 1970b. Embryology of Pancratium longiflorum. – Phytomorphology. 20 (1): 1–5.
Endress P.K. 2011. Angiosperm ovules: diversity, development, evolution. – Ann. Bot. 107: 1465–1489.
Eyde R.H. 1967. The peculiar gynoecial vasculature of Cornaceae and its systematic significance. – Phytomorphology. 17 (1–4): 172–182.
Fagerlind F. 1937. Embryologische, zytologische und bestaubungsexperimentelle Studien in der Familie Rubiaceae nebst Bemerkungen über einige Polyploiditätsprobleme. – Acta Horti Berg. 11 (9): 195–470.
Fagerlind F. 1948. Beitrage zur Kenntnis der Gynoceummorphologie und Phylogenie der Santalales-Familien. – Svensk Bot. Tidskr. 42: 195–229.
Gaiser J.C., Robinson-Beers K., Gasser C.S. 1995. The Arabidopsis SUPERMAN gene mediates asymmetric growth of the outer integument of ovules. – Plant Cell. 7: 333–345.
Goebel K. 1897. Morphologische und biologische Bemerkungen. – Flora. 83: 426–435.
Goebel K. 1933. Organographie der Pflanzen. Jena. 460 S.
Groß-Hardt R., Lenhard M., Laux T. 2002. WUSHEL signaling functions in interregional communication during Arabidopsis thaliana ovule development. – Genes et Development. 16: 1129–1128.
Hofmeister W. 1958. Neuere Beobachtungen über die Embryobildung der Phanerogamen. – Jahrb. Wiss. Bot. 1: 82–190.
Hofmeister W. 1861. Neue Beitrage zur Kenntnis der Embryobildung der Phanerogamen. II. Monokotyledonen. – Abh. Kongl. Sachs Ges. Wiss. 7: 629–760.
Huber H. 1969. Die Samenmerkmale und Verwandtschaftsverhältnisse der Liliifloren. – Mitt. Bot. Staatssamml. München. 8 (2): 219–538.
Johow F. 1885. Die chlorophyllfreien Humusbewohner Westindiens, biologisch-morphologisch dargestellt. – Jahrb. Wiss. Bot. 16 (3): 415–449.
Johow F. 1889. Die chlorophyllfreien Humuspflanzen nach ihren biologischen und anatomischentwicklungsgeschichtlichen Verhaltnissen. – Jahrb. Wiss. Bot. 20 (4): 475–525.
Johri M.M. 1966. The style, stigma and pollen tube. III. Some taxa of the Amaryllidaceae. – Phytomorphology. 16 (2): 142–157.
[Kamelina] Камелина О.П. 2011. Систематическая эмбриология цветковых растений. Однодольные. Барнаул. 191 с.
Khaleel T.F., Siemsen D. 1989. Cytoembryology of Amaryllis hybrids. – Canad. Bot. J. 67 (3): 839–847.
[Komar] Комар Г.А. 1985. Семейство Amaryllidaceae. – В кн.: Сравнительная анатомия семян. Л. Т. 1. С. 83–85.
Maheshwari P. 1950. An introduction to the embryology of angiosperms. New York. 453 p.
Meerow A.W., Guy C.L., Li Q.-B, Clayton J.R. 2002. Phylogeny of the tribe Hymenocallideae (Amaryllidaceae) based on morphology and molecular characters. – Ann. Missouri Bot. Club. 89 (3): 400–413.
Meerow A.W., Snijman D.A. 2001. Phylogeny of Amaryllidaceae Tribe Amaryllideae Based on nr DNA ITS sequences and morphology. – Amer. J. Bot. 88 (12): 2321–2330. https://doi.org/10.2307/3558392
[Pausheva] Паушева З.П. 1974. Практикум по цитологии растений. М. 288 с.
[Petrova] Петрова Л.Р. 1965. Морфология репродуктивных органов бамбука Melocanna bambusoides Trin. – Бот. журн. 50 (9): 1288–1304.
[Petrova et al.] Петрова Л.Р., Федотова Т.А., Николаевская Т.С. 1985. Семейство Poaceae. – В кн.: Сравнительная анатомия семян. Л. Т. 1. С. 192–205.
Ram M. 1959. Morphological and embryological studies in the family Santalaceae. 2. Exocarpus, with a discussion on its systematic position. – Phytomorphology. 9 (1): 4–19.
Robinson-Beers K., Pruitt R.E., Gasser C. 1992. Ovule development in wild-type Arabidopsis and two female-sterile mutants. – Plant Cell. 4: 1237–1249.
[Savchenko] Савченко М.И. 1973. Морфология семяпочки покрытосеменных растений. Л. 190 с.
[Savchenko, Komar] Савченко М.И., Комар Г.А. 1965. Морфология семяпочек некоторых однодольных. – В кн.: Морфология цветка и репродуктивный процесс у покрытосеменных растений. М.; Л. С. 74–113.
Schneitz K., Hulskamp M. Pruitt R.E. 1995. Wild-type development in Arabidopsis thaliana: light microscope study of cleared whole-mount tissue. – Plant J. 7 (5): 731–749.
[Shamrov] Шамров И.И. 1997. Развитие семязачатка и семени у Ceratophyllum demersum (Ceratophyllaceae). – Бот. журн. 82 (10): 1–13.
[Shamrov] Шамров И.И. 2008. Семязачаток цветковых растений: строение, функции, происхождение. М. 356 с.
[Shamrov] Шамров И.И. 2017. Морфологические типы семязачатков цветковых растений. – Бот. журн. 102 (2): 129–146. https://doi.org/10.1134/S0006813618020011
[Shamrov] Шамров И.И. 2018. Особенности морфогенеза, разнообразие и возможные преобразования семязачатков цветковых растений. – Бот. журн. 103 (2): 163–186. https://doi.org/10.1134/S0006813618020011
[Shamrov, Anisimova] Шамров И.И., Анисимова Г.М. 2015. Строение гинецея и происхождение семязачатка у Polygonum affine (Polygonaceae). – Бот. журн. 100 (6): 521–539.
[Shamrov et al.] Шамров И.И., Анисимова Г.М., Батыгина Т.Б., Лакшми Сита Г. 2001. Типы и морфологическая эволюция семязачатка в порядке Santalales. – Бот. журн. 86 (7): 1–14.
Singh V. 1972 Floral embryology of the Amaryllidaceae. I. Subfamily Amaryllidoideae. – Canad. Bot. J. 50 (7): 1555–1565.
Snijman D.A., Linder H.P. 1996. Phylogenetic relationships, seed characters, and dispersal system evolution in Amaryllideae (Amaryllidaceae). – Ann. Missouri Bot. Club. 83 (3): 362–386.
Stenar S.H. 1925. Embryologische Studien I und II: I. Zur Embryologie einiger Columniferen. II. Die Embryologie der Amaryllideen. Diss. Upsala. 305 S.
Stenar S.H. 1951. Zur Embryologie von Haemanthus katharinae Bak., nebst Erőrterungen über das helobiale Endosperm in den Amaryllidaceae und Liliaceae. – Acta Horti Berg. 16 (2): 57–73.
[Takhtajan] Тахтаджян А.Л. 1966. Система и филогения цветковых растений. Л. 611 с.
Takhtajan A. 2009. Flowering plants. Springer. 871 p. https://doi.org/10.1007/978-1-4020-9609-9.
[Teryokhin] Терехин Э.С. 1977. Паразитные цветковые растения. Эволюция онтогенеза и образа жизни. Л. 219 с.
Tobe H. 2016. Embryology of Cardiopteris (Cardiopteridaceae, Aquifoliales), with emphasis on unusual ovule and seed development. – J. Plant Res. 129 (5): 883–897. https://doi.org/10.1007/s19265-016-0845-9
Tomita K. 1931. Über die Entwicklung des nackten Embryos von Crinum latifolium L. – Sci. Rep. Tohôku Univ. 6: 163–169.
Tomlinson P.B. 1969. On the morphology and anatomy of turtle grass, Thalassia testudinum (Hydrocharitaceae). III. Floral morphology and anatomy. – Bull. Marine Sci. Vol. 19. P. 286–305.
Traub H.P. 1957. Classification of the Amaryllidaceae, subfamilies, tribes, and genera. – Herbertia (Plant Life). 13 (1): 76–83.
Voronova O.N., Shamrov I.I., Batygina T.B. 2003. Ovule morphogenesis in normal and mutant Zea mays. – Acta Biol. Cracov. Ser. Bot. 45 (1): 155–160.
[Vorsobina, Solntseva] Ворсобина Л.И., Солнцева М.П. 1979. Особенности цветения и процесс оплодотворения у некоторых амариллисовых. – В кн.: Актуальные проблемы эмбриологии покрытосеменных растений. Л. С. 28–38.
[Vorsobina, Solntseva] Ворсобина Л.И., Солнцева М.П. 1990. Семейство Amaryllidaceae. – В кн: Сравнительная эмбриология цветковых растений. Однодольные. Л. С. 87–96.
Warming E. 1878. De l`ovule. – Ann. Sci. Natur. Bot. Sér. 6. 5: 175–266.
Wόycicki Z. 1929. Die Entwicklung des Embryosackes bei Haemanthus katharinae. – Acta Soc. Bot. Polon. 6 (3): 323–340.
Wunderlich R. 1959. Zur Frage der Phylogenie der Endospermtypen bei den Angiospermen. – Österr. Bot. Zeitschr. 106 (3–4): 203–293.
[Zhinkina et al.] Жинкина Н.А., Торшилова А.А., Озеров И.А. 2018. Применение модифицированной методики окрашивания тканей современных и ископаемых растений. – Бот. журн. 103 (9): 1191–1195. https://doi.org/10.7868/S0006813618090090
Дополнительные материалы отсутствуют.
Инструменты
Ботанический журнал


