Ботанический журнал, 2020, T. 105, № 9, стр. 835-853
ДИАЛЕКТИКА ВИДОВ: ОТ ИСХОДНОГО ЕДИНООБРАЗИЯ, ЧЕРЕЗ МАКСИМАЛЬНО ВОЗМОЖНОЕ РАЗНООБРАЗИЕ К КОНЕЧНОМУ ЕДИНООБРАЗИЮ
А. В. Родионов 1, 2, *, В. С. Шнеер 1, **, А. А. Гнутиков 3, Н. Н. Носов 1, Е. О. Пунина 1, П. М. Журбенко 1, И. Г. Лоскутов 2, 3, О. В. Муравенко 4
1 Ботанический институт им. В.Л. Комарова РАН
197376 Санкт-Петербург, ул. Профессора Попова 2, Россия
2 Биологический ф-т, Санкт-Петербургский государственный университет
199034 Санкт-Петербург, Университетская наб., 7/9, Россия
3 Федеральный исследовательский центр
Всероссийский институт генетических ресурсов растений им. Н.И. Вавилова (ВИР)
190000 Санкт-Петербург, ул. Большая Морская, 42–44, Россия
4 Институт молекулярной биологии им. В.А. Энгельгардта
119991 Москва, ул. Вавилова 32, Россия
* E-mail: avrodionov@mail.ru
** E-mail: shneyer@rambler.ru
Поступила в редакцию 30.01.2020
После доработки 05.04.2020
Принята к публикации 14.04.2020
Аннотация
В статье показано, что данные сравнительной геномики раскрыли генетические механизмы явлений и процессов, наблюдаемых на разных стадиях видообразования у растений в случаях, когда оно идет через события более или менее отдаленной межвидовой гибридизации, часто сопровождаемой полногеномной дупликацией родительских геномов (полиплоидизацией). Рассмотрены быстрые и долговременные последствия этих процессов. Транспозоны (мобильные элементы) и микроРНК являются важными факторами изменчивости генома и фенотипа после отдаленной гибридизации. В истории всех таксонов наземных растений, по-видимому, неоднократно происходил цикл: межвидовая гибридизация – полиплоидизация – геномный шок – всплеск изменчивости генома и транскриптома, индуцированный транспозонами – “доместикация” вновь обретенных транспозонов, потеря части генов-паралогов, приобретение некоторыми из дуплицированных генов новых функций – стабилизация кариотипа – вторичная диплоидизация. Все это вполне согласуется с так называемой “гегелевской триадой”, о которой размышлял В.Л. Комаров.
Слова, вынесенные в название нашей статьи, приведены В.Л. Комаровым в заключительной главе его книги “Учение о виде у растений”. Комаров пишет: “Большое искушение – предположить, что процесс возникновения новых видов, приспособленных к новым условиям, идет по путям известной гегелевской триады: от исходного единообразия, через максимально возможное разнообразие к конечному единообразию”. (Komarov, 194011: 204). Гегелевская триада, о которой говорит Комаров – это приписываемая Гегелю формула, описывающая диалектический процесс познания и/или процесс развития в природе и обществе, звучащая как “тезис – антитезис – синтез”22.
Примерно тогда же, в начале 1940-х годов, сходные идеи о стадийности таксоногенеза высказывал М.Г. Попов (“Теория систематических единиц (категорий)”, рукопись 1940–1944 гг. цит. по изданию: Popov, 198333), полагавший, что в своем развитии вид проходит через три стадии:
1. Константный вид, размножающийся большей частью “в себе”;
2. Комплексный вид – возникающий в результате межвидовой гибридизации и возвратных скрещиваний, разнообразный морфологически и генетически, некоторые группы особей этого комплексного вида оказываются более приспособленными к новым условиям существования и поддерживаются отбором, промежуточные формы и неудачные комбинации признаков вымирают;
3. Относительно однородный реликтовый вид, в некоторых случаях вымирающий, в других вступающий в новые межвидовые гибридизации.
Существенная для взглядов J.P. Lotsy (Lotsy, 1916) и М.Г. Попова (Popov, 1983) идея, что движущей силой в процессах видообразования у растений может являться межвидовая гибридизация, была не по душе Комарову. Он пишет: “Вообще основывать теорию видообразования на гибридах, как это делал Линней и много позднее его Лотси, нельзя, <…> дело не в перекомбинировании уже имеющихся наследственных зачатков, а в выработке новых, возникающих под влиянием противоречий между средой и организмом (борьба за существование и отбор)” (Komarov, 1940: 123). Личный опыт В.Л. Комарова как флориста говорил о том, что межвидовую гибридизацию нельзя рассматривать как существенный элемент процессов видообразования у растений. Он пишет: “…гибриды в природе не очень часты. Так, в Уссурийском крае, на 1500 видов, там мною осмотренных, я встречал только два примера их” (Komarov, 1940: 117). И далее: “…гибридные циклы врываются в общий строй природы <…> каким-то диссонансом. Среди массы более или менее устойчивых форм попадаются одна-две группы, в которых что ни индивидуум, то что-нибудь особенное; какая-нибудь новая для исследователя морфологическая особенность или своеобразное сочетание признаков. Словом, одно мучение – crux botanicorum!” (Komarov, 1940: 135).
По мнению Комарова, главная проблема, с которой сталкивается исследователь, пытающийся понять механизмы видообразования у растений, состоит в коренном противоречии между непрерывно идущим в масштабах геологического времени изменением видов в ходе эволюции и дискретностью наблюдаемых в природе жизненных форм. Он пишет: “Задача поймать и изобразить вид в движении трудна. Трудна потому, что в громадном большинстве случаев вид движется во времени и в пространстве бесконечно медленнее, чем движемся мы сами, мыслящие и изучающие его особи. Нам приходится открывать процесс становления и распространения, а также и вымирания видов часто только из сравнения отдельных звеньев морфологических рядов. Накопить такой материал по сравнительной физиологии и биохимии видов, который позволил бы уловить движение видов во времени и пространстве до сих пор науке не удалось, в ее распоряжении имеются только морфологические ряды, которые позволяют установить филогению отдельных растений” (Komarov, 1940: 206). В данной статье мы попробуем обозреть, что говорит о процессах видообразования у растений современная наука. Прежде всего, речь пойдет о том, какую роль играла отдаленная гибридизация в появлении групп особей, способных к ароморфозам, дававших начало новым таксонам более высоких рангов.
РЕПРОДУКТИВНАЯ ИЗОЛЯЦИЯ КАК КРИТЕРИЙ “БИОЛОГИЧЕСКОГО ВИДА”
Согласно синтетической теории эволюции (СТЭ) дивергенция генотипов и фенотипов, как естественное следствие генетико-автоматических процессов, начинается с момента, когда возникает генетическая изоляция. Отсюда вытекала биологическая (генетическая) концепция вида. Вид – это группа природных популяций, состоящих из особей, скрещивающихся между собой и репродуктивно изолированных от других таких групп (Dobzhansky, 1935; Mayr, 1942; Grant, 1981). Идею эту нельзя назвать новой – трудно не согласиться с Любарским (Lyubarsky, 201844: 261–262), что представление о том, что живые существа естественным образом разделены на интуитивно воспринимаемые общности (историки науки обычно называют их родо-видами), самовоспроизводимые при размножении и репродуктивно изолированные от других родо-видов, существовало “всегда”, а то, что изоляция эта не абсолютна и иногда некоторые из животных, подобно кобыле и ослу, могут скрещиваться и порождать новые формы, было известно провинциальным животноводам Древнего Рима (Armitage, Chapman, 1979) и, благодаря авторитету Фомы Аквинского, уже в натурфилософском контексте, обсуждалось в кругах интеллектуалов XIII и последующих веков (Lyubarsky, 2018). Тем не менее очевидный акцент на репродуктивной изоляции как критерии вида, характерный для СТЭ, как отмечают И.Я. Павлинов и Г.Ю. Любарский (Pavlinov, Lyubarsky, 201155, p. 414–415), имел важные последствия для естествознания: тем самым был предложен критерий, который позволял отличать вид как от внутривидовых форм (не изолированных друг от друга репродуктивно), так и от надвидовых таксонов, к которым этот критерий неприменим. Такое понимание вида вернуло виду статус важнейшей таксономической категории. Показательно, что при этом было отказано в статусе “видов”, или, во всяком случае, “полноценных видов”, как агамным формам, так и гибридогенным видам-агрегатам (Komarov, 1940; Harlan, de Wet, 1963; Grant, 1981; Kashin, 200266).
Концепция биологического вида была принята генетиками и зоологами, однако ботаники отнеслись к ней неоднозначно. В своем предисловии к русскому переводу книги V. Grant (Grant, 1984) А.Л. Тахтаджян писал, что “В ботанике она [концепция “биологического вида”] имела некоторый успех лишь в 40-х и отчасти 50-х годах (и в ее пользу высказывался и автор этих строк77). Но постепенно стали выявляться все изъяны этой концепции и против нее выступил ряд крупных биологов (преимущественно ботаников)” (Takhtajan, 19848, 899). Так, по мнению самого Тахтаджяна, эта концепция применима только к “бипарентальным” видам. У растений много видов с агамным и почти облигатным апомиктическим размножением – все это множества морфологически, экологически и географически определенные, “хорошие” виды, однако к ним критерий внутривидовой скрещиваемости неприменим. Кроме того, критерий репродуктивной изоляции применим преимущественно к симпатрическим видам (здесь Тахтаджян приводит пример с видами Platanus, упоминаемыми нами ниже). Хорошо морфологически различающиеся виды, возникшие и существовавшие аллопатрически, сохраняют способность к скрещиванию при совместном произрастании в ботанических садах, в парках, на газонах и в иных рукотворно созданных комбинациях живых растений, несмотря на то, что со времени дивергенции этих видов прошли десятки миллионов лет (Grant, 1981; Levin, 2012). С другой стороны, концепция “биологического вида” предполагает трактовку как самостоятельных видов “криптических” видов (видов-двойников) – репродуктивно изолированных, но морфологически неразличимых (по крайней мере по внешней морфологии). По мере расширения использования молекулярных данных в систематике таких видов обнаруживается все больше (особенно у животных, но и у растений), но их формальное описание связано с большими проблемами (Shneyer, Kotseruba, 2015; Shneyer et al., 2018). Ну и, наконец, последним по порядку, но не по значению, является то, что традиционно для ботаников при описании нового вида определяющим являлось и является, прежде всего, указание на своеобразие характеризующего вид набора морфологических признаков – особый “образ вида” (Timonin, 19981010; Kamelin, 2005), определенность его географического ареала и места в структуре биосферы (“экономике природы” по В.Л. Комарову) (Tzvelev, 19951111 и др.). Наличие этих определяющих вид признаков позволяет ботанику предположить общность происхождения составляющих вид индивидуумов и косвенно указывает на определенную репродуктивную изоляцию вида. Однако при таксономической обработке растительных объектов, дискретности, основанные на критериях скрещивания, на морфологической и экологической обособленности, не всегда совпадают друг с другом (Grant, 1981; Tzvelev, 1995; Kamelin, 2009 и др.). Для некоторых растений (американские дубы, евроазиатские ивы, многие роды розоцветных, сложноцветных, злаков) характерны длительно существующие и занимающие определенные экологические ниши гибридные комплексы (называемые также сингамеонами, гибридными циклами), образующиеся в результате более или менее регулярных скрещиваний между двумя-тремя “морфологически-определенными видами” с последующими реципрокными скрещиваниями с родительскими видами или разведением “в себе” (Grant, 1981; Kamelin, 20091212). Такие сингамеоны (гибридные циклы) дают разнообразие форм, которое при определенной таксономической обработке может дать неисчислимое множество видов и подвидов (“В шутку говорят иногда, что флора Швеции состоит из 1100 видов сосудистых растений и 1500 видов Hieracium” – пишет В.Л. Комаров (Komarov, 1940: 128)).
Репродуктивные барьеры между видами принято разделять на презиготические и постзиготические. Презиготические барьеры – это разного рода затруднения для скрещивания видов, препятствующие образованию зиготы. Среди них, для растений с их особым образом жизни, в котором одна из существенных черт – иммобилизация, облигатное прикрепление к субстрату, на первое место среди репродуктивных барьеров надо поставить пространственное разобщение особей, препятствующее обмену генами между популяциями (географическую изоляцию). Далее следует назвать разобщенность экологическую: приуроченность потенциально скрещивающихся видов к разным экотопам, фенологические различия между видами (разное время цветения и т.п.), склонность к самооплодотворению одного или обоих родительских видов, и, наконец, прогамную несовместимость (проблемы с прорастанием пыльцы и пыльцевых трубок) и сингамную несовместимость родительских видов (неспособность спермия сливаться с ядром яйцеклетки или ядром центральной клетки) (Grant, 1981; Levin, 2012; Baack et al., 2015; Abbott, 2017; Pershina, Trubacheeva, 2017).
Исследование постзиготических механизмов репродуктивной изоляции требует специальных цитологических и генетических исследований и потому концентрируется вокруг небольшого числа модельных объектов (Avena, Triticum, Iris, Mimulus, Helianthus и немногие другие) (Baack et al, 2015; Abbott, 2017). Достаточно часто презиготические барьеры у растений значительно сильнее, чем постзиготические. Так, некогда географически абсолютно изолированные друг от друга виды платанов, североамериканский Platanus occidentalis L. и европейский P. orientalis L. – два вида, чей общий предок существовал около 50 млн. лет назад (Feng et al., 2005), при спонтанном или экспериментальном скрещивании дают вполне жизнеспособные гибриды, получившие название Platanus × acerifolia (Aiton) Willd. Такие растения впервые отмечены в Англии в середине XVII века, эти гибриды плодовиты и превосходят родительские виды по устойчивости к урбанизированным условиям существования в современной западной и центральной Европе (Santamour, 1972).
В тех случаях, когда репродуктивные барьеры между видами есть, репродуктивная изоляция, как правило, связана сразу с несколькими механизмами. Так, при гибридизации между двумя видами триллиумов Trillium camschatcense Ker Gawl. и T. tschonoskii Maxim., чьи ареалы частично перекрываются, чужеродная пыльца прорастает хуже, значительно чаще происходит самооплодотворение (Ishizaki et al., 2013). Если в качестве материнского растения выступал T. tschonoskii, гибридные растения никогда не достигают стадии цветения, демонстрируя еще одну особенность репродуктивных барьеров у растений: часто наблюдаемую их асимметрию – гибриды F1 могут быть бесплодны при одном направлении скрещивания, но способны давать жизнеспособное, частично фертильное потомство в реципрокном скрещивании (Ishizaki et al., 2013; Senerchia et al., 2016). Несмотря на эти барьеры гибриды между Trillium camschatcense и T. tschonoskii, в природе существуют, они известны под именем T. × hagae Miyabe et Tatew. (Punina et al., 20051313).
ВИДЫ И НОТОВИДЫ ГИБРИДНОГО ПРОИСХОЖДЕНИЯ: ФЕНОГИБРИДЫ, КРИПТОГИБРИДЫ, ПАЛЕОГИБРИДЫ
В.Л. Комаров выделял три типа межвидовых гибридов растений: гибридные циклы (о которых речь пойдет ниже), криптогибриды, понимаемые как морфотипы, обычно считаемые видами, гибридную природу которых выдает в той или иной степени недоразвитая пыльца, и феногибриды – гибриды, гибридная природа которых следует из их внешнего облика, в котором сочетаются признаки их вероятных предков. Иногда феногибриды рассматривают как нотовиды, в других случаях им не придают таксономического статуса. К этим типам можно добавить еще один тип гибридов – палеогибриды, то есть такие виды, у которых нормальная фертильность потомства, но их гибридная природа может быть установлена путем исследования генома или кариотипа.
В.Л. Комаров полагал, что гибридогенные виды (криптогибриды и феногибриды) встречаются в природе редко и только в некоторых родах и семействах. Напротив, современные исследователи склоняются к тому, что межвидовая гибридизация по крайней мере в некоторых семействах растений относительно широко распространена и является одним из основных механизмов процессов видообразования и освоения новых экологических ниш (Folk et al., 2018; Mitchell, Whitney, 2019). Whitney et al. (2010) обобщили мнения флористов о частоте встречаемости межвидовых гибридов и видов гибридного происхождения во флоре Европы, Северной Америки и части Австралии. Среди 37 тысяч видов сосудистых растений, относящихся к 3212 родам из 282 семейств, виды гибридного происхождения и межвидовые гибриды встречались с частотой 8%. Гибриды были отмечены в 40% семейств и 16% родов.
Примем во внимание, что приведенные оценки дают нам представление о том, как часто в природе встречаются виды, особенности морфологии которых заставляют предполагать их гибридное происхождение вследствие смешения признаков двух или более предполагаемых родительских видов. Но, как указывал Комаров, в природе существуют и криптогибриды – растения, гибридная природа которых при визуальном анализе не очевидна. Так, например, британские ботаники нашли растение, которое по габитусу и по произрастанию вблизи растений видов Gymnadenia borealis (Druce) R.M. Bateman, Pridgeon et M.W. Chase и Dactylorhiza praetermissa (Druce) Soo сочли новым нотовидом × Dactylodenia lacerta R.M. Bateman et Tattersall. Несмотря на то, что морфометрический анализ по 40 признакам, казалось бы, заставлял рассматривать эти растения лишь как уклоняющуюся форму Dactylorhiza praetermissa, сравнение последовательностей ядерных и хлоропластных ДНК-маркеров не только подтвердило гибридное происхождение растения, но и показало, что это результат скрещивания, в котором яйцеклетка происходила от D. praetermissa, а пыльца – от G. borealis, что, между прочим, противоречило ожиданиям – принято считать, что насекомые-опылители (в данном случае, шмели) предпочтительно переносят пыльцу от растений с коротким шпорцем (D. praetermissa) на растения с длинным шпорцем (G. borealis) (Bateman et al., 2017). Молекулярный анализ выявил криптические (морфологически не отличимые от одного из родителей) межвидовые гибриды у Pyrola (Beatty et al., 2010), Linaria (Boswell et al., 2016), Protea (Mitchell, Holsinger, 2018) и в ряде других случаев. Для нас существенно, что сам феномен наличия криптогибридов свидетельствует, что гибридов может быть еще больше, чем по приведенным выше оценкам флористов.
То, что в мировой флоре, без учета садовых и сельскохозяйственных растений, не менее 9 гибридов приходится на 100 видов негибридного происхождения – цифра, несомненно, большая и требующая объяснения. Она говорит о том, что межвидовая гибридизация у растений связана с таксоногенезом, и вывод этот находит убедительное подтверждение в результатах секвенирования геномов растений, представляющих разные филетические ветви. Прежде всего, обращает на себя внимание, что в геномах растений много генов (как правило, больше, чем в геномах животных). Так, если в гаплоидном геноме человека около 20 тыс. протеин-кодирующих генов, то у яблони Malus × domestica таких генов 57 380 (а если учитывать и гены, принесенные в геном яблони в составе транспозонов (рис. 1), то более 95 тыс. генов) (Velasco et al., 2010). В геноме пшеницы Triticum aestivum найдено более 124 тыс. генов (IWGSC 2014). При этом характерной особенностью геномов растений оказалось то, что значительная часть генов в их гаплоидных геномах представлена несколькими копиями. Расчеты показывают, что, в среднем, в полностью секвенированных геномах растений 64.5% генов имеют паралоги (несколько копий одного гена в пределах одного генома). У яблони доля таких генов доходит до 84.4% (Panchy et al., 2016). Наличие большого числа паралогов в геномах растений – путь к приобретению ими новых функций (Panchy et al., 2016; Soltis, Soltis, 2016; Qiu et al., 2019).
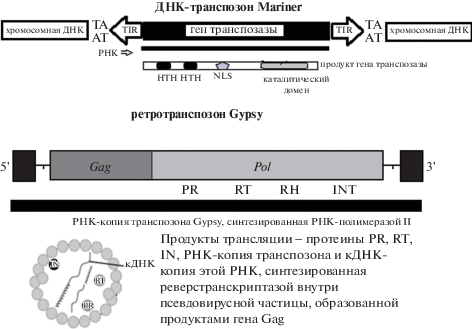
Рис. 1.
Два типа транспозонов, многократно повторенных в геномах растений.
В верхней части рисунка ДНК-транспозон типа Mariner и схема строения транспозазы – протеина, необходимого для его перемещения по геному. На флангах транспозона расположены две инвертированные последовательности TIR, в центре – ген транспозазы. Транспозаза имеет три функциональных домена. Домен NLS в молекуле транспозазы – это сигнал, разрешающий пропустить транспозазу в ядро. Попав в ядро, транспозаза, с помощью двойного домена HTH, узнает “свои” TIRы в геноме и “зачаливается” за них. Затем вступает в действие каталитический домен транспозазы, который вырезает транспозон из хромосомной ДНК, и комплекс ДНК транспозон-транспозаза начинает искать динуклеотид 5'-TА-3' в геномной ДНК. На месте, где был транспозон, остается двунитевой разрыв в ДНК, который часто, но не всегда репарируется. Найдя новую пару нуклеотидов 5'-ТА-3', транспозаза посредством своего каталитического домена делает надрез в ДНК и транспозон встраивается в новое место в геноме, на флангах его оказываются динуклеотиды TA – это удвоившийся сайт встраивания транспозона. В нижней части рисунка – схема строения ретротранспозона Gypsy и кодируемые им протеины. На флангах транспозонов этого типа располагаются длинные терминальные повторы (LTR – на схеме – черные квадраты). Это сильные усилители транскрипции. В РНК-копии транспозона есть две единицы трансляции (2 гена). Один из них кодирует протеин Gag – продукт этого гена формирует так называемую “псевдовирусную частицу”, которая нужна для эффективного синтеза кДНК-копии транспозона и транспорта ДНК-копии, обратной транскриптазы (RT), РНКазы H (RH) и интегразы (INT) в ядро. Во втором гене закодирован мультидоменный протеин, имеющий в своем составе протеазу PR, которая и разрезает его на обратную транскриптазу, РНКазу H и интегразу. Все продукты связываются с РНК-копией ретротранспозона, на которой они и были закодированы, и попадают внутрь псевдовирусной частицы. Там RT делает кДНК-копию транспозона, РНКаза H “съедает” РНК-компонент в получившемся ДНК-РНК-гибриде. После того как весь этот комплекс попадет в ядро, интеграза (INT) сделает надрез в каком-либо участке генома, однонитевая копия транспозона сформирует короткий участок двойной спирали с “хозяйской” ДНК, по ней построится вторая нить ДНК, и вся конструкция будет встроена в геном – появится новая копия ретротранспозона в геноме.
Fig. 1. Two types of transposons, repeated many times in plant genomes.
In the upper part of the picture, there is a DNA-transposon of Mariner type and the scheme of transposase, the protein necessary for its movement along the genome. There are two inverted TIR sequences on the transposon flanks, and the gene of transposase in the centre. The transposase has three functional domains. The NLS domain in the transposase molecule is the signal that allows the transposase to pass into the nucleus. Once in the nucleus, the transposase using the HTH double domain recognizes only the TIRs of their own type of transposons and binds to them. Then the catalytic domain of transposase comes, to cut out the transposon from chromosomal DNA, and the complex DNA-transposon-transposase begins to look for dinucleotide TA in genomic DNA. At the site where the transposon was, a two-strand DNA break remains, which is further often but not always repaired. Having found a nucleotides pair 5'-ТА-3', the transposase by means of its catalytic domain makes an incision in DNA and the transposon is built into a new place in the genome, on its flanks the TA dinucleotides appear – this is a doubled site of transposon inserting. In the lower part of the picture, there is the representation of the structure of Gypsy retrotransposon and the proteins encoded by it. On the flanks of transposons of this type there are long terminal repeats (LTR – black squares on the scheme). They are strong transcription amplifiers. There are two translational units (2 genes) in the RNA-copy of the transposon. One of them encodes the protein Gag, the product of this gene forming so-called “pseudovirus particle” which is needed for the effective synthesis of cDNA-copy of transposon and for the transfer of DNA-copy, reverse transcriptase (RT), RNAase H (RH) and integrase (INT) into the nucleus. The second gene contains an encoded multi-domain protein that contains the PR protease, which cuts it into reverse transcriptase, RNAase H and integrase. All the products bind to the RNA copy of the retrotransposon on which they were encoded, and enter the pseudovirus particle. There, RT makes a cDNA copy of the transposon, and RNase H (RH) “eats” the RNA component in the resulting DNA-RNA hybrid. After the whole complex gets into the nucleus, the integrase (INT) will make an incision in some part of the genome, a single-stranded copy of the transposon will form a short section of the double helix from the “master” DNA, it will build the second thread of DNA, and the whole structure will be built into the genome – a new copy of retrotransposon in the genome will appear.
Механизмов, благодаря которым в геномах растений оказалось большое число дуплицированных, триплицированных, мультиплицированных генов, несколько: это полногеномные дупликации (WGD) (полиплоидизации), локальные дупликации, возникающие в результате неравного кроссинговера, и дупликации, индуцируемые транспозициями транспозонов (IWGSC 2014; Panchy et al., 2016; Lye, Purugganan, 2019). Среди этих механизмов для нас наибольший интерес представляют акты WGD. Сравнение геномов показывает, что в генеалогии всех современных цветковых растений имели место один или, чаще, несколько актов полногеномных дупликаций (Soltis, Soltis, 2016; Van de Peer et al., 2017). Расчеты показывают, что в мире растений около 75% выявленных актов WGD произошли во второй половине мелового периода и на границе мезозоя и кайнозоя (Vanneste et al., 2014; Van de Peer et al., 2017), то есть в период, предшествующий и частично совпадающий с периодом активного таксонообразования у голо- и покрытосеменных (Soltis, Soltis, 2016; Soltis et al., 2018). Анализ филогенетических деревьев показывает, что акты WGD могли предшествовать таким важнейшим этапам в эволюции растений, как возникновение покрытосеменных, двудольных, однодольных, появление сем. Asteraceae, взрывное видообразование в порядке Brassicales (Tank et al., 2015; Soltis, Soltis, 2016; Soltis et al., 2018).
На два важных обстоятельства обратили внимание Schranz и соавторы (Schranz et al., 2012):
1) После акта WGD сальтационное видообразование начинается не сразу, а через несколько миллионов лет (lag-time hypothesis);
2) Филогенетические линии, в которых после WGD идет сальтационное видообразование, имеют сестринские ветви, в которых число видов невелико. Последние часто занимают ограниченный ареал и могут обладать многими ключевыми морфологическими признаками, характерными для видов сестринской эволюционно-лабильной, богатой видами клады.
Теоретически акты удвоения генома (WGD), выявляемые при полногеномном анализе, могут быть связаны как с автополиплоидией, так и с аллополиплоидией. Есть основания думать, что вероятность того, что ароморфозы будут следствием появления аллополиплоидов, а не автополиплоидов, выше. Прежде всего, автополиплоиды, известные нам среди современных растений, как правило, не отличаются от своих диплоидных предков сколько-нибудь существенными признаками, кроме часто наблюдаемых различий в скорости роста, в размерах ядер, клеток и всего растения в целом (Doyle, Coate, 2019). Систематики-практики, как правило, не видят оснований выделять такие автополиплоидные цитотипы в особый вид или подвид (Barker et al., 2016; Shneyer et al., 2018). Напротив, аллополиплоидия часто ведет к идиоадаптациям и, вероятно, к ароморфозам, к появлению морфотипов, отличных от родительских видов в степени, которая воспринимается как достаточная для описания нового вида (Yakimowski, Rieseberg, 2014; Barker et al., 2016; Shneyer et al., 2018).
Эти наблюдения находят соответствие в характеристиках транскриптомов авто- и аллополиплоидов. Показано, что удвоение генома у автополиплоидов сопровождается лишь незначительными изменениями в транскриптоме в сравнении с транскриптомом диплоида. Так, например, только 4.3% генов генома автотетраплоидных особей Isatis indigotica Fortune (Brassicaceae) изменяли свою экспрессию в сравнении с транскриптомом диплоидных растений (Liu, Sun, 2019). Дупликация генома у Citrus limonia Osbeck (Rutaceae) привела к изменению экспрессии только 1% генов (Allario et al., 2011). Не отмечено заметных изменений в экспрессии генов у синтетических автополиплоидов Brassica oleracea L. (Yoo et al., 2014). Напротив, синтетические аллополиплоиды, как правило, характеризуются значительными изменениями транскриптома (Yoo et al., 2014) – так, у аллополиплоидного рапса Brassica napus L. отмечено изменение экспрессии 38% генов (Higgins et al., 2012). Изменение экспрессии 16% генов наблюдалось у аллополиплоидной пшеницы, 30–70% генов – у аллотетраплоидного хлопка, 30–60% генов – у аллогексаплоидных крестовников (Senecio), 5–38% генов – у аллотетраплоидных Arabidopsis (обзор: Liu, Sun, 2019). Конечно, даже незначительное изменение транскрипции генов, характерное для автополиплоидов, может затрагивать важные с точки зрения физиологии гены, такие как Cdc2k, H1F, Px63, Lhca2, гены, кодирующие Cdc2-подобную протеинкиназу, гистон H1F, хлорофилл-связывающие протеины, что ведет к увеличению разнообразия потомства по устойчивости к стрессовым факторам, таким, например, как дефицит воды (Ng et al., 2012). Спектр возможных последствий неаддитивных изменений транскриптомов и протеомов, характерных для аллополиплоидов, надо полагать, будет всегда шире, чем у автополиплоидов.
Сам феномен полиплоидизации генома часто напрямую связан с межвидовой гибридизацией. Так, сообщается, что 90% потомства от скрещивания гибридов первого поколения Digitalis ambigua Murray × D. purpurea L. было тетраплоидным (Buxton, Newton, 1928). Половина потомства гибридов Allium cepa L. × A. fistulosum L. было тетраплоидным (Levan, 1941). Полиплоиды постоянно возникают в потомстве гибридов A. cepa c A. ascalonicum L., A. globosum M. Bieb. ex Redoute, A. lineare L., A. senescens L., и A. victorialis L. (Keller et al., 1996). Высокая частота появления полиплоидов в потомстве межвидовых гибридов объясняется, в частности, характерными для гибридов нарушениями мейоза и высокой частотой формирования нередуцированных гамет. Расчеты показали, что для 11 видов покрытосеменных средняя частота образования нередуцированных гамет при разведении “в себе” была 0.6% против 27.5% у межвидовых гибридов (Mason, Pires, 2015).
“–ОМ-КРИЗИС” – ЭТАП МАКСИМАЛЬНО ВЫСОКОГО ГЕНОМНОГО, РЕПИТОМНОГО, ТРАНСКРИПТОМНОГО, ПРОТЕОМНОГО, МЕТАБОЛОМНОГО И ФЕНОТИПИЧЕСКОГО (ФЕНОМНОГО) РАЗНООБРАЗИЯ ГИБРИДИЗАЦИИ
Последствия отдаленной гибридизации надо разделять на быстрые (непосредственно следующие за актом гибридизации и полиплоидизации геномов) и долговременные (Wendel et al., 2018). К непосредственным последствиям межвидовой гибридизации мы бы отнесли количественные и качественные изменения транскриптома, протеома и метаболома гибридов в сравнении с тем, что имело место у родительских видов (Kirk et al., 2005; Shen et al., 2015, 2017). Надо сказать, что у растений до 80% генома представлено транспозонами (ДНК-повторами, мобильными элементами) (Feschotte et al., 2002). Вторым прямым следствием появления гибридного генома (полиплоидного или гомоплоидного) является многократно показанная экспансия рассеяных по геному транспозонов, выражающаяся в сальтационном увеличении их числа в геноме и, соответственно, в многочисленных актах инсерции их в кодирующие и некодирующие районы генома (Ungerer et al., 2006; Wendel et al., 2018). В последнее время эту характеристику генома принято называть репитомом (repeatome) (Jouffroy et al., 2016; Bolsheva et al., 2019). Третий феномен, характерный для гибридов первых поколений, – часто наблюдаемая потеря всех или части хромосом одного из родителей (Gernand et al., 2005; Polgari et al., 2019). Этот процесс может иметь место в первом же поколении или быть растянут на несколько (много) поколений. И, наконец, важным неканоническим механизмом в продуцировании геномного разнообразия в потомстве аллополиплоидов, который нужно отметить, является компенсированная анеуплоидия – явление, называемое также замещением гомеологов (homoeologous exchange), – ситуация, когда, вместо ожидаемых в потомстве аллотетраплоида двух пар гомеологичных хромосом АACC, у разных потомков может быть хромосомная конституция, состоящая из трех хромосом одного субгенома и одной копии другого (ACCC) или все 4 хромосомы этого квартета гомеологов у тетраплоида вдруг окажутся происходящими из одного субгенома (CCCC) и целый спектр иных вариантов (Lipman et al., 2013; Li et al., 2019; Rodionov et al., 2019).
Разнонаправленные изменения фенотипа, сопровождающие изменения генома, репитома, транскриптома, протеома и метаболома в духе времени (Zelenin et al., 2016) нужно назвать вариациями фенома (Butte, Kohane, 2006) – объектом нового направления исследований – феномики (Medvedev et al., 20191414).
Механизмы явлений, сопровождающих акты отдаленной гибридизации, интенсивно исследуются. Так, есть все основания думать, что потери хромосом одного из родителей гибрида часто связаны с быстрой эволюцией центромерной ДНК и быстрой параллельной эволюцией тех доменов центромерных белков, которые с центромерной ДНК взаимодействуют (Henikoff et al., 2017). Кажется очень вероятным, что один из механизмов быстрой и согласованно идущей в разных хромосомах одного генома эволюции центромерной ДНК связан с активностью особого семейства транспозонов – центромерных транспозонов (Morata et al., 2018; Klein, O’Neil, 2018).
Неаддитивные изменения в транскриптоме гибридов в сравнении с родителями связаны со сложными, многокомпонентными механизмами регуляции транскрипции в геномах растений, в которых задействованы процессы метилирования и деметилирования ДНК, метилирования, фосфорилирования, ацетилирования гистонов (Song, Chen, 2015). Иногда отмечают значительное изменение в метилировании субгеномов аллотетраплоидов в сравнении с тем, что наблюдалось в родительских геномах: например, у искусственно полученных аллотетраплоидов Arabidopsis 8.3% исследованных участков ДНК были метилированы не так, как это происходило в геномах родительских видов A. thaliana (L.) Heynh. и A. arenosa (L.) Lawalree (Madlung et al., 2002). В других случаях, в частности, у тетраплоидов, искусственно полученных из F1 гибридов от скрещивания Oryza sativa subsp. japonica Shig. Kato × O. sativa subsp. indica Shig. Kato, заметных различий в метилировании геномов тетраплоидов, в сравнении с родительскими геномами, за исключением районов скрытой анеуплоидии и мест локализации транспозонов, не наблюдалось (Li et al., 2019).
ТРАНСПОЗОНЫ И МИКРОРНК КАК ФАКТОРЫ ИЗМЕНЧИВОСТИ ГЕНОМА И ФЕНОТИПА ПОСЛЕ ОТДАЛЕННОЙ ГИБРИДИЗАЦИИ
Существенное влияние на фенотип аллополиплоида оказывают участки генома, не кодирующие протеины, но транскрибируемые с образованием молекул РНК длиной от нескольких десятков до нескольких тысяч нуклеотидов, которые посттранскрипционно модифицируются с образованием нескольких классов двунитевых малых РНК длиной 21–24 п.н. (пар нуклеотидов). По механизмам образования и функциям различают несколько классов микроРНК – miRNAs, hp‑siRNAs, natsiRNAs, вторичные siRNAs, hetsiRNAs. В клетках растений микроРНК могут блокировать работу генов, способствуя разрезанию транскриптов или подавляя трансляцию информационной РНК, или участвуя в локус-специфичном метилировании ДНК (Budak, Akpinar, 2015; Borges, Martienssen, 2015). Их последовательности, собственно, и определяют, что именно будет метилировано и тем самым выключено из пула транскрибируемой ДНК – это особый регуляторный механизм, называемый РНК-направленным ДНК-метилированием (RdDM) (Matzke et al., 2015; Cho, 2018).
МикроРНК, с их способностью локус-специфично блокировать процессы транскрипции и трансляции протеин-кодирующих генов, подавлять транскрипцию и транспозиции транспозонов, оказывают тем самым определяющее влияние на процессы развития и роста растений, на способность растений отвечать на стрессовые влияния окружающей среды и осуществлять защиту генома от экспансии транспозонов. Последняя задача более чем актуальна. Известно, что около 35% генома риса, 62% генома сорго и около 85% генома кукурузы представлено активными или дефектными транспозонами (Wei et al., 2016). Для того, чтобы транспозон мог перемещаться по геному и увеличивать свою численность, он должен транскрибироваться. Основной механизм борьбы с транспозициями в геномах растений, насколько известно, связан с блокадой их транскрипции (обычно осуществляемой РНК-полимеразой II) путем метилирования цитозина в ДНК. При этом у растений метилирование dC происходит не только в динуклеотидах CpG, как в геномах животных, но и последовательностях CpNpG и CpHpH (где H = A, T или C) (Matzke et al., 2015). Не вдаваясь в детали, укажем, что инактивация транспозонов в геноме растений идет следующим образом: особая РНК-полимераза IV продуцирует РНК-копию транспозона. Эта однонитевая РНК-копия транспозона служит матрицей для работы особой РНК-зависимой РНК‑полимеразы V, в результате чего образуется двунитевая РНК, которая, при участии белка ARGONAUTE4, разрезается с образованием 24‑нуклеотидных двунитевых молекул siRNA, которые находят в геноме комплементарные им последовательности транспозонов, давая сигнал для их метилирования и инактивации (Matzke et al., 2015; Zhang et al., 2018). Комплементарные транспозонам siRNA из соматических клеток материнского растения поступают затем в зародыш, подавляя там транскрипцию и перемещение транспозонов по геному (Jangam et al., 2017; Anderson, Springer, 2018; Wu, Zheng, 2019). В инактивации транспозонов кооперативно с гиперметилированием dC в ДНК может быть задействован гистон H1 (Choi et al., 2019), а также Polycomb-complex, участвующий в триметилировании лизина в 27 положении в гистоне H3 (Fedorova, Rodionov, 2008; Mozgova et al., 2015).
Особая роль в инактивации транспозонов у генома центральной клетки зародышевого мешка. В геноме центральной клетки идут процессы локус-специфичного деметилирования ДНК транспозонов. Предполагается, что при этом активируется транскрипция транспозонов материнского генома (Ibarra et al., 2012). Синтезированные РНК-копии транспозонов в ядре центральной клетки деградируют с образованием 21-нуклеотидных двунитевых siРНК, которые, попадая в яйцеклетку и затем в зародыш, также инактивируют транскрипцию и трансляцию транспозонов (Wu, Zheng, 2019).
Отцовское растение тоже принимает участие в инактивации транспозонов в геномах потомства. В этом случае, сначала в ядре вегетативной клетки пыльцевого зерна идет деметилирование ДНК, тем самым активируется транскрипция транспозонов отцовского генома, эти транскрипты деградируют с образованием двунитевых 21- и 22-нуклеотидных siRNA, которые каким-то образом перемещаются в клетки спермия и затем в зародыш и эндосперм. Там они инактивируют транспозоны, попавшие в геномы зародыша и эндосперма с хромосомами отца, тем самым обеспечивая нормальное развитие зародыша (Martí nez et al., 2016; Wu, Zheng, 2019).
Легко видеть, что инактивация транспозонов в половых клетках и зародышах строится на узнавании транспозонов, уже имеющихся в геномах отцовского и материнского растений – их называют доместицированными транспозонами. Именно на них нацелен механизм siРНК-интерференции. Потенциально активные транспозоны при этом метилируются и тем самым теряют способность к транскрипции и, следовательно, к транспозициям. Для потенциально активных транспозонов характерно еще одно явление, механизм которого неясен, но, по-видимому, как-то связан с микроРНК: в потенциально активных транспозонах появляются делеции, их ДНК, словно целенаправленно, изменяется, транспозоны становятся “дефектными” (Liu, Sun, 2019). Интересно, что старые транспозоны, неспособные к транскрипции и транспозициям, при этом не перестраиваются (Liu, Sun, 2019).
По-видимому, в результате этих процессов транспозоны растений необычайно быстро эволюционируют. В этом убеждает нас феномен геномной in situ-гибридизации (GISH), широко используемый для определения происхождения субгеномов аллополиплоидов (Raskina et al., 2002; Amosova et al., 2009 и др.). Предки современных аллополиплоидов в самых разных семействах растений, как оказалось, имели настолько разные наборы транспозонов в своих геномах, что в процессе GISH-гибридизации ДНК, выделенная из генома одного гипотетического предка, в присутствии “холодной” (немеченной) ДНК второго предка, комплементарно связывается только с ДНК тех хромосом аллополиплоида, которые от этого предка произошли. Подчеркнем, что условия гибридизации при этом такие, при которых гибридизируют прежде всего повторы (Raskina et al., 2002; Amosova et al., 2009; Zemtsova et al., 2014 и др.).
Если наборы транспозонов у предков анеуплоида существенно различались, мы вправе ожидать, что после межвидовой гибридизации некоторые из них могут выйти из-под контроля. Вероятность такого сценария должна повышаться, если у гибрида идут процессы потери части хромосом одного из родителей и замещения гомеологов (скрытой анеуплоидии). Очевидно, что при этом в той или иной степени изменяется баланс генов, нарушаются видоспецифичные системы регуляции работы генов, дают “сбой” обычно работающие механизмы “умиротворения” доместицированных транспозонов, часть из которых ускользает из-под контроля со стороны генома. За отсутствием или недостаточным количеством комплементарной им интерференционной siРНК, они могут начать транскрибироваться, размножаться, перемещаться по геному, встраиваясь в межгенные районы и в кодирующие части генов, что, помимо прочего, является одной из причин низкой фертильности гибридов, одним из механизмов постзиготической репродуктивной изоляции видов (Alix et al., 2017; Anderson, Springer, 2018; Serrato-Capuchina, Matute, 2018; Wu, Zheng, 2019).
Перемещаясь по геному, транспозоны вызывают мутации. Можно привести несколько ярких примеров, когда встраивание транспозона влияло на морфологию растений. Встраивание транспозона Hopscotch на расстоянии около 58 тыс.п.н. от гена teosinte branched1 (tb1) общего предка теосинте и кукурузы привело к тому, что стебель перестал ветвиться и появился род Zea с характерным для кукурузы мощным стеблем (Studer et al., 2011).
Инсерция MITE-транспозона в 3'-конец гена CrabApple Fruit Size (CAFS) генома яблони, продукт которого микро-РНК miRNA172p ингибирует трансляцию семейства генов APETALA2 (AP2), влечет за собой увеличение размера яблока. Транспозон внедрился в геном на Тянь-Шане, где-то на границе современных Казахстана и Китая. Увеличение размера плода сделало яблоню привлекательной сельскохозяйственной культурой, 4–6 тыс. лет назад начавшей распространяться по Евразии по Великому шелковому пути (Yao et al., 2015). Malus sieversii (Ledeb.) M. Roem. чудесным образом превратился в Malus domestica Borkh. (Richards et al., 2009).
Тысячи сортов винограда разделяются на две группы – виноград бывает красный и белый. Цвет ягоды определяется наличием или отсутствием антоцианина в кожице ягоды. Показано, что все исследованные белые, но не красные, сорта винограда имеют инсерцию LTR-ретротранспозона Gret1 (gypsy) перед ATG – старт-кодоном (положение – 181) гена VvMYBA1, что блокирует транскрипцию этого гена (This et al., 2007). Похожие события, но с обратным результатом, произошли в геномах Brassica. В геноме пурпурной цветной капусты Brassica oleracea var. botrytis инсерция ДНК-транспозона Harbinger (около 4 тыс.п.н.) в регуляторную часть гена BoMyb2 дает пурпурную окраску растению (Chiu et al., 2010). Удивительно, но секвенирование гена BoMYB2 у пурпурного кольраби B. oleracea var. gongylodes, у листовой капусты, называемой также кале или брунколь, (B. oleracea var. acephala) и у 2 из 3 исследованных сортов капусты огородной (B. oleracea var. capitata) выявило инсерцию в промоторный район этого гена другого транспозона – транспозона CACTA (7,6 т.п.н.), также нарушившего экспрессию гена – есть основания думать, что все это результат нескольких независимых инсерций транспозонов, подхваченных селекционерами (Yan et al., 2019).
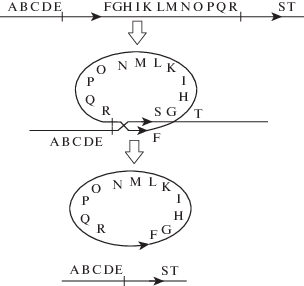
Влияние транспозонов на физиологию генетических процессов и фенотип не ограничивается влиянием на уровень экспрессии соседних генов и индукцию мутаций при встраивании в кодирующую часть гена. Показано, что, если два повторенных элемента (не обязательно транспозона) в геноме ориентированы одинаково, рекомбинация между ними ведет к появлению двух продуктов – хромосомы с делецией района между повторами и кольцевой внехромосомной ДНК, содержащей вырезанный из хромосомы участок генома (рис. 2). Этот кольцевой фрагмент, за счет следующего акта рекомбинации, может встроиться в геном в другом участке генома (результат – транслокация, иногда с формированием химерного гена) или утратиться при следующем делении клеток. Такой способностью вырезаться из генома и перемещаться по геному, прихватив и перенося на новое место в геноме несколько соседних генов, отличается транспозон Helitron, найденный в геномах растений, грибов и животных (Thomas, Pritham, 2015; Krasileva, 2019).
Рис. 2.
Рекомбинация между однонаправленно ориентированными повторами, лежащими в одной хромосоме, ведет к делециям хромосомной ДНК и появлению кольцевых внехромосомных ДНК, которые могут теряться при делении клеток или встраиваться в новые места в геноме. Повторы (стрелки) лежали между генами E и А и R и S.
Fig. 2. The recombination between unidirectional repeats lying in the same chromosome leads to deletions of chromosomal DNA and the appearance of ring nonchromosome DNA, which may be lost or inserted in new locations in the genome. The repeats (shown by arrows) lay between genes E and A, and R and S.
Транскрипция ретротранспозона может не остановиться на его границе, а распространиться на соседние районы, после чего, через обычные для ретротранспозона механизмы, транспозон и скопированный соседний район генома могут встроиться в любой другой район генома (Krasileva, 2019). Так, ретротранспозон Rider, встроившийся в sun-локус хромосомы 7 Solanum lycopersicum L. (локус sun контролирует транспорт ауксина), принес с собой несколько генов хромосомы 10 – в результате появилась линия томатов с удлиненными плодами (Jiang et al., 2009). Возникшие при участии ретротранспозонов дополнительные копии генов интересны тем, что это не просто дубликаты гена, пусть и расположенные в новом для себя месте в геноме, но часто это копии с измененными или дополнительными экзонами, являющимися побочным продуктом ретротранспозиций. Так расчеты показывают, что в геноме риса 32 тыс. протеин-кодирующих генов (Itoh et al., 2007), при этом 1235 генов возникли в результате ретротранспозиций, причем значительная часть из них (42%) являются “химерными” генами – в их составе есть дополнительные экзоны, рекрутированные из соседних районов генома или из генов транспозонов (Wang et al., 2006). Из 106 “ретрогенов” в геноме тополя Populus trichocarpa Torr. et A.Gray ex Hook. 17% были изменены в сравнении с оригинальными генами, копиями которых они являлись. Изменения касались появления “химерных” генов с новыми экзонами или, наоборот, интронизации некоторых из бывших экзонов (Zhu et al., 2009). Есть все основания думать, что это один из основных путей появления новых генов с новыми функциями (Panchy et al., 2016).
Одним из механизмов воздействия транспозонов на фенотип может быть индуцированное транспозоном изменение сплайсинга продуктов транскрипции. Так, в одном из интронов гена MANTLED генома масличной пальмы Elaeis guineensis Jacq. сидит транспозон Karma, обычно метилированный и неактивированный. Но в 5% случаев может происходить спонтанное деметилирование транспозона, при этом интрон не вырезается, попадает в транскрипт, но при трансляции этой РНК проявляет себя сайт терминации трансляции в составе транспозона Karma, синтез протеина прекращается. Как результат, на пальме появляются плоды измененной формы (“мантийные” плоды), семян нет (Ong-Abdullah et al., 2015).
УКРОЩЕНИЕ АКТИВНЫХ ТРАНСПОЗОНОВ, ГЕНОМНЫЙ СИМБИОЗ
Экспансия новых и/или не вполне управляемых гибридным геномом транспозонов постепенно затухает. Не без многочисленных жертв в ходе естественного или искусственного отбора, идет процесс молекулярной доместикации транспозонов, явления, называемого также “геномным симбиозом” (Miller et al., 1992; Pardue, DeBaryshe, 2008; Saint-Leandre et al., 2019) – шаг за шагом отбираются геномы, в которых транспозоны попали под контроль механизмов инактивации, причем некоторые из транспозонов или их дериваты берут на себя функцию защиты генома от экспансии себе подобных (Miller et al., 1992; Saint-Leandre et al., 2019). Например, показано, что около 3 млн лет назад один из ДНК транспозонов, называемый P-элементом, встроился в геном общего предка видов Drosophila guanche, D. madeirensis и D. subobscura, в какой-то момент утратил часть своих последовательностей, в том числе те, что необходимы для транспозиций, и, в частности, утратил 3-й экзон в гене теломеразы. Измененный ген уже неспособен продуцировать транспозазу (протеин, который способен распознать свой ДНК-транспозон в геноме, вырезать его и способствовать его встраиванию в геном), оставшиеся экзоны этого гена кодируют “P-repressor-like”-протеин, который действует как ингибитор транспозиции P-элементов, являя собой пример гена-защитника от экспансии транспозонов (Pinsker et al., 2001).
Основная и первоначальная функция продуцируемых на матрицах транспозонов siРНК – это инактивация транскрипции транспозонов. Однако, на мутуалистической основе, в геноме, по-видимому постепенно, возникают функциональные связи между siРНК транспозонов и генами, не имеющими прямого отношения к транспозонам, но, тем не менее, взаимодействующими с siРНК. В геноме Arabidopsis, в частности, найдено не менее 27 таких генов (McCue et al., 2013).
Некоторые специфические характеристики генома эукариот, которые можно рассматривать как таксономически значимые признаки на макротаксономическом уровне, возникли при непосредственном участии транспозонов. Так, одним из фундаментальных различий про- и эукариот является то, что у эукариот хромосомы, как правило, линейные, а у прокариот, включая предковую для ядерного генома эукариот группу архей Asgard, как правило, кольцевые (Koonin, 2010; Fournier, Poole, 2018; Rautian et al., 2019; Takemata et al., 2019). У эукариот, как у животных, так и у растений, кольцевые хромосомы возникают только как аберрация и очень нестабильны (McClintock, 1938; Pristyazhnyuk, Menzorov, 1917; Yu, 2018). Линейные хромосомы эукариот реплицируются с помощью особой реверстранскриптазы – теломеразы. Гены теломеразы получены эукариотами от транспозонов типа LINE и Penelope (Kordyukova et al., 2018). Примечательно, что когда в одной из филогенетических ветвей Diptera был утрачен этот типичный для эукариот механизм репликации и поддержания целостности концов линейных хромосом с помощью теломеразы, ветвь Drosophila вновь вступила в мутуалистические отношения с транспозонами – у нее удлинение концов хромосом и их стабилизация происходят путем регулярных транспозиций на концы хромосом транспозонов семейства Jockey (Pardue, DeBaryshe 2008; Saint-Leandre et al., 2019). Впрочем, Drosophila biarmipes вновь утратила транспозоны на концах своих хромосом (Saint-Leandre et al., 2019).
Другим таксономически значимым признаком макротаксона Eucaryota являются центромеры. Центромеры эукариот не имеют гомологичных структур в мире прокариот, по-видимому, они образовались из теломер (Slijepcevic, 2016). Ретротранспозоны по какой-то причине являются непременным элементом центромерных ДНК эукариот, в том числе растений, возможно способствуя быстрым перестройкам центромерной ДНК и воспроизведению в ряду клеточных поколений эпигенетических характеристик центромерного хроматина, необходимых для того, чтобы центромера в хромосоме работала (Gao et al., 2015; Klein, O’Neill, 2018).
ЭУПОЛИПЛОИДЫ, ВТОРИЧНЫЕ ДИПЛОИДЫ, НОВЫЕ АКТЫ МЕЖВИДОВОЙ ГИБРИДИЗАЦИИ
Поколение за поколением геном и кариотип аллополиплоида постепенно стабилизируются (рис. 3, рис. 4А) – прекращается потеря хромосом, снижается частота транспозиций, геном переходит в состояние эуполиплоида – аллополиплоидная природа его легко устанавливается при цитологическом исследовании (Myakoshina et al., 2004; Punina et al., 2005; Catalá n et al., 2012; Samatadze et al., 2014; Zelenin et al., 2016). Стабилизация эта относительна – в геноме поколение за поколением происходит потеря части генов-паралогов и приобретение некоторыми из дуплицированных генов новых функций. Идет растянутый во времени процесс постепенной функциональной и структурной диплоидизации генома и кариотипа (Clarkson et al., 2005; Mandá ková et al., 2017). Хромосомные перестройки постепенно трансформируют генетический состав хромосом (групп сцепления) – со временем в кариотипе нашего объекта по морфологии хромосом уже нельзя определить бывшего полиплоида, выявить гомеологи – это стадия палеополиплоида. Основное число хромосом в кариотипах палеополиплоидов иногда может быть необычно большим, например, x = 21 у некоторых Zingiberaceae (Ramachandran, 1969) или x = 13 у некоторых Deschampsia (Amosova et al., 2015), или, напротив, необычно маленьким, как в родах Zingeria и Colpodium, где, несмотря на то, что в генеалогии рода, как и у всех злаков, имели место не менее 3-х актов WGD (Van de Peer et al., 2017), основное число хромосом x = 2 (Kim et al., 2009; Rodionov et al., 20131515). Хромосомные перестройки в геномах гомоплоидных гибридов также постепенно диплоидизируют кариотип – со временем он внешне также становится неотличим от обычного диплоида. Закономерности этого процесса изучены плохо (Mandá ková et al., 2017). Ясно, что число хромосом в кариотипе уменьшается за счет тандемных и робертсоновских слияний хромосом (Schubert et al., 1995), кроме того, происходит встраивание целых хромосом в центромерные районы других хромосом кариотипа (The International Brachypodium Initiative, 2010; Lysak, 2014). При этом доля хромосомных сегментов, оставшаяся от одного из предковых видов, может постепенно уменьшаться – например у современного Aegilops markgrafii (Greuter) K. Hammer (2n = 14) от одного из предковых геномов осталось 8–15% последовательностей (Danilova et al., 2017).
Рис. 3.
Изменения генома и кариотипа неополиплоида.
Fig. 3. Genome and karyotype changes in neopolyploid.
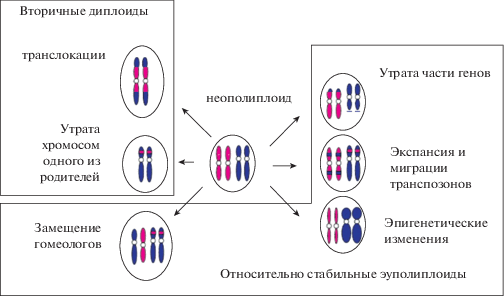
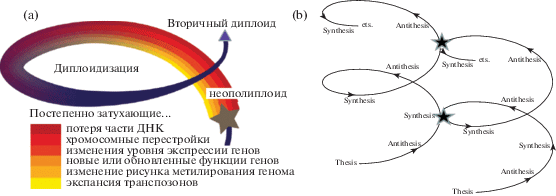
Рис. 4.
а – повторяющийся цикл “межвидовая гибридизация” – “вторичная диплоидизация” в эволюции растений (Soltis et al., 2016). b – диалектика вида: “thesis” – “antithesis” – “synthesis” в эволюции растений.
Fig. 4. a – iterative cycle “interspecies hybridization” – “secondary diploidization” in plant evolution (Soltis et al., 2016). b – species dialectics: “thesis” – “antithesis” – “synthesis” in plant evolution.
Геномы “старых” аллополиплоидов в той или иной мере диплоидизированы на генном уровне. Так, геном бананов Musa acuminata Colla (2n = 22) 75–100 млн лет назад прошел через три раунда WGD и состоит сейчас из 36542 протеин-кодирующих генов. Большинство (65.4%) генов представлены в этом геноме лишь одной копией, и только 10% сохранили все 4 копии предковых геномов (D’Hont et al., 2012). При этом, как правило, не теряются гены, продукты которых работают в составе мультипротеиновых комплексов и регуляторные гены, то есть, те гены, для которых важно поддержание определенной дозы гена относительно других генов.
Неясно, как связаны процессы диплоидизации генома и диплоидизации хромосом с адаптивной радиацией и таксонообразованием (Man-dá ková et al., 2017). На эти вопросы пока нет ответа, однако очевидно, что сам по себе цикл: межвидовая гибридизация – полиплоидизация – геномный шок – всплеск изменчивости генома и транскриптома, индуцированный транспозонами – “доместикация” вновь обретенных транспозонов, потеря части генов-паралогов, приобретение некоторыми из дуплицированных генов новых функций – стабилизация кариотипа – вторичная диплоидизация (рис. 3, 4а) в истории всех таксонов наземных растений происходил неоднократно (Soltis, Soltis, 2016; Rodionov, 2013; Soltis et al., 2016; Rodionov et al., 2019). Важно, что на каждой стадии этого цикла геном может вновь вступать в акты межвидовой гибридизации.
Все это вполне согласуется с так называемой “гегелевской триадой”, о которой размышлял В.Л. Комаров: объединение в одном геноме в результате более или менее отдаленной гибридизации двух различных геномов закономерно ведет к “геномному шоку”, характеризующемуся целым спектром явлений, сопровождающихся в разных геномах (в разных генеалогических линиях) разнонаправленными генетическими, эпигенетическими, фенотипическими изменениями исходного генотипа/морфотипа; все эти варианты в условиях жесткого естественного или искусcтвенного отбора проходят тест на адекватность в конкретных условиях внешней среды (рис. 4). Немногие состоятельные варианты достигают нового состояния квазистабильного генома. И на каждом этапе этой череды событий возможно вовлечение организма в новый акт скрещиваний, после чего процессы межгеномных взаимодействий включатся вновь… тезис – антитезис – синтез – антитезис – синтез – антитезис – ….
Список литературы отсутствует.
Дополнительные материалы отсутствуют.
Инструменты
Ботанический журнал


