Ботанический журнал, 2020, T. 105, № 9, стр. 919-930
ФОРМИРОВАНИЕ СЕМЯЗАЧАТКА И СЕМЕНИ JASMINUM FRUTICANS (OLEACEAE)
Т. Н. Кузьмина *
Никитский ботанический сад – Национальный научный центр РАН
298648 Ялта, ул. Никитский спуск, 52, пгт. Никита, Республика Крым, Россия
* E-mail: tnkuzmina@rambler.ru
Поступила в редакцию 17.03.2020
После доработки 18.05.2020
Принята к публикации 19.05.2020
Аннотация
В статье приводятся данные исследования генезиса семязачатка и семени у дистильного вида флоры Крыма Jasminum fruticans L. (Oleaceae). Показано, что длинно- и короткостолбчатые цветки не имеют различий в последовательности и ходе дифференциации основных структур семязачатка и генезисе семени. Археспорий образован 1–4 клетками. Семязачаток у J. fruticans геми-анатропный, тенуинуцеллятный, унитегмальный. В результате мегаспорогенеза формируется линейная тетрада мегаспор. Зародышевый мешок развивается по Polygonum-типу из халазальной мегаспоры. В зрелом состоянии зародышевый мешок образован семью клетками. Полярные ядра сливаются до оплодотворения. Развитие зародыша идет по Solanad-типу. В ходе развития зародыша выделяют зиготический (1–3 сутки после опыления), проэмбриональный (4–21 сутки) периоды. Начиная с 4 недели после опыления, зародыш переходит в эмбриональный период. В зрелом семени зародыш дифференцирован на две семядоли, апекс побега, гипокотиль и зародышевый корешок. Показана трансформация интегумента семязачатка при формировании семенной кожуры. В зрелом семени она образована саркотестой и склеротестой.
Особенностью видов рода Jasminum L. (Oleaceae Hoffmanns. et Link) являет дистилия, которая рассматривается как частный случай гетеростилии. При дистилии у растений в пределах вида существуют особи с цветками двух морфологических форм: длинностолбчатые и короткостолбчатые, которые различаются по длине столбиков пестиков и тычиночных нитей (Zhinkina, 2000; Demyanova, 2010). Кроме того, у цветков различных морфологических форм выявлены различия в размерах цветков, пыльцевых зерен, строении рыльца пестика (Pailler, Thompson, 1997; Guitián et al., 1998; Thompson, Dommé e, 2000; Faivre, MсDade, 2001; Naiki, Nagamusu, 2003; Olesen et al., 2005; Wu et al., 2010; Cohen, Litt, Davis, 2015; Kuzmina, 2017b). Известно, что у некоторых гетеростильных видов, в зависимости от морфологической формы растения, происходит редукция генеративных структур (Imhanitskaya, 1981). В частности, у цветков длинностолбчатой формы рода Mussaenda L. (сем. Rubiaceae) дегенерируют пыльники, в результате чего пыльцевые зерна не формируются, а у цветков короткостолбчатой формы отмечается дегенерация семязачатков, что фактически делает длинностолбчатые цветки пестичными, а короткостолбчатые – тычиночными (Li et al., 2010). Характерно, что аналогичные процессы редукции тканей генеративных структур выявлены у растений различных таксонов при формировании однополых цветков (Kordyum, Glushchenko, 1976). Однако, данные о генезисе генеративных элементов у гетеростильных видов, в большинстве случаев, даются без учета морфологической формы цветка, что не позволяет выявить частоту распространения среди них случаев редукции генеративных органов. Общие сведения о строении семязачатка и семени представителей рода Jasminum L. представлены в ряде работ (Maheswari, 1975; Johri et al., 1992; Litvinenko, 1987; Kamelina, 2009). Ранее было рассмотрено формирование мужской генеративной сферы и дана оценка состояния мужского гаметофита длинно- и короткостолбчатых цветков Jasminum fruticans L. – дистильного вида флоры Южного берега Крыма (Kuzmina, 2018). Целью данной работы была характеристика генезиса семязачатков и семян J. fruticans с учетом морфологической формы цветка.
МАТЕРИАЛ И МЕТОДЫ
Jasminum fruticans L., или жасмин кустарниковый, – дистильный вид средиземноморской флоры из сем. Oleaceae, ареал которого распространяется и на горные районы Крыма и Кавказ (Golubev, 1996). Для анализа в 2016–2019 годах брали бутоны, цветки на разных стадиях развития у растений длинно- и короткостолбчатой морфологических форм, произрастающих на территории Никитского ботанического сада (г. Ялта, Республика Крым). Завязи фиксировали ежедневно в течение первой недели после искусственного опыления. В последующем фиксацию материала проводили каждую неделю, вплоть до полного созревания плода. В качестве фиксатора использовали раствор F.A.A. (formalin : acetic acid : alcohol 70% – 7:7:100). Обезвоживание материала осуществлялось изопропиловым спиртом (Кuzmina, 2017а). Инфильтрация объектов парафином проходила в течение недели. Парафиновые срезы делали на ротационном полуавтоматическом микротоме RMD-3000 (Россия). Толщина срезов при изготовлении препаратов варьировала в зависимости от размеров объектов в диапазоне 7–45 мкм. Постоянные цитоэмбриологические препараты окрашивали гематоксилином и алциановым синим (Zhinkina, Voronova, 2000). Анализ цитоэмбриологических препаратов проводили с помощью микроскопов Jenaval и AxioScope A.1 (“Carl Zeiss”, Германия). Микрофотографии получены системой анализа изображений AxioCamERc5s (“Carl Zeiss”, Германия). Типизация структур семязачатка приводится согласно современным классификациям, предложенным И.И. Шамровым (Shamrov, 1999, 2017).
РЕЗУЛЬТАТЫ
У J. fruticans гинецей димерный синкарпный, образован двумя карпеллами. В единичных случаях у растений обеих морфологических форм встречается гинецей из трех плодолистиков. В каждой карпелли расположено, как правило, по два семязачатка. Также в анализируемом материале наблюдались случаи, когда в одной из карпелл развивались один или три семязачатка. Вариабельность по количеству семязачатков в большей степени была отмечена в завязях короткостолбчатых цветков, у которых в 16% случаев в одной из карпеллей формировался лишь один семязачаток. У длинностолбчатых цветков подобные изменения не отмечались. Семязачатки у J. fruticans имеют угловую или маргинальную плацентацию.
Независимо от морфологической формы растения закладка примордиев семязачатков происходит летом в год, предшествующий цветению. Дифференциация структур семязачатка, как правило, начинается в конце февраля – в I декаде марта. В этот период в примордии хорошо различимы эпидерма, субэпидермальные клетки и осевой ряд клеток. В субэпидермальном слое дифференцируется от одной до четырех археспориальных клеток и инициальные клетки латеральной части нуцеллуса (табл. I). Клетки субэпидермального слоя, расположенные латерально от археспория, являются инициальными клетками латеральной части нуцеллуса. В период дифференциации мегаспороцита и мегаспорогенеза в нуцеллусе можно выделить апикальную область, образованную эпидермальными клеками, латеральную область и 2–3 клетки базальной области. Однако в ходе дифференциации зародышевого мешка клетки нуцеллуса облитерируют (табл. II).
Таблица I. Семязачатки длинно- (A) и короткостолбчатой (B) флоральных форм Jasminum fruticans на ранних стадиях развития.
1 – примордий семязачатка с археспориальными клетками; 2 – семязачаток на стадии мегаспороцита; 3 – семязачаток в период дифференциации интегумента. a c –археспориальная клетка, h – гипостаза, i – интегумент, ms – мегаспороцит, n – нуцеллус.
Plate I . Ovules of long-styled (A) and short-styled (B) floral forms of Jasminum fruticans in the early stages of development.
1 – ovule primordium with archesporial cells; 2 – ovule at the stage of megasporocyte; 3 – ovule during the integument differentiation. a c – archesporial cell, h – hypostasis, i – integument, ms – megasporocyte, n – nucellus.
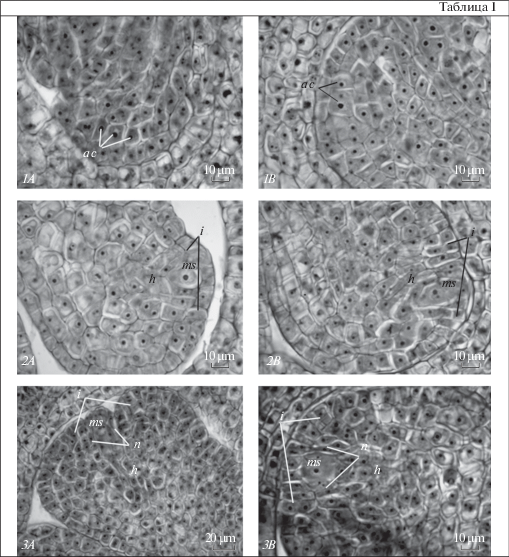
Таблица II. Семязачатки длинно- (А) и короткостолбчатой (B) флоральных форм Jasminum fruticans.
1, 2 – в период мегаспорогенеза, 3 – дифференциации зародышевого мешка, 4, 5 – зрелый зародышевый мешок. at – антиподы, ch – халаза, e a – яйцевой аппарат, e s – зародышевый мешок, f – фуникулус, i – интегумент, i t – интегументальный тапетум, mgs – мегаспора, n – нуцеллус, p n – полярное ядро, r – рафе, v b – проводящий пучок.
Plate II . Ovules of long-styled (A) and short-styled (B) floral forms of Jasminum fruticans.
1, 2 – during megasporogenesis, 3 – differentiation of the embryo sac, 4, 5 – mature embryo sac. at – antipodal cells, ch – chalaza, e a – egg apparatus, e s – embryo sac, f – funiculus, i – integument, i t – integumentary tapetum, mgs – megaspore, n – nucellus, p n – polar nucleus, r – raphe, v b– vascular bundle.
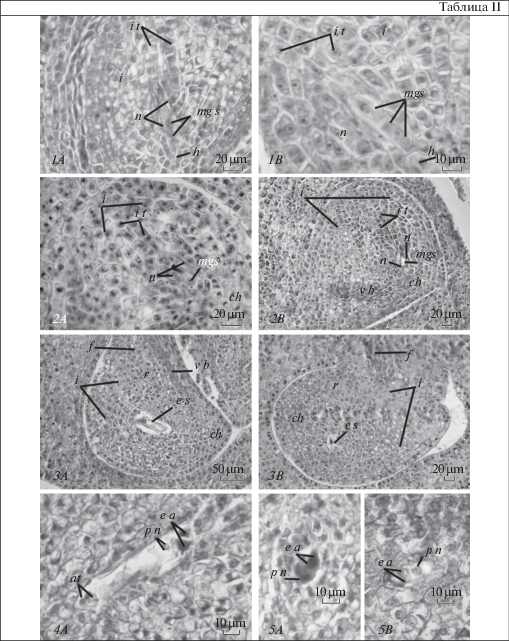
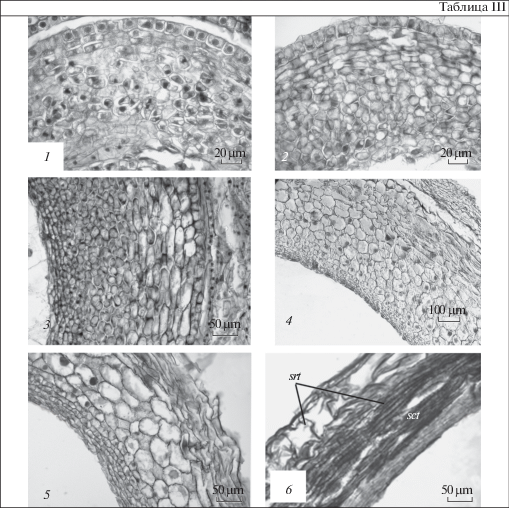
В семязачатке J. fruticans закладывается только один интегумент. Его развитие начинается в период дифференциации мегаспороцита с деления инициальных клеток интегумента, расположенных в эпидермальном слое примордия семязачатка. Первые деления идут в антиклинальном направлении, в результате чего образуется четыре клетки, после чего расположенные под ними субэпидермальные клетки делятся периклинально. В дальнейшем последовательно проходят периклинальные деления клеток эпидермального слоя и антиклинальные и периклинальные деления клеток субэпидермального слоя, за счет которых образуется многослойная ткань интегумента, окружающая зародышевый мешок. Клетки внутренней эпидермы изодиаметрической формы, выстилают прямое микропиле и образуют интегументальный тапетум, который непосредственно соприкасается с зародышевым мешком. В зрелом семязачатке, независимо от морфологической формы растения, интегумент образован 12–14 клеточными слоями. Паренхима интегумента продолжает разрастаться и после дифференциации зародышевого мешка и оплодотворения. Характерно, что у семязачатка на стадии дифференциации зародышевого мешка клетки трех субэпидермальных слоев интегумента приобретают уплощенную форму. В зрелом семязачатке таких уплощенных слоев – четыре–шесть. Морфологическое преобразование интегумента в семенную кожуру происходит, начиная с 14 суток после опыления. В этот период эпидермальные клетки приобретают изодиаметрическую форму, а в субэпидермальных клетках образуются вакуоли, при этом сами клетки растягиваются и уплощаются в тангетальном направлении, образуя саркотесту. В последующем в них накапливается клеточный сок, придающий зрелому семени темный оттенок. При этом клетки дистальных слоев интегумента остаются мелкими. В зрелом семени они формируют склеротесту (табл. III).
Таблица III. Фрагменты интегумента семязачатка Jasminum fruticans в процессе формирования семенной кожуры.
1 – 7 сутки после опыления; 2 – 14 сутки; 3 – 21 сутки после опыления; 4 – 42 сутки после опыления; 5 – 56 сутки после опыления; 6 – зрелое семя. srt – саркотеста; sсt – склеротеста.
Plate III . Fragments of the integument ovules of Jasminum fruticans in the process of forming the seed coat.
1 – 7 days after pollination; 2 – 14 days; 3 – 21 days after pollination; 4 – 42 days after pollination; 5 – 56 days after pollination; 6 – mature seed. srt – sacrotesta; sсt – sclerotesta.
Инициальная клетка гипостазы различима в осевом ряду клеток на стадии археспориальных клеток ниже археспориальных клеток. На стадии мегаспорогенеза гипостаза имеет вид колонки изодиаметрических клеток с утолщенными стенками. Позднее, при дифференциации и созревании зародышевого мешка, она представлена двумя колонками клеток с утолщенными стенками. В ходе образования семени происходит ее трансформация, и в зрелом семени гипостаза морфологически не выражена.
Халазальная область семязачатка небольшая, что позволяет ее характеризовать как мезохалазу. Эта область включает в себя клетки проводящего пучка, которые проходят через рафе в фуникулус. Фуникулус у J. fruticans короткий. В зрелом семязачатке эпидермальные клетки фуникулуса вытягиваются, образуя небольшой фуникулярный обтуратор.
В ходе развития семязачатка в результате образования и разрастания рафе, происходит смещение прямой морфологической оси, образованной микропиле и халазой. При этом она оказывается расположенной относительно плаценты под углом в 45°, что соответствует геми-анатропному подтипу гемитропного типа, согласно современной классификации (Shamrov, 2017).
У J. fruticans может закладываться до четырех археспориальных клеток, которые без дополнительного деления преобразуются в мегаспороциты. В ходе мегаспорогенеза формируются линейные тетрады мегаспор. Однако, несмотря на наличие нескольких мегаспороцитов, участвующих в мегаспорогенезе, у J. fruticans были выявлены семязачатки только с одним зародышевым мешком. Развитие зародышевого мешка у данного вида идет по Polygonum-типу из халазальной мегаспоры, в отличие от Olea europaea L. (Oleaceae), где зародышевый мешок биспорический Allium-типа (Shevchenko, 2009). В зрелом зародышевом мешке дифференцирован яйцевой аппарат, образованный яйцеклеткой и двумя синергидами, два полярных ядра и три небольшие антиподальные клетки. Полярные ядра расположены ближе к микропилярному полюсу центральной клетки. Они сливаются при оплодотворении. Зрелости семязачатки достигают в конце апреля – начале мая.
Эндосперм у J. fruticans клеточный (целлюлярный), как и у других представителей сем. Oleaceae (Litvinenko, 1987; Кamelina, 2009). До стадии глобулярного зародыша он представлен крупными клетками с относительно мелким ядром. Начиная с поздней глобулярной стадии, по периферии эндосперма формируются мелкие густоплазменные клетки, которые к моменту созревания семени, образуют несколько плотных рядов клеток, окружающих зародыш. В зрелых семенах эндосперм представлен тонким слоем мелких уплощенных клеток, окружающих зародыш.
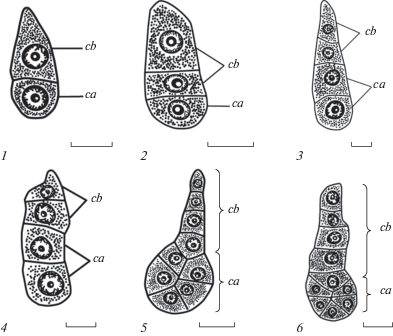
Сравнительная характеристика последовательности деления, основных стадий и динамики формирования зародыша у длинно- и короткостолбчатых растений J. fruticans не выявила различий между морфологическими формами. Развитие зародыша у J. fruticans проходит по Solanad-типу, при котором зигота делится поперечными делениями с образованием клеток ca и cb, последующие деления которых также проходят в поперечном направлении. Производные клетки са формируют основные части зародыша, а суспензор и гипофиз являются производными клетки сb. Начальные этапы генезиса проэмбрио J. fruticans представлены на рис. 1.
Рис. 1.
Начальные стадии генезиса зародыша длинно- (2, 3, 5) и короткостолбчатых (1, 4, 6) растений Jasminum fruticans.
1 – двуклеточный предзародыш; 2 – трехклеточный проэмбрио; 3, 4 – четырехклеточный предзародыш; 5, 6 – многоклеточный проэмбрио. са – апикальная клетка и ее производные, cb – базальная клетка и ее производные. Масштабная линейка: 10 μm.
Fig. 1. Initial stages of embryogenesis in long-styled (2, 3, 5) and short-styled (1, 4, 6) plants of Jasminum fruticans.
1 – two-celled proembryo; 2 – three-celled proembryo; 3, 4 – four-celled proembryo; 5, 6 – multicellular proembryo. ca – apical cell and its derivatives, cb – basal cell and its derivatives. Scale bar: 10 µm.
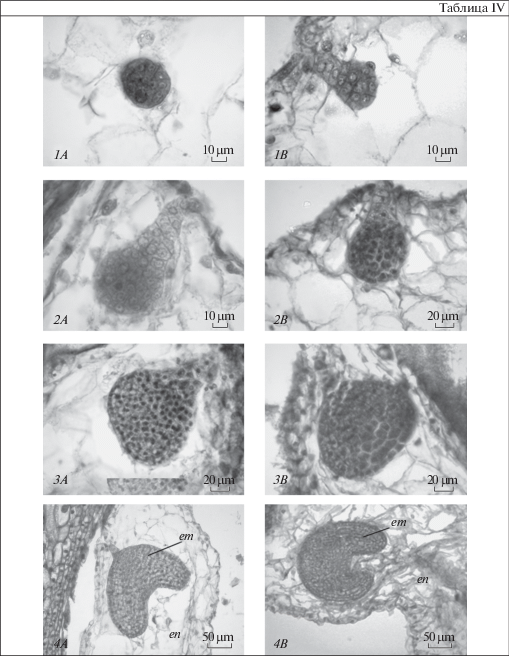
Зиготическая стадия развития зародыша J. fruticans занимает до 3 суток, после чего начинается его проэмбриональный период развития. Проэмбрио формируется на 21 сутки после опыления. Глобулярная стадия развития зародыша отмечается на 28–35 сутки после опыления (табл. IV). На 6 неделе после опыления (42–49 сутки) последовательно проходят стадии сердечковидного и торпедовидного зародыша. В этот период происходит облитерация суспензора.
Таблица IV. Стадии развития зародыша у длинно- (А) и короткостолбчатых (B) растений Jasminum fruticans.
1 – проэмбрио (21 сутки после опыления); 2 – глобулярный зародыш (28 сутки после опыления); 3 – поздняя глобулярная стадия зародыша (35 сутки после опыления); 4 – зародыш на сердцевидной стадии (42–49 сутки после опыления). em – зародыш, en – эндосперм.
Plate IV . The stages of development embryo long-styled (a) and short-styled (b) plants of Jasminum fruticans.
1 – proembryo (21 days after pollination); 2 – globular embryo (28 days after pollination); 3 – late globular stage of the embryo (35 days after pollination); 4 – embryo at the heart-shaped stage (42–49 days after pollination). em – embryo, en – endosperm.
На 56 сутки после опыления проходит дифференциация органов зародыша. К концу второго месяца развития зародыш полностью дифференцирован, после чего начинается его рост, который продолжается до 11 недели развития семени после опыления. В конце 2–начале 3 месяца после опыления зародыш морфологически сформирован.
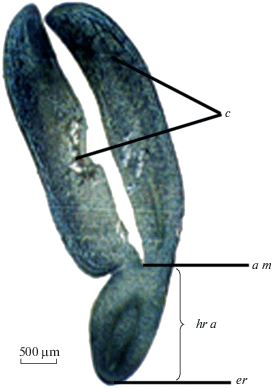
Зрелый зародыш J. fruticans прямой, дифференцирован на две крупные округлые семядоли, гипокотиль короткий, апекс побега и корешок с корневым чехликом. У зародыша дифференцирована прокамбиальная система (рис. 2). В этот период происходит дифференциация саркотесты и главным образом формирование в ней слоев механической ткани, непосредственно прилегающих к зародышу. В ряде случаев на ранних этапах эмбриогенеза отмечалась полиэмбриония, однако в зрелых семенах случаи полиэмбрионии нами не были выявлены.
Рис. 2.
Зрелый зародыш Jasminum fruticans.
c – семядоля; a m – апикальная меристема; hr a – ось гипокотиль – корень; e r – эмбриональный корень.
Fig 2. Mature embryo of Jasminum fruticans.
c – cotyledon, a m – apical meristem, hr a – hypocotyl-root axis; e r – embryonic root.
Таким образом, зрелые семена J. fruticans независимо от морфологической формы материнского растения содержат дифференцированный зародыш, окруженный тонким слоем эндосперма и защищенный семенной кожурой, имеющей слои механической ткани – склеротесты, и многослойную сочную оболочку – саркотесту.
ОБСУЖДЕНИЕ
По сведениям F.R. Ganders (Ganders, 1979), гетеростилия наблюдается в 36 семействах покрытосеменных растений. Следует отметить, что встречаются лишь единичные работы, дающие характеристику генеративных элементов гетеростильных видов с учетом морфологической формы растения (Zenkteler, 1966; Krupko, 1972; Gorokhovskaya, 1973; Salakhova, 1978; Vereshchagina, 1982; Li et al., 2010). Однако анализ литературных сведений о цитоэмбриологических признаках семейств, которые согласно данным F.R. Ganders (1979), являются наиболее многочисленными по количеству гетеростильных видов, показал, что в родах, относящихся к семействам Polygonaceae, Plumbaginaceae, Lythraceae, семязачатки обладают примитивными признаками: крассинуцелятный тип семязачатка, наличие двух интегументов (Solntseva, 1983; Korobova, 1983; Batygina, Kolesova, 1985). А у представителей семейств Oxalidaceae, Boraginaecae, Rubiaceae, Primulaceae, как и у J. fruticans, относящегося к семейству Oleaceae, отмечается тенуинуцелятный тип семязачатка (Vereshchagina, 1980; Mamet’eva, 1983; Andronovа, 1987; Litvinenko, 1987; Gachechiladze, 1993; Jedr-zejuk, Szlachetka, 2005). В частности, у представителей родов Oldenlandia L. и Bouvardia Salisb. (Rubiaceae), для которых характерна гетеростилия, эпидермис нуцеллуса образован одной или двумя клетками (Savchenko, 1973).
Многоклеточный археспорий встречается только у некоторых представителей сем. Rubiaceae (Kamelina, 2009), а также он описан для ряда видов рода Jasminum (Oleaceae) (Litvinenko, 1987). В других семействах археспорий семязачатка представлен, как правило, одной или двумя клетками. Для родов семейства Rubiaceae установлена вариабельность функциональной мегаспоры (Rubiaceae) (Andronova, 1987; Kamelina, 2009). Редукция генеративных элементов у видов, относящихся к родам с гетеростилией, не носит массового характера. Случаи аномалий развития и редукции зародышевого мешка описаны у представителей родов Oxalis (Oxalidaceae) (Zenkteler, 1966; Krupko, 1972), Plumbago (Plumbaginaceae) (Russel, 1980; Kamelina, 2009), Mussaenda (Rubiaceae) (Li et al., 2010).
Семена у таксонов, обладающих флоральным полиморфизмом, имеют, как правило, дифференцированный зародыш, а эндосперм у них клеточный. В зрелом семени эндосперм сохраняется, как правило, в виде нескольких слоев. Аналогичные процессы отмечены и у J. fruticans.
В целом, по основным цитоэмбриологическим признакам с учетом критериев продвинутости и примитивности (Poddubnaya-Arnol’di, 1976; Kamelina, 2009) семязачаткам J. fruticans свойственны как примитивные признаки, в частности – возможность образования многоклеточного археспория, так и признаки, типичные для более прогрессивных таксонов: тенуинуцеллятный тип семязачатка, отсутствие кроющих клеток в нуцеллусе, унитегмальность, наличие интегументального тапетума, слабое развитие гипостазы, клеточный эндосперм и относительно крупный и дифференцированный зародыш.
Однако однозначно нельзя утверждать, что перечисленные признаки являются неотъемлемыми характеристиками таксонов, обладающих флоральным полиморфизмом. Тем не менее, проведенное сопоставление подтверждает мнение, высказанное А.М. Агаджанян (Agadjanyan, 2000), о проявлении гетеростилии в эволюционно продвинутых таксонах покрытосеменных растений, по сравнению с таксонами, для которых типична двудомность.
ЗАКЛЮЧЕНИЕ
Морфологическая форма растения J. fruticans не влияет на характер и динамику формирования семязачатка и семени. Случаи редукции семязачатков и зародышевых мешков у J. fruticans не были отмечены. В зрелом состоянии семязачаток характеризуется как геми-анатропный, тенуинуцеллятный, унитегмальный с рафе. Археспорий образован одной или двумя клетками. Спорогенные клетки дифференцируются непосредственно из археспориальных. В семязачатке могут закладываться 1–4 археспориальные клетки, которые преобразуются в мегаспороциты. Как правило, развивается один зародышевый мешок, дифференциация которого идет по Polygonum-типу из халазальной мегаспоры. В зрелом состоянии женский гаметофит 7-клеточный. Начальные этапы деления зиготы соответствуют Solanad-типу. В зрелом семени зародыш дифференцирован на семядоли, короткий гипокотиль, апекс стебля и зародышевый корень. Эндосперм клеточный, начиная с глобулярной стадии развития зародыша, происходит трансформация клеток эндосперма. Семенная кожура, образованная склеротестой и саркотестой, трансформируется из интегумента.
Список литературы
[Agadjanyan] Агаджанян А.М. 2000. Распространенность и распределение гетеростилии в системе покрытосеменных растений. – Успехи современной биологии. 120 (4): 348–360.
[Andronova] Андронова Е.Н. 1987. Семейство Rubiaceae. – В кн.: Сравнительная эмбриология цветковых растений. Davidiaceae – Asteraceae. Л. С. 116–124.
[Batygina, Kolesova] Батыгина Т.Б., Колесова Г.Е. 1985. Семейство Lythraceae. – В кн.: Сравнительная эмбриология цветковых растений. Brunelliaceae – Tremandraceae. Л. С. 85–88.
Cohen J. I., Litt A., Davis J. I. 2015.Comparative floral development in Lithospermum (Boraginaceae) and implications for the evolution and development of heterostyly. – Am. J. Bot. 99 (5): 797– 805. https://doi.org/10.3732/Ajb.1100329
[Demyanova] Демьянова E.И. 2010. Антэкология: учебное пособие по спецкурсу. Пермь. 116 с.
Faivre A.E., McDade L.A. 2001. Population-level variation in the expression of heterostyly in three species of Rubiaceae: does reciprocal placement of anthers and stigmas characterize heterostyly? – Am. J. Bot. 88 (5): 841–853.
Ganders F.R. 1979. The biology of heterostyly. – N. Z. J. Bot. 17: 607–635.
[Gachechiladze] Гачечиладзе М.И. 1993. Эмбриология Primula bayernii (Primulaceae). – Бот. журн. 78 (5): 93–96.
[Golubev] Голубев В.Н. 1996. Биологическая флора Крыма. Ялта. 126 с.
[Gorokhovskaya] Гороховская Е.И. 1973. К эмбриологии Primula officinalis (L.) Hill и P. pallasii Lehm. – В сб.: Матер. Всесоюзного симпозиума “Половой процесс и эмбриогенез растений”. М. С. 55–56.
Guitián J., Guitián P., Medrano M. 1998. Floral biology of the distylous Mediteranean shrub Jasminum fruticans (Oleaceae). – Nord. J. Bot. 18: 195–201.
[Imkhanitskaya] Имханицкая Н.Н. 1981. Семейство мареновые (Rubiaceae). – В кн.: Жизнь растений. Т. 5. Ч. 2 .М. С. 353–358.
Jedrzejuk A., Szlachetka W. 2005. Development of flower organs in common liliac (Syringa vulgaris L.) cv. Mme Florent Stepman. – Acta Biologica Cracoviensla. Series Botanica. 42 (2): 41–52.
Johri B.M., Ambrgaokal K.B., Srivastava P.S. 1992. Comparative embryology of angiosperms. Vol. 2. Berlin. P. 650–653.
[Kamelina] Камелина О.П. 2009. Систематическая эмбриология цветковых растений. Двудольные. Барнаул. 501 с.
[Kordyum, Glushchenko] Кордюм Е.Л., Глущенко Г.И. 1976. Цитоэмбриологические аспекты проблемы пола у покрытосеменных растений. Киев. 200 с.
[Korobova] Коробова С.Н. 1983. Семейство Plumbaginacae. – В кн.: Сравнительная эмбриология цветковых растений. Phytolaccaceae – Thymelaeaceae. Л. С. 59–64.
Krupko S. 1972. Some embryological and cytological characteristics of two varieties of Oxalis cernua Thunb. var. sericea and var. compressa from South Africa. – Bull. Soc. Amis sci. et lett. Pozn. D. (12–13): 161–168.
[Kuzmina] Кузьмина Т.Н. 2017a. Генезис микроспорангия Jasminum officinale L. (Oleaceae). – Бюллетень Государственного Никитского ботанического сада. 124: 103–109.
[Kuzmina] Кузьмина Т.Н. 2017b. Диморфизм цветков Jasminum fruticans L. – Вестник Пермского университета. Серия Биология. 3: 233–239.
[Kuzmina] Кузьмина Т.Н. 2018. Формирование мужских генеративных структур Jasminum fruticans (Oleaceae). – Бот. журн. 103 (5): 654–663.
Li A-M., Wu X.-Q., Zhang D.-X., Barrett S.C.H. 2010. Cryptic dioecy in Mussaenda pubescens (Rubiaceae): a species with stigma-height dimorphism. – Ann. Bot. 106: 521–531.
[Litvinenko] Литвиненко Н.М. 1987. Семейство Oleaceae. – В кн.: Сравнительная эмбриология цветковых растений. Davidiaceae – Asteraceae. Л. С. 154–158.
Maheswari Devi H. 1975. Embryology of jasminums and its bearing on the oil composition of Oleaceae. – Acta Botanica India. 3 (1): 52–61.
[Mamet’eva] Маметьева Т.Б. 1983. Семейство Primulaceae. – В кн.: Сравнительная эмбриология цветковых растений. Phytolaccaceae – Thymelaeaceae. Л. С. 241–243.
Naiki A., Nagamusu H. 2003. Distyly and pollen dimorphism in Damnacanthus (Rubiaceae). – J. Plant Res. 116: 105–113.
Olesen J.M., Dupont Y.L., Ehler B.K., Hansen D.M. 2005. Heterostyly in the Canarian endemic Jasminum odoratissimum (Oleaecae). – Nord. J. Bot. 23 (5): 537–539. https://doi.org/10.1111/j.1756-1051.2003.tb00431.x
Pailler T., Thompson J.D. 1997. Distyly and variation in heteromorphic incompatibility in Gaertnera vaginata (Rubiaceae) endemic to la reunion island. – Am. J. Bot. 84 (3): 315–327.
[Poddubnaya-Arnol’di] Поддубная-Арнольди В.А. 1976. Цитоэмбриология покрытосеменных растений. Основы и перспективы. М. 508 с.
Russel S.D. 1980. Participation of male cytoplasm during gamete fusion in Angiosperm. Plumbago zeylanica. – Science. 210: 200–201.
[Savchenko] Савченко М.И. 1973. Морфология семяпочки покрытосеменных растений. Л. 190 с.
[Salakhova] Салахова Г.Б. 1978. Макроспорогенез, женский гаметофит и оплодотворение Rumex confertus Wild. в связи с особенностями его сексуализации. – В сб.: Тезисы докладов VII Всесоюзного симпозиума по эмбриологии растений. Ч. 1. Киев. С. 48–50.
[Shamrov] Шамров И.И. 1999. Семязачаток как основа семенного воспроизведения цветковых растений: классификация структур. – Бот. журн. 84 (10): 3–35.
[Shamrov] Шамров И.И. 2017. Морфологические типы семязачатков цветковых растений. – Бот. журн. 102 (2): 129–146.
[Shevchenko] Шевченко С.В. 2009. Репродуктивная биология декоративных и субтропических плодовых растений Крыма. Киев. 336 с.
[Solntseva] Солнцева М.П. 1983. Семейство Polygonaceae. – В кн.: Сравнительная эмбриология цветковых растений. Phytolaccaceae – Thymelaeaceae. Л. С. 53–58.
Thompson J.D., Dommée B. 2000. Morph-specific patterns of variation in stigma height in natural populations of distylous Jasminum fruticans. – New Phytol. 148: 303–314.
[Vereshchagina] Верещагина В.А. 1980. Эмбриологическая характеристика сем. Oxalidaceae R. Brown. – Биологический науки. 3: 52–58.
[Vereshchagina] Верещагина В.А. 1982. Эмбриология тристильного вида Lythrum salicaria L. – В кн.: Экология опыления растений. Пермь. С. 116–129.
Wu X.Q., Li A.M., Zhang D.X. 2010. Cryptic self-incompatibility and distyly in Hedyotis acutangula Champ. (Rubiaceae). – Plant Biol. 12: 484–494.
Zenkteler M. 1966. Comparative embryology of three heterostylic races of Oxalis cernua Thunb. – Bull. Soc. Amis. Sci. et let. Pozn. 6D: 99–145.
[Zhinkina] Жинкина Н.А. 2000. Гетеростилия. – В кн.: Эмбриология цветковых растений. Терминология и концепции. Т. 3. СПб. С. 82–83.
[Zhinkina, Voronova] Жинкина Н.А., Воронова О.Н. 2000. О методике окраски эмбриологических препаратов. – Бот. журн. 85 (6): 168–171.
Дополнительные материалы отсутствуют.
Инструменты
Ботанический журнал


