Ботанический журнал, 2021, T. 106, № 10, стр. 939-958
ПОЛОЖЕНИЕ ВОДОРОСЛЕЙ В СИСТЕМЕ ОРГАНИЧЕСКОГО МИРА
М. А. Гололобова 1, *, Г. А. Белякова 1
1 Биологический факультет МГУ имени М.В. Ломоносова
119234 Москва, Ленинские горы, д. 1, стр. 12, Россия
* E-mail: gololobovama@mail.ru
Поступила в редакцию 27.01.2021
После доработки 20.07.2021
Принята к публикации 27.07.2021
Аннотация
В работе рассмотрены проблемы, связанные с эволюцией хлоропластов водорослей. Обсуждается положение водорослей в системах органического мира. На сегодняшний день, среди многочисленных монофилетических супергрупп эукариот, к пяти из них относятся водоросли: Archaeplastida (Glaucocystophyta, Rhodophyta, Prasinodermophyta, Chlorophyta, Charophyta), TSAR (Ochrophyta, Dinophyta, Chlorarachniophyta, а также фотосинтезирующие представители родов Chromera, Vetrella и Paulinella), Haptista (Prymnesiophyta, Rappemonads), Cryptista (Cryptophyta) и Discoba (Euglenophyta). Приводятся краткие характеристики отделов водорослей и супергрупп, к которым они относятся.
Водоросли – группа преимущественно фотоавтотрофных организмов, большинство из которых обитает в водной среде, имеет одноклеточные гаметангии, и вегетативное тело которых представлено талломом (слоевищем). К водорослям относят как прокариотные (цианобактерии), так и эукариотные организмы, представляющие собой сборную полифилетическую группу. Таким образом, понятие “водоросли” является эколого-биологическим по своей сути, объединяя разные по происхождению организмы.
Представления об эволюции и родственных связях между разными группами организмов, включая водоросли, за последние почти 30 лет кардинально изменились. В значительной степени это связано с развитием молекулярной филогенетики и использованием и совершенствованием так называемых омиксных технологий (геномики, протеомики, транскриптомики). Стоит отметить, что с началом применения молекулярных методов неоднократно происходил, а для некоторых групп организмов все еще происходит, пересмотр их объема и положения в системе, что зачастую затрудняет придать определенный ранг той или иной группе. Одним из важнейших вопросов эволюции эукариот является эволюция хлоропластов. Большинство линий фотосинтезирующих эукариот имеют хлоропласты, которые были получены путем эндосимбиоза с эукариотическими водорослями, однако последовательность и направление эволюции этих отдельных эндосимбиотических событий остаются не выясненными до конца (Archibald et al., 2017).
Таким образом, цель данной работы – представить обзор, отражающий современные представления об эволюции хлоропластов у разных групп водорослей, а также суммирующий современные сведения о макротаксонах, к которым относятся водоросли, и привести исторический обзор существующих систем органического мира.
В связи с этим данный обзор включает три основные части. Первая посвящена эндосимбиотической теории происхождения хлоропластов и их эволюции, так как именно эволюция пластид, по современным представлениям, отражает эволюцию и родственные связи водорослей, являясь, таким образом, основой для их систематики. Положение водорослей в системе органического мира и объем макротаксонов (в частности, супергрупп) неоднократно менялись, и место ряда фотоавтотрофных эукариот на филогенетическом древе продолжает оставаться дискуссионным. Следовательно, вторая часть статьи посвящена рассмотрению разных систем органического мира в историческом аспекте и обсуждению положения в них водорослей. В заключительной, третьей части, приводятся основные характеристики макрогрупп и отделов водорослей, как они трактуются в настоящее время.
ЭНДОСИМБИОТИЧЕСКАЯ ТЕОРИЯ ПРОИСХОЖДЕНИЯ ХЛОРОПЛАСТОВ И ЭВОЛЮЦИЯ ВОДОРОСЛЕЙ
В докембрийскую эпоху протоатмосфера Земли принципиально отличалась по составу от современной атмосферы, в частности, практически полным отсутствием кислорода (O2). По данным разных исследований, в конце Архея – начале Протерозоя (примерно 2.4 млрд лет назад) произошло глобальное изменение состава атмосферы (так называемая “кислородная революция”, Great Oxidation Event (GOE)), связанное с появлением в ней свободного кислорода, а также смена условий с восстановительных на окислительные (Lyons et al., 2014; Allen et al., 2019).
Единственными прокариотными организмами, которые обладают оксигенным фотосинтезом, являются цианобактерии (синезеленые водоросли). Как геологические, так и генетические исследования предполагают, что предки цианобактерий приобрели способность к оксигенному фотосинтезу примерно за 0.5 млрд лет до “кислородной революции” (Junge, 2019), т.е. около 3 млрд лет назад. Появление наземных растений около 0.5 млрд лет назад вызвало новое повышение содержания кислорода в атмосфере. Биомасса и кислород, образовавшиеся на Земле в результате фотосинтеза, способствовали дальнейшей эволюции живых организмов. Таким образом, история развития жизни на Земле тесно связана с историей накопления кислорода.
Одной из наиболее важных ступеней в эволюции живых организмов было приобретение эукариотными клетками хлоропласта11, что привело к возникновению разных групп фотоавтотрофов (водорослей и эмбриофитов).
Идею о том, что хлоропласты имеют симбиотическое происхождение, впервые предложил A. Schimper (1883). Опираясь на работу Schimper (1883), К.С. Мережковский (Merezhkowsky, 1905), а вслед за ним А.С. Фаминцын (Famintsyn, 1907)22 пришли к выводу, что хлоропласты произошли в результате эндосимбиоза. Однако именно Мережковский (Merezhkowsky, 1909)33 предложил само название “симбиогенез”, детально сформулировав теорию и создав на ее основе новую классификацию органического мира.
Общепринятой в настоящее время является гипотеза, что первичный хлоропласт (т.е. хлоропласт, оболочка которого состоит их двух мембран) возник в результате первичного эндосимбиоза, т.е. путем “захвата” эукариотной гетеротрофной клеткой-хозяином фотосинтезирующей цианобактерии (рис. 1).
Рис. 1.
Первичный эндсимбиоз (в основу оригинального рисунка положена схема Archibald, Keeling, 2002: Fig. 1a, b).
а – первичный эндосимбиоз между гетеротрофным эукариотным хозяином и цианобактерией, b – образование первичного хлоропласта (первичная фагосомальная мембрана хозяина утрачена).
1 – будущая фагосомальная мембрана первичного хозяина, 2 – наружная мембрана цианобактерии, 3 – пептидогликан, 4 – внутренняя мембрана цианобактерии.
Fig. 1. Primary endosymbiosis (original figure based on Archibald, Keeling, 2002: Fig. 1a, b).
a – primary endosymbiosis between heterotrophic eukaryote and cyanobacterium, b – primary plastid formation (primary host phagosomal membrane is lost).
1 – subsequent primary host phagosomal membrane, 2 – cyanobacterial outer membrane, 3 – peptidoglycan, 4 – cyanobacterial inner membrane.
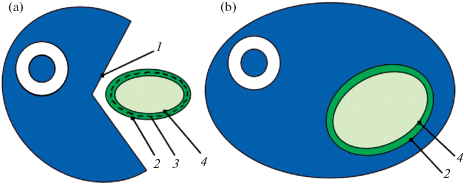
По данным разных исследований, это событие произошло более 1.5 млрд лет назад (Yoon et al., 2004; Sánchez-Baracaldo et al., 2017).
Предполагается, что изначально цианобактериальный эндосимбионт был покрыт мембраной фагосомы (так называемой первичной фагосомальной мембраной хозяина) (рис. 1а), а затем эта мембрана редуцировалась в процессе эволюции. Таким образом, первичный хлоропласт имеет 2 мембраны, которые представляют собой по происхождению мембраны оболочки цианобактерии (рис. 1b) (Cavalier-Smith, 2000; Archibald, Keeling, 2002 и др.).
Несмотря на то, что эндосимбиотическое происхождение пластид от общего цианобактериального предка не вызывало сомнений, природа этого предкового организма оставалась долгое время спорной. Чтобы решить эту проблему, R.I. Ponce-Toledo et al. (2017) провели филогеномный анализ данных, включая кодируемые хлоропластами белки и кодируемые ядром белки хлоропластного происхождения, полученные в результате эндосимбиотических переносов генов (Endosymbiotic Gene Transfer (EGT)) первичных фотосинтетических эукариот, а также широкого спектра геномных данных цианобактерий. В результате исследования авторами было показано, что самым близким родственником первичных пластид является Gloeomargarita lithophora Moreira et al. – широко распространенный в пресноводных микробиалитах и микробных матах вид цианобактерий (Couradeau et al., 2012; Ragon et al., 2014).
Хлоропласт, полученный в результате первичного эндосимбиоза, имеют представители пяти отделов водорослей: Glaucocystophyta, Rhodophyta, Prasinodermophyta44, Chlorophyta и Charophyta (табл. 1), а также фотосинтетические представители рода Paulinella (Cercozoa), входящие в группу Rhizaria (Lhee et al., 2019). Помимо вышеперечисленных групп водорослей, эмбриофиты также имеют двумембранные хлоропласты. Все эти представители (исключая Paulinella) на сегодняшний день признаны монофилетической кладой и в настоящее время объединены в группу Archaeplastida, или Plantae (см. ниже).
Таблица 1.
Основные группы водорослей и характеристика их пластид (по Burki, 2017 с дополнениями) Table 1. Main groups of algae and characteristics of their plastids (after Burki, 2017, with additions)
| Группа водорослей Group of algae |
Супергруппа Supergroup |
Число мембран пластиды Number of plastid membranes |
ХФ Chl |
НМ NM | Предок пластиды Plastid origin |
|---|---|---|---|---|---|
| Glaucocystophyta (=Glaucophyta) | Archaeplastida | 2 (с ПГ) (with PG) | a | нет/no | цианобактерия cyanobacteria |
| Rhodophyta | Archaeplastida | 2 | a | нет/no | цианобактерия cyanobacteria |
| Prasinodermophyta (=Prasinodermatophyta) | Archaeplastida | 2 | a, b | нет/no | цианобактерия cyanobacteria |
| Chlorophyta | Archaeplastida | 2 | a, b | нет/no | цианобактерия cyanobacteria |
| Charophyta | Archaeplastida | 2 | a, b | нет/no | цианобактерия cyanobacteria |
| Ochrophyta | SAR, Stramenopila | 4 (есть связь с ЭПР)* (continuous with ER)* | a, c | нет/no | красная водоросль red algae |
| Dinophyta | SAR, Alveolata | 3** | a, с | нет/no | красная водоросль** red algae** |
| Vitrella, Chromera | SAR, Alveolata | 4 | a | нет/no | красная водоросль red algae |
| Chlorarachniophyta | SAR, Rhizaria | 4 | a, b | есть/yes | зеленая водоросль green algae |
| Paulinella | SAR, Rhizaria | 2 (с ПГ) (with PG) | a | нет/no | цианобактерия cyanobacteria |
| Prymnesiophyta (= Haptophyta) |
Haptista | 4 (есть связь с ЭПР)* (continuous with ER)* | a, c | нет/no | красная водоросль red algae |
| Rappemonads | Haptista | ? | a | ? | красная водоросль red algae |
| Cryptophyta | Cryptista | 4 (есть связь с ЭПР)* (continuous with ER)* | a, c | есть/yes | красная водоросль red algae |
| Eulenophyta | Excavata (?), Discoba | 3 | a, b | нет/no | зеленая водоросль green algae |
Примечание. ХФ – хлорофилл, НМ – нуклеоморф, ПГ – пептидогликан; * – внешняя мембрана хлоропласта связана с эндоплазматическим ретикулюмом (ЭПР), ** – у видов, имеющих перидинин-содержащие хлоропласты. Более подробные объяснения см. в тексте.
Note. Chl – chlorophyll, NM – nucleomorph, PG – peptidoglycan; * – the outermost membrane of chloroplast is continuous with endoplasmic reticulum (ER), ** – in the species with peridinin-containing chloroplasts. See the text for more detailed explanations.
Одним из наглядных свидетельств происхождения хлоропласта от цианобактерий могут служить хлоропласты глаукоцистофитовых водорослей, у которых в пластиде находится карбоксисома, а между внешней и внутренней мембраной присутствует пептидогликан муреин, характерный для эубактерий (Pfanzagl et al., 1996; Löffelhardt et al., 1997).
Необходимо отметить, что помимо организмов, относящихся к Archaeplastida, есть другие представители, у которых в клетках присутствуют хлоропласты, полученные в результате первичного эндосимбиоза, но это приобретение произошло независимо в процессе эволюции. К таким организмам относятся одноклеточные фотосинтезирующие раковинные амебы из рода Paulinella (табл. 1). Как предполагают, хлоропласты Paulinella имеют сравнительно недавнее происхождение: примерно 90–140 млн лет (Delaye et al., 2016). В клетках Paulinella содержится по 2 хлоропласта (имеющих удлиненно-изогнутую форму), близких к кладе цианобактерий рода Synechococcus (Marin et al., 2005; Yoon et al., 2006). В настоящее время известно три фотосинтетических вида Paulinella, два из них являются пресноводными (P. chromatophora Lauterborn и P. micropora Lhee, Yang, Kim, Andersen et Yoon) и один (P. longichromatophora Kim et Park) – морским (Lhee et al., 2019).
Кроме организмов, относящихся к супергруппе Archaeplastida и трех видов Paulinella, остальные фотосинтетики получили свои пластиды в результате последующих симбиозов. Вторичнопластидные водоросли приобрели хлоропласты путем “захвата” эукариотных фотосинтезирующих клеток зеленой или красной водоросли (табл. 1, рис. 2).
Рис. 2.
Вторичный эндосимбиоз (в основу оригинального рисунка положена схема Archibald, Keeling, 2002: Fig. 1c, d).
a – вторичный эндосимбиоз между гетеротрофным эукариотным хозяином и водорослью, содержащей первичный хлоропласт, b – образование вторичного хлоропласта.
1 – фагосомальная мембрана вторичного хозяина, 2 – плазматическая мембрана первичного хозяина (отсутствует у динофит и эвгленофит), 3 – наружная мембрана цианобактерии, 4 – внутренняя мембрана цианобактерии, 5 – эндомембранный люмен вторичного хозяина, 6 – цитоплазма первичного хозяина (у криптофит и хлорарахниофит содержит нуклеомроф), 7 – межмембранное пространство цианобактерии, 8 – цитоплазма цианобактерии.
Fig. 2. Secondary endosymbiosis (original figure based on Archibald, Keeling, 2002: Fig. 1c, d).
a – secondary endosymbiosis between heterotrophic eukaryote and primary alga, b – secondary plastid formation.
1 – secondary host phagosomal membrane, 2 – primary host plasma membrane (lost in dinophytes and euglenophytes), 3 – cyanobacterial outer membrane, 4 – cyanobacterial inner membrane, 5 – secondary host endomembrane lumen, 6 – primary host cytosol (contains nucleomorph in cryptophytes and chlorarachniophytes), 7 – cyanobacterial intermembrane space, 8 – cyanobacterial cytosol.
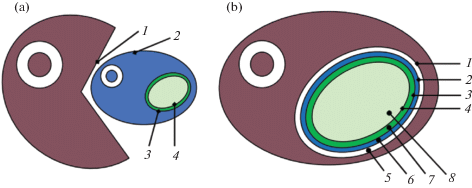
Путем вторичного эндосимбиоза с предковой зеленой водорослью возникли хлоропласты у представителей отделов Chlorarachniophyta и Euglenophyta, у остальных отделов – Сryptophyta, Haptophyta55, Ochrophyta и Dinophyta – с красной водорослью (Keeling, 2010; Zimorski et al., 2014) (табл. 1). Оболочки “вторичных” хлоропластов имеют более двух мембран, так как помимо собственно двух мембран хлоропласта эндосимбионта, присутствуют дополнительные. В “классическом” варианте такие хлоропласты имеют 4 мембраны: две внутренние цианобактериального происхождения (гомологичны мембранам первичных пластид) и две наружные, одна из которых – мембрана, оставшаяся от клетки эндосимбионта, другая (расположенная кнаружи от предыдущей) – фагосомальная мембрана хозяина (рис. 2b).
В настоящее время показано, что у отделов Chlorarachniophyta и Euglenophyta хлоропласты появились в результате вторичного эндосимбиоза независимо, тогда как ранее считалось, что они были получены от общего предка (так называемая Кабозоа гипотеза (Cabozoa hypothesis), подробнее см. Cavalier-Smith, 1999). Причем, хлоропласты Chlorarachniophyta были приобретены от предковой зеленой водоросли, близкой представителям Ulvophyceae (Rogers et al., 2007; Suzuki et al., 2016), а в качестве хозяина эндосимбионта предполагают представителя группы Cercozoa (Cavalier-Smith, 1999). Euglenophyta приобрели хлоропласты от предковой зеленой водоросли, близкой роду Pyramimonas (Prasinophyceae) (Hrdá et al., 2012), а в качестве хозяина предполагают представителя группы Euglenozoa (Cavalier-Smith, 1999). Однако однозначно вопрос о том, какой организм выступал в качестве хозяина для одной и другой группы, остается до сих пор нерешенным (Zimorski et al., 2014). При этом, хлоропласты Chlorarachniophyta четырехмембранные, а между двумя внешними и двумя внутренними мембранами сохраняется редуцированное ядро эндосимбионта – нуклеоморф (нуклеоморфа) (табл. 1). Эвгленовые водоросли имеют хлоропласт, покрытый тремя мембранами (табл. 1). Как предполагают, это связано с тем, что одна из мембран (фагосомальная мембрана хозяина или мембрана клетки эндосимбионта) редуцировалась в процессе эндосимбиоза (Vanclová et al., 2017). Согласно J.M. Archibald, P.J. Keeling (2002) у эвгленовых редуцировалась мембрана клетки эндосимбионта, которая, по-видимому, могла перевариться в процессе фаготрофного поглощения.
Представители отделов Cryptophyta, Haptophyta, Ochrophyta и Dinophyta имеют пластиды, ограниченные тремя (у Dinophyta) или четырьмя мембранами, и являются результатом эндосимбиоза между двумя эукариотами: подразумевается, что какая-то гетеротрофная эукариотная клетка-хозяин приобрела хлоропласты путем “захвата” фотосинтезирующей красной водоросли (Bhattacharya et al., 2007). Однако понять эволюцию этих групп пока до конца не удается, так как существует расхождение в данных, полученных, с одной стороны, при филогенетических построениях, основанных на геноме хлоропластов, с другой – на ядерном геноме хозяев (Burki et al., 2016). На сегодняшний день, по-видимому, убедительно говорить о вторичном хлоропласте, полученном от красных водорослей, можно только в отношении группы криптомонад (см. ниже).
Построения, основанные на филогении хлоропластов, согласуются с представлением о том, что все пластиды, полученные от предковой красной водоросли, являются продуктом одного вторичного эндосимбиоза (Janouškovec et al., 2010; Qiu et al., 2012; Ševčíková et al., 2015). Эта идея впервые была сформулирована в виде так называемой Хромальвеолятной гипотезы (Chromalveolate hypothesis), которая утверждает, что у охрофит, гаптофит, криптофит и альвеолят (объединяемых ранее в группу Chromalveolata66), был общий предок, единственный раз в процессе эволюции “захвативший” красную водоросль (Cavalier-Smith, 1999) (рис. 3).
Рис. 3.
Единственный вторичный эндосимбиоз у предка всех эукариот, получивших пластиды от красной водоросли (согласно Хромальвеолятной гипотезе) (в основу оригинального рисунка положена схема Burki et al., 2016: Fig. 3a). Объяснение см. в тексте.
Fig. 3. A single secondary endosymbiosis in the ancestor of all red plastid-bearing eukaryotes (according to Chromalveolate hypothesis) (original figure based on Burki et al., 2016: Fig. 3a). See the text for explanations.

С другой стороны, построения, основанные на выяснении филогенетических связей хозяев, показывают, что данная группа не является монофилетической (Burki et al., 2016). В связи с этим, возникает проблема: каким образом соотнести данные, основанные, с одной стороны, на филогении хлоропластов, показывающей монофилию “краснопластидных”77 групп, а с другой – основанные на филогении хозяев, не показывающей монофилию.
В своей работе F. Burki et al. (2016) пытались разобраться с этим вопросом. В частности, по их данным, эволюция пластид, схема которой представлена на рисунке 3, была невозможной. Почему? Во многих работах показано, что криптомонады (клада Cryptista) филогенетически близки к первичнопластидным (Archaeplastida) (Burki et al., 2012, 2016, 2020; Adl et al., 2019), и это их родство и положение на филогенетическом дереве исключает возможность существования единственного общего предка у всех “хромальвеолят”.
Чтобы согласовать данные, Burki et al. (2016) предложили два возможных варианта эволюции “краснопластидных” групп водорослей. Первый вариант связан с независимыми вторичными эндосимбиозами, которые могли происходить в процессе эволюции (рис. 4); второй – с единственным вторичным эндосимбиозом, за которым уже следовала новая серия эндосимбиозов (то есть третичный или четвертичный) (рис. 5).
Рис. 4.
Неоднократные независимые вторичные эндосимбиозы с различными симбионтами, содержащими пластиды, полученные от красных водорослей (в основу оригинального рисунка положена схема Burki et al., 2016: Fig. 3b). Объяснение см. в тексте.
Fig. 4. Multiple independent secondary endosymbioses with different endosymbionts containing the plastids from red algae (original figure based on Burki et al., 2016: Fig. 3b). See the text for explanations.

Рис. 5.
Единственный вторичный эндосимбиоз, за которым следуют последовательные эндосимбиозы между эукариотами (в основу оригинального рисунка положена схема Burki et al., 2016: Fig. 3c). Объяснение см. в тексте.
Fig. 5. A single secondary endosymbiosis followed by serial eukaryote-to-eukaryote endosymbioses (original figure based on Burki et al., 2016: Fig. 3c). See the text for explanations.
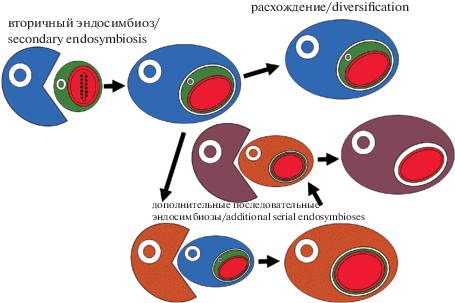
Согласно выводам авторов, первый сценарий (рис. 4) эволюционных событий маловероятен, так как многочисленные работы показывают, что у всех представителей группы “хромальвеолят” хлоропласт получен от общего предка (Petersen et al., 2014; Zimorski et al., 2014 и др.). Что касается второго сценария (рис. 5), то именно этот вариант возможной эволюции поддерживается большинством исследователей. Основная идея этого сценария заключается в том, что в процессе эволюции сначала произошел один вторичный эндосимбиоз – “захват” эукариотным гетеротрофным хозяином предковой красной водоросли, за которым происходили уже последующие “захваты” (т.е. последующие эндосимбиозы) (Bodył et al., 2009; Baurain et al., 2010; Petersen et al., 2014; и др.).
Схема, приведенная Burki et al. (2016) (рис. 5), была ранее предложена в работе J. Petersen et al. (2014) и получила название Родоплекс гипотеза (Rhodoplex hypothesis). Она заключается в том, что хлоропласты у представителей группы CASH (Cryptophyta, Alveolata, Stramenopila и Haptophyta) произошли в результате одного вторичного эндосимбиоза с красной водорослью, а затем происходили последующие эндосимбиозы. Результаты исследований J.W. Stiller et al. (2014) показали, что “исходной” группой в серии эндосимбиозов (т.е. вторичном симбиозе) можно считать появление криптофитовых водорослей, хлоропласты которых, по-видимому, стали предками для других групп “краснопластидных” водорослей (в пределах Alveolata, Stramenopila и Haptophyta). Особенностью хлоропластов криптомонад, также как и хлорарахниофит, является наличие между двумя внешними и двумя внутренними мембранами редуцированного ядра эндосимбионта – нуклеоморфа, однако, в отличие от хлорарахниофит, происхождение эндосимбионта криптомонад (т.е. какая красная водоросль была предком их хлоропласта) до сих пор не ясно (Tanifuji, Onodera, 2017) (табл. 1).
Помимо всего вышесказанного хотелось бы также отметить, что относительно недавно у двух представителей группы Alveolata, наиболее близких к споровикам (Apicomplexa), Chromera (Moore et al., 2008) и Vitrella (Oborník et al., 2012), были описаны пластиды, имеющие 4 мембраны, но содержащие только хлорофилл а (табл. 1, также см. ниже).
К водорослям также можно отнести организмы (по последним данным близкие к Haptophyta), содержащие в клетках 2–4 “красные” пластиды. Эти организмы, описанные только на основании изучения тотальных проб окружающей среды, были названы раппемонады (Rappemonads) (Kim et al., 2011). Однако группа остается крайне скудно охарактеризованной, и в ней до сих пор не описано ни одного рода и вида (Adl et al., 2019).
Концепция, что хлоропласты имеют цианобактериальное происхождение, принимается как научная парадигма. Однако в настоящее время некоторые исследователи ставят под сомнение тот факт, что все хлоропласты произошли в результате одного симбиотического события. В частности, N. Sato (2019, 2020) исследовал и сравнил различные ферменты хлоропластов (кодируемые хлоропластными и ядерными генами) с цианобактериальными аналогами, делая упор на гены, кодирующие ферменты, участвующие в биосинтезе хлоропластных мембранных липидов и жирных кислот. Как пишет автор, можно предположить разное происхождение этих генов. 1. Если ферменты, участвующие в биосинтезе липидов мембран хлоропластов, кодируются хлоропластным геномом, то можно однозначно сказать, что мембраны хлоропластов унаследованы от мембран эндосимбионтов. 2. Если ферменты кодируются ядерным геномом (т.е. геномом хозяина), тогда есть два возможных варианта. 2а. Если ферменты произошли от эндосимбионта (в результате эндосимбиотического переноса генов, EGT), то можно говорить о том, что мембраны хлоропластов унаследованы от мембран эндосимбионтов (также как в случае 1). 2б. Однако если ферменты являются исходно ферментами хозяина, или произошли от организмов, отличных от эндосимбионта, то мы не можем сказать, что мембраны хлоропластов унаследованы от одного эндосимбионта (Sato, 2020). В своей работе Sato (2020) провел филогенетический анализ большинства основных ферментов, участвующих в биосинтезе липидов в хлоропластах, а также некоторых дополнительных ферментов хлоропластов, участвующих в фотосинтезе, экспрессии генов и делении. Результаты показали различное происхождение ферментов. Автором было выявлено 4 типа ферментов: тип 1 – ферменты хлоропластов, происходящие от цианобактерий; тип 2 – хлоропластные и цианобактериальные ферменты, происходящие от общей сестринской группы; тип 3 – ферменты хлоропластов, полученные от бактериальных гомологов, отличных от цианобактерий; тип 4 – ферменты хлоропластов, происходящие от эукариот (рис. 6).
Рис. 6.
Четыре топологии филогенетических деревьев для хлоропластных ферментов (в основу оригинального рисунка положена схема Sato, 2020: Fig. 2). Объяснение см. в тексте.
1 – хлоропластные ферменты, происходящие от цианобактерий (тип 1), 2 – хлоропластные и цианобактериальные ферменты являются сестринскими группами (тип 2), 3 – хлоропластные ферменты, происходящие от гомологов бактерий, но не цианобактерий (тип 3), 4 – хлоропластные ферменты, происходящие от эукариот (тип 4).
CHL – хлоропласт, CB – цианобактерии, GB – зеленые бактерии, B – другие бактерии, EK – эукариоты, PK – прокариоты.
Fig. 6. Four topologies of phylogenetic trees of the chloroplast proteins (original figure based on Sato, 2020: Fig. 2). See the text for explanations.
1 – chloroplast enzymes of cyanobacterial clade origin (type 1), 2 – chloroplast and cyanobacterial enzymes are sister groups (type 2), 3 – chloroplast enzymes originated from their homologs in bacteria other than cyanobacteria (type 3), 4 – chloroplast enzymes diverged from eukaryotic homologs (type 4).
CHL – chloroplast, CB – cyanobacteria, GB – green bacteria, B – other bacteria, EK – eukaryotes, PK – prokaryotes.
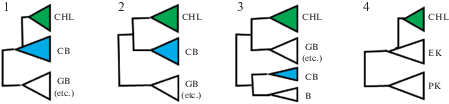
Анализ полученных результатов позволил предположить, что время получения ферментов и хлоропластов было различным, что указывает на множественные переносы генов. Таким образом, Sato (2019, 2020) ставит под сомнение, что происхождение хлоропластов было связано с одним эндосимбиотическим событием. Альтернативная гипотеза автора предполагает направленное хозяином образование хлоропластов (Hypothesis of host-directed chloroplast formation) (Sato, 2020: 17), в результате которого способность к синтезу гликолипидов была приобретена эукариотическим хозяином до приобретения рибосом хлоропластов. Хлоропластная мембранная система могла быть предоставлена хозяином, в то время как цианобактерии вносили вклад в генетическую и фотосинтетическую системы в разное время, либо до, либо после образования мембран хлоропластов. Основное заключение автора состоит в том, что перенос генов происходил много раз в разное время: различные гены (от цианобактерий и других бактерий) были много раз переданы прото-водорослевым клеткам. Некоторые из них остались в геноме хлоропласта, многие перешли в геном ядра. Автор считает, что “настало время изменить упрощенный взгляд из учебника на “первичный эндосимбиоз” как на событие, произошедшее только один раз (“It is now time to change the simplistic textbook view of “primary endosymbiosis” as a single event occurring just once”) (Sato, 2019: 172).
Таким образом, несмотря на многочисленные работы, посвященные эндосимбиотической теории и эволюции хлоропластов, неразрешенных вопросов, связанных с происхождением этих фотосинтетических органелл и, соответственно, эволюцией и филогенетическими связями разных групп водорослей, остается еще достаточно много.
СИСТЕМЫ ОРГАНИЧЕСКОГО МИРА И ПОЛОЖЕНИЕ В НИХ ВОДОРОСЛЕЙ
Одним из первых ученых, кто пытался систематизировать организмы, был Аристотель, который предложил разделение органического мира на два царства – Plantae (растения) и Animalia (животные) (Margulis, Chapman, 2009). В его системе все водоросли попадают в царство Plantae.
Шведский ученый К. Линней, основоположник биологический систематики и бинарной номенклатуры, бесспорно, внес значительный вклад в классификацию органического мира, в том числе, в систему растений. В своей системе Линней рассматривал водоросли как самостоятельный порядок Algae класса тайнобрачных (Cryptogamia) царства растений (Vegetabile) (Linnæus, 1735). К этому порядку Линней отнес несколько родов, 4 из которых относятся к водорослям в современном понимании: Chara L., Conferva L., Fucus L. и Ulva L. Однако в связи с тем, что Линней рассматривал водоросли как самостоятельный таксон, долгое время сохранялось представление о них как о единой таксономической категории, а не сборной группе, объединяющей самые разные по происхождению организмы.
Немецкий биолог Э. Геккель пришел к выводу, что многие организмы (бактерии, простейшие, водоросли, грибы), у которых нет разделения на органы и ткани, принципиально отличаются как от животных, так и от растений. На основании этого, Геккель предложил отнести их к отдельному царству Protista (протисты), т.е. выделил еще одно царство (весьма гетерогенное по составу входящих в него организмов) наряду с растениями и животными (Haeckel, 1866, цит. по: Margulis, Chapman, 2009). В системе Геккеля водоросли частично попадали в царство растений, частично – в царство протистов.
Система органического мира, предложенная R.H. Whittaker (1969), на протяжении многих лет была общепринятой. В его системе, включающей 5 царств (Monera (монера) – прокариотные организмы, Protista (протисты) – эукариотные, преимущественно одноклеточные организмы, Plantae (растения) – эукариотные многоклеточные автотрофы, Fungi (грибы) – эукариотные многоклеточные осмотрофы и Animalia (животные) – эукариотные многоклеточные фаготрофы), водоросли были распределены среди первых трех.
Очень важным этапом в биологии стало развитие в середине 20 века методов электронной микроскопии и их активного применения для изучения клеточных структур, что дало возможность использовать ультраструктурные признаки в систематике и при построении филогенетических систем. В частности, исследования структуры жгутиков, крист митохондрий, хлоропластов, клеточных покровов и т.п., а также типов митоза и цитокинеза, позволили по-новому взглянуть на многие таксоны эукариот, и еще до “эры молекулярной биологии” высказать предположения относительно моно-/полифилии некоторых групп. Одним из первых, кто использовал для характеристики макротаксонов (царств) эукариот ультраструктурные признаки (строение крист митохондрий, жгутиков, аппарата Гольджи, хлоропластов и т.д.) был британский биолог Т. Кавалье-Смит, который утверждал, что при построении естественной системы необходимо основываться на фундаментальных структурах клетки (Cavalier-Smith, 1978, 1981). Например, именно анализ ультраструктурных признаков позволил предположить, что криптомонады (отдел Cryptophyta) правомочно выделять в отдельное царство (Cavalier-Smith, 1981), что, в настоящее время, подтверждается молекулярно-генетическими исследованиями (см. ниже).
За последние десятилетия системы и классификации живых организмов претерпели значительные изменения, что связано с новыми подходами, методами и возможностями. Значительные достижения в области молекулярной биологии, биохимии, клеточной биологии, генетики и т.д. расширили знания об организации живых организмов, и, как следствие, взгляды на их происхождение и родственные связи значительно изменились.
Огромный вклад в развитие и использование новых подходов для построения макросистем внес американский биолог К.Р. Везе, который является основоположником молекулярной филогенетики. Использовать последовательности 16S рРНК для филогенетического анализа было предложено в знаковой для биологии работе (Woese, Fox, 1977), в которой авторы предложили разделять прокариот на Archaebacteria (архей) и Eubacteria (собственно бактерий).
С началом применения молекулярно-генетических методов для выяснения родственных связей между организмами, взгляд на макросистему органического мира (главным образом эукариот) и положение в них разных организмов, в том числе и водорослей, коренным образом изменился.
Одной из первых работ, в которой было показано, что многие эукариоты “не укладываются” в традиционно выделяемые царства (протисты, растения, животные и грибы), было исследование M.L. Sogin (1991).
Позже, S.L. Baldauf et al. (2000), одними из первых опубликовали работу, в которой были пересмотрены филогенетические связи эукариот.
Впервые разделять эукариот на несколько супергрупп было предложено в работе A.G. Simpson, A.J. Roger (2002). Авторы выделили 6 групп эукариот (Opisthokonta, Plantae, Сhromalveolata, Cercozoa, Amoebozoa и Excavata), и к четырем из них относились разные группы водорослей (табл. 2).
Таблица 2.
Положение водорослей в макросистеме эукариот (по Simpson, Roger, 2002) Table 2. Position of algae among eukaryotes (after Simpson, Roger, 2002)
| Супергруппа Supergroup | Отдел Phylum |
|---|---|
| Plantae | Glaucocystophyta, Rhodophyta, Chlorophyta, Charophyta |
| Сhromalveolata | Dinophyta, Ochrophyta, Cryptophyta, (?) Haptophyta |
| Cercozoa | Chlorarachniophyta |
| Excavata | Euglenophyta |
В 2005 г. вышли две работы, в которых было предложено разделить эукариот на 5 (Keeling et al., 2005) или 6 супергрупп (Adl et al., 2005). В обеих системах эукариотные водоросли распределены среди четырех супергрупп (табл. 3).
Таблица 3.
Положение водорослей в макросистеме эукариот (по Keeling et al., 2005) Table 3. Position of algae among eukaryotes (after Keeling et al., 2005)
| Супергруппа Supergroup | Отдел Phylum |
|---|---|
| Plantae* | Glaucocystophyta, Rhodophyta, Chlorophyta, Charophyta |
| Сhromalveolata (включая Alveolata и Stramenopila) Сhromalveolata (including Alveolata and Stramenopila) |
Dinophyta, Ochrophyta, Cryptophyta, Haptophyta |
| Rhizaria (включая Cercozoa) Rhizaria (including Cercozoa) |
Chlorarachniophyta |
| Excavata | Euglenophyta |
Затем Burki et al. (2007) показали близкое родство супергруппы Rhizaria и двух основных клад супергруппы Chromalveolata: Stramenopila и Alveolata, на основании чего предложили объединить их в общую группу SAR (Stramenopila+Alveolata+Rhizaria). Подробные описания этих супергрупп и макротаксонов можно найти в работах Baldauf (2008) и S.M. Adl et al. (2005, 2012).
Несмотря на то, что филогенетические связи большинства групп водорослей были более или менее определены, положение двух групп, криптофит (Cryptophyta) и гаптофит (Haptophyta), было не очевидным. Положение в макросистеме криптомонад и гаптофит и их отнесение к Сhromalveolata ставилось под сомнение давно (Cavalier-Smith, 1999). Существовали и существуют разные взгляды на положение этих двух групп водорослей в макросистеме. Вначале была показана монофилия этих двух отделов (Hackett et al., 2007), затем, оба отдела были отнесены в группу (царство) Hacrobia клады Chromalveolata (Okamoto et al., 2009; Keeling, 2009). Позже Burki et al. (2012) показали, что гаптофитовые водоросли являются сестринской группой супергруппе SAR, а криптомонады – супергруппе Archaeplastida. В работе Adl et al. (2012) криптофиты и гаптофиты отнесены в группу Inсertae sedis именно с учетом того, что данные относительно их родства и положения в системе весьма противоречивы.
В одной из последних опубликованных работ, посвященных классификации эукариотных организмов (Adl et al., 2019), предложено разделять эукариот на две мегагруппы (домена): Amorphea (у Lax et al. (2018) названа Amorphea+ и включает также Metamonada и CRuMs88) и Diaphoretickes. При этом положение некоторых групп эукариот (находящихся на разных ступенях таксономической иерархии), до сих пор остается неясным. К ним, в частности, относится супергруппа Excavata, включающая эвгленовые водоросли. В целом, все отделы водорослей (за исключением Euglenophyta), относятся в данной системе к домену Diaphoretickes, который включает различные клады. Из водорослей к домену Diaphoretickes относятся клада Cryptista (к которой относится отдел Cryptophyta), Haptista (включает отдел Haptophyta), Archaeplastida (включает отделы Glaucocystophyta, Rhodophyta, Chlorophyta и Charophyta) и SAR (включает отделы Ochrophyta, Dinophyta и Chlorarachniophyta) (подробнее см. Adl et al., 2019).
Подводя итог вышесказанному и обобщив полученные к настоящему времени данные, ниже мы приводим краткие характеристики супергрупп (по Adl et al., 2019; Burki et al., 2020) и отделов водорослей, которые к ним относятся. Для каждой группы (отдела) водорослей указаны следующие основные признаки, важные для систематики: тип таллома, строение хлоропласта, фотосинтетические пигменты (хлорофиллы и дополнительные пигменты), запасные продукты, строение жгутиков.
КРАТКИЕ ХАРАКТЕРИСТИКИ ОСНОВНЫХ СУПЕРГРУПП И ОТДЕЛОВ ВОДОРОСЛЕЙ
Представления ученых о филогенетических связях разных организмов, главным образом, эукариот, меняются в связи с накоплением новых, преимущественно молекулярно-генетических, данных. Ниже приведены краткие описания макротаксонов органического мира (по Adl et al., 2019; Burki et al., 2020), к которым относятся водоросли, а также даны краткие характеристики отделов водорослей (по Frey, 2012, 2015, 2017). В связи с тем, что некоторые группы водорослей традиционно изучаются не только альгологами, но и протистологами (например, динофитовые, эвгленовые и др.), используемые для этих объектов классификации могут быть разными (в силу разных подходов к классификации). В данной работе мы приводим отделы водорослей согласно принятой в альгологии систематике (Frey, 2012, 2015, 2017).
ПРОКАРИОТЫ
BACTERIA – одноклеточные и многоклеточные формы с прокариотным строением клеток; с различными типами питания; характерны двухслойная липопротеиновая мембрана и пептидогликан муреин в качестве основного компонента клеточной стенки.
К прокариотным водорослям относится один отдел – Cyanophyta.
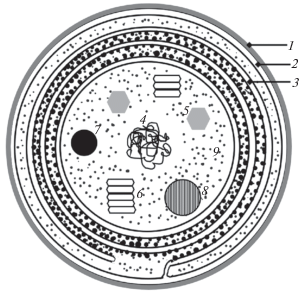
Отдел Cyanophyta, Cyanobacteria, Cyanoprokaryota (синезеленые водоросли, цианобактерии, цианопрокариоты) – одноклеточные и многоклеточные формы; клетки способны к оксигенному фотосинтезу; тилакоиды у большинства одиночные, у некоторых (прохлорофитовых) – собраны в граны; большинство представителей содержат только хлорофилл а (есть виды, содержащие также хлорофиллы b, c, d и f); дополнительные фотосинтетические пигменты – каротиноиды (β-каротин, зеаксантин, эхиненон, миксоксантофилл и др.) и фикобилипротеины (фикоэритрин, фикоцианин и аллофикоцианин), собранные в фикобилисомы; присутствует карбоксисома (полиэдрическое тело); запасные продукты – цианофициновый крахмал, соединения азота (в виде цианофициновых гранул), полифосфаты; клеточная стенка близка по строению стенке грамотрицательных бактерий; жгутиковые стадии отсутствуют (рис. 7).
Рис. 7.
Клетка цианобактерий.
1 – слизистый чехол, 2 – клеточная стенка, 3 – тилакоид и фикобилисомы, 4 – нуклеоид, 5 – карбоксисома, 6 – газовые везикулы, 7 – полифосфатное тело, 8 – цианофициновая гранула, 9 – рибосомы.
Fig. 7. Cyanobacterial cell.
1 – mucus sheath, 2 – cell wall, 3 – thylakoid and phycobilisomes, 4 – nucleoid, 5 – carboxysome, 6 – gas vesicles, 7 – polyphosphate body, 8 – cyanophycin granule, 9 – ribosomes.
ЭУКАРИОТЫ
Один из вопросов, связанных с макросистемой эукариот – что такое супергруппы и как их выделяют? В целом, понятие (категория) “супергруппа” изначально было неформальным; в супергруппу объединяли самые разнообразные организмы, для которых имелись достаточные доказательства того, что они образуют монофилетическую кладу (которой не всегда можно дать биологическое описание). Как оказалось, применять эти категории удобно по самым разным причинам, поэтому и сегодня они используются в различных филогенетических построениях (подробнее см. Burki et al., 2020). На основе филогеномного анализа разных эукариотных организмов за последние 15 лет было опубликовано новое филогенетическое дерево эукариот (Burki et al., 2020), которое в значительной степени отличается от предыдущих (рис. 8) (подробнее о проекте Interactive Tree of Life см. Letunic, Bork, 2019).
Рис. 8.
Филогенетическое древо эукариот (в основу оригинального рисунка положена схема Burki et al., 2020: Fig. 1).
Fig. 8. The tree of eukaryotes (original figure based on Burki et al., 2020: Fig. 1).
Примечание. * отмечены группы, включающие фотоавтотрофных эукариот. Обведенные цветными линиями четырехугольники соответствуют супергруппам эукариот в современном понимании. Неразрешенные связи между группами показаны пунктирными линиями.
Note. * – groups including photoautotrophic eukaryotes. The color-outlined quadrangles draw current supergroups. The dotted lines show unresolved links between groups.

Как видно из рисунка 8, большинство “исходных” супергрупп на филогенетическом дереве включены в новые таксоны, а некоторые – отсутствуют. Такие изменения связаны, во-первых, с “расщеплением” старых супергрупп (часто сопровождаемом реорганизацией в разных частях дерева); во-вторых, с объединением отдельных таксонов в новые большие клады; и, в-третьих, с добавлением новых таксонов уровня супергруппы. В результате получилась модель (model eToL), которая в целом сохранила форму, аналогичную более ранним схемам, но в деталях – отличную от предыдущих (Burki et al., 2020). Более подробно описания всех супергрупп см. в Adl et al. (2019) и Burki et al. (2020).
ARCHAEPLASTIDA – одноклеточные и многоклеточные формы, у которых хлоропласт возник в результате первичного эндосимбиоза (хлоропласт покрыт двумя мембранами); содержат хлорофилл а или а и b; митохондрии с плоскими кристами. Эта супергруппа также включает два вида гетеротрофных фаготрофных жгутиконосцев из рода Rhodelphis, имеющих трубчатые кристы митохондрий (в отличие от других Archaeplastida), у которых не обнаружены пластиды, однако, обнаружены гены, участвующие в фотосинтезе; Rhodelphis является сестринской группой для Rhodophyta (подробнее см. Gawryluk et al., 2019) (рис. 8).
К Archaeplastida относится 5 отделов водорослей: Glaucocystophyta, Rhodophyta, Prasinodermophyta, Chlorophyta и Charophyta (табл. 1); последние 3 объединяют вместе с высшими растениями в группу Chloroplastida (см. ниже).
Отдел Glaucocystophyta, Glaucophyta (глаукоцистофитовые водоросли, глаукофитовые водоросли, глаукоцистофиты, глаукофиты) – одноклеточные и колониальные формы; клетки содержат уникальный хлоропласт, между мембранами которого расположен слой пептидогликана муреина; тилакоиды одиночные (рис. 9a); содержат хлорофилл a; дополнительные фотосинтетические пигменты – каротиноиды (β-каротин, зеаксантин) и фикобилипротеины (фикоцианин и аллофикоцианин), собранные в фикобилисомы; запасные продукты – крахмал, липиды (откладываются в цитоплазме).
Рис. 9.
Хлоропласты Archaeplastida. а – глаукофитовые водоросли, b – красные водоросли, с – зеленые водоросли.
1 – строма, 2 – внешняя и внутренняя мембраны оболочки хлоропласта, 3 – тилакоид, 4 – грана, 5 – фикобилисома, 6 – карбоксисома, 7 – пиреноид, 8 – слой пептидогликана, 9 – крахмал.
Fig. 9. Chloroplasts of Archaeplastida. а – glaucophytes, b – rhodophytes, с – chlorophytes.
1 – stroma, 2 – outer and inner membranes of chloroplast envelope, 3 – thylakoid, 4 – granum, 5 – phycobilisome, 6 – carboxysome, 7 – pyrenoid, 8 – peptidoglycan layer, 9 – starch.

Отдел Rhodophyta (красные водоросли, родофиты, багрянки) – одноклеточные, колониальные и многоклеточные формы; тилакоиды одиночные (рис. 9b); содержат хлорофилл a; дополнительные фотосинтетические пигменты – каротиноиды (ɑ-, β-каротин, лютеин, зеаксантин) и фикобилипротеины (фикоэритрин, фикоцианин и аллофикоцианин), собранные в фикобилисомы; запасные продукты – багрянковый крахмал, флоридозид (откладываются в цитоплазме); жгутиковые стадии отсутствуют.
Chloroplastida, Viridiplantae – одноклеточные, колониальные и многоклеточные формы; тилакоиды формируют граны (рис. 9c); хлоропласты содержат хлорофиллы a и b; запасной продукт – крахмал (откладывается в хлоропласте).
К этой группе относится 3 отдела водорослей – Prasinodermophyta, Chlorophyta и Charophyta, разделение которых во многом основано на цитологических, биохимических и молекулярно-генетических признаках.
Отдел Prasinodermophyta, Prasinodermatophyta (празинодермофиты, празинодерматофиты) – одноклеточные или колониальные, свободноживущие или прикрепленные коккоидные формы; цитокинез неравный; морские виды. Отдел был выделен Li et al. (2020) на основании молекулярно-филогенетических и биохимических данных.
Отдел Chlorophyta (зеленые водоросли, хлорофиты) – одноклеточные, колониальные и многоклеточные формы; митоз закрытый или полузакрытый; цитокинез происходит бороздой или с образованием клеточной пластинки, у многих с формированием фикопласта; микротрубочковые корешки жгутиков имеют крестообразное расположение, базальные тела могут быть расположены супротивно, быть сдвинуты по часовой стрелке (и не перекрываться) или против часовой стрелки (и перекрываться); присутствует гликолатдегидрогеназа (в пероксисомах).
Отдел Charophyta (харовые водоросли, харофиты)99 – одноклеточные, колониальные и многоклеточные формы; митоз открытый или полузакрытый; цитокинез происходит бороздой или с образованием клеточной пластинки, у многих с формированием фрагмопласта; микротрубочковые корешки расположены асимметрично, один корешок состоит из 1–2 микротрубочек, другой образует широкую ленту из микротрубочек, базальные тела жгутиков расположены почти параллельно и лежат на многослойной структуре (пластинке), от которой отходит лента из микротрубочек; присутствуют гликолатоксидаза и каталаза (в пероксисомах).
TSAR – монофилетическая супергруппа, включает 4 клады: Telonemia (включает гетеротрофных жгутиконосцев), Stramenopila, Alveolata и Rhizaria (рис. 8).
Stramenopila – подвижные клетки имеют два ряда трехчастных мастигонем на одном из жгутиков; митохондрии с трубчатыми кристами. Из водорослей к Stramenopila относится один отдел – Ochrophyta (табл. 1).
Отдел Ochrophyta (охрофитовые водоросли, охрофиты) – одноклеточные, колониальные и многоклеточные формы; хлоропласт с четырьмя мембранами (внешняя мембрана хлоропласта чаще всего переходит во внешнюю мембрану ядра), трехтилакоидные ламеллы, у многих есть опоясывающая ламелла (рис. 10a); содержат хлорофиллы a и с (хлорофилл с может присутствовать в форме с1, с2, с3; отсутствует у Eustigmatophyceae); дополнительные фотосинтетические пигменты – каротиноиды (фукоксантин, вошериаксантин, виолаксантин и др.); запасные продукты – хризоламинарин, липиды (откладываются в цитоплазме).
Рис. 10.
Хлоропласты SAR. а – охрофитовые водоросли, b – динофитовые водоросли, c – хлорарахниофитовые водоросли.
1 – строма, 2 –мембрана хлоропластного ЭПР, 3 – мембраны собственно хлоропласта, 4 – тилакоид, 5 – пиреноид, 6 – опоясывающая ламелла, 7 – рибосомы, 8 – часть хлоропластного ЭПР, переходящего во внешнюю мембрану ядра, 9 – перипластидное пространство, 10 – нуклеоморф.
Fig. 10. Chloroplasts of SAR. а – ochrophytes, b – dinophytes, с – chlorarachniophytes.
1 – stroma, 2 – membrane of chloroplast ER, 3 – membranes of chloroplast, 4 – thylakoid, 5 – pyrenoid, 6 – girdle lamella, 7 – ribosomes, 8 – chloroplast ER continuous with outer nuclear membrane, 9 – periplastidial space, 10 – nucleomorph.

Alveolata – у большинства представителей клеточные покровы имеют альвеолы (кортикальные везикулы), расположенные под цитоплазматической мембраной; митохондрии с трубчатыми кристами. К группам, имеющим пластиды, относятся отдел Dinophyta, два рода из Colpodellida (табл. 1), а также Apicomplexa.
Отдел Dinophyta (динофитовые водоросли, динофиты, динофлагелляты) – одноклеточные и колониальные формы; хлоропласт с тремя мембранами (у перидинин-содержащих пластид), трехтилакоидные ламеллы (рис. 10b); содержат хлорофиллы a и с2; дополнительные фотосинтетические пигменты – каротиноиды (перидинин, диадиноксантин, диатоксантин и др.); запасные продукты – крахмал, липиды, стеролы (откладываются в цитоплазме).
Динофлагелляты – необычная группа эукариот, так как у некоторых из них в клетках содержатся пластиды, полученные в результате эндосимбиоза с другими водорослями: гаптофитовыми, диатомовыми и зелеными. Вопрос о том, были такие хлоропласты приобретены клетками, имевшими исходно перидинин-содержащие пластиды и утратившими их, или получены изначально гетеротрофными клетками, до конца не изучен, однако преобладает точка зрения, что их изначально “красные” пластиды редуцировались и в процессе эволюции были замещены (Saldarriaga et al., 2001, 2004).
Пластиды, полученные в результате эндосимбиоза с гаптофитовой водорослью, известны у представителей семейства Kareniaceae (у родов Karenia, Karlodinium и Takayama). Такие пластиды окружены (как предполагают) четырьмя мембранами, содержат хлорофиллы a, c1 и с2, а также производные фукоксантина (Waller, Korený, 2017).
У некоторых представителей семейства Gymnodiniaceae (род Lepidodinium) присутствуют пластиды, произошедшие в результате эндосимбиоза с зеленой водорослью и содержащие хлорофиллы a и b. Такие пластиды окружены четырьмя мембранами, при этом, между двумя внутренними и двумя внешними мембранами сохраняются цитоплазма эндосимбионта с рибосомами, везикулами и, возможно, нуклеоморфом (Waller, Korený, 2017).
Помимо этого, среди динофлагеллят есть представители, у которых также обнаружены не перидинин-содержащие пластиды, например, Kryptoperidinium foliaceum (F. Stein) Er. Lindem. и Durinskia baltica (Levander) Carty et El.R. Cox. У этих видов присутствуют пластиды, произошедшие в результате третичного эндосимбиоза с диатомовой водорослью, содержащие хлорофиллы a и с2, и фукоксантин. Интересно, что эндосимбионт отделен от цитоплазмы хозяина одной мембраной, под которой расположены ядро, митохондрии и хлоропласты симбионта (хлоропласты окружены четырьмя мембранами). Клетки этих динофлагеллят называют динотомы (dinotoms) (Hehenberger et al., 2014). Предполагают, что у этих видов собственные хлоропласты были утрачены в процессе эволюции и заменены на новые (Waller, Korený, 2017). Видов динофлагеллят, содержащих в качестве симбионтов диатомовые водоросли, в настоящее время описано достаточно много, и все они относятся к семейству Kryptoperidiaceae (подробнее см. Gómez, 2020).
Помимо этого, среди динофитовых есть виды, содержащие клептопластиды, полученные от разных групп водорослей (например, криптомонад и диатомовых).
Как было сказано выше, в группе Alveolata относительно недавно было описано два вида, в клетках которых содержатся четырехмембранные хлоропласты. Согласно Adl et al. (2019) эти виды относятся группе Colpodellida.
Colpodellida – фотосинтезирующие или нефотосинтезирующие организмы, хищники; в апикальном комплексе присутствует коноид-подобная структура1010; есть микропора1111.
Среди колподеллид известно два рода – Chromera и Vitrella, виды которых содержат хлоропласты, покрытые четырьмя мембранами.
Chromera – одноклеточные формы; хлоропласт с четырьмя мембранами; содержат хлорофилл a; дополнительные фотосинтетические пигменты – каротиноиды (виолаксантин, изофукоксантин, β-каротин). Известен один вид – Chromera velia R.B. Moore et al. (Moore et al., 2008).
Vitrella – одноклеточные формы; хлоропласт с четырьмя мембранами, тилакоиды собраны в стопки по 3 или более; содержат хлорофилл a; дополнительные фотосинтетические пигменты – каротиноиды (виолаксантин, вошериаксантин, β-каротин). Известен один вид – Vitrella brassicaformis Oborník et al. (Oborník et al., 2012).
Apicomplexa – одноклеточные, в основном внутриклеточные паразитические организмы; клетки с характерным апикальным комплексом; большинство обладает уникальной органеллой – апикопластом, представляющим собой редуцированный нефотосинтезирующий хлоропласт с четырьмя мембранами, содержащим кольцевую молекулу ДНК; в апикопласте происходит биосинтез изопреноидов и жирных кислот.
Rhizaria – одноклеточные организмы; клетки имеют разные псевдоподии (филоподии, ретикулоподии или аксоподии); митохондрии с трубчатыми кристами. Из представителей, имеющих пластиды, к Rhizaria относятся хлорарахниофиты и 3 вида рода Paulinella (табл. 1).
Отдел Chlorarachniophyta – одноклеточные и колониальные формы; хлоропласты четырехмембранные, между двумя внешними и двумя внутренними мембранами хлоропласта содержится нуклеоморф, одно-трехтилакоидные ламеллы (рис. 10c); содержат хлорофиллы a и b; запасной продукт – β-глюкан (откладывается в цитоплазме).
К группе Rhizaria, наряду с хлорарахниофитами, относится род филозных раковинных амеб Paulinella, у трех видов которых в клетках присутствуют первичные хлоропласты (см. выше).
Paulinella – одноклеточные организмы, 3 вида: P. chromatophora, P. micropora и P. longichromatophora имеют хлоропласты (содержат карбоксисомы), покрытые двумя мембранами, между которыми расположен муреиновый слой; содержат хлорофилл a и фикобилипротеины.
HAPTISTA – для клеток характерно наличие выростов (гаптонемы и аксоподий, которые содержат микротрубочки), используемых для питания; на поверхности клеток имеются минерализованные (кремнеземные или известковые) чешуйки. Эта супергруппа включает один отдел водорослей (Haptophyta) (ранее относившийся к Chromalveolata или к группе Incertae sedis), группу некультивируемых, но фотосинтезирующих организмов, названных раппемонады (Rappemonads) (табл. 1), а также гетеротрофных центрохелидных солнечников (Centrohelida) (рис. 8).
Отдел Prymnesiophyta, Haptophyta (примнезиофитовые водоросли, гаптофитовые водоросли, примнезиофиты, гаптофиты) – одноклеточные формы; хлоропласт с четырьмя мембранами (внешняя мембрана хлоропласта может переходить во внешнюю мембрану ядра), трехтилакоидные ламеллы (рис. 11a); содержат хлорофиллы a и с (хлорофилл с может быть в разных сочетаниях форм с1, с2 и с3); дополнительные фотосинтетические пигменты – каротиноиды (фукоксантин, β-каротин, диатоксантин, диадиноксантин и др.).
Рис. 11.
Хлоропласты Haptista, Cryptista и Discoba. a – гаптофитовые водоросли, b – криптофитовые водоросли, c – эвгленовые водоросли.
1 – строма, 2 – мембрана хлоропластного ЭПР, 3 – мембраны собственно хлоропласта, 4 – тилакоид, 5 – пиреноид, 6 – рибосомы, 7 – часть хлоропластного ЭПР, переходящего во внешнюю мембрану ядра, 8 – перипластидное пространство, 9 – нуклеоморф, 10 – крахмал.
Fig. 11. Chloroplasts of Haptista, Cryptista and Discoba. a – haptophytes, b – cryptophytes, c – euglenophytes.
1 – stroma, 2 – membrane of chloroplast ER, 3 – membranes of chloroplast, 4 – thylakoid, 5 – pyrenoid, 6 – ribosome, 7 – part of chloroplast ER, continuous with outer nuclear membrane, 8 – periplastidial space, 9 – nucleomorph, 10 – starch.

Rappemonads – некультивируемые микроскопические морские и пресноводные фотосинтезирующие организмы; клетки содержат 2–4 пластиды; хлорофилл а; группа крайне мало изученная (до настоящего времени не описано ни одного вида и рода) (подробнее см. Kim et al., 2011).
CRYPTISTA – супергруппа, близкая к супергруппе Archaeplastida (вопрос о включении Cryptista в Archaeplastida остается дискуссионным). Из фотосинтезирующих представителей включает один отдел Cryptophyta (ранее относившийся к Chromalveolata или к группе Incertae sedis) (табл. 1), а также гетеротрофных Katablepharidа и Palpitomonas (рис. 8).
Отдел Cryptophyta (криптофитовые водоросли, криптофиты, криптомонады) – одноклеточные формы; хлоропласт с четырьмя мембранами (внешняя мембрана хлоропласта может переходить во внешнюю мембрану ядра), между двумя внешними и двумя внутренними мембранами хлоропласта (в перипластидном пространстве) содержатся нуклеоморф и эукариотные рибосомы, ламеллы двух-трехтилакоидные (рис. 11b); содержат хлорофиллы a и с2; дополнительные фотосинтетические пигменты – каротиноиды (α-, β-каротин, зеаксантин, аллоксантин и др.) и фикобилипротеины (фикоэритрин или фикоцианин), не собранные в фикобилисомы, а расположенные внутри тилакоидов; запасные продукты – крахмал (откладывается между второй и третьей мембранами хлоропласта, в перипластидном пространстве), липиды (откладываются в цитоплазме).
EXCAVATA – одноклеточные организмы; многие представители имеют цитостом и пищевую борозду.
Первоначально супергруппа Excavata была выделена на основе морфологии (форме пищевой борозды и связанной с ней системой цитоскелета). Основываясь на молекулярно-генетических данных, в Excavata были выделены 3 монофилетические клады (Discoba, Metamonada и Malawimonadida), которые не всегда объединяли в одну группу. В настоящее время Excavata рассматривается как парафилетическая группа (Burki et al., 2020) (рис. 8). В работе G. Lax et al. (2018) Discoba выделяется в отдельную мега-группу (наряду с Amorphea+ и Diaphoretikes), а Metamonada и Malawimonadida отнесены в группу Amorphea+, в то время как Adl et al. (2019) рассматривают Excavata как группу Incertae sedis.
Discoba – клетки имеют митохондрии с дисковидными кристами. Из представителей, имеющих пластиды, к Discoba относится один отдел – Euglenophyta (табл. 1).
Отдел Euglenophyta (эвгленовые водоросли, эвгленофиты) – одноклеточные формы; хлоропласт с тремя мембранами, трехтилакоидные ламеллы (рис. 11c); содержат хлорофиллы a и b; дополнительные фотосинтетические пигменты – каротиноиды (β-каротин, неоксантин и др.); запасной продукт – парамилон (откладывается в цитоплазме).
ЗАКЛЮЧЕНИЕ
Биоразнообразие водорослей оценить весьма сложно; по приблизительным оценкам эта группа насчитывает от 30 тысяч до более одного миллиона видов (Guiry, 2012). К сожалению, невозможно перечислить всех тех, кто внес вклад в изучение этой группы, однако, благодаря их усилиям, на протяжении всей истории развития альгологии происходило постоянное накопление различных данных о той или иной таксономической группе водорослей. Знаковой для понимания эволюции водорослей стала теория симбиогенеза, родоначальником которой был русский ученый К.С. Мережковский, и которую возродила американский ученый Л. Маргулис. Именно происхождение хлоропластов водорослей, и, соответственно, их строение, является одним из важнейших признаков для характеристики определенной таксономической группы, хотя установление эволюционной истории пластид и выяснение их родственных связей все еще требует дополнительных исследований. Очевидно, что это важно не только для понимания эволюции разных групп водорослей, но и основных эволюционных событий других эукариот в целом. В зависимости от развития разных методов и подходов к изучению организмов, менялись и взгляды исследователей на систему органического мира и положение в ней групп водорослей. Со времен основания систематики, ученые пытались строить классификации, отражающие эволюционные отношения между таксонами. На сегодняшний день, среди десяти выделяемых монофилетических супергрупп эукариот (см. Burki et al., 2020), к пяти из них относятся водоросли (TSAR, Haptista, Cryptista, Archaeplastida, и Discoba). Несмотря на значительный прогресс в области молекулярной филогенетики, очевидно, что нельзя игнорировать цитологические и морфологические признаки организмов. Без адекватных знаний о строении и образе жизни водорослей невозможно правильно интерпретировать построенные филогенетические деревья. Тем более, что к настоящему времени далеко не для всех групп водорослей имеются надежные данные относительно их родства с другими группами. Очевидно, что имеющиеся к настоящему времени филогенетические реконструкции не являются окончательными и могут быть в большей или меньшей степени пересмотрены в недалеком будущем.
“Как и все филогенетические системы и классификации, эта может быть только предварительной. Ее следует считать “рабочим документом”. Любая критика и комментарии активно приветствуются, поскольку существуют проблемы, решение которых полностью зависит от сотрудничества между знающими и заинтересованными людьми” (Margulis, 1974: 67).
Список литературы отсутствует.
Дополнительные материалы отсутствуют.
Инструменты
Ботанический журнал


