Ботанический журнал, 2021, T. 106, № 3, стр. 239-254
ФОРМИРОВАНИЕ ЗАРОДЫШЕВОГО МЕШКА, РАЗВИТИЕ СЕМЯЗАЧАТКА И СЕМЕНИ У HELIANTHUS CILIARIS И H. TUBEROSUS (ASTERACEAE)
О. Н. Воронова 1, *, А. А. Бабро 1, **
1 Ботанический институт им. В.Л. Комарова РАН
197376 Санкт-Петербург, ул. Проф. Попова, 2, Россия
* E-mail: o_voronova@binran.ru
** E-mail: ABabro@binran.ru
Поступила в редакцию 15.09.2020
После доработки 01.11.2020
Принята к публикации 10.11.2020
Аннотация
Исследовались процессы формирования зародышевого мешка, развития семязачатка и семени, начиная со стадии одноядерной мегаспоры до формирования семени, у двух видов многолетних подсолнечников Helianthus ciliaris DC и H. tuberosus L.
У обоих видов выявлено сходство в формировании зародышевого мешка и окружающих структур. Халазальная мегаспора дает начало зародышевому мешку Polygonum-типа, который имеет особенность в развитии антиподальных клеток, приводящую к формированию только двух антипод, одна из которых двуядерная. Нуцеллус дегенерирует рано и к началу формирования зародышевого мешка представлен единичными базальными клетками. Интегумент дифференцируется на две хорошо различимые зоны: внутреннюю и наружную. Эпидермис внутренней зоны преобразуется в интегументальный тапетум. Сосудистый пучок входит в халазу и повторяет изгиб семязачатка, доходя до уровня антипод в зародышевом мешке. При отсутствии оплодотворения зародышевый мешок сохраняется в течение длительного времени, при этом интегументальный тапетум становится многослойным.
Наблюдалось формирование зародышей от глобулярной до торпедовидной стадии. Эндосперм нуклеарный. Отмечалось формирование зародыша и в отсутствии эндосперма, при этом интегументальный тапетум сохранялся и становился многослойным.
Род Helianthus L. относится к семейству Asteraceae L., трибе Heliantheae Cass, подтрибе Helianthinae Dumort. (The Families and Genera…, 2007). Род Helianthus L. весьма полиморфный и включает в себя, по оценкам разных систематиков, от 10 до 254 видов (Gavrilova, Anisimova, 2003). Наиболее распространенной среди исследователей подсолнечника является классификация E.E. Schilling и C.B. Heiser (1981), в которой выделено 12 однолетних и 36 многолетних видов, произрастающих в Северной Америке и распределенных в 5 секций. Особенности эмбриологии и репродуктивной биологии большинства видов Helianthus практически не исследовались, исключение составляют хозяйственно-ценные виды. Среди однолетних видов наиболее изучены культурные формы (сорта, линии) однолетнего подсолнечника Helianthus annuus L., среди многолетних – топинамбура H. tuberosus L.
Межвидовые скрещивания культурного подсолнечника с дикими видами этого рода используются в селекционной работе для улучшения высокопродуктивных масличных сортов, а также для выведения декоративных сортов и гибридов. Но в этом процессе есть определенные трудности. Межвидовые гибриды крайне нестабильны и дают расщепление в последующих поколениях, что приводит к затруднениям в их поддержании и сохранении их признаков. В то же время, есть данные о наличии у культурного подсолнечника таких форм апомиксиса, как апоспория и интегументальная эмбриония (Ustinova, 1955, 1970; Voronova, Gavrilova, 2007; Voronova, 2010, 2013). Апоспорические образования обнаружены также у топинамбура (Dziubenko, 1965). Апомиксис, как возможность формирования семян бесполым путем, мог бы способствовать решению целого ряда селекционных задач.
Нами было начато эмбриологическое исследование некоторых диких видов подсолнечника и изучено развитие мужской репродуктивной сферы у двух представителей рода Helianthus L.: H. tuberosus L. и H. ciliaris DC (Babro, Voronova, 2018). У этих же видов были исследованы ранние стадии развития семязачатка и заложение репродуктивных структур до стадии завершения мейоза в мегаспороците и формирования мегаспоры (Voronova, Babro, 2018).
Данная статья является продолжением вышеуказанных работ по исследованию эмбриологии подсолнечника и посвящена, главным образом, исследованию процессов формирования зародышевого мешка, а также затрагивает этапы развития семязачатка и семени у H. tuberosus и H. cilia-ris, начиная со стадии мегаспоры и до формирования зародыша.
МАТЕРИАЛ И МЕТОДЫ
Объектами исследования стали подсолнечник клубненосный, или топинамбур, Helianthus tuberosus L. и подсолнечник реснитчатый H. ciliaris DC. Эти два вида относятся к разным секциям (Divaricati и Ciliares, соответственно) в пределах рода Helianthus семейства Asteraceae (Schilling, Heiser, 1981). Оба вида относятся к группе диких многолетних подсолнечников, но значимо различаются по размерам и времени цветения, а также по числу хромосом: H. tuberosus – гексаплоид с числом хромосом 2n = 102, H. ciliaris – тетраплоид с 2n = 68.
Материал по H. ciliaris был собран на Кубанской опытной станции ВИР (45°21' с.ш. и 40°80' в.д.), где поддерживается коллекция диких однолетних и многолетних видов подсолнечника, H. tuberosus – в Ботаническом саду БИН РАН. Растения произрастали в условиях свободного (перекрестного) опыления, без изоляции.
Целые корзинки на разных стадиях развития были собраны и зафиксированы в растворе FAA (формалин, ледяная уксусная кислота и 70% этанол в отношении 7:7:100). Материал дегидратировали через серию спиртов, проводили через ряд этанол-хлороформных смесей до чистого хлороформа и заключали в Histomix® (Биовитрум), постоянные препараты для световой микроскопии окрашивали несколькими красителями в разных комбинациях (более подробно методики описаны в статье Voronova, Babro, 2018).
Для ускоренного анализа материала использовался метод просветления тотальных препаратов семязачатков и семян (Voronova, 2008b).
Препараты анализировались и фотографировались с помощью микроскопа Zeiss Axioplan 2 Imaging с цифровой фотокамерой в программе AxioVision.
РЕЗУЛЬТАТЫ
У обоих исследованных видов формирование зародышевого мешка и развитие семязачатка идет сходным образом.
В результате мегаспорогенеза из мегаспороцита формируется тетрада мегаспор. Три верхние (микропилярные) вскоре дегенерируют, а нижняя (халазальная) продолжает развитие и дает начало формированию зародышевого мешка (рис. 1, 1, 2).
Рис. 1.
Завершение мегаспорогенеза и начало развития зародышевого мешка.
1 – часть семязачатка с функционирующей мегаспорой и остатками дегенерировавших мегаспор, 2 – часть семязачатка на стадии дифференциации мегаспоры в одноядерный зародышевый мешок, 3a – завязь с семязачатком на стадии двуядерного зародышевого мешка (срез радиальный, общий вид), 3b – часть семязачатка с двуядерным зародышевым мешком сразу после митоза, ядра лежат рядом, 4, 5 – часть семязачатка с двуядерным зародышевым мешком, ядра разошлись на противоположные полюса зародышевого мешка.
Helianthus ciliaris: 2, 3a, 3b, 4; Helianthus tuberosus: 1, 5.
b c – базальная клетка, ch – халаза, d ms – дегенерирующая мегаспора, e c – эпидермальная клетка, e s – зародышевый мешок, in – интегумент, i t – интегументальный тапетум, m – микропиле, ms – мегаспора, n – ядро зародышевого мешка, o – завязь, ov – семязачаток, t c – таблитчатые клетки.
Шкала: 3a – 100 мкм; 1, 2, 3b, 4, 5 – 20 мкм.
Fig. 1. Completion of megasporogenesis and initial stages of embryo sac development.
1 – the ovule’s part containing functional megaspore and residuals of degenerated ones; 2 – the ovule at the stage of megaspore differentiation into the uninuclear embryo sac (fragment), 3a – ovary with ovule at the stage of 2-nuclear embryo sac (radial section, general view), 3b – the part of ovule with 2-nucleate embryo sac directly after mitosis; the nuclei lie side by side, 4, 5 – the part of ovule with 2-nuclear embryo sac; the nuclei already have moved to the opposite poles of the embryo sac.
Helianthus ciliaris: 2, 3a, 3b, 4; Helianthus tuberosus: 1, 5.
b c – basal cell, ch – chalaza, d ms – degenerating megaspore, e c – epidermal cell, e s – embryo sac, in – integument, i t – integumental tapetum, m – micropyle, ms – megaspore, n – embryo sac nucleus, o – ovary, ov – ovule, t c – table-like cells.
Scale bars: 3a – 100 μm; 1, 2, 3b, 4, 5 – 20 μm.
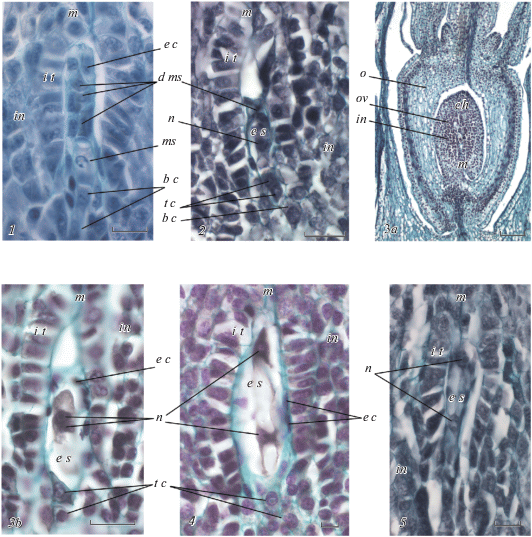
Халазальная мегаспора претерпевает процесс дифференциации. Она увеличивается в размерах, вытягивается, заполняя практически все пространство, где ранее располагалась тетрада мегаспор. Ядро в ней становится более четко выраженным и смещается из центра клетки в слегка асимметричное положение, чуть ближе к микропилярному концу. Этот процесс также сопровождается вакуолизацией цитоплазмы.
В результате первого митотического деления зародышевый мешок становится двуядерным (рис. 1, 3b). Ядра расходятся в разные стороны – одно оказывается в микропилярной части, второе несколько смещается в сторону халазального конца зародышевого мешка, но не достигает его, оказываясь в результате примерно посередине между центром клетки и ее халазальным концом (рис. 1, 4, 5). Второе деление митоза происходит несколько асинхронно. Халазальное ядро вступает в митотическое деление чуть быстрее микропилярного. Вследствие этого, зародышевый мешок на какой-то момент становится трехъядерным – в центре клетки уже два ядра, а на микропилярном полюсе ядро еще в процессе митоза (рис. 2, 3). Когда на микропилярном конце деление ядер заканчивается, то на халазальном ядра уже расходятся друг от друга, смещаясь так, чтобы расположиться вдоль продольной оси зародышевого мешка (рис. 2, 4, 5). Задержка деления на микропилярном полюсе позволяет ядрам на халазальном конце сместиться в нужные позиции перед третьим делением. В третье митотическое деление ядра вступают практически синхронно, результатом его является образование восьмиядерного зародышевого мешка (рис. 3, 1).
Рис. 2.
Завязь и семязачаток на стадии двуядерного-четырехъядерного зародышевого мешка.
1a – завязь и семязачаток во время второго митоза в зародышевом мешке (радиальный срез), 1b – халазальная часть семязачатка, 2 – завязь и семязачаток во время второго митотического деления в зародышевом мешке (тангентальный срез), 3 – часть семязачатка с зародышевым мешком, на халазальном полюсе которого митотическое деление ядер завершено, а на микропилярном – ядро в состоянии профазы митоза, 4, 5 – часть семязачатка с четырехъядерным зародышевым мешком.
Helianthus ciliaris: 3, 4; Helianthus tuberosus: 1a, 1b, 2, 5.
b c – базальная клетка, ch – халаза, e c – эпидермальная клетка, e s – зародышевый мешок, in – интегумент, i t – интегументальный тапетум, m – микропиле, n – ядро зародышевого мешка, o – завязь, ov – семязачаток, r t c – ряды таблитчатых клеток, v b – проводящий пучок.
Шкала: 1a, 1b, 2, – 100 мкм; 3, 4, 5 – 20 мкм.
Fig. 2. Ovary and ovule at the stage from 2- up to 4-nuclear embryo sac.
1a – ovary and ovule during the second mitosis in the embryo sac (radial section), 1b – chalazal part of the ovule, 2 – ovary and ovule during the second mitotic division in the embryo sac (tangential section), 3 – the part of ovule containing embryo sac with completed mitotic division of nuclei on its chalazal pole and the nucleus in the prophase of mitosis state on its micropylar pole, 4, 5 – the part of ovule containing 4-nuclear embryo sac.
Helianthus ciliaris: 3, 4; Helianthus tuberosus: 1a, 1b, 2, 5.
b c – basal cell, ch – chalaza, e c – epidermal cell, e s – embryo sac, in – integument, i t – integumental tapetum, m – micropyle, n – embryo sac nucleus, o – ovary, ov – ovule, r t c – rows of table-like cells, v b – vascular bundle.
Scale bars: 1a, 1b, 2 – 100 μm; 3–5 – 20 μm.
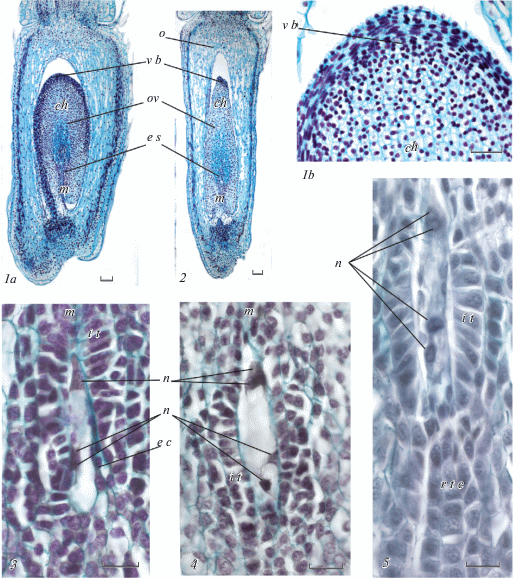
Рис. 3.
Поздние стадии формирования зародышевого мешка
1 – часть семязачатка с восьмиядерным зародышевым мешком сразу после третьего митотического деления ядер, 2 – микропилярная часть зародышевого мешка с формирующимся яйцевым аппаратом и еще не слившимися полярными ядрами, 3 – зрелый зародышевый мешок, 4 – халазальная часть зрелого зародышевого мешка с двумя антиподальными клетками, в верхней видны два ядра, вокруг каждого из них обособлена цитоплазма, но нет клеточной перегородки, 5 – халазальная часть зрелого зародышевого мешка с двумя антиподальными клетками, в верхней видны два огромных ядра с перетяжкой между ними, 6 – халазальная часть зрелого зародышевого мешка с двумя антиподальными клетками, в верхней клетке видны метафазные пластинки делящихся ядер, 7 – зрелый зародышевый мешок после опыления: видны потемневшая синергида и спермии в цитоплазме центральной клетки, 8 – часть семязачатка с интегументальным тапетумом и эпидермальными клетками нуцеллуса, в котором зародышевый мешок не сформировался.
Helianthus ciliaris: 1, 2, 3, 5, 6, 7; Helianthus tuberosus: 4, 8.
a c – антиподальная клетка, с с n – ядро центральной клетки, e a – яйцевой аппарат, e с – яйцеклетка, i t – интегументальный тапетум, i z i – внутренняя зона интегумента, m – микропиле, n – ядро зародышевого мешка, o z i – наружная зона интегумента, p l s – постаменто-подобная структура, p n – полярное ядро, s – синергида, s h – синергидный крюк, sp – спермий.
Стрелка указывает на перемычку между ядрами в антиподе.
Шкала: 1, 2, 3, 4, 7, 8 – 20 мкм; 5, 6 – 10 мкм.
Fig. 3. The later developmental stages of the embryo sac
1 – the part of the ovule with 8-nuclear embryo sac just after the third mitotic division of the nuclei, 2 – micropylar part of the embryo sac with a forming egg apparatus and still unfused polar nuclei, 3 – mature embryo sac, 4 – the chalazal part of a mature embryo sac with two antipodal cells; two nuclei with separated cytoplasm around each of them but without cell wall between them can be seen in the upper antipodal cell, 5 – the chalazal part of a mature embryo sac with two antipodal cells; two enormous nuclei with a constriction between them can be seen in the upper antipodal cell, 6 – the chalazal part of a mature embryo sac with two antipodal cells; the metaphase plates of the dividing nuclei are seen in the upper one, 7 – the mature embryo sac after pollination: the darkened synergid and the sperms in the cytoplasm of the central cell are seen, 8 – the fragment of the ovule in which the embryo sac did not form, with integumental tapetum and epidermal cells of nucellus.
Helianthus ciliaris: 1–3, 5–7; Helianthus tuberosus: 4, 8.
a c – antipodal cell, с с n – central cell’s nucleus, e a – egg apparatus, e с – egg cell, i t – integumental tapetum, i z i – inner zone of integument, m – micropyle, n – embryo sac’s nucleus, o z i – outer zone of integument, p l s – postament-like structure, p n – polar nucleus, s – synergid, s h – synergid hook, s p – sperm.
The arrow points to the constriction between nuclei in the antipodal cell.
Scale bars: 1–4, 7, 8 – 20 μm; 5, 6 – 10 μm.
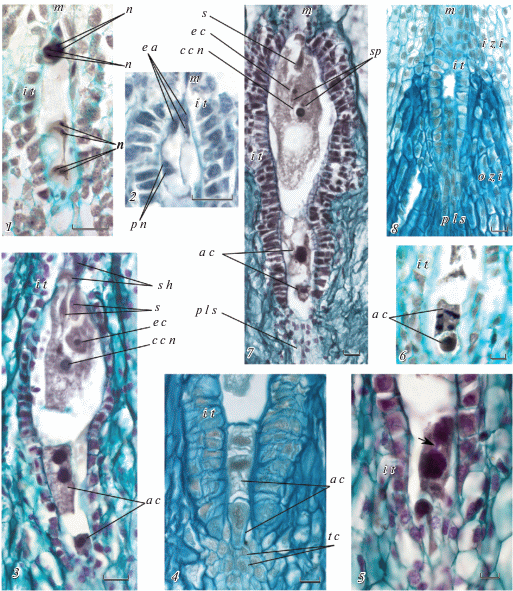
На микропилярном полюсе, после заложения клеточных перегородок между всеми только что образовавшимися ядрами, формируется трехклеточный яйцевой аппарат (рис. 3, 2). В дальнейшем его клетки дифференцируются в яйцеклетку и две синергиды (рис. 3, 3).
На халазальном полюсе зародышевого мешка клеточные перегородки закладываются между только что поделившимися ядрами, но не между ядрами соседних пар. В нижней части зародышевого мешка формируется одноядерная антипода, над ней – двуядерная антипода, выше которой располагается второе полярное ядро центральной клетки, которое быстро смещается в центр. Полярные ядра сначала располагаются в середине центральной клетки зародышевого мешка, а затем перемещаются вплотную к яйцевому аппарату и сливаются друг с другом (рис. 3, 2, 3).
Сформированный антиподальный аппарат у исследованных видов состоит из двух клеток, которые располагаются друг над другом. Лишь в единичных случаях наблюдалось формирование трех антипод. Нам удалось обнаружить в одном из зрелых зародышевых мешков интересный случай – картину промежуточного состояния между двух- и трехклеточным антиподальным аппаратом. Два верхних ядра антипод обособлены друг от друга, четко видно и обособление цитоплазмы каждого из них, но при этом между ними нет полисахаридной (окрашивающейся алциановым синим) клеточной перегородки (рис. 3, 4).
Ядра антипод могут делиться в дальнейшем и после заложения клеточных перегородок, что приводит к увеличению их плоидности (рис. 3, 6). Заложения клеточных перегородок не происходит, а вновь образующиеся ядра сливаются, что приводит к образованию одного огромного бесформенного ядра с множеством ядрышек. Мы наблюдали образование своеобразных “перемычек” между ядрами в верхней (микропилярной) дву-ядерной клетке антипод (рис. 3, 5), в отдельных случаях, ядро может приобретать гантелевидную или 8-образную форму. Халазальная антипода обычно некрупная, и в зрелом зародышевом мешке она треугольной или клиновидной формы. Микропилярная антипода удлиненная, может достигать значительных размеров и быть сопоставимой по длине с центральной клеткой. Обе антиподы довольно сильно вакуолизированы (рис. 3, 3, 4, 5, 7; рис. 4, 8).
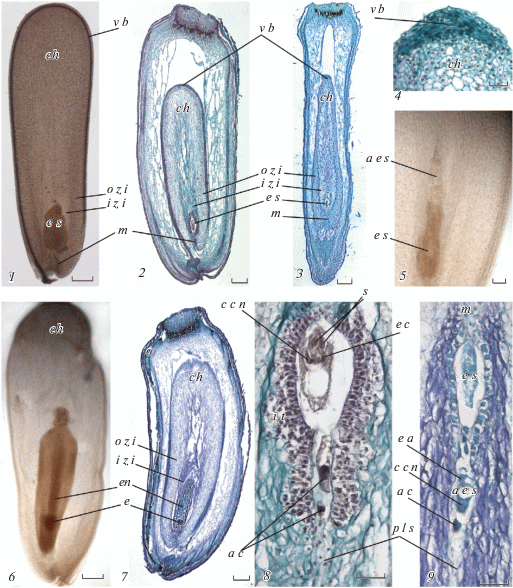
Рис. 4.
Завязь и семязачаток к моменту опыления и дальнейшие изменения в их структурах.
1 – семязачаток со зрелым зародышевым мешком к моменту опыления (тотальный препарат, просветление), 2 – завязь с семязачатком и зрелым зародышевым мешком к моменту опыления (радиальный срез), 3 – завязь с семязачатком и зрелым зародышевым мешком к моменту опыления (тангентальный срез), 4 – халазальная часть семязачатка, 5 – часть семязачатка с основным и апоспорическим зародышевыми мешками (тотальный препарат, просветление), 6 – семязачаток с зародышем и эндоспермом (тотальный препарат, просветление), 7 – завязь с дегенерирующим семязачатком и развивающимся зародышем и эндоспермом (радиальный срез), 8 – часть семязачатка с многослойным интегументальным тапетумом и стареющим зародышевым мешком в отсутствии опыления, 9 – часть семязачатка с основным и апоспорическим зародышевыми мешками.
Helianthus ciliaris: 1, 2, 5, 6, 7, 8, 9; Helianthus tuberosus: 3, 4.
a c – антиподальная клетка, a e s – апоспорический зародышевый мешок, с с n – ядро центральной клетки, ch – халаза, e – зародыш, e a – яйцевой аппарат, e с – яйцеклетка, en – эндосперм, i t – интегументальный тапетум, i z i – внутренняя зона интегумента, m – микропиле, n – ядро зародышевого мешка o z i – наружная зона интегумента, p l s – постаменто-подобная структура, p n – полярное ядро, s – синергида , v b – проводящий пучок.
Шкала: 1–4, 6, 7 – 200 мкм; 5, 8, 9 – 50 мкм.
Fig. 4. Ovary and ovule by the time of pollination and further changes in their structures.
1 – ovule with mature embryo sac by the time of pollination (whole mount, clearing), 2 – ovary with ovule and mature embryo sac by the time of pollination (radial section), 3 – ovary with ovule and mature embryo sac by the time of pollination (tangential section), 4 – chalazal part of the ovule, 5 – the part of the ovule with the main embryo sac and aposporic one (whole mount, clearing), 6 – ovule with embryo and endosperm (whole mount, clearing), 7 – ovary with degenerating ovule and with developing embryo and endosperm (radial section), 8 – ovule with multilayered integumental tapetum and senescent embryo sac in the absence of pollination, 9 – the part of the ovule with the main embryo sac and aposporic one.
Helianthus ciliaris: 1, 2, 5–9; Helianthus tuberosus: 3, 4.
a c – antipodal cell, a e s – aposporic embryo sac, с с n – central cell’s nucleus, ch – chalaza, e – embryo, e a – egg apparatus, e с – egg cell, en – endosperm, i t – integumental tapetum, i z i – inner zone of integument, m – micropyle, n – embryo sac’s nucleus, o z i – outer zone of integument, p l s – postament-like structure, p n – polar nucleus, s – synergid, v b – vascular bundle.
Scale bars: 1–4, 6, 7 – 200 μm; 5, 8, 9 – 50 μm.
По мере дальнейшего развития зародышевого мешка идет дифференциация клеток яйцевого аппарата. Ядро яйцеклетки увеличивается в размерах, по сравнению с ядрами синергид, оно смещается в апикальную область клетки, цитоплазма клетки вакуолизируется. Основная часть цитоплазмы и ядро располагаются в апикальной части, а в базальной находится крупная вакуоль. Яйцеклетка меняет форму с округлой на удлиненно-грушевидную. Ядра синергид мелкие, располагаются в центре клетки, вакуолизация цитоплазмы не выражена. Изначально синергиды имеют форму треугольника со сглаженными углами, по мере развития они довольно сильно вытягиваются. На базальных концах синергид формируются особые выпуклые структуры, называемые обычно крючьями (рис. 3, 3).
В средней части зародышевого мешка оказываются два полярных ядра, которые сливаются друг с другом до оплодотворения и формируют вторичное ядро центральной клетки зародышевого мешка. Ядро центральной клетки очень крупное, с хорошо различимым ядрышком, внутри которого наблюдаются более темные и более светлые структуры. Это ядро является самым крупным ядром зародышевого мешка и превосходит по своим размерам ядра соматических клеток – клеток интегумента и тканей завязи. Ядро центральной клетки располагается вблизи яйцеклетки. Центральная клетка – самая большая в зародышевом мешке. Она содержит несколько огромных вакуолей. Основная часть ее цитоплазмы сосредоточена вблизи яйцевого аппарата (рис. 3, 3, 7).
Таким образом, зрелый зародышевый мешок у исследованных видов состоит, как правило, из 6 клеток, 6 (редко – 7) ядер. Ядра яйцевого аппарата и нижней антиподы гаплоидные, ядро центральной клетки диплоидное, ядро верхней антиподы обычно диплоидное (рис. 3, 7), но иногда в ней бывает два гаплоидных ядра (рис. 3, 3).
По мере формирования и созревания зародышевого мешка претерпевают изменения и окружающие его структуры семязачатка.
Нуцеллус начинает дегенерировать уже во время мейоза в мегаспороците, к моменту формирования тетрады мегаспор он представлен только эпидермальным слоем и несколькими базальными клетками, расположенными под халазальной мегаспорой. Клетки латеральной области нуцеллуса дегенерируют в первую очередь, и даже их остатки редко наблюдаются позднее стадии мегаспорогенеза (Voronova, Babro, 2018). Клетки базальной области (таблитчатые клетки) сохраняются как минимум до стадии восьмиядерного зародышевого мешка, возможно, и дольше (рис. 3, 4). Эпидермальный слой нуцеллуса, в виде остатков единичных клеток, можно проследить до стадии 4-ядерного зародышевого мешка (рис. 1, 4, 5).
К началу формирования зародышевого мешка, интегумент уже хорошо развит. Ткани интегумента, расположенные в непосредственной близости к зародышевому мешку, дифференцируются в процессе развития на две хорошо различимые зоны (рис. 2, 1a, 2; рис. 4, 1, 2, 3, 7).
Первая зона – это внешняя часть интегумента, которая состоит из более-менее однородных паренхимных клеток, не очень крупных по размеру, расположенных ровными слоями (рис. 4, 2, 3, 7). Она сохраняется довольно долго и наблюдается до стадии зрелого семени (рис. 5, 3a, 3b, 4, 5, 6).
Рис. 5.
Формирование зародыша и семени у Helianthus ciliaris.
1 – часть семязачатка с зародышевым мешком, в котором видна зигота и ядро центральной клетки с примкнувшим к ней спермием (поперечный срез), 2 – рыльце пестика с прорастающей на нем пыльцой, в одной пыльцевой трубке видны спермии, 3a – завязь (формирующееся семя) с глобулярным зародышем, 3b – часть семязачатка с разрушающейся внутренней зоной интегумента, многослойным интегументальным тапетумом, зародышем и четырьмя ядрами эндосперма, 4 – часть семязачатка с разрушающейся внутренней зоной интегумента, сердечковидным зародышем и клеточным эндоспермом, 5 – формирующееся семя с торпедовидным зародышем (видна часть зародыша) с разрушающимся эндоспермом, 6 – формирующееся семя с зародышем, видны остатки интегуметального тапетума.
a c – антиподальная клетка, с с n – ядро центральной клетки, e – зародыш, en – эндосперм, e s – зародышевый мешок, i t – интегументальный тапетум, i z i – внутренняя зона интегумента, o – завязь, o z i – наружная зона интегумента, p g – пыльцевое зерно, p t – пыльцевая трубка, z – зигота.
Шкала: 3a, 5, 6 – 200 мкм; 4 – 100 мкм; 3b – 50 мкм; 1, 2 – 20 мкм.
Fig. 5. Embryo and seed formation in Helianthus ciliaris.
1 – the ovule part with the embryo sac, in which the zygote and central cell’s nucleus with an attached sperm are seen (transverse section), 2 – the stigma with pollen germinating on it; sperms can be seen in one of the pollen tubes, 3a – ovary (developing seed) with globular embryo, 3b – the ovule part with disintegrating inner zone of integument and with multilayered integumental tapetum, embryo and four nuclei of endosperm, 4 – the ovule part with disintegrating inner zone of integument and with heart-shaped embryo and cellular endosperm, 5 – developing seed with torpedo-shaped embryo (part of the embryo is seen) and disintegrating endosperm, 6 – developing seed with embryo, residuals of integumental tapetum are seen.
a c – antipodal cell, с с n – central cell’s nucleus, e – embryo, en – endosperm, e s – embryo sac, i t – integumental tapetum, i z i – inner zone of integument, o – ovary, o z i – outer zone of integument, p g – pollen grain, p t – pollen tube, z – zygote.
Scalebars: 3a, 5, 6 – 200 μm; 4 – 100 μm; 3b – 50 μm; 1, 2 – 20 μm.
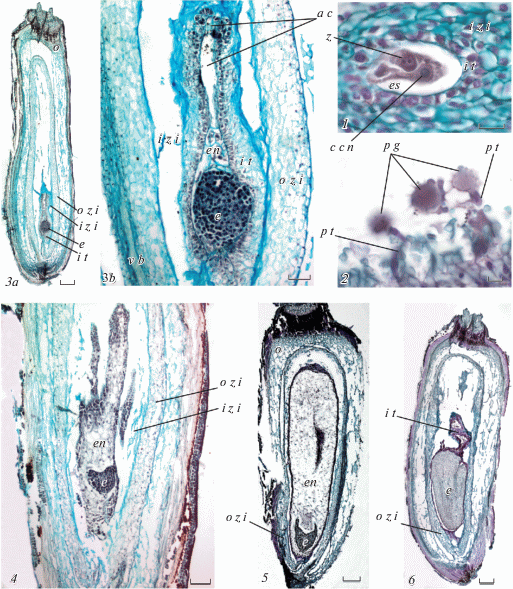
Вторая зона – это внутренняя часть интегумента, в которой клетки сильно вытягиваются, а в зоне зародышевого мешка начинают разрушаться. Оболочки клеток ослизняются, ядра становятся неразличимыми. Эта часть интегумента интенсивно окрашивается алциановым синим и некоторыми другими красителями (рис. 4, 2, 3, 7). К моменту созревания зародышевого мешка внутренняя часть интегумента визуально значительно отличается от внешней его части. Эта зона интегумента практически вся разрушается ко времени формирования зародыша (рис. 5, 3a, 3b, 4).
Эпидермальные клетки внутренней зоны, непосредственно примыкающие к зародышевому мешку, дифференцируются в интегументальный тапетум (эндотелий). Первые признаки формирования эндотелия появляются еще во время начала мейоза в мегаспороците, в дальнейшем они становятся заметнее (рис. 1, 1, 2). Клетки интегументального тапетума имеют слегка трапециевидную уплощенную форму, более узкой стороной они обращены к зародышевому мешку. Стенки клеток утолщенные, на них откладывается каллоза, особенно мощный слой формируется со стороны зародышевого мешка (рис. 2, 5). В дальнейшем, ядра клеток интегументального тапетума увеличиваются, вероятно, полиплоидизируются, в них просматривается по несколько ядрышек. Ко времени созревания зародышевого мешка в клетках тапетума начинаются периклинальные деления, что приводит к появлению второго слоя, а продолжение делений – и к появлению многослойности (рис. 3, 3, 7).
Внутренняя часть интегумента, по мере развития семязачатка, подвергается полной деструкции (рис. 5, 3a, 3b, 4), которая не касается лежащих рядом клеток интегументального тапетума. Интегументальный тапетум, с его сильно утолщенными каллозными оболочками клеток вдоль границы с зародышевым мешком, представляет собой своеобразный барьер между веществами из разрушающихся клеток внутренней части интегумента и клетками зародышевого мешка.
Клетки, относящиеся к базальной области нуцеллуса и располагающиеся под зародышевым мешком, также изменяются (рис. 1, 2, 3b, 4). На ранних этапах они выглядели как несколько рядов таблитчатых клеток. По мере роста семязачатка эти клетки сильно вытягиваются в длину вдоль его продольной оси (рис. 2, 5). Формируется структура, которая подобна постаменту, характерному для крассинуцеллятных семязачатков, но выявляется она только на ранних стадиях развития, до формирования зародышевого мешка (Voronova, Babro, 2018). На поздних стадиях развития, к моменту созревания зародышевого мешка, сохраняется только небольшая колонка из мелких клеток со светлой цитоплазмой, расположенных под зародышевым мешком (рис. 3, 7, рис. 4, 8, 9). Проводящего пучка эта структура не достигает, замещаясь крупными паренхимными клетками (рис. 4, 2, 3), и на халазальном конце семязачатка не обнаруживается (рис. 4, 2, 4). Остатки этой структуры отмечаются до оплодотворения и окончательно разрушаются после оплодотворения вместе со всей внутренней зоной интегумента (рис. 5, 3a, 6).
В процессе роста семязачаток изгибается в анатропное положение и к началу микроспорогенеза микропиле оказывается обращенным к фуникулусу (рис. 1, 3a).
Через весь интегумент проходит сосудистый пучок, который входит через халазу и почти полностью повторяет изгиб семязачатка, доходя до уровня зародышевого мешка с противоположной стороны (рис. 2, 1a, 1b, 2, рис. 4, 1, 2, 3, 4).
На месте, где ранее ряды таблитчатых клеток подходили к сосудистому пучку, а также вокруг самого пучка формируется плотная мелкоклеточная ткань, которая без резкой границы переходит в довольно рыхлую паренхимную ткань внутренней части интегумента (рис. 2, 1b, рис. 4, 4).
Увидеть детальные картины процесса вхождения спермиев в зародышевый мешок и оплодотворения на нашем материале не удалось. Мы наблюдали прорастание пыльцы на рыльце (рис. 5, 2); ядра генеративных клеток, окрашенных реактивом Фельгена, в цитоплазме центральной клетки вблизи яйцеклетки у H. tuberosus, присутствие следов пыльцевой трубки и ядра спермия в цитоплазме центральной клетки вблизи от ее ядра (рис. 3, 7) и зиготу (рис. 5, 1) у H. ciliaris.
На более поздних стадиях развития мы наблюдали как семязачатки со стареющими разрушающимися зародышевыми мешками, в которых не произошло оплодотворения (рис. 4, 8), так и развивающиеся семена с формирующимися зародышами (рис. 5, 3a, 3b, 4, 5, 6).
При отсутствии оплодотворения зародышевый мешок мог существовать продолжительное время. При этом его основные элементы сохранялись без заметных признаков дегенерации. В то же время, в интегументальном тапетуме отмечались интенсивные клеточные деления, которые приводили к увеличению количества его слоев до 7–8. Тапетальная ткань становилась довольно массивной, в ней формировались складки и выпячивания, которые сжимали зародышевый мешок, что придавало ему форму восьмерки (рис. 4, 8).
Мы наблюдали формирующиеся зародыши на стадиях от глобулярной до торпедовидной. В семенах, где отмечалось присутствие зародышей, интегументальный тапетум оставался одно-двухслойным (рис. 5, 4) и не достигал такого массивного многослойного состояния, как в тех, где зародыши не выявлялись.
Развитие зародышей не всегда сопровождалось формированием эндосперма. Отмечались случаи, когда в семязачатке эндосперм был слабо развит или совсем не наблюдался. Интересно отметить, что при наличии зародыша в сочетании со слабым развитием или с отсутствием эндосперма формировалась довольно массивная ткань интегументального тапетума (рис. 5, 3a, b).
У H. ciliaris было выявлено формирование дополнительных апоспорических зародышевых мешков (примерно 5% от общего количества изученных семязачатков). Апоспорические зародышевые мешки располагались за основным зародышевым мешком, вне зоны интегументального тапетума, имели нерегулярную форму и набор элементов, сходный по составу с основным зародышевым мешком (рис. 4, 5, 9).
У H. tuberosus было выявлено несколько семязачатков, где женский гаметофит не формировался. Вместо мегаспор или зародышевого мешка в середине семязачатка под слоем эпидермиса обнаруживалось несколько сжатых клеток без выраженной структуры, окруженных интегументальным тапетумом (рис. 3, 8).
ОБСУЖДЕНИЕ
Строение женских репродуктивных структур и процессы их развития на поздних стадиях (после мейоза в мегаспороците) в целом оказались сходны у обоих изученных видов – H. ciliaris и H. tuberosus – и сопоставимы с таковыми у H. annuus и у других ранее исследованных видов подсолнечника (Ustinova, 1964; Newcomb, 1973a,b; Toderich, 1988; Gotelli et al., 2008; Voronova, 2013, 2014). Основные эмбриологические характеристики данных видов, как и ожидалось, соотносят их с представителями трибы Heliantheae (Maheswari, 1963) и семейства Asteraceae в целом (Solntseva, 1987).
Семязачаток у подсолнечников анатропный, унитегмальный с интегументальным тапетумом. Хотя в сформированном виде семязачаток подсолнечника по строению интегумента выглядит как унитегмальный, в нем отчетливо видна дифференциация интегументальной паренхимы на внутреннюю и наружную зоны, что может быть следствием объединения инициальных зон двух интегументов на самом раннем этапе (Shamrov, 2008). В этой связи можно упомянуть одну из ранних работ Е.И. Устиновой (Ustinova, 1947: 58) где она отмечала, что у гибридов подсолнечника с топинамбуром “наиболее развит внешний интегумент, а внутренний же виден только на очень ранних стадиях развития семяпочки, на поздних стадиях он обычно сливается с нуцеллусом”. Таким образом, она выделяла, пусть и недолго существующий, внутренний интегумент. Но в дальнейших своих работах автор подробно генезис интегументов не описывала, а семязачаток культурного подсолнечника характеризовала как унитегмальный (Ustinova, 1964).
По строению нуцеллуса семязачаток может быть классифицирован как медионуцеллятный (синдермальная вариация однослойная субвариация (Shamrov, 2008) с базальной зоной, представленной осевым рядом клеток, с выраженной латеральной зоной и интегументальным тапетумом.
В семязачатке формируется массивная халаза. Проводящий пучок ответвляется от фуникулярного пучка, тянется вдоль рафе, огибает халазу, повторяя изгиб семязачатка, и, проходя за границу интегумента и нуцеллуса, доходит до уровня антипод зародышевого мешка.
Интегументальный тапетум (эндотелий) к моменту созревания зародышевого мешка у подсолнечника может быть однослойным (Newcomb, 1973a; Voronova, 2013, 2014) или становится нерегулярно двуслойным у культурного подсолнечника (Toderich, 1988), а у H. rigidus и H. scaberrimus – 2–3 слойным, иногда достигая 4 слоев (Toderich, 1988). В то же время отмечается, что у подсолнечника сорта Передовик увеличение числа слоев интегументального тапетума происходит после оплодотворения (Newcomb, 1973a). У некоторых гибридов культурного подсолнечника и линии НА89 эндотелий может достигать толщины до 6 слоев, особенно в районе антипод (Gotelli et al., 2008), что отмечалось не только для H. annuus, но и для других представителей трибы Heliantheae (Maheswari, 1963).
У H. ciliaris и H. tuberosus интегументальный тапетум к моменту созревания зародышевого мешка, как правило, однослойный, но вскоре число слоев увеличивается, и он может даже становиться многослойным, особенно массивным (до 5‒6 и более слоев) в случае отсутствия оплодотворения. Также массивный многослойный интегумент наблюдается в случаях, когда оплодотворение произошло, и зародыш начал формироваться, а развитие эндосперма тормозится. Возможно, что в этой ситуации интегументальный тапетум берет на себя функции эндосперма, связанные с обеспечением зародыша питательными веществами. Но также может быть, что он просто утилизирует метаболиты, предназначенные эндосперму, и за их счет продолжает наращивать число слоев.
Кроме формирования интегументального тапетума, наблюдалось морфологическое разделение интегумента на внешнюю и внутреннюю зоны. Подобная гетерогенная структура интегумента характерна не только для подсолнечника H. annuus (Newcomb, 1973 a, b), но отмечалась и у других видов, например у Taraxacum (Musial et al., 2013).
Для других сложноцветных также отмечалось такое глубокое, как у подсолнечника, проникновение сосудистого пучка в семязачаток, когда он проходит сквозь халазу и проникает в интегумент, почти достигая микропиле (Musial et al., 2013).
У исследованных видов ряды таблитчатых клеток под зародышевым мешком не столь четко выделяются в семязачатке, как, например, это было обнаружено у культурного подсолнечника (Vo-ronova, 2013, 2014) и характерно для некоторых других видов, например, для злаков (Modilevskii et al., 1958, Voronova et al., 2002, 2003). Тем не менее, некоторое подобие этой структуры присутствует непродолжительное время и в семязачатке подсолнечников. Уже к моменту формирования мегаспороцита эти ряды клеток начинают вытягиваться в продольном направлении, под зародышевым мешком формируется своеобразный клеточный тяж в виде узкой колонки, который может быть соотнесен с постаментом – структурой, наиболее характерной для крассинуцеллятных семязачатков, но встречающейся и среди медионуцеллятных (Shamrov, 2008).
Развитие зародышевого мешка, в целом, идет согласно Polygonum-типу, за исключением числа закладывающихся антиподальных клеток. В зрелом зародышевом мешке у исследованных видов мы наблюдали, в большинстве случаев, формирование только двух антипод. Антиподы располагались линейно.
Формирование только двух антипод и, соответственно, 6-клеточного зародышевого мешка отмечалось у культурного подсолнечника сорта Передовик (Newcomb, 1973a), у ряда гибридов и линий культурного подсолнечника (Teleżyńska, Teleżyński, 1973; Gotelli et al., 2008; Voronova, 2013, 2014), хотя и указывалось, что в отдельных случаях формировалось три (Ustinova, 1951, 1964; Vo-ronova, 2013, 2014) и даже четыре антиподы (Gotelli et al., 2008). Наличие преимущественно двух антипод отмечалось не только у подсолнечника, но и для многих других представителей семейства Asteraceae (Solntseva, 1987).
Зачастую авторы не обращают пристального внимания на точное количество антипод, отмечая лишь, что зародышевый мешок формируется согласно Polygonum-типу. Однако на представленных ими фотографиях хорошо видны две антиподы, она из которых двуядерная, как, например, у Ageratum fastigiatum (Franca et al., 2015). Gotelli с соавторами (Gotelli et al., 2008) не объясняли механизм образования двух клеток антипод, а количество ядер в них связывали со стадией развития женского гаметофита. В то же время, на предложенных в статье рисунках можно видеть такое же расположение ядер, как мы наблюдали у H. ci-liaris и H. tuberosus, когда после третьего митотического деления на халазальном конце зародышевого мешка между сестринскими ядрами закладывается клеточная перегородка, а между соседними парами ядер – нет. В итоге два средних ядра оказываются в одной антиподальной клетке, что принималось авторами за результат деления. В дальнейшем эти ядра сближаются и, вероятно, делятся еще несколько раз без клеткообразования, что приводит к многоядерному состоянию антиподальных клеток. Увеличение количества ядер или их плоидности в антиподальных клетках отмечалось не только у подсолнечника (Dziubenko, 1959, 1965; Ustinova, 1964; Gotelli et al., 2008 и др.), но и у других сложноцветных (Maheswari, 1963; Solntseva, 1987).
Мы считаем, что вышеописанная последовательность событий при формировании антипод характерна для подсолнечника в целом, но не все авторы согласны с этой точкой зрения. Л. К. Дзюбенко (Dziubenko, 1959) полагала, что у культурного подсолнечника изначально формируется всегда три антиподы, а после оплодотворения антиподы продолжают делиться, формируя многоклеточный антиподальный комплекс. Эту же точку зрения, но только в отношении диких видов, поддерживала Тодерич (Toderich, 1988), но при этом для культурного подсолнечника отмечала, что у него средняя антипода дегенерирует, и в итоге остаются две антиподальные клетки. Н.С. Беляева (Belyaeva, 1975) писала о присутствии трех антипод у топинамбура, а Дзюбенко (Dziubenko, 1965) отмечала, что у топинамбура иногда встречаются зародышевые мешки и с двумя антиподами.
Формирование яйцевого аппарата идет у обоих видов сходным образом и соответствует характерному для подсолнечника в целом. Обычно дискуссия разворачивается о наличии или отсутствии в синергидах таких элементов как нитчатый аппарат и так называемые синергидные крючья. Формирование нитчатого аппарата в синергидах мы не наблюдали. Ряд других авторов также не отмечали его наличия как у культурного и некоторых из диких видов (Teleżyńska, Teleżyński, 1973; Toderich, 1988), так и у H. tuberosus (Belyaeva, 1975). Это может быть связано с тем, что на светооптическом уровне исследования он не выявляется, в то время как обнаруживается при исследовании с помощью электронного микроскопа (Newcomb, 1973a; Yan et al., 1991), хотя у некоторых представителей Asteraceae, например, у Stifftia и Wunderlichia, хорошо заметный нитчатый аппарат отмечается при светомикроскопическом исследовании (Bonifácio et al., 2018). Мы четко видели присутствие выростов в форме крючьев на микропилярных концах синергид, которые также отмечались для подсолнечника большинством авторов (synergid hook или synergid hood) (Maheswari, 1963; Teleżyńska, Teleżyński, 1973; Newcomb, 1973a; Yan et al., 1991), за исключением Тодерич (Toderich, 1988). Gotelli с соавторами (Gotelli et al., 2008) о наличии крючьев у синергид не упоминают в тексте, но они хорошо видны на представленных в работе рисунках.
Сформированный зародышевый мешок долго сохраняется без изменений при отсутствии опыления. На исследованном нами материале оплодотворение отмечалось реже, чем старение и дегенерация зародышевого мешка. Это может быть связано как с самонесовместимостью, так и с недостаточным количеством или низким качеством пыльцы. Ранее отмечалось, что многолетние подсолнечники размножаются преимущественно вегетативно и завязывают мало семян.
Интересно отметить, что были обнаружены случаи формирования зародышей и слабого развития эндосперма – формировалось лишь несколько клеток. При этом как раз интегументальный тапетум был довольно массивным и многослойным. Возможно, он каким-то образом брал на себя функцию эндосперма или же просто использовал нереализованные пластические вещества.
В целом мы не обнаружили аномалий в формировании зародышевого мешка и в тех семязачатках, где произошло опыление и оплодотворение; аномалии в процессе развития зародыша и эндосперма были редки. При исследовании другими авторами культурного подсолнечника в качестве аномалий отмечалось развитие зародыша без эндосперма и эндосперма без оплодотворения яйцеклетки (Teleżyńska, Teleżyński, 1973).
В нашем исследовании нам не удалось детально проследить весь путь формирования зародыша, но имеющиеся данные говорят о том, что у исследованных видов подсолнечника эндосперм нуклеарный, а клеткообразование начинается на ранней стадии развития зародыша (4–8-клеточной по данным Newcomb, 1973b и Toderich, 1988). Эмбриогенез идет согласно Asterad-типу (Senecio-вариация), что отмечалось и ранее как для культурных (Voronova, 2013, 2014), так и для дикорастущих (Toderich, 1988) форм.
Для культурного подсолнечника ранее было отмечено формирование апоспорических зародышевых мешков (Voronova, 2006, 2008a; Voronova, Gavrilova, 2007; Voronova, 2013, 2014). Поэтому обнаруженные у H. ciliaris апоспорические образования не являются уникальными. Ранее мы уже описывали их более подробно и высказали предположение, что инициальные клетки апоспорических зародышевых мешков, вероятнее всего, происходят из той же субэпидермальной клетки примордия семязачатка, что и археспориальная клетка (Voronova, 2013, 2014; Voronova, Babro, 2019) и являются сестринскими по происхождению. Тем не менее, существует диаметрально противоположная точка зрения на происхождение апоспорических зародышевых мешков: они рассматриваются не как производные одной обособившейся клетки, а как группы распавшихся клеток интегумента, преобразующихся в синцитий (Ustinova, 1955).
В отдельных семязачатках H. tuberosus отмечалось полное отсутствие зародышевого мешка. В литературе отсутствие зародышевого мешка отмечалось лишь для тетраплоидных форм культурного подсолнечника (Efremov, 1967; Pustovoit et al., 1976). Авторы предположили, что зародышевый мешок не развивается по причине нарушения в мейозе (Pustovoit et al., 1976). Скорее всего, это так, но мы не обнаружили картин нарушений в мейозе или семязачатков с дегенерирующими мегаспороцитами, поэтому вопрос о том, что является причиной отсутствия зародышевого мешка в нормально сформированном семязачатке, остается до конца не ясным. В нашем исследовании все структуры семязачатка были нормально сформированы, фазы их развития и взаимное расположение элементов соответствовали стадии развития цветка. Ранее подобное отсутствие зародышевого мешка мы подробно описали у некоторых линий культурного подсолнечника (Voronova, 2006, 2008a).
Настоящее исследование и полученные ранее данные (Babro, Voronova, 2018, Voronova, Babro, 2018) позволяют говорить о том, что заложение и развитие как мужских, так и женских репродуктивных структур идет у H. ciliaris и H. tuberosus сходным образом и без значимых отклонений. В то же время отсутствие оплодотворения в большинстве случаев позволяет предположить, что низкая семенная продуктивность, отмеченная ранее для исследованных образцов, определяется самонесовместимостью и нарушениями при прорастании пыльцы.
Список литературы
[Babro, Voronova] Бабро А.А., Воронова О.Н. 2018. Развитие мужских репродуктивных структур у Helianthus ciliaris и H. tuberosus (Asteraceae). – Бот. журн. 103 (9): 1093–1108. https://doi.org/10.7868/S0006813618090028
[Belyaeva] Беляева Н.С. 1975. К вопросу стерильности топинамбура (развитие женского гаметофита). – Изв. Академии наук Туркменской ССР. Серия Биологические Науки. 4: 37–43.
Bonifácio S.K.V., Moura L.L., Marzinek J., De-Paula O.C. 2018. Comparative embryology of Stifftia and Wunderlichia and implications for its evolution in Asteraceae. – Bot. J. Linn. Soc. XX: 1–17. https://doi.org/10.1093/botlinnean/boy044
[Dziubenko] Дзюбенко Л.К. 1959. Цитоембрiологiчне дослiдження жiночоi генеративноi зони в насiнному зачатку соняшника (Helianthus L.). – Укр. бот. журн. 16 (3): 8–19.
[Dziubenko] Дзюбенко Л.К. 1965. Особливостi розвитку чоловiчного та жiночного гаметофiтiв топiнамбура (Helianthus tuberosus L.). – Укр. Бот. журн. 22 (1): 43–53.
[Efremov] Ефремов А.Е. 1967. Морфологические и цитоэмбриологические особенности тетраплоидного подсолнечника. – Генетика. 11: 31–36.
Franca R.O., De-Paula O.C., Carmo-Oliveira R., Marzinek J. 2015. Embryology of Ageratum conyzoides L. and A. fastigiatum R.M. King et H. Rob. (Asteraceae). – Acta Botanica Brasilica. 29 (1): 8–15. https://doi.org/10.1590/0102-33062014abb3609
[Gavrilova, Anisimova] Гаврилова В.А., Анисимова И.Н. 2003. Подсолнечник. СПб. 209 с.
Gotelli M.M., Galati B.G., Medan D. 2008. Embryology of Helianthus annuus (Asteraceae). – Annales Botanici Fennici. 45 (2): 81–96. https://doi.org/10.5735/085.045.0201
Maheswari D.H. 1963. Embryological studies in Compositae. IV. Heliantheae. – Proc. Ind. Acad. Sci. Sect. B. LVIII (5): 274–290.
[Modilevskii et al.] Модилевский Я.С., Оксиюк П.Ф., Худяк М.И., Дзюбенко Л.К., Бейлис-Выровая Р.А. 1958. Цитоэмбриология основных хлебных злаков. Киев. 335 с.
Musial K., Plachno B.J., Swiatek P., Marciniuk J. 2013. Anatomy of ovary and ovule in dandelions (Taraxacum, Asteraceae). – Protoplasma. 250 (3): 715–722. https://doi.org/10.1007/s00709-012-0455-x
Newcomb W. 1973a. The development of the embryo sac of sunflower Helianthus annuus before fertilization. – Can. J. Bot. 51: 863–878. https://doi.org/10.1139/b73-109
Newcomb W. 1973b. The development of the embryo sac of sunflower Helianthus annuus after fertilization. – Can. J. Bot. 51: 879–890. https://doi.org/10.1139/b73-110
[Pustovoit et al.] Пустовойт Г.В., Федоренко Т.С., Прокопенко А.И. 1976. Морфологическая характеристика женских генеративных органов тетраплоидного подсолнечника. – Бюллетень научно-технической информации по масличным культурам ВНИИ масличных культур. 3: 13–16.
Schilling E.E., Heiser C.B. 1981. Infrageneric classification of Helianthus (Compositae). – Taxon. 30 (2): 393–403. https://doi.org/10.2307/1220139
[Shamrov] Шамров И.И. 2008. Семязачаток цветковых растений: строение, функции, происхождение. М. 350 с.
[Solntseva] Солнцева М.П. 1987. Семейство Asteraceae. – В кн.: Сравнительная эмбриология цветковых растений. Davidiaceae – Asteraceae. Л. С. 318–331.
Teleżyńska J., Teleżyński H. 1973. Double fertilization in Helianthus. – Acta Societatis Botanicorum Poloniae. XLII (2): 323–343. https://doi.org/10.5586/asbp.1973.025
The families and genera of vascular plants. Vol. 8. 2007. Berlin. 636 p.
[Toderich] Тодерич К.Н. 1988. Эмбриология подсолнечника (Helianthus annuus, H. rigidus и другие): Дис. … канд. биол. наук. Л. 256 с.
[Ustinova] Устинова Е.И. 1947. К вопросу плодовитости межвидовых гибридов подсолнечника с топинамбуром. – Природа. 4: 56–60.
[Ustinova] Устинова Е.И. 1951. Случаи апоспории у подсолнечника. – Природа. 8: 43–45.
[Ustinova] Устинова Е.И. 1955. Явление апоспории у подсолнечника. – Доклады Академии наук СССР. 100 (6): 1163–1166.
[Ustinova] Устинова Е.И. 1964. Изменчивость женского гаметофита у подсолнечника (Helianthus annuus L.). – Бюллетень МОИП. Отдел биологический. 69 (4): 111–117.
[Ustinova] Устинова Е.И. 1970. Апомиксис у подсолнечника. – В кн: Апомиксис и селекция. М. С. 110–116.
[Voronova et al.] Воронова О.Н., Шамров И.И., Батыгина Т.Б. 2002. Морфогенез семязачатка Zea mays (Poaceae). – Бот. журн. 87 (9): 10–26.
Voronova O.N., Shamrov I.I., Batygina T.B. 2003. Ovule morphogenesis in normal and mutant Zea mays. – Acta Biol. Cracov. Ser. Bot. 45 (1): 155–160.
[Voronova] Воронова О. 2006. Аномалии в развитии генеративной сферы у некоторых ЦМС линий подсолнечника. – В кн.: Conf. ştiinţifică intern. “Invăţămăntul superior şi cercetarea – piloni ai societăţii bazate pe cunoaştere”. Chişinău. С. 335–336.
[Voronova] Воронова О.Н. 2008a. Особенности развития генеративной сферы у некоторых ЦМС линий подсолнечника. – Генетические ресурсы растений. 6: 76–81.
[Voronova] Воронова О.Н. 2008b. Экспресс-анализ методом просветления и его использование в эмбриологии. – Бот. журн. 93 (10): 1620–1625.
Voronova O.N. 2010. Integumentary embryony in CMS sunflower line. – Russ. Jour. Dev. Biol. 41 (6): 394–399. https://doi.org/10.1134/S106236041006007X
Voronova O.N. 2013. Development of female reproduction structures and apomixis in some CMS lines of sunflower. – Helia. 36 (58): 47–60. https://doi.org/10.2298/HEL1358047V
Voronova O.N. 2014. Chapter 3. Development of female reproductive structures and apomixis in sunflower. – In: Sunflowers: Growth and Development, Environmental Influences and Pests/Diseases. New York. P. 43–60.
[Voronova, Babro] Воронова О.Н., Бабро А.А. 2018. Ранние этапы формирования женских репродуктивных структур у Helianthus ciliaris и H. tuberosus (Asteraceae). – Бот. журн. 103 (4): 488–504. https://doi.org/10.1134/S0006813618040051
Voronova O.N., Babro A.A. 2019. Apospory in Helianthus ciliaris DC. (Asteraceae). – The International Journal of Plant Reproductive Biology. 11 (1): 66–69. https://doi.org/10.14787/ijprb.201911.1
[Voronova, Gavrilova] Воронова О.Н., Гаврилова В.А. 2007. Апоспория у подсолнечника Helianthus annuus (Asteraceae). – Бот. журн. 92 (10): 1535–1544.
Yan H., Yang H.-Y., Jensen W.A. 1991. Ultrastructure of the developing embryo sac of sunflower (Helianthus annuus) before and after fertilization. – Can. J. Bot. 69 (1): 191–202. https://doi.org/10.1139/b91-027
Дополнительные материалы отсутствуют.
Инструменты
Ботанический журнал


