Физиология человека, 2019, T. 45, № 2, стр. 115-127
Оценка функционального состояния дыхательных мышц: методические аспекты и интерпретация данных
М. О. Сегизбаева 1, *, Н. П. Александрова 1
1 ФГБУН Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
* E-mail: segizbaevamo@infran.ru
Поступила в редакцию 12.04.2018
После доработки 22.05.2018
Принята к публикации 01.10.2018
Аннотация
Цель данного обзора – ознакомить специалистов с методическими аспектами исследования функции дыхательных мышц человека и наиболее важными моментами в интерпретации результатов исследования. Рассматриваются особенности измерения максимальных респираторных давлений, основные принципы электромиографической методики, а также возможности применения разных модификаций расчетного индекса “напряжение–время” для оценки функционального состояния и определения резервных возможностей инспираторных мышц в норме и при заболеваниях, вызывающих повышенную нагрузку на дыхательную мускулатуру. Оценка функционального состояния респираторной мускулатуры имеет важное значение для дифференциальной диагностики ряда заболеваний бронхолегочной, нейромышечной, сердечнососудистой систем. Анализ функциональных возможностей моторного аппарата системы внешнего дыхания может быть чрезвычайно полезен специалистам в области экспериментальной физиологии, спортивной и восстановительной медицины.
Современными исследованиями установлено, что патогенез вентиляционных расстройств может быть связан не только с ухудшением бронхиальной проводимости, изменением свойств легочной ткани или снижением диффузионной способности легких – в его основе может лежать дисфункция и патология дыхательных мышц [1–3 и др.]. Дисфункция дыхательных мышц выражается в развитии их утомления или слабости и проявляется в снижении их функциональных свойств – силы (способности развивать максимальное усилие) и/или выносливости (способности продолжительно поддерживать субмаксимальные усилия). Дисфункция респираторной мускулатуры вызывается комплексным взаимодействием различных факторов, приводящим к структурным, метаболическим и функциональным изменениям. Ключевыми этиологическими факторами ее возникновения у пациентов с хронической обструктивной болезнью легких (ХОБЛ) являются легочная гиперинфляция и увеличенное сопротивление воздухоносных путей, которые повышают нагрузку на дыхательную мускулатуру. Помимо этого, ухудшение сократительных свойств дыхательных мышц может быть опосредовано системным воспалением, влиянием сигаретного дыма, оксидативного стресса, нарушением нормального питания, недостаточностью анаболизма, обострениями хронических заболеваний, терапией стероидными препаратами, тяжелыми мышечными нагрузками [4, 5]. Было показано, что длительно действующая повышенная инспираторная нагрузка приводит к развитию утомления и снижению сократительной способности диафрагмы и вспомогательных инспираторных мышц [6]. При этом физическая нагрузка способствует ускорению этого процесса и появлению выраженных клинических симптомов [7–9]. Более детально вопросы патофизиологии и этиологии развития функциональной недостаточности дыхательных мышц, а также клинических последствий их дисфункции рассматриваются в ряде обзоров [3–5, 10, 11].
Необходимо отметить, что исследование функции дыхательных мышц в клинической практике должно быть выполнено как часть комплексного диагностического процесса, включающего оценку функции внешнего дыхания – спирометрию, измерение статических легочных объемов и диффузионной способности легких, анализ газов артериальной крови, рентгенодиагностику. Измерение силы или выносливости дыхательных мышц не должно быть интерпретировано отдельно от остальных функциональных тестов. Низкая сила инспираторных или экспираторных мышц без клинического контекста имеет относительно слабое значение, т.к. диапазон нормальных величин у здоровых субъектов варьирует достаточно широко [12–15].
ОЦЕНКА СИЛОВОГО РЕЗЕРВА ДЫХАТЕЛЬНОЙ МУСКУЛАТУРЫ
Сила сокращений дыхательных мышц трансформируется в величину развиваемого ими давления. Поэтому в клинической практике и экспериментальной физиологии дыхания для оценки силовых параметров дыхательной мускулатуры измеряется давление, генерируемое во время инспирации или экспирации, которое обычно выражается в килопаскалях (кПа) или в см вод. ст. (1 кПа = 10.2 см вод. ст.). Функциональный резерв дыхательных мышц оценивают по величине давлений, развиваемых при произвольной максимальной активации респираторной мускулатуры (максимальное ин- или экспираторное усилие), а также при электрической или магнитной стимуляции диафрагмального нерва или грудных корешков. Общее инспираторное усилие, т.е. суммарная сила сокращений всех мышц, участвующих в акте вдоха, характеризуется величиной плеврального (Ppl), ротового (Pm) или назального (Psniff) давления. Сила сокращения основной инспираторной мышцы-диафрагмы оценивается по величине трансдиафрагмального давления (Pdi), которое определяется как разность между абдоминальным и плевральным давлениями: Pdi = Pab – Ppl. Измерение истинного плеврального давления требует инвазивного вмешательства, что достаточно затруднительно и чревато опасностью повреждения легочной ткани. Поэтому в клинических и экспериментальных исследованиях обычно используют непрямой метод регистрации плеврального давления, который состоит в измерении давления внутри пищевода. Пищеводное (внутригрудное) давление и плевральное давление примерно одинаковы, т.к. пищевод расположен в грудной полости и его эластичные стенки практически без искажений передают колебания плеврального давления. Трансдиафрагмальное давление на практике определяется как разность между гастральным (Pg) и пищеводным (Pes) давлениями: (Pdi) = (Pg) – (Pes) [16]. Следует учитывать, что Pg по своей абсолютной величине немного выше Pab в силу дополнительного гидростатического давления, действующего на желудок, и собственного тонуса желудка [17]. Пищеводное (Pes) давление, в свою очередь, также несколько отличается от Ppl, что связано с небольшим тонусом пищевода и сдавливанием его органами средостения [18]. Тем не менее, изменения гастрального и эзофагального давлений очень незначительно отличаются от изменений абдоминального и плеврального давлений [17, 18], что и обуславливает их применение в качестве аналога последних в практике экспериментальной физиологии дыхания. В клинической практике для оценки силы дыхательных мышц, как правило, проводят неинвазивное измерение максимального ротового или назального инспираторного и экспираторного давления, которое отражает силу сокращений всех мышц, участвующих в акте вдоха или выдоха.
Максимальное произвольное ротовое или внутримасочное давление. Измерение максимального произвольного инспираторного (PI, max) и экспираторного (PЕ, max) (или MIP и MEP – maximal inspiratory pressure или maximal expiratory pressure) является наиболее простым неинвазивным методом оценки силы дыхательных мышц. Впервые эту методику начали применять L.F. Black и R.E. Hyatt в конце 1960 гг. [19], и с этого времени она широко используется для измерения максимальной силы сокращений респираторных мышц как у здоровых испытуемых и спортсменов, так и у пациентов всех возрастов. Давление регистрируется во рту или в маске во время максимального произвольного вдоха (маневр Мюллера) или выдоха (маневр Вальсальвы) при перекрытых воздухоносных путях. Поскольку при выполнении таких маневров не происходит изменения легочного объема, величина измеряемого давления не зависит от свойств легких и отражает исключительно суммарную силу сокращений всех мышц, участвующих в акте вдоха или выдоха. Маневр обычно выполняется от уровня остаточного объема легких (ООЛ) для измерения MIP и от уровня общей емкости легких (ОЕЛ) для измерения MEP. Медицинскими противопоказаниями для выполнения таких маневров являются состояния, при которых необходимо избегать относительно больших перепадов давления в грудной или брюшной полости, как, например, неконтролируемая гипертензия или наличие аневризм. Несмотря на то, что данная методика оценки функции респираторной мускулатуры является достаточно простой и легко выполнимой в кабинетах функциональной диагностики, существует несколько технических моментов, которые могут влиять на полученные результаты и делают их более вариабельными, чем большинство других измерений легочной функции. В связи с этим необходимо рассмотреть некоторые важные аспекты этой методики.
Для получения объективных результатов и качественного контроля измерений следует руководствоваться рекомендациями по тестированию дыхательных мышц, разработанными совместно Американским Торакальным и Европейским Рес-пираторным Обществами (ATS/ERS) в 2002 г. [10]. В соответствии с этими рекомендациями максимальное давление регистрируется в самом начале маневра и должно поддерживаться по крайней мере 1 с (плато давления) в 3–4-секундном усилии. Для измерения величины плато необходимо регистрировать кривую давление–время в ходе выполнения респираторных маневров, которая должна быть доступна для визуального контроля. Измерения предпочтительно проводить в положении сидя. Изменение положения тела у пациентов с ХОБЛ может значительно влиять на полученный результат. Наклон вперед, например, может приводить к более высоким значениям инспираторного давления [20], в то время, как измерения, полученные в положении “лежа”, могут давать более низкие результаты [21], причем и у здоровых испытуемых тоже [22, 23].
Чтобы избежать участия мышц щек в генерации давления при регистрации MIP и MEP необходимо обеспечить небольшой отток воздуха из маски или из загубника, через которые осуществляется дыхание. Наличие такого оттока обеспечивает открытие голосовой щели и позволяет генерировать давление более 1 с, а полученный результат отражает давление, развиваемое исключительно дыхательными мышцами. В современных электронных приборах, предназначенных для измерения MIP и MEP, предусмотрено наличие необходимого отверстия для оттока воздуха, а также программное обеспечение для сбора и хранения данных, включая графическое изображение кривых развиваемого давления.
Важным моментом, касающимся стандартизации выполнения маневров и измерения MIP и MEP для получения корректных результатов, является тип используемого мундштука. В Рекомендациях АТS/ERS предложено использовать мягкие загубники, т.к. они обеспечивают минимальную утечку воздуха в ротовой полости при выполнении маневров, особенно у пациентов со слабостью ротовых мышц [10]. Исследования также могут быть успешно выполнены при использовании лицевой маски, особенно у пациентов с нейромышечными заболеваниями, характеризующимися слабостью мышц лица. При этом следует учитывать, что при использовании маски измеряемое может быть на 16% ниже, чем при применении твердого мундштука [24].
Для получения корректных результатов при измерении MIP и MEP предпочтительно выполнять 5 маневров с временным интервалом между маневрами не менее 1 мин [10, 25], при этом воспроизводимость результатов должна составлять 5–10% [26].
Измерение MIP и MEP в практике клинических исследований. Представленные в литературе данные нормальных величин для MIP и MEP достаточно разнообразны [13, 14, 27, 28 и др.]. Вариабельность значений MIP для здоровых мужчин и женщин в зависимости от возраста показана на рис. 1. Установлено, что у здоровых мужчин MIP на 34–66%, а MEP на 41–57% выше, чем у женщин [29, 30]. В подавляющем большинстве случаев MEP приблизительно вдвое больше MIP [25]. Однако для некоторых заболеваний (например, травма позвоночника ниже С3–С5, множественный склероз) характерно более значительное снижение MEP по сравнению с MIP. Для ряда нейро-мышечных заболеваний описан различный паттерн снижения силы инспираторных и экспираторных мышц и предложено использование отношения MEP/MIP в качестве важного параметра для оценки нарушений функции дыхательной мускулатуры, а также для контроля эффективности лечения и реабилитации в динамике [31]. Кроме того, этот индекс может быть полезен для скрининга пациентов при подозрении на дисфункцию диафрагмы (нейропатии диафрагмального нерва) [32]. Большинство исследований показало линейную регрессию между силой респираторных мышц и возрастом как у мужчин, так и у женщин [29], а также у детей и подростков [27]. В работе J.A. Evans [13] на основании анализа большого количества литературных данных было предложено использовать следующие формулы для расчета нормальных величин этих показателей для мужчин и женщин: MIP (муж) = 120 – (0.41 × возраст), MIP (жен) = 108 – (0.61 × возраст), MEP (муж) = 174 – (0.83 × возраст), MEP (жен) = 131 – (0.86 × × возраст), где возраст выражен в годах и ограничен 70 г. Можно отметить, что весьма немногочисленны результаты MIP и MEP у здоровых лиц старше 70-летнего возраста [24, 29]. Имеются сведения, что зависимость MIP от возраста нелинейна и имеет более выраженный отрицательный наклон в диапазоне от 60 лет. Другими авторами не обнаружено достоверной взаимосвязи между MIP и пожилым возрастом [33]. Существуют данные, что максимальные респираторные давления у пожилых людей в большей степени зависят от уровня физического состояния и жизненной активности, чем только от возраста [34, 35, собственные неопубликованные данные]. Что касается нижней границы нормальных величин, то были предложены формулы для их расчета (LLN – lower limit of normal) у мужчин и женщин: MIP LLN (муж) = 62 – (0.15 × возраст), MIP LLN (жен) = = 62 – (0.50 × возраст), MEP LLN (муж) = 117 – ‒ (0.83 × возраст), MEP LLN (жен) = 95 – (0.57 × × возраст) [13]. Кроме того, предложены формулы для расчета должных величин MIP и MEP у здоровых детей в зависимости от пола и возраста: для мальчиков MIP = 2.90 + 0.36 × возраст (кПа), для девочек MIP = 3.19 + 0.24 × возраст (кПа) [15].
Рис. 1.
Средние значения максимального инспираторного давления (MIP) у мужчин и женщин разных возрастных групп, полученные на основе рандомизированной выборки и используемые при проведении мета-анализа (для каждой возрастной группы использованы 5–6 исследований с количеством испытуемых от 59 до 96 чел. различных этнических групп). По оси абсцисс – возрастные группы (года), по оси ординат – максимальное инспираторное давление (см вод. ст.). а – мужчины, б – женщины. (По [14] c изменениями).
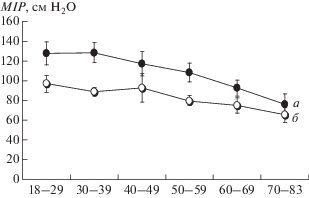
Нормальные значения MIP обычно исключают клиническую патологию инспираторных мышц. В тоже время низкие величины MIP должны быть всегда внимательно интерпретированы. Важно помнить, что в создание MIP и MEP вносят вклад все вспомогательные мышцы, функция которых не ограничивается обеспечением потребностей дыхания. Поэтому физиологически оправдано, что дыхательные мышцы здорового человека намного сильнее, чем это необходимо для осуществления только респираторной функции. Даже в том случае, когда MIP или MEP оказываются меньше нижней границы нормы, суммарная сила дыхательных мышц может быть достаточной для обеспечения нормальной жизненной емкости легких (ЖЕЛ) и поддержания необходимой вентиляции легких во время легких мышечных нагрузок. Примерно 5% обследуемых людей, не имеющих клинической патологии респираторной системы, показывают значения MIP и MEP ниже физиологической нормы. Было вычислено, что давление –35 см вод. ст. должно быть тем минимальным MIP, при котором возможно выполнение мышечной работы с потреблением кислорода 1 л/мин [35]. Более низкие величины MIP и MEP могут обеспечивать адекватную легочную вентиляцию только в состоянии покоя [13]. В тоже время из практики интенсивной терапии известно, что величина MIP должна превышать –20 см вод. ст. [13], а по другим данным –30 см вод. ст. [36] для того, чтобы стало возможным перевести пациента с искусственной вентиляции легких на спонтанное дыхание. Вместе с остальными исследованиями функции легких, многократно измеренное в ходе лечения максимальное инспираторное давление, может быть скорее надежным индикатором динамики заболевания, чем важным диагностическим критерием в его начале. В клинической практике целесообразно проводить измерение MIP и MEP у пациентов с наличием или подозрением на проблемы дыхательной мускулатуры.
У здорового человека снижение значений MIP и MEP может происходить после длительного голодания или неполноценного питания вследствие значительной потери мышечной массы [37], при избыточной массе тела из-за излишнего растяжения длины мышечных волокон диафрагмы, постоянной повышенной работы дыхания и нарушения биомеханических условий процесса мышечного сокращения в результате давления абдоминальной массы [38, 39], а также после выполнения тяжелых и продолжительных физических нагрузок [9, 40, 41], что является проявлением и одним из критериев развития утомления респираторной мускулатуры. Кроме того, сила инспираторных мышц здорового человека может снижаться в антиортостатическом положении с углом наклона –30° [42] из-за возникающей в таких условиях центральной гиперволемии и изменения биомеханики дыхания, а также после длительной гипокинезии, моделирующей физиологические эффекты невесомости [43].
ИНДЕКС “НАПРЯЖЕНИЕ–ВРЕМЯ”, КАК ПОКАЗАТЕЛЬ УТОМЛЕНИЯ ДЫХАТЕЛЬНЫХ МЫШЦ
Более сложным показателем, отражающим функциональное состояние инспираторных мышц и критерием развития их утомления, является индекс “напряжение–время”, который учитывает не только силовые, но и временные параметры мышечного сокращения. Впервые индекс “напряжение−время” для оценки функции диафрагмы (TTdi) был предложен F. Bellemaro и A. Grassino в 1982 г. [44, 45]. Величина индекса рассчитывается как произведение среднего трансдиафрагмального давления Pdi/Pdi max на значение “полезного цикла”:
Рис. 2.
Влияние паттерна дыхания на утомляемость инспираторных мышц (по [45]). По оси абсцисс – отношение среднего трансдиафрагмального давления к максимальному трансдиафрагмальному давлению (Pdi/Pmax); по оси ординат – отношение длительности инспираторной фазы дыхательного цикла к длительности дыхательного цикла (TI/TT). Черный кружок на штриховой линии – паттерн спокойного дыхания в норме. Заштрихованная полоса – порог утомления. Справа от нее – зона утомления, слева – неутомляемая зона. Цифры – 0.15, 0.18 – величина индекса “напряжение – время”.
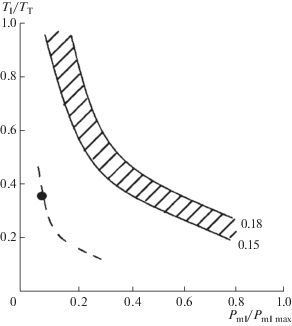
Установлено, что индекс TTdi значительно возрастает у пациентов с хронической сердечной недостаточностью, с нейро-мышечной патологией [46], при увеличении эластической и резистивной нагрузки в условиях спокойного дыхания, а при выполнении мышечной нагрузки достигает уровня, при котором развивается утомление дыхательных мышц [47] (табл. 1). У пациентов с ХОБЛ в стадии обострения заболевания значения индекса TTdi находятся в зоне утомления даже в состоянии покоя (индекс TTdi = 0.156) [48].
Таблица 1.
Значения различных модификаций индекса “напряжение–время” в норме и при заболеваниях
| Индекс "напряжение–время" |
Источник | Здоровые испытуемые (покой) |
Мышечная нагрузка |
Избыточная масса тела |
ХОБЛ | Кистозный фиброз |
Хроническая сердечная недостаточность |
Нейро-мышечные заболевания |
Порог утомления |
|---|---|---|---|---|---|---|---|---|---|
| TTdi = = Pdi/Pdi maxTI/TT | [50] | 0.019 ± 0.06 | 0.062 ± 0.044 | >0.15 | |||||
| [46] | 0.058 ± 0.015 | 0.141 ± 0.057 | |||||||
| [47] | 0.01 ± 0.001 | 0.03 ± 0.01 | 0.03 ± 0.02 0.1 ± 0.03 (после МН) |
||||||
| [48] | 0.156 ± 0.04 (обострение ХОБЛ) |
||||||||
| TTI = Pes /Pes maxTI /TT | [49] | 0.012 ± 0.004 | 0.094 ± 0.034 | 0.039 ± 0.015 | >0.30 | ||||
| TTmus = = 5P0.1TI/PImaxTI /TT | [50] | 0.045 ± 0.007 | 0.15 ± 0.098 | ||||||
| [60] | 0.054 ± 0.021 | 0.205 ± 0.117 | |||||||
| [63] | 0.045 ± 0.01 | 0.136 ± 0.003 | |||||||
| [57] | 0.04 ± 0.01 | 0.08 ± 0.03 | |||||||
| [55] | 0.07 (0.052–0.094) |
0.112 (0.079–0.174) |
|||||||
| [62] | 0.06 ± 0.02 | 0.21 ± 0.11 | |||||||
| [46] | 0.046 ± 0.016 | 0.161 ± 0.066 | |||||||
| [61] | 0.1 ± 0.06 | 0.44 ± 0.36 | |||||||
| TT0.1 = = P0.1/PmI maxTI /TT | [49] | 0.003 ± 0.001 | 0.0076 ± 0.03 | 0.013 ± 0.006 | |||||
| [78] | 0.006 ± 0.001 | 0.098 ± 0.009 | 0.015 ± 0.003 | ||||||
| [34] | 0.07 ± 0.01 | ||||||||
| [79] | 0.017 ± 0.003 | ||||||||
| TTm = PmI/PmI max × ×TI /TT ×100 | [52] | 0.11 ± 0.04 | 0.29 ± 0.10 |
Однако следует учитывать, что величина индекса TTdi избирательно отражает функциональное состояние только диафрагмы – основной инспираторной мышцы. В то же время при увеличении нагрузки на дыхательную систему резко возрастает вклад вспомогательных инспираторных мышц в обеспечение роста легочной вентиляции. Поэтому в дальнейшем были проведены исследования и определены значения суммарного индекса “напряжение−время” всех инспираторных мышц (TTI), совокупная сила сокращений которых выражается в величине инспираторных колебаний внутригрудного давления, регистрируемого баллонографическим методом в пищеводе:
Кроме того, апробирована возможность расчета индекса “напряжение−время” на основе оценки только окклюзионного ротового давления P0.1: TT0.1 = P0.1/PI max × TI/TT [49]. Авторы продемонстрировали высокую степень корреляции TT0.1 с TTI и обосновали использование такой модификации индекса для оценки функции инспираторных мышц у здоровых людей при выполнении мышечной нагрузки “до отказа”.
Существуют работы, в которых предложено в качестве альтернативы применять наиболее простой расчет индекса “напряжение−время”, в котором вместо окклюзионного инспираторного давления, основанного на измерении P0.1, используется значение инспираторного ротового давления: TTm = Pmus/PI max × TI/TT × 100 [52, 53]. Определение индекса TTm существенно легче, т.к. не требуется специального оборудования для перекрытия инспираторного контура, которое необходимо для измерения P0.1. Было показано, что значения индекса TTm у пациентов с ХОБЛ во время обострения заболевания достигают значения 0.29, что существенно выше, чем у здоровых обследуемых (0.11). На основании полученных данных авторы заключили, что использование в расчетах значений ротового давления вместо окклюзионного обеспечивает валидный и простой в использовании метод для оценки нагрузки на респираторные мышцы и позволяет определить их резервные возможности. Оценка данного индекса в динамике при терапии обострений ХОБЛ дает объективную информацию об улучшении функционального состояния инспираторных мышц [52].
Использование индекса “напряжение–время” в практике клинических исследований. Основным фактором, определяющим величину индекса TTmus у стабильных пациентов с ХОБЛ различной степени тяжести, является обструкция воздухоносных путей [54, 55]. В ряде исследований было показано, что у больных с обструкцией воздухоносных путей возрастание индекса TTmus происходит преимущественно за счет увеличения силовой составляющей уравнения, тогда как величина “полезного” цикла имеет тенденцию к уменьшению [56]. Такой выбор режима дыхания может быть связан с попыткой предотвратить или отсрочить потенциально возможное развитие утомления дыхательных мышц [54]. Показано, что значения индекса TTmus у детей с кистозным фиброзом достоверно выше (0.112), чем у здоровых детей того же возраста (0.07) [55]. При этом значения индекса TTmus достоверно коррелируют с сопротивлением дыхательных путей, форсированным объемом выдоха в 1 с (ОФВ1), жизненной емкостью (ЖЕЛ), функциональной остаточной емкостью (ФОЕ) и общей жизненной емкостью (ОЕЛ). Достоверная обратная корреляция между PImax и отношением ФОЕ/ОЕЛ поддерживает предположение, что гиперинфляция отрицательно влияет на силу инспираторных мышц у больных кистозным фиброзом [55]. Известно, что у больных с хронической сердечной недостаточностью (ХСН) наблюдается значительное снижение максимального инспираторного давления по сравнению со здоровыми обследуемыми, что позволяет предположить развитие слабости инспираторных мышц у таких пациентов. При этом было обнаружено, что и значения индекса TTmus в покое вдвое выше у больных ХСН, а в момент отказа от выполнения возрастающей мышечной нагрузке превышают пороговые значения зоны утомления инспираторных мышц (TTmus = 0.33) [57]. Причем увеличение TTmus происходит преимущественно из-за роста силовых параметров мышечного сокращения (PI/PI max), тогда как временные параметры остаются сходными в обеих группах обследованных. Механизмы, ответственные за снижение сократительной способности инспираторных мышц у пациентов с ХСН, могут быть связаны с недостаточной перфузией из-за сниженного сердечного выброса, с деоксигенацией вспомогательных дыхательных мышц во время мышечных нагрузок, с метаболическими и гистологическими нарушениями у пациентов с ХСН [58, 59].
Пациенты с нейромышечными заболеваниями также подвергаются риску развития утомления дыхательной мускулатуры [60]. У таких больных слабые респираторные мышцы вынуждены преодолевать увеличенное эластическое сопротивление из-за снижения эластичности (растяжимости) легких и грудной стенки. В результате может развиваться утомление дыхательных мышц, что, в свою очередь, будет способствовать развитию вентиляторной недостаточности. Неинвазивное определение индекса “напряжение–время” идентифицирует предрасположение к утомлению дыхательных мышц при нейромышечных заболеваниях [46, 61, 62]. Было показано, что у больных мышечной дистрофией Дюшенна значения индекса значимо превышают результаты его измерения у здоровых испытуемых (табл. 1).
Кроме того, значения индекса TTmus были определены у лиц, страдающих избыточной массой тела [63]. Авторы обнаружили, что величины TTmus значительно больше у людей со значениями индекса массы тела BMI > 30 по сравнению с обследуемыми, имеющими нормальный вес (0.136 vs 0.045). Это может быть связано с тем, что у людей с избыточным весом наблюдается увеличение сопротивления дыхательных путей, что сопровождается усиленной работой инспираторных мышц даже в условиях спокойного дыхания. Таким образом, повышенные значения TTmus у таких пациентов могут предрасполагать к развитию утомления инспираторных мышц. А раннее выявление таких изменений должно способствовать введению превентивных лечебных мероприятий для предотвращения или замедления перехода утомления дыхательных мышц в их слабость [63].
Было установлено, что расчет индексов TTdi и TTmus обеспечивает точный прогноз последствий экстурбации пациентов, находящихся на искусственной вентиляции легких (ИВЛ) [64]. Авторы показали, что средние значения индексов TTdi и TTmus у детей, не способных к самостоятельному дыханию после экстурбации, были значимо выше, чем у успешно экстурбированных детей. Значения TTdi > 0.15 и TTmus > 0.18 прогнозируют 100%-ю безуспешность адекватного спонтанного дыхания пациента после отключения от аппарата ИВЛ [65].
Таким образом, неинвазивный и легко определяемый индекс “напряжение−время” может быть полезен в клинической практике как для оценки функционального состояния и резервных возможностей дыхательных мышц, так и в плане обеспечения динамического контроля и эффективности фармакологической и физиотерапии, а также тренировок дыхательных мышц у больных с бронхо-легочной, сердечно-сосудистой и нейромышечной патологией. Оценка функции инспираторных мышц с использованием индекса TTmus может позволить идентифицировать пациентов с высоким риском развития острой дыхательной недостаточности в периоды обострения пульмонологических заболеваний и быть основанием для обеспечения пациента вспомогательной вентиляторной поддержкой. Кроме того, определение TTmus может дополнять мониторирование влияния искусственной вентиляция легких на функцию инспираторных мышц.
МЕТОД ЭЛЕКТРОМИОГРАФИИ
Метод электромиографии дыхательных мышц может быть использован для оценки электрического “выхода” дыхательного центра, исследования координированной работы дыхательных мышц, выявления патологии проводящего нерва или нейро-мышечного соединения, а также определения эффективности сократительной функции мышцы при одновременной регистрации электромиограммы и измерении силы ее сокращения. Сокращения диафрагмы и вспомогательных респираторных мышц в нормальных условиях зависят от их электрической активации. Электрические импульсы формируются в дыхательных нейронах ствола мозга в строгом соответствии и на основании постоянно поступающей афферентной информации от хеморецепторов, механорецепторов легких, проприоцепторов дыхательных мышц, а также произвольных влияний. Проходя по аксонам до мотонейронов шейного и грудного сегментов спинного мозга, коллатерали которых достигают нейро-мышечного соединения, эфферентная импульсация возбуждает мембрану мышечного волокна. Нарушение проводимости на любом из этих звеньев вызывает изменение координированных мышечных сокращений и приводит к снижению их эффективности. Использование ЭМГ-анализа позволяет описать паттерн миоэлектрических сигналов и оценить функциональные возможности нейро-мышечного аппарата дыхательной системы. Важно отметить, что ЭМГ не является прямым отражением силы сокращений мышцы, а отражает процесс возбуждения, инициируемый потенциалом действия, который распространяется по мембране мышечного волокна. При регистрации ЭМГ дыхательных мышц человека чаще всего используют поверхностные биполярные электроды, которые накладываются и фиксируются на коже над местом расположения мышцы. Не существует единых стандартов по виду, форме или точному месторасположению регистрирующих электродов, т.к. качество получаемого сигнала в любом случае будет зависеть от индивидуальных особенностей испытуемого или пациента, толщины подкожной жировой ткани, общего сопротивления кожи. Обязательным условием для успешной регистрации ЭМГ является тщательная обработка кожи перед наложением электродов – снятие волосяного покрова, обезжиривание и абразивная обработка 76% этанолом для снижения кожного сопротивления. В исследовательских целях для регистрации ЭМГ респираторных мышц используют также игольчатые электроды, вводимые непосредственно в исследуемую мышцу. Применение внутримышечных электродов позволяет получить наиболее “чистые” записи потенциалов действия, причем как отдельных моторных единиц, так и суммарных электрических разрядов. Однако использование такой методики весьма затруднительно, остаются риски кровотечения и возникновения гематом, а также пневмоторакса при введении игольчатых электродов в межреберные мышцы.
Для регистрации ЭМГ диафрагмы возможно применение эзофагальных электродов, которые вводятся через носовую или ротовую полость, располагаются в желудке и регистрируют электрическую активность купольной части диафрагмы. Преимуществом использования эзофагальных электродов в исследовательских целях является возможность параллельной регистрации ЭМГ диафрагмы и трансдиафрагмального давления, т.к. проводится комбинированное введение электродов и катетеров для регистрации эзофагального и гастрального давлений, а также возможность регистрации ЭМГ у пациентов со значительным превышением массы тела и высоким кожным сопротивлением [66]. В то же время недостатком этого метода являются дискомфорт для испытуемого, риски проявления рвотного рефлекса и вагально опосредованной брадикардии [10]. Для анализа ЭМГ дыхательных мышц чаще всего используется измерение пиковой величины амплитуды интегрированной ЭМГ, величины площади под огибающей электромиографического сигнала, проводится амплитудно-частотный анализ. Амплитудно-частотный анализ ЭМГ респираторных мышц чрезвычайно информативен для оценки развития их утомления при повышенных нагрузках на систему дыхания (дыхание с повышенным резистивным сопротивлением, тяжелые мышечные нагрузки). При утомлении диафрагмы наблюдаются характерные изменения в частотном составе спектра ЭМГ: увеличение амплитуды низкочастотных (20–46 Гц) и уменьшение амплитуды высокочастотных компонентов (150–350 Гц). Поэтому в качестве критерия ухудшения функционального состояния дыхательных мышц, используется перераспределение мощности спектра от более высоких к более низким частотам. Для выявления частотного сдвига спектра ЭМГ обычно используются два способа: либо определяется отношение мощности спектра в области высоких частот к мощности в области низких (Н/L), либо рассчитывается центроидная частота спектра (fc), как наиболее стабильный параметр [44, 67]. Числовая оценка fc показывает значение той частоты, при которой мощности низкочастотной и высокочастотной областей спектра являются сбалансированными. Повышение центроидной частоты свидетельствует о возрастании высокочастотной активности, а ее снижение – об увеличении низкочастотной активности в заданном диапазоне частот, что является характерным признаком развития утомления мышцы (рис. 3). Таким образом, смещение центроидной частоты в ту или другую сторону отражает изменение относительного вклада низко- и высокочастотной компоненты в данную полосу спектра. Причины изменения в спектральном составе ЭМГ, наблюдаемые в процессе развития утомления, до конца не выяснены. Маловероятно, чтобы сдвиг спектра мощности ЭМГ был результатом снижения или синхронизации частоты разрядов в нерве или задержки в нервно-мышечном соединении. Возможно, что причиной спектральных изменений при утомлении дыхательных мышц является замедление скорости проведения миопотенциалов в мышечных волокнах [68], что в свою очередь является первоначальным признаком метаболических изменений в мышце, связанных с аккумуляцией молочной кислоты, снижением внутриклеточного рН и изменением вследствие этого транспорта K+ и Са+2.
Рис. 3.
Пример количественной обработки электромиограммы лестничной мышцы человека. А – интерфейс программы для обработки электромиограммы дыхательных мышц. Б – снижение величины центроидной частоты спектра ЭМГ лестничной мышцы после выполнения мышечной нагрузки возрастающей мощности у здоровых испытуемых (9 чел.). По оси абсцисс – испытуемые (1–9), по оси ординат – величина центроидной частоты, выраженная в процентах по отношению к контрольным данным (покой) (по [40]).

ЗАКЛЮЧЕНИЕ
Комплексная оценка функции респираторной мускулатуры, включающая измерение максимального инспираторного и экспираторного давлений, определение индекса “напряжение−время” и электромиографический анализ, является важным и информативным дополнением к рутинным методам функциональной диагностики системы дыхания, способствует наиболее успешной дифференциальной диагностике заболеваний, а также является неотъемлемой составляющей исследовательского процесса в экспериментальной физиологии дыхания. Информация о дисфункциях респираторной мускулатуры открывает новые возможности для превентивной коррекции патологических состояний и адекватного клинического лечения. Важным результатом многочисленных исследований последних лет является физиологическое обоснование возможности тренировки дыхательных мышц с целью повышения их силы и выносливости, а также увеличения общей физической работоспособности здоровых испытуемых [69] и спортсменов [70, 71]. Особо следует отметить, что тренировка респираторной мускулатуры, является эффективным дополнением при лечении и реабилитации пациентов с различными патологиями бронхолегочной [72], сердечно-сосудистой [73] и нервно-мышечной систем [74], при которых диагностируется снижение сократительной способности дыхательных мышц вследствие развития их утомления или слабости. Этой актуальной тематике посвящен целый ряд обзоров, основанных на результатах проведения мета-анализа с привлечением большого количества современных исследований [75–77 и др.].
Работа выполнена при финансовой поддержке Программы фундаментальных научных исследований государственных академий на 2013–2020 гг. (ГП-14, раздел 65).
Список литературы
Polkey M.I., Moxham J. Clinical aspects of respiratory muscle dysfunction in the critically ill // Chest. 2001. V. 119. № 3. P. 926.
McKenzie D.K., Butler J.E., Gandevia S.C. Respiratory muscle function and activation in chronic obstructive pulmonary disease // J. Appl. Physiol. 2009. V. 107. № 2. P. 621.
Charususin N., Dacha S., Gosselink R. et al. Respiratory muscle function and exercise limitation in patients with chronic obstructive pulmonary disease: a review // Expert Rev. Respir. Med. 2018. V. 12. № 1. P. 67.
Gea J., Pascual S., Casadevall C. et al. Muscle dysfunction in chronic obstructive pulmonary disease: update on causes and biological findings // J. Thorac Dis. 2015 V. 7. № 10. P. 418.
Barreiro E., Gea J. Respiratory and limb muscle dysfunction in COPD // COPD. 2015. V. 12. P. 413.
Aleksandrova N.P., Isaev G.G. Central and peripheral components of diaphragmatic fatigue during inspiratory resistive load in cats // Acta Physiol Scand. 1997. V. 161. P. 355.
Segizbaeva M., Aleksandrova N. The effect of oxygen breathing on inspiratory muscle fatigue development during resistive load in cycling men // J. Physiol. and Pharmacol. 2009. V. 60. № 5. P. 111.
Janssens L., Brumagne S., McConnell A.K. et al. The assessment of inspiratory muscle fatigue in healthy individuals: a systematic review // Respir. Med. 2013. V. 107. № 3. P. 331.
Сегизбаева М.О., Александрова Н.П. Оценка устойчивости разных групп инспираторных мышц к утомлению при физической нагрузке на фоне моделируемой обструкции дыхательных путей // Физиология человека. 2014. Т. 40 № 6. С. 114.
ATS/ERS Statement on Respiratory Muscle Testing // Am. J. Respir. Crit. Care Med. 2002. V. 166. № 4. P. 518.
Laghi F., Tobin M.J. Disorders of the respiratory muscles // Am. J. Respir. Crit. Care Med. 2003. V. 168. P. 10.
Enright P.L., Kronmal R.A., Manolio T.A. et al. Respiratory muscle strength in the elderly / Correlates and reference values // Am. J. Respir. Crit. Care Med. 1994. V. 149. P. 430.
Evans J.A., Whitelaw W.A. The assessment of maximal respiratory mouth pressure in adults // Respir. Care. 2009. V. 54. № 10. P. 1348.
Sclauser Pessoa I.M., Franco Parreira V., Fregonezi G.A. et al. Reference values for maximal inspiratory pressure: a systematic review // Can. Respir. J. 2014. V. 21. № 1. P. 43.
Mellies U., Stehling F., Dohna-Schwake C. Normal values for inspiratory muscle function in children // Physiol. Meas. 2014. V. 35. № 10. P. 1975.
Gilbert R., Peppi D., Auchincloss J.H. Measurement of transdiaphragmatic pressure with a single gastric-esophageal probe // J. Appl. Physiol. 1979. V. 47. № 3. P. 628.
Agostoni T., Rahn H. Abdominal and thoracic pressures at different lung volume // J. Appl. Physiol. 1960. V. 15. № 6. P. 1087.
Milic-Emili J., Mead S., Turner S.M., Glaser E.M. Improved technique for estimating pleural pressure from esophageal balloons // J. Appl. Physiol. 1964. V. 19. № 1. P. 207.
Black L.F., Hyatt R.E. Maximal respiratory pressures: normal values and relationship to age and sex // Am. Rev. Respir. Dis. 1969. V. 99. P. 696.
O’Neill S., McCarthy D.S. Postural relief of dyspnoea in severe chronic airflow limitation: relationship to respiratory muscle strength // Thorax. 1983. V. 38. № 8. P. 595.
Heijdra Y.F., Dekhuijzen P.N., van Herwaarden C.L., Folgering H.T. Effects of body position, hyperinflation, and blood gas tensions on maximal respiratory pressures in patients with chronic obstructive pulmonary disease // Thorax. 1994. V. 49. P. 453.
Costa R., Almeida N., Ribeiro F. et al. Body position influences the maximum inspiratory and expiratory mouth pressures of young healthy subjects // Physiotherapy. 2015. V. 101. № 2. P. 239.
Segizbaeva M.O., Pogodin M.A., Aleksandrova N.P. Effects of body positions on respiratory muscle activation during maximal inspiratory maneuvers // Adv. Exp. Medicine and Biology. 2013. V. 756. P. 355.
Wohlgemuth M., van der Kooi E.L., Hendriks J.C. et al. Face mask spirometry and respiratory pressures in normal subjects // Eur. Respir. J. 2003. V. 22. P. 1001.
Troosters T., Gosselink R., Decramer M. Respiratory muscle assessment / Lung function testing. European respiratory monograph // Eds. Gosselink R., Stam H. Wakefield: European Respiratory Society Journals Ltd., Sheffield, UK. 2005. V. 31. P. 57.
Maillard J.O., Burdet L., van Melle G., Fitting J.W. Reproducibility of twich mouth pressure, sniff nasal inspiratory pressure, and maximal inspiratory pressure // Eur. Respir. J. 1998. V. 11. P. 901.
Hulzebos E., Takken T., Reijneveld E.A. et al. Reference Values for Respiratory Muscle Strength in Children and Adolescents // Respiration. 2018. V. 95. № 4. P. 235.
Choi W.H., Shin M.J., Jang M.H. et al. Maximal Inspiratory Pressure and Maximal Expiratory Pressure in Healthy Korean Children // Ann. Rehabil. Med. 2017. V. 41. № 2. P. 299.
Hautmann H., Hefele S., Schotten K., Huber R.M. Maximal inspiratory mouth pressures (PImax) in healthy subjects – what is the lower limit of normal? // Respir. Med. 2000. V. 94. P. 689.
Harik-Khan R., Wise R.A., Fozard J.L. Determinants of maximal inspiratory pressure // Am. J. Respir. Crit Care Med. 1998. V. 158. № 5. P. 1459.
Fregonezi G., Azevedo I.G., Resqueti V.R. et al. Muscle impairment in neuromuscular disease using an expiratory/inspiratory pressure ratio // Respir. Care. 2015. V. 60. № 4. P. 533.
Koo P., Oyieng’o D.O., Gartman E.J. et al. The Maximal Expiratory-to-Inspiratory Pressure Ratio and Supine Vital Capacity as Screening Tests for Diaphragm Dysfunction // Lung. 2017. V. 195. № 1. P. 29.
Watsford M.L., Murphy A.J., Pine M.J., Coutts A.J. The effect of habitual exercise on respiratory-muscle function in older adults // J. Ageing Phys Act. 2005. V. 13. № 1. P. 34.
Chlif M., Keochkerian D., Temfemo A. et al. Inspiratory muscle performance in endurance-trained elderly males during incremental exercise // Respir. Physiol. Neurobiol. 2016. V. 228. P. 61.
McConnell A.K., Copestake A.J. Maximum static respiratory pressures in healthy men and women: issues of reproducibilityand interpretation // Respiration. 1999. V. 66. № 5. P. 251.
Khemani R.G., Sekayan T., Hotz J. et al. Risk Factors for Pediatric Extubation Failure: The Importance of Respiratory Muscle Strength // Crit. Care Med. 2017. V. 45. № 8. e798.
Soori M., Mohaghegh S., Hajain M., Moraadi B. Effects of Ramadan Fasting on Inspiratory Muscle Function // Asian J. Sports Med. 2016. V. 7. № 3. e35201.
Chlif M., Keochkerian D., Choquet D. et al. Effects of obesity on breathing pattern, ventilatory neural drive and mechanics // Respir. Physiol. Neurobiol. 2009. V. 168. № 3. P. 198.
Arena R., Cahalin L.P. Evaluation of cardiorespiratory fitness and respiratory muscle function in the obese population // Prog. Cardiovasc Dis. 2014. V. 56. № 4. P. 457.
Segizbaeva M.O., Donina Zh.A., Timofeev N.N. et al. EMG Analysis of Human Inspiratory Muscle Resistance to Fatigue During Exercise // Adv. Exp. Med. Bi-ol. 2013. V. 788. P. 197.
Oueslati F., Berriri A., Boone J., Ahmaidi S. Respiratory muscle strength is decreased after maximal incremental exercise in trained runners and cyclists // Respir. Physiol.- Neurobiol. 2018. V. 248. P. 25.
Segizbaeva M.O., Donina Z.A., Aleksandrov V.G., Aleksandrova N.P. The Mechanisms of Compensatory Responses of the Respiratory System to Simulated Central Hypervolemia in Normal Subjects // Adv. Exp. Med. Biol. 2015. V. 858. P. 9.
Segizbaeva M.O., Aleksandrova N.P., Donina Z.A. et al. Effect of Simulated Microgravity and Lunar Gravity on Human Inspiratory Muscle Function: “Selena-T” 2015 Study // Adv. Exp. Med. Biol. 2016. V. 934. P. 31.
Bellemare F., Grassino A. Evaluation of human diaphragm fatigue // J. Appl. Physiol. 1982. V. 53. № 5. P. 1196.
Bellemare F., Grassino A. Effect of pressure and timing of contraction on human diaphragm fatigue // J. Appl. Physiol. 1982. V. 53. № 5. P. 1190.
García-Río F., Mediano O, Pino J.M. et al. Noninvasive measurement of the maximum relaxation rate of inspiratory muscles in patients with neuromuscular disorders // Respiration. 2006. V. 73. № 4. P. 474.
Mancini D., Henson D., LaManca J., Levine S. Respiratory muscle function and dyspnea in patients with chronic heart failure // Circulation. 1992. V. 86. P. 909.
Ceriana P., Vitacca M., Carlucci A. et al. Changes of Respiratory Mechanics in COPD Patients from Stable State to Acute Exacerbations with Respiratory Failure // COPD. 2017. V. 14. № 2. P. 150.
Hayot M., Ramonatxo M., Matecki S. et al. Noninvasive assessment of inspiratory muscle function during exercise // Am. J. Respir. Crit. Care Med 2000. V. 162. № 6. P. 2201.
Ramonatxo M., Boulard P., Prefaut C. Validation of a non-invasive tension-time index of inspiratory muscles // J. Appl. Physiol. 1995. V. 78. № 2. P. 646.
Gaultier C., Boule M., Tournier G., Girard F. Inspiratory force reserve of the respiratory muscles in children with chronic obstructive pulmonary diseases // Am. Rev. Respir. Dis. 1985. V. 131. № 6. P. 811.
Gonzalez C., Servera E., Celli B. et al. A simple noninvasive pressure-time index at the mouth to measure respiratory load during acute exacerbation of COPD. A comparison with normal volunteers // Respir. Med. 2003. V. 97. № 4. P. 415.
DeTorres J.P., Talamo C., Aguirre-Jaime A. et al. Electromyographic validation of the mouth pressure-time index: a noninvasive assessment of inspiratory muscle load // Respir. Med. 2003. V. 97. № 9. P. 1006.
Hayot M., Perrigault P.F., Gautier-Dechaud V. et al. Tension-time index of inspiratory muscles in COPD patients: role of airway obstruction // Respir. Med. 1998. V. 92. № 6. P. 828.
Hahn A., Ankermann T., Claass A. et al. Non-invasive tension-time index in relation to severity of disease in children with cystic fibrosis // Pediatr. Pulmonol. 2008. V. 43. № 10. P. 973.
Hayot M., Guillaumont S., Ramonatxo M. et al. Determinants of the tension-time index of inspiratory muscles in children with cystic fibrosis // Pediatr Pulmonol. 1997. V. 23. № 5. P. 336.
Vibarel N., Hayot M., Pellenc P.M. Noninvasive assessment of inspiratory muscle performance during exercise in patients with chronic heart faiure // Eur. Heart J. 1998. V. 19. № 5. P. 766.
Mancini D.M., Ferraro N., Nazzaro D. et al. Respiratory muscle deoxygenation during exercise in patients with heart failure demonstrated with near-infrared spectroscopy // J. Am. Coll. Cardiol. 1991. V. 18. № 2. P. 492.
Mancini D.M., Henson D., LaManca J., Levine S. Respiratory muscle function and dyspnea in patients with chronic congestive heart failure // Circulation. 1992. V. 86. № 3. P. 909.
Mulreany L.T., Weiner D.J., McDonough J.M. et al. Noninvasive measurement of the tension-time index in children with neuromuscular disease // J. Appl. Physiol. 2003. V. 95. № 3. P. 931.
Stehling F., Alfen K., Dohna-Schwake C., Mellies U. Respiratory Muscle Weakness and Respiratory Failure in Pediatric Neuromuscular Disorders: The Value of Noninvasive Determined Tension-Time Index // Neuropediatrics. 2016. V. 47. № 6. P. 374.
Hahn A., Duisberg B., Neubauer B.A. et al. Noninvasive determination of the tension-time index in Duchenne muscular dystrophy // Am. J. Phys. Med. Rehabil. 2009. V. 88. № 4. P. 322.
Chlif M., Keochkerian D., Mourlhon C. et al. Noninvasive assessment of the time-tension index of inspiratory muscles at rest in obese male subjects // Int. J. Obes (London). 2005. V. 29. № 12. P. 1478.
Currie A., Patel D.S., Rafferty G.F., Greenough A. Prediction of exturbation outcome in infants using the tension-time index // Arch. Dis. Fetal Neonatal Ed. 2011. V. 96. № 4. P. 265.
Harikumar G., Egberongbe Y., Nadel S. et al. Tension-time index as a predictor of extubation outcome in ventilated children // Am. J. Respir. Crit. Care Med. 2009. V. 180. № 10. P. 982.
McKenzie D.K., Gandevia S.C. Phrenic nerve conduction times and twitch pressures of the human diaphragm // J. Appl. Physiol. 1985. V. 58. № 5. P. 1496.
Schweitzer T.W., Fitzgerald J.W., Bowden J.A., Lynne-Davies P. Spectral analyses of human inspiratory diaphragmatic electromyograms // J. Appl. Physiol. 1979. V. 46. P. 152.
Gross D., Grassino A., Ross W.R.D., Macklem P.T. Electromyogram pattern of diaphragmatic fatigue // J. A-ppl. Physiol. 1979. V. 46. № 1. P. 1.
Segizbaeva M.O., Timofeev N.N., Donina Zh.A. et al. Effects of Inspiratory Muscle Training on Resistance to Fatigue of Respiratory Muscles During Exhaustive Exercise // Adv. Exp. Biol. and Med. 2015. V. 840. № 9. P. 35.
HajGhanbari B., Yamabayashi C., Buna T.R. et al. Effects of respiratory muscle training on performance in athletes: a systematic review with meta-analyses // J. Strength Cond Res. 2013. V. 27. № 6. P. 1643.
Vašíčková J, Neumannová K., Svozil Z. The Effect of Respiratory Muscle Training on Fin-Swimmers’ Performance // J. Sports Sci Med. 2017. V. 116. № 4. P. 521.
Mehani S.H.M. Comparative study of two different respiratory training protocols in elderly patients with chronic obstructive pulmonary disease // Clin. Interv. Aging. 2017. V. 12. P. 1705.
Menezes K.K., Nascimento L.R., Ada L. et al. Respiratory muscle training increases respiratory muscle strength and reduces respiratory complications after stroke: a systematic review // J. Physiother. 2016. V. 62. № 3. P. 138.
Human A., Corten L., Jelsma J., Morrow B. Inspiratory muscle training for children and adolescents with neuromuscular diseases: A systematic review // Neuromuscul Disord. 2017. V. 27. № 6. P. 503.
Neves L.F., Reis M.H., Plentz R.D. et al. Expiratory and expiratory plus inspiratory muscle training improves respiratory muscle strength in subjects with COPD: systematic review // Respir. Care. 2014. V. 59. № 9. P. 1381.
Sales A.T., Fregonezi G.A., Ramsook A.H. et al. Respiratory muscle endurance after training in athletes and non-athletes: A systematic review and meta-analysis // Phys. Ther. Sport. 2016. V. 17. P. 76.
Yoo H.J., Pyun S.B. Efficacy of bedside respiratory muscle training in patients with stroke: A randomized controlled trial // Am. J. Phys. Med. Rehabil. 2018. V. 97. № 10. P. 691.
Chlif M., Keochkerian D., Feki Y. et al. Inspiratory muscle activity during incremental exercise in obese men // Int. J. Obes. 2007. V. 31. № 9. P. 1456.
Chlif M., Chaouachi A., Ahmaidi S. Effect of Aerobic Exercise Training on Ventilatory Efficiency and Respiratory Drive in Obese Subjects // Resp. Care. 2017. V. 62. № 7. P. 936.
Дополнительные материалы отсутствуют.
Инструменты
Физиология человека


