Физиология человека, 2019, T. 45, № 2, стр. 44-50
Изменение кортико-спинальной возбудимости при управлении искусственной кистью в контуре интерфейса мозг-компьютер на основе компонента P300 зрительного вызванного потенциала
Н. В. Сыров 1, К. А. Новичихина 1, Д. А. Кирьянов 1, С. Ю. Гордлеева 2, А. Я. Каплан 1, 2, *
1 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
2 Нижегородский государственный университет им. Н.И. Лобачевского
Нижний Новгород, Россия
* E-mail: akaplan@mail.ru
Поступила в редакцию 11.01.2018
После доработки 23.03.2018
Принята к публикации 01.11.2018
Аннотация
В исследовании тестировался новый вид технологии интерфейсов мозг-компьютер на основе компонента Р300 (ИМК-Р300), в котором в качестве исполнительного устройства использовалась искусственная кисть руки с подвижными пальцами, а зрительными стимулами были вспышки светодиодов, расположенных на каждом пальце. Фокусирование внимания испытуемого на вспышках конкретного светодиода детектировалось по волне P300 и транслировалось к электрическому приводу соответствующего пальца и приводило к его сгибанию. Проверялась гипотеза о том, что работа испытуемого в контуре ИМК-Р300 с управлением приводами пальцев искусственной кисти руки приводит к повышению кортико-спинальной возбудимости, тестируемой методом транскраниальной магнитной стимуляции. В тестировании с участием 43 испытуемых-добровольцев было показано, что кортико-спинальная возбудимость действительно повышается при управлении испытуемым пальцами искусственной кисти через ИМК-Р300, и не меняется, если испытуемый просто наблюдает за независимыми от него движениями пальцев искусственной кисти, или работает в ИМК-Р300 с панелью светодиодов, расположенной отдельно от кисти. Полученное в работе подтверждение гипотезы о повышении кортико-спинальной возбудимости при активной работе испытуемого в контуре ИМК-Р300 с управлением пальцами искусственной кисти позволяет рекомендовать этот комплекс в качестве тренажера двигательной функции в восстановительном периоде после инсульта и нейротравм.
Одним из перспективных подходов к восстановлению двигательных функций после инсульта или нейротравм является активация корковых систем моторного контроля посредством мысленного представления движений [1–4]. При этом методом оценки амплитуды мышечных вызванных потенциалов (МВП) в ответ на корковую транскраниальную магнитную стимуляцию (ТМС) было показано [5–7], что формирования мысленного образа движения в той или иной мере сопровождается повышением кортико-спинальной возбудимости. Это позволяет надеяться, что систематическая идеомоторная тренировка может способствовать эффективности реабилитационных мероприятий, направленных на восстановление двигательной функции [4, 8–10].
Однако при необходимости многократного повторения мысленных образов движения их яркость и устойчивость может постепенно снижаться, в частности, в силу психического утомления и падения мотивации у пациента. Поэтому ключевым условием для эффективной идеомоторной тренировки является наличие обратной связи, сообщающей пациенту о качестве моторного образа при каждой попытке его мысленного представления. Такую обратную связь позволяет создать контур интерфейса мозг-компьютер (ИМК), в котором на основе регистрации ЭЭГ детектируется связанный с моторным образом специфический паттерн электрической активности, а именно – десинхронизация μ-ритма [1, 9, 11]. По факту этого события в ИМК формируется команда для включения сигнала обратной связи подходящей модальности и формы.
В настоящее время технология ИМК на основе представления движений активно используется для создания нейротренажерных комплексов в помощь пациентам с нарушением двигательной функции [1, 12–14]. Эти комплексы позволяют пациентам не только тренировать яркие моторные образы в надежде на позитивные пластические перестройки в моторной коре, но и формировать команды к экзоскелетным конструкциям, приводящим в движение парализованные части тела, что, по мнению многих исследователей, усиливает тренировочные эффекты [12, 14]. Однако эти ИМК технологии позволяют сформировать не более 2–4 сигналов обратной связи или команд для исполнительных устройств, что определяется очень ограниченным набором мысленных образов, детектируемых по десинхронизации ЭЭГ с надежностью хотя бы в 65–75% от общего числа попыток, причем после длительного обучения пациента методике представления движения [1, 15].
Между тем, наиболее трудным для восстановления после инсульта и нейротравм является мелкая моторика кисти, в частности, движения отдельных пальцев [16]. Для использования нейротренажеров здесь требуется не менее 5 надежно детектируемых мысленных команд, чтобы через контур ИМК активировать пять специфичных для движений каждого пальца сигналов обратной связи или команд для соответствующей экзоскелетной системы. В этой связи становится актуальной разработка нейроинтерфейсных систем для поддержки мультикомандных тренажеров мелкой моторики. В настоящее время подобную мультикомандность могут обеспечить технологии ИМК на основе позитивной волны зрительного вызванного потенциала Р300 (ИМК-Р300), в которых число команд, детектируемых с более чем 80% точностью, ограничивается только числом экранных стимулов, обозначающих эти команды [17].
Ранее нами был разработан нейротренажерный комплекс на основе ИМК-Р300 и искусственной кисти с подвижными пальцами, позволяющий испытуемому фокусированием внимания на подсветках каждого пальца формировать команды к соответствующим электрическим приводам и тем самым инициировать движение каждого пальца в отдельности [16]. Работа пользователя в подобном тренажере явным образом не связана с представлением движения, и потому возникает вопрос о том, приводит ли одно только фокусирование внимание на конкретном пальце, причем не своей руки, а всего лишь рядом расположенной искусственной кисти, к активации корковых моторных областей, наподобие того, как это происходит при мысленном представлении движения конечности?
Целью настоящей работы является проверка гипотезы о том, что работа человека в контуре нейроинтерфейса на основе волны P300, управляющем пальцами искусственной кисти, приводит к повышению кортико-спинальной возбудимости моторных областей коры. Подтверждение этой гипотезы будет рекомендацией к разработке нейротренажерных комплексов на основе ИМК-Р300 для восстановления движения.
МЕТОДИКА
Выполнили два исследования, каждое из которых состояло из 2-х опытных дней с перерывом в 3–7 дней, в которых участвовали соответственно 23 испытуемых-добровольцев в возрасте от 18 до 31 года (9 женского пола) и 20 испытуемых-добровольцев в возрасте от 18 до 23 лет (11 женского пола), соответственно. Все испытуемые подписывали Информированное согласие, которое вместе с регламентом исследования было одобрено Комиссией по биоэтике МГУ им. М.В. Ломоносова.
Над правой рукой сидящего в кресле испытуемого располагалась искусственная кисть антропоморфного вида (рис. 1), каждый палец которой мог сгибаться с помощью струнной тяги от компактного сервомотора и разгибаться посредством растягивающегося при сгибании резинового тяжа [18]. На последних фалангах каждого пальца фантома установили белые светодиоды яркостью 5 Кд, кратковременное (на 50 мс) включение которых служило зрительными стимулами, выполняющими роль маркеров “целевых” и “не целевых” пальцев. Фокусирование внимания испытуемого на подсветках маркера на “целевом” пальце фантома воспроизводило известную парадигму “oddball” и приводило к характерным изменениям в связанных с этим событием потенциалах (ПСС) ЭЭГ, в основном в виде возрастания позитивности в области 300 мс после начала подсветки. Таким образом, в контуре ИМК-Р300 по наличию таких изменений детектировали внимание испытуемого к конкретному пальцу фантома и по факту этого события с помощью компактного сервомотора запускали движение соответствующего пальца искусственной кисти. Испытуемые получали возможность произвольно управлять пальцами искусственной кисти одними только мысленными усилиями [16].
Рис. 1.
Общий вид испытательного стенда для выполнения исследования. 1 – фантом кисти, 2 – светодиоды на пальцах кисти, 3 – дисплей для задания номера целевого пальца, 4 – резиновые тяжи, 5 – сервоприводы пальцев, 6 – усилитель ЭЭГ, 7 – катушка ТМС.

Для выделения и анализа ПСС на включения светодиодов использовали записи ЭЭГ в отведениях Pz, Poz, PO3, PO4, PO7, PO8, O1, O2 (10–10% по Джасперу) со средней точкой в позиции Fpz и объединенным ушным контактом в качестве референтного электрода. Регистрацию ЭЭГ осуществляли посредством усилителя NVX-52 (МКС, г. Зеленоград) с частотой дискретизации 500 Гц. Задание фокусировать внимание на подсветки светодиодов на том или ином пальце искусственной кисти испытуемые получали указанием номера пальца на компактном дисплее, закрепленном на этой же кисти (рис. 1).
Процесс записи ЭЭГ и управления стимулами осуществлялся с помощью программной реализации технологии интерфейса мозг-компьютер на основе волны P300 [1, 15] с использованием линейного дискриминанта Фишера для выделения ПСС на целевой стимул.
Изменение кортико-спинальной возбудимости в покое оценивали по величине миографических вызванных потенциалов (МВП) мышц предплечья, вызываемых стандартными импульсами транскраниальной магнитной стимуляции коркового моторного представительства этой мышцы. Накожные электроды для регистрации МВП устанавливали на правую руку испытуемого в области мышц: flexor digitorum superficialis (поверхностный сгибатель пальцев кисти, далее – мышца-сгибатель) и extensor digitorum communis (общий разгибатель пальцев кисти, далее – мышца-разгибатель). На каждую мышцу, пальпируемую по ее рельефу при напряжении, устанавливали по 3 электрода: один в области сухожилия, два других – далее по ходу брюшка мышцы. Заземляющий электрод устанавливали в области шиловидного отростка локтевой кости левой руки. Межэлектродный импеданс миографической регистрации не превышал 5 кОм. Сигнал от мышцы регистрировали посредством усилителя NVX52 и оцифровывали с частотой 10 кГц.
Для сравнительного количественного анализа МВП амплитуду этих ответов от пика до пика нормировали на медианное ее значение по результатам всех ТМС-импульсов в состоянии спокойного бодрствования. Статистический анализ различий амплитуд нормированных МВП при разных экспериментальных условиях выполняли с использованием теста Краскела–Уоллеса (непараметрический аналог метода ANOVA для несвязных выборок) с дальнейшим post-hoc-анализом с коррекцией p-значений методом Данна (Dunn’s test). Отображение, предобработка и статистический анализ изменения амплитуд МВП проводили в среде MATLAB и Graphpad prism.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
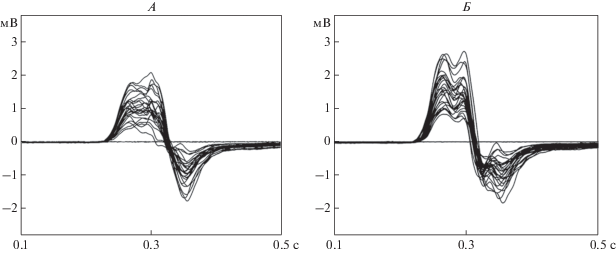
В первый опытный день обоих исследований испытуемый обучался управлению пальцами искусственной кисти в контуре ИМК-Р300, для чего сначала выполнялось калибровочное тестирование с построением классификатора реакций ЭЭГ на целевые, т.е. указанные на кистевом дисплее по номеру пальца, и не целевые подсветки пальцев искусственной кисти. Далее, у каждого испытуемого сначала находили точку на поверхности головы, магнитная стимуляция которой вызывала максимальные МВП с мышцы сгибателя, затем определялась пороговая мощность ТМС, при которой появляются МВП данной мышцы. В ходе эксперимента ТМС проводилась при мощности импульса на 10% большей порога моторного ответа. В силу того, что порог для мышцы разгибателя ниже, чем для сгибателя, на фоне магнитной стимуляции выбранной на скальпе точки сгибателя, как правило, регистрировались МВП и разгибателя. Примеры МВП в ответ на одиночные импульсы ТМС представлены на рис. 2.
Рис. 2.
Примеры накопленных МВП в ответ на 15 применений одиночных импульсов ТМС для одного испытуемого. А – для мышцы сгибателя, Б – для разгибателя.
В этот же опытный день испытуемые тестировались в контуре ИМК-Р300, сопряженном с подачей вызывающей МВП ТМС сразу после полного сгибания пальца фантома. Каждый испытуемый получал с экрана кистевого дисплея по 20 указаний на сгибание того или иного пальца.
К работе во второй опытный день исследований отбирались только те испытуемые, которые в первый день успешно, т.е. не менее чем в 75% попыток, выполняли регламент управления пальцами искусственной кисти. Отличительной особенностью регламента работы испытуемого в контуре ИМК-Р300 во второй опытный день первого исследования было сделано намеренное со стороны исследователя увеличение числа неправильных срабатываний фантома за счет программно-регулируемого введения ошибок в канал исполнения команд испытуемого. Если в первый день испытуемый при управлении пальцами искусственной кисти через ИМК-Р300 мог достигать точности срабатываний 95% и более из 20-ти попыток, то в регламенте тестирования во второй день процент правильных срабатываний, т.е. когда сгибался тот палец фантома, на котором фокусировал свое внимание испытуемый, не мог превысить 30%. Оставшиеся 70% срабатываний приходились на ошибки первого и второго рода (неправильное срабатывание или отсутствие такового), которые возникали вне зависимости от усилий испытуемого и точности срабатывания ИМК-Р300.
В этот день испытуемые заранее предупреждались о введении “более трудных” условий для их работы и о возможном снижении в связи с этим точности срабатываний системы. Это позволяло, во-первых, достичь максимальных усилий испытуемых по управлению пальцами искусственной кисти, и, во-вторых, создавало примерно равное число трех категорий “реакций” фантома при фокусировании испытуемого на подсветках указанного на дисплее пальца: правильные сгибания, неправильные и отсутствие сгибаний.
В рамках данного исследования предполагалось ответить на вопрос о том, будет ли изменяться и в какую сторону возбудимость моторной коры у испытуемых, фиксирующих внимание на подсветках целевого пальца, при разной результативности этого мысленного действия (при сгибании целевого пальца, нецелевого пальца и при несрабатывании искусственной кисти в ответ на усилия испытуемого).
На рис. 3 представлены усредненные по всем испытуемым данные нормированных амплитуд МВП для условий фокусирования внимания испытуемого на целевом пальце при разных вариантах срабатывания приводов пальцев искусственной кисти.
Рис. 3.
Изменение амплитуды МВП у группы испытуемых (N = 23) при работе в контуре ИМК-Р300 с различной результативностью. ЦП – сгибание целевого пальца, НП – сгибание нецелевого пальца, ОС – отсутствие сгибания и ПК – покой. Значения амплитуд МВП представлены в процентах от амплитуды МВП в состоянии “покой”. Столбцы – медианы, планки погрешностей – интерквартильный размах. ** – p < 0.01; **** – p < 0/0001.

Как видно из рис. 3 при фокусировании внимания на целевом пальце фантома в среднем по группе испытуемых наблюдалось статистически значимое увеличение амплитуды МВП относительно состояния покоя при любых реакциях фантома: правильных, неправильных, и при отсутствии реакций. Это свидетельствует об увеличении кортико-спинальной возбудимости у испытуемых при выполнении ими задачи на фокусирование внимания к определенному пальцу фантома, с целью вызвать его движение, независимо от результативности этой деятельности.
Однако оставалось неясным, что именно приводит к повышению кортико-спинальной возбудимости: собственно работа испытуемого в контуре ИМК-Р300 с целью вызова движения пальца фантома, или сама деятельность по фокусированию внимания на мигающих светодиодах, вне зависимости от ее направленности на сгибание пальцев? Кроме того, вполне возможно, что даже одно только наблюдение за движениями пальцев фантома, не связанными с мысленными усилиями испытуемого и контуром ИМК-Р300, может привести к увеличению МВП.
Для проверки этих предположений во втором исследовании во время повторного визита тестирование испытуемых в контуре ИМК-Р300 на фоне ТМС выполнялось в трех экспериментальных условиях, последовательность которых в каждом исследовании выбиралась случайным образом. Первое условие предполагало, что ТМС включается только при правильном или ошибочном сгибании пальца фантома. При невыполнении движения фантомом ТМС не включалась, так как эффекты при отсутствии сгибания уже были изучены в первый опытный день. Контролем служила ТМС в состоянии спокойного бодрствования испытуемого, наблюдавшего за искусственной кистью, на которой светодиоды не включались и пальцы не двигались, хотя ТМС-стимулы подавались в том же количестве и темпе, что и в первую сессию.
В рамках второго условия испытуемый должен был также спокойно наблюдать за фантомом кисти, пальцы которой не подсвечивались, но в случайном порядке сгибались в том же темпе, что и при условии 1.
В третьем условии фантомная кисть замещалась панелью со светодиодами в том же пространственном расположении, что и на кисти. В этом случае испытуемому с дисплея давалось задание фокусировать внимание на подсветках того или иного светодиода, согласно его порядковому номеру, как и при работе с кистью. При этом некоторые подсветки сопровождались стимулами ТМС со средним интервалом между ними, характерным для условия 1. Таким образом, в этом условии испытуемые не работали с фантомом, но выполняли по сути ту же активность с фокусированием внимания на включениях тех же светодиодов с тем только отличием, что испытуемые не ожидали какого-то действия по результатам своих мысленных усилий. Результаты второго исследования представлены на рис. 4.
Рис. 4.
Изменение амплитуды МВП у испытуемых во время их работы в разных экспериментальных условиях. ИМК – в контуре ИМК-Р300 с управлением движением целевого пальца фантома, НС – с наблюдением за программно управляемыми движениями пальцев фантома, СП – с фокусированием внимания на светодиодах панели и в состоянии покоя – ПК. * – p < 0.05. Остальные обозначения см. рис. 3.

Как видно из рис. 4. только при работе в контуре ИМК, т.е. с возможностью реального запуска движения целевого пальца фантома у испытуемых обнаруживается увеличение возбудимости нейронов моторной коры, судя по статистически значимому росту МВП. Простое наблюдение за движением пальцев искусственной кисти без фокусирования внимания на каком-то из пальцев с целью вызова его движения не приводит к изменению кортико-спинальной возбудимости (рис. 4). Также одно только копирование активной работы в контуре ИМК с фокусированием внимания на тех же световых маркерах, но расположенных не на пальцах фантома, а на отдельной панели, также не приводило к изменению МВП.
ЗАКЛЮЧЕНИЕ
В данном исследовании проверялась гипотеза о возможности увеличения кортико-спинальной возбудимости у испытуемых при работе в контуре интерфейса на волне Р300, который обеспечивал сгибание конкретных пальцев искусственной кисти при фокусировании на них зрительного внимания испытуемого. Полученные данные свидетельствуют о том, что возбудимость нейронов моторной коры у испытуемых действительно повышалась при управлении через ИМК-Р300 пальцами искусственной кисти посредством фокусирования на них зрительного внимания и с ожиданием ответного их движения. Контрольное тестирование с оцениванием кортико-спинальной возбудимости при наблюдении испытуемым движений искусственных пальцев или при работе в контуре ИМК-Р300 с панелью светодиодов, но без искусственной кисти показали, что в этих случаях возбудимость корковых моторных нейронов не изменяется. Это, по-видимому, означает, что наблюдение испытуемым инициированного им через ИМК-Р300 движения антропоморфного объекта, внешнего по отношению к телу человека, интегрируется в мысленный образ движения собственного тела и тем самым приводит к повышению кортико-спинальной возбудимости. Менее вероятной причиной подобной трансформации внешнего движения в активацию мозговых моторных систем можно считать работу системы зеркальных нейронов [19, 20], поскольку, как уже отмечалось, наблюдение тех же пальцев искусственной кисти, но не инициированное испытуемым, – не приводит к повышению кортико-спинальной возбудимости. В работе [5] исследователи хотя и обнаружили некоторое повышение кортико-спинальной возбудимости при пассивном наблюдении испытуемым за движением пальцев руки человека на экране, но показали, что гораздо больший эффект дает активное наблюдение, например, с целью имитации.
Таким образом, полученная совокупность данных позволяет полагать, что комплекс ИМК-Р300 с искусственной кистью руки человека в качестве исполнительного устройства может быть использован в качестве тренажера, инициативная работа пользователя на котором приводит к активации моторных областей коры больших полушарий. Преимуществом тренажера на основе ИМК-Р300 с искусственной кистью перед известными тренажерами на основе представления движения, является возможность формирования большого числа команд, для управления отдельными элементами экзоскелетных устройств, например, пальцами фантома кисти, или экзоскелетными сегментами различных частей тела, что дает возможность тренировки мелкой моторики.
Список литературы
Каплан А.Я. Нейрофизиологические основания и практические реализации технологии мозг-машинных интерфейсов в неврологической реабилитации // Физиология человека. 2016. Т. 42. № 1. С. 118.
Porro C.A., Francescato M.P., Cettolo V. et al. Primary motor and sensory cortex activation during motor performance and motor imagery: a functional magnetic resonance imaging study // J. Neuroscience. 1996. V. 16. № 23. P. 7688.
Pfurtscheller G., Neuper C. Motor imagery activates primary sensorimotor area in humans. Neuroscience Letters. 1997. V. 239. № 2. P. 65.
Mulder T. Motor imagery and action observation: cognitive tools for rehabilitation // J. Neural Transmission. 2007. V. 114. № 10. P. 1265.
Roosink M., Zijdewind I. Corticospinal excitability during observation and imagery of simple and complex hand tasks: Implications for motor rehabilitation // Behavioural Brain Research. 2010. V. 213. № 1. P. 35.
Liepert J., Greiner J., Dettmers C. Motor excitability changes during action observation in stroke patients // J. Rehabilitation Medicine. 2014. V. 46. № 5. P. 400.
Mokienko O.A., Chervyakov A.V., Kulikova S.N. et al. Increased motor cortex excitability during motor imagery in brain-computer interface trained subjects // Frontiers in Computational Neuroscience. 2013. V. 7. P. 168.
Vasilyev A., Liburkina S., Yakovlev L. et al. Assessing motor imagery in brain-computer interface training // Psychological and Neurophysiological Correlates. Neuropsychologia. 2017. V. 97. P. 56.
Wolpaw J.R., Birbaumer N., McFarland D.J. et al. Brain–computer interfaces for communication and control // Clinical Neurophysiology. 2002. V. 113. № 6. P. 767.
Munzert J., Lorey B., Zentgraf K. Cognitive motor processes: The role of motor imagery in the study of motor representations // Brain Research Reviews. 2009. V. 60. № 2. P. 306.
Мокиенко О.А., Бобров П.Д., Черникова Л.А., Фролов А.А. Основанный на воображении движений интерфейс мозг−компьютер в реабилитации пациентов с гемипарезом // Бюллетень сибирской медицины. 2013. Т. 12. № 2. С. 30.
Фролов А.А., Бирюкова Е.В., Бобров П.Д. и др. Принципы нейрореабилитации, основанные на использовании интерфейса “мозг−компьютер” и биологически адекватного управления экзоскелетоном // Физиология человека. 2013. Т. 39. № 2. С. 99.
Мокиенко О.А., Черникова Л.А., Фролов А.А. Интерфейс мозг-компьютер как новая технология нейрореабилитации // Анналы клинической и экспериментальной неврологии. 2011. Т. 5. № 3. С. 46.
Иванова Г.Е. Восстановительное лечение больных с инсультом // Российский медицинский журн. 2002. № 1. С. 48.
Teo W.P., Chew E. Is motor-imagery brain-computer interface feasible in stroke rehabilitation? // PM and R. 2014. V. 6. № 8. P. 723.
Каплан А.Я., Жигульская Д.Д., Кирьянов Д.А. Изучение возможности управления отдельными пальцами фантома кисти руки человека в контуре интерфейса мозг−компьютер на волне P300 // Вестник Российского государственного медицинского университета. 2016. № 2. С. 26.
Burns A., Adeli H., Buford J.A. Brain-Computer Interface after Nervous System Injury // The Neuroscientist. 2014. V. 20. P. 639.
Кирьянов Д.А., Каплан А.Я. Распознавание когнитивных потенциалов на целевые стимулы в интерфейсе мозг−компьютер на основе ансамбля классификаторов // Наука и инновации в медицине. 2017. № 3. С. 28.
Iacoboni M., Woods R.P., Brass M. et al. Cortical mechanisms of human imitation // Science. 1999. V. 286. P. 2526.
Isaac A., Marks D.F., Russell D.G. An instrument for assessing imagery of movement: The Vividness of Movement Imagery Questionnaire (VMIQ) // J. Mental Imagery. 1986. V. 10. № 4. P. 23.
Дополнительные материалы отсутствуют.
Инструменты
Физиология человека


