Физиология человека, 2019, T. 45, № 4, стр. 127-136
Влияние гормона роста на мышечную массу и силу у здоровых молодых людей: систематический обзор и метаанализ
К. В. Сергеева 1, *, А. Б. Мирошников 1, А. В. Смоленский 1
1 ФГБОУ ВО Российский государственный университет физической культуры, спорта,
молодежи и туризма
Москва, Россия
* E-mail: sergeeva_xenia@mail.ru
Поступила в редакцию 21.09.2018
После доработки 10.10.2018
Принята к публикации 20.12.2018
Аннотация
Гормон роста относится к запрещенным для использования спортсменами веществам, но вопрос о его анаболическом действии на мышечную ткань продолжает дискутироваться. Цель исследования заключалась в систематической оценке действия гормона роста на состав тела и силовые показатели у здоровых, физически подготовленных молодых людей. Выполнен метаанализ рандомизированных контролируемых исследований (РКИ) в соответствии с положениями инструкции “Предпочтительные параметры отчетности для систематических обзоров и метаанализа (PRISMA)”. Объединенные результаты одиннадцати РКИ показали, что применение гормона роста увеличивает тощую массу тела (2.72, 95% ДИ: 2.02; 3.38, р < 0.01), общее содержание воды (1.10, 95% ДИ: 0.54; 1.66, р < 0.01), количество внеклеточной воды (1.78, 95% ДИ: 1.04; 2.52, р < 0.01), снижает содержание жира (–0.67, 95% ДИ: –0.93; –0.40, р < 0.01), при этом не влияет на скорость синтеза мышечного белка (0.00, 95% ДИ: –0.01; 0.02, р = 0.70) и мышечную силу (–0.02, 95% ДИ: –0.05; 0.02, р = 0.36) по сравнению с использованием плацебо. Таким образом, применение гормона роста может улучшать состав тела у здоровых молодых людей за счет выраженного липолитического эффекта, но при этом не влияет на гипертрофию мышечных волокон. Увеличение тощей массы тела обусловлено накоплением внеклеточной жидкости.
Гормон роста (ГР) получил широкое распространение в спорте, начиная с 80-х гг. прошлого столетия. В 1989 г. гормон роста был официально запрещен Олимпийским комитетом, однако в последнее время продажи препарата увеличились в несколько раз. Незаконное использования ГР среди элиты и спортсменов-любителей [1] связано с его способностью увеличивать мышечную массу и снижать жировую прослойку. Подобное заключение является спорным, принимая во внимание то обстоятельство, что данные об анаболическом эффекте этого гормона в подавляющем своем большинстве пришли из исследований по изучению влияния заместительной терапии препаратами ГР у пациентов с различными вариантами низкорослости и дефицитом ГР [2–5]. Фактически, в настоящее время достоверных данных в пользу анаболического действия ГР у здоровых взрослых людей не представлено. Научное и медицинское сообщество без всякой критики принимает предположение о том, что ГР – это анаболический гормон, игнорируя тот факт, что согласно большинству исследований у здоровых взрослых людей введение экзогенного гормона роста не увеличивает силу мышц, а рост мышечной массы, очевидно, связан с удержанием в организме большего количества жидкости [6]; что у здоровых мужчин зрелого и пожилого возраста с возрастным дефицитом ГР заместительная терапия не замедляет старение, не улучшает физическое состояние, не вызывает увеличение мышечной массы или силы [7–15]; и что пациенты, страдающие акромегалией – синдромом, развивающимся в результате чрезмерной выработки ГР опухолями гипофиза – секреция гормона в 100 раз выше нормы, но с точки зрения спортивных показателей они имеют плохую толерантность к тренировкам [16], у них незначительная истинная гипертрофия мышц и страдают они от миопатии и атрофии волокон 2 типа [6]. Масштабность данной проблемы подчеркивается огромным ущербом для здоровья, связанным с рядом опасных побочных эффектов, таких, как гипертония, рак и инсулинорезистентность [17].
Цель данного обзора заключается в систематической оценке эффективности применения гормона роста на мышечную силу, состав тела, гипертрофию мышц, индуцированную тренировкой с отягощениями, у здоровых, физически подготовленных молодых людей.
МЕТОДИКА
Стратегия поиска. Проведен систематический поиск исследований по следующим электронным базам: MEDLINE, EMBASE, Кокрановской (Cochrane) базе данных систематических обзоров и Кокрановскому регистру кон-тролируемых испытаний с охватом научных исследований с момента их создания до августа 2018 г. без ограничений по языку или дате публикации. Стратегия поиска включала использование валидизированного фильтра для идентификации рандомизированных испытаний в сочетании с контекстным поиском. Поиск проводили по следующим ключевым словам: гормон роста и рандомизированное контролируемое исследование. Кроме того, были просмотрены все списки литературных источников найденных оригинальных статей и обзоров. Просмотр результатов поиска (названий и тезисов статей) осуществляли два независимых эксперта. После отбора всех потенциально подходящих статей был проведен анализ их полного содержания для установления соответствия с принятыми критериями включения. Эти же эксперты независимо друг от друга выполнили извлечение данных с использованием стандартных форм. Расхождения в результатах отбора данных устранены при совместном обсуждении.
Критерии включения исследований. В метаанализ включены рандомизированные плацебо-контролируемые исследования, включая перекрестные рандомизированные исследования, терапии ГР, отвечающие следующим требованиям: 1) участие в исследовании лиц без нарушений здоровья; 2) размер выборки не менее 5 участников; 3) возраст участников от 18 до 45 лет и 4) предоставляющие данные, по крайней мере, об одном клиническом исходе, представляющим интерес, а именно, составе тела (например, тощая масса тела, жировая масса, общее содержание воды, содержание внеклеточной воды), силовых показателей (например, сила двуглавой мышцы плеча, сила четырехглавой мышцы бедра, или изометрическая становая сила), показатели скорости синтеза мышечного белка (например, фракционная скорость синтеза мышечного белка). Из метаанализа исключены исследования, которые: 1) были ориентированы исключительно на оценку стимуляторов секреции ГР, 2) включали пациентов с сочетанными соматическими заболеваниями или 3) оценивали гормона роста для лечения конкретной болезни (например, дефицит гормона роста или фибромиалгия). Если несколько исследований представляли результаты из одной и той же когорты, то эти данные использовались только один раз.
Абстракция данных. Следующие данные были извлечены из каждого исследования: характеристики выборки (возраст, пол, индекс массы тела (ИМТ), максимальное потребление кислорода (МПК)), интервенционное вмешательство (дозировки препарата, частота инъекций и продолжительность терапии), качество исследования (дизайн, рандомизация, статистический метод) и клинические исходы.
Оценка качества исследований (оценка риска предвзятости). Оценка методологического качества исследований была основана на методе Cochrane Collaboration’s tool для оценки риска предвзятости [18]. Оценивалось использование следующих стратегий, свидетельствующих о высоком качестве исследований: характер распределения участников исследования в группы и скрытие распределения; маскирование (“ослепление”) исследователей, участников, экспертов, оценивающих исходы и проводящих анализ данных; неполные данные о результатах; выборочная отчетность и другие источники погрешностей, которые могут повлиять на результаты (например, источники финансирования). Для каждой области риск предвзятости оценивался как низкий, высокий или неясный. Неясный риск предвзятости назначали в том случае, если предоставлялось недостаточно деталей и информации или же если результат исследования был известен, но его вклад в риск предвзятости был неясен.
Статистический анализ данных. Для определения различий исходов рассчитаны взвешенные разности средних с соответствующими 95% доверительными интервалами (ДИ) для непрерывных данных с использованием метода DerSimonian и Laird для модели случайных эффектов, позволяющего оценить дисперсию между исследованиями. Гетерогенность полученных данных оценивали с помощью тестов на однородность: критерий Хи-квадрат (χ2) и I2 [19]. В тесте на общий эффект, который задавали по Z-критерию, значимым считали двустороннее значение р < 0.05. Для каждого результата создали точечные и интервальные (95% доверительный интервал, ДИ) оценки обобщенного эффекта вмешательства. Мы также провели анализ чувствительности, извлекая каждое исследование индивидуально, чтобы оценить влияние этого исследования на сводные оценки. Для проверки “публикационной” ошибки (систематической ошибки, связанной с преимущественной публикацией положительных результатов) мы использовали анализ асимметрии воронкообразного графика, предложенный M. Egger et al. [20].
Если исходы оценивали в разных единицах измерения, то использовали стандартизованную разницу средних (SMD, Standart mean difference) в сравниваемых группах и итоговую оценку выражали не в единицах шкалы результатов, а в единицах стандартного отклонения. Для анализа данных использовали программу Review Manager (RevMan) [Computer program]. Version 5.3. Copenhagen: The Nordic Cochrane Centre, The Cochrane Collaboration, 2014.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Первоначальный поиск в базах данных обеспечил в общей сложности 1553 источника (424 в PubMed, 460 в EMBASE и 669 в Cochrane), из которых 1020 были уникальными без дублирования. В ходе поиска мы подробно рассмотрели 253 тезиса и 62 статей для полнотекстовой оценки, из которых 51 были исключены из дальнейшего анализа, поскольку не соответствовали критериям включения. В одном исследовании первичные данные были представлены неполноценно [21], поэтому не были включены в метаанализ. 11 РКИ [22–32] соответствовали критериям включения в данный систематический обзор и определили общее количество участников по восьми конечным точкам (рис. 1).
Характеристики участников. Участники исследования были преимущественно мужчинами (72%), физически подготовленными (среднее МПК: 48.9 мл/кг/мин (SD: 6.7) со средним возрастом и ИМТ: 27.7 лет (SD: 3.2) и 23.9 кг/м2 (SD: 1.7) соответственно. Исходные характеристики участников исследования представлены в табл. 1.
Таблица 1.
Базовые характеристики участников и интервенционная терапия
| Исследование (источника) | Средний возраст (SD), годы |
Средний МПК (SD), мл/кг/мин | Число участников в начале/ конце исследования, n | Средний ИМТ (SD), кг/м2 | Интервенционная терапия | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| ГР группа | контр. группа | ГР группа | контр. группа | ГР группа | контр. группа | ГР группа | контр. группа | длительность терапии ГР, дни | дозировки ГР, мкг/кг–1/день–1 | |
| [23] | 23.4(2.8)**** | 23.4(2.8)**** | – | – | 11/8 | 11/10 | – | – | 42 | 30 |
| [24] | 33(2) | 33(2) | – | – | 10/10 | 10/10 | – | – | 14 | 50 |
| [25] | 25.6(4.2) | 27.0(4.4) | 42.8(7.2) | 45.2(7.2) | 20/20 | 10/10 | 23.1(2.6) | 23.2(3.9) | 30 | 67 |
| [26] | 32(9) | 32(11) | 41.8(9.8) | 44.8(7.9) | 24/24 | 24/24 | 27.5(3.0) | 28.0(3.1) | 7 | 19 |
| [27] | 24.0(4.0) | 25.0(4.0) | 60.1(9.6) | 57.8(7.2) | 8/8 | 8/8 | 22.2(2.0) | 21.4(1.6) | 14 | 28***** |
| [28] | 31(–) | 33(–) | 54.2(–) | 53.4(–) | 6/6 | 5/5 | 24(–) | 25(–) | 30 | 67 |
| [29]*** | 27.6(5.7) | 28.3(5.0) | 45.6(9.9) | 43.4(9.9) | 37/32 | 33/32 | 23.3(2.8) | 24.5(3.1) | 56 | 28***** |
| [32] | 27(4.2)**** | 27(4.2)**** | – | – | 9/7 | 9/9 | 23.5(–) | 23.5(–) | 84 | 40 |
| [22]** | 27.9(3.7) | 27.9(3.7) | – | – | 8/8 | 8/8 | – | – | 42 | 38***** |
| [31] | 21–29* | 21–29* | – | – | 8/8 | 8/8 | 22.5–27.0* | 22.5–27.0* | 10 | 33 |
| [30]** | 26.5(2.7) | 26.5(2.7) | – | – | 8/8 | 8/8 | 22.8(1.7) | 22.8(1.7) | 14 | 52***** |
Характеристики исследований. В одиннадцати исследованиях участвовали 271 испытуемый. Из них 139 получали лечение ГР. Размеры выборок, как правило, были небольшими (среднее число участников 12.3 (SD: 8.2), а показатели отсева были низкими (95% участников завершили исследования). Средняя продолжительность лечения была 31.2 дня (SD: 23.5), только 4 исследования имели продолжительность терапии ГР более чем 30 дней [22, 23, 29, 32], и ни одно исследование не продолжалось больше чем 3 мес. Средняя суточная доза ГР составила 41.1 мкг/кг–1/день–1 (SD: 16). Все исследования использовали ГР подкожно (табл. 1).
Качество исследований. Методологическое качество исследований варьировало. Ни одно исследование не соответствовало всем критериям качества, хотя 6 исследований удовлетворили 6 из 7 критериев [22, 24, 25, 27, 28, 31]. Скрытие распределения при отборе участников было адекватным только в одном исследовании [29], генерация рандомизированной последовательности была неясной в двух исследованиях [23, 32]. Итоговые данные, связанные с полнотой наблюдений были неадекватны в одном [23] и неясны в двух [29, 32] исследованиях. Обслуживающий персонал, исследователи и оценивающие результат были ослеплены во всех исследованиях за исключением одного [26]. Воронкообразная диаграмма рассеяния не выявила признаков наличия “публикационной” систематической ошибки или других систематических ошибок, связанных с малым объемом выборки.
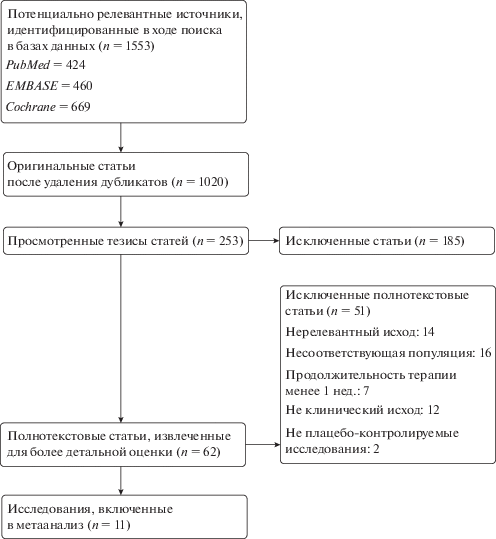
Влияние ГР на состав тела. Метаанализ восьми РКИ [22, 23, 25, 27–29, 31, 32] выявил значительное увеличение тощей массы тела c применением терапии ГР на 2.72 кг (95% ДИ: 2.02; 3.38, р < 0.01) по сравнению с плацебо. Тощая масса тела определяется как сумма общей воды организма и сухой массы тела без жира. Увеличение тощей массы тела сопровождалось увеличением внеклеточной воды (взвешенная разница средних 1.78 кг, 95% ДИ: 1.04; 2.52, р < 0.01). Результаты двух исследований [21, 30], представленные только в форме значений исхода в конце исследования (без указаний начальных значений) не были включены в метаанализ. В данных исследованиях также выявлено увеличение внеклеточной жидкости у участников опытной группы по сравнению с контрольной группой. В трех исследованиях [25, 30, 32] было установлено значимое увеличение общего содержания воды в экспериментальной группе (взвешенная разница средних 1.10, 95% ДИ: 0.54; 1.66, р < 0.01). В двух методологически тщательно проведенных РКИ [24, 32] оценивалась фракционная скорость синтеза белка, т.е., измерение скорости синтеза белка, как скорость включения аминокислот, меченных стабильными изотопами, в мышечную ткань. По данным этих исследований применение ГР не оказывало влияния на скорость синтеза белка (взвешенная разница средних 0.00% в час, 95% ДИ: –0.01; 0.02, р = 0.70). Жировая масса уменьшилась в группе, получавшей ГР по сравнению с группой плацебо (взвешенная разница средних –0.67, 95% ДИ: ‒0.93; –0.40, р < 0.01) (рис. 2).
Рис. 2.
Влияние гормона роста на состав тела. А – жировая масса (SD), Б – тощая масса тела (кг), В – общее содержание воды (SD), Г – внеклеточная вода (кг), Д – фракционная скорость синтеза мышечного белка (% в час).
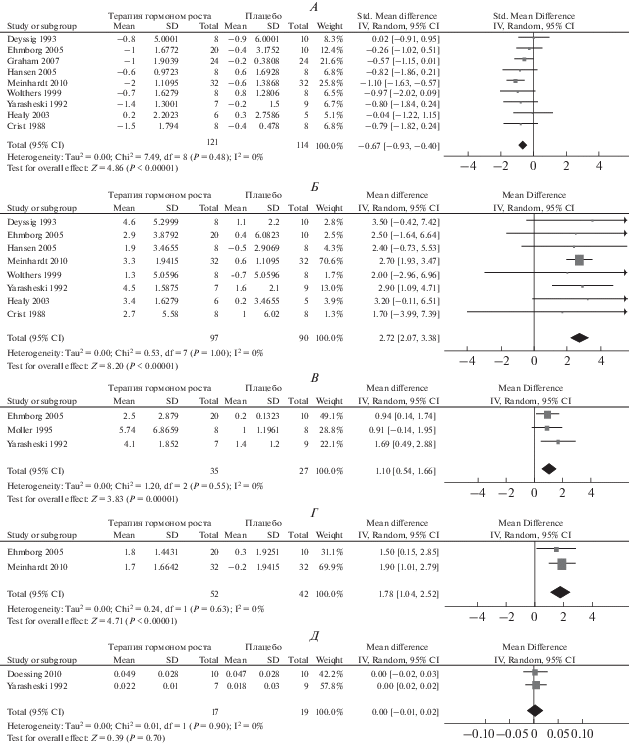
Влияния ГР на мышечную силу. В двух исследованиях оценивалось изменение силовых показателей двуглавой мышцы плеча и четырехглавой мышцы бедра [23, 32]. В этих исследованиях продолжительность терапии составила 42 дня [32] и 84 дня [23], т.е., были самые длительные по продолжительности из всех включенных исследований. Использование ГР не увеличило силу двуглавой мышцы плеча при тестировании 1 повторного максимума (1ПМ) (–0.24 кг, 95% ДИ: –1.50; 1.03, р < 0.71) или силу четырехглавой мышцы бедра (–1.06 кг, 95% ДИ: –3.65; 1.54, р = 0.43). Одно исследование [32] оценило изменение силы 7 мышечных групп. Различий между экспериментальной и контрольной группами выявлено не было, силовые показатели были сопоставимы у обеих групп (–0.10 кг, 95% ДИ: –0.61; 0.41, p = = 0.70). Еще одно исследование [29] показало, что ни сила мышц (становая тяга в изометрическом режиме), ни максимальная взрывная сила (высота прыжка) не увеличились в группе получавшей ГР (2.00 кг, 95% ДИ: –1.29; 5.29, р = 0.23) и (–1.30 см, 95% ДИ: –2.19; 0.41, р < 0.01), соответственно. Сводные результаты применения ГР показывают отсутствие влияния этого гормона на относительное изменение силы мышц (–0.02, 95% ДИ: ‒0.05; 0.02, р = 0.36) (рис. 3).
Рис. 3.
Влияние гормона роста на мышечную силу. А – двуглавая мышца плеча (1ПМ, кг), Б – четырехглавая мышца бедра (1ПМ, кг), В – относительное изменение силы мышц.
После получения обобщенных оценок величин эффектов мы определяли ее устойчивость путем исключения каждого исследования из анализа и пересчета результатов с последующей оценкой их гетерогенности по критерию χ2. Величина эффекта всех анализируемых исходов существенно не изменилась, что дает нам основания полагать, что выводы первичного метаанализа достаточно обоснованы.
Мы не нашли доказательства предвзятости публикации посредством визуального осмотра воронкообразных графиков.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Метаанализ данных РКИ выявил, что хотя терапия ГР значительно увеличивает тощую массу тела и связана с близкой к значимой тенденцией к уменьшению жировой массы, тем не менее, не приводит к увеличению силы мышц у рекреационных спортсменов и представителей силовых видов спорта [23, 29, 32]. В связи с этим возникает резонный вопрос: каким образом увеличение тощей массы тела не приводит к увеличению силы? Дело в том, что методы количественного определения тощей массы тела (двухэнергетическая рентгеновская абсорбциометрия) не надежно различает твердую и жидкую составляющие тощей массы тела [33]. В этой связи примечательно, что ГР значительно увеличивает объем внеклеточной воды [30, 34], путем удержания натрия, активируя ренин-ангиотензиновую систему, и, тем самым, вызывает повышенную абсорбцию воды в тубулярном аппарате почек и кишечнике [35, 36]. Вполне вероятно, что задержка жидкости отвечает за основную долю увеличенной тощей массы тела.
Гораздо более чувствительный метод определения реакции мышц, нежели простая оценка изменения мышечной массы между двумя временными точками, – это фракционная скорость синтеза белка. Основан этот метод на измерении скорости синтеза белка, как скорости включения аминокислот, меченных стабильными изотопами, в мышечную ткань. Применение данного метода показало, что у молодых здоровых взрослых людей ГР не влияет на синтез мышечного белка. Нерандомизированное исследование с участием опытных тяжелоатлетов поддерживает эту точку зрения, где фракционная скорость синтеза мышечного белка, а также скорость распада белков всего тела были идентичны базовым исходным значениям через 2 нед. применения ГР [37]. Кроме того, хорошо документировано, что ГР и инсулиноподобный фактор роста (ИФР-1) стимулируют синтез коллагена в сухожилиях и скелетных мышцах, что указывает на стимулирующую роль этих гормонов в мышечно-сухожильной соединительной ткани [24, 38, 39]. В исследовании A.P. Boesen et al. [40] у молодых здоровых людей после 2 нед. иммобилизации конечности и последующей реабилитации совместно с физическими упражнениями в течение 6 нед. мышечная сила восстановилась без различий между группой, получавшей ГР и группой плацебо. Применение ГР в дозировках 33–50 мкг/кг–1/сут–1 привело к увеличению поперечного сечения сухожилия и сухожильного модуля при отсутствии изменений в морфологии миофибрилл. Авторы не установили никакого благотворного влияния сочетанного применения ГР и физических упражнений на рост скелетной мышцы в ходе реабилитации. Основываясь на предположении о потенцирующем действии ГР на синтез коллагена, допинг ГР может позволить спортсмену тренироваться с большей частотой и более высокой интенсивностью, снижая вероятность травм мышц и сухожилий, что косвенно повысит спортивные результаты.
В целом, полученные результаты позволяют предположить, что ГР не влияет на морфологию миофибриллярного аппарата скелетных мышц. Наблюдаемое увеличение безжировой массы объясняется увеличением внеклеточной воды, что свидетельствует об ограниченности анаболического воздействия супрафизиологических доз ГР. Ошибочное ощущение повышенной производительности может быть следствием субъективных изменений кинестезии в результате отека и увеличенной жесткости мышцы за счет роста ткани коллагена, поскольку ось ГР/ИФР-1 играет центральную роль в регулировании метаболизма коллагена в мышечно-сухожильной и костной ткани [41].
Наш анализ имеет определенные ограничения. Во-первых, мы не можем полностью исключить “публикационную” систематическую ошибку. Несмотря на то, что мы провели статистический тест для выявления “публикационной” ошибки, следует учитывать низкую мощность подобных тестов при метаанализе малого количества испытаний. Кроме того, относительно небольшой размер выборок не позволил провести подгрупповой анализ с разделением размеров эффекта по половому признаку, срокам и типу терапии.
Во-вторых, несмотря на то, что включенные исследования не были гетерогенны, учитывая малое количество исследований, статистические выводы о детерминантах гетерогенности могут быть некорректными.
В-третьих, схемы дозирования ГР, назначаемые в исследованиях, могут отличаться от доз спортивного допинга, используемых спортсменами. Предположительно, спортсмены применяют ГР в дозировках от 15 к 180 мкг/кг, от 3 до 4 раз в нед., циклами от 4 до 6 нед. [1], т.е., дозы могут быть выше, чем используемые в большей части включенных исследований нашего обзора. Однако, на данный момент неясно, существует ли дозозависимый эффект применения ГР.
В-четвертых, качество метаанализа определяется качеством включенных исследований. Лишь некоторые из включенных в наш анализ испытаний можно назвать методологически качественными. К потенциальным ограничениям следует отнести неопределенное или неадекватное скрытие распределения, отсутствие маскирования, а также ограничения, связанные с малым объемом выборки.
ЗАКЛЮЧЕНИЕ
Cледует отметить, что в настоящее время не существует ни одного надежного, заслуживающего доверия исследования, которое могло бы ясно показать характер действия ГР в среднесрочной и долгосрочной перспективе, самостоятельно или в комбинации с разнообразными тренировочными протоколами на синтез миофибриллярного белка и силовые показатели. Спортсменам и спортивным педагогам важно глубоко и всесторонне усвоить не только механизм воздействия физических упражнений на организм, но и механизм влияния фармакологических средств на физиологические системы. С учетом данных соображений следует рекомендовать дальнейшее проведение качественных клинических исследований с использованием валидизированных исходов для оценки фармакологического воздействия гормона роста.
Благодарности. Авторы благодарят д.б.н., профессора, заведующую кафедрой “Биохимии и биоэнергетики спорта им. Н.И. Волкова” Ритту Викторовну Тамбовцеву за помощь в написании статьи и работе с литературными источниками.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией данной статьи.
Список литературы
Saugy M., Robinson N., Saudan C. et al. Human growth hormone doping in sport // Br. J. Sports Med. 2006. V. 40. Suppl 1. P. 35.
Baum H.B., Biller B.M., Finkelstein J.S. et al. Effects of physiologic growth hormone therapy on bone density and body composition in patients with adult-onset growth hormone deficiency. A randomized, placebo-controlled trial // Ann. Intern. Med. 1996. V. 125. № 11. P. 883.
Christ E.R., Carroll P.V., Russell-Jones D.L. et al. The consequences of growth hormone deficiency in adulthood, and the effects of growth hormone replacement // Schweiz. Med. Wochenschr. 1997. V. 127. № 2. P. 1440.
Cuneo R.C., Salomon F., Wiles C.M. et al. Histology of skeletal muscle in adults with GH deficiency: comparison with normal muscle and response to GH treatment // Horm. Res. 1992. V. 37. № 1. P. 23.
Rubeck K.Z., Bertelsen S., Vestergaard P., Jørgensen J.O. Impact of GH substitution on exercise capacity and muscle strength in GH-deficient adults: a meta-analysis of blinded, placebo-controlled trials // Clin. Endocrinol. 2009. V. 71. № 6. P. 860.
Rennie M.J. Claims for the anabolic effects of growth hormone: a case of the Emperor’s new clothes? // Br. J. Sports Med. 2003. V. 37. № 2. P. 100.
Giannoulis M.G., Sonksen P.H., Umpleby M. et al. The effects of growth hormone and/or testosterone in healthy elderly men: a randomized controlled trial // J. Clin. Endocrinol. Metab. 2006. V. 91. № 2. P. 477.
Lange K.H., Andersen J.L., Beyer N. et al. GH administration changes myosin heavy chain isoforms in skeletal muscle but does not augment muscle strength or hypertrophy, either alone or combined with resistance exercise training in healthy elderly men // J. Clin. Endocrinol. Metab. 2002. V. 87. № 2. P. 513.
Lange K.H., Isaksson F., Rasmussen M.H. et al. GH administration and discontinuation in healthy elderly men: effects on body composition, GH-related serum markers, resting heart rate and resting oxygen uptake // Clin. Endocrinol. (Oxf). 2001. V. 55. № 11. P. 77.
Liu H., Bravata D.M., Olkin I. et al. Systematic review: the safety and efficacy of growth hormone in the healthy elderly // Ann. Intern. Med. 2007. V. 146. № 2. P. 104.
Papadakis M.A., Grady D., Black D. et al. Growth hormone replacement in healthy older men improves body composition but not functional ability // Ann. Intern. Med. 1996. V. 124. № 8. P. 708.
Taaffe D.R., Jin I.H., Vu T.H. et al. Lack of effect of recombinant human growth hormone (GH) on muscle morphology and GH-insulin-like growth factor expression in resistance-trained elderly men // J. Clin. Endocrinol. Metab. 1996. V. 81. № 1. P. 421.
Taaffe D.R., Pruitt L., Reim J. et al. Effect of recombinant human growth hormone on the muscle strength response to resistance exercise in elderly men // J. Clin. Endocrinol. Metab. 1994. V. 79. № 5. P. 1361.
Yarasheski K.E., Zachwieja J.J., Campbell J.A. et al. Effect of growth-hormone and resistance exercise on muscle growth and strength in older men // Am. J. Physiol. 1995. V. 268. № 2. P. 268.
Yarasheski K.E., Zachwieja J.J. Growth hormone therapy for the elderly: the fountain of youth proves toxic // JAMA. 1993. V. 270. № 14. P. 1694.
Colao A., Cuocolo A., Marzullo P. et al. Is the acromegalic cardiomyopathy reversible? Effect of 5-year normalization of growth hormone and insulin-like growth factor I levels on cardiac performance // J. Clin. Endocrinol. Metab. 2001. V. 86. № 4. P. 1551.
Holt R.I.G., Sönksen P.H. Growth hormone, IGF-I and insulin and their abuse in sport // Br. J. Pharmacol. 2008. V. 154. № 3. P. 542.
Higgins J.P., Green S. Handbook for systematic reviews of interventions version 5.1.0 The Cochrane Collaboration, 2011. www.cochrane-handbook.org.
Higgins J.P., Thompson S.G. Quantifying heterogeneity in a meta-analysis // Stat. Med. 2002. V. 21. № 11. P. 1539.
Egger M., Smith G.D., Schneider M., Minder C. Bias in metaanalysis detected by a simple, graphical test // Br. Med. J. 1997. V. 315. № 7109. P. 629.
Moller J., Jorgensen J.O., Moller N. et al. Expansion of extracellular volume and suppression of atrial natriuretic peptide after growth hormone administration in normal man // J. Clin. Endocrinol. Metab. 1991. V. 72. № 4. P. 768.
Crist D.M., Peake G.T., Egan P.A., Waters D.L. Body composition response to exogenous growth hormone during training in highly conditioned adults // J. Appl. Physiol. 1988. V. 65. № 2. P. 579.
Deyssig R., Frisch H., Blum W.F. et al. Effect of growth hormone treatment on hormonal parameters, body composition and strength in athletes // Acta. Endocrinol. (Copenh). 1993. V. 128. № 4. P. 313.
Doessing S., Heinemeier K.M., Holm L. et al. Growth hormone stimulates the collagen synthesis in human tendon and skeletal muscle without affecting myofibrillar protein synthesis // J. Physiol. 2010. V. 588. № 2. P. 341.
Ehrnborg C., Ellegård L., Bosaeus I. et al. Supraphysiological growth hormone: less fat, more extracellular fluid but uncertain effects on muscles in healthy, active young adults // Clin. Endocrinol. (Oxf). 2005. V. 62. № 4. P. 449.
Graham M.R., Baker J.S., Evans P. et al. Evidence for a decrease in cardiovascular risk factors following recombinant growth hormone administration in abstinent anabolic-androgenic steroid users // Growth Horm. IGF Res. 2007. V. 17. № 3. P. 201.
Hansen M., Morthorst R., Larsson B. et al. Effects of 2 wk of growth hormone administration on 24-h indirect calorimetry in young, healthy, lean men // Am. J. Physiol. Endocrinol. Metab. 2005. V. 289. № 6. P. 1030.
Healy M.L., Gibney J., Russell-Jones D.L. et al. High dose growth hormone exerts an anabolic effect at rest and during exercise in endurance-trained athletes // J. Clin. Endocrinol. Metab. 2003. V. 88. № 11. P. 5221.
Meinhardt U., Nelson A.E., Hansen J.L. et al. The effects of growth hormone on body composition and physical performance in recreational athletes: A randomized trial // Ann. Intern. Med. 2010. V. 152. № 9. P. 568.
Moller J., Jorgensen J.O., Frandsen E. et al. Body fluids, circadian blood pressure and plasma rennin during growth hormone administration: a placebo-controlled study with two growth hormone doses in healthy adults // Scandinavia J. Clinical and Laboratory Investigation. 1995. V. 55. P. 663.
Wolthers T., Lechuga A., Grøfte T. et al. Serum leptin concentrations during short-term administration of growth hormone and triiodothyronine in healthy adults: a randomised, double-blind placebo-controlled study // Horm. Metab. Res. 1999. V. 31. № 1. P. 37.
Yarasheski K.E., Campbell J.A., Smith K. et al. Effect of growth hormone and resistance exercise on muscle growth in young men // Am. J. Physiol. 1992. V. 262. № 3. P. 261.
de Boer H., Blok G.J., Van der Veen E.A. Clinical aspects of growth hormone deficiency in adults // Endocr. Rev. 1995. V. 16. № 1. P. 63.
Мирошников А.Б., Смоленский А.В. Факторы мышечной гипертрофии под лампой физиологии // Терапевт. 2017. № 12. C. 53.
Johannsson G., Sverrisdottir Y.B., Ellegard L. et al. GH increases extracellular volume by stimulating sodium reabsorption in the distal nephron and preventing pressure natriuresis // J. Clinical Endocrinology and Metabolism. 2002. V. 87. № 4. P. 1743.
Moller J., Nielsen S., Hansen T.K. Growth hormone and fluid retention // Horm. Res. 1999. V. 51. № 3. P. 116.
Yarasheski K.E., Zachweija J.J., Angelopoulos T.J., Bier D.M. Short-term growth hormone treatment does not increase muscle protein synthesis in experienced weight lifters // J. Appl. Physiol. 1993. V. 74. № 6. P. 3073.
Doessing S., Kjaer M. Growth hormone and connective tissue in exercise // Scand. J. Med. Sci. Sports. 2005. V. 15. № 4. P. 202.
Trepp R., Flück M., Stettler C. et al. Effect of GH on human skeletal muscle lipid metabolism in GH deficiency // Am. J. Physiol. Endocrinol. Metab. 2008. V. 294. № 6. P. 1127.
Boesen A.P., Dideriksen K., Couppé C. et al. Tendon and skeletal muscle matrix gene expression and functional responses to immobilisation and rehabilitation in young males: effect of growth hormone administration // The J. Physiology. 2013. V. 591. № 23. P. 6039.
Brixen K., Nielsen H.K., Mosekilde L., Flyvbjerg A. A short course of recombinant human growth hormone treatment stimulates osteoblasts and activates bone remodeling in normal human volunteers // J. Bone. Miner Res. 1990. V. 5. № 6. P. 609.
Дополнительные материалы отсутствуют.
Инструменты
Физиология человека