Физиология человека, 2019, T. 45, № 5, стр. 49-56
ЭЭГ-показатели прогноза терапевтического ответа при маниакально-бредовых и маниакально-парафренных состояниях
Е. В. Изнак 1, *, С. В. Сизов 1, И. В. Олейчик 1, А. Ф. Изнак 1, **
1 ФГБНУ Научный центр психического здоровья
Москва, Россия
* E-mail: ek_iznak@mail.ru
** E-mail: iznak@inbox.ru
Поступила в редакцию 15.04.2019
После доработки 22.05.2019
Принята к публикации 03.06.2019
Аннотация
Исследование клинических, психопатологических и нейробиологических характеристик аффективно-бредовых состояний актуально для уточнения диагностики и индивидуального прогноза развития заболевания. Количественная ЭЭГ позволяет объективно оценить функциональное состояние головного мозга таких пациентов и уточнить нейрофизиологические механизмы, лежащие в основе особенностей синдромальной структуры психопатологических расстройств. Цель работы – поиск особенностей исходных амплитудно-частотных и пространственных характеристик ЭЭГ как возможных показателей прогноза терапевтического ответа у пациентов с маниакально-парафренными и маниакально-бредовыми состояниями в рамках эндогенных психических расстройств, имеющих разную структуру синдрома. Исследовано 73 женщины 18–55 лет с аффективно-бредовыми состояниями, отвечающими критериям рубрик F25.0 и F25.2 по МКБ-10 и различающимися по структуре синдрома: с преобладанием чувственно-бредовых (28 чел.) или идеаторно-бредовых (31 чел.) расстройств, а также группа больных с маниакально-бредовыми состояниями (14 чел.). Количественную оценку психического состояния пациентов в динамике терапии осуществляли по клиническим шкалам YMRS и PANSS. Функциональное состояние головного мозга оценивали с помощью многоканальной регистрации и спектрального анализа фоновой ЭЭГ. Методом корреляционного анализа определяли взаимосвязи между индивидуальными количественными клиническими оценками после курса терапии и параметрами ЭЭГ, зарегистрированными до начала терапии – возможными предикторами терапевтического ответа. В трех синдромально различных группах пациентов выявлены межгрупповые особенности структуры корреляций исходных (зарегистрированных до начала терапии) индивидуальных значений спектральной мощности ЭЭГ с количественными клиническими оценками по шкалам YMRS и PANSS после курса терапии. Эти параметры ЭЭГ можно рассматривать в качестве кандидатов на роль предикторов индивидуального терапевтического ответа у пациентов с маниакально-бредовыми и маниакально-парафренными состояниями. Они отражают либо исходно сниженное функциональное состояние головного мозга, в частности, лобно-височных отделов коры, либо ее исходную гиперактивацию, т.е. нарушение нормального соотношения процессов возбуждения и торможения. Таким образом, вариации нарушения соотношения процессов возбуждения и торможения, отражающееся в параметрах исходной фоновой ЭЭГ, по-видимому, обуславливают как особенности клинических проявлений маниакально-парафренных и маниакально-бредовых состояний, так и адаптивные ресурсы головного мозга в плане возможности и величины индивидуального терапевтического ответа пациента.
Уточнение нейробиологических механизмов, лежащих в основе аффективно-бредовых состояний в рамках эндогенных психических расстройств, является актуальной задачей клинической и биологической психиатрии [1–3]. При эндогенных психозах достаточно часто встречаются маниакально-бредовые состояния. Они характеризуются сочетанием маниакального аффекта (от благодушно-приподнятого шутливого настроения и необоснованного оптимизма, до моторного и идеаторного возбуждения, “скачки идей” и спутанности сознания) с выраженными расстройствами мышления (бредовыми идеями особых способностей, величия, мессианского предназначения, бредом преследования, воздействия, непосредственного участия в противостоянии добра и зла), что серьезно нарушает социальную и профессиональную адаптацию пациентов. При этом более тяжелые расстройства мышления обозначаются термином “парафрении”. Исследование клинических, психопатологических и нейробиологических особенностей маниакально-бредовых и маниакально-парафренных состояний имеет большое значение для уточнения диагностики и индивидуального прогноза развития заболевания, тем более, что достаточно большое число таких пациентов (не менее 30%) дают неудовлетворительный ответ на стандартную синдромально обусловленную курсовую терапию [4].
Одним из перспективных направлений оптимизации терапии эндогенных психических расстройств является ранний прогноз индивидуального терапевтического ответа. Из-за относительно невысокой информативности в этом отношении клинических показателей предпочтительным является использование биомаркеров, причем желательно таких, которые будучи зарегистрированными у пациента еще до начала курса терапии, позволяли бы прогнозировать терапевтический ответ [5].
Среди таких биомаркеров особое место занимают ЭЭГ-показатели вследствие неинвазивности, безопасности и низкой стоимости ЭЭГ-исследования, возможности регистрации фоновой ЭЭГ у большинства пациентов и широкой доступности метода ЭЭГ в клинической практике. Исследование количественных параметров ЭЭГ в динамике терапии дает возможность объективно оценить изменения функционального состояния головного мозга пациентов и не только уточнить нейрофизиологические механизмы, лежащие в основе особенностей синдромальной структуры психопатологических расстройств, но и выявить возможные ЭЭГ-показатели прогноза терапевтического ответа [6–14].
Цель работы – поиск особенностей исходных амплитудно-частотных и пространственных характеристик ЭЭГ как возможных показателей прогноза терапевтического ответа у пациентов с маниакально-парафренными и маниакально-бредовыми состояниями в рамках эндогенных психических расстройств, имеющих разную структуру синдрома.
МЕТОДИКА
Исследование проводили на базе лаборатории нейрофизиологии и отдела по изучению эндогенных психических расстройств и аффективных состояний ФГБНУ “Научный центр психического здоровья”.
В исследование включили 73 пациента клиники ФГБНУ НЦПЗ (женщины-правши, 18–55 лет, средний возраст 33.4 ± 11.6 лет) с маниакально-бредовыми и маниакально-парафренными состояниями, отвечающими критериям рубрик F25.0 и F25.2 по МКБ-10.
Критериями включения больных в исследование служили: возраст от 18 до 55 лет, наличие маниакально-бредового или маниакально-парафренного состояния, подписание информированного согласия на участие в исследовании. Критериями не включения – наличие у пациентов признаков органического заболевания ЦНС, хронических соматических заболеваний в стадии декомпенсации, а также сведений о злоупотреблении психоактивными веществами.
Клинико-психопатологическим методом выделили три группы больных с аффективно-бредовыми состояниями, различающимися по структуре синдрома. В две группы вошли пациентки с маниакально-парафренными состояниями. При этом больные 1-й группы (28 чел., средний возраст 33.7 ± 8.4 лет) характеризовались преобладанием чувственно-бредовых феноменов (бреда восприятия и бреда воображения) и приподнятого фона настроения. Во 2-й группе (31 чел., средний возраст 32.3 ± 3.8 лет) преобладали идеаторно-бредовые расстройства, сочетающие чувственный бред восприятия с интерпретативными идеями, гневливостью, подозрительностью, малодоступностью. У больных 3-й группы (14 чел., средний возраст 33.2 ± 3.5 лет) преобладали маниакально-бредовые состояния с идеями завышенной самооценки и величия. Маниакальный аффект у них характеризовался благодушно-веселым настроением, оптимизмом, общительностью, повышенной активностью (в том числе, сексуальной), идеаторная ускоренность никогда не доходила до “скачки идей”, а бредовая симптоматика была выражена слабее, чем в группах 1 и 2, и выявлялась лишь при детальном расспросе и внимательном наблюдении.
Все пациенты получали комбинированную синдромально обусловленную психофармакотерапию, включавшую антипсихотические, анксиолитические и нормотимические препараты.
Клиническая оценка состояния пациентов. Количественную оценку психического состояния пациентов до и после курса терапии осуществляли с использованием шкалы Янга для мании (Young Mania Rating Scale − YMRS) и шкалы позитивных и негативных синдромов (Positive and Negative Syndrome Scale − PANSS). При анализе учитывали как общую сумму баллов всей шкалы PANSS (PANSS-сумма), так и отдельно суммы баллов по подшкалам позитивных симптомов (PANSS-поз), негативных симптомов (PANSS-нег) и общей психопатологии (PANSS-общ).
ЭЭГ-исследование. Всем больным до начала и по окончании курса терапии проводили многоканальную регистрацию фоновой ЭЭГ в состоянии спокойного бодрствования с закрытыми глазами с помощью аппаратно-программного комплекса “Нейро-КМ” (фирмы “Статокин”, Россия) и компьютерной программы “BrainSys” (фирмы “Нейрометрикс”, Россия) [15]. ЭЭГ записывали в 16-ти отведениях: F7, F3, F4, F8, T3, C3, Cz, C4, T4, T5, P3, Pz, P4, T6, O1 и O2 относительно ипсилатеральных ушных референтов А1 и А2, по Международной системе 10–20, с полосой пропускания усилителя 35 Гц, постоянной времени 0.1 с и частотой оцифровки 200 Гц.
При спектральном анализе безартефактных фрагментов ЭЭГ (не менее 30-ти эпох по 2 с) вычисляли значения абсолютной спектральной мощности 8-ми узких частотных поддиапазонов ЭЭГ (Δ – 2–4 Гц, θ1 – 4–6 Гц, θ2 – 6–8 Гц, α1 – 8–9 Гц, α2 – 9–11 Гц, α3 – 11–13 Гц, β1 – 13–20 Гц и β2 – 20–30 Гц) с их усреднением по трем клинически выделенным группам пациентов. Ранее в ряде исследований мы показали целесообразность выделения указанных узких частотных поддиапазонов ЭЭГ и их информативность в отношении тонкой оценки функционального состояния головного мозга пациентов с разными видами психической патологии (в том числе с аффективно-бредовыми расстройствами) [10–14].
Статистический анализ данных. Статистическую обработку комплекса количественных клинических данных и параметров ЭЭГ осуществляли непараметрическими методами с использованием пакета программ “Statistica для Windows, v.6.0”, а также статистических программ, встроенных в программное обеспечение для анализа ЭЭГ “BrainSys”. Достоверность различий количественных клинических показателей до и после курса терапии в каждой из трех групп больных определяли по критерию Уилкоксона для связанных выборок. Связи между исходными (зарегистрированными до начала курса терапии) индивидуальными значениями спектральной мощности узких частотных поддиапазонов ЭЭГ и значениями числа баллов по шкалам YMRS и PANSS после курса терапии выявляли методом корреляционного анализа (по Спирмену).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Клинические показатели терапевтического ответа. Клинические показатели эффективности проведенного курса терапии приведены в табл. 1.
Таблица 1.
Количественные клинические оценки (в баллах, M ± S.D.) психического состояния пациентов до начала и после курса терапии
| Шкала | Визит | Группа 1 | Группа 2 | Группа 3 |
|---|---|---|---|---|
| YMRS | до терапии | 38.6 ± 4.4 | 38.6 ± 6.7 | 39.1 ± 8.8 |
| после терапии | 6.9 ± 5.0** | 8.8 ± 3.1** | 7.7 ± 4.6* | |
| PANSS-поз | до терапии | 29.5 ± 7.3 | 27.4 ± 6.6 | 19.2 ± 6.8 |
| после терапии | 11.3 ± 2.1* | 12.5 ± 3.1** | 9.8 ± 2.6* | |
| PANSS-нег | до терапии | 18.7 ± 6.0 | 23.7 ± 7.5 | 19.4 ± 6.7 |
| после терапии | 14.3 ± 4.3* | 18.2 ± 7.1* | 17.9 ± 10.9 н/д | |
| PANSS-общ | до терапии | 49.7 ± 14.0 | 48.1 ± 17.9 | 41.0 ± 13.0 |
| после терапии | 29.6 ± 6.9* | 30.2 ± 8.4** | 24.9 ± 5.6* | |
| PANSS-сумма | до терапии | 96.2 ± 17.4 | 98.4 ± 25.2 | 76.8 ± 17.8 |
| после терапии | 55.3 ± 9.4** | 59.7 ± 14.5** | 50.8 ± 12.3* |
Данные, приведенные в табл. 1, наглядно иллюстрируют, что после курса терапии среднегрупповые значения большинства показателей использованных клинических оценочных шкал снизились во всех трех группах больных, что соответствовало улучшению психического состояния пациентов. Наиболее выраженный высоко достоверный (p < 0.01) терапевтический ответ был достигнут в отношении редукции маниакального аффекта по шкале YMRS (в среднем на 82, 77 и 81% в 1-й, 2-й и 3-й группах соответственно). Менее выраженный, но достоверный (p < 0.05), терапевтический ответ отмечался в отношении уменьшения позитивной симптоматики по подшкале PANSS-поз (в среднем на 62, 54 и 53% соответственно). Значения сумм баллов по подшкале общепсихопатологических симптомов PANSS-общ после курса терапии заметно снизились (в среднем на 40, 37 и 38%). То же отмечалось для общей суммы баллов шкалы PANSS-сумма (снижение в среднем на 43, 39 и 33%). Однако изменения по этим двум шкалам не достигли уровня статистической достоверности (p > 0.05).
Выраженность негативных симптомов (по подшкале PANSS-нег) во всех трех группах больных уменьшилась незначительно (в среднем на 24, 23 и 9%) и не достоверно (p > 0.05), что соответствует клиническим представлениям о резистентности негативной симптоматики к стандартной антипсихотической фармакотерапии [2, 4].
Динамика ЭЭГ в результате терапии. При сравнении топографических карт спектральной мощности до (рис. 1, А) и после курса терапии (рис. 1, Б) видно, что у пациентов всех трех групп после курса терапии возрастала выраженность низкочастотного α1-компонента (8–9 Гц) α-ритма в теменно-затылочных областях. У пациентов 1-й и 2-й групп он распространялся до лобно-центральных отведений. Высокочастотный α3-компонент (11–13 Гц) заметно редуцировался у пациентов 1-й группы и почти полностью исчезал в 3-й группе, тогда как у пациентов 2-й группы он сохранялся, лишь немного ослабевая.
Рис. 1.
Топографические карты спектральной мощности ЭЭГ, усредненные по трем выделенным клиническим группам пациентов (1, 2 и 3 соответственно) до (А) и после (Б) курса терапии. Под каждой из карт указан частотный поддиапазон ЭЭГ (в Гц), черно-белая шкала между группами карт А и Б – значения спектральной мощности ЭЭГ в мкВ2.
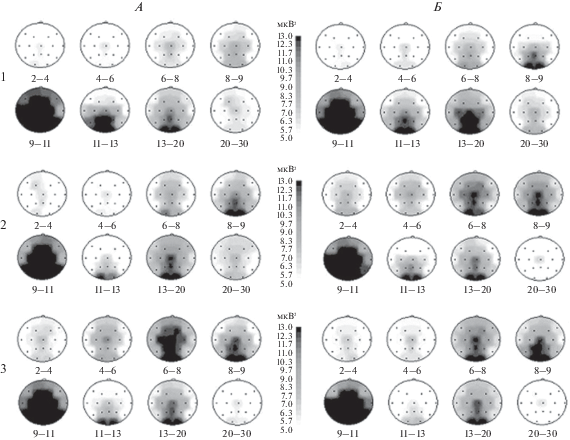
У больных 1-й и 3-й групп отмечалось практически полное исчезновение β2-ритма (20–30 Гц) и заметное уменьшение выраженности β1-ритма (13–20 Гц) в лобных и центрально-теменно-затылочных областях. У пациентов 2-й группы происходило лишь некоторое ослабление выраженности β1-ритма (13–20 Гц) в центрально-теменно-затылочных отведениях и β2-ритма (20–30 Гц) в затылочных областях.
Что касается низкочастотных ритмов ЭЭГ, то у пациентов 1-й группы происходило генерализованное усиление выраженности θ2-поддиапазона (6.0–8.0 кол/с) в лобно-центрально-теменно-затылочных областях и расширение топографии θ1-активности (4–6 Гц) до лобно-центральных областей. Локализация медленноволновой Δ- (2–4 Гц) и θ- (4.0–8.0 Гц) активности у пациентов 3-й группы не изменялась. У пациентов 2-й группы отмечалось усиление широко распространенной Δ- (2–4 Гц) и θ1-активности (4–6 Гц) с фокусами в лобно-центральных и затылочных зонах и θ2-активности (6.0–8.0 Гц) с фокусом в центрально-теменно-затылочных областях.
Изменение соотношения частотных компонентов α-ритма ЭЭГ в виде большей выраженности поддиапазона α1 (8–9 Гц) по сравнению с α3 (11–13 Гц), редукция β2-ритма (20–30 Гц) и существенное ослабление β1-ритма (13–20 Гц) в лобно-центрально-теменно-затылочных областях, а также появление и усиление выраженности θ2-активности (6.0–8.0 Гц) в лобно-центрально-теменно-затылочных областях указывает на улучшение баланса активирующих и тормозных процессов в коре головного мозга после курса терапии у пациентов 1-й и 3-й групп. Такая динамика ЭЭГ согласуется с более благоприятным, по клиническим оценкам, прогнозом течения заболевания у этих пациентов.
У пациентов 2-й группы, несмотря на некоторое усиление тормозных процессов в виде широкого распространения θ1- (4–6 Гц) и θ2- (6–8 Гц) активности в передних программирующих и задних ассоциативно-сенсорных областях в результате терапии, сохраняется преобладание спектральной мощности компонента α3 (11–13 Гц) над α1 (8–9 Гц) и лишь слабо уменьшается выраженность β1-ритма (13–20 Гц) в центрально-теменно-затылочных отведениях и β2-ритма (20–30 Гц) в затылочных зонах. Это указывает на сохранение преобладания активирующих процессов в ассоциативно-сенсорных областях коры и согласуется с неблагоприятным клиническим прогнозом пациентов 2-й группы.
ЭЭГ-показатели прогноза терапевтического ответа. Для выявления возможных ЭЭГ-показателей прогноза терапевтического ответа был проведен анализ корреляций между индивидуальными спектральными параметрами ЭЭГ, зарегистрированными до начала курса терапии, и количественными клиническими оценками состояния после курса терапии в трех клинически выделенных группах больных. Результаты корреляционного анализа приведены в табл. 2, где указаны ЭЭГ-отведения, в которых коэффициенты корреляции (по Спирмену) между исходными индивидуальными значениями спектральной мощности узких частотных поддиапазонов ЭЭГ и значениями числа баллов по шкалам YMRS и PANSS после курса терапии достигли уровня статистической достоверности отличия от нуля.
Таблица 2.
ЭЭГ-отведения, в которых коэффициенты корреляции между индивидуальными значениями числа баллов по шкалам YMRS и PANSS после курса терапии и значениями спектральной мощности узких частотных поддиапазонов ЭЭГ до начала терапии достигли уровня статистической достоверности (по Спирмену)
| Шкала | Группа 1 | Группа 2 | Группа 3 |
|---|---|---|---|
| YMRS_2 | н/д | F3β2*, C3β2**, C4β2*,
T3β2**, T4β2*, P3β2*, P4β2* |
−T3α2*, −T4α2*, −T3α3*, −T4α3*, −P3α3*, −P4α3* |
| PANSS поз_2 | F3θ2* | н/д | T3θ2*, C3α1*, T3α1*, T4α1* |
| PANSS нег_2 | −F3α3*, −F4α3*, −C3α3*, −C4α3*, −T3α3*, −T4α3*, −P3α3*, −P4α3*, −O1α3*, −O2α3* | н/д | −T3Δ*, −T4Δ*, −P3Δ*, −P4Δ*, −F3α2*, −F4α2*, −C3α2*, −C4α2*, −T3α2*, −T4α2* |
| PANSS общ_2 | н/д | F3Δ*, F4Δ**, C3Δ*, T3Δ*, P4Δ*, O1θ1*, O2θ1*, F3θ2*, F4θ2*, F3α2*, C3α2*, T3α2*, O2α2*, T3α3**, O1β1*, O2β1*, O2β2* |
F3Δ*, T3θ2* |
| PANSS сумма_2 | н/д | F3Δ*, F4Δ**, T3Δ**, P4Δ* |
н/д |
Примечание: F3, F4, C3, C4, T3, T4, P3, P4, O1, O2– ЭЭГ-отведения по Международной системе 10–20; Δ – 2–4 Гц, θ1 – 4–6 Гц, θ2 – 6–8 Гц, α1 – 8–9 Гц, α2 – 9–11 Гц, α3 – 11–13 Гц, β1 – 13–20 Гц, β2 – 20–30 Гц – узкие частотные поддиапазоны ЭЭГ; * – p < < 0.05, ** – p < 0.01, н/д – p > 0.05, знак минус – отрицательная корреляция.
Данные, приведенные в табл. 2, показывают, что структура корреляционных связей между значениями исходных (до начала терапии) спектральных показателей ЭЭГ и количественными клиническими оценками после курса терапии в трех группах больных существенно различается.
Так, в группе 1 не было выявлено ЭЭГ-кандидатов на роль возможных показателей прогноза выраженности маниакального аффекта по шкале YMRS. В группе 2 в качестве таких показателей выступают значения спектральной мощности β2-активности (20–30 Гц) в левом лобном и в центральных, височных и теменных отведениях обоих полушарий. Причем, чем более выражена β2-активность, отражающая преобладание процессов возбуждения, в ЭЭГ больных этой группы до начала терапии, тем в большей степени у них сохраняются симптомы мании после курса терапии. В группе 3 в качестве возможных предикторов терапевтического ответа по шкале YMRS оказались значения спектральной мощности основного среднечастотного α2-ритма (9–11 Гц) в обеих средневисочных областях и высокочастотного α3-ритма (11–13 Гц) в средневисочных и в теменных зонах обоих полушарий. При этом, чем выше эти ЭЭГ-показатели до начала терапии, тем лучше терапевтический ответ этих больных в отношении симптомов мании (меньше сумма баллов по шкале YMRS) после курса терапии.
В отношении прогноза терапевтического ответа по общей сумме баллов шкалы PANSS (PANSS-сумма) информативные параметры ЭЭГ выявились только в группе 2. Ими оказались исходные значения спектральной мощности Δ-активности в обоих лобных, левом средневисочном и правом теменном отведениях. Чем выше были эти ЭЭГ-показатели сниженного функционального состояния коры до начала терапии, тем слабее был терапевтический ответ (больше общая сумма баллов шкалы PANSS после курса терапии). В группах 1 и 3 ЭЭГ-кандидатов на роль возможных показателей прогноза терапевтического ответа по общей сумме баллов шкалы PANSS выявлено не было.
Что касается возможных ЭЭГ-показателей прогноза редукции позитивной симптоматики (по шкале PANSS-поз), то в группе 1 выявилось только одно значение спектральной мощности θ2-активности в левом лобном отведении, а в группе 3 – значения спектральной мощности θ2-активности и α1-активности в левом средневисочном отведении и α1-активности в левом центральном и правом средневисочном отведениях, что отражает исходно несколько сниженное функциональное состояние коры, обуславливающее более слабый терапевтический ответ (большую сумму баллов по подшкале PANSS-поз после курса терапии).
Достоверные корреляции исходных параметров ЭЭГ с клиническими оценками выраженности негативных симптомов (по подшкале PANSS-нег) после курса терапии также выявились только в 1-й и 3-й группах больных.
В группе 1 они относились к значениям спектральной мощности α3-активности в лобных, центральных, средневисочных, теменных и затылочных отведениях обоих полушарий. Большие значения этих ЭЭГ-показателей, отражающих преобладание процессов возбуждения в коре головного мозга, ассоциировались с меньшей выраженностью остаточных негативных симптомов (в виде меньших значений суммы баллов по подшкале PANSS-нег) после курса терапии.
В группе 3 такими ЭЭГ-показателями оказались значения спектральной мощности Δ-активности в обоих средневисочных и в теменных отведениях, а также α2-активности в лобных, центральных и средневисочных отведениях обоих полушарий. Отрицательный знак коэффициентов корреляции этих исходных параметров ЭЭГ, отражающих преобладание тормозных процессов в этих областях коры, с клиническими оценками выраженности негативных симптомов после курса терапии свидетельствует о роли дефицита тормозных процессов в проявлении не только позитивных, но и негативных симптомов (по крайней мере, в этой группе больных).
В группе 2 достоверных корреляций исходных параметров ЭЭГ с клиническими оценками выраженности позитивных симптомов (по подшкале PANSS-поз) и негативных симптомов (по подшкале PANSS-нег) после курса терапии не выявилось. Зато в отношении общепсихопатологических симптомов оказалось, что более слабый терапевтический ответ (в виде больших значений суммы баллов по подшкале PANSS-общ после курса терапии) связан с исходно большими значениями спектральной мощности ЭЭГ в широком частотном диапазоне (Δ, θ1, θ2, α3, β1 и β2) и в большинстве (с левополушарным акцентом) ЭЭГ-отведений, т.е. с более выраженной синхронизацией и общей амплитудой ЭЭГ до начала терапии.
В группе 1 по этому клиническому показателю корреляции не достигли уровня статистической достоверности, а в группе 3 выявилось только два параметра исходной ЭЭГ – значения спектральной мощности Δ-активности в левом лобном и θ2-активности в левом средневисочном отведениях, отражающие исходно сниженное функциональное состояние лобно-височных областей коры левого полушария, обуславливающее более слабый терапевтический ответ по подшкале общепсихопатологических симптомов (PANSS-общ), что наблюдалось и в группе 2.
В совокупности, полученные данные свидетельствуют о том, что ряд параметров фоновой ЭЭГ, зарегистрированной до начала курса терапии, можно рассматривать в качестве кандидатов на роль предикторов индивидуального терапевтического ответа у пациентов с маниакально-бредовыми и маниакально-парафренными состояниями. Эти параметры ЭЭГ, в основном, отражают либо исходно сниженное функциональное состояние головного мозга, в частности, лобно-височных отделов коры, либо ее исходную гиперактивацию, т.е. нарушение нормального соотношения процессов возбуждения и торможения. При этом структура корреляционных связей между значениями исходных (до начала терапии) спектральных показателей ЭЭГ и количественными клиническими оценками после курса терапии существенно различается в группах больных с разной клинико-психопатологической структурой синдрома. Это согласуется с ранее полученными нами данными о различиях в наборах ЭЭГ-предикторов прогноза терапевтического ответа у пациентов с депрессивно-бредовыми [12], маниакально-бредовыми [13] и галлюцинаторно-бредовыми [14] расстройствами. Таким образом, вариации нарушения соотношения процессов возбуждения и торможения, отражающееся в параметрах исходной фоновой ЭЭГ, по-видимому, обуславливают как особенности клинических проявлений психического расстройства, так и адаптивные ресурсы головного мозга в плане возможности и величины индивидуального терапевтического ответа пациента.
Ограничения работы определяются относительно небольшими объемами выборок и включению в данное исследование больных только женского пола, что требует, в перспективе, увеличения объема выборок и сбалансированности гендерного состава пациентов.
ЗАКЛЮЧЕНИЕ
Полученные данные указывают на то, что комплексы ЭЭГ-показателей, зарегистрированных до начала курса терапии, отражают не только текущее функциональное состояние головного мозга, но и его адаптивные ресурсы в плане возможности и величины ответа пациента на терапию. Их использование, в перспективе, позволит осуществлять индивидуальный прогноз эффективности стандартной синдромально обусловленной курсовой терапии, на этой основе своевременно корректировать терапию для достижения ремиссии удовлетворительного качества, и тем самым оптимизировать лечение таких тяжелых социально-значимых психических заболеваний как эндогенные психические расстройства. При построении перспективных моделей индивидуального прогноза терапевтического ответа по исходным ЭЭГ-показателям необходимо будет учитывать и индивидуальные особенности клинико-психопатологической структуры синдрома конкретного пациента.
Этические нормы. Все исследования проведены в соответствии с принципами биомедицинской этики, сформулированными в Хельсинкской декларации 1964 г. и ее последующих обновлениях, и одобрены локальным биоэтическим комитетом Научного центра психического здоровья (Москва).
Информированное согласие. Каждый участник исследования представил добровольное письменное информированное согласие, подписанное им после разъяснения ему потенциальных рисков и преимуществ, а также характера предстоящего исследования.
Финансирование работы. Исследование поддержано РФФИ (грант № 18-01-00029а).
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией данной статьи.
Список литературы
Тиганов А.С. Эндогенные аффективные расстройства: проблемы систематики и типологии // Вестник Российской академии медицинских наук. 2011. № 4. С. 4.
Краснов В.Н. Расстройства аффективного спектра. М.: Практическая медицина, 2011. 432 с.
Knoweles R., McCarthny-Jones S., Rowse G. Grandiose delusions: A review and theoretical integration of cognitive and affective perspectives // Clinical Psychology Review. 2011. V. 31. P. 684.
Мосолов С.Н., Потапов В.В., Цукарзи Э.Э. Стандартизированные клинико-функциональные критерии терапевтической ремиссии при шизофрении. Учебно-методическое пособие. М.: изд-во НМИЦ психиатрии и наркологии им. В.П. Сербского, 2017. 72 с.
Cook I.A. Biomarkers in psychiatry: potentials, pitfalls, and pragmatics // Primary Psychiatry. 2008. V. 15. № 3. P. 54.
Small J.G., Milstein V., Malloy F.W. et al. Clinical and quantitative EEG studies of mania // J. Affect. Disord. 1999. V. 53. P. 217.
Iosifescu D.V. Electroencephalography-derived biomarkers of antidepressant response // Harv. Rev. Psychiatry. 2011. V. 19. № 3. P. 144.
Johannesen J.K., O’Donnell B.F., Shekhar A. et al. Diagnostic specificity of neurophysiological endophenotypes in schizophrenia and bipolar disorder // Schizophrenia Bulletin. 2013. V. 39. № 6. P. 1219.
Boutros N.N., Mucci A., Vignapiano A., Galderisi S. Electrophysiological Aberrations Associated with Negative Symptoms in Schizophrenia // Curr. Top. Behav. Neurosci. 2014. V. 21. P. 129.
Изнак А.Ф., Тиганов А.С., Изнак Е.В., Сорокин С.А. ЭЭГ-корреляты и возможные предикторы эффективности терапии эндогенной депрессии // Физиология человека. 2013. Т. 39. № 4. С. 49.
Изнак А.Ф., Изнак Е.В., Олейчик И.В. и др. ЭЭГ-корреляты лобной дисфункции как предикторы относительной фармакорезистентности при терапии эндогенных аффективных расстройств // Журн. неврологии и психиатрии им. С.С. Корсакова. 2014. Т. 114. № 12. С. 54.
Изнак А.Ф., Изнак Е.В., Клюшник Т.П., и др. Нейрофизиологические и нейроиммунологические показатели прогноза эффективности терапии аффективно-бредовых состояний в рамках приступообразной шизофрении // Психиатрия. 2014. № 2. С. 47.
Изнак А.Ф., Изнак Е.В., Клюшник Т.П. и др. Регрессионные модели взаимосвязей клинических и нейробиологических показателей при терапии маниакально-бредовых состояний в рамках приступообразной шизофрении // Журн. неврологии и психиатрии им. С.С. Корсакова. 2016. Т. 116. № 3. С. 33.
Iznak A.F., Iznak E.V., Klyushnik T.P. et al. Neurobiological parameters in quantitative prediction of treatment outcome in schizophrenic patients // J. Integrative Neuroscience. 2018. V. 17. № 3. P. 221.
Митрофанов А.А. Компьютерная система анализа и топографического картирования электрической активности мозга с нейрометрическим банком ЭЭГ-данных (описание и применение). М., 2005. 63 с.
Дополнительные материалы отсутствуют.
Инструменты
Физиология человека


