Физиология человека, 2019, T. 45, № 6, стр. 44-51
Функциональная связанность (по данным фМРТ покоя) дорсолатеральной префронтальной коры и левой височной речевой области у психически здоровых родственников первой степени родства больных шизофренией
Я. Р. Паникратова 1, *, И. С. Лебедева 1, А. Н. Помыткин 1, У. О. Попович 1, П. С. Кананович 1, И. В. Клочкова 1, А. Д. Румшиская 1, В. Г. Каледа 1
1 ФГБНУ Научный центр психического здоровья
Москва, Россия
* E-mail: panikratova@mail.ru
Поступила в редакцию 12.10.2018
После доработки 06.03.2019
Принята к публикации 04.04.2019
Аннотация
Известно, что у больных шизофренией находят нарушение функционального взаимодействия между зонами мозга, связанными с регуляторными и речевыми функциями. Однако данные особенности до сих пор не были исследованы у их “непораженных” родственников – последнее является крайне значимым в рамках поиска нейробиологических показателей, ассоциированных с генетической архитектурой шизофрении (т.н. черт или эндофенотипов). Целью данной работы стала проверка гипотезы об изменении функциональной связанности (ФС) дорсолатеральной префронтальной коры (ДЛПФК) с речевой зоной в височных отделах левого полушария у “непораженных” родственников больных шизофренией (12 чел.), по сравнению с испытуемыми без наследственного отягощения по психическим заболеваниям (13 чел.), по данным функциональной магнитно-резонансной томографии (фМРТ) покоя, полученным на томографе Philips 3T. Группы были также сравнены по показателям нейропсихологического теста вербальных ассоциаций и шкале выраженности продромальных симптомов. В основной группе было найдено повышение ФС между левой ДЛПФК и речевой зоной в височных отделах левого полушария, хотя межгрупповых различий по другим тестируемым показателям и корреляций между ними и ФС выявлено не было. Полученные результаты, предположительно, могут отражать компенсаторные мозговые процессы в группе психически здоровых родственников больных шизофренией.
Поиск нейробиологических профилей эндогенных психических заболеваний, связанных с генетической архитектурой болезни, т.н. черт или эндофенотипов, является широко распространенным современным направлением исследований на стыке психиатрии и нейронаук. Один из подходов в рамках поиска эндофенотипов – это обследование “непораженных” (психически здоровых) родственников первой степени родства [1]. Этот подход представляется продуктивным, т.к. позволяет глубже изучить патофизиологические механизмы заболевания: с одной стороны, обнаружить сходные с пациентами отклонения, отражающие потенциальные факторы “уязвимости” (предрасположения) к развитию заболевания, с другой стороны, компенсаторные процессы, благодаря которым родственники пациентов не заболевают (в современной англоязычной литературе для описания этого феномена используется термин “resilience”, означающий сопротивляемость психофизиологического единства психики и организма процессам болезни [2]). Изучение структурно-функциональных эндофенотипов психических заболеваний включает широкой диапазон направлений, в том числе изучение морфометрических особенностей коры, подкорковых образований и трактов белого вещества, однако в данном исследовании мы сконцентрировали внимание на функциональных особенностях головного мозга “непораженных” родственников первой степени родства больных шизофренией.
Одним из наиболее востребованных подходов здесь является такой неинвазивный и высокоинформативный подход, как функциональная магнитно-резонансная томография (фМРТ). В связи с ограничениями фМРТ, связанной с выполнением задачи (высокая зависимость результатов от конкретной выбранной задачи и особенностей предъявления стимульного материала), в последнее время наиболее широко применяется фМРТ покоя, при которой регистрация данных проводится в отсутствие “внешней” задачи. Данный метод основан на подсчете корреляций спонтанных низкочастотных (<0.1 Гц) колебаний BOLD-сигнала (“blood oxygenation level dependent”) в различных зонах головного мозга и глубинных структурах [3]. Применение фМРТ покоя позволяет увидеть общие особенности функционирования мозга в норме и патологии (функциональные профили), в отличие от частной ситуации выявления активации определенных областей мозга при выполнении конкретной задачи.
Исследования родственников больных шизофренией с применением фМРТ покоя немногочисленны. В основном, исследуется функциональная связанность (ФС) в рамках крупных нейронных сетей – в первую очередь, дефолтной сети (“default mode network”) [4–6]. Полученные в этих исследованиях результаты указывают на сходство особенностей функционирования мозга данной группы испытуемых с больными шизофренией [7]. Вне поля зрения исследователей остается, однако, такой значимый маркер заболевания, как нарушение взаимодействия между зонами мозга, связанными с речевыми и регуляторными функциями (“executive functions”).
Нарушение структурной и функциональной связанности считается базовым механизмом шизофрении [8], в связи с чем данное заболевание называют синдромом дисконнекции (“dysconnectivity syndrome”). Исследования ФС при шизофрении, по сравнению с группой здорового контроля, показали, в частности, снижение ФС префронтальной коры [9–11] и изменение ФС во фронто-темпоральной сети [12].
В данном контексте большое внимание исследователями уделяется анализу взаимосвязи между позитивными симптомами и взаимодействием таких областей головного мозга, как дорсолатеральная префронтальная кора (ДЛПФК) и височные зоны левого полушария [13–17]. В частности, было показано, что один из ключевых симптомов при шизофрении – вербальные галлюцинации [18, 19] – связан с “растормаживанием” активности левой височной доли в результате нарушения ФС между лобными и височными отделами; “усиленные” сигналы снизу вверх (bottom-up) из вторичных височных отделов левого полушария , связанных с восприятием речи, сочетаются с “ослабленными” сигналами сверху-вниз (top-down) из зон, связанных с регуляторными функциями: дорсолатеральная префронтальная, передняя поясная, дополнительная моторная кора [18, 20]. В соответствии с одной из гипотез, с точки зрения психологических механизмов это проявляется как нарушение осознания больным своих собственных намерений при порождении внутренней речи (“verbal self-monitoring”) и атрибуция речи источнику вовне [21]: восприятие собственной внутренней речи не сопровождается сигналами из префронтальной коры, которые бы указывали на то, что речь порождается самим субъектом [13].
Несмотря на впечатляющий массив накопленных данных по больным шизофренией, в доступной литературе отсутствуют данные о том, наблюдаются ли выявленные функциональные особенности головного мозга у их родственников. Это определило цель данного исследования – сопоставление ФС ДЛПФК и левой височной речевой области в группах родственников больных шизофренией и испытуемых без наследственного отягощения по психическим заболеваниям. Дополнительной целью стала проверка наличия различий между группами по нейропсихологическому тесту вербальных ассоциаций, поскольку он направлен на оценку как регуляторных, так и речевых функций [22]; на оценку функционирования как лобных, так и височных областей мозга [23, 24], например, выполнение вербальных ассоциаций на букву связано с активацией левой ДЛПФК и деактивацией верхней височной извилины [25]. Более того, у больных шизофренией были выявлены нарушения выполнения данной пробы [26, 27].
МЕТОДИКА
В исследовании принимали участие 25 практически здоровых испытуемых, в том числе 12 родственников первой степени родства больных шизофренией (8 женщин, средний возраст 24 ± 4) и 13 испытуемых без наследственного отягощения по психическим заболеваниям (7 женщин, средний возраст 25 ± 3). Группы статистически значимо не отличались по возрасту (Т-критерий Стьюдента; t = 0.46, p = 0.65) и полу (критерий хи-квадрат Пирсона; χ2 = 4.23, p = 0.11). Все испытуемые по самоотчету были праворукими; на момент обследования были соматически здоровы и не имели противопоказаний к прохождению всех этапов исследования.
Материалы и методы. Обследование методами нейровизуализации проводили на томографе Philips 3Т (Филипс, Голландия). На первом этапе получили анатомические T1-изображения (170 срезов, размер воксела 1 × 1 × 1 мм, MPR; TR/TE/FA = 8 мс/4 мс/8°). Функциональные T2*- изображения фМРТ покоя получили с помощью последовательности EPI (TR/TE/FA = 3 с/35 мс/ 90°), 100 измерений, 35 срезов, матрица 128 × × 128 вокселов, размер воксела 1.8 × 1.8 × 4 мм. Во время фМРТ-сканирования испытуемые лежали неподвижно с открытыми глазами, фиксируя взгляд на белом кресте в центре серого поля монитора в течение 5 мин. Испытуемым дали инструкцию избегать любой систематической мыслительной деятельности.
Нейропсихологическое обследование проводили с использованием теста вербальных ассоциаций (“Verbal fluency”) батареи Delis–Kaplan Executive Function System [28]. Тест состоял из трех субтестов: ассоциации на букву (К, Р, П по отдельности); ассоциации в рамках заданных категорий “животные” и “мужские имена” (по отдельности); переключения в рамках заданных категорий “фрукты” и “мебель” (называть то фрукт, то мебель). Оценивали следующие показатели: среднее количество потерь инструкции, среднее количество повторов, среднее количество верных ответов для каждого из трех субтестов, а также количество верных переключений в третьем субтесте. Исследование проводили в тот же день, что и МРТ, максимально приближенно по времени к томографическому обследованию. В группе контроля отсутствовали данные теста вербальных ассоциаций для 2 испытуемых, в группе родственников – для 3 испытуемых.
Кроме того, все испытуемые были обследованы психиатром и признаны психически здоровыми. Также был проведен психометрический анализ с использованием шкалы SOPS (the Scale of Prodromal Symptoms, Шкала оценки продромальных симптомов) [29]. В данной работе использовали общий балл, отражающий общую степень выраженности симптомов. Поскольку среди испытуемых без наследственного отягощения по психическим заболеваниям данные по шкале SOPS имелись только у 7 чел. из 13, для увеличения контрольной группы, соответствующей группе родственников больных шизофренией по возрасту и полу, были привлечены дополнительные данные; в итоговую группу испытуемых без наследственного отягощения по психическим заболеваниям для межгрупповых сравнений по шкале SOPS вошло 15 испытуемых (6 мужчин и 9 женщин; средний возраст 25.7 ± 3).
Обработка данных. Предобработку изображений проводили с использованием пакета SPM12 (http://www.fil.ion.ucl.ac.uk/spm/software/spm12/). Изображения ориентировали параллельно плоскости, проходящей через переднюю и заднюю комиссуры (AC/PC). Производилась коррекция метрических искажений, возникающих вследствие неоднородности магнитного поля и его взаимодействия с движением головы испытуемого (realign и unwarp), корректировка смещения во времени измерений в рамках одного объема головного мозга, совмещение функциональных изображений с анатомическими, выделение в анатомических изображениях серого, белого вещества и спинно-мозговой жидкости, приведение всех изображений к координатам пространства MNI (при этом размер воксела анатомических изображений остался прежним, размер воксела функциональных изображений был изменен на 3 × 3 × 3 мм), пространственное сглаживание функциональных изображений (8 мм). Дальнейшую обработку данных фМРТ покоя проводили с помощью CONN-fMRI toolbox 17.b (https://www.nitrc.org/projects/conn).
С целью снижения веса в анализе измерений, во время регистрации которых наблюдалось движение головы испытуемых, выполняли процедуру “ART-based identification of outlier scans for scrubbing” (принимались пороговые значения показателей движения головы, которым соот-ветствовало исключение 3% изображений в нормативной выборке). Для коррекции артефактов, связанных с движениями головы, на этапе шумоподавления выделяли вокселы, флуктуации BOLD-сигнала в которых коррелировали с колебаниями сигнала в белом веществе или спинномозговой жидкости по индивидуальным картам (aCompCor) [30]. Использовали частотный фильтр 0.008 < f < 0.09 Гц. Индивидуальные параметры движения были включены в модель в качестве ковариаты первого уровня, возраст – в качестве ковариаты второго уровня. Данные фМРТ покоя обрабатывали методом анализа ФС между зонами интереса (“ROI-to-ROI”, region of interest to another region of interest) в состоянии покоя испытуемого (подсчет корреляций спонтанных низкочастотных колебаний BOLD-сигнала между зонами интереса). Связи оценивали с помощью коэффициентов корреляции с трансформацией Фишера. Зоны интереса взяли из атласа лаборатории функциональной нейровизуализации нейропсихиатрических расстройств (functional imaging in neuropsychiatric disorders) Стэнфордского университета (https://findlab. stanford.edu/functional_ROIs.html; [31]), включающего 14 функциональных сетей, полученных методом независимых компонент на данных фМРТ покоя. Данный атлас использовался нами и в предыдущих работах и был выбран из-за свободного доступа и наличия в нем речевой сети, которая во многих атласах не выделяется. Зоны интереса в данном исследовании включали компоненты регуляторной сети (ДЛПФК левого и правого полушария) и височный компонент речевой сети (рис. 1). Последний компонент с высокой долей вероятности является зоной Вернике, которая традиционно считалась расположенной в задней трети верхней височной извилины левого полушария, однако, по современным данным, характеризуется крайне вариативным расположением среди здоровых взрослых людей, что было показано как с помощью фМРТ, связанной с задачей, так и с помощью фМРТ покоя [32]. Характеристики зон интереса приведены в табл. 1. Все зоны интереса отсортировали по маске серого вещества. Проверяли две гипотезы: о межгрупповых различиях ФС сначала левой ДЛПФК, затем правой ДЛПФК с зоной интереса из речевой сети.
Рис. 1.
Зоны интереса для ROI-to-ROI анализа: левая (A) и правая (Б) ДЛПФК (соответственно относящиеся к левой и правой регуляторным сетям), (В) компонент речевой сети в задней части средней височной извилины левого полушария (атлас W.R. Shirer et al. [31]). Маски зон интереса наложены на шаблон индивидуального мозга в пространстве MNI. Цифрами обозначены номера срезов.
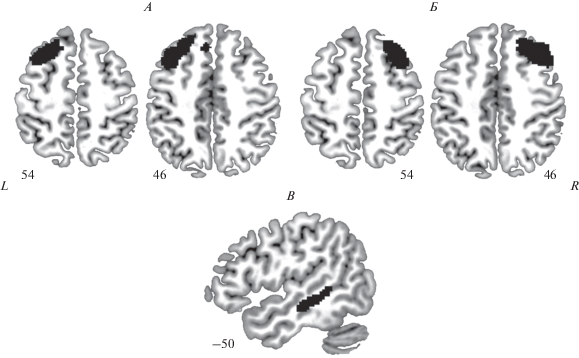
Таблица 1.
Средний объем (мм3) и средний центр масс для выбранных зон интереса
| Зона интереса | Функциональная сеть, из которой взята зона интереса |
Средний объем (мм3) | Средний центр масс |
|---|---|---|---|
| Левая ДЛПФК | Регуляторная сеть | 12 008 | {–30; 23.4; 48.9} |
| Правая ДЛПФК | 16 744 | {38.1; 26.1; 42.4} | |
| Компонент в задней части средней височной извилины левого полушария | Речевая сеть | 2536 | {–52.1; –31.1; –5.8} |
Для результатов выбрали уровень статистической значимости q(FDR-corrected) < 0.05, стандартный для ROI-to-ROI анализа. Поскольку отдельный анализ проводили для ФС левой и правой ДЛПФК с зоной интереса из речевой сети, уровень статистической значимости корректировали с учетом множественных сравнений (q(FDR-corrected) < 0.05/2, т.е. q(FDR-corrected) < 0.025).
Статистический анализ нейропсихологических данных, а также данных по шкале SOPS проводили с использованием программы IBM SPSS Statistics 21. Для межгруппового сравнения использовали непараметрический критерий для двух независимых выборок U-Манна-Уитни. Порог значимости для результатов по тесту вербальных ассоциаций также корректировали на множественные сравнения (p < 0.05/10, т.е. p < 0.005).
В случае получения значимых результатов при обработке фМРТ-данных планировалось подсчитать коэффициенты корреляции Спирмана между показателями ФС и нейропсихологическими показателями.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
По результатам ROI-to-ROI анализа в группе родственников больных шизофренией, по сравнению с испытуемыми без наследственного отягощения по психическим заболеваниям, была выявлена большая ФС левой ДЛПФК с речевой зоной в височных отделах левого полушария (p = = 0.0127, проходит поправку на множественные сравнения с порогом q(FDR-corrected) < 0.025) (рис. 2).
Рис. 2.
Результаты ROI-to-ROI анализа: большая ФС левой ДЛПФК с височной речевой зоной в левом полушарии в группе родственников больных шизофренией, по сравнению с испытуемыми без наследственного отягощения по психическим заболеваниям (p = 0.0127).

Поскольку в данном анализе зоны интереса были взяты из атласа [31] и не были индивидуализированы, мы провели post hoc анализ на индивидуализированных зонах интереса. Получение индивидуализированных зон интереса включало несколько этапов. Функциональные изображения МРТ, прошедшие предобработку, далее подвергались групповому анализу (2 группы: родственники больных шизофренией и испытуемые без наследственного отягощения по психическим заболеваниям) методом выделения независимых компонент (n = 20; порог z > 1) с помощью программного обеспечения GIFT 3.0a (http:// icatb.source-forge.net). Из компонент каждой группы методом пространственной сортировки на основе атласа [31] и экспертной оценки выделялись компоненты, являющиеся речевой и правой и левой регуляторными сетями. Далее из группового анализа извлекались индивидуальные компоненты, которые были обрезаны по маскам средней лобной извилины правого и левого полушария, а также верхней и средней височных извилин левого полушария атласа Harvard-Oxford [33] для получения индивидуализированных зон интереса соответственно в левой и правой ДЛПФК и височных отделах левого полушария. Затем была проведена процедура анализа ФС между данными зонами интереса с помощью CONN-fMRI toolbox 17.b. Результаты основного анализа были подтверждены результатами анализа с индивидуализированными зонами интереса: в группе родственников больных шизофренией, по сравнению с испытуемыми без наследственного отягощения по психическим заболеваниям, была выявлена большая ФС левой ДЛПФК с речевой зоной в височных отделах левого полушария (p = = 0.0133 при пороге с учетом множественных сравнений q(FDR-corrected) < 0.025).
С учетом поправки на множественные сравнения межгрупповых различий на достоверном уровне значимости (p < 0.005) ни по одному показателю вербальных ассоциаций обнаружено не было. Межгрупповых различий по шкале SOPS на уровне значимости p < 0.05 не наблюдалось. Значимых корреляций нейропсихологических показателей с показателями ФС в группе родственников больных шизофренией выявлено не было.
Данное исследование было связано с поиском эндофенотипов шизофрении, а именно – направлено на проверку гипотезы об изменении ФС ДЛПФК с речевой зоной в височных отделах левого полушария у “непораженных” родственников больных шизофренией, по сравнению с испытуемыми без наследственного отягощения по психическим заболеваниям. Актуальность исследования определялась тем, что, несмотря на выявленную у больных шизофренией сниженную ФС ДЛПФК и височных зон [13–16], особенности функционального взаимодействия между указанными зонами не были исследованы у родственников пациентов. Выявленные результаты позволили впервые показать наличие в группах семейного риска по шизофрении особенностей ФС мозговых областей, связанных с регуляторными и речевыми функциями.
Произвольный контроль психической деятельности, доступный лишь человеку благодаря филогенетическому и онтогенетическому развитию в социальном контексте, связан с возможностью овладения и сознательного управления своими высшими психическими функциями с помощью речи [34–36]. Такие наиболее поздние и сложные эволюционные образования, как речевые и регуляторные функции, находящиеся в тесном взаимодействии, характеризуются высокой подверженностью нарушениям при различных заболеваниях, в частности, при шизофрении. Однако, в отличие от сниженной ФС между лобными и височными отделами у больных шизофренией, родственники больных шизофренией продемонстрировали бо'льшую ФС между данными зонами, по сравнению с контролем.
Известно, что ДЛПФК, являющаяся зоной интереса в данном анализе, обладает реципрокными связями практически со всеми корковыми и подкорковыми мозговыми структурами, что позволяет ей координировать и интегрировать функционирование остальных отделов мозга, включая ассоциативные области, связанные с пониманием речи [37]. Можно высказать предположение, что в основе найденных нами результатов лежат девиации “top-down” процессов (увеличение влияния ДЛПФК на височные речевые зоны левого полушария), хотя особенности методологии (анализ ФС) не позволяют делать выводы о направленности взаимодействия между зонами мозга.
По определению E.P. Ganella et al. [2], особенности ФС в головном мозге, отличающие “непораженных” родственников больных шизофренией от “пораженных” родственников и общей популяции, могут рассматриваться как компенсаторные процессы, благодаря которым эти люди не заболевают, хотя имеют генетическую предрасположенность к заболеванию (“resilience ma---rkers”) [38, 39]. Таким образом, возможной интерпретацией полученных результатов является то, что выявленные нами особенности могут отражать компенсаторные мозговые процессы в группе “непораженных” родственников больных шизофренией. Отсутствие межгрупповых различий по показателям вербальных ассоциаций и общему баллу по шкале SOPS, вероятно, также может быть связано с успешной компенсацией в группе родственников больных шизофренией, в частности, с усилением ФС между лобными и височными областями; тем не менее, данное предположение требует дальнейшей проверки.
Авторы статьи учли также альтернативную возможную интерпретацию полученных результатов: родственники людей с психическими заболеваниями, по сравнению с испытуемыми без наследственного отягощения, могут испытывать больший стресс при прохождении психологического и МРТ-обследования в связи с осознанием повышенной вероятности выявления признаков заболевания. Однако, по данным литературы [40], стресс оказывает влияние на дефолтную сеть и сеть определения значимости (“salience network”), но по результатам большинства исследований не влияет на регуляторную сеть, в которую входит ДЛПФК. Тем не менее, с целью проверки, не связан ли полученный результат с повышенным стрессом в группе родственников больных шизофренией, был проведен post hoc ROI-to-ROI анализ ФС в рамках левой и правой регуляторных сетей по отдельности (маски были взяты из того же атласа [31]), различий между группами выявлено не было.
Ограничением данного исследования является сравнительно небольшой размер выборок. Однако в отличие от фМРТ-исследований, в которых анализируются все вокселы в полном объеме головного мозга, в данной работе повоксельный анализ не проводился. Напротив, проверялись по отдельности лишь две гипотезы: о межгрупповых различиях по ФС левой ДЛПФК с речевой зоной в левой височной доле и аналогичная гипотеза относительно правой ДЛПФК. Учитывая этот факт, а также большой размер полученного нами эффекта (Cohen’s d = 0.97), статистическая мощность, определяемая размером выборки, представляется значимым, но не ключевым фактором при рассмотрении полученных данных. Кроме того, исследования групп семейного риска по развитию психических заболеваний ограничены по объему выборок, поскольку подобный контингент испытуемых неохотно идет на контакт [2, 41–43].
ВЫВОДЫ
1. В группе “непораженных” родственников больных шизофренией, по сравнению с испытуемыми без наследственного отягощения по психическим заболеваниям, было выявлено усиление ФС левой ДЛПФК с височной речевой зоной левого полушария, что может являться отражением компенсаторных мозговых процессов.
2. Отсутствие межгрупповых различий по показателям вербальных ассоциаций и общему баллу по шкале SOPS, вероятно, может быть связано с успешной компенсацией, в частности, на уровне мозговых процессов в группе родственников больных шизофренией, например, с усилением ФС между лобными и височными областями.
Этические нормы. Все исследования проведены в соответствии с принципами биомедицинской этики, сформулированными в Хельсинкской декларации 1964 г. и ее последующих обновлениях, и одобрены локальным биоэтическим комитетом Научного центра психического здоровья (Москва).
Информированное согласие. Каждый участник исследования представил добровольное письменное информированное согласие, подписанное им после разъяснения ему потенциальных рисков и преимуществ, а также характера предстоящего исследования.
Финансирование работы. Работа выполнена при поддержке РФФИ (грант № 17-06-00985).
Благодарности. Авторы выражают благодарность Р.М. Власовой за помощь в обработке данных и обсуждении результатов исследования.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией данной статьи.
Список литературы
Gottesman I.I., Gould T.D. The endophenotype concept in psychiatry: etymology and strategic intentions // Am. J. Psychiatry. 2003. V. 160. № 4. P. 636.
Ganella E.P., Seguin C., Bartholomeusz C.F. et al. Risk and resilience brain networks in treatment-resistant schizophrenia // Schizophr Res. 2018. V. 193. P. 284.
Reineberg A.E., Andrews-Hanna J.R., Depue B.E. et al. Resting-state networks predict individual differences in common and specific aspects of executive function // Neuroimage. 2015. V. 104. P. 69.
Peeters S.C., van de Ven V., Gronenschild E.H. et al. Default mode network connectivity as a function of familial and environmental risk for psychotic disorder // PLoS One. 2015. V. 10. № 3. P. e0120030.
Galindo L., Bergé D., Murray G.K. et al. Default Mode network aberrant connectivity associated with neurological soft signs in schizophrenia Patients and Unaffected relatives // Front. Psychiatry. 2018. V. 8. P. 298.
Meda S.A., Ruaño G., Windemuth A. et al. Multivariate analysis reveals genetic associations of the resting default mode network in psychotic bipolar disorder and schizophrenia // PNAS. 2014. V. 111. № 19. P. E2066.
Hu M.L., Zong X.F., Mann J.J. et al. A review of the functional and anatomical default mode network in schizophrenia // Neurosci. Bull. 2017. V. 33. № 1. P. 73.
Friston K., Brown H.R., Siemerkus J., Stephan K.E. The dysconnection hypothesis (2016) // Schizophrenia research. 2016. V. 176. № 2–3. P. 83.
Pettersson-Yeo W., Allen P., Benetti S. et al. Dysconnectivity in schizophrenia: where are we now? // Neurosci. Biobehav. Rev. 2011. V. 35. № 5. P. 1110.
Cole M.W., Anticevic A., Repovs G., Barch D. Variable global dysconnectivity and individual differences in schizophrenia // Biol. Psychiatry. 2011. V. 70. № 1. P. 43.
Woodward N.D., Rogers B., Heckers S. Functional resting-state networks are differentially affected in schizophrenia // Schizophr. Res. 2011. V. 130. № 1–3. P. 86.
Khadka S., Meda S.A., Stevens M.C. et al. Is aberrant functional connectivity a psychosis endophenotype? A resting state functional magnetic resonance imaging study // Biol. Psychiatry. 2013. V. 74. № 6. P. 458.
Lawrie S.M., Buechel C., Whalley H.C. et al. Reduced frontotemporal functional connectivity in schizophrenia associated with auditory hallucinations // Biol. Psychiatry. 2002. V. 51. № 12. P. 1008.
Wolf N.D., Sambataro F., Vasic N. et al. Dysconnectivity of multiple resting-state networks in patients with schizophrenia who have persistent auditory verbal hallucinations // J. Psychiatry Neurosci. 2011. V. 36. № 6. P. 366.
Rotarska-Jagiela A., van de Ven V., Oertel-Knöchel V. et al. Resting-state functional network correlates of psychotic symptoms in schizophrenia // Schizophr. Res. 2010. V. 117. № 1. P. 21.
Sprooten E., Romaniuk L., Giles S. et al. Fronto-temporal connectivity in bipolar disorder and schizophrenia related to auditory verbal hallucinations // Neuroimage. 2009. № 47. P. S135.
Mondino M., Jardri R., Suaud-Chagny M.F. et al. Effects of fronto-temporal transcranial direct current stimulation on auditory verbal hallucinations and resting-state functional connectivity of the left temporo-parietal junction in patients with schizophrenia // Schizophr. Bull. 2015. V. 42. № 2. P. 318.
Bohlken M.M., Hugdahl K., Sommer I.E.C. Auditory verbal hallucinations: neuroimaging and treatment // Psychol. Med. 2017. V. 47. № 2. P. 199.
Alderson-Day B., McCarthy-Jones S., Fernyhough C. Hearing voices in the resting brain: a review of intrinsic functional connectivity research on auditory verbal hallucinations // Neurosci. Biobehav. Rev. 2015. V. 55. P. 78.
Allen P., Larøi F., McGuire P.K., Aleman A. The hallucinating brain: a review of structural and functional neuroimaging studies of hallucinations // Neurosci. Biobehav. Rev. 2008. V. 32. № 1. P. 175.
Frith C.D., Friston K.J., Herold S. et al. Regional brain activity in chronic schizophrenic patients during the performance of a verbal fluency task // Br. J. Psychiatry. 1995. V. 167. № 3. P. 343.
Whiteside D.M., Kealey T., Semla M. et al. Verbal fluency: Language or executive function measure? // Appl. Neuropsychol. Adult. 2016. V. 23. № 1. P. 29.
Biesbroek J.M., van Zandvoort M.J., Kappelle L.J. et al. Shared and distinct anatomical correlates of semantic and phonemic fluency revealed by lesion-symptom mapping in patients with ischemic stroke // Brain Struct. Funct. 2016. V. 221. № 4. P. 2123.
Wagner S., Sebastian A., Lieb K. et al. A coordinate-based ALE functional MRI meta-analysis of brain activation during verbal fluency tasks in healthy control subjects // BMC Neurosci. 2014. V. 15. № 1. P. 19.
Spence S.A., Liddle P.F., Stefan M.D. et al. Functional anatomy of verbal fluency in people with schizophrenia and those at genetic risk: focal dysfunction and distributed disconnectivity reappraised // Br. J. Psychiatry. 2000. V. 176. № 1. P. 52.
Berberian A.A., Moraes G.V., Gadelha A. et al. Is semantic verbal fluency impairment explained by executive function deficits in schizophrenia? // Bras J. Psychiatry. 2016. V. 38. № 2. P. 121.
Liang S., Deng W., Wang Q. et al. Performance of Verbal Fluency as an Endophenotype in Patients with Familial versus Sporadic Schizophrenia and Their Parents // Sci. Rep. 2016. V. 6. P. 32597.
Delis D.C., Kramer J.H., Kaplan E., Holdnack J. Reliability and validity of the Delis-Kaplan Executive Function System: an update // J. Int. Neuropsychol. Soc. 2004. V. 10. № 2. P. 301.
McGlashan T., Miller T., Woods S. et al. Instrument for the assessment of prodromal symptoms and states / Early intervention in psychotic disorders. Springer, Dordrecht, 2001. P. 135.
Behzadi Y., Restom K., Liau J., Liu T.T. A component based noise correction method (CompCor) for BOLD and perfusion based fMRI // Neuroimage. 2007. V. 37. № 1. P. 90
Shirer W.R., Ryali S., Rykhlevskaia E. et al. Decoding subject-driven cognitive states with whole-brain connectivity patterns // Cereb. Cortex. 2012. V. 22. № 1. P. 158.
Makovskaya L., Vlasova R., Mershina E.A., Pechenkova E. Independent component and seed-based analyses in localisation and lateralisation of Broca’s and Wernicke’s areas with resting state fMRI. European Congress of Radiology, 2017. https://doi.org/10.1594/ecr2017/B-0348
Desikan R.S., Ségonne F., Fischl B. et al. An automated labeling system for subdividing the human cerebral cortex on MRI scans into gyral based regions of interest // Neuroimage. 2006. V. 31. № 3. P. 968.
Лурия А.Р. Язык и сознание. М.: МГУ, 1979. С. 115.
Выготский Л.С. Собрание сочинений: в 6 т. / Вопросы теории и истории психологии. М.: Педагогика, 1982. Т. 1. С. 109.
Выготский Л.С. Мышление и речь. Изд. 5, испр. М.: Изд-во “Лабиринт”, 1999. С. 52.
Tanji J., Hoshi E. Role of the lateral prefrontal cortex in executive behavioral control // Physiol. Rev. 2008. V. 88. № 1. P. 37.
Lo C.Y.Z., Su T.W., Huang C.C. et al. Randomization and resilience of brain functional networks as systems-level endophenotypes of schizophrenia // PNAS. 2015. V. 112. № 29. P. 9123.
Chakravarty M.M., Rapoport J.L., Giedd J.N. et al. Striatal shape abnormalities as novel neurodevelopmental endophenotypes in schizophrenia: a longitudinal study // Hum. Brain Mapp. 2015. V. 36. № 4. P. 1458.
van Oort J., Tendolkar I., Hermans E.J. et al. How the brain connects in response to acute stress: A review at the human brain systems level // Neurosc. Biobehav. Rev. 2017. V. 83. P. 281.
Kindler J., Schultze-Lutter F., Hauf M. et al. Increased striatal and reduced prefrontal cerebral blood flow in clinical high risk for psychosis // Schizophr. Bull. 2017. V. 44. № 1. P. 182.
Falkenberg I., Chaddock C., Murray R.M. et al. Failure to deactivate medial prefrontal cortex in people at high risk for psychosis // Eur. Psychiatry. 2015. V. 30. № 5. P. 633.
Zarogianni E., Storkey A.J., Johnstone E.C. et al. Improved individualized prediction of schizophrenia in subjects at familial high risk, based on neuroanatomical data, schizotypal and neurocognitive features // Schizophr. Res. 2017. V. 181. P. 6.
Дополнительные материалы отсутствуют.
Инструменты
Физиология человека


