Физиология человека, 2020, T. 46, № 1, стр. 69-77
Вызванная десинхронизация/синхронизация электрической корковой активности при выполнении модифицированной oddball задачи у пациентов с ишемической болезнью сердца и умеренным когнитивным расстройством
И. В. Тарасова 1, *, Н. В. Вольф 2, Р. М. Акбиров 1, И. Н. Кухарева 1, О. Л. Барбараш 1
1 ФГБНУ НИИ комплексных проблем сердечно-сосудистых заболеваний
Кемерово, Россия
2 ФГБНУ НИИ физиологии и фундаментальной медицины
Новосибирск, Россия
* E-mail: iriz78@mail.ru
Поступила в редакцию 13.02.2019
После доработки 11.03.2019
Принята к публикации 02.06.2019
Аннотация
Выявлению надежных маркеров, которые могут эффективно способствовать ранней диагностике когнитивных расстройств, в настоящее время уделяется пристальное внимание. Для изучения нейрофизиологических основ нарушений внимания, характерных для когнитивного расстройства у пациентов с ишемической болезнью сердца (ИБС), может быть перспективным метод вызванной десинхронизации/синхронизации ЭЭГ-ритмов. В результате анализа вызванной десинхронизации/синхронизации θ- и α-ритмов при выполнении модифицированного oddball теста у пациентов с ИБС и наличием или отсутствием умеренного когнитивного расстройства (УКР) установлено, что у пациентов с УКР наблюдается сниженный корковый ответ на частоте θ-ритма при предъявлении целевых стимулов. Между тем изменения вызванной десинхронизации/синхронизации α-активности были общими для всех пациентов с ИБС и, скорее всего, отражали селективные процессы внимания. Высказывается предположение, что для когнитивного дефицита у пациентов с ИБС, прежде всего, характерны нарушения нисходящего (top-down) контроля внимания со стороны лобных структур, тогда как вызванные реакции α-активности более сохранны и не являются его дифференцирующими маркерами.
Лечение и диагностика когнитивных расстройств стали серьезной проблемой современного общественного здравоохранения во всем мире. Выявлению надежных маркеров, которые могут эффективно способствовать ранней диагностике когнитивных расстройств в настоящее время уделяется пристальное внимание, так как ожидание появления более выраженных симптомов нарушения когнитивной сферы существенно снижает эффективность проводимой терапии и увеличивает затраты на здравоохранение [1, 2]. Отдельной, сложно курируемой когортой являются пациенты с сердечно-сосудистыми заболеваниями, имеющие когнитивные расстройства [3]. С одной стороны, установлен вклад сосудистых изменений в возрастные и патологические нарушения когнитивных функций, с другой – все больше исследователей сходятся в том, что этиология когнитивных расстройств, наблюдаемых у лиц пожилого возраста, носит смешанный характер, связанный как с прогрессированием атеросклеротических изменений сосудов мозга, так и с нейродегенерацией [4–6]. Умеренное когнитивное расстройство (УКР) является в большинстве случаев ранней стадией развития более тяжелых когнитивных нарушений (деменции). Исследования показывают, что примерно у половины людей, у которых обнаружены симптомы УКР, деменция разовьется в среднем через 1–2 г. [7]. У пациентов с сердечно-сосудистыми заболеваниями это имеет особенное значение, так как существенно влияет на качество жизни и приверженность пациента к постоянной терапии, тем самым ухудшая прогноз заболевания, в частности, ишемической болезни сердца (ИБС) [8].
Количественный анализ электроэнцефалографических (ЭЭГ) показателей потенциально является одним из лучших кандидатов среди возможных биомаркеров когнитивных расстройств, поскольку проведение ЭЭГ-исследования относительно дешево, неинвазивно и безопасно. Продемонстрирована значимость показателей фоновой ЭЭГ для ранней диагностики болезни Альцгеймера, сосудистых когнитивных расстройств [9–11]. При этом наиболее информативными показателями фоновой ЭЭГ, ассоциированными с когнитивными расстройствами, являются параметры θ- и α-активности [10, 11]. Однако для изучения нейрофизиологических основ нарушений внимания, характерных для сосудистого УКР, может быть использован также анализ связанной с событием (вызванной) десинхронизации/синхронизации ЭЭГ-ритмов. Ранее было показано, что изучение корковых ответов при выполнении когнитивных задач информативно не только для ранней диагностики когнитивных расстройств, но и для оценки вероятности прогрессирования УКР до деменции [2].
В связи с вышеперечисленным, целью данного исследования явился анализ вызванной десинхронизации/синхронизации θ- и α-ритмов при выполнении модифицированного oddball теста у пациентов с ИБС и наличием или отсутствием УКР.
МЕТОДИКА
Исследование проводили на базе кардиологического отделения ФГБНУ “НИИ комплексных проблем сердечно-сосудистых заболеваний”. В исследовании участвовали 47 пациентов со стабильной ИБС, мужчины в возрасте 45–69 лет. Исключили женщин, а также пациентов старше 70 лет, чтобы избежать потенциального влияния факторов пола и возраста на результаты исследования. Исключили тех пациентов, у которых сумма баллов по шкале депрессии Бека (BDI-II) была ≤8, с наличием деменции (сумма баллов по Краткой шкале оценки психического статуса (КШОПС) ≤24 и/или по Батарее тестов лобной дисфункции (БТЛД) ≤11), кроме того, наличие в анамнезе жизнеугрожающих нарушений ритма, сердечной недостаточности IV функционального класса по данным Нью-Йоркской кардиологической ассоциации (NYHA), стенозов сонных артерий (СА) ≥50%, тяжелых сопутствующих заболеваний (хронической обструктивной болезни легких, злокачественных новообразований), заболеваний центральной нервной системы, регулярного употребления психоактивных веществ, любых эпизодов нарушений мозгового кровоснабжения и/или травм головного мозга, несогласие пациента на начало или продолжение исследования также являлись основанием для исключения из него.
Все пациенты прошли общее клинико-инструментальное и неврологическое обследования. Врачи, обследовавшие пациентов, не были осведомлены об их когнитивном статусе. Для проведения эхокардиографии и оценки стенозирующих поражений экстрамозговых артерий использовали оборудование экспертного класса (Vivid 7; GE Medical Systems). Многослойную спиральную компьютерную томографию проводили у всех включенных в исследование пациентов для выявления структурных нарушений головного мозга.
Нейропсихологическое исследование. Состояние когнитивных функций пациентов оценивалось с помощью скрининговых нейропсихологических шкал – КШОПС и БТЛД. В соответствии с критериями УКР, разработанных Р.С. Петерсеном и др. [12], пациентов с ИБС разделили на две группы: пациенты с УКР (n = 24; оценка по шкале КШОПС 26.3 ± 0.76) и пациенты без когнитивных нарушений (n = 23; КШОПС балл 28.5 ± 0.66). Уровень депрессивных симптомов у пациентов оценивали с помощью опросника BDI-II [13], ситуативной и личностной тревожности с помощью опросника Спилбергера–Ханина [14].
Нейрофизиологическое (ЭЭГ) исследование. Монополярную регистрацию электроэнцефалограммы (ЭЭГ) (62 канала; полоса пропускания 0.1–50.0 Гц, частота дискретизации 1000 Гц) проводили при выполнении тестового задания, являющегося модификацией oddball парадигмы, у пациентов с наличием и отсутствием УКР. Пациентов, сидящих в комфортабельном кресле, просили нажимать правой рукой клавишу в ответ на появление изображения кролика (целевой стимул) и левой рукой – любой другой картинки (нецелевой стимул). В качестве стимулов использовали графические изображения реальных объектов. Размеры стимулов были от 3.5° до 4° по горизонтали и 4° по вертикали. Длительность предъявления каждого стимула составляла 170 мс, межстимульный интервал – 2000 мс. В ходе выполнения задания в центре экрана предъявляли крест для фиксации взгляда, через 300 мс после его появления, в этом месте появлялись в случайном порядке целевые и “нецелевые” стимулы. Целевой стимул (кролик) предъявляли 90 раз (45.4% от всех предъявлений). Среди нецелевых стимулов были повторяющиеся – “яблоко”, количество его предъявлений было таким же, как целевого стимула, и неповторяющиеся стимулы (18 стимулов или 9.1%), каждый из которых предъявляли один раз за все время проведения теста.
ЭЭГ регистрировали (в соответствии с международной системой 10–20) с помощью системы Neuvo SynAmps2 (Compumedics, Charlotte, NC, США) с использованием модифицированной 64-канальной шапочки с Ag/AgCl электродами (QuikCap; Neurosoft, El Paso, TX, США). Электрод-референт был прикреплен к кончику носа, а заземляющий электрод – в центре лба. Электродное сопротивление было <5 кОм.
Для анализа отбирали эпохи ЭЭГ длительностью 1000 мс до предъявления стимулов и 1500 мс после предъявления стимула. Сохраненные эпохи оценивали визуально, сегменты ЭЭГ с наличием мышечной или другой артефактной активности исключили из дальнейшего анализа, кроме того провели автоматическую проверку для устранения окулографических артефактов. Эпохи с длительным временем реакции (более 1 с), а также в которых были пропущены целевые и нецелевые стимулы, отклонили. Для анализа использовали 40 безартефактных эпох. В соответствии с целью исследования расчет вызванной десинхронизации/синхронизации проводили в θ (3–7 Гц)- и α (7–12 Гц)-диапазонах, расчет диапазонов был выполнен автоматически в программе “Scan 4.5” (Compumedics, Charlotte, NC, США) на основании среднего значения ведущей частоты (частоты наибольшего значения спектральной мощности в α-диапазоне), которая составила 9.5 Гц (9.44 Гц – у пациентов с УКР и 9.47 Гц – у пациентов без когнитивного дефицита).
Данные усредняли для 5-ти областей симметрично в левом и правом полушарии: фронтальной (Ф) (Fp1/2, AF3/4, F1/2, Fp3/4, Fp5/6, F7/8), фронто-центральной (ФЦ) (FC1/2, FC3/4, FC5/6, C1/2, C3/4, C5/6), височной (В) (FT7/8, T7/8, TP7/8), центро-париетальной (ЦП) (CP1/2, CP3/4, CP5/6, P1/2, P3/4, P5/6, P7/8) и (О) окципитальной (PO3/4, PO5/6, PO7/8, O1/2).
Выбор временны́х отрезков для описания результатов исследования осуществляли на основании данных литературы, согласно которым в интервале до 200 мс после предъявления стимула происходят перцептивные и неосознаваемые процессы [15], потому этот временнóй интервал исключили из анализа. Последующие 200–400 мс, как установлено с помощью анализа когнитивных вызванных потенциалов [16, 17], отражают процесс визуальной селекции информации, а временнóй интервал 400–800 мс связывается с процессом удержания в рабочей памяти предыдущей стимульной информации для селекции последующей [17, 18]. Учитывая также известные данные о замедлении скорости обработки информации при старении, мы рассмотрели два временны́х интервала: 200–400 и 600–800 мс после предъявления стимульного материала.
Статистический анализ проводили с использованием ANOVA по программе STATISTICA 10 (StatSoft, Inc.) с применением, где необходимо, коррекции статистической значимости по методу Гринхауза–Гейссера. Анализ взаимодействий проводили с помощью плановых контрастов. Сравнение клинико-анамнестических показателей проводили с использованием t-критерия для независимых выборок.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Пациенты исследованных групп были сопоставимы по большинству клинико-анамнестических характеристик. Однако пациенты с УКР чаще имели более низкий показатель БТЛД, а также реже имели высшее образование (табл. 1).
Таблица 1.
Клинико-демографическая характеристика пациентов с ИБС с наличием или отсутствием УКР
| Показатель | УКР (n = 24) | Без УКР (n = 23) | p |
|---|---|---|---|
| Возраст, M ± σ, лет | 58.9 ± 6.09 | 55.5 ± 5.68 | 0.06 |
| Наличие артериальной гипертензии, n, % | 23 (96) | 20 (87) | 0.27 |
| Длительность анамнеза ИБС, M ± σ, лет | 4.4 ± 4.88 | 3.3 ± 3.95 | 0.44 |
| Образование, в том числе | |||
| cреднее, n, % | 21 (87.5) | 14 (61) | 0.03 |
| высшее, n, % | 3 (12.5) | 9 (39) | |
| БТЛД, балл | 16.2 ± 1.31 | 17.0 ± 0.93 | 0.02 |
| BDI-II, балл | 2.2 ± 1.85 | 2.9 ± 2.29 | 0.28 |
| Ситуативная тревожность, балл | 20.1 ± 9.72 | 19.7 ± 7.85 | 0.85 |
| Личностная тревожность, балл | 37.7 ± 9.17 | 38.6 ± 5.81 | 0.69 |
| Фракция выброса левого желудочка, M ± σ, % | 59.0 ± 9.43 | 59.7 ± 7.93 | 0.78 |
| Стенозы СА* < 50%, n, % | 12 (50) | 12 (52) | 0.88 |
| Сахарный диабет, n, % | 9 (37.5) | 7 (30) | 0.61 |
| Функциональный класс по NYHA*, n, % | |||
| I–II | 21 (87.5) | 23 (100) | 0.07 |
| III | 3 (12.5) | 0 (0) | |
| Стенокардии ФК, n, % | |||
| I–II | 19 (79) | 19 (83) | 0.76 |
| III | 5 (21) | 4 (17) |
Был проведен ANOVA показателей вызванной десинхронизации/синхронизации θ- и α-диапазона с выделением факторов: УКР (пациенты с наличием и отсутствием когнитивного расстройства) × СТИМУЛ (целевой, нецелевой) × ВРЕМЕННÓЙ ИНТЕРВАЛ (2 интервала: 200–400, 600–800 мс после предъявления стимула) × ОБЛАСТЬ (5 областей) × ЛАТЕРАЛЬНОСТЬ (правое, левое полушарие).
Для показателей θ-диапазона были выявлены следующие факторы и взаимодействия: общие эффекты, такие как СТИМУЛ (F(1, 45) = 8.62, p = = 0.005), ВРЕМЕННÓЙ ИНТЕРВАЛ (F(1, 45) = = 118.34, p = 0.000), ОБЛАСТЬ (F(4, 180) = 8.71, p = 0.000) и ЛАТЕРАЛЬНОСТЬ (F(1, 45) = 4.77, p = = 0.03), можно не обсуждать подробно, а остановиться на их взаимодействии с другими факторами.
Так, например, выявлено значимое взаимодействие факторов УКР × СТИМУЛ × ВРЕМЕННÓЙ ИНТЕРВАЛ (F(1, 45) = 4.30, p = 0.04), которое было связано с межгрупповыми различиями θ-десинхронизации во временнóм интервале 200–400 мс после предъявления задачи, у пациентов без когнитивного расстройства наблюдалась большая степень десинхронизации на целевой стимул по сравнению с пациентами с УКР (F(1, 45) = = 5.06, p = 0.03), при этом при реакции на нецелевой стимул межгрупповых различий не получено, равно как и на целевые и нецелевые сигналы во временнóм интервале 600–800 мс после их предъявления (рис. 1).
Рис. 1.
Различия в вызванной десинхронизации/синхронизации биопотенциалов θ-ритма при предъявлении целевых и нецелевых сигналов в исследуемых временны́х интервалах выполнения модифицированной oddball задачи у пациентов с ишемической болезнью сердца (ИБС) в зависимости от наличия умеренного когнитивного расстройства (УКР). А – левое полушарие, Б – правое полушарие. а – пациенты с наличием УКР, б – с отсутствием УКР. ERD/ERS, % – вызванная десинхронизация/синхронизация. * – статистически значимые различия между группами пациентов.
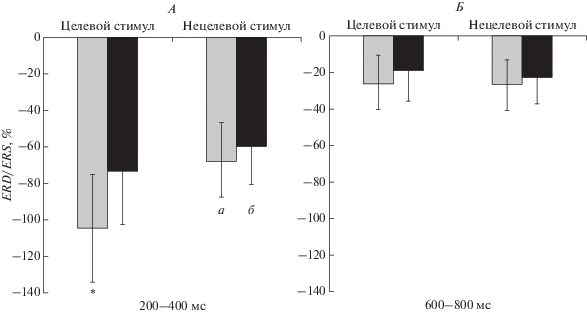
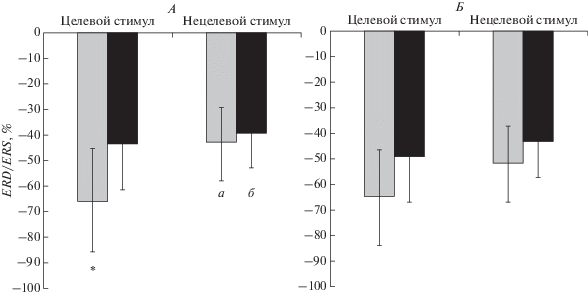
Следующее взаимодействие, связанное с влиянием когнитивного расстройства, УКР × СТИМУЛ × ЛАТЕРАЛЬНОСТЬ (F(1, 45) = 4.58, p = = 0.038), было обусловлено большей выраженностью левополушарной θ-десинхронизации на целевой стимул у пациентов без когнитивного расстройства по сравнению с пациентами с УКР (F(1, 45) = 4.66, p = 0.036) (рис. 2).
Рис. 2.
Различия в вызванной десинхронизации/синхронизации (ERD/ERS, %) биопотенциалов θ-ритма в левом и правом полушарии при предъявлении целевых и нецелевых сигналов независимо от временнóго интервала выполнения модифицированной oddball задачи у пациентов с ИБС в зависимости от наличия УКР. Обозначения см. рис. 1.
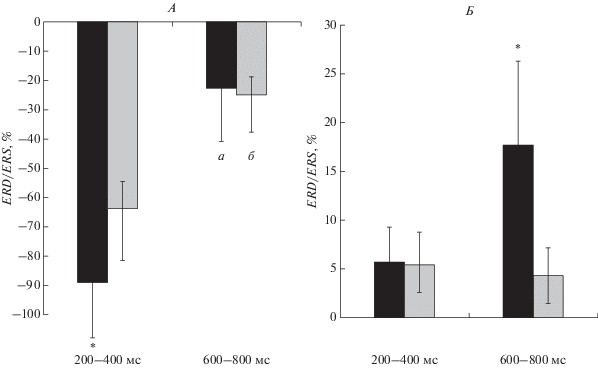
Значимость взаимодействия факторов СТИМУЛ × ВРЕМЕННÓЙ ИНТЕРВАЛ (F(1, 45) = 32.65, p = 0.000) была обусловлена тем, что θ-десинхронизация на целевой стимул была более выражена, чем на нецелевой во временнóм интервале 200–400 мс после предъявления задачи (F(1, 45) = 24.37, p = 0.000) (рис. 3, А).
Рис. 3.
Различия в десинхронизации/синхронизации биопотенциалов θ-(А) и α-диапазонов (Б) при предъявлении целевых и нецелевых сигналов в зависимости от временнóго интервала выполнения модифицированной oddball задачи у пациентов с ИБС. а – целевые сигналы, б – нецелевые сигналы. Остальные обозначения см. рис. 1.
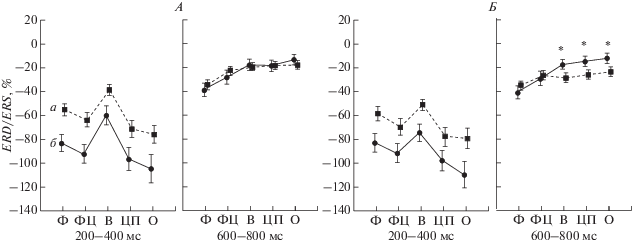
Второе взаимодействие факторов СТИМУЛ × × ВРЕМЕННÓЙ ИНТЕРВАЛ × ОБЛАСТЬ × × ЛАТЕРАЛЬНОСТЬ (F(4, 180) = 3.65, p = 0.03) было обусловлено большей выраженностью θ-десинхронизации на нецелевой стимул по сравнению с целевым в правых височных и теменно-затылочных областях коры во временнóм интервале 600–800 мс после предъявления задачи (p = 0.02, p = 0.02 и p = 0.016 соответственно) (рис. 4).
Рис. 4.
Топографические особенности вызванной десинхронизации/синхронизации биопотенциалов θ-ритма в левом и правом полушарии при предъявлении целевых и нецелевых сигналов в зависимости от временнóго интервала выполнения модифицированной oddball задачи у пациентов с ИБС. Ф – фронтальная, ФЦ – фронто-центральная, В – височная, ЦП – центро-париетальная и О – окципитальная область. Остальные обозначения см. рис. 1 и 3.
В α-диапазоне также получены ряд общих факторов и взаимодействий: СТИМУЛ (F(1, 45) = = 8.17, p = 0.006), ОБЛАСТЬ (F(4, 180) = 22.78, p = = 0.000), ОБЛАСТЬ × ЛАТЕРАЛЬНОСТЬ (F(4, 180) = 3.88, p = 0.02). Однако фактор УКР не был значим, как и его взаимодействия с другими факторами. Тем не менее, интересным представляется обсудить ряд статистических взаимодействий факторов, характеризующих временнýю динамику α-ритма при предъявлении стимулов различной значимости.
Получено статистически значимое взаимодействие СТИМУЛ × ВРЕМЕННÓЙ ИНТЕРВАЛ (F(1, 45) = 14.91, p = 0.0004), обусловленное различиями в степени синхронизации α-активности во временнóм интервале 600–800 мс после предъявления задачи. Установлено, что α-синхронизация была более выражена при обработке целевого стимула по сравнению с нецелевым (p = 0.000) (рис. 3, Б).
Взаимодействие СТИМУЛ × ОБЛАСТЬ (F(4, 180) = 3.03, p = 0.047) было обусловлено разнонаправленными изменениями вызванной α-активности в зависимости от типа стимулов. Обнаружено, что в лобных и височных областях коры при обработке нецелевых стимулов наблюдается десинхронизация α-ритма (p = 0.02 и p = = 0.0018, соответственно), тогда как обработка целевого сигнала была связана с синхронизацией α-активности во всех областях коры (p ≤ 0.05). При обработке как целевых, так и нецелевых сигналов в задних областях коры по сравнению с передними регионами мозга наблюдается более выраженные изменения α-активности (синхронизация α-ритма) (p = 0.000).
Кроме того, независимо от типа стимула, процесс синхронизации в задних областях коры был более выражен во временнóм интервале 600–800 мс после предъявления задачи, взаимодействие ВРЕМЕННÓЙ ИНТЕРВАЛ × ОБЛАСТЬ (F(4, 180) = 12.82, p = 0.000). Тогда как статистически значимое взаимодействие ВРЕМЕННÓЙ ИНТЕРВАЛ × ОБЛАСТЬ × ЛАТЕРАЛЬНОСТЬ (F(4, 180) = 6.39, p = 0.003) характеризовалось полушарными различиями временны́х изменений вызванной α-активности. В задних областях коры левого и правого полушария наблюдалось увеличение степени синхронизации от временнóго интервала 200–400 мс к временнóму интервалу 600–800 мс после предъявления задачи (p ≤ 0.05). В лобных отделах временнáя динамика была незначимой, а в височных областях – в левом полушарии отмечена десинхронизация во временнóм интервале 200–400 мс и синхронизация во временнóм интервале 600–800 мс после предъявления задачи, тогда как в правом полушарии различия отсутствовали (p = 0.003).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Результаты проведенного исследования показывают, что у пациентов с ИБС особенности организации вызванной корковой активности при обработке целевой и нецелевой стимульной информации связаны с наличием когнитивного расстройства, причем наблюдаемые различия связаны только с вызванной θ-активностью, тогда как в α-диапазоне не получено значимых межгрупповых различий. Обнаружено, что у пациентов с УКР меньше степень θ-десинхронизации на целевой стимул во временнóм интервале 200–400 мс после предъявления задачи по сравнению с пациентами без когнитивного расстройства. Причем независимо от временнóго интервала эти различия были характерны только для левого полушария.
Ранее нами была выявлена значимость показателей θ-ритмов ЭЭГ покоя для дифференциации пациентов с наличием и отсутствием сосудистых когнитивных расстройств [11, 19]. В частности, было показано, что увеличение индекса θ/α-активности, как и высокие показатели мощности биопотенциалов θ1-ритма, преимущественно в задних областях коры, связаны с наличием УКР у пациентов с ИБС. Более высокие показатели мощности θ-активности по сравнению со здоровыми были обнаружены и у пациентов с другими когнитивными расстройствами [20–22]. Также установлено, что сохранность когнитивных функций ассоциирована со снижением представленности медленных волн в ЭЭГ покоя людей пожилого возраста [23–25].
Данные исследования показывают, что у пациентов без когнитивного расстройства по сравнению с пациентами с УКР была более выражена левополушарная θ-десинхронизация на целевой стимул. Предыдущими исследованиями продемонстрировано, что у здоровых взрослых наблюдается преимущественная активация левого полушария при опознании целевых стимулов [26, 27]. С другой стороны, при изучении связанной с событиями мозговой активности установлено, что десинхронизация θ-ритма наблюдается при отвлечении внимания от нерелевантных стимулов, торможении процесса обработки информации в рабочей памяти при ее удержании и переходе к внутреннему фокусу внимания [28, 29]. В нашей работе различия между пациентами с наличием и отсутствием УКР по вызванной θ-десинхронизации отмечались только на начальном этапе обработке стимула (200–400 мс), однако именно этот этап является критически важным для принятия решения о значимости стимула. В исследовании M.P. Deiber et al. [30] было обнаружено, что индуцированная реакция θ-ритма при выполнении когнитивного задания была значительно снижена у пациентов с прогрессирующим когнитивным расстройством по сравнению как со стабильными пациентами, так и со здоровыми, что указывает на нарушения нисходящего (top-down) контроля внимания со стороны лобных структур. Ранее у пациентов с сердечно-сосудистыми заболеваниями было обнаружено ухудшение кровотока в передней и медиальной фронтальной, передней поясной коре, в регионах островка и предклинья, что позволило предположить, что лобные отделы мозга наиболее подвержены риску развития возрастных и ишемических нарушений [31]. Снижение мозгового кровотока в лобных отделах коры также сопровождалось худшими показателями памяти и исполнительных функций [32]. Таким образом, можно рассматривать полученные нами различия в вызванной θ-десинхронизации при обработке целевой информации в oddball задаче как маркер нарушения функций внимания у пациентов с ИБС.
Мы получили для всех пациентов с ИБС, имеющих или не имеющих УКР, и ряд общих закономерностей, связанных с выполнением модифицированной oddball задачи, которые наблюдались в вызванной десинхронизации/синхронизации α-активности. Согласно результатам нашего исследования при обработке как целевых, так и нецелевых сигналов наблюдалась преимущественно синхронизация α-ритма, особенно в задних областях коры. Ее суммарная выраженность увеличивалась при обработке целевого стимула по сравнению с нецелевым. При этом при обработке нецелевых стимулов в лобных и височных областях коры наблюдалась десинхронизация α-активности. Ранее были получены данные о том, что вызванная синхронизация α-ритма служит показателем нисходящего тормозного контроля со стороны лобных структур и отражает торможение когнитивных процессов, которые незначимы напрямую для выполнения задания [30, 33]. Также обнаружено, что увеличение мощности на частоте α-ритма в задних областях коры при выполнении когнитивных задач связывают с торможением обработки иррелевантной перцептивной информации, чтобы освободить ресурсы, ответственные за поддержание значимых для выполнения задания процессов [29, 34, 35]. Можно предполагать, что полученная нами синхронизация α-активности в теменно-затылочных отделах мозга отражает общий для всех пациентов процесс селекции стимулов.
Таким образом, у пациентов с ИБС и наличием когнитивного расстройства наблюдаются прежде всего нарушения нисходящего (top-down) контроля внимания со стороны лобных структур, ишемическое повреждение которых может быть определяющим в развитии сосудистого когнитивного дефицита, тогда как вызванные реакции α-активности более сохранны и не являются его дифференцирующими маркерами.
ЗАКЛЮЧЕНИЕ
В результате проведенного исследования у пациентов с ИБС, имеющих или не имеющих УКР, выделены как дифференцирующие, так и общие закономерности организации вызванной мозговой активности, связанных с выполнением модифицированной oddball задачи. К первым можно отнести сниженный корковый ответ у пациентов с УКР на частоте θ-ритма при предъявлении целевых стимулов. Изменения вызванной десинхронизации/синхронизации α-активности были общими для всех пациентов с ИБС и, скорее всего, отражали селективные процессы внимания.
Этические нормы. Все исследования проведены в соответствии с принципами биомедицинской этики, сформулированными в Хельсинкской декларации 1964 г. и ее последующих обновлениях, и одобрены локальным биоэтическим комитетом НИИ комплексных проблем сердечно-сосудистых заболеваний” (Кемерово).
Информированное согласие. Каждый участник исследования представил добровольное письменное информированное согласие, подписанное им после разъяснения ему потенциальных рисков и преимуществ, а также характера предстоящего исследования.
Благодарности. Авторы выражают благодарность О.М. Малевой и А.В. Солодухину за техническую помощь при проведении данного исследования.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией данной статьи.
Список литературы
Kok W.F., Koerts J., Tucha O. et al. Neuronal damage biomarkers in the identification of patients at risk of long-term postoperative cognitive dysfunction after cardiac surgery // Anaesthesia. 2017. V. 72. № 3. P. 359.
Fraga F.J., Mamani G.Q., Johns E. et al. Early diagnosis of mild cognitive impairment and Alzheimer’s with event-related potentials and event-related desynchronization in N-back working memory tasks // Comput. Methods Programs Biomed. 2018. V. 164. P. 1.
Indja B., Seco M., Seamark R. et al. Neurocognitive and psychiatric issues post cardiac surgery // Heart Lung Circ. 2017. V. 26. № 8. P. 779.
Gorelick P.B., Scuteri A., Black S.E. et al. American heart association stroke council, Council on epidemiology and prevention, council on cardiovascular nursing, Council on cardiovascular radiology and intervention, and Council on cardiovascular surgery and anesthesia. Vascular contributions to cognitive impairment and dementia: a statement for healthcare professionals from the American heart association/American stroke association // Stroke. 2011. V. 42. № 9. P. 2672.
Flanagan M., Larson E.B., Latimer C.S. et al. Clinical-pathologic correlations in vascular cognitive impairment and dementia // Biochim. Biophys. Acta. 2016. V. 1862. № 5. P. 945.
Yang T., Sun Y., Lu Z. et al. The impact of cerebrovascular aging on vascular cognitive impairment and dementia // Ageing Res. Rev. 2017. V. 34. P. 15.
Thies W., Bleiler L. Alzheimer’s Association. 2013 Alzheimer’s disease: facts and figures // Alzheimers Dement. 2013. V. 9. № 2. P. 208.
Аргунова Ю.А., Трубникова О.А., Каган Е.С., Барбараш О.Л. Связь предоперационной приверженности к терапии с риском развития ранней послеоперационной когнитивной дисфункции у пациентов, подвергшихся коронарному шунтированию // Кардиологический вестник. 2017. Т. 12. № 2. С. 54.
Mazzon G., De Dea F., Cattaruzza T. et al. Memorization test and resting state EEG components in mild and subjective cognitive impairment // Curr. Alzheimer Res. 2018. V. 15. № 9. P. 809.
Musaeus C.S., Engedal K., Högh P. et al. EEG theta power is an early marker of cognitive decline in dementia due to Alzheimer’s disease // J. Alzheimers Dis. 2018. V. 64. № 4. P. 1359.
Tarasova I.V., Trubnikova O.A., Barbarash O.L. EEG and clinical factors associated with mild cognitive impairment in coronary artery disease patients // Dement. Geriatr. Cogn. Disord. 2018. V. 46. № 5–6. P. 275.
Petersen R.C., Negash S. Mild cognitive impairment: an overview // CNS Spectr. 2008. V. 13. № 1. P. 45.
Beck A.T., Steer R.A., Brown G.K. Beck Depression Inventory. 2nd edition manual. New York (NY): The Psychological Corporation, 1996. 38 p.
Spielberger C.D., Gorsuch R.L., Lushene R.E. State-Trait Anxiety Inventory for adults: sampler set: manual, test, scoring key. Redwood City, CA: Mind Garden, 1983. 70 p.
Ильюченок И.Р., Сысоева О.В., Иваницкий А.М. Две семантические системы мозга для быстрого и медленного различения абстрактных и конкретных слов // Журн. высшей нервной деятельности им. И.П. Павлова. 2007. Т. 57. № 5. С. 566.
Cross-Villasana F., Finke K., Hennig-Fast K. et al. The speed of visual attention and motor-response decisions in adult attention-deficit/hyperactivity disorder // Biol. Psychiatry. 2015. V. 78. № 2. P. 107.
Luo X., Guo J., Liu L. et al. The neural correlations of spatial attention and working memory deficits in adults with ADHD // Neuroimage Clin. 2019. V. 22. P. 101 728.
Orme E., Brown L.A., Riby L.M. Retrieval and monitoring processes during visual working memory: an ERP study of the benefit of visual semantics // Front. Psychol. 2017. V. 8. P. 1080.
Тарасова И.В., Вольф Н.В., Сырова И.Д. и др. Умеренные когнитивные расстройства у пациентов с ишемической болезнью сердца: клинико-демографические и ЭЭГ-корреляты // Журн. неврологии и психиатрии им. C.C. Корсакова. 2014. Т. 114. № 12-1. С. 89.
Ponomareva N., Klyushnikov S., Abramycheva N. et al. Alpha-theta border EEG abnormalities in preclinical Huntington’s disease // J. Neurol. Sci. 2014. V. 344. № 1–2. P. 114.
Bonanni L., Perfetti B., Bifolchetti S. et al. Quantitative electroencephalogram utility in predicting conversion of mild cognitive impairment to dementia with Lewy bodies // Neurobiol. Aging. 2015. V. 36. № 1. P. 434.
López M.E., Turrero A., Cuesta P. et al. Searching for primary predictors of conversion from mild cognitive impairment to Alzheimer’s disease: a multivariate follow-up study // J. Alzheimers Dis. 2016. V. 52. № 1. P. 133.
Вольф Н.В., Глухих А.А. Фоновая электрическая активность мозга при “успешном” ментальном старении // Физиология человека. 2011. Т. 37. № 5. С. 51.
Vlahou E.L., Thurm F., Kolassa I.T., Schlee W. Resting-state slow wave power, healthy aging and cognitive performance // Sci. Rep. 2014. V. 4. P. 5101.
Sanchez-Lopez J., Silva-Pereyra J., Fernández T. et al. High levels of incidental physical activity are positively associated with cognition and EEG activity in aging // PLoS One. 2018. V. 13. № 1. P. e0191561.
Фарбер Д.А., Мачинская Р.И., Курганский А.В., Петренко Н.Е. Функциональная организация коры больших полушарий при подготовке к опознанию неполных изображений у детей 7–8 лет и взрослых // Физиология человека. 2014. Т. 40. № 5. С. 5.
Newman D.P., Loughnane G.M., Kelly S.P. et al. Visuospatial asymmetries arise from differences in the onset time of perceptual evidence accumulation // J. Neurosci. 2017. V. 37. № 12. P. 3378.
Вольф Н.В., Тарасова И.В. Электрофизиологические показатели и возможности повышения образной креативности при денежном вознаграждении // Журн. высшей ервной деятельности им. И.П. Павлова. 2012. Т. 62. № 6. С. 692.
Приводнова Е.Ю., Вольф Н.В. Особенности временнóй динамики осцилляторной активности мозга при решении творческой задачи у молодых и пожилых испытуемых // Физиология человека. 2016. Т. 42. № 5. С. 5.
Deiber M.P., Meziane H.B., Hasler R. et al. Attention and working memory-related EEG markers of subtle cognitive deterioration in healthy elderly individuals // J. Alzheimers Dis. 2015. V. 47. № 2. P. 335.
Beason-Held L.L. Subjective cognitive decline: identifying factors that may predict future dementia // Biol. Psychiatry Cogn. Neurosci. Neuroimaging. 2018. V. 3. № 5. P. 409.
Alosco M.L., Spitznagel M.B., Cohen R. et al. Reduced cerebral perfusion predicts greater depressive symptoms and cognitive dysfunction at a 1-year follow-up in patients with heart failure // Int. J. Geriatr. Psychiatry. 2014. V. 29. № 4. P. 428.
Костандов Э.А., Черемушкин Е.А., Петренко Н.Е., Яковенко И.А. Ослабление нисходящих тормозных влияний из префронтальной коры в условиях увеличения нагрузки на рабочую память у студентов с трудностями обучения // Физиология человека. 2018. Т. 44. № 1. С. 12.
Roux F., Uhlhaas P.J. Working memory and neural oscillations: α-γ versus θ-γ codes for distinct WM information? // Trends Cogn. Sci. 2014. V. 18. № 1. P. 16.
Payne L., Sekuler R. The importance of ignoring: Alpha oscillations protect selectivity // Curr. Dir. Psychol. Sci. 2014. V. 23. № 3. P. 171.
Дополнительные материалы отсутствуют.
Инструменты
Физиология человека


