Физиология человека, 2020, T. 46, № 1, стр. 87-93
Ассоциации между полиморфизмом STin2VNTR гена транспортера серотонина и фоновой ЭЭГ у молодых и пожилых испытуемых
Е. Ю. Приводнова 1, 2, *, Н. В. Вольф 1, 2
1 ФГБНУ Научно-исследовательский институт физиологии
и фундаментальной медицины
Новосибирск, Россия
2 ФГБОУВПО Новосибирский национальный исследовательский
государственный университет
Новосибирск, Россия
* E-mail: privodnovaeu@physiol.ru
Поступила в редакцию 26.12.2018
После доработки 15.06.2019
Принята к публикации 03.09.2019
Аннотация
Спонтанная электрическая активность мозга может рассматриваться как состояние тонической активации или торможения, которое является физиологической основой для осуществления мозговых функций в норме и патологии. Проекции серотонинергической системы широко распространены в коре мозга и оказывают влияние как на процессы нейропластичности, так и на формирование основополагающих нейронных сетей, определяющих активность мозга в состоянии покоя. Задачей исследования было выявление ассоциаций полиморфизма STin2VNTR, который выполняет роль аллель-зависимого усилителя экспрессии гена транспортера серотонина, с характеристиками фоновой ЭЭГ у здоровых пожилых (51 мужчина (64.5 ± 7.13 лет) и 48 женщин (63.56 ± 5.4 лет)) и молодых (86 мужчин (22.5 ± 3.5 лет) и 110 женщин (21.17 ± 2.7 лет)) людей. Выявлено, что эндофенотипы электрической активности мозга, ассоциированные с полиморфизмом STin2VNTR гена транспортера серотонина, характеризуются специфическими паттернами асимметрии мощности α3-ритма в парието-окципитальных отделах полушарий мозга и отличаются у молодых и пожилых испытуемых. В младшей возрастной группе носители генотипа 12'/12' по сравнению с другими генотипами имели достоверно большие значения показателя асимметрии мощности α3-ритма (ПП > ЛП) в парието-окципитальных отделах. Наличие в генотипе аллеля 12 положительно коррелировало с величиной показателя асимметрии. Только у молодых носителей 12 аллеля (10'/12' и 12'/12') латеральные различия были статистически значимы. В старшей возрастной группе наименьшие значения показателя асимметрии имели носители генотипа 10'/10'. Только у носителей этого генотипа латеральные различия, обусловленные большей мощностью ритма в парието-окципитальном отделе правого по сравнению с левым полушарием, были статистически значимы. Латеральные различия, обусловленные большими значениями мощности α-ритма в задних отделах правого полушария могут представлять собой электрофизиологический эндофенотип, ассоциированный с риском возможного возникновения шизоидных расстройств у молодых людей с генотипом 12'/12'.
Серотонинэргическая система является ключевым регулятором пластических перестроек мозга на всем протяжении жизни [1–3]. Проекции серотонинергической системы широко распространены в коре мозга (прежде всего в префронтальной коре, соматосенсорных зонах париетальной доли, визуальных зонах затылочной доли и задней цингулярной коре [4, 5], что обуславливает интерес к изучению влияния полиморфизмов генов, кодирующих работу серотонинергической системы мозга, на характеристики фоновой биоэлектрической активности коры больших полушарий [6–9]. Изменения фоновой активности мозга могут быть также предвестниками или показателями изменения мозговых функций при патологических процессах [10, 11].
Одним из ключевых регуляторов функций этой системы является транспортер серотонина (5-HTT), осуществляющий обратный захват медиатора из синаптической щели. Изучение гена SLC6A4, кодирующего белок транспортер серотонина, выявило два функциональных полиморфизма. Первоначально был найден полиморфный участок 5-HTTLPR в промоторной области гена, состоящий из 16 (long, L) или 14 (short, S) повторяющихся элементов. Второй полиморфизм STin2VNTR выявлен позже и обусловлен изменением числа тандемных повторов во втором интроне с двумя частыми (10 и 12 повторов) и одним редким (9 повторов) аллелями. Этот полиморфизм выполняет роль аллель-зависимого усилителя экспрессии гена [12].
Влияние полиморфизма STin2VNTR широко изучается в отношении такого психического заболевания, как шизофрения [13], сопровождающегося изменениями полушарной активности. Известно только одно исследование влияния полиморфизма STin2VNTR гена транспортера серотонина на характеристики фоновой электрической активности мозга [14]. На испытуемых, состоящих из молодых китайских женщин, было подтверждено наличие влияния данного полиморфизма на ЭЭГ: у носителей 10 аллеля выявлены более низкие глобальные показатели мощности γ-ритма. В действительности эта группа носителей 10 аллеля была представлена почти исключительно носителями генотипа 10/12 (24 против 1 гомозиготы 10/10). Таким образом, влияние отдельных гомозиготных и гетерозиготного генотипов полиморфизма STin2VNTR гена транспортера серотонина на характеристики фоновой активности мозга представителей европиоидной расы до настоящего времени не изучены.
Известно, что характеристики фоновой электрической активности мозга различаются у молодых и пожилых людей [15, 16]. С другой стороны, в областях мозга, характеризующихся высокой плотностью транспортера серотонина, показано прогрессивное снижение его доступности по мере старения (например, таламус, средний мозг, стриатум, лимбические, сенсорные и моторные корковые области) [17, 18]. Данные возрастные изменения могут вносить свой вклад в функционирование мозга.
Приведенные данные делают актуальной проблему определения ассоциаций между полиморфизмом STin2VNTR гена транспортера серотонина и характеристиками фоновой электрической активности мозга с учетом возможного эпигенетического влияния фактора возраста. Учитывая многочисленные данные о влиянии женских половых гормонов на экспрессию гена транспортера серотонина [19, 20], мы рассмотрели в работе также влияние фактора пола.
Таким образом, целью данного исследования было выяснение ассоциаций между полиморфизмом Stin2VNTR и фоновой электрической активностью мозга с учетом возраста и пола испытуемых европиоидной расы.
МЕТОДИКА
В исследовании принимали участие 99 пожилых (51 мужчина (среднее значение M = 64.5, среднеквадратичное отклонение SD = 7.13 лет) и 48 женщин (M = 63.56, SD = 5.4 лет)) и 196 молодых (86 мужчин (M = 22.5, SD = 3.5 лет) и 110 женщин (M = 21.17, SD = 2.7 лет) людей, относящихся по данным опроса к европеоидной расе. Для участия в исследовании не допускались люди с неврологическими, психическими и серьезными соматическими заболеваниями. Все испытуемые на момент исследования учились или работали, были правшами, имели нормальное или скорректированное до нормального зрение.
Регистрация и обработка ЭЭГ. Регистрацию ЭЭГ в 52 отведениях согласно модифицированной системе 10–20 (American Electroencephalographic Society, 1991) выполняли с использованием комплекса “Neuroscan 4.4” в звукоизолированной комнате в течение 3 мин при закрытых и 3 мин при открытых глазах. В качестве референтного использовали объединенный ушной электрод. Сопротивление электродов не превышало 5 kΩ. Частота дискретизации при записи ЭЭГ составляла 1000 Гц при верхнем ограничении частот 50 Гц и постоянной времени 0.3 с. При записи ЭЭГ регистрировали также электроокулограмму, запись которой использовали для удаления глазодвигательных артефактов. Оставшиеся артефакты удаляли с помощью метода независимых компонент с использованием пакета EEGLAB (http://www.sccn.ucsd.edu/eeglab/).
Учитывая связанное с возрастом возможное смещение пика α активности в область низких частот, расчет мощности производили не в стандартных, а в индивидуальных частотных диапазонах, так как при различиях в частоте α пиков такой подход дает более точные оценки спектральных характеристик ЭЭГ [21]. Частотные диапазоны определяли относительно индивидуального пика частоты α ритма (ИПЧА). Выделяли 8 частотных диапазонов: Δ (от 1 Гц до (ИЧПА ‒6 Гц)); θ ((ИПЧА –6 Гц) – (ИПЧА –4 Гц)), α1 ((ИПЧА –4 Гц) – (ИПЧА –2 Гц)), α2 ((ИПЧА ‒2 Гц) – ИПЧА), α3 (ИПЧА – (ИПЧА +2 Гц)), β1 ((ИПЧА +2 Гц) – 20 Гц), β2 (20–30 Гц) и γ (30–45 Гц) [16].
Спектральную плотность ЭЭГ определяли на основе быстрого преобразования Фурье. Для расчета мощности использовали 90 безартефактных 1.5-секундных эпох.
Вычисляли средние значения мощности для 4 областей левого полушария: фронтальной (Fp1, AF3, F7, F5, F3, F1), центральной (FC3, FC1, C3, C1, CP3, CP1), центрально-темпоральной (FT7, FC5, T7, C5, TP7, CP5) и париетально-окципитальной (P7, P5, P3, P1, PO7, PO5, PO3, O1) и симметричных отделов правого полушария. Данные логарифмировали для нормализации распределения. Показатель межполушарной асимметрии вычисляли как логарифмирированные значения мощности правого полушария минус аналогичные показатели левого полушария.
Определение полиморфизмов STin2VNTR гена транспортера серотонина. Клетки для анализа ДНК получали из соскоба слизистой с внутренней поверхности щеки. ДНК выделяли солевым методом [22]. Для этого клетки в течение двух часов лизировали при 50°C с помощью протеазы К. Белки осаждали насыщенным раствором NaCl (6M). Отбирали супернатант, затем ДНК осаждали с помощью 2 объемов 96% этанола, отмывали 70% этанолом, высушивали, растворяли в стерильной воде и хранили до использования при температуре 20°C. Генотипы 9/9, 9/10, 9/12, 10/10, 10/12 и 12/12 полиморфизма STin2VNTR, локализованного во втором интроне гена транспортера серотонина (Slc6a4), определяли с помощью ПЦР реакции со специфическими к данному полиморфизму праймерами 5'-GGTCAGTATCACAGGCTGCGAGTAG-3' и 5'-TGTTCCTAGTCTTACGCCAGTGAAG-3' (температура отжига 63°C) с последующим разделением и визуализацией продуктов ПЦР методом электрофореза на 3% агарозном геле и окрашиванием бромистым этидием для визуализации. Размеры фрагментов STin2.12, STin2.10 и STin2.9 аллелей были 298, 265 и 248 п.о., соответственно [23]. При статистической обработке мы объединяли в одну группу генотипы, содержащие STin2.10 и STin2.9 аллели [13]. Таким образом, в зависимости от величины аллель-зависимого усиления транскрипции гена, мы рассмотрели 3 функциональных группы: 10'/10', 10'/12', 12'/12'.
Статистический анализ проводили с использованием repeated measures ANOVA в программе STATISTICA 8. Последующий анализ значимых взаимодействий проводили с помощью плановых сравнений и критерия Фишера. Для выявления связи между показателем межполушарной асимметрии и количеством 12 аллеля использовали критерий непараметрической корреляции Спирмена.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Распределение 10'/10', 10'/12', 12'/12' генотипов не отличалось от соотношения Харди-Вайнберга в группах как молодых (χ2 = 6.57, p = 0.44), так и пожилых (χ2 = 1.27, p = 0.39) испытуемых.
Для широкого диапазона частот был проведен дисперсионный анализ с выделением факторов: ПОЛ (мужчины, женщины), ВОЗРАСТ (молодые и пожилые), ГЕНОТИП (10'/10', 10'/12', 12'/12'), ДИАПАЗОН (Δ, θ, α1, 2, 3, β1, 2, γ), ОБЛАСТЬ (4 области) и ЛАТЕРАЛЬНОСТЬ (левое и правое полушария). Поскольку задачей исследования являлось изучение влияния полиморфизма Stin2VNTR на биоэлектрическую активность мозга, рассматривали только эффекты фактора ГЕНОТИП и взаимодействия, включающие этот фактор. Было выявлено статистически значимое взаимодействие: ВОЗРАСТ × ГЕНОТИП × ДИАПАЗОН × ОБЛАСТЬ × ЛАТЕРАЛЬНОСТЬ (F(42, 6069) = 1.64, p = 0.005; р = 0.038 с поправкой Гринхауса-Гейзера). Так как влияние полиморфизма Stin2VNTR не зависело от фактора пола, однако было опосредовано фактором диапазона, провели анализ отдельно для каждого частотного диапазона и без учета половых различий. Статистически значимое взаимодействие, включающее фактор ГЕНОТИП, было обнаружено только при анализе α3-ритма: ВОЗРАСТ × ГЕНОТИП × ОБЛАСТЬ × ЛАТЕРАЛЬНОСТЬ (F(6, 885) = 3.44, p = 0.002; р = 0.005 с поправкой Гринхауса-Гейзера). Дальнейший анализ взаимодействия методом плановых сравнений показал, что генетические различия, связанные с возрастом и латеральностью, были характерны только для показателей мощности париетально-окципитальной области мозга. Эффект был обусловлен различиями в показателях межполушарной асимметрии (при отсутствии статистически значимых различий в мощности ритма отдельно в правом и левом полушариях между носителями различных генотипов).
В младшей возрастной группе у носителей генотипа 10'/10' (21.9% испытуемых в выборке) различия значений спектральной мощности α3-ритма в париетально-окципитальной области мозга в левом и правом полушариях были менее выражены по сравнению с гомо- и гетерозиготными носителями аллеля 12 (10'/10' vs 12'/12', р = 0.003; 10'/10' vs 10'/12', р = 0.018). В то же время у людей старшего возраста генетические различия были менее яркие и противоположно направленные. Пожилые носители генотипа 10'/10' (17.1% испытуемых в выборке) имели достоверно большие абсолютные значения показателя асимметрии (мощность в правом минус мощность в левом полушарии) по сравнению с 10'/12' (р = 0.035), свидетельствующие об относительно большей мощности α3-ритма в правом полушарии (рис. 1).
Рис. 1.
Результаты в α3-частотном диапазоне для париетально-окципитальной области мозга. А – показатель межполушарной асимметрии α3-мощности фоновой ЭЭГ (логарифмированные показатели мощности левого минус правого полушария) (M ± SE) для молодых и пожилых испытуемых трех полиморфизмов генотипа Stin2VNTR. а – показатели в группе молодых испытуемых, б – в группе пожилых. Б, В – мощность (M ± SE) в α3-ритме в париетально-окципитальной области в левом и правом полушариях у испытуемых младшей (Б) и старшей (В) возрастных групп. в – значения мощности в левом полушарии, г – в правом. В процентах указаны межполушарные различия в показателях мощности (значения в правом полушарии относительно значений в левом полушарии). Столбики обозначены следующим образом: а – все испытуемые, б – 10'/10', в – 10'/12', г – 12'/12'. Звездочками обозначены показатели асимметрии с достоверными латеральными различиями (* – р < 0.05, ** – p < 0.001).
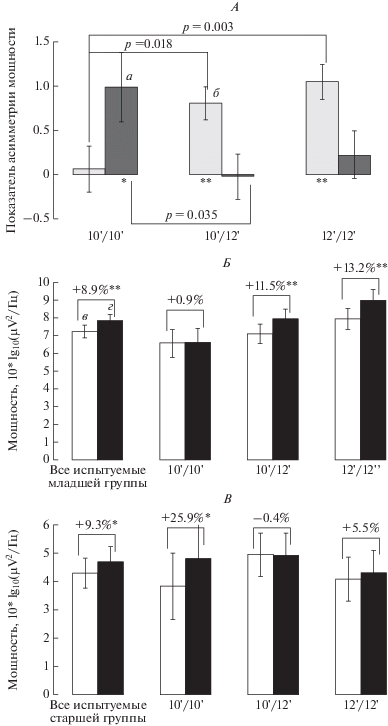
При сравнении мощности биопотенциалов в парието-окципитальных отделах разных полушарий мозга были выявлены большие значения мощности в правом по сравнению с левым полушарием: у молодых носителей генотипа 12'/12' (р = 0.000), 10'/12' (р = 0.000), а среди пожилых – у носителей генотипа 10'/10' (р = 0.014). В остальных группах молодых и пожилых лиц латеральные различия не были статистически значимы.
Дополнительный анализ с использованием нелинейной корреляции Спирмена обнаружил статистически значимую положительную корреляцию между показателем асимметрии и количеством 12 аллелей STin2VNTR в генотипе только среди молодых испытуемых (r = 0.21, p = 0.002): показатель асимметрии мощности α3-ритма в париетально-окципитальной области растет с увеличением числа 12 аллелей в генотипе.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Проведенное исследование впервые рассматривает ассоциации между полиморфизмом Stin2VNTR и характеристиками фоновой электрический активности мозга с учетом пола и возраста испытуемых. Результаты исследования показывают, что опосредованные генотипом латеральные различия в α3-ритме в задних областях мозга зависят от такого эпигенетического фактора, как возраст испытуемых. У пожилых испытуемых достоверные латеральные различия, обусловленные большими значениями мощности ритма в правом полушарии, обнаружены у носителей генотипа 10'/10', тогда как у молодых в группе с генотипом 12'/12'. Только у молодых испытуемых ассоциация между количеством 12 аллеля в генотипе Stin2VNTR и выраженностью полушарной асимметрии носит корреляционный характер.
Результаты мета-анализа, проведенного J.B. Fan и P. Sklar [13], показывают, что аллель 12 полиморфизма STin2VNTR является фактором риска развития шизофрении. Считается также, что значимая роль в этиологии шизофрении принадлежит нарушениям в полушарной латерализации функций [24–26]. Так, с помощью функциональной магнитно-резонанасной томографии (фМРТ) выявлено, что большая активность в правом полушарии по сравнению с левым в нижней париетальной дольке и задней цингулярной извилине наблюдается у больных шизофренией [27]. Поскольку была показана важная роль рецепторов серотонина типа 5-HT1A в регуляции активности задней цингулярной коры [5], в этиологии данного эффекта возможно влияние полиморфизма гена, кодирующего обратный захват серотонина из синаптической щели. Согласно современным данным, выраженность BOLD-сигнала в таких структурах, как нижняя париетальная долька и задняя цингулярная кора, положительно коррелирует с мощностью α-ритма [28]. В соответствии с этим при регистрации фоновой ЭЭГ у испытуемых с первым эпизодом шизофрении зафиксирована большая мощность α-ритма в правом полушарии по сравнению с левым [29], с наиболее выраженным эффектом в задних отведениях [30]. Возраст выборки составлял 17–32 годa, что согласуется с данными о проявлении первых симптомов шизофрении в молодом возрасте – часто между двадцатью и тридцатью годами [31, 32].
Важно отметить, что в литературе указаны также и другие возможные ассоциации между полиморфизмом STin2VNTR и патологиями, которые могут быть связаны с асимметрией в активности мозга. Колебание уровня серотонина является известным фактором в формировании мигрени за счет эффекта сужения сосудов. Мета-анализ M. Schürks et al. [33] по проблеме ассоциаций мигрени с полиморфизмом Stin2VNTR показал, что протекторным фактором относительно мигрени является 10 аллель (т.е. генотипы 10'/12' и 10'/10' по сравнению с гомозиготами 12'/12'). Кроме того, оказалось, что наименьшим риском обладают носители гетерозиготного генотипа: у носителей 10'/12' риск возникновения мигрени был на 25% ниже, чем носителей 12'/12' [33]. Однако эти данные расходятся с выявленным в эксперименте градуальным увеличением показателя межполушарной асимметрии париетального α3-ритма с увеличением количества 12 аллеля в генотипе и с возможностью объединения носителей 12 генотипа в единую группу по показателю асимметрии. Генетические различия, выявленные у пожилых испытуемых также противоречат возможности объединения электрофизиологических эндофенотипов носителей аллеля 10.
Таким образом, можно предположить, что латеральные различия, обусловленные большими значениями мощности α-ритма в задних отделах правого полушария по сравнению с левым, могут представлять собой электрофизиологический эндофенотип, ассоциированный с риском возможного возникновения шизоидных расстройств у молодых людей с генотипом 12'/12'. Происходящие в процессе старения изменения в ассоциации между полиморфизмом STin2VNTR и показателями асимметрии α-активности могут быть основой того, что возрастные изменения в мозге уменьшают вероятность развития таких расстройств в старшей возрастной группе. Однако это предположение носит предварительный характер, для его проверки требуются дополнительные исследования с включением в выборку больных в начальной стадии шизофрении.
ВЫВОДЫ
1. Эндофенотипы электрической активности мозга, ассоциированные с полиморфизмом STin2VNTR гена транспортера серотонина, характеризуются специфическими паттернами асимметрии мощности α3-ритма в парието-окципитальных отделах полушарий мозга и отличаются у молодых и пожилых испытуемых.
2. В младшей возрастной группе носители генотипа 12'/12' по сравнению с другими генотипами имели достоверно большие значения показателя асимметрии мощности α3-ритма в парието-окципитальных отделах (ПП > ЛП). Наличие в генотипе аллеля 12 положительно коррелировало с величиной показателя асимметрии.
3. В старшей возрастной группе наибольшие значения показателя асимметрии α3-ритма имели носители генотипа 10'/10'; только у носителей этого генотипа латеральные различия (ПП > ЛП) были статистически значимы.
Этические нормы. Все исследования проведены в соответствии с принципами биомедицинской этики, сформулированными в Хельсинкской декларации 1964 г. и ее последующих обновлениях, и одобрены локальным биоэтическим комитетом Научно-исследовательского института физиологии и фундаментальной медицины (Новосибирск).
Информированное согласие. Каждый участник исследования представил добровольное письменное информированное согласие, подписанное им после разъяснения ему потенциальных рисков и преимуществ, а также характера предстоящего исследования.
Финансирование работы. Исследование выполнено при частичной финансовой поддержке РФФИ и Правительства Новосибирской области в рамках научного проекта (№ 19-415-543 009).
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией данной статьи.
Список литературы
van Kesteren R.E., Spencer G.E. The role of neurotransmitters in neurite outgrowth and synapse formation // Annu. Rev. Neurosci. 2003. V. 14. № 3. P. 217.
Sodhi M.S., Sanders-Bush E. Serotonin and brain development // Int. Rev. Neurobiol. 2004. V. 59. P. 111.
Homberg J.R., Molteni R., Calabrese F., Riva M.A. The serotonin BDNF duo: developmental implications for the vulnerability to psychopathology // Neurosci. Biobehav. Rev. 2014. V. 43. P. 35.
Celada P., Puig M.V., Artigas F. Serotonin modulation of cortical neurons and networks // Front. Integr. Neurosci. 2013. V. 7. № 25. P. 25.
Hahn A., Wadsak W., Windischberger C. et al. Differential modulation of the default mode network via serotonin-1A receptors // Proc. Natl. Acad. Sci. U.S.A. 2012. V. 109. № 7. P. 2619.
Volf N.V., Belousova L.V., Knyazev G.G., Kulikov A.V. Gender differences in association between serotonin transporter gene polymorphism and resting-state EEG activity // Neuroscience. 2015. V. 284. P. 513.
Christou A.I., Endo S., Wallis Y. Variation in serotonin transporter linked polymorphic region (5-HTTLPR) short/long genotype modulates resting frontal electroencephalography asymmetries in children // Dev. Psychopathol. 2016. V. 28. № 1. P. 239.
Volf N.V., Belousova L.V., Knyazev G.G., Kulikov A.V. Interactive effect of 5-HTTLPR genotype and age on sources of cortical rhythms in healthy women // Int. J. Psychophysiol. 2016. V. 109. P. 107.
Proshina E.A., Savostyanov A.N., Bocharov A.V., Knyazev G.G. Effect of 5-HTTLPR on current source density, connectivity, and topological properties of resting state EEG networks // Brain Res. 2018. V. 1697. P. 67.
Smit D.J.A., Wright M.J., Meyers J.L. et al. Genome-wide association analysis links multiple psychiatric liability genes to oscillatory brain activity // Hum. Brain mapp. 2018. V. 39. № 11. P. 4183.
Howells F.M., Temmingh H.S., Hsieh J.H. et al. Electroencephalographic delta/alpha frequency activity differentiates psychotic disorders: a study of schizophrenia, bipolar disorder and methamphetamine-induced psychotic disorder // Transl. Psychiatry. 2018. V. 8. № 1. P. 75.
Fiskerstrand C.E., Lovejoy E.A., Quinn J.P. An intronic polymorphic domain often associated with susceptibility to affective disorders has allele dependent differential enhancer activity in embryonic stem cells // FEBS letters. 1999. V. 458. № 2. P. 171.
Fan J.B., Sklar P. Meta-analysis reveals association between serotonin transporter gene STin2 VNTR polymorphism and schizophrenia // Mol. Psychiatry. 2005. V. 10. № 10. P. 928.
Lee T.W., Yu Y.W., Hong C.J. et al. The influence of serotonin transporter polymorphisms on cortical activity: a resting EEG study // BMC Neurosci. 2011. V. 12. № 1. P. 33.
Barry R.J., De Blasio F.M. EEG differences between eyes-closed and eyes-open resting remain in healthy ageing // Biol. Psychol. 2017. V. 129. P. 293.
Sleimen-Malkoun R., Perdikis D., Müller V. et al. Brain dynamics of aging: Multiscale variability of EEG signals at rest and during an auditory oddball task // eNeuro. 2015. V. 2. № 3. P. 0067.
Yamamoto M., Suhara T., Okubo Y. et al. Age-related decline of serotonin transporters in living human brain of healthy males // Life Sci. 2002. V. 71. № 7. P. 751.
Smith G.S., Barrett F.S., Joo J.H. et al. Molecular imaging of serotonin degeneration in mild cognitive impairment // Neurobiol. Dis. 2017. V. 105. P. 33.
Bethea C.L., Mirkes S.J., Su A., Michelson D. Effects of oral estrogen, raloxifene and arzoxifene on gene expression in serotonin neurons of macaques // Psychoneuroendocrinology. 2002. V. 27. № 4. P. 431.
Barth C., Villringer A., Sacher J. Sex hormones affect neurotransmitters and shape the adult female brain during hormonal transition periods // Front. Neurosci. 2015. V. 9. P. 37.
Doppelmayr M., Klimesch W., Pachinger T., Ripper B. Individual differences in brain dynamics: important implications for the calculation of event-related band power // Biol. Cybern. 1998. V. 79. № 1. P. 49.
Miller S.A., Dykes D.D., Polesky H.F. A simple salting out procedure for extraction DNA from human nucleated cells // Nucleic. Acids. Res. 1988. V. 16. № 3. P. 1215.
Avula R., Rand A., Black J.L., O’Kane D.J. Simultaneous genotyping of multiple polymorphisms in human serotonin transporter gene and detection of novel allelic variants // Transl. Psychiatry. 2011. V. 1. № 8. P. e32.
Ribolsi M., Daskalakis Z.J., Siracusano A., Koch G. Abnormal Asymmetry of Brain Connectivity in Schizophrenia // Front. Hum. Neurosci. 2014. V. 8. P. 1010.
Sun Y., Chen Y., Collinson S.L. et al. Reduced Hemispheric Asymmetry of Brain Anatomical Networks Is Linked to Schizophrenia: A Connectome Study // Cereb. Cortex. 2017. V. 27. № 1. P. 602.
Ocklenburg S., Güntürkün O., Hugdahl K., Hirnstein M. Laterality and mental disorders in the postgenomic age – A closer look at schizophrenia and language lateralization // Neurosci. Biobehav. Rev. 2015. V. 59. P. 100.
Swanson N., Eichele T., Pearlson G. et al. Lateral Differences in the Default Mode Network in Healthy Controls and Schizophrenia Patients // Hum. Brain Mapp. 2011. V. 32. № 4. P. 654.
Mantini D., Perrucci M.G., Del Gratta C. et al. Electrophysiological signatures of resting state networks in the human brain // Proc. Natl. Acad. Sci. USA. 2007. V. 104. № 32. P. 13170.
Мельникова Т.С., Саркисян В.В., Гурович И.Я. Характеристика α-ритма ЭЭГ при первом эпизоде параноидной шизофрении // Социальная и клиническая психиатрия. 2013. Т. 23. № 1. С. 40.
Strelets V.B., Garakh Zh.V., Novototskii-Vlasov V.Y., Magomedov R.A. Relationship between EEG power and rhythm synchronization in health and cognitive pathology // Neurosci. Behav. Physiol. 2006. V. 36. № 6. P. 655.
Ochoa S., Usall J., Cobo J. et al. Gender differences in schizophrenia and first-episode psychosis: a comprehensive literature review // Schizophr. Res. 2012. V. 2012. Article ID 916198. 9 p.
Gupta S.K., Jiloha R.C., Yadav A. Onset of schizophrenia at 100 years of age // Indian J. Psychiatry. 2014. V. 56. № 1. P. 82.
Schürks M., Rist P.M., Kurth T. STin2 VNTR polymorphism in the serotonin transporter gene and migraine: pooled and meta-analyses // J. Headache. Pain. 2010. V. 11. № 4. P. 317.
Дополнительные материалы отсутствуют.
Инструменты
Физиология человека


