Физиология человека, 2020, T. 46, № 3, стр. 37-55
Регуляторные системы мозга у подростков с признаками девиантного поведения. Междисциплинарный анализ
Р. И. Мачинская 1, *, М. Н. Захарова 1, Д. И. Ломакин 1
1 ФГБНУ Институт возрастной физиологии РАО
Москва, Россия
* E-mail: reginamachinskaya@gmail.com
Поступила в редакцию 04.12.2019
После доработки 23.12.2019
Принята к публикации 03.02.2020
Аннотация
В работе проведен сравнительный междисциплинарный анализ состояния регуляторных функций мозга у подростков 13–16 лет с признаками девиантного поведения (n = 82) и подростков без признаков девиантного поведения (n = 125). В первую группы вошли подростки, имеющие поведенческие и эмоциональные проблемы в школе и при взаимодействии с родителями, о которых сообщали школьные психологи. Оценивали склонность к отклонениям в поведении (стандартизированные опросники), эффективность произвольной регуляции когнитивной деятельности (нейропсихологическое тестирование) и функциональное состояние регуляторных систем (РС) мозга в покое (визуальный структурный анализ ЭЭГ). Показано, что у подростков 13–16 лет склонность к девиантному поведению сопровождается неоптимальным состоянием различных звеньев РС. У подростков с признаками девиантного поведения изменения ЭЭГ лимбического происхождения были наиболее заметными и отмечались значимо чаще, чем в контрольной группе. Групповые различия той же направленности были обнаружены для ЭЭГ-признаков неоптимального состояния фронто-таламических структур (на уровне тенденции) и изменений ЭЭГ в латеральных префронтальных областях левого полушария. Подростки с ЭЭГ признаками неоптимального состояния различных звеньев РС мозга демонстрировали как общие, так и специфические склонности к девиантному поведению и дефицит различных компонентов произвольной регуляции деятельности. Полученные результаты свидетельствуют о том, что неоптимальное функционирование РС головного мозга является важным нейрофизиологическим фактором, определяющим поведенческие отклонения у подростков.
Особенности поведения и функционирования мозга в подростковом возрасте. Роль регуляторных систем
В подростковом возрасте на фоне важнейших перестроек всех физиологических систем организма [1] и формирования эмоционально-волевой сферы личности [2], чаще, чем на других этапах онтогенеза, наблюдаются негативные изменения поведения: повышенная эмоциональная лабильность вплоть до проявления агрессии, склонность к принятию необдуманных и рискованных решений, которые могут нанести вред самому подростку или окружающим, отказ от соблюдения социальных норм и правил, т.е. такие формы поведения, которые относят к отклоняющимся – девиантным [3]. Несмотря на интенсивные исследования подросткового возраста в нейрокогнитивной науке [4] вопрос о том, почему этот период развития сопровождается повышенным риском девиантности, остается открытым. Исследователи “подростковых” проблем сталкиваются с противоречием между прогрессивными изменениями произвольных форм когнитивной деятельности и их мозговых механизмов [5–9], с одной стороны, и трудностями регуляции поведения, с другой [10–12]. У подростков по сравнению с детьми существенно повышается эффективность внимания и рабочей памяти [13, 14], возрастает когнитивная гибкость [15]. Вместе с тем, недостаточность произвольного контроля в сочетании с дефицитом распознавания социально значимой информации могут приводить к выраженным отклонениям в виде делинквентности [16], а в сочетании со стремлением к быстрому достижению цели – к увеличению риска импульсивных реакций и затруднениям при анализе последствий своих действий [17]. В психологических исследованиях показано, что подростков с признаками девиантного поведения отличают трудности мотивационной регуляции, проявляющиеся в отказе от деятельности, требующей длительных усилий для достижения результата (delay aversion) [18], асоциальном характере мотивов деятельности и способах достижения результата [19, 20], в склонности к принятию рискованных решений (risk-taking behavior) [21, 22].
Какие же особенности подросткового возраста, отличающие его от других периодов развития, снижают эффективность регуляции целенаправленного поведения? В настоящее время можно считать общепризнанным, что на развитие человека оказывают влияние как социальные, так и биологические факторы, взаимодействующие между собой [1, 2, 7, 14, 23]. Подростковые физиологические изменения “запускаются” гормональными сдвигами, обусловленными половым созреванием, но не сводятся к ним. Влияние половых гормонов на активность коры и глубинных структур головного мозга реализуется через специализированные молекулярные рецепторы на мембранах их нейронов. Наличие таких рецепторов показано в структурах мозга, активность которых связана с эмоционально-мотивационной регуляцией поведения: лимбической системе, гипоталамусе, покрышке моста и прилежащем ядре, вместе составляющих дофаминовую “систему награды”, гиппокампе, обонятельной луковице, черной субстанции и цингулярной коре [24]. Чувствительные к содержанию стероидов нейронные рецепторы обнаружены также в префронтальной [25] и височной [26] зонах коры, причем их активность возрастает в период полового созревания. Стероиды оказывают влияние также на морфологическое изменения нейронных сетей в том числе в период полового созревания [27–32]. В подростковом возрасте усиливается и активность гипоталамо-гипофизарной системы, регулирующей содержание кортизола [33], уровень которого возрастает при негативных эмоциональных состояниях. Согласно данным [34] активность мозговых систем, участвующих в произвольном контроле эмоционального поведения зависит от соотношений уровня тестостерона и кортизола. В этой работе было показало, что во время произвольного контроля негативных эмоций при низком уровне кортизола, содержание тестостерона положительно коррелирует с активностью дорзолатеральной префронтальной коры и таламуса – структурами, входящими во фронто-таламическую систему избирательной произвольной регуляции деятельности [35], а при высоком уровне кортизола такая зависимость отсутствует. Более того, на фоне соотношения “низкий кортизол/высокий тестостерон” возрастают функциональные связи между префронтальной корой и амигдалой – основным “регулятором” внешнего выражения эмоционального состояния.
Представленные выше данные говорят о неоднозначном влиянии гормональных перестроек подросткового возраста на активность структур мозга, обеспечивающих произвольный контроль и эмоционально-мотивационную регуляцию поведения. Кроме того, интенсификация процессов роста всего организма, так же связанная с повышенной активностью гипоталамо-гипофизарной системы, снижает адаптационные ресурсы и сопровождается повышенной утомляемостью и снижением работоспособности [1]. Если учесть, что морфофункциональное созревание высших регуляторных центров мозга, расположенных в префронтальной коре и их связей с другими областями коры и глубинными структурами продолжается на всем протяжении подросткового и даже юношеского возраста [14, 36, 37], то становится ясным, что этот период онтогенеза характеризуется, прежде всего, высокой вариативностью и напряжением в работе нейронных сетей, реализующих регуляторные аспекты поведения – регуляторных систем мозга (РС). Следовательно, наиболее вероятной биологической основой увеличения риска девиантного поведения у подростков является сочетание индивидуальных и возрастных особенностей функционирования различных звеньев РС.
В мозговом обеспечении регуляции целенаправленного поведения и когнитивных процессов участвует множество зон коры и подкорковых образований, объединенных в функционально-специфичные нейронные сети с “центрами управления” в различных зонах префронтальной кор [35]: 1) сеть избирательного контроля когнитивной деятельности и поведения с центром в дорзолатеральной части префронтальной коры; 2) фронто-лимбическая сеть (fronto-limbic network) с центром в медиальной части префронтальной коры, включая переднюю цингулярную извилину [38, 39], осуществляет оценку соответствия совершенного или планируемого действия целям поведения на основе отрицательной обратной связи, а также длительное поддержание внимания для достижения “отставленной” во времени цели [40]; 3) фронто-стриарная сеть с центром в орбитофронтальной коре включает дофаминовую систему награды (reward system), активность которой усиливается при ожидании или получении полезного результата (положительной обратной связи). Орбитофронтальная кора, тесно связанная с базальными ганглиями, участвует в обеспечении еще одной важной для контроля поведения подростков функции – социальном взаимодействии [41]. Таким образом, фронтостриарная сеть наряду с фронто-лимбической является важным элементом мозгового обеспечения мотивационной регуляции деятельности. Анализ состава описанных выше РС показывает, что в них входят многие из тех структур и связей, которые испытывают на себе неоднозначное влияние гормональных перестроек подросткового возраста. Это значит, что у подростков происходят существенные возрастные изменения в функционировании РС, которые при неблагоприятных условиях, внешних или внутренних, могут привести к отклонениям поведения. Имеющиеся в литературе данные действительно указывают на то, что активность некоторых звеньев РС мозга у подростков отличается от “взрослого” типа. Наиболее изученной в этом отношении является фронтостриарная система. Сведения о ее функционировании у подростков противоречивы. Одни авторы указывают на снижение активности прилежащего ядра, заставляющее подростков искать сильные стимулы для положительного подкрепления и дополнительной активизации системы награды [11, 42]. Другие, их мнение доминирует среди исследователей, напротив, указывают на повышенную активацию системы награды как отличительную особенность подросткового возраста [17, 43–45]. Вместе с тем, само по себе повышение активности прилежащего ядра не всегда приводит к негативным изменениям поведения. Согласно выводам обзора [46], усиленная реакция подкоркового звена системы награды может рассматриваться как позитивное явление, поскольку повышает стремление к получению положительно результата, например, поощрения своих успехов в учебе или каком-то другом виде деятельности, одобряемом обществом.
Существенный интерес для понимания возможной специфической роли различных РС в увеличении рисков девинатного поведения подростков представляют сравнительные фМРТ-исследования подростков с разной степенью выраженности рискованного поведения (risk-taking behavior) [47, 48]. Эти иследования показывают, что “критическим” для риска отклонений в поведении является не повышение или понижение активности прилежащего ядра, а несформированность или нарушение баланса активности префронтальной коры и подкорковых звеньев системы.
Особенности функционирования лимбического звена мотивационной регуляции у подростков представлены в современной нейрокогнитивной науке существенно меньше. Известно, что на протяжении всего подросткового возраста происходят морфологические изменения амигдалы, которые коррелируют с периодами интенсивного синтеза половых гормонов [49]. Что касается специфики вовлечения амигдалы в процессы эмоционально-мотивационной регуляции у подростков по сравнению с детьми младшего возраста и взрослыми, то, согласно обзору [6] сведения об этом противоречивы: в литературе представлены свидетельства как в пользу относительного снижения, так и в пользу относительного повышения активации амигдалы при восприятии социально-значимой эмоционально-окрашенной информации.
Неоднозначность сведений об особенностях функционирования регуляторных систем мозга у подростков и ограниченность данных о связи между состоянием регуляторных систем и склонностью к отклонениям поведения делают актуальной цель настоящего исследования – сравнительный анализ индивидуальных особенностей регуляторных функций мозга на поведенческом и нейрофизиологическом уровнях у подростков с признаками девиантного поведения и подростков без таких признаков. Можно предполагать, что у подростков с признаками девиантного поведения снижена эффективность произвольной регуляции деятельности, и это связано с неоптимальным состоянием мозговых систем когнитивного контроля и эмоционально-мотивационной регуляции. Учитывая описанную выше функциональную специфичность корково-подкорковых нейронных сетей, участвующих в реализации контроля поведения, следует ожидать, что неоптимальное состояние отдельных звеньев РС может оказывать специфическое влияние на эффективность произвольной регуляции поведения у подростков.
Оценка произвольной регуляции деятельности на поведенческом уровне осуществлялась с помощью анкетирования самих подростков и нейропсихологического обследования, направленного на выявление трудностей избирательной регуляции, программирования и контроля деятельности – управляющих функций (УФ).
Оценка индивидуальных особенностей функционирования РС в состоянии покоя проводилась с помощью схемы структурного анализа ЭЭГ [50, 51], которая была разработана ранее специально для сопоставления данных ЭЭГ и результатов нейропсихологического анализа и использовалась в наших предыдущих междисциплинарных исследованиях когнитивной деятельности и поведения у детей и подростков [52, 53]. Учитывая роль визуального анализа ЭЭГ в настоящем исследовании, необходимо подробнее рассмотреть анализируемые нами ЭЭГ-паттерны, их происхождение и функциональный смысл.
Структурный анализ ЭЭГ как инструмент оценки индивидуальных особенностей функционирования коры и глубинных структур мозга
В основе структурного анализа ЭЭГ лежит принцип соотнесения определенных ЭЭГ-паттернов с отклонениями функционального состояния различных макроструктур мозга (принцип функциональной классификации) [52], сходный с принципом функциональной классификации наблюдаемых при нейропсихологическом обследовании отклонений когнитивной деятельности, предложенном А.Р. Лурия [54].
Согласно схеме структурного анализа ЭЭГ, различные электроэнцефалографические феномены, такие как ритмические осцилляции определенной частоты или отдельные отклоняющиеся паттерны, в зависимости от их регулярности, формы и топографии относятся к 4-м функциональным классам, которые характеризуют состояние коры больших полушарий и глубинных регуляторных структур мозга: 1) состояние и степень функциональной зрелости ритмогенных сетей коры, 2) общемозговые (диффузные) изменения, 3) локальные отклонения функционального состояния коры в отдельных макрозонах правого или левого полушарий, 4) функциональное состояние глубинных стволовых и подкорковых структур.
Состояние и степень функциональной зрелости ритмогенных сетей коры, отражается в регулярности и частоте основного ритма (α-ритма), который регистрируется в каудальных отделах мозга и разрушается (десинхронизируется) при открывании глаз [51]. Общемозговые изменения характеризуются непароксизмальными паттернами в виде отдельных острых или медленных колебаний различной частоты без четкой локализации (негрубые изменения) или диффузных медленных колебаний (выраженные изменения) [55]. ЭЭГ-признаками локальных изменений функционального состояния коры являются отклоняющиеся паттерны в виде отдельных острых и/или медленных волн, либо групп регулярных колебаний различной частоты, которые регистрируются в одном или нескольких рядом расположенных отведениях одного из полушарий. Неоптимальное функционирование и/или незрелость глубинных стволовых и/или подкорковых структур отражаются на ЭЭГ в виде билатерально-синхронных изменений в гомологичных отведениях обоих полушарий [55]. Анализ данных клинических и нейронных исследований позволил нам выделить билатерально-синхронные паттерны, отличающиеся локализацией, частотой и формой колебаний, отражающие неоптимальное состояние различных звеньев РС.
В связи с задачами настоящего исследования необходимо рассмотреть подробнее билатерально-синхронные паттерны различного происхождения, примеры которых приведены на рис. 1, 2 и 3.
Рис. 1.
Фрагмент ЭЭГ (Артем Г., 13 лет) с признаками изменений фронто-таламического генеза – группами билатерально-синхронных θ-волн с частотой 5 кол./с в лобных и центральных отведениях.
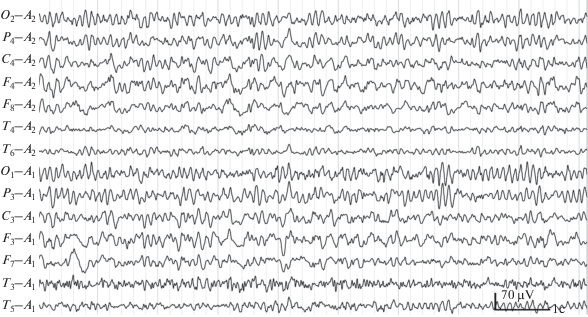
Рис. 2.
Фрагмент ЭЭГ (Дарья Р., 13 лет) с признаками изменений лимбического происхождения – группами билатерально-синхронных α-подобных колебаний с частотой 7–8 кол./с в лобных, нижнелобных и передневисочных отведениях.
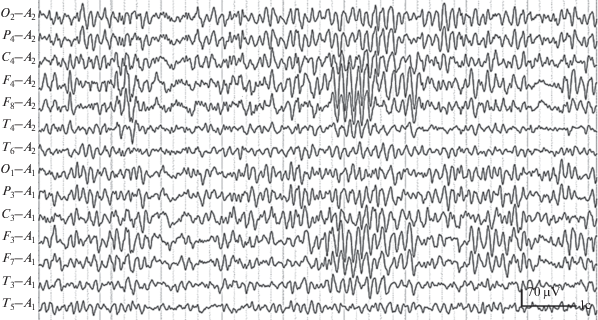
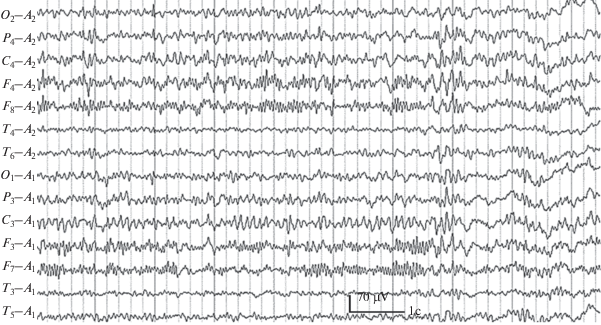
Рис. 3.
Фрагмент ЭЭГ (Михаил Г., 14 лет) с признаками изменений лобно-базального происхождения – β-веретена с частотой осцилляций 20–25 кол./с в лобных и нижнелобных отведениях – и гипоталамического происхождения – генерализованные билатерально-синхронные паттерны, состоящие из двухфазных пиков и острых волн α- и β-диапазонов.
Изменения ЭЭГ фронто-таламического генеза. Согласно схеме структурного анализа ЭЭГ к признакам неоптимального состояния фронто-таламической системы (ФТС) относятся группы билатерально-синхронных θ-волн (4–6 Гц) в лобных и/или центральных отведениях (рис. 1). Основными составляющими ФТС являются префронтальные зоны коры и медиодорзальное ядро таламуса (MD), объединенные мощными реципрокными проводящими путями [56]. Эта система является одним из ключевых звеньев нейронных сетей, обеспечивающих когнитивный контроль поведения и ментальной активности [35, 57]. В пользу связи билатерально-синхронных групп регулярных медленных колебаний ∆–θ-диапазона в передних отделах коры с неоптимальным состоянием ФТС говорят клинические ЭЭГ-исследования [58–60]. На таламическое происхождение θ-колебаний на ЭЭГ фронтальных отделов коры указывают также экспериментальные исследования нейронной активности животных (мышей) [61].
Изменения ЭЭГ лимбического генеза. К ЭЭГ-признакам неоптимального состояния лимбических структур мы относили группы билатерально-синхронных веретенообразных колебаний низкочастотного α-диапазона (6–10 Гц) в лобных и/или передневисочных отведениях (рис. 2). На лимбическое происхождение этих паттернов указывают многочисленные литературные данные. По данным исследований [62, 63] повреждения лимбических структур мозга приводят к увеличению представленности α-колебаний в передних и передневисочных отделах коры.
В работах [64, 65] на основании анализа магнитоэнцефалограммы показано, что дипольные источники α-колебаний в лобных отделах локализованы в передней цингулярной коре – корковом звене лимбической системы. В пользу связи фронтального α-ритма с лимбическими и медиальными лобными структурами мозга свидетельствуют данные МЭГ- и ЭЭГ-исследований электрографических коррелятов нейронных сетей покоя [66–68]. Нейронные генераторы α-осцилляций в подкорковом отделе лимбической системы – базалатеральном ядре амигдалы (BLA, basolateral amygdala) обнаружены у свободно передвигающихся мышей при выработке и угашении условного рефлекса страха [69]. α-осцилляции в лимбических структурах мозга человека (амигдале и гиппокампе) описаны в исследовании [70]. Авторы этого исследования связывают усиление ритмических влияний амигдалы на гиппокамп в диапазоне α-частот со снижением эффективности “эмоциональной” памяти.
Таким образом, литературные данные свидетельствуют в пользу лимбического происхождения вспышек регулярных α-колебаний в лобных и/или передневисочных отделах мозга. Представленные выше результаты современных исследований α-активности амигдалы у животных и человека дают возможность связать рассматриваемые ЭЭГ-паттерны (гиперсинхронные вспышки фронтального α-ритма) со снижением функциональных возможностей лимбической системы в обеспечении процессов эмоционально-мотивационной регуляции поведения и когнитивной деятельности.
Изменения ЭЭГ лобно-базального генеза. К ЭЭГ-признакам неоптимального состояния лобно-базальных структур мы относили вспышки билатерально-синхронной веретенообразной β-активности (20–30 Гц) в лобных, центральных и/или передневисочных отведениях (рис. 3), которые в клинической классификации ЭЭГ-паттернов обозначается термином SEB (spindling excessive β) и описываются как “высокочастотный β веретенообразной формы с доминированием в передних отделах” [71, 72].
В обзорах, посвященных информативности отклоняющихся паттернов ЭЭГ [72, 73] представлены данные о наличии SEB у пациентов с нарушениями поведения (импульсивностью) и эмоциональной сферы (депрессиями, биполярными расстройствами, обсессивно-компульсивными расстройствами, тревожностью). Вспышки β-осцилляций описаны в ЭЭГ лобных отделов у “нетипичной” подгруппы детей с СДВГ, в клинической картине которых помимо симптомов невнимательности наблюдаются эмоциональные нарушения [72–74].
Наиболее вероятным источником гиперсинхронных высокочастотных осцилляций в передних отделах мозга являются нейронные сети, включающие базальные ядра, ядра таламуса и неокортекс. О роли лобно-базальных структур в генезе β-веретен свидетельствуют исследования фокальных потенциалов и нейронной активности бледного шара (GP, globus pallidus), субталамического ядра (STN, subthalamic nucleus), стриатума у животных [75, 76] и у пациентов с болезнью Паркинсона [77–80].
Корковые источники регулярной β-активности, регистрируемой в лобных и центральных отведениях на ЭЭГ и МЭГ человека, обнаружены в зонах неокортекса, входящих в базально-таламо-корковые сети: в моторной коре [73], соматосенсорной и нижнелобной областях [81]. Нейронные механизмы генерации регулярного коркового β-ритма связывают либо с прямыми ритмическими влияниями базальных структур на кору через ядра вентралатерального таламуса [82], либо с модуляцией активности дистальных дендритов пирамидных нейронов коры со стороны таламических ядер, входящих в базально-таламо-корковые сети [81].
Необходимо отметить, что регулярная ритмическая β-активность с частотой 20–25 Гц, генерируемая в нейронных сетях, связывающих лобно-базальные структуры, таламус и неокортекс, не может рассматриваться как исключительно “патологический” феномен. В исследованиях фокальных потенциалов STN у пациентов во время нейрохирургической операции [83], а также в исследованиях “роландического” β-ритма здоровых испытуемых, источники которого расположены в моторной коре [73], показано, что императивный сигнал, разрешающий действие (Go signal) при выполнении простой сенсомоторной реакции с предупреждением, вызывает десинхронизацию ритмической β-активности, тогда как императивный сигнал, запрещающий действие (NoGo signal) после короткой десинхронизации приводит к усилению β-активности.
Есть основания полагать, что измененное состояние нейронных сетей, связывающих бледный шар, субталамическое ядро, ядра таламуса и неокортекс, и отражающееся в гиперсинхронии β-колебаний, может влиять не только на реализацию моторных функций, но и на другие компоненты поведения, в том числе внимание и эмоции, что обусловлено включенностью в эти сети нескольких морфофункциональных объединений, в том числе участвующих в обеспечении когнитивной деятельности и регуляции эмоциональных аспектов социального взаимодействия [84]. В работе [85] показана возможность распространения генерируемых в субталамическом ядре человека β-осцилляций в зоны коры, не связанные с моторными функциями. Полученные в этой работе данные позволяют предположить, что веретенообразная ритмическая бета-активность в ЭЭГ лобных и центральных отведений пациентов с нарушениями когнитивного контроля, дефицитом внимания и/или эмоциональными нарушениями, может быть результатом распространения гиперсинхронных β-осцилляций, на “немоторные” ассоциативные зоны коры.
Изменения ЭЭГ гипоталамического генеза. Появление на ЭЭГ вспышек генерализованной билатерально-синхронной отклоняющейся активности (рис. 3) представляющей собой веретено-образные колебания высокой (13–20 Гц), средней (8–13 Гц) и низкой (4–8 Гц) частоты в разных сочетаниях, включающей иногда и острые компоненты в виде монофазных и/или двухфазных пиков, интерпретировалось нами как свидетельство неоптимального состояния диэнцефальных (преимущественно гипоталамических) структур. Такая трактовка генерализованных билатерально-синхронных паттернов является достаточно распространенной в ЭЭГ-диагностике функционального состояния мозга и подтверждается исследованиями пациентов с дисфункцией [86] или патологией [62] гипоталамических структур.
МЕТОДИКА
В исследовании принимали участие подростки 13–16 лет с признаками девиантного поведения (n = 82, 61 юноша, средний возраст 14.20 ± 1.3 лет, 21 девушка, средний возраст 14.20 ± 1.28 лет) – группа Д – и подростки того же возраста без признаков девиантного поведения (n = 125, 69 юношей, средний возраст 14.5 ± 1.0 лет, 56 девушек, средний возраст 14.25 ± 1.0 лет) – контрольная группа К. Все они обучались в общеобразовательных средних учебных заведениях г. Москвы и г. Жуковского и не имели в анамнезе психических и/или неврологических заболеваний. Формирование групп подростков осуществляли на основании жалоб на отклонения в поведении со стороны родителей и педагогов, о которых сообщали школьные психологи: отказ посещать школу, вызывающее или агрессивное поведение, несоблюдение норм поведения, необдуманные поступки, которые могут нанести вред самим подросткам или окружающим и пр.
Оценка индивидуальных особенностей склонностей к девиантному поведению. Анкетирование. Для оценки индивидуальных особенностей отклоняющегося поведения использовали 2 опросника в вариантах, которые заполняли сами участники исследования: методику “Диагностика склонности к отклоняющемуся поведению (СОП)” [87] и методику диагностики эмоциональных и поведенческих проблем у детей и подростков Т. Ахенбаха – Youth Self Report (YSR), адаптированную для русскоязычной популяции [88]. Опросник СОП позволяет оценить склонность к отклонению поведения по 7 шкалам: 1) установка на социально-желательные ответы (вспомогательная шкала), 2) склонность к преодолению норм и правил, 3) склонность к аддиктивному поведению, 4) склонность к самоповреждающему и саморазрушающему поведению, 5) склонность к агрессии и насилию, 6) слабость волевого контроля эмоциональных реакций, 7) склонность к делинквентному поведению. Опросник Т. Ахенбаха [88] применяется для оценки тяжести эмоционально-поведенческих проблем у подростков и включает 8 шкал, содержащих утверждения, описывающие способы реагирования, типичные для подростка. На основе анализа выделяются “синдромы” сочетанных проблем: замкнутость, психосоматические проблемы, тревожность/депрессия, социальная дезадаптация, трудности мышления, трудности внимания, делинквентность, агрессивность.
Оценка индивидуальных особенностей эффективности произвольной регуляции деятельности. Оценку индивидуальных особенностей эффективности УФ осуществляли на основе качественного анализа результатов выполнения подростками нейропсихологических проб, основанных на методологии А.Р. Лурия [89], модифицированных и адаптированных для целей данного исследования. Для перекодирования результатов качественного нейропсихологического обследования в количественные показатели, которые затем использовали для статистического сравнения групп, применяли следующий подход: выполнение каждой нейропсихологической пробы оценивали либо по количеству ошибочных ответов или реакций определенного типа, либо по выраженности трудностей выполнения, которую в свою очередь оценивал нейропсихолог в баллах (по шкале от 0 до 3-х баллов). Оба типа оценок затем сравнивали со средним диапазоном значений, характерным для данной пробы и данного возраста. При попадании индивидуальных значений в этот диапазон или более низких показателях данному индивидуальному показателю присваивали оценку 0 (нет трудностей), при превышении “стандартного” диапазона – оценку 1 (наличие трудностей).
Каждый подросток участвовал в индивидуальном нейропсихологическом обследовании из 10 проб: реакция выбора, копирование фигуры Тэйлора, динамический праксис, графическая проба, составление рассказа по серии сюжетных картинок и по готовой сюжетной картинке (из рисунков Х. Бидструпа), запоминание невербализуемых фигур (6 фигур), пересказ басни (“Голова и хвост змеи”), запоминание ряда слов (10 слов), опознание эмоционального состояния по фотографиям лиц. Также оценивали (по шкале от 0 до 3-х) особенности поведения во время тестирования, в частности, утомляемость, импульсивность, тревожность, демонстративность, неусидчивость во время тестирования. По результатам выполнения нейропсихологических проб по схеме, предложенной О.А. Семеновой [53], оценивали выраженность дефицита семи компонентов УФ: усвоения новых алгоритмов деятельности (I), создания стратегии деятельности (II), преодоления непосредственных реакций (III), своевременного прекращения начавшегося действия и переключения с одного действия на другое (IV), переключения с одного способа действий на другой, с программы на программу (V), устойчивого поддержания усвоенной программы (VI), контроля за выполнением собственных действий (VII). На основании этих оценок дополнительно определяли три интегральных показателя: дефицит функций программирования (VIII: включает I и II), избирательной регуляции (IX: включает III, IV, V и VI) и контроля (VII), а также общий показатель дефицита произвольной регуляции (X: среднее коэффициентов для компонентов I–VII). Определяли состояние эмоционально-мотивационной сферы по поведению в ходе обследования (XI), а также по результатам выполнения заданий, связанных с пониманием социально-значимой информации (XII) и интегральному коэффициенту неоптимального состояния эмоционально-мотивационной сферы (XIII).
В связи с тем, что в нейропсихологические показатели, характеризующие отдельные компоненты УФ и показатели состояния эмоционально-мотивационные сферы, входили оценки различного количества проб, они вычислялись как средние баллы оценок по всем входящим в них тестам. Таким образом, значения нейропсихологических показателей отдельных компонентов УФ и эмоционально-мотивационной сферы, а также значения интегральных нейропсихологических показателей варьировали от 0 до 1.
Запись и анализ ЭЭГ. ЭЭГ регистрировали в состоянии спокойного бодрствования с закрытыми глазами с помощью компьютерного электроэнцефалографа (Electrical Geodesics, Inc, США) в полосе частот 0.1–70 Гц (частота оцифровки – 250 Гц) от 129 электродов, расположенных на шлеме HydroCel GSN (HCGSN), один из которых (вертексный электрод) использовали в качестве референтного при записи ЭЭГ.
В данной работе для визуального анализа кривых ЭЭГ использовали монополярный (с ипсилатеральными ушными референтными электродами) и биполярный (с большим и малым расстоянием между сенсорами) виртуальные монтажи, которые включали ограниченное количество отведений над левым и правым полушариями, локализация которых соответствовала международной системе 10–20%: затылочные (О1, 2), теменные (P1, 2), центральные (С3, 4), лобные (F3, 4), нижнелобные (F7, 8), передневисочные (T3, 4) и задневисочные (T5, 6).
Описание и оценку индивидуальных особенностей функционирования коры и глубинных структур мозга в состоянии покоя проводили с помощью схемы структурного анализа ЭЭГ. У каждого участника исследования в бинарной системе оценивали наличие/отсутствие ЭЭГ-паттернов, описанных выше (рис. 1–3). Критерием наличия определенных паттернов служило их появление в течение 10–15-минутной записи не менее 3-х раз.
Для оценки статистической значимости различий анализируемых параметров использовали непараметрические критерии: χ2, Н-тест Крускала–Уоллиса для нескольких независимых выборок и критерий Манна–Уитни для двух независимых выборок.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Для сравнительного анализа индивидуальных особенностей различных проявлений склонности к отклонениям поведения в группах К и Д был проведен межгрупповой статистический анализ значений шкал опросников СОП и YSR c помощью непараметрического критерия Манна-Уитни для двух независимых выборок. В табл. 1 и 2 представлена первичная описательная статистика переменных (медиана и межквартильный размах) и результаты межгрупповых сравнений для шкал СОП и YSR. Выбор медианы и межквартильного размаха в качестве характеристик описательной статистики для шкал опросников связан с существенными различиями в вариативности индивидуальных значений переменных в сравниваемых группах. Данные, представленные в табл. 1 указывают на значимые (с учетом поправки Бонферрони на множественные сравнения в качестве значимых рассматривались различия с p < 0.05/7 = 0.007) межгрупповые различия практически по всем шкалам опросника СОП (кроме вспомогательной шкалы “установка на социально желательные ответы”). При этом более высокие значения шкал наблюдаются для группы подростков с признаками девиантного поведения.
Таблица 1.
Описательная статистика и результаты непараметрической оценки межгрупповых различий шкал опросника СОП в группах К и Д
| Группы | К (n = 110) | Д (n = 94) | Стат. различия | ||
|---|---|---|---|---|---|
| шкалы СОП | М | Q3–Q1 | М | Q3–Q1 | U (1), p |
| Установка на социально-желательные ответы | 4 | 4 | 5 | 5 | 4591.00, p = 0.939 |
| Склонность к преодолению норм и правил | 5 | 3 | 7 | 4 | 2975.00, p < 0.001 |
| Склонность к самоповреждающему и саморазрушающему поведению | 6 | 5 | 8 | 5 | 3097.50, p < 0.001 |
| Склонность к агрессии и насилию | 6 | 4 | 9 | 7 | 2731.50, p < 0.001 |
| Слабость волевого контроля эмоциональных реакций | 6 | 4 | 7 | 4 | 3432.50, p < 0.001 |
| Cклонность к делинквентному поведению | 5 | 3 | 7 | 5 | 3033.50, p < 0.001 |
| Склонность к аддиктивному поведения | 3 | 3 | 4 | 5 | 2995.00, p < 0.001 |
Таблица 2.
Описательная статистика и результаты непараметрической оценки межгрупповых различий шкал опросника YSR в группах К и Д
| Группы, выделенные на основе жалоб родителей и педагогов | К (n = 110) | Д (n = 94) | Стат. различия | ||
|---|---|---|---|---|---|
| Шкалы YSR | М | Q3–Q1 | М | Q3–Q1 | U (1), p |
| Замкнутость | 4 | 4 | 4 | 4 | 4416.00, p = 0.597 |
| Тревожность | 7 | 7 | 9 | 10 | 3643.00, p = 0.012 |
| Социальная дезадатация | 2 | 3 | 3 | 6 | 3773.50, p = 0.027 |
| Проблемы мышления | 2 | 3 | 3 | 4 | 3739.50, p = 0.022 |
| Проблемы внимания и гиперактивность | 6 | 4 | 7 | 7 | 3544.00, p = 0.005 |
| Делинквентность | 3 | 4 | 5 | 9 | 2980.50, p < 0.005 |
| Агрессия | 9 | 8 | 13 | 13 | 3097.00, p < 0.005 |
По результатам опросника YSR для шкал, совпадающих со шкалами опросника СОП (склонность к делинквентности и склонность к агрессии) получены аналогичные результаты (табл. 2). Также высоко значимыми оказались различия по шкале “Проблемы внимания и гиперактивность”. Для других шкал этого опросника (кроме шкалы “Замкнутость”) межгрупповые различия были значимы без учета поправки на множественные сравнения (p < 0.05).
ЭЭГ-оценка индивидуальных особенностей состояния регуляторных систем мозга. У каждого подростка определялось наличие/отсутствие определенных ЭЭГ-паттернов (рис. 1–3), характеризующих неоптимальное состояние отдельных глубинных структур мозга или отдельных областей больших полушарий. Для сравнения функционального состояния мозга в группах подростков в каждой из них подсчитывалось количество случаев с наличием определенного паттерна ЭЭГ и затем проводился статистический межгрупповой анализ с помощью непараметрического критерия χ2.
В связи с тем, что количество подростков разного пола было не одинаковым в контрольной и экспериментальной группах для определения возможного влияния фактора пола на результаты группового статистического анализа частоты представленности различных ЭЭГ-паттернов было проведено предварительное сравнение юношей и девушек в контрольной группе. Результаты этого сравнения показали, что фактор пола не оказывает влияния на частоту представленности ни одного из анализируемых ЭЭГ-паттернов. Для всех сравнений 0.163 < χ2 < 1.555, 0.212 < p < 0.678.
Рис. 4 демонстрирует частоту представленности паттернов фронто-таламического (I), гипоталамического (II), лимбического (III) и лобно-базального (IV) происхождения, а также частоту представленности локальных изменений ЭЭГ в левом (V) и правом (VI) полушариях в двух группах подростков.
Рис. 4.
Частота представленности различных ЭЭГ-паттернов, отражающих неоптимальное состояние глубинных РС мозга (I – фронто-таламических, II – гипоталамических, III – лимбических, IV – лобно-базальных), и локальных изменений ЭЭГ в левом (V) и правом (VI) больших полушарий у подростков группы К (а, n = 126) и Д (б, n = 81). ** – p < 0.001, * – p = 0.081.
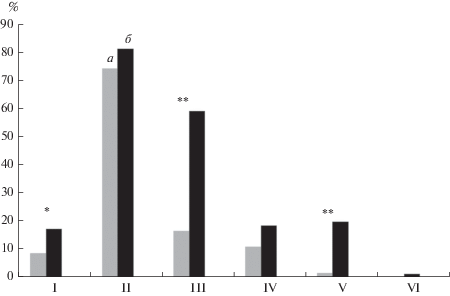
Межгрупповые сравнения с помощью критерия χ2 выявили в группе Д более высокую частоту представленности паттернов фронто-таламического (на уровне тенденции, χ2 = 3.397, p = 0.081) и лимбического (высоко значимые различия, χ2 = = 40.250, p < 0.001) происхождения, а также значимо более высокую частоту представленности локальных отклонений электрической активности (ЭА) в левом полушарии (χ2 = 20.493, p < < 0.001). Во всех случаях изменения ЭА в левом полушарии наблюдались в лобных отведениях (F3) в сочетании с изменениями в средневисочных (T3) и/или центральных (C3) отведениях. Частота представленности паттернов лобно-базального происхождения также оказалась выше в группе Д, однако различия в этом случае не достигали уровня значимости. Следует отметить, что в обеих группах у подавляющего числа подростков на ЭЭГ наблюдались изменения гипоталамического происхождения, и, напротив, практически отсутствовали локальные изменения ЭА в правом полушарии.
Склонность к девиантному поведению у подростков с ЭЭГ-признаками неоптимального состояния различных звеньев регуляторных систем мозга. Для выявления возможной связи между состоянием различных звеньев РС и особенностями поведения и произвольной регуляции когнитивной деятельности в объединенной группе подростков по критерию наличия в их ЭЭГ определенных отклоняющихся паттернов были выделены 6 отдельных групп. В контрольную группу 1 (n = 66) вошли подростки без отклоняющихся паттернов и с непароксизмальными ЭЭГ-паттернами гипоталамического происхождения, поскольку последние встречались как в группе К, так и в группе Д в подавляющем количестве случаев (рис. 4). В группу 2 (n = 20) вошли подростки с выраженными пароксизмальными изменениями гипоталамического происхождения. В остальные группы вошли подростки, у которых помимо непароксизмальных паттернов гипоталамического генеза был выявлен еще только один из паттернов глубинного происхождения. В группу 3 (n = 21) вошли подростки с фронто-таламическими знаками, в группу 4 (n = 51) – с паттернами лимбического происхождения, в группу 5 (n = 17) – с паттернами лобно-базального происхождения и в группу 6 c локальными изменениями ЭЭГ во фронтальных латеральных отделах левого полушария. Подростки, на ЭЭГ которых были обнаружены несколько паттернов различного происхождения, кроме гипоталамических, не вошли ни в одну группу.
В группах подростков, выделенных на основе анализа ЭЭГ для выявления индивидуальных особенностей девиантных характеристик поведения, обусловленных неоптимальным состоянием различных звеньев РС мозга, был проведен сравнительный анализ шкал опросников СОП и YRS. Наполнение групп при сравнении шкал указано в табл. 3 и 4.
Таблица 3.
Описательная статистика и результаты непараметрической оценки межгрупповых различий шкал опросника СОП в группах подростков с ЭЭГ-признаками неоптимального состояния различных звеньев РС мозга
| Группы, выделенные на основании ЭЭГ | 1 (n = 50) | 2 (n = 18) | 3 (n = 19) | 4 (n = 49) | 5 (n = 18) | 6 (n = 16) | Стат. различия | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| шкалы СОП | М | Q3–Q1 | М | Q3–Q1 | М | Q3–Q1 | М | Q3–Q1 | М | Q3–Q1 | М | Q3–Q1 | χ2 (5), p |
| Установка на социально- желательные ответы | 5 | 5 | 5.5 | 4 | 4 | 5 | 4 | 3 | 4.5 | 4 | 3.5 | 4 | 2.040, p = 0.844 |
| Склонность к преодолению норм и правил | 5 | 4 | 5.5 | 4 | 7 | 5 | 6 | 3 | 6 | 4 | 6 | 5 | 14.584, p = 0.012 |
| Склонность к самоповреждающему и саморазрушающему поведению | 6 | 5 | 5.5 | 6 | 8 | 4 | 6 | 4 | 9 | 5 | 10 | 7 | 13.262, p = 0.021 |
| Склонность к агрессии и насилию | 6 | 4 | 7 | 8 | 9 | 8 | 8 | 6 | 6.5 | 8 | 10 | 10 | 10.410, p = 0.050 |
| Слабость волевого контроля эмоциональных реакций | 6 | 4 | 6 | 3 | 6 | 4 | 7 | 4 | 6 | 4 | 6.5 | 6 | 2.059, p = 0.841 |
| Cклонность к делинквентному поведению | 5 | 3 | 5 | 4 | 7 | 7 | 6 | 3 | 5 | 4 | 6 | 6 | 11.702, p = 0.039 |
| Склонность к аддиктивному поведению | 3 | 3 | 3 | 5 | 5 | 7 | 3 | 4 | 4 | 6 | 5.5 | 7 | 12.262, p = 0.027 |
Примечание: группа 1 (контрольная) – подростки, на ЭЭГ которых не было выявлено отклоняющихся паттернов или присутствовали только паттерны непароксизмального характера гипоталамического и/или стволового происхождения, группа 2 – с паттернами гипоталамического происхождения пароксизмального характера, группа 3 – с паттернами фронто-таламического происхождения, группа 4 – с паттернами лимбического происхождения, в группа 5 – с паттернами лобно-базального происхождения, группа 6 – c локальными изменениями ЭА во фронтальных латеральных отделах левого полушария.
Таблица 4.
Описательная статистика и результаты непараметрической оценки межгрупповых различий шкал опросника YSR в группах подростков с ЭЭГ-признаками неоптимального состояния различных звеньев РС мозга
| Группы, выделенные на основании ЭЭГ |
1 (n = 50) | 2 (n = 18) | 3 (n = 19) | 4 (n = 49) | 5 (n = 18) | 6 (n = 16) | Стат. различия | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| шкалы YSR | М | Q3–Q1 | М | Q3–Q1 | М | Q3–Q1 | М | Q3–Q1 | М | Q3–Q1 | М | Q3–Q1 | χ2 (5), p |
| Замкнутость | 3 | 5 | 5 | 3 | 4 | 5 | 3 | 4 | 4 | 5 | 4 | 5 | 1.383, p = 0.926 |
| Тревожность | 8 | 9 | 9 | 7 | 8 | 5 | 7 | 9 | 9 | 6 | 9 | 9 | 4.868, p = 0.432 |
| Социальная дезадатация | 2 | 3 | 4.5 | 7 | 3 | 4 | 2 | 3 | 3 | 3 | 3 | 6 | 8.267, p = 0.142 |
| Проблемы мышления | 2 | 4 | 3 | 4 | 2 | 3 | 2 | 4 | 3 | 2 | 3.5 | 5 | 3.407, p = 0.638 |
| Проблемы внимания и гиперактивность | 6 | 5 | 8 | 6 | 7 | 6 | 7 | 4 | 6.5 | 6 | 5.5 | 6 | 6.795, p = 0.235 |
| Делинквентность | 3 | 4 | 3 | 5 | 7 | 9 | 3 | 3 | 4.5 | 7 | 6.5 | 10 | 13.764, p = 0.017 |
| Агрессия | 9 | 10 | 9 | 9 | 10 | 16 | 9 | 6 | 10.5 | 9 | 13 | 11 | 6.263, p = 0.281 |
Примечание: обозначения групп см. табл. 3.
Несовпадение количества подростков в некоторых группах с указанным выше в тексте обусловлено тем, что не все подростки, прошедшие ЭЭГ-обследование участвовали в анкетировании. Использовался непараметрический Н-тест Крускала–Уоллиса для нескольких независимых выборок. Последующие парные сравнения были проведены с помощью критерия Манна–Уитни. Результаты этого анализа представлены в табл. 3 и 4.
Значимые межгрупповые различия по шкалам опросника СОП без учета поправки на множественные сравнения обнаружены для большинства шкал, исключения составляют 2 шкалы, одна из которых вспомогательная. Парные сравнения контрольной группы с остальными группами выявили некоторые особенности девиантных характеристик поведения в группах, отличающихся от контрольной наличием специфических ЭЭГ-паттернов. Так, в группе 3 с изменениями ЭЭГ фронто-таламического генеза выявлены значимые превышения шкал “склонность к преодолению норма и правил” (p = 0.005), “склонность к аддиктивному поведению” (p = 0.004), “склонность к агрессии и насилию” (p = 0. 028). Это была единственная группа, которая продемонстрировала значимо более высокие баллы по шкале “Склонность к делинквентному поведению” (p = 0.005). В группе 4 с изменения ЭЭГ лимбического генеза выявлены значимые превышения шкал “Склонность к преодолению норм и правил” (p = 0.012) и “Склонность к агрессии и насилию” (p = 0.016). В группе 5 с изменениями ЭЭГ лобно-базального генеза обнаружено значимое отличие от группы 1 только по одной шкале “Склонность к самоповреждающему и саморазрушающему поведению” (p = 0.033). В группе 6 с локальными изменениями ЭЭГ в лобных зонах левого полушария, также как для групп 3 и 4 выявлены более высокие, чем в группе 1, различия по шкалам “Склонность к преодолению норм и правил” (p = = 0.007) и “Склонность к агрессии и насилию” (p = 0.013). Кроме этого, для подростков с изменениями ЭЭГ в лобных отделах левого полушария характерно превышение по шкале “Склонность к аддиктивному поведению” (p = 0.014) и по шкале “Склонность к самоповреждающему и саморазрушающему поведению” (p = 0.015). В группе 2 с выраженными изменениями ЭЭГ диэнцефального (гипоталамического) происхождения значимых различий по шкалам опросника СОП по сравнению с группой 1 обнаружено не было.
Согласно данным, представленным в табл. 4, значимые различия при сравнении всех 6 групп, сформированных на основании анализа паттернов ЭЭГ, были обнаружены только для одной шкалы “склонность к делинквентности” опросника YSR. Парные сравнения контрольной группы 1 с остальными группами выявили значимо более высокие значения шкалы делинквентности в группе 3 (p = 0.005), в группе 6 (p = 0.020) и сходные различия на уровне тенденции в группе 5 (p = 0.057). В группе 6, кроме этого, на уровне тенденции отмечены более высокие, чем в группе 1, баллы по шкале агрессивности (p = 0.054).
Эффективность произвольной регуляции деятельности у подростков с ЭЭГ-признаками неоптимального состояния различных звеньев регуляторных систем мозга. Эффективность произвольной регуляции деятельности оценивалась с помощью экспертного качественного анализа выполнения нейропсихологических тестов по 13 показателям, описанным в методическом разделе. Результаты статистического сравнения нейропсихологических показателей в группах, выделенных на основании анализа ЭЭГ, представлены в табл. 5, где также указано наполнение ЭЭГ- групп, а римские цифры соответствуют нейропсихологическим показателям: I – трудности освоения новой программы, II – трудности формирования стратегии, III – импульсивность, IV – наличие персевераций, V – инертность, VI – трудности удержания программы VII – трудности контроля собственных действий, VIII – интегральный показатель трудностей программирования, IX – интегральный показатель трудностей избирательной регуляции, X – общий интегральный коэффициент дефицита управляющий функций, XI – отклонения в состоянии эмоционально-мотивационной сферы, XII – трудности понимания социально-значимой информации (XII) и общий коэффициент неоптимального состояния эмоционально-мотивационной сферы (XIII).
Таблица 5.
Описательная статистика и результаты непараметрической оценки межгрупповых различий нейропсихологических показателей эффективности УФ мозга в группах подростков с ЭЭГ-признаками неоптимального состояния различных звеньев РС
| ЭЭГ-группы | 1 (n = 58) | 2 (n = 20) | 3 (n = 20) | 4 (n = 47) | 5 (n = 19) | 6 (n = 14) | Стат. различия | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| нейропс. показатели | М | Q3–Q1 | М | Q3–Q1 | М | Q3–Q1 | М | Q3–Q1 | М | Q3–Q1 | М | Q3–Q1 | χ2 (5), p |
| I | 0.20 | 0.25 | 0.40 | 0.40 | 0.20 | 0.20 | 0.20 | 0.40 | 0.20 | 0.40 | 0.40 | 0.20 | 15.532, p = 0.008 |
| II | 0.50 | 0.50 | 0.00 | 0.50 | 0.50 | 0.88 | 0.50 | 0.50 | 0.00 | 0.50 | 0.50 | 0.63 | 2.439, p = 0.788 |
| III | 0.00 | 0.25 | 0.25 | 0.44 | 0.25 | 0.44 | 0.00 | 0.00 | 0.25 | 0.25 | 0.125 | 0.31 | 13.439, p = 0.020 |
| IV | 0.33 | 0.33 | 0.67 | 0.33 | 0.67 | 0.33 | 0.33 | 0.33 | 0.33 | 0.00 | 0.50 | 0.33 | 18.817, p = 0.002 |
| V | 0.25 | 0.25 | 0.50 | 0.50 | 0.50 | 0.44 | 0.50 | 0.75 | 0.25 | 0.25 | 0.50 | 0.50 | 11.007, p = 0.051 |
| VI | 0.40 | 0.40 | 0.60 | 0.40 | 0.80 | 0.40 | 0.60 | 0.40 | 0.40 | 0.80 | 0.60 | 0.40 | 22.974, p < 0.001 |
| VII | 0.25 | 0.25 | 0.62 | 0.50 | 0.50 | 0.50 | 0.50 | 0.25 | 0.50 | 0.50 | 0.50 | 0.05 | 19.829, p = 0.001 |
| VIII | 0.25 | 0.28 | 0.30 | 0.53 | 0.35 | 0.49 | 0.25 | 0.35 | 0.25 | 0.20 | 0.32 | 0.36 | 5.647, p = 0.342 |
| IX | 0.25 | 0.19 | 0.43 | 0.21 | 0.48 | 0.21 | 0.32 | 0.28 | 0.31 | 0.33 | 0.46 | 0.17 | 24.486, p < 0.001 |
| X | 0.31 | 0.23 | 0.45 | 0.28 | 0.42 | 0.28 | 0.33 | 0.21 | 0.35 | 0.24 | 0.43 | 0.19 | 21.584, p < 0.001 |
| XI | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 | 0.29 | 0.00 | 0.17 | 0.00 | 0.00 | 0.00 | 0.21 | 5.126, p = 0.401 |
| XII | 0.10 | 0.20 | 0.00 | 0.20 | 0.20 | 0.40 | 0.20 | 0.40 | 0.20 | 0.40 | 0.20 | 0.25 | 8.020, p = 0.155 |
| XIII | 0.10 | 0.12 | 0.04 | 0.16 | 0.18 | 0.16 | 0.10 | 0.20 | 0.10 | 0.20 | 0.10 | 0.15 | 11.580, p = 0.041 |
Примечание: обозначения групп см. табл. 3. Описание нейропсихологических показателей см. раздел “МЕТОДИКА”.
Согласно данным, представленным в табл. 5, высоко значимые (с учетом поправки на множественные сравнения, p < 0.004) различия при сравнении всех 6 групп, сформированных на основании анализа паттернов ЭЭГ, были обнаружены для нейропсихологических показателей выраженности персевераций, трудностей удержания программы, трудностей контроля собственных действий, для интегрального показателя дефицита избирательной произвольной регуляции деятельности и общего коэффициента дефицита управляющих функций. Значимые различия без поправки на множественные сравнения (p < 0.05) выявлены для показателей трудностей усвоения новой программы, импульсивности и общего коэффициента неоптимального состояния эмоционально-мотивационной сферы.
Парные сравнения по критерию Манна–Уитни позволили обнаружить различия нейропсихологических показателей произвольной регуляции деятельности у подростков контрольной группы и подростков других ЭЭГ-групп. В группе 2 значимо более выраженными (с поправкой на множественные сравнения) оказались трудности усвоения новой программы, трудности устойчивого удержания программы, интегральный показатель трудностей избирательной регуляции деятельности и общий коэффициент дефицита управляющих функций. Для всех этих различий 0.001 ≤ p ≤ 0.003. В группе 3 были выявлены высоко значимые различия по выраженности персевераций, трудностям устойчивого удержания программы, интегральному показателю трудностей избирательной регуляции деятельности и общему коэффициенту дефицита управляющих функций. Для всех этих парных сравнений 0.0004 ≤ p ≤ 0.001. В группе 4 значимо больше (с поправкой на множественные сравнения), чем в контрольной группе оказались выражены трудности устойчивого удержания программы (p = 0.003), а также (без поправки на множественные сравнения) трудности контроля собственных действий (p = 0.011) и общий коэффициент неоптимального состояния эмоционально-мотивационной сферы (p = 0.045). Группа 5 значимо отличалась от контрольной группы только выраженностью трудностей контроля собственных действий (p = 0.004). Группа 6 демонстрировала в целом наиболее выраженные трудности произвольной регуляции деятельности. Высоко значимые различия по сравнению с контрольной группой были выявлены для нейропсихологических показателей трудностей устойчивого удержания программы (p = 0.001), интегральному показателю трудностей избирательной регуляции деятельности (p < 0.001) и общему коэффициенту дефицита управляющих функций (p = 0.001). Кроме этого, в группе 6 были больше выражены трудности усвоения новых программ (p = 0.012), персеверации (p = 0.015) и особенности эмоционально-мотивационных аспектов поведения при прохождении нейропсихологического обследования (p = 0.041).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
На первом этапе междисциплинарного исследования была проведена количественная оценка индивидуальной склонности к различным формам девиантного поведения с помощью стандартизированных опросников. В целом, результаты анкетирования указывают на правомерность использованного критерия отнесения подростков к “девиантной” и “контрольной” группам, а также дают дополнительную информацию по сравнению с жалобами родителей и педагогов: подростки “девиантной” группы больше, чем подростки контрольной группы склонны к игнорированию социальных норм, аддиктивному поведению, негативным эмоциональным проявлениям в виде агрессии и самоповреждающего поведения. Эти личностные особенности, по-видимому, лежат в основе более выраженной склонности к делинквентному (противоправному) поведению.
Сравнение ЭЭГ “девиантной” и “контрольной” групп подтвердило исходное предположение нашего исследования о том, что важным нейрофизиологическим фактором отклонений поведения у подростков является неоптимальное состояние мозговых регуляторных систем. Действительно ЭЭГ подростков с признаками девиантного поведения отличалась от ЭЭГ контрольной группы, прежде всего увеличением частоты представленности паттернов, отражающих неоптимальное состояние лимбических структур мозга и фронтальных отделов левого полушария, а также большей частотой представленности паттернов фронто-таламического и, в меньшей степени, лобно-базального происхождения. Во всех случаях речь идет о структурах мозга, входящих в состав регуляторных систем, обеспечивающих контроль поведения – управляющих системах мозга [35]. Необходимо отметить, что выявленные в “девиантной” группе отклонения ЭЭГ различного генеза при индивидуальном обследовании могут встречаться как изолировано, так и в различных сочетаниях, что указывает на гетерогенность мозговых механизмов девиантного поведения. Результаты настоящего исследования позволяют более подробно проанализировать возможные связи между неоптимальным состоянием отдельных звеньев РС, особенностями произвольной регуляции деятельности и отклонениями поведения.
Чаще всего на ЭЭГ подростков с признаками девиантного поведения можно было видеть изменения, отражающие неоптимальное состояние лимбических структур. При анкетировании подростки с такими ЭЭГ-паттернами демонстрировали выраженные склонности к несоблюдению социальных норм и агрессии. Эти наблюдения согласуются с результатами фМРТ-исследований подростков [90] и молодых взрослых [91], в которых показано, что асоциальность и агрессия коррелируют со сниженной реактивностью амигдалы на изображения страха или боли других людей. Гипофункция амигдалы по мнению авторов этих работ является причиной сниженной эмпатии и приводит к нарушению контроля социального поведения. Нейрофизиологические данные о генезе ЭЭГ-паттернов лимбического происхождения, позволяют связать их с неоптимальным состоянием механизмов восприятия и анализа негативной информации. Одной из причин отклонений поведения у подростков с такими изменениями ЭЭГ может быть трудность оценки последствий совершаемых действий для себя и других людей. По данным нейропсихологического тестирования в группе подростков с изменениями ЭЭГ лимбического генеза трудности выявления и коррекции собственных ошибок выражены больше, чем в контрольной группе. Помимо оценки субъективной значимости событий, важной функцией лимбических структур является длительное произвольное поддержание активного состояния [92]. В связи с этим, еще одним фактором, оказывающим негативное влияние на поведение при неоптимальном состоянии лимбических структур, может быть дефицит мотивационной регуляции, необходимой при поддержании длительных усилий для достижения цели. В пользу этого предположения свидетельствуют трудности устойчивого удержания программы действий, а также снижение мотивации к выполнению заданий, выявленные в группе с изменениями ЭЭГ лимбического происхождения.
Локальные изменения в лобных отделах левого полушария – еще одна особенность ЭЭГ, которая встречалась в “девиантной” группе значимо чаще, чем в контрольной. Учитывая роль амигдалы в генезе негативных эмоциональных реакций, склонность к агрессии и насилию, а также к самоповреждающему и саморазрушающему поведению, выявленная при анкетировании у подростков с “лимбическими” паттернами, может быть обусловлена сниженным нисходящим контролем амигдалы со стороны префронтальной коры левого полушария. В работах [93, 94] показано, что в ситуациях, когда испытуемые должны по инструкции стараться “погасить” свои эмоциональные реакции на негативно окрашенные зрительные сцены, у них повышается уровень активации префронтальной коры именно левого полушария и снижается активность амигдалы. Согласно результатам нейропсихологического тестирования подростки c локальными изменениями ЭЭГ во фронтальных отделах левого полушария отличались от подростков контрольной группы склонностью к персеверациям, наличием трудностей избирательной регуляции деятельности, усвоения новых программ и устойчивого удержания выработанных программ. Сочетание специфичного для левополушарной дисфункции снижения контроля негативных эмоций с общим для неоптимального состояния префронтальной коры дефицитом УФ вероятно приводит к значимому превышению показателей большинства шкал опросника СОП по сравнению с контрольной группой.
В ходе нейропсихологического обследования выраженный дефицит УФ – наличие персевераций, трудности устойчивого удержания выработанной программы, снижение эффективности избирательной регуляции деятельности – был обнаружен также в подгруппе подростков с изменениями ЭЭГ фронто-таламического происхождения. Такой результат нейропсихологического обследования был ожидаемым, поскольку и литературные данные и наши предыдущие исследования детей и подростков [35, 52, 53, 57] свидетельствуют в пользу участия фронто-таламической системы, включающей обширные области префронтальной коры и медиодорзальные структуры таламуса, в обеспечении различных компонентов УФ. Что касается результатов анкетирования, характеризующих особенности склонностей к девиантному поведению, то для подростков с ЭЭГ-паттернами фронто-таламического генеза они в основном совпадали с результатами, полученными для подростков с локальными отклонениями ЭЭГ фронтальных отделов левого полушария. Исключение составили результаты по шкале “Склонность к самоповреждающему и саморазрушающему поведению” опросника СОП, различия по которой по сравнению с контрольной группой были выявлены, только у подростков с “левополушарными” ЭЭГ-паттернами. Значительное сходство результатов нейропсихологического обследования и анкетирования в двух рассмотренных выше подгруппах подростков может быть связана с общим для них неоптимальным состоянием латеральных префронтальных зон коры.
Наименее выраженный дефицит УФ в нашем исследовании проявили подростки, на ЭЭГ которых были обнаружены изолированные (без сочетания с другими отклонениями ЭЭГ) признаки неоптимального состояния лобно-базальных структур: в ходе нейропсихологического тестирования они демонстрировали лишь трудности контроля собственных ошибок. В то же время, эта подгруппа характеризовалась более выраженной, чем контрольная, склонностью к криминальному и самоповреждающему поведению. Склонность к асоциальному поведению может быть обусловлена влияем неоптимального состояния базальных ганглиев на функционирование орбитофронтальной коры – ключевой корковой структуры, участвующей в обеспечении контроля социального поведения [95]. Согласно результатам исследования [96], одной из причин асоциального поведения при дисфункции орбитофронтальной коры могут быть трудности оценки собственного поведения (self-monitoring) в контексте социальных норм.
Данное исследование было направлено преимущественно на анализ связи между отклонениями поведения, его произвольным контролем и состоянием глубинных структур, входящих в регуляторные системы мозга. Анализ влияния неоптимального состояния регуляторных систем мозга подростков на эмоционально-мотивационные компоненты поведения требует проведения дополнительных исследований, в том числе исследований специфики восприятия, важной для социального взаимодействия эмоционально окрашенной информации.
ЗАКЛЮЧЕНИЕ
Проведено сравнительное исследование регуляторных функций мозга у подростков с признаками девиантного поведения и подростков без признаков девиантного поведения. Исследование включало: 1) оценку индивидуальных особенностей склонностей к отклонениям поведения с помощью анкетирования самих подростков; 2) нейропсихологический анализ эффективности произвольной регуляции деятельности – управляющих функций (УФ); 3) электроэнцефалографический (ЭЭГ) анализ состояния регуляторных систем мозга (РС). Показано, что у подростков 13–16 лет склонность к девиантному поведению сопровождается неоптимальным состоянием различных звеньев РС. В исследованной выборке на ЭЭГ подростков с признаками девиантного поведения наблюдались преимущественно изменения лимбического происхождения, частота встречаемости которых была значимо выше в этой группе, чем в контрольной. Кроме этого, чаще, чем в контрольной группе отмечались ЭЭГ-признаки неоптимального состояния фронто-таламической системы, лобно-базальных структур и изменения электрической активности фронтальных зон левого полушария.
Для оценки связи между состоянием определенных звеньев РС и поведением были сформированы подгруппы, в каждую из которых вошли подростки с одним из перечисленных выше типом отклонений ЭЭГ. Общим для всех подростков с неоптимальным состоянием различных звеньев РС было сочетание склонностей к асоциальным формам поведения со снижением эффективности различных компонентов УФ. Более всего различные компоненты УФ страдали у подростков с неоптимальным состоянием фронто-таламической системы и лобных отделов левого полушария, т.е. в случаях заинтересованности конвексиальных отделов префронтальной коры. Только в этих подгруппах при нейропсихологическом обследовании были отмечены персевераторные нарушения. Снижение эффективности произвольной регуляции деятельности наблюдалось и при отклонениях функционального состояния лимбических и лобно-базальных структур, однако проявлялось оно преимущественно в трудностях самоконтроля и низкой мотивации при когнитивной деятельности.
Таким образом, полученные результаты подтвердили исходное предположение исследования о том, что важным фактором девиантного поведения подростков является неоптимальное функционирование регуляторных систем мозга. При этом было обнаружено, что сходные поведенческие проблемы могут быть связаны с неоптимальным состоянием различных глубинных и корковых звеньев этих систем. В целом эти наблюдения указывают на гетерогенную природу нейрофизиологических механизмов девиантного поведения и необходимости учета индивидуальных особенностей регуляторных функций мозга при диагностике и коррекции отклонений поведения в подростковом возрасте.
Этические нормы. Все исследования проведены в соответствии с принципами биомедицинской этики, сформулированными в Хельсинкской декларации 1964 г. и ее последующих обновлениях, и одобрены локальным биоэтическим комитетом Института возрастной физиологии РАО (Москва).
Информированное согласие. Подростки участвовали в исследовании добровольно. Родители подростков представили письменное информированное согласие на участие своих детей в исследовании, подписанное после разъяснения потенциальных рисков и преимуществ, а также характера исследования.
Финансирование работы. Работа поддержана РФФИ (грант № 17-06-00837).
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией данной статьи.
Список литературы
Физиология развития ребенка. Руководство по возрастной физиологии / Под ред. Безруких М.М., Фарбер Д.А.. М.: изд-во Московского психолого-социального института. Воронеж: Изд-во НПО “Модек”, 2010. 768 с.
Фельдштейн Д.И. Трудный подросток: некоторые психологические вопросы формирования личности детей подросткового возраста. Серия: Библиотека психолога. М.: Изд-во Московского психолого-социального института. Воронеж: Изд-во НПО “Модек”, 2008. 206 с.
Змановская Е.В. Девиантология (психология отклоняющегося поведения). М.: Издательский центр “Академия”, 2003. 288 с.
Casey B.J. Beyond simple models of self-control to circuit-based accounts of adolescent behavior // Annu. Rev. Psychol. 2015. V. 66. P. 295.
Klingberg T., Forssberg H., Westerberg H. Increased brain activity in frontal and parietal cortex underlies the development of visuospatial working memory capacity during childhood // J. Cogn. Neurosci. 2002. V. 14. № 1. P. 1.
Blakemore S.J., Choudhury S. Development of the adolescent brain: implications for executive function and social cognition // J. Child Psychol. Psychiat. 2006. V. 47. № 3–4. P. 296.
Arain M., Haque M., Johal L. et al. Maturation of the adolescent brain // Neuropsych. Dis. Treat. 2013. V. 9. P. 449.
Karns C.M., Isbell E., Giuliano R.J., Neville H.J. Auditory attention in childhood and adolescence: An event-related potential study of spatial selective attention to one of two simultaneous stories // Dev. Cogn. Neurosci. 2015. V. 13. P. 53.
Vinette S.A., Bray S. Variation in functional connectivity along anterior-to-posterior intraparietal sulcus, and relationship with age across late childhood and adolescence // Dev. Cogn. Neurosci. 2015. V. 13. P. 32.
Cauffman E., Steinberg L., Piquero A.R. Psychological, neuropsychological and physiological correlates of serious antisocial behavior in adolescence: the role of self-control // Criminology. 2005. V.43. № 1. P. 133.
Spear L.P. The adolescent brain and age-related behavioral manifestations // Neurosci. Biobehav. Rev. 2000. V. 24. № 4. P. 417.
Steinberg L. A dual systems model of adolescent risk-taking // Dev. Psychobiol. 2010. V. 52. № 3. P. 216.
Crone E., Dahl R. Understanding adolescence as a period of social-affective engagement and goal flexibility // Nat. Rev. Neurosci. 2012. V. 13. P. 636.
Crone E.A., Konijn E.A. Media use and brain development during adolescence // Nat. Commun. 2018. V. 9. № 1. P. 588.
Steinbeis N., Crone E.A. The link between cognitive control and decision-making across child and adolescent development // Curr. Opin. Behav. Sci. 2016. V. 10. P. 28.
Klapwijk E.T., van den Bos W., Güroğlu B. Neural mechanisms of criminal decision making in adolescence: The roles of executive functioning and empathy / The Oxford Handbook of Offender Decision Making. Eds: Bernasco W., Van Gelder J.-L., Elffers H. Oxford University Press, 2017. P. 246.
Blakemore S.J., Robbins T. W. Decision-making in the adolescent brain // Nat. Neurosci. 2012. V. 15. № 9. P. 1184.
Moreira F.A., Jupp B., Belin D., Dalley J.W. Endocannabinoids and striatal function: implications for addiction-related behaviours // Behav. Pharmacol. 2015. V. 26. № 1–2. P. 59.
Корнилова Т.А., Григоренко Е.Л., Смирнов С.Д. Подростки группы риска. СПб.: Питер, 2005. 336 с.
Менделевич В.Д. Психология девиантного поведения: учебное пособие для вузов СПб: Речь, 2005. 445 с.
Van Leijenhorst L., Zanolie K., Van Meel C.S. et al. What motivates the adolescent? Brain regions mediating reward sensitivity across adolescence // Cereb. Cortex. 2010. V. 20. № 1. P. 61.
Cservenka A., Herting M.M., Seghete K.L.M. et al. High and low sensation seeking adolescents show distinct patterns of brain activity during reward processing // Neuroimage. 2013. V. 66. P. 184.
Casey B.J., Jones R.M. Neurobiology of the adolescent brain and behavior: implications for substance use disorders // J. Am. Acad. Child. Adolesc. Psychiatry. 2010. V. 49. № 12. P. 1189.
Oxford handbook of developmental behavioral neuroscience. Eds. Mark S. Blumberg, John H. Freeman, Scott R. Robinson. N.Y.: Oxford University Press, 2010. 769 p.
Montague D., Weickert C.S., Tomaskovic-Crook E. et al. Oestrogen receptor alpha localisation in the prefrontal cortex of three mammalian species // J. Neuroendocrinol. 2008. V. 20. № 7. P. 893.
Sinclair D., Purves-Tyson T.D., Allen K.M., Weickert C.S. Impacts of stress and sex hormones on dopamine neurotransmission in the adolescent brain // Psychopharmacol. (Berl). 2014. V. 231. № 8. P. 1581.
Sisk C.L., Zehr J.L. Pubertal hormones organize the adolescent brain and behavior // Front Neuroendocrinol. 2005. V. 26. № 3–4. P. 163.
Raznahan A., Lee Y., Stidd R. et al. Longitudinally mapping the influence of sex and androgen signaling on the dynamics of human cortical maturation in adolescence // Proc. Natl Acad. Sci. USA. 2010. V. 107. № 39. P. 16988.
Koolschijn P.C.M.P., Peper J.S., Crone E.A. The Influence of Sex Steroids on Structural Brain Maturation in Adolescence // PLoS ONE. 2014. V. 9. № 1. e83929.
Cooke B.M., Woolley C.S. Gonadal hormone modulation of dendrites in the mammalian CNS // J. Neurobiol. 2005. V. 64. № 1. P. 34.
Vigil P., Del Río J.P., Carrera B. et al. Influence of sex steroid hormones on the adolescent brain and behavior: An update // Linacre Q. 2016. V. 83. № 3. P. 308.
Peper J.S., Hulshoff Pol H.E., Crone E.A., van Honk J. Sex steroids and brain structure in pubertal boys and girls: a mini-review of neuroimaging studies // Neuroscience. 2011. V. 191. P. 28.
Spear L.P. The behavioral neuroscience of adolescence. N.Y., US: W.W. Norton & Company, 2010. 391 p.
Denson T.F., Mehta P.H., Ho Tan D. Endogenous testosterone and cortisol jointly influence reactive aggression in women // Psychoneuroendocrinology. 2013. V. 38. № 3. P. 416.
Мачинская Р.И. Управляющие системы мозга // Журн. высш. нервн. деят. им. И.П. Павлова. 2015. Т. 65. № 1. С. 33. [Machinskaya R.I. The brain executive systems] // Zh. Vyssh. Nerv. Deiat. Im. I.P. Pavlova. 2015. V. 65. № 1. P. 33.
Цехмистренко Т.А., Васильева В.А., Обухов Д.К., Шумейко Н.С. Строение и развитие коры большого мозга. М.: Спутник, 2019. 538 с.
Tamnes C.K., Walhovd K.B., Grydeland H. et al. Longitudinal Working Memory Development Is Related to Structural Maturation of Frontal and Parietal Cortices // J. Cogn. Neurosci. 2013. V. 25. № 10. P. 1611.
Ochsner K.N., Ray R.R., Hughes B. et al. Bottom-up and top-down processes in emotion generation: common and distinct neural mechanisms // Psychol. Sci. 2009. V. 20. № 11. P. 1322.
Malhi G.S., Tanious M., Fritz K. et al. Differential engagement of the fronto-limbic network during emotion processing distinguishes bipolar and borderline personality disorder // Mol. Psychiatry. 2013. V. 18. № 2. P. 1247.
Carl H., Walsh E., Eisenlohr-Moul T. et al. Sustained anterior cingulate cortex activation during reward processing predicts response to psychotherapy in major depressive disorder // J. Affect. Disord. 2016. V. 203. P. 204.
Sundram F., Deeley Q., Sarkar S. et al. White matter microstructural abnormalities in the frontal lobe of adults with antisocial personality disorder // Cortex. 2012. V. 48. № 2. P. 216.
Bjork J.M., Knutson B., Fong G.W. et al. Incentive-elicited brain activation in adolescents: similarities and differences from young adults // J. Neurosci. 2004. V. 24. № 8. P. 1793.
Galvan A., Hare T.A., Parra C.E. et al. Earlier Development of the Accumbens Relative to Orbitofrontal Cortex Might Underlie Risk-Taking Behavior in Adolescents // J. Neurosci. 2006. V. 26. № 25. P. 6885.
Ernst M., Pine D.S., Hardin M. Triadic model of the neurobiology of motivated behavior in adolescence // Psychol. Med. 2006. V. 36. № 3. P. 299.
Van Leijenhorst L., Zanolie K., Van Meel C.S. et al. What motivates the adolescent? Brain regions mediating reward sensitivity across adolescence // Cereb. Cortex. 2010. V. 20. № 1. P. 61.
Telzer E.H. Dopaminergic reward sensitivity can promote adolescent health: A new perspective on the mechanism of ventral striatum activation // Dev. Cogn. Neurosci. 2016. V. 17. P. 57.
Harris K.M., McDade T.W. The Biosocial Approach to Human Development, Behavior, and Health Across the Life Course // RSF. 2018. V. 4. № 4. P. 2.
Galvan A., Hare T., Voss H et al. Risk-taking and the adolescent brain: who is at risk? // Dev. Sci. 2007. V. 10. № 2. P. F8.
Scherf K.S., Smyth J.M., Delgado M.R. The amygdala: an agent of change in adolescent neural networks // Horm. Behav. 2013. V. 64. № 2. P. 298.
Lukashevich I.P., Machinskaya R.I., Fishman M.N. The EEG-EXPERT Automatic Diagnostic System // Biomedical Engineering. 1999. V. 33. № 6. P. 302.
Развитие мозга и формирование познавательной деятельности ребенка / Под ред. Фарбер Д.А., Безруких М.М. М.: Изд-во МПСУ, Воронеж: МОДЭК, 2009. 432 с.
Machinskaya R.I., Semenova O.A., Absatova K.A., Sugrobova G.A. Neurophysiological factors associated with cognitive deficits in children with ADHD symptoms: EEG and neuropsychological analysis // Psychol. Neurosci. 2014. V. 7. № 4. P. 461.
Семенова О.А., Мачинская Р.И. Влияние функционального состояния регуляторных систем мозга на эффективность произвольной организации когнитивной деятельности у детей. Сообщение II. Нейропсихологический и электроэнцефалографический анализ состояния регуляторных функций мозга у детей пре // Физиология человека. 2015. Т. 41. № 5. С. 28. Semenova O.A., Machinskaya R.I. The influence of the functional state of brain regulatory systems on the efficiency of voluntary regulation of cognitive activity in children: II. Neuropsychological and EEG analysis of brain regulatory functions in 10–12-year-old children with learning difficulties // Human Physiology. 2015. V. 41. № 5. P. 478.
Лурия А.Р. Функциональная организация мозга. Естественно-научные основы психологии / Под ред. Смирнова А.А., Лурия А.Р., Небылицына В.Д. М.: Педагогика, 1978. С. 109.
Electroencephalography: Basic Principles, Clinical Applications, and Related Fields. 5th Edition / Eds. Ernst Niedermeyer, Fernando Lopes da Silva. Lippincott Williams & Wilkins, 2005. 1309 p.
Goldman-Rakic P.S., Porrino L.J. The primate mediodorsal (MD) nucleus and its projection to the frontal lobe // J. Comp. Neurol. 1985. V. 242. № 4. P. 535.
Ouhaz Z., Fleming H., Mitchell A.S. Cognitive Functions and Neurodevelopmental Disorders Involving the Prefrontal Cortex and Mediodorsal Thalamus // Front. Neurosci. 2018. V. 12. Article 33. eCollection.
Майорчик В.Е. Изменения ЭЭГ в зависимости от локализации опухоли мозга. Клиническая электроэнцефалография / Под ред. Русинова В.С. М.: Медицина, 1973. С. 106.
Лукашевич И.П., Сазонова О.Б. Влияние поражения различных отделов зрительного бугра на характер биоэлектрической активности мозга человека // Журн. высш. нерв. деят. им. И.П. Павлова. 1996. Т. 46. № 5. С. 866. Lukashevich I.P., Sazonova O.B. [Influence of the thalamic local lesions on the human brain electrical activity] // Zh. Vyssh. Nerv. Deiat. Im. I.P. Pavlova. 1996. V. 46. № 5. P. 866.
Sarnthein J., Morel A., von Stein A., Jeanmonod D. Thalamocortical theta coherence in neurological patients at rest and during a working memory task // Int. J. Psychophysiol. 2005. V. 57. № 2. P. 87.
Kim J., Woo J., Par, Y.G. et al. Thalamic T-type Ca(2)+ channels mediate frontal lobe dysfunctions caused by a hypoxia-like damage in the prefrontal cortex // J. Neurosci. 2011. V. 31. № 11. P. 4063.
Болдырева Г.Н. Нейрофизиологический анализ поражения лимбико-диэнцефальных структур мозга человека. Краснодар: Экоинвест, 2009. 232 с.
Болдырева Г.Н. Атипичные формы церебральной альфа-активности при поражении регуляторных структур мозга человека // Физиология человека. 2018. Т. 44. № 3. С. 14. Boldyreva G.N. Atypical forms of cerebral α-activity in the case of lesions in regulatory structures of the human brain // Human Physiology. 2018. V. 44. № 3. P. 246.
Connemann B.J., Mann K., Lange-Asschenfeldt C. et al. Anterior limbic alpha-like activity: a low-resolution electromagnetic tomography study with lorazepam challenge // Clin Neurophysiol. 2005. V. 116. № 4. P. 886.
Yamamoto S., Kitamura Y., Yamada N. et al. Medial prefrontal cortex and anterior cingulate cortex in the generation of alpha activity induced by transcendental meditation: A magnetoencephalographic study // Acta Med. Okayama. 2006. V. 60. № 1. P. 51.
Knyazev G. EEG Correlates of Self-Referential Processing // Front. Hum. Neurosci. 2013. V. 7. Article 264.
Kim J.S., Shin K.S., Jung W.H. et al. Power spectral aspects of the default mode network in schizophrenia: an MEG study // BMC Neurosci. 2014. V. 15. P. 104.
Fingelkurts A., Fingelkurts A. Persistent operational synchrony within brain default-mode network and self-processing operations in healthy subjects // Brain. Cogn. 2011. V. 75. № 2. P. 79.
Davis P., Zaki Y., Maguire J., Reijmers L.G. Cellular and oscillatory substrates of fear extinction learning // Nat. Neurosci. 2017. V. 20. № 11. P. 1624.
Zheng J., Stevenson R.F., Mander B.A. et al. Multiplexing of Theta and Alpha Rhythms in the Amygdala-Hippocampal Circuit Supports Pattern Separation of Emotional Information // Neuron. 2019. V. 102. № 4. P. 887.
Johnstone J., Gunkelman J., Lunt J. Clinical database development: characterization of EEG phenotypes // Clin EEG Neurosci. 2005. V. 36. № 2. P. 99.
Arns M., Swatzyna R.J., Gunkelman J., Olbrich S. Sleep maintenance, spindling excessive beta and impulse control: an RdoC arousal and regulatory systems approach? // Neuropsychiatr. Electrophysiol. 2015. V. 1. № 1. P. 5.
Kropotov J.D. Functional Neuromarkers for Psychiatry. San Diego: Academic Press, 2016. 498 p.
Clarke A.R., Barry R.J., Dupuy F.E. et al. Excess beta activity in the EEG of children with attention-deficit/hyperactivity disorder: a disorder of arousal? // Int. J. Psychophysiol. 2013. V. 89. № 3. P. 314.
Mallet N., Pogosyan A., Márton L.F. et al. Parkinsonian beta oscillations in the external globus pallidus and their relationship with subthalamic nucleus activity // J. Neurosci. 2008. V. 28. № 52. P. 14245.
Degos B., Deniau J.M., Chavez M., Maurice N. Chronic but not acute dopaminergic transmission interruption promotes a progressive increase in cortical beta frequency synchronization: relationships to vigilance state and akinesia // Cereb Cortex. 2009. V. 19. № 7. P. 1616.
Williams D., Tijssen M., Van Bruggen G. et al. Dopamine-dependent changes in the functional connectivity between basal ganglia and cerebral cortex in humans // Brain. 2002. V. 125. № 7. P. 1558.
Brown P., Williams D. Basal ganglia local field potential activity: character and functional significance in the human // Clin. Neurophysiol. 2005. V. 116. № 11. P. 2510.
Weinberger M., Mahant N., Hutchison W.D. et al. Beta oscillatory activity in the subthalamic nucleus and its relation to dopaminergic response in Parkinson’s disease // J. Neurophysiol. 2006. V. 96. № 6. P. 3248.
McCarthy M.M., Moore-Kochlacs C., Gu X. et al. Striatal origin of the pathologic beta oscillations in Parkinson’s disease // Proc. Natl. Acad. Sci. USA. 2011. V. 108. № 28. P. 11620.
Sherman M.A., Lee S., Law R. et al. Neural mechanisms of transient neocortical beta rhythms: Converging evidence from humans, computational modeling, monkeys, and mice // Proc. Natl Acad. Sci. USA. 2016. V. 113. № 33. e4885.
Holgado A.J., Terry J.R., Bogacz R. Conditions for the generation of beta oscillations in the subthalamic nucleus-globus pallidus network // J. Neurosci. 2010. V. 30. № 37. P. 12340.
Kuhn A.A., Williams D., Kupsch A. et al. Event-related beta desynchronization in human subthalamic nucleus correlates with motor performance // Brain. 2004. V. 127. № 4. P. 735.
Alexander G.E., DeLong M.R., Strick P.L. Parallel organization of functionally segregated circuits linking basal ganglia and cortex // Annu. Rev. Neurosci. 1986. V. 9. P. 357.
Accolla E.A., Herrojo Ruiz M., Horn A. et al. Brain networks modulated by subthalamic nucleus deep brain stimulation // Brain. 2016. V. 139. № 9. P. 2503.
Латаш Л.П. Гипоталамус, приспособительная активность. и электроэнцефалограмма. М.: Наука, 1968. 296 с.
Фетискин Н.П., Козлов В.В., Мануйлов Г.М. Социально-психологическая диагностика развития личности и малых групп. М.: Изд-во Института Психотерапии, 2002. 362 с.
Vasin G., Lobaskova M., Gindina E. The Youth Self Report: validity of the Russian version // SHS Web Conf. 2016. V. 29. P. 02041.
Лурия А.Р. Высшие корковые функции человека и их нарушения при локальных поражениях мозга. М.: МГУ, 1969. 433.
Fairchild G., Hagan C.C., Passamonti L. et al. Atypical neural responses during face processing in female adolescents with conduct disorder // J. Am. Acad. Child. Adolesc. Psychiatry. 2014. V. 53. № 6. e675.
Hyde L.W., Shaw D.S., Murray L. et al. Dissecting the role of amygdala reactivity in antisocial behavior in a sample of young, low-income, urban men // Clin. Psychol. Sci. 2016. V. 4. № 3. P. 527.
Catani M., Dell’acqua F., Thiebaut de Schotten M. A revised limbic system model for memory, emotion and behavior // Neurosci. Biobehav Rev. 2013. V. 37. № 8. P. 1724.
Johnstone T., van Reekum C.M., Urry H.L. et al. Failure to regulate: counterproductive recruitment of top-down prefrontal-subcortical circuitry in major depression // J. Neurosci. 2007. V. 27. № 33. P. 8877.
Steward T., Picó-Pérez M., Mestre-Bach G. et al. A multimodal MRI study of the neural mechanisms of emotion regulation impairment in women with obesity // Transl. Psychiatry. 2019. V. 9. № 1. P. 194.
Blair R.J. The roles of orbital frontal cortex in the modulation of antisocial behavior // Brain Cogn. 2004. V. 55. № 1. P. 198.
Beer J.S., John O.P., Scabini D., Knight R.T. Orbitofrontal cortex and social behavior: integrating self-monitoring and emotion-cognition interactions // J. Cogn. Neurosci. 2006. V. 18. № 6. P. 871.
Дополнительные материалы отсутствуют.
Инструменты
Физиология человека


