Физиология человека, 2020, T. 46, № 5, стр. 91-99
Физиологические аспекты восстановления репродуктивной функции у пациенток после перенесенных острых гинекологических заболеваний
К. А. Тониян 1, *, А. О. Духин 2, В. В. Бояринцев 3
1 ФГБУ Клиническая больница № 1 (Волынская) УД Президента РФ
Москва, Россия
2 ФГАОУ ВО Российский университет дружбы народов
Москва, Россия
3 ФГБУ ДПО Центральная государственная медицинская академия
УД Президента РФ
Москва, Россия
* E-mail: ktoniyan@mail.ru
Поступила в редакцию 23.03.2020
После доработки 16.04.2020
Принята к публикации 25.05.2020
Аннотация
Поиск эффективных подходов к реализации репродуктивной функции у женщин фертильного возраста после перенесенного хирургического лечения по поводу острых гинекологических заболеваний, в связи с широкой распространенностью последних, является актуальной проблемой современной физиологии репродукции. В данной работе оценивали предлагаемый подход к ведению таких пациенток, основанный на стратегии с элементами “fast track” хирургии и реабилитации, включающей в себя, наряду с традиционными подходами, методы физиотерапевтического лечения. Полученные результаты свидетельствуют об улучшении овариального кровотока, сохранении большего объема овариального резерва и более эффективной реализации репродуктивной функции.
На сегодняшний день одной из часто встречающихся причин снижения репродуктивной функции у женщин фертильного возраста является наличие в анамнезе перенесенного острого гинекологического заболевания (ОГЗ) [1, 2].
С одной стороны, симптомокомплекс “острого живота” безальтернативно приводит к экстренному хирургическому вмешательству в области малого таза [1, 3, 4], которое само по себе часто становится причиной первичного бесплодия, связанного с сальпингэктомией или сальпингоофорэктомией, и снижения овариального резерва, также как и гормонального дисбаланса, ввиду механической и термической травматизации фолликулов [5–7]. Причем, выраженность синдрома недостаточности яичников связывают со степенью дестабилизации интраовариального кровотока, детерминируемой объемом вмешательств и исходными особенностями кровоснабжения органа, что делает интенсификацию трофики яичника в послеоперационном периоде одной из задач реабилитации.
С другой стороны, ОГЗ неоднородны по своей этиологии. Условно выделяют три группы: 1) связанные с внутрибрюшным кровотечением (прервавшаяся трубная беременность – около 42%, апоплексия яичника или разрыв его кисты – 19%); 2) нарушением кровоснабжения в органе и его некрозом (перекрут ножки кисты или опухоли яичника, придатков матки – 8–15%); 3) воспалительные процессы с вовлечением тазовой брюшины (пиосальпинкс, пиовар, тубоовариальный абсцесс, первичный перитонит при гонорее, острое воспаление придатков матки – около 25%) [3, 8].
К развитию трубной беременности (ТБ) приводит эктопическая имплантация плодного яйца, которая может быть связана как с особенностями ферментативной активности внутриклеточной массы зародыша, так и с нарушением транспорта оплодотворенной яйцеклетки по маточной трубе. Последнее может быть обусловлено перенесенными воспалительными заболеваниями органов малого таза [9], в частности, восходящей хламидийной инфекцией (титр IgG к хламидиям, в среднем при этой патологии, более чем в пять раз превышает контрольный уровень [10]) и последующим сальпингитом, что приводит к дисфункции маточных труб [11].
Апоплексия яичника (АЯ), чаще всего, связана с гормональным дисбалансом, показателем которого являются, в том числе, и раннее менархе, и нарушения менструального цикла, имевшие место у 71.4 и 36% пациенток с подтвержденным диагнозом соответственно [12].
Причины перекрута придатков матки, также как и апоплексия яичника, могут быть связаны с увеличением его размеров, например, при гиперстимуляции в протоколах экстракорпорального оплодотворения [13, 14]. Причем, левый яичник меньше подвержен риску скручивания ввиду более короткой связки и анатомического ограничения его подвижности сигмовидной кишкой [15].
Гнойные тубоовариальные образования по типу пиосальпинкса, пиовара, тубовариальных абсцессов возникают, чаще всего, в результате хронического воспалительного процесса [16–18], причем, среди факторов риска отмечают репродуктивный возраст, введение внутриматочных контрацептивов, наличие нескольких половых партнеров и эпизод острого воспалительного процесса в органах малого таза в анамнезе [17, 19, 20].
Таким образом, несмотря на принадлежность к одной нозологической единице, разные типы ОГЗ имеют разную этиологию и, как следствие, патогенез снижения реализации репродуктивной функции после проведенного оперативного вмешательства также является различным, но некоторые физиологические аспекты весьма схожи. Последнее позволяет разработать единую стратегию более эффективного восстановления репродуктивной функции у пациенток с перенесенными ОГЗ, что очень востребовано в современной клинической практике.
На сегодняшний день, традиционная реабилитация пациенток с ОГЗ, не предусматривает использования физиотерапевтического лечения в ранний послеоперационный период. Однако, можно полагать, что применение методов, интенсифицирующих кровообращение в области хирургического вмешательства, в целом будет препятствовать развитию фиброзного компонента и, соответственно, спаечного процесса, и сохранению большего объема функционально активной ткани, что особенно актуально, для поддержания овариального резерва и последующей реализации репродуктивной функции.
В связи с вышеизложенным, целью данного исследования была попытка увеличить эффективность реализации репродуктивной функции у женщин, перенесших хирургическое лечение по поводу ОГЗ, путем сочетанного использования методов, направленных на улучшение трофики яичников.
МЕТОДИКА
Настоящее исследование было проведено на клинической базе кафедры акушерства и гинекологии с курсом перинатологии медицинского факультета Медицинского института Российского университета дружбы народов (г. Москва), ГБУЗ “ГКБ № 29 им. Н.Э. Баумана ДЗМ” и в ФГБУ Клинической больнице № 1 УДП РФ (Волынской) (г. Москва).
Были сформированы восемь групп исследования, в которые входили женщины с различной острой гинекологической патологией (трубная беременность – ТБ, апоплексия яичника – АЯ, перекрут ножки кисты/кистомы яичника – ПКЯ, гнойные тубоовариальные образования – ГТОО), с различной тактикой ведения: у 4-х групп проводили лечение с элементами “fast track” хирургии (в частности, отказ от премедикации и использования дренажей, неопиодная анальгезия, ранняя активизация) и реабилитации (группы +Р, выборка пациентов, пролеченных в 2016–2019 гг.) и 4 группы сравнения, у которых такой реабилиации не проводили (ретроспективная выборка пациентов, пролеченных в 2010–2015 гг.). Реабилитация включала в себя, наряду с традиционными подходами (лечебная физкультура и дыхательная гимнастика), спектр физиотерапевтического воздействия: ультразвуковое и переменное магнитное поле в импульсном режиме, токи надтональной частоты, комбинированное использование магнито-лазеротерапии, внутривагинальной и накожной электро- и нейростимуляции (комбайн “КЛМП-01 “АндроГин”, Россия).
Число пациентов в группах было следующим:
1. трубная беременность без и с реабилитацией: ТБ (n = 90) и ТБ + Р (n = 36);
2. апоплексия яичника без и с реабилитацией: АЯ (n = 67) и АЯ + Р (n = 64);
3. перекрут ножки кисты/кистомы яичника без и с реаблитацией: ПКЯ (n = 66) и ПКЯ + Р (n = 60);
4. гнойные тубоовариальные образования без и с реабилитацией: ГТОО (n = 88) и ГТОО + Р (n = 62).
В исследование не включали пациентов, имеющих психические и экстрагенитальные заболевания в стадии декомпенсации, злокачественные и аутоиммунные заболевания, инфекционно-воспалительные заболевания в фазе обострения, поливалентную аллергию.
Определение параметров интраовариального кровотока, объема яичников и числа антральных фолликулов. Ультразвуковое исследование (УЗИ) проводили в трехмерном режиме по стандартной методике с использованием аппарата VOLUSON-730 (Expert Zipf, Австрия) с трансвагинальным датчиком 3.3–10 МГц через три и шесть месяцев после проведенного оперативного вмешательства. Построение изображений для определения объема яичников и подсчета числа антральных фолликулов проводили с помощью программы VOCAL. Наряду с оценкой кровоснабжения органа определяли индекс васкуляризации (VI), индекс кровотока (FI) и васкуляризационно-поточный индекс (VFI).
Определение содержания антимюллерова гормона в сыворотке крови. Для оценки овариального резерва определяли антимюллеров гормон (АМГ, нг/мл) в первую фазу менструального цикла (на 3 д.м.ц.) через три–шесть месяцев после оперативного вмешательства методом иммуноферментного анализа с использованием коммерческого набора AMH GenII ELISA (Beckman Coulter, США).
Статистическая обработка экспериментальных данных. Статистический анализ проводили при помощи программного пакета “SPSS 13 for Windows” и программ “Statistica 8” (Statsoft Inc., США). Нормальность распределения количественных признаков проверяли с помощью одновыборочного критерия Колмогорова-Смирнова. Для определения достоверности данных применяли: при количественных нормально распределенных данных (расчеты приведены в виде М ± m – средней арифметической и ее стандартной ошибки среднего значения) – Т-критерий Стьюдента, качественных – точный критерий Фишера, непараметрические методы Манна-Уитни. Статистически значимыми считали различия при p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
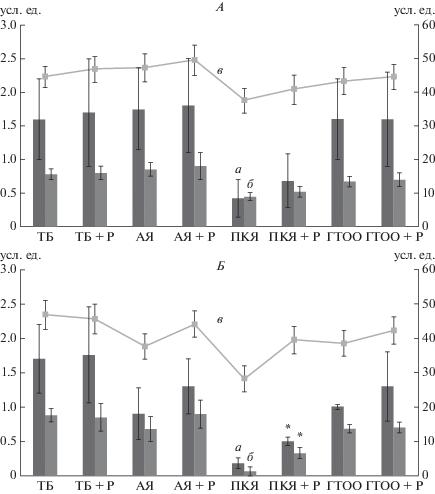
Состояние интраовариального кровотока. Параметры овариального кровотока (рис. 1) женщин после перенесенного хирургического лечения по поводу трубной беременности соответствовали таковым у здоровых женщин как через месяц после вмешательства, так и через три месяца вне зависимости наличия/отсутствия реабилитации. В группе с апоплексией яичника через месяц после оперативного лечения имело место некоторое увеличение интенсивности кровотока, особенно в группе АЯ + Р, которое, однако, имело транзиторный характер, поскольку через три месяца эти параметры снижались. Активация интраовариального кровотока в оперированном яичнике (после резекции кисты воспалительного генеза) оказалась кратковременной с постепенным снижением параметров, более выраженным в группе без реабилитации (p < 0.05). В целом, сравнительный анализ индекса васкуляризации (VI), индекса кровотока (FI) и васкуляризационно-поточного индекса (VFI) в динамике оценки интраовариального кровотока женщин после ургентных операций по поводу ОГЗ показал более выраженное его снижение в группах без реабилитации (p < 0.05), особенно при персистирующих хронических воспалительных заболеваниях органов малого таза.
Рис. 1.
Динамика овариального кровотока у пациенток после ургентной хирургии в зависимости от наличия реабилитации. А – через 1 мес., Б – через 3 мес. а – индекс васкуляризации VI, б – васкуляризационно-поточный индекс VFI, в – поток крови в объеме яичника FI. * – p < 0.05 по сравнению с соответствующими группами без реабилитации.
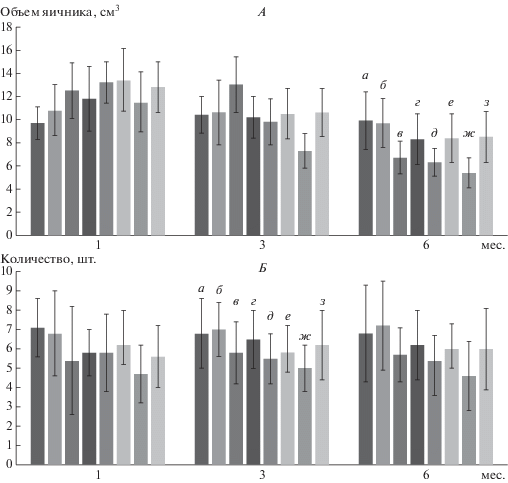
Объем яичников и число антральных фолликулов. Объем яичников (рис. 2) во всех группах исследования, вне зависимости от реабилитации был несколько увеличен через месяц после оперативного вмешательства, однако к трем месяцам не отличался от возрастной нормы здоровых женщин. Исключение составила группа АЯ, в которой и через три месяца объем яичника был увеличен. В то же время, в группе АЯ + Р этот параметр от нормы не отличался. При этом число антральных фолликулов в группе после сальпингэктомии и реабилитации не претерпевало отклонений от возрастной нормы в отличие от женщин без реаблитации (7.4 ± 2.8 против 6.0 ± 2.2, p < 0.05). Истощение фолликулярного аппарата – 3–7 фолликулов в пределах среза отмечали в группе без реабилитации после резекции кисты воспалительного характера на фоне мультифолликулярных изменений в контрлатеральном яичнике. Примечательно, что устойчивую на протяжении срока наблюдения овуляцию в здоровом яичнике чаще отмечали после реаблитациионных мероприятий (67.8% против 32.5%), чем без них (p < < 0.05).
Рис. 2.
Объем яичников и число антральных фолликулов у пациенток после ургентной хирургии в зависимости от наличия реабилитации. А – объем яичника, Б – число антральных фолликулов. а – ТБ, б – ТБ + Р, в – АЯ, г – АЯ + Р, д – ПКЯ, е – ПКЯ + Р, ж – ГТОО, з – ГТОО + Р.
Содержание антимюллерова гормона. Содержание АМГ (рис. 3) в группах с трубной беременностью находилось в пределах нормальных значений (1–10.6 нг/мл) и не отличалось в зависимости наличия/отсутствия реабилитации.
Рис. 3.
Концентрация антимюллерова гормона (АМГ) в сыворотке крови пациенток после ургентной хирургии в зависимости от наличия реабилитации. Нижняя граница нормы составляет 1 нг/мл. * – p < 0.05 по сравнению с соответствующими группами без реабилитации.

В группах с апоплексией яичника значения также были в пределах нормы, но после проведения реабилитации содержание АМГ было достоверно выше – более чем на 23% (p < 0.05), чем без нее.
В группе ПКЯ значение АМГ было на 18% (p < 0.05) ниже нормы, а в соответствующей группе с реабилитацией ПКЯ + Р – соответствовало нижней границе референсных значений.
В группе ГТОО концентрация АМГ была еще ниже, чем в группе ПКЯ – на 36% ниже референсного значения (p < 0.05), но применение реабилитации в группе с ГТОО + Р позволяло практически достичь нижней границы нормы, достоверно от нее не отличаясь.
Оценка эффективности тактики ведения женщин с ОГЗ на основании частоты наступления беременности и исходов.
Частота беременностей с благоприятным исходом (рис. 4) оказалась наибольшей в группах с реабилитацией после вмешательства по поводу трубной беременности и апоплексии яичника, достигая практически половины всех репродуктивных запросов, и была почти в два раза выше по сравнению с аналогичными группами без реабилитации: 47.2 против 17.8% при ТБ и 50.0 против 28.4% при АЯ соответственно (p < 0.05). При этом в группе ТБ + Р число репродуктивных потерь (негативных исходов) было практически в два раза ниже (p < 0.05), чем в группе без реабилитации: 13.9% в группе ТБ + Р и 26.7% в группе ТБ.
Рис. 4.
Данные и характер репродуктивных исходов у пациенток после ургентной хирургии в зависимости от наличия реабилитации. а – ТБ, б – ТБ + Р, в – АЯ, г – АЯ + Р, д – ПКЯ, е – ПКЯ + Р, ж – ГТОО, з – ГТОО + Р. * – p < 0.05 по сравнению с соответствующими группами без реабилитации.
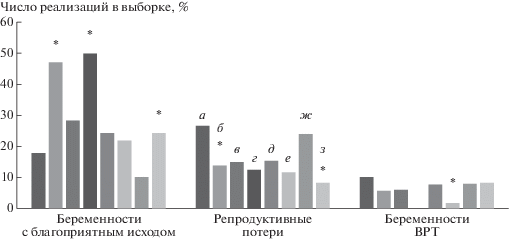
Существенно ниже были показатели беременностей с благоприятным исходом в группах ПКЯ и ГТОО. В группах ПКЯ вне зависимости от наличия реабилитации показатели не превышали 25% (ПКЯ + Р – около 22%, ПКЯ – около 24%), хотя процент беременностей, наступивших с помощью вспомогательных репродуктивных технологий, в группе ПКЯ + Р существенно ниже, чем в группе ПКЯ – 1.7 и 7.6% соответственно.
В группе ГТОО + Р число беременностей с благоприятным исходом составило 24.2%, что достоверно выше (p < 0.05), чем в группе ГТОО (10.2%) и, кроме того, число репродуктивных потерь было почти в три раза ниже (p < 0.05): 8.1% в группе ГТОО + Р и 23.9% в группе ГТОО.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Актуальность восстановления репродуктивного здоровья после органосохраняющего лечения ОГЗ объясняется неудовлетворительными результатами исходов оперативных вмешательств, в частности, отсутствием желанной беременности. Мультифакторность снижения репродуктивного потенциала у пациенток после ургентной хирургии затрудняет поиск эффективных методов реабилитации, которые могут быть использованы в широкой клинической практике.
Одним из ведущих факторов функциональной несостоятельности тканей органов малого таза при органосохранящих операциях является ишемия, вызванная термическими повреждениями во время хирургического вмешательства и последующим отеком, что ведет к нарушению трофики. Последнее может оказать решающее влияние на созревание фолликула и оогенез, приводя к необратимой потере репродуктивной функции [21]. Например, снижение и полная потеря фертильности с возрастом коррелирует со снижением овариального кровотока [22, 23]. Сохранение овариального кровотока является одним из приоритетов при выборе методик лечения заболеваний органов малого таза, особенно у пациентов репродуктивного возраста [24]. Поэтому особую значимость приобретает адекватный объем лечебно-восстановительных мероприятий, нивелирующих последствия операционной травмы яичников – отека тканей и ухудшения кровоснабжения [25]. Полученные нами результаты свидетельствуют о том, что сочетанное применение даже рутинных физиотерапевтических процедур у больных с острыми гинекологическими заболеваниями, в отличие от больных без реабилитации, приводит к заметно более выраженному восстановлению интраовариального кровотока, особенно при его нарушениях, в частности, при апоплексии яичника. Кроме того, это восстановление имеет устойчивый характер, о чем свидетельствуют данные, полученные через три месяца после оперативного вмешательства: у больных с реабилитацией показатели кровотока были выше, чем без нее. Следует отметить, что использованные УЗИ-маркеры отражают интенсивность кровотока в яичниках как в трехмерном теле [22, 26, 27]. Так, индекс васкуляризации (VI) отражает плотность сосудов в объеме яичника, индекс кровотока (FI) – поток крови в объеме яичника. Васкуляризационно-поточный индекс (VFI) представляет собой фактически комбинацию VI и FI, что позволяет комплексно оценить кровоснабжение в яичнике, и при одномоментной оценке всех трех показателей, выявить тонкие механизмы регуляции кровотока в исследуемом трехмерном теле. Практически во всех группах исследования наблюдали увеличение васкуляризационно-поточного индекса, в основном, за счет увеличения индекса васкуляризации, что дало основания предположить более эффективное восстановление трофики яичников и, как следствие, сохранение большего объема функционально активной ткани.
Поэтому мы предполагали, что в группах пациенток с примененной реабилитацией число антральных фолликулов, как одного из биомаркеров овариального резерва, будет больше, нежели в группах без реабилитации. Однако, по данным ультразвукового исследования, принципиальных отличий объема яичников и числа антральных фолликулов между группами в зависимости от используемого подхода не было.
Тем не менее, следует отметить, что число антральных фолликулов не всегда отражает их зрелость и, соответственно, способность к овуляции. Растущий ооцит в фолликуле продуцирует паракринный фактор роста GDF9 (семейство ростовых факторов TGFβ) под действием которого происходит пролиферация клеток гранулезы [28]. В свою очередь, эти фолликулярные клетки секретируют факторы роста и дифференцировки, которые по механизму обратной связи стимулируют ооцит к росту и способствуют образованию кровеносных сосудов в области фолликула [29]. Среди этих факторов, продуцируемых клетками гранулезы, выделяют АМГ, который в последнее время гораздо чаще, чем ингибин В используется как маркер овариального резерва, ввиду зависимости содержания последнего от фолликулостимулирующего гормона передней доли гипофиза. Причем АМГ как маркер имеет не только констатационное значение, но и предиктивное [30–32], что актуально для пациентов после тубэктомии для оценки риска возникновения синдрома гиперстимуляции яичников.
Учитывая вышеизложенное, определяли содержание АМГ на 3-й день менструального цикла у пациенток через 3 мес. после перенесенного хирургического вмешательства.
Таким образом, в группе трубной беременности, вне зависимости от использования реабилитационной терапии, показатели АМГ соответствовали возрастной норме, свидетельствуя о среднем уровне овариального резерва. Однако в других группах применение реабилитации приводило к достоверному увеличению АМГ по сравнению с группами без реабилитации. Причем особую актуальность это имело в группах ПКЯ и ГТОО, поскольку известно, что после цист- и сальпингоофорэктомии без применения реабилитационных процедур его содержание существенно снижено [25, 33, 34]. Полученные результаты показывают, что применение реабилитации приводит к возрастанию содержания АМГ после оперативного лечения ПКЯ и ГТОО вплоть до нижней границы референсных значений, позволяя рассчитывать на реализацию репродуктивной функции.
Проведенный статистический анализ репродуктивных исходов у пациенток, перенесших ОГЗ и получавших реабилитационную терапию, по сравнению с группами без реабилитации свидетельствует об увеличении числа благополучных репродуктивных исходов. Снижение числа репродуктивных потерь имело место во всех группах с реабилитацией, и примерно в 2 раза увеличивалось число беременностей с благоприятным исходом в группах ТБ + Р, АЯ + Р и ГТОО + Р по сравнению с аналогичными группами без реабилитации. В группе ПКЯ + Р число беременностей с благоприятным исходом оставалось на том же уровне, что и в группе без применения реабилитационных подходов. Но следует отметить, что в группе с реабилитацией тот же процент достигался без обращения к вспомогательным репродуктивным технологиям, что, безусловно, позволяет сохранить не только репродуктивное, но и соматическое здоровье этих пациенток.
Можно полагать, что использованный подход был достаточно успешным в силу своей комплексности: с одной стороны, такой ключевой элемент fast track хирургии как ранняя активизация и реабилитационная терапия, имели своей целью стимулирование кровотока в оперированном яичнике и, как следствие, улучшение его трофики и условий для созревания фолликулов, что является одним из ключевых моментов для успешной реализации репродуктивной функции. С другой стороны, в стратегии fast track заложено большее: уменьшение предоперационного периода и отсутствие премедикации могут снижать провоспалительную активацию системы иммунитета, причем как гуморального, так и клеточного, и как следствие приводить к скорейшему наступлению положительного результата лечения. Подобное предположение основано на анализе результатов в группе пациенток в гнойными тубоовариальными образованиями, однако требует дальнейшего прицельного исследования с точки зрения параметров иммунологического статуса.
ЗАКЛЮЧЕНИЕ
Таким образом, полученные результаты свидетельствуют о возможности использования единых физиологически обоснованных методов реабилитации этиологически различных ОГЗ.
Однако, вероятно, дальнейшее увеличение эффективности наступления беременностей с благоприятным исходом может быть основано на подходах персонализированной медицины.
Этические нормы. Все исследования проведены в соответствии с принципами биомедицинской этики, сформулированными в Хельсинкской декларации 1964 г. и ее последующих обновлениях. Обследование пациенток, предоперационная подготовка и ведение в послеоперационном периоде проводили, согласно Приложению 4 приказа МЗ РФ № 323 от 05.11.98 “Об отраслевых стандартах объемов акушерско-гинекологической помощи” и приказу МЗ РФ № 572н от 01.11.2012 “Об утверждении порядка оказания медицинской помощи по профилю “акушерство и гинекология (за исключением использования вспомогательных репродуктивных технологий)””. В исследование не включали пациентов, имеющих психические и экстрагенитальные заболевания в стадии декомпенсации, злокачественные и аутоиммунные заболевания, инфекционно-воспалительные заболевания в фазе обострения, поливалентную аллергию.
Информированное согласие. Каждая пациентка, участвовавшая в исследовании, представила добровольное письменное информированное согласие, подписанное ею после разъяснения ей потенциальных рисков и преимуществ, а также характера предстоящего исследования.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией данной статьи.
Список литературы
Радзинский В.Е. Гинекология. М.: ГЭОТАР-Медиа, 2014. 259 с.
Савельева Г.М. Гинекология. Национальное руководство. Краткое издание. М.: ГЭОТАР-Медиа, 2013. 704 с.
Гаспаров А.С., Тер-Овакимян А.Э., Хилькевич Е.Г., Косаченко А.С. Апоплексия яичника и разрывы кист яичников. М.: МИА, 2009. 176 с.
Пучков К.В., Коренная В.В., Подзолкова Н.М. Fast track: хирургические протоколы ускоренной реабилитации в гинекологии // Медицинские аспекты здоровья женщины. 2016. Т. 17. № 8. С. 59.
Мальцева Л.И. Современные проблемы инфекционной патологии в акушерстве и гинекологии // Практическая медицина. 2010. Т. 2. № 41. С. 20.
Kalra G.S., Campbell S., Nargund G. Ovarian reserve may be compromised after adnexal surgery: Are we sufficientlyfertility–focused in our surgical training? // Facts Views Vis Obgyn. 2016. V. 8. № 2. P. 104.
Сафронова Д.А., Братчикова O.B., Кавтеладзе E.B. Овариальный резерв и репродуктивная функция у пациенток после лапароскопической кистэктомии по поводу доброкачественных опухолей яичников // Вестник Российского государственного медицинского университета. 2011. № 2. С. 124.
Llata E., Bernstein K.T., Kerani R.P. Management of pelvic inflammatory disease in selected u.s. sexually transmitted disease clinics: sexually transmitted disease surveillance network // Sex Transm Dis. 2015. V. 42. № 8. P. 429.
Shaw J.L., Dey S.K., Critchley H.O., Horne A.W. Current knowledge of the aetiology of human tubal ectopic pregnancy // Hum. Reprod. Update. 2010. V. 16. № 4. P. 432.
Li C., Meng C.X., Zhao W.H. et al. Risk factors for ectopic pregnancy in women with planned pregnancy: a case–control study // Eur. J. Obstet. Gynecol. Reprod. Biol. 2014. V. 181. P. 176.
Barnhart K. Ectopic pregnancy // N. Engl. J. Med. 2009. V. 361. P. 379.
Ткаченко Л.В., Гриценко И.А. Системный подход к восстановлению репродуктивного потенциала у женщин после хирургического снижения овариального резерва // Лечение и профилактика. 2013. Т. 2. № 6. С. 18.
Huchon C., Fauconnier A. Adnexal torsion: a literature review // Eur. J. Obstet. Gynecol. Reprod. Biol. 2010. V. 150. № 1. P. 8.
Romanski P.A., Melamed A., Elias K.M. et al. Association between peak estradiol levels and ovarian torsion among symptomatic patients receiving gonadotropin treatment // J. Assist. Reprod. Genet. 2017. V. 34. № 5. P. 627.
Weitzman V.N., DiLuigi A.J., Maier D.B., Nulsen J.C. Prevention of recurrent adnexal torsion // Fertil. Steril. 2008. V. 90. № 5. P. 2018. e1-3.
Fouks Y., Cohen Y., Tulandi T. et al. Complicated Clinical Course and Poor Reproductive Outcomes of Women with Tubo–Ovarian Abscess after Fertility Treatments // J. Minim Invas. Gyn. 2019. V. 26. № 1. P. 162.
Kairys N., Roepke C. Tubo–Ovarian Abscess / StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing. 2019.
Tao X., Ge S.Q., Chen L. Relationships between female infertility and female genital infections and pelvic inflammatory disease: a population–based nested controlled study // Clinics (Sao Paulo). 2018. V. 73. P. 364.
Абашидзе A.A. Методы реабилитации репродуктивной функции у женщин с трубно–перитонеальным бесплодием // Медико-социальная экспертиза и реабилитация. 2014. № 2. С. 42.
Аникин С.С., Рыбалка А.Н., Заболотнов В.А., Лившиц И.В. Выбор метода хирургического лечения трубной беременности // Таврический медико–биологический вестник. 2013. Т. 16. № 2(1). С. 11.
Redmer D., Reynolds L. Angiogenesis in the ovary // Rev. Reprod. 1996. V. 1. № 3. P. 182.
Ng E.H., Chan C.C., Yeung W.S., Ho P.C. Effect of age on ovarian stromal flow measured by three-dimensional ultrasound with power Doppler in Chinese women with proven fertility // Hum. Reprod. 2004. V. 19. № 9. P. 2132.
Kupesic S., Kurjak A., Bjelos D., Vujisic S. Three-dimensional ultrasonographic ovarian easurements and in vitro fertilization outcome are related to age // Fertil. Steril. 2003. V. 79. № 1. P. 190.
Lee D.Y., Park H.J., Kim B.G. et al. Change in the ovarian environment after hysterectomy as assessed by ovarian arterial blood flow indices and serum anti-Müllerian hormone levels // Eur. J. Obstet. Gynecol. Reprod. Biol. 2010. V. 151. № 1. P. 82.
Rustamov O., Krishnan M., Roberts S.A., Fitzgerald C.T. Effect of salpingectomy, ovarian cystectomy and unilateral salpingo–oopherectomy on ovarian reserve // Gynecol. Surg. 2016. V. 13. P. 173.
Титченко Л.И., Пырсикова Ж.Ю., Чечнева М.А., Титченко И.П. Трехмерное ультразвуковое исследование для функциональной оценки внутриплацентарной сосудистой сети // SonoAce International. 2007. № 16. С. 22.
Kamal N., Sanad Z., Elkelani O. et al. Changes in ovarian reserve and ovarian blood flow in patients with polycystic ovary syndrome following laparoscopic ovarian drilling // Gynecol. Endocrinol. 2018. V. 34. № 9. P. 789.
Dong J., Albertini D.F., Nishimori K. et al. Growth differentiation factor-9 is required during early ovarian folliculogenesis // Nature. 1996. V. 383. № 6600. P. 531.
Antczak M., van Blerkom J., Clark A. A novel mechanism of vascular endothelial growth factor, leptin, and transforming growth factor-β2 sequestration in a population of human ovarian follicle cells // Hum. Reprod. 1997. V. 12. P. 2226.
Kelsey T.W., Anderson R.A., Wright P. et al. Data–driven assessment of the human ovarian reserve // Mol. Hum. Reprod. 2012. V. 18. № 2. P. 79.
Freeman E.W., Sammel M.D., Lin H. Antimullerian hormone as a predictor of time to menopause in late reproductive age women // J. Clin Metab. 2012. V. 97. № 5. P. 1673.
Freeman E.W., Sammel M.D., Lin H. Contribution of the rate of change of antimullerian hormone in estimating time to menopause for late reproductive age women // Fertil. Steril. 2012. V. 98. № 5. P. 1254.
Гасымова Д.М., Рухляда Н.Н. Овариальный резерв после ургентных гинекологических операций у женщин с осложнениями доброкачественных и опухолеподобных образований яичников // Проблемы репродукции. 2017. № 2. С. 27.
Мусаев Р.Д., Чабан О.В., Давыдов А.И. Функциональное состояние яичников после различных методов хирургического вмешательства у больных с эндометриоидными кистами // Вопросы гинекологии, акушерства и перинатологии. 2011. Т. 10. № 5. С. 5.
Дополнительные материалы отсутствуют.
Инструменты
Физиология человека


