Физиология человека, 2021, T. 47, № 1, стр. 73-83
Регуляция фаз шагательного цикла при неинвазивной электрической стимуляции спинного мозга
Р. М. Городничев 1, А. М. Пухов 1, С. А. Моисеев 1, С. М. Иванов 1, В. В. Маркевич 1, И. Н. Богачева 2, А. А. Гришин 2, Т. Р. Мошонкина 2, Ю. П. Герасименко 2, *
1 ФГБОУ ВО Великолукская государственная академия физической культуры и спорта
Великие Луки, Россия
2 ФГБУН Институт физиологии имени И.П. Павлова РАН
Санкт-Петербург, Россия
* E-mail: gerasimenko@infran.ru
Поступила в редакцию 27.05.2020
После доработки 10.06.2020
Принята к публикации 20.08.2020
Аннотация
В данной статье описан новый способ регуляции шагательных движений у человека посредством неинвазивной электрической стимуляции спинного мозга для воздействия на флексорные/экстензорные моторные пулы нижних конечностей в шагательном цикле. Процесс управления селективной стимуляцией был автоматизирован и осуществлялся на основе информации, поступающей от датчиков-гироскопов, которые использовались для детектирования фазы опоры и фазы переноса конечности. Момент разгибания бедра являлся триггером для активации экстензорных моторных пулов (L1) в фазе опоры, а момент сгибания был триггером для активации флексорных моторных пулов (Т11) в фазе переноса. У здоровых испытуемых (n = 6) при ходьбе по движущейся ленте тредбана стимуляция L1 с частотой 15 Гц на 4% (p = 0.0457) уменьшала длительность нахождения ноги на опоре, увеличивала на 11% (p = 0.0266) амплитуду движений в тазобедренном суставе, уменьшала на 17% (p = 0.0081) в голеностопном суставе и увеличивала ЭМГ-активность экстензорных vastus lateralis (VL) на 31% (p = 0.0441) и gastrocnemius medialis (GM) на 17% (p = 0.0465) и флексорных мышц biceps femoris (BF) на 26% (p = 0.4637) и tibialis anterior (TA) на 21% (p = 0.0215) по сравнению с ходьбой без электровоздействия. Стимуляция Т11 с частотой 30 Гц приводила к сокращению длительности фазы опоры на 3% (p = 0.0318), вызывала увеличение амплитуды движений в тазобедренном суставе на 12% (p = 0.0467), подъем колена на 25% (p = 0.0001) и конечной антропометрической точки на 19% (p = 0.0001) над опорой. Это сопровождалось увеличением активности флексорных мышц BF на 18% (p = 0.230) и TA на 14% (p = 0.0170) и снижением коэффициента реципрокности в мышцах бедра на 15% (p = 0.0301) и повышением в мышцах голени на 5% (p = 0.0452). При пространственно-временнóй чередующейся стимуляции L1 и Т11 длительности каждой из фаз шага достоверно не отличались от ходьбы без стимуляции, вместе с тем кинематические характеристики шагательных движений изменялись: в фазе опоры увеличивалась амплитуда движений в тазобедренном суставе, в фазе переноса увеличивалась амплитуда движений в тазобедренном суставе и увеличивался подъем колена и конечной антропометрической точки над опорой. При стимуляции L1-T11 ЭМГ-активность мышц бедра и голени увеличивалась. При этом активность мышц-экстензоров в фазе опоры была больше по отношению к флексорным и, напротив, в фазе переноса активность мышц-флексоров превосходила активность экстензоров. Таким образом, полученные данные показывают возможность чрескожной стимуляции адресно воздействовать на моторные пулы нижних конечностей и управлять их активностью для регуляции фаз шагательного цикла при локомоции человека.
Неинвазивная чрескожная электрическая стимуляция спинного мозга (ЧЭССМ) является эффективным методом активации спинальных нейронных локомоторных сетей для управления двигательными функциями человека [1, 2]. В настоящее время ЧЭССМ с успехом применяется для реабилитации локомоторной [3] и постуральной [4] функции у пациентов с травматическим поражением спинного мозга и у пациентов с детским церебральным параличем [5]. В основе метода ЧЭССМ лежит стимуляционное воздействие электрическими импульсами, модулируемыми высокочастотной составляющей 5–10 кГц, известными как “русские токи” [6]. Использование такой конфигурации импульсов снижает чувствительность кожных рецепторов, что позволяет чрескожно стимулировать структуры спинного мозга относительно безболезненно. Показано, что использование модулированных (5 кГц) импульсов более эффективно восстанавливает моторные функции руки у пациентов с тетраплегией, чем обычная немодулированная стимуляция [7].
Цель исследования – выяснить возможности использования модулированной ЧЭССМ для активации не только спинальных нейронных сетей, но и для селективной активации флексорных и экстензорных моторных пулов нижних конечностей в определенные фазы шагательного цикла. В анатомических [8, 9] и электрофизиологических [10] исследованиях показано, что в поясничном утолщении спинного мозга человека ядра флексорных и экстензорных моторных пулов распределены в ростро-каудальном направлении. В сегментах спинного мозга в области позвонков T11–T12 локализованы, преимущественно, ядра флексоров, а в сегментах в области T12–L1 позвонков – ядра экстензоров.
В исследовании предполагалось получить ответы на следующие вопросы: 1) насколько ЧЭССМ способна селективно воздействовать на флексорные и экстензорные моторные пулы нижних конечностей; 2) выявить оптимальные режимы и условия для селективной активации флексорных и экстензорных моторных пулов; 3) определить, как изменяется шагательный паттерн при стимуляции флексорных и/или экстензорных моторных пулов. Ответы на эти вопросы могут стать основой для разработки новой стратегии регуляции локомоторной функции, включающей управление спинальными нейронными сетями в сочетании с пространственно-временнóй адресной активацией флексорных и экстензорных моторных пулов в определенные фазы шагательного цикла.
МЕТОДИКА
В исследовании принимали участие 6 здоровых испытуемых мужского пола, средний возраст которых составил 23.71 ± 2.29 года (от 18 до 35 лет).
Исследование проводили на базе Научно-исследовательского института Проблем спорта и оздоровительной физической культуры ФГБОУ ВО “Великолукская государственная академия физической культуры и спорта” (г. Великие Луки) в период с ноября по декабрь 2019 г.
ЧЭССМ осуществляли посредством пятиканального стимулятора БиоСтим-5 (ООО “Косима”, Россия) [11]. Стимуляционные электроды (катоды) (“FIAB”, Италия) из токопроводящей резины диаметром 3 см, центр электродов располагали на 2.5 см латеральнее средней линии позвоночника с правой стороны на уровне L1–L2 и T11–T12 позвонков для активации экстензорных и флексорных моторных пулов, посредством стимуляционного воздействия на дорсальные корешки и структуры спинного мозга. Референтные поверхностные электроды (аноды) из токопроводящей резины размером 5 × 9 см располагали билатерально над гребнями подвздошных костей. Силу тока стимуляции подбирали индивидуально для каждого испытуемого – стимуляция должна была вызывать сокращение мышц нижних конечностей, не доставляя болевых ощущений. Параметры стимуляции: длительность импульса 1 мс, форма импульса прямоугольная мононофазная, заполненная несущей частотой 5 кГц, частота стимуляции экстензорных пулов составляла 15 Гц, флексорных – 30 Гц.
Для осуществления активации флексорных/ экстензорных моторных пулов в определенные фазы шагательного цикла использовали систему детектирования, позволяющую определять моменты отрыва и постановки стопы на опорную поверхность с помощью датчиков (цифровой акселерометр и гироскоп LSM6DSL, производства ST Microelectronics, Швейцария), предназначенных для регистрации линейного ускорения и угловой скорости. За момент постановки стопы на опору принимали момент начала разгибания бедра. Этот момент определяется изменением знака производной сигнала угла в тазобедренном суставе с плюса на минус. За момент отрыва стопы от опоры принимали момент начала сгибания бедра, он определялся по изменению знака производной с минуса на плюс. Разгибание бедра являлось триггером для активации экстензорных моторных пулов (L1–L2) (фаза опоры), при сгибании бедра давали сигнал на прекращение стимуляции экстензоров и запускали стимуляцию для активации флексорных моторных пулов (Т11–Т12) (фаза переноса). Переключение режимов стимуляции осуществляли в автоматическом режиме. На рис. 1, А представлена схема стимуляции в фазы шагательного цикла.
Рис. 1.
Пространственно-временнáя стимуляция спинного мозга. А – схема электрической стимуляции в фазы шагательного цикла Т11 – стимуляция на уровне Т11–Т12, L1 – электростимуляция на уровне L1–L2 позвонков, Кнч – траектория движения конечной антропометрической точки в сагиттальной плоскости. а – стимуляция в фазе опоры, б – стимуляция в фазе переноса, в – пространственно-временнáя стимуляция. Б – схема измерения углов в суставах и линейных перемещений антропометрических точек. Плч, Врт, Вбц, Нбц, Кнч – плечевая, вертельная, верхнеберцовая, нижнеберцовая, конечная антропометрические точки, соответственно. 1, 2, 3 – тазобедренный, коленный, голеностопный суставные углы, соответственно. Х, Z – сагиттальное и вертикальное направления движения, соответственно.
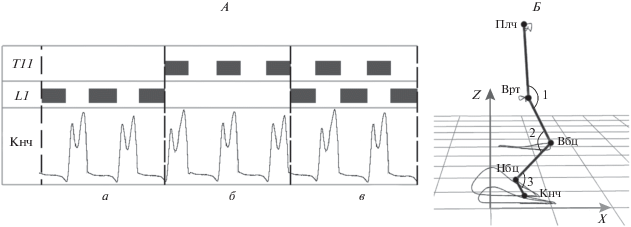
Кинематические характеристики движений регистрировали с использованием системы 3D-видеозахвата движений “Qualisys” (Qualisys, Швеция). Данная система включала 8 высокоскоростных камер Oqus, располагаемых по периметру вокруг испытуемого. Анализ движений осуществляли в трехмерном пространстве в программной среде Qualisys Track Manager. Частота кадров видеозахвата составляла 500 Гц. Для регистрации перемещения сегментов тела использовали светоотражающие маркеры, которые прикрепляли к опорным точкам тела, совпадающих с осями движения в плечевом, тазобедренном, коленном и голеностопном суставах, они фиксировались на билатеральных антропометрических точках: плечевой, вертельной, верхнеберцовой, нижнеберцовой, конечной (над пятым пальцем стопы) (рис. 1, Б).
Синхронно с кинематическими характеристиками шага, посредством 16-канальной телеметрической системы ME6000 и соответствующей программы MegaWin (MegaElectronics LTD, Финляндия) регистрировали биоэлектрическую активность скелетных мышц нижних конечностей: m. tibialis anterior (TA); m. gastrocnemius medialis (GM); m. vastus lateralis (VL); m. biceps femoris (BF). Регистрацию электромиограмм (ЭМГ) скелетных мышц осуществляли накожными одноразовыми самоклеющимися электродами с токопроводящим гелем с активной площадью контакта 2.5 см2. Электроды накладывали биполярно с дополнительным электродом заземления на каждой мышце. ЭМГ-сигналы усиливали биоусилителем (ME6000) с полосой пропускания частот от 10 до 10 КГц и оцифровывали с частотой 2000 Гц. Регистрация ЭМГ была аппаратно синхронизирована с системой видеозахвата движений. Последующий анализ позволял однозначно соотносить участки регистрации ЭМГ с фазами шага.
В процессе проведения исследования испытуемые шли по движущейся ленте тредбана “Venus” (HP Cosmos, Австрия) с постоянной скоростью 1.5 км/ч в различных экспериментальных условиях: ходьба без стимуляции (контроль), ходьба с ЧЭССМ экстензорных мотонейронных пулов в фазах опоры, ходьба со стимуляцией, направленной на активацию флексорных пулов в фазах переноса ноги, чередующаяся ЧЭССМ флексорных и экстензорных пулов в фазах переноса и опоры, соответственно.
В эпоху анализа были включены 8 шагательных циклов в каждом экспериментальном условии. При анализе ЭМГ граничными событиями фазы опоры являлись постановка конечной антропометрической точки на поверхность тредбана и ее отрыв; фазы переноса – ее отрыв и постановка, соответственно. Рассчитывали среднегрупповые значения продолжительности шагательного цикла и каждой фазы шага (с), амплитуды движений в тазобедренном, коленном и голеностопном суставах (угл. град), линейные перемещения движений верхнеберцовой, нижнеберцовой и конечной антропометрических точек по вертикальной и сагиттальной осям (мм) (рис. 1, Б) и амплитуды ЭМГ-активности скелетных мышц (мкВ). Зарегистрированные ЭМГ предварительно сглаживались в интервалах 0.002 с и нормировались к ЭМГ-активности каждой мышцы при произвольной ходьбе без стимуляции. Рассчитывали среднюю амплитуду ЭМГ в фазах шагательных циклов в среднем по группе испытуемых.
Коэффициент реципрокности – степень активации мышцы-антагониста в процентах по отношению к активности мышцы-агониста рассчитывали по формуле: амплитуда ЭМГ антагониста (в режиме напряжения агониста)/амплитуда ЭМГ агониста (в режиме напряжения агониста) × 100% [12]. Коэффициент реципрокности рассчитывали по средним значениям амплитуды ЭМГ в фазах опоры и переноса для мышц-антагонистов бедра и голени.
Для оценки достоверности различий при сравнении параметров в разных экспериментальных условиях использовали однофакторный дисперсионный анализ (ANOVA) с Post-Hoc анализом по критерию Newman-Keuls. Различия считали значимыми при p < 0.05. В некоторых случаях рассчитывали изменения, выраженные в процентах. В связи со значительным разбросом индивидуальных значений среднегрупповые данные были нормированы, при этом за единицу принимали усредненные значения, полученные при произвольной ходьбе без стимуляции.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Характеристики шагательных движений при ходьбе без стимуляции. При ходьбе по движущейся ленте тредбана в отсутствии стимуляции спинного мозга кинематические и ЭМГ-параметры имели следующие характеристики. Длительность одного шагательного цикла составляла 1.63 ± 0.02 с, при этом продолжительность фазы опоры (0.99 ± 0.02 с) была больше длительности фазы переноса (0.64 ± 0.02 с) на 35%. При произвольной ходьбе (Прзв) средняя амплитуда движений в тазобедренном суставе в фазе опоры составляла 11 угл. град (разгибание), а в фазе переноса – 15 угл. град (сгибание) (рис. 2, А). В коленном суставе амплитуда разгибания в фазе опоры – 26 угл. град, а сгибания в фазе переноса – 48 угл. град. В голеностопном суставе эти показатели составляли 19 угл. град (опора) и 14 угл. град (перенос), соответственно. Таким образом, амплитуда движений в тазобедренном и коленном суставах больше в фазе переноса, чем в фазе опоры, а в голеностопном – напротив, в фазе опоры больше, чем в фазе переноса.
Рис. 2.
Кинематические параметры движений правой ноги. А – изменения суставных углов при ходьбе без стимуляции (Прзв) и при стимуляции на уровне позвонков L1, T11 и L1 + T11 (М ± m). а – стимуляция в фазе опоры, б – стимуляция в фазе переноса. 1 – Прзв, 2 – L1, 3 – Т11 + L1, 4 – Т11. Амплитуды движений (разгибаний и сгибаний) в тазобедренном (Тзб), коленном (Клн) и голеностопном (Глн) суставах. Амплитуды линейных перемещений антропометрических точек по сагиттальной (Б) и вертикальной (В) осям. Вбц, Нбц, Кнч – верхнеберцовая, нижнеберцовая, конечная антропометрические точки, соответственно.
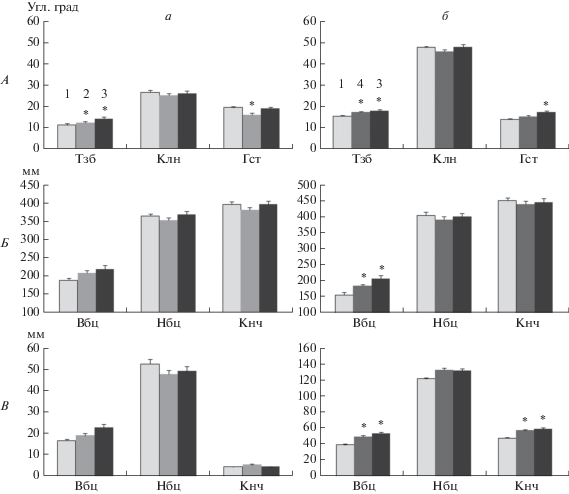
Перемещение антропометрических точек по сагиттальной оси характеризовало перемещение суставов по направлению ходьбы, а по вертикальной – перпендикулярно этому направлению (рис. 1, Б, 2, Б, В). При ходьбе без стимуляции в фазе опоры средняя амплитуда перемещения верхнеберцовой антропометрической точки (колена) по сагиттальной оси составляла 188 мм и была незначительно больше перемещения в фазе переноса (156 мм). Амплитуда движений нижнеберцовой (голеностоп) и конечной точек по этой оси в фазе опоры были меньше, чем в фазе переноса. Средняя амплитуда перемещений голеностопа в фазе опоры составляла 364 мм, в фазе переноса – 403 мм. Амплитуда перемещения конечной точки по сагиттальной оси была больше амплитуды движения других регистрируемых точек и составляла в фазе опоры 395 мм и в фазе переноса 449 мм. По вертикальной оси в фазе опоры движения колена составляли 16 мм, голеностопа – 52 мм и конечной антропометрической точки – 4 мм. Различия в амплитудах вертикальных движений голеностопа и конечной точки в фазе опоры обусловлены алгоритмом деления шагательного цикла на фазы – контакт конечной точки с опорой и отрыв от нее делили шагательный цикл на фазы. Пальцы стопы (конечная точка) были на опоре, когда пятка (нижнеберцовая антропометрическая точка) начинала отрыв от опоры. В фазе переноса перемещения по вертикальной оси колена, голеностопа и конечной точки составили 39, 122 и 48 мм, соответственно.
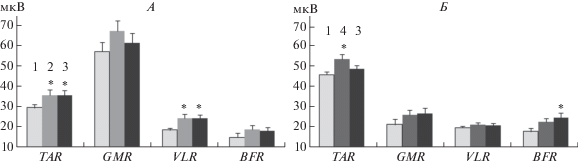
Анализ ЭМГ-активности скелетных мышц, зарегистрированной при ходьбе по движущейся ленте тредбана без стимуляции, выявил, что активность дистальных мышц была больше, чем активность проксимальных (рис. 3). В фазе опоры средняя ЭМГ-активность GM составляла 57 мкВ, что на 63% больше по сравнению с активностью в фазе переноса (29 мкВ). Средняя активность ТА была на 56% больше в фазе переноса (46 мкВ), чем в фазе опоры. Активность VL и BF в фазе переноса была больше, чем в фазе опоры на 6 и 18%, соответственно. Коэффициент реципрокности мышц-антагонистов голени в фазе опоры составляли 52%, в фазе переноса – 46%. Коэффициент реципрокности мышц бедра в фазе опоры был 81%, в фазе переноса – 111%.
Рис. 3.
Изменения ЭМГ-активности скелетных мышц правой ноги. А – в фазах опоры. Б – в фазах переноса. 1 – ходьба без стимуляции, 2 – при стимуляции мотонейронных пулов корешков спинного мозга на уровне позвонков L1, 3 – чередующейся стимуляции на уровнях L1 и Т11, 4 – стимуляция на уровне T11 (М ± m).
На рис. 4, А показаны кинематические характеристики шагательных движений при ходьбе по движущейся ленте тредбана (контроль), при активации (L1) экстензорных моторных пулов в фазе опоры, при активации (Т11) флексорных моторных пулов в фазе переноса и при пространственно-временнóй активации L1 и T11 экстензорных и флексорных моторных пулов в шагательном цикле.
Рис. 4.
Кинематические и ЭМГ-характеристики шагательных движений при ходьбе без стимуляции (Прзв), а также при стимуляции на уровне L1, T11 и L1 + T11. A – стик-диаграммы, показывающие движение ноги в фазах опоры и переноса. Траектория движения конечной антропометрической точки в одном шагательном цикле. Б – ЭМГ-характеристики движения правой ноги при воздействии на экстензорные и флексорные мотонейронные пулы. Испытуемый М.Б. BF – m. biceps femoris, VL – m. vastus lateralis, GM – m. gastrocnemius medialis, TA – m. tibialis anterior. Тзб, Клн, Глн – тазобедренный, коленный, голеностопный суставы, соответственно. П – знак производной углового ускорения движений правого тазобедренного сустава (см. Методика), фаза опоры внизу, фаза переноса вверху. L1, Т11 – уровни электрической стимуляции. Калибровка ЭМГ в мкВ, гониограмм в угл. град. Испытуемый Д.Г.
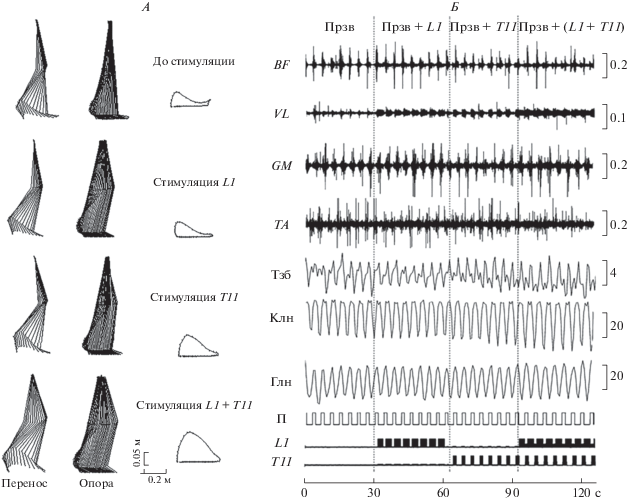
Анализ стик-диаграмм (реконструированный шагательный цикл) показал, что при всех условиях стимуляции происходят видимые изменения углов в тазобедренном, коленном и голеностопном суставах, изменяется также траектория движения конечной точки в шагательном цикле. Так, при стимуляции L1 у некоторых испытуемых заметно увеличение амплитуды движений в коленном суставе, свидетельствующее об усилении проталкивания конечности, однако при этом траектория движения конечной точки изменяется незначительно. При стимуляции Т11 значительно увеличивается подъем конечной точки, этот эффект выражен сильнее при пространственно-временнóй стимуляции L1 + T11. При этом происходит увеличение высоты подъема и длины общей траектории движения (рис. 4, А) и увеличение амплитуды движений в суставах и активности регистрируемых мышц по сравнению с ходьбой без стимуляции (рис. 4, Б).
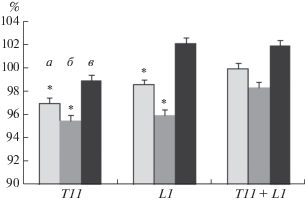
Характеристики шагательных движений при стимуляции L1. Активация экстензорных мотонейронных пулов (стимуляция L1) в фазе опоры сопровождалась сокращением длительности шагательного цикла на 3% (p < 0.05) относительно ходьбы без стимуляции за счет уменьшения длительности фазы опоры на 4% (p < 0.05), при этом продолжительность фазы переноса практически не изменялась (рис. 5).
Рис. 5.
Относительная длительность фаз шагательного цикла правой ноги по сравнению с ходьбой без стимуляции. L1, Т11 – уровни электрической стимуляции (данные нормированы в процентах). Достоверность различий по отношению к ходьбе без стимуляции: * – p < 0.05. а – шагательный цикл, б – опора, в – перенос.
Стимуляция L1 в фазе опоры ноги приводила к увеличению амплитуды разгибания в тазобедренном суставе на 11% (p < 0.05), но при этом амплитуда разгибания в коленном и голенном суставах сократились на 6 и 17% (p < 0.05), соответственно (рис. 2, А). Статистически значимых изменений амплитуды движений антропометрических точек в фазе опоры при стимуляции в этой фазе выявлено не было (рис. 2, Б, В).
Воздействие на экстензорные мотонейронные пулы в фазе опоры приводило к относительно равному увеличению активности флексорных и экстензорных мышц по сравнению с ходьбой без стимуляции (рис. 3). Усредненная активность GM в фазе опоры составляла – 67 мкВ, что на 17% больше, чем в контроле. Увеличение активности VL составило 31% (p < 0.05) и достигло 24 мкВ. Эти данные показывают, что активность экстензорных мышц бедра и голени росла в фазе опоры при стимуляции L1. Выявлено также повышение активности флексорных мышц ТА на 21% (p < 0.05) и BF на 26% в фазе опоры (рис. 3). Вследствие этого коэффициент реципрокности в фазе опоры увеличился по сравнению с ходьбой без стимуляции для мышц голени на 3.5% и уменьшился для мышц бедра на 3.7%.
Таким образом, активация экстензорных мотонейронных пулов (L1) в фазе опоры уменьшала длительность нахождения ноги на опоре, увеличивала амплитуду разгибания в тазобедренном суставе, уменьшала – в голеностопном суставе и достоверно увеличивала активность экстензорных мышц бедра и флексорных мышц голени.
Характеристики шагательных движений при стимуляции T11. Активация флексорных мотонейронных пулов при стимуляции Т11 в фазе переноса приводила к недостоверному увеличению длительности этой фазы (на 1.6%). При такой стимуляции достоверно уменьшались длительность фазы опоры на 3.0% (p < 0.05) и шагательного цикла в целом на 1.2% (p < 0.05) (рис. 5).
Анализ показал, что при стимуляции Т11 происходило увеличение амплитуды сгибаний в тазобедренном суставе на 12% (p < 0.05) и голеностопном – на 10% (рис. 2, Б). Вместе с тем в фазе переноса наблюдалось увеличение выноса колена вперед, о чем свидетельствовало повышение размаха движений по сагиттальной оси верхнеберцовой точки на 18% (p < 0.05) (рис. 2, В). При этом длина шага не увеличилась, так как амплитуда движений конечной точки по сагиттальной оси не изменилась. В фазе переноса происходило достоверное увеличение подъема колена на 25% (p < 0.05), увеличение подъема голеностопа на 9% и конечной антропометрической точки на 19% (p < 0.05).
При стимуляции на уровне Т11 увеличивалась активность флексорных мышц (рис. 3). Так, активность ТА увеличилась на 14% (p < 0.05), а активность BF на 18%. Активность мышц-антагонистов увеличилась в фазе переноса незначительно. Коэффициент реципрокности мышц голени в фазе переноса увеличился на 4.9%, а мышц бедра, напротив, снизился на 14.8% по отношению к контрольным значениям.
Таким образом, активация флексорных мотонейронных пулов в фазе переноса приводила к увеличению частоты шага за счет сокращения длительности фазы опоры, вызывала увеличение амплитуды сгибаний в тазобедренном суставе, что отразилось в значимом увеличении подъема колена и конечной антропометрической точки. Зарегистрировано увеличение активности мышц BF и TA и коэффициента реципрокности в мышцах бедра и голени.
Характеристики шагательных движений при стимуляции L1 + T11. Пространственно-временнáя (чередующаяся) стимуляция на уровне L1 и Т11, направленная на активацию экстензорных и флексорных мышц в фазах опоры и переноса, соответственно, не изменяла достоверно длительность шагательного цикла и фаз шага (рис. 5). При чередующейся стимуляции в фазе опоры увеличивалась амплитуда разгибания в тазобедренном суставе по отношению к ходьбе без стимуляции на 27% (p < 0.05). Достоверные изменения амплитуды разгибания в других суставах и линейных перемещений всех суставов не зарегистрированы (рис. 2).
В фазе переноса такая стимуляция увеличивала амплитуду сгибания в тазобедренном суставе на 16% (p < 0.05) и голеностопном – на 24% (p < < 0.05) (рис. 2, Б). Амплитуда сгибаний в коленном суставе в фазе переноса ноги не изменялась. В фазе переноса зарегистрировали значительный подъем колена на 36% (p < 0.05) и подъем конечной антропометрической точки на 23% (p < 0.05) (рис. 2, В).
Чередующаяся ритмическая стимуляция на уровне L1 и T11 оказывала влияние на флексорные и экстензорные мышцы как в фазе опоры, так и в фазе переноса. В фазе опоры происходило увеличение активности флексорных мышц TA и BF на 21% (p < 0.05) и на 20%, соответственно, а экстензорных мышц GM и VL на 7 и 30%, соответственно (рис. 3). При этом в фазе опоры коэффициент реципрокности мышц голени увеличился на 12.6%, мышц бедра уменьшился на 7.7%.
В фазе переноса наблюдалось увеличение активности экстензорной GM на 26% и флексорной BF на 39% (p < 0.05) по отношению к ходьбе без стимуляции (рис. 3). Коэффициент реципрокности мышц голени увеличился на 18.1%, мышц бедра – уменьшился на 24.2%.
Таким образом, при пространственно-временнóй стимуляция на уровне L1 и Т11 в обеих фазах шага зарегистрированы изменения характеристик шага, воспроизводящие основные изменения, которые наблюдали при стимуляции экстензорных пулов в фазе опоры и флексорных пулов в фазе переноса: в фазе опоры увеличивается амплитуда движений в тазобедренном суставе, в фазе переноса увеличивается амплитуда сгибаний в тазобедренном суставе и увеличивается подъем колена и конечной антропометрической точки над опорой. Реципрокность мышц-антагонистов голени увеличивается и мышц бедра уменьшается. При этом абсолютная мера активности мышц, обеспечивающих выполнение соответствующей фазы шага, была наибольшей в паре агонист-антагонист. В фазе опоры активность экстензорной мышцы GM составляла 61 ± 5 мкВ, а флексорной мышцы ТА – 36 ± 2 мкВ и наоборот, в фазе переноса активность ТА составляла 49 ± 2 мкВ, а GM – 27 ± 3 мкВ. Аналогичное соотношение было для мышц бедра (рис. 3).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В настоящем исследовании описан новый способ регуляции шагательных движений у человека посредством неинвазивной стимуляции спинного мозга для воздействия на флексорные/экстензорные моторные пулы нижних конечностей в шагательном цикле. Способ пространственно-временнóй стимуляции локомоторных структур спинного мозга сочетает в себе рефлекторную активацию моторных пулов и активацию локомоторных нейронных сетей. Получены новые данные, показывающие возможность чрескожной стимуляции адресно воздействовать на моторные пулы нижних конечностей и управлять их активностью для регуляции фаз шагательного цикла при локомоции человека.
Регуляция локомоторной активности при пространственно-временнóй стимуляции спинного мозга. С помощью специально разработанной системы, детектировали фазу опоры и фазу переноса конечности и активировали соответственно флексорные и экстензорные моторные пулы нижних конечностей в строго определенные периоды шагательного цикла. Точность детектирования была достаточно высокой и это позволяло наносить стимулирующие воздействия в одни и те же временны́е интервалы внутри шагательного цикла.
Пространственно-временнáя ритмическая активация экстензорных пулов в фазе опоры (L1), а флексорных пулов в фазе переноса (T11) изменяла характеристики шагательных движений. Особенно отчетливым был эффект при активации флексорных моторных пулов при переносе конечности. Согласно усредненным данным при активации флексоров подъем колена по вертикальной оси увеличивался на 36% (p < 0.05) а подъем конечной антропометрической точки на 23% (p < 0.05) по сравнению с ходьбой без стимуляции (рис. 2, В). Стимуляция в фазе опоры давала не столько выраженный эффект в виду того, что конечность, находящаяся в опоре, продолжала двигаться за счет перемещения ленты тредбана и это пассивное перемещение конечности накладывалось на эффект стимуляции. Тем не менее, стимуляция сказывалась на продолжительности фазы опоры, в сторону ее сокращения.
Полученные результаты позволяют говорить о следующих закономерностях. Активация экстензорных моторных пулов в фазе опоры уменьшает длительность нахождения ноги на опоре, увеличивает амплитуду разгибания в тазобедренном суставе, увеличивает активность экстензорных мышц бедра и флексорных мышц голени. Активация флексорных моторных пулов в фазе переноса приводит к увеличению сокращения длительности фазы опоры, увеличению амплитуды сгибаний в тазобедренном суставе и увеличению подъема колена и конечной антропометрической точки и увеличению активности флексорных мышц BF и TA (рис. 2, 3, 5). При пространственно-временнóй стимуляции (L1 + Т11) в фазе опоры увеличивается амплитуда движений в тазобедренном суставе, в фазе переноса увеличивается амплитуда сгибаний в тазобедренном суставе и увеличивается подъем колена и конечной антропометрической точки над опорой. Таким образом, можно сделать заключение о том, что при чередующейся стимуляции двух уровней (L1 – в фазе опоры и T11 – в фазе переноса) происходят такие же изменения характеристик шага в каждой фазе, какие наблюдали в фазе опоры при активации экстензорных пулов (L1) без стимуляции в фазе переноса и в фазе переноса при стимуляции флексорных пулов (T11) без стимуляции в фазе опоры. Однако при чередующейся ритмической L1 + T11 стимуляции происходит не просто суммация двух воздействий, а их интеграция.
Следует заметить, что при ходьбе по тредбану скорость движения ленты определяет частоту и длительность шага, поэтому это обстоятельство необходимо учитывать при интерпретации эффектов пространственно-временнóй стимуляции на кинематические характеристики шагательных движений. В этом смысле, хорошим индикатором эффективности стимуляции являются показатели ЭМГ-активности проксимальных и дистальных мышц нижних конечностей. Анализ полученных результатов показал, что при пространственно-временнóй стимуляции происходит коактивация мышц-антагонистов, т.е. увеличивается коэффициент реципрокности. При этом абсолютная мера активности мышц, обеспечивающих выполнение соответствующей фазы шага в паре агонист-антагонист, является превалирующей. Так, если в фазе опоры активность экстензорной мышцы GM составляла 61 ± 5 мкВ, а флексорной мышцы ТА – 36 ± 2 мкВ, то в фазе переноса активность ТА составляла 49 ± 2 мкВ, а GM – 27 ± ± 3 мкВ. Аналогичное соотношение было для мышц бедра (рис. 3). Увеличение активности мышц агонистов в определенную фазу шага сопровождалось изменениями амплитуды движений в суставах и, как следствие, их линейных перемещений (рис. 2).
Нейрофизиологические корреляты локомоторной активности при неинвазивной стимуляции спинного мозга. Электрическая стимуляция спинного мозга для регуляции локомоторной функции известна уже более 20 лет. В 1998 г. впервые было показано, что с помощью эпидуральной стимуляции спинного мозга можно инициировать ритмический шагательный ЭМГ-паттерн у парализованных пациентов [13]. Это было прямым доказательством существования у человека нейронных спинальных сетей, названных генераторами шагательных движений [14–16]. Можно предположить, что активация генераторов шагательных движений при эпидуральной стимуляции происходит через активацию афферентов группы I и группы II в дорсальных корешках [17].
Неинвазивная чрескожная стимуляция спинного мозга для управления локомоторной функцией предложена относительно недавно. Установлено, что у здоровых испытуемых в условиях горизонтальной вывески ног [18] чрескожная стимуляция в области поясничного утолщения может инициировать непроизвольные шагоподобные движения [3, 19]. В аналогичных услових внешней поддержки ног, ритмические движения удавалось также инициировать у пациентов с полным моторным поражением спинного мозга [3]. Несмотря на эти факты, чрескожная стимуляция остается “terra incognita”, т. к. не понятно каким образом стимуляция, наносимая на кожную поверхность спины над позвоночником, обеспечивает адресность воздействия на спинальные локомоторные структуры. Экспериментальные исследования на децеребрированных кошках подтвердили, что накожная стимуляция может инициировать локомоцию не менее эффективно, чем эпидуральная стимуляция [20]. Сравнительный анализ организации рефлекторной активности у человека при эпидуральной и чрескожной стимуляции выявил их общие свойства. С использованием методов компъютерного моделирования было показано, что при обоих видах стимуляции происходит активация одних и тех же афферентных волокон дорсальных корешков [21, 22]. Доказано, что вызванные моторные мышечные потенциалы как при эпидуральной, так и при накожной стимуляции являются моносинаптическими рефлексами вследствие активации афферентов группы Iа в дорсальных корешках [17]. При увеличении интенсивности стимуляции порядок вовлечения в активность волокон дорсальных и вентральных корешков при эпидуральной и чрескожной стимуляции является одинаковым. Первыми вовлекаются в активность волокна дорсальных корешков, вызывающие моно-и полисинаптические рефлексы, затем волокна вентральных корешков, вызывающие прямые мышечные ответы и третьими по счету активируются волокна дорзальных столбов [22]. Таким образом можно заключить, что эпидуральная и чрескожная стимуляция имеют общие механизмы активации спинальных нейронных структур, в том числе и структур регулирующих локомоторную активность.
Может ли неинвазивная стимуляция селективно активировать нейронные сети и моторные пулы? Было показано, что неинвазивная мультисегментарная стимуляция одновременно воздействующая на шейный (С5), нижнегрудной (Т11) и поясничный (L1) отделы позвоночника значительно эффективнее регулирует локомоторную активность человека, по сравнению со стимуляцией только одного (T11) уровня [3]. Эти результы позволяют сделать два важных вывода. Во-первых, что неинвазивная стимуляция способна активировать разные нейронные сети, локализованные в разных сегментах: постуральные (L1), локомоторные (Т11) и нейронные сети регулирующие движения верхних конечностей (C5). Во-вторых, что при мультисегментарной стимуляции происходит интеграция этих воздействий, обеспечивающая эффективное управление двигательных функций. Данные с использованием парной стимуляции и стимуляции, прикладываемой к L2 и S1 с определенными временны́ми задержками относительно друг друга (кондиционирование-тестирование) показывают, что чрескожная стимуляция может дифференцированно активировать селективные моторные пулы через афферентные волокна дорсальных корешков и индуцировать модуляторные эффекты в зависимости от характеристик пространственно-временнóй стимуляции [23].
Другим аргументом в пользу возможности селективной активации моторных пулов при неинвазивной стимуляции спинного мозга служат данные о разном характере рекрутирования проксимальных и дистальных мышц ног, иннервируемые разными спинальными сегментами при активации их моторных пулов. Установлено, что при стимуляции на уровне T11 первыми в активность вовлекаются мышцы бедра, а при стимуляции L1 – мышцы голени [23].
Данные, полученные при эпидуральной стимуляции этих сегментов, также свидетельствуют о возможности селективной активации флексорных и экстензорных моторных пулов нижних конечностей [9].
Недавно была предпринята попытка управлять шагательными движениями у спинальных пациентов, используя эпидуральную пространственно-временнýю стимуляцию, воздействующую на флексорные-экстензорные моторные пулы нижних конечностей в шагательном цикле [9]. Получены обнадеживающие результаты, демонстрирующие, что пациенты в услових внешней поддержки веса тела при пространственно временнóй стимуляции моторных пулов могли инициировать и осуществлять шагательные движения. Эти результаты дают основание говорить об обоснованности использования стратегии адресной стимуляции флексорных\экстензорных моторных пулов для регуляции локомоции человека, а возможность использования для этих целей неинвазивной чрескожной стимуляции спинного мозга делает эту технологию уникальной.
ЗАКЛЮЧЕНИЕ
В настоящем исследовании впервые предложен способ неинвазивной чрескожной пространственно-временнóй стимуляции спинного мозга, воздействующей на флексорные/экстензорные моторные пулы в шагательном цикле. Показано, что с помощью такой стимуляции можно управлять фазами шагательного цикла, регулируя фазу опоры и фазу переноса конечности. Тот факт, что при стимуляции флексоров в фазе переноса происходит значительный подъем конечности, позволяет предположить, что такая стимуляция может быть эффективной для управления движениями паретичной ноги у пациентов с нарушением мозгового кровообращения для устранения волочения стопы и восстановления координированной ходьбы.
Этические нормы. Все исследования проведены в соответствии с принципами биомедицинской этики, сформированными в Хельсинкской декларации 1964 г. и ее последующими обновлениями, и одобрены локальным биоэтическим комитетом Великолукской государственной академии физической культуры и спорта (Великие Луки).
Информированное согласие. Каждый участник исследования представил добровольное письменное информированное согласие, подписанное им после разъяснения ему потенциальных рисков и преимуществ, а также характера предстоящего исследования.
Финансирование работы. Работа выполнена при поддержке НИР с ООО “Косима” № 2/2019 от 01.12.2019 в рамках проекта НТИ “Разработка нейростимуляционного устройства для регуляции двигательных функций у больных с последствиями острого нарушения мозгового кровообращения” и Программой “Фундаментальные научные исследования для долгосрочного развития и обеспечения конкурентоспособности общества и государства” (проект № АААА-А18-118 050 890 115-9).
Благодарности. Авторы благодарны Н.Д. Шандыбиной за помощь в анализе электромиограмм.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией данной статьи.
Список литературы
Михайлова Е.А., Козлов В.А., Ершов В.Ю., Городничев Р.М. Повышение эффективности маховых движений при беге посредством чрескожной электрической стимуляции спинного мозга // Теория и практика физической культуры. 2015. № 6. С. 29. Mikhaylova E.A., Kozlov V.A., Ershov V.Y., Gorodnichev R.M. [Enhancement of running swinging efficiency via transcutaneous electrical stimulation of spinal cord] // Teoriya i Praktika Fizicheskoy Kultury. 2015. № 6. P. 29.
Gerasimenko Y.P., Gorodnichev R., Machueva E. et al. Novel and Direct Access to the Human Locomotor Spinal Circuitry // J. Neuroscience. 2010. V. 30. № 10. P. 3700.
Gerasimenko Y.P., Lu D.C., Modaber M. et al. Noninvasive Reactivation of Motor Descending Control after Paralysis // J. Neurotrauma. 2015. V. 32. № 24. P. 1968.
Sayenko D.G., Rath M., Ferguson A.R. et al. Self-Assisted Standing Enabled by Non-Invasive Spinal Stimulation after Spinal Cord Injury // J. Neurotrauma. 2019. V. 36. № 9. P. 1435.
Solopova I.A., Sukhotina I.A., Zhvansky D.S. et al. Effects of spinal cord stimulation on motor functions in children with cerebral palsy // Neuroscience Letter. 2017. V. 639. P. 192.
Ward A.R. Electrical Stimulation Using Kilohertz-Frequency // Alternating Current Physical Therapy. 2009. V. 89. № 2. P. 181.
Benavides F.D., Jo H.J., Lundell H. et al. Cortical and Subcortical Effects of Transcutaneous Spinal Cord Stimulation in Humans with Tetraplegia // J. Neuroscience. 2020. V. 40. № 13. P. 2633.
Kendall F.P., Kendall McCreary E., Provance P.G. et al. Muscles, testing and function: with posture and pain. 5th ed. Baltimore, MD: Williams & Wilkins, 2005. 556 p.
Sharrard W.J. The segmental innervation of the lower limb muscles in man: Arris and Gale lecture delivered at the Royal College of Surgeons of England on 2nd January 1964 // Ann. R. Coll. Surg. Engl. 1964. V. 35. № 2. P. 106.
Wagner F.B., Mignardot J.-B., Goff-Mignardot C.G. et al. Targeted neurotechnology restores walking in humans with spinal cord injury // Nature. 2018. V. 563. P. 65.
Grishin A.A., Moshonkina T.R., Solopova I. et al. A five-channel noninvasive electrical stimulator of the spinal cord for rehabilitation of patients with severe motor disorders // Biomedical Engineering. 2017. V. 50. № 5. P. 300.
Команцев В.Н., Заболотных В.А. Методические основы клинической электронейромиографии. СПб.: Лань, 2001. 350 с.
Dimitrijevic M.R., Gerasimenko Y., Pinter M.M. Evidence for a spinal central pattern generator in humans // Ann. N.Y. Acad. Sci. 1998. V. 860. P. 360.
Bussel B., Roby-Brami A., Azouvi P. et al. Myoclonus in a patient with spinal cord transection. Possible involvement of the spinal stepping generator // Brain. 1988. V. 111. Pt 5. P. 1235.
Dietz V. Central pattern generator // Paraplegia. 1995. V. 33. № 12. P. 739.
Gerasimenko Y.P., Avelev V.D., Nikitin O.A., Lavrov I.A. Initiation of locomotor activity in spinal cats by epidural stimulation of the spinal cord // Neurosci. Behav. Physiol. 2003. V. 33. № 3. P. 247.
Minassian K., Persy I., Rattay F. et al. Posterior root-muscle reflexes elicited by transcutaneous stimulation of the human lumbosacral cord // Muscle Nerve. 2007. V. 35. № 3. P. 327.
Gurfinkel V.S., Levik Y.S., Kazennikov O.V., Selionov V.A. Locomotor-like movements evoked by leg muscle vibration in humans // Eur. J. Neurosci. 1998. V. 10. № 5. P. 1608.
Городничев Р.М., Пивоварова Е.А., Пухов А.М. и др. Чрезкожная электрическая стимуляция спинного мозга: неинвазивный способ активации генераторов шагательных движений у человека // Физиология человека. 2012. Т. 38. № 2. С. 158. Gorodnichev R.M., Pivovarova E.A., Pukhov A.M. et al. Transcutaneous electrical stimulation of the spinal cord: non-invasive tool for activation of locomotor circuitry in human // Human Physiology. 2012. V. 38. № 2. P. 158.
Musienko P., Courtine G., Tibbs J.E. et al. Somatosensory control of balance during locomotion in decerebrated cat // J. Neurophysiology. 2012. V. 107. № 8. P. 2072.
Ladenbauer J., Minassian K., Hofstoetter U.S. et al. Stimulation of the human lumbar spinal cord with implanted and surface electrodes: a computer simulation study // IEEE Trans. Neural Syst.Rehabil. Eng. 2010. V. 18. № 6. P. 637.
Danner S.M., Hofstoetter U.S., Ladenbauer J. et al. Can the human lumbar posterior columns be stimulated by transcutaneous spinal cord stimulation? A modeling study // J. Artificial Organs. 2011. V. 35. № 3. P. 257.
Sayenko D.G., Atkinson D.A., Dy C.J. et al. Spinal segment-specific transcutaneous stimulation differentially shapes activation pattern among motor pools in humans // J. Appl. Physiol. 2015. V. 118. № 11. P. 1364.
Дополнительные материалы отсутствуют.
Инструменты
Физиология человека


