Физиология человека, 2021, T. 47, № 1, стр. 94-103
Изменение профиля белков мочи, ассоциированных с сердечно-сосудистой системой у здоровых юношей в ответ на локомоторный тест со ступенчато-возрастающей нагрузкой
Л. Х. Пастушкова 1, И. М. Ларина 1, Е. В. Фомина 1, 2, 3, В. Б. Русанов 1, *, А. Г. Гончарова 1, А. М. Носовский 1, Д. Н. Каширина 1, Н. Ю. Лысова 1, Н. С. Дидковская 1, 2, А. Г. Бржозовский 1, И. Н. Гончаров 1, О. И. Орлов 1
1 ФГБУН ГНЦ РФ – Институт медико-биологических проблем РАН
Москва, Россия
2 ФГОБОУ ВО Московский педагогический государственный университет
Москва, Россия
3 Российский университет дружбы народов
Москва, Россия
* E-mail: vasilyrusanov@gmail.com
Поступила в редакцию 29.04.2020
После доработки 13.07.2020
Принята к публикации 02.09.2020
Аннотация
Перспективы межпланетных миссий делают актуальной разработку стандартных тестов для поиска критериев коррекции профилактических мероприятий в длительном космическом полете (КП) с целью обеспечения пика физической работоспособности к моменту выполнения межпланетной деятельности. Одним из них может быть разрабатываемый в настоящее время локомоторный тест со ступенчато-возрастающей нагрузкой в активном режиме движения полотна беговой дорожки. Представляет интерес оценка влияния этой нагрузки на изменение профиля белков, ассоциированных с сердечно-сосудистой системой с позиции возможности их использования в качестве маркеров ее реакции на физическую нагрузку. В статье проанализированы результаты экспериментального исследования протеома мочи человека после дозированной ступенчато-возрастающей нагрузки и обсуждена возможная роль выявленных белков, которые могут быть отнесены к функционированию сердечно-сосудистой системы. В исследовании участвовали практически здоровые добровольцы в возрасте 18.6 ± 0.7 лет, весом 75.7 ± 8 кг (n = 12). Протеом мочи оценивался хромато-масс-спектрометрически и анализировался биоинформационными методами. Впервые представлены данные протеомного ответа на локомоторный тест со ступенчато-возрастающей нагрузкой в активном режиме движения полотна в однородной по вегетативному статусу группе. В результате анализа было идентифицировано 429 белков, 69 из которых достоверно изменились. На основе биоинформационного анализа были выделены процессы, связанные с работой сердца, тонусом и проницаемостью сосудов. Описаны 10 белков, связанных с процессами быстрого ответа сердечно-сосудистой системы на дозированную физическую нагрузку. Полученные результаты помогут в выборе стандартных критериев оценки физиологической стоимости физической нагрузки.
Принципы индивидуальной оценки работоспособности и персонифицированного подхода в купировании негативных изменений в системах вегетативного обеспечения мышечной деятельности во время космического полета (КП) реализуются в экспертных пробах. Физическая нагрузка вызывает адренергическую стимуляцию сердца и сосудов, увеличивая потребление кислорода, что отражается на вариабельности сердечного ритма (ВСР), давлении и индексе жесткости сосудов, являющихся доступными для анализа показателями функционального состояния сердечно-сосудистой системы. При этом увеличение скорости кровотока обеспечивается вазодилатацией сосудов скелетных мышц, что требует увеличения сердечного выброса и облегчается повышением артериального давления (АД). Изменения гемодинамики, которые приводят к увеличению сердечного выброса, АД, сосудистого тонуса, являются результатом взаимодействия множества вазодилататоров и вазоконстрикторов, включая нейрогормоны, эндотелиальные и миокардиальные факторы [1–3].
Учитывая особенности ответов на физическую нагрузку лиц с доминированием симпатических и парасимпатических влияний, целесообразно формировать группы добровольцев по сходству особенностей вегетативной регуляции. Интегральной характеристикой для оценки текущего функционального состояния и физиологической однородности группы может являться ВСР, отражающая активность координирующей системы, суммарный эффект регуляции и вегетативный гомеостаз [4–8].
Ранее нами выполнялся анализ изменения состава белков и “присутственность” в образцах мочи протеинов, экспрессируемых почками и клетками выделительной системы в ответ на локомоторную физическую нагрузку, выполняемую в пассивном режиме движения полотна дорожки, т.е. с перемещением полотна посредством силы ног добровольца. Было показано, что после выполнения добровольцами физической нагрузки 4 белка из 9 не меняли частоту выявляемости в моче; 2 (α-метилацил-коэнзим А рацемаза и кубулин) встречались в пробах чаще, а 3 (калликреин-1, остеопонтин и витамин К-зависимый белок Z) – реже. Дрейф белковой композиции в одних случаях ослаблял, а в других активировал комплекс биологических процессов, в которых участвовали данные белки. Мы обнаружили, что проникновение белков в мочу имело положительную корреляцию с их тканевой экспрессией. Селективность гломерулярного барьера при физической нагрузке снижалась, и высокомолекулярные белки легче проникали через него [3].
В настоящее время предпринимаются попытки выявления связи профиля цитокинов с физической работоспособностью человека [9–11]. Показано, что определение биомаркеров, связанных с уровнем физической работоспособности, актуально для оценки состояния здоровья лиц экстремальных профессий [12].
В нашем исследовании изучалось изменение в моче профиля белков, ассоциированных с сердечно-сосудистой системой в результате тестовой физической нагрузки, предлагаемой для оценки уровня работоспособности человека в условиях КП. Моделирование особенностей функционирования сердечно-сосудистой системы в условиях невесомости выполнялось с использованием ранее описанных методик [13], когда доброволец расположен горизонтально, а контакт с вертикальной дорожкой обеспечивается специальным костюмом, используемым для тренировок космонавтов в условиях КП.
Цель работы – определить изменение профиля белков мочи, связанных с сердечно-сосудистой системой, на однократную ступенчато-возрастающую локомоторную нагрузку при моделировании опорной разгрузки.
В рамках исследования решались следующие задачи: уточнение вклада комплекса белков жидкостей человека в быстрый ответ на физическую нагрузку; характеристика основных процессов быстрого ответа сердечно-сосудистой системы юношей на дозированную физическую нагрузку.
МЕТОДИКА
В исследовании принимали участие 12 добровольцев с высоким уровнем двигательной активности (возраст 18.6 ± 0.7 лет, рост 180.3 ± 7.1 см, вес 75.7 ± 8 кг). Исследование проводили в рамках отработки эксперимента с 21-суточной “сухой” иммерсией в Институте медико-биологических проблем РАН (г. Москва).
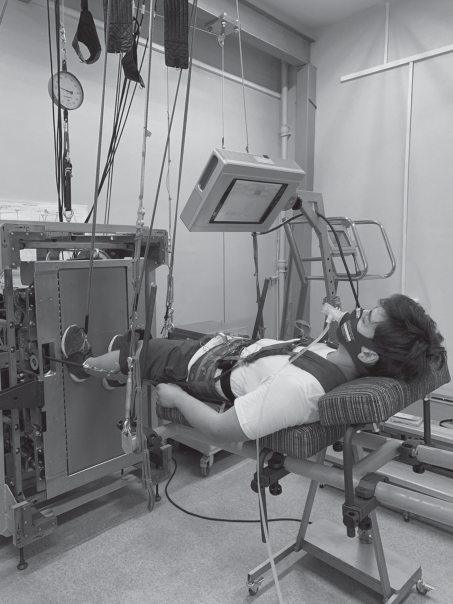
Тест выполнялся на бегущей дорожке БД-2 (ИМБП, Россия) в активном режиме движения полотна дорожки и состоял из 13 ступеней нагрузки от 3 до 15 км/ч или до отказа, приращение скорости составляло 1 км/ч каждые 30 с. В каждом тесте ступенчато-возрастающей локомоторной нагрузке в качестве стандартной разминки предшествовала интервальная нагрузка с чередованием нескольких отрезков ходьбы со скоростью 3 и 6 км/ч. Испытуемый располагался на специальном стенде-подвеске параллельно полу. Ноги испытуемого были вывешены с помощью системы амортизирующих жгутов (рис. 1). Протокол теста позволял оценивать изменения систем вегетативного обеспечения мышечной деятельности в спектре нагрузок от минимальных до 15 км в ч.
Образцы мочи для выполнения анализа белкового состава методами протеомики на основе масс-спектрометрии собирали до выполнения теста и после него, при произвольном мочеиспускании. В соответствии с требованиями EuroKUP и HKUPP использовали стандартизированный протокол сбора мочи для анализа протеома [10]. Образцы мочи подвергали пробоподготовке, состоящей из этапов восстановления, алкилирования, осаждения белка и протеолиза с использованием трипсина. Для определения молекулярных функций и биологических процессов с участием выявленных белков использовали программный пакет Perseus. Реконструкцию ассоциативных генных сетей осуществляли программой ANDSystem [14]. Построенные ассоциативные сети включали достоверно отличающиеся белки, обнаруженные в протеоме мочи здоровых добровольцев после нагрузки; связь с функциональным состоянием сердечно-сосудистой системы устанавливалась через соответствующие идентификаторы Perseus.
Для определения вклада симпатической и парасимпатической систем в вегетативную модуляцию использовали анализ ВСР с предварительной регистрацией электрокардиограммы (ЭКГ), которая осуществлялась перед взятием проб мочи в положении сидя, в покое после 15-минутного отдыха. Для регистрации использовали прибор “Карди-2” (ООО “Медицинские компьютерные системы”, Россия). Для обработки полученного массива длительностей кардиоинтервалов использовали программное обеспечение “Иским-6” (ООО “Институт внедрения новых медицинских технологий “Рамена”, г. Рязань). Программное обеспечение “Иским-6” позволяет регистрировать и рассчитывать 41 показатель, которые характеризуют ВСР и отражают симпатическую и парасимпатическую активность вегетативной нервной системы (ВНС). Исследование ВСР, расчет и анализ показателей для оценки вегетативного статуса осуществляли на основе рекомендаций, разработанных Европейским кардиологическим и Северо-Американским электрофизиологическим Обществами, а также Российскими рекомендациями анализа ВСР [4, 15].
Для статистического анализа и определения физиологической однородности выборки, на основе анализа параметров ВСР, применяли метод главных компонент [16]. Проверяли статистическую гипотезу о том, что рассматриваемая выборка принадлежит нормальному распределению. Для этого применяли статистический критерий Шапиро-Уилка, который является одним из наиболее эффективных критериев проверки нормальности, уровень значимости составил p < 0.325, т.е. нулевая гипотеза о принадлежности к нормальному распределению не отвергается [17]. Нахождение значения различий между выборками проводили с помощью критерия достоверной значимой разности Тьюки (Tukey’s honestly significant difference test) [18].
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
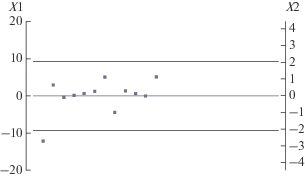
Экспериментальная группа являлась однородной не только по формальным признакам (пол, возраст, антропометрические критерии), но и по особенностям физиологической регуляции сердечного ритма. Математический алгоритм метода главных компонент позволил установить, что разброс проанализированных параметров ВСР находится в диапазоне ±2δ, что свидетельствует об идентичных физиологических процессах, отраженных в системе вегетативной регуляции (рис. 2).
Рис. 2.
Плот параметров вариабельности сердечного ритма (ВСР). По левой оси ординат (Х1) – первая главная компонента; по правой оси ординат (Х2) – стандартное отклонение первой главной компоненты.
В результате хромато-масс-спектрометрического анализа мочи испытуемых было идентифицировано 429 белков, “присутственность” 69 из которых достоверно изменялась при сравнении “до–после теста”. Скорость их появления в полученных образцах – около 60 мин (выполнение локомоторной нагрузки и период восстановления) – позволяет отнести эти белки к регуляторам “быстрого ответа”.
Построение ассоциативных сетей с помощью специализированных программ AND Systems и анализа массива доступных литературных данных позволило выделить основные процессы и соответствующие им белки, вовлеченные в быстрый ответ сердечно-сосудистой системы на физическую нагрузку.
Основные процессы, обеспечивающие быстрый ответ сердечно-сосудистой системы, можно условно разделить на три группы, которые связаны с работой сердца, тонусом сосудов и их проницаемостью.
Список достоверно изменяющихся белков, связанных с процессами быстрого ответа сердечно-сосудистой системы, в настоящем исследовании, и их молекулярная масса представлены в табл. 1.
Таблица 1.
Достоверно изменяющиеся белки, связанные с процессами быстрого ответа сердечно-сосудистой системы и их молекулярная масса
| Процессы | Название белка | Название гена по UniProtKB | Ген | Молекулярная масса |
|---|---|---|---|---|
| Работа сердца | Карбоангидраза | Carbonicanhydrase 1 (Карбоангидраза) | CA1 | 28.870 |
| Лизосомальная α-глюкозидаза | Lysosomalalpha-glucosidase | GAA | 105.324 | |
| Тонус сосудов | Кининоген/Брадикинин | Kininogen-1/Bradikynin | KNG1 | 71.957 |
| Простагландин-H2D-изомераза | Prostaglandin-H2 D-isomerase | PTGDS | 21.029 | |
| Тирозин-специфичная протеинкиназа | Tyrosine-protein kinase receptor UFO | Axl | 98.191 | |
| Проницаемость сосудов | Ингибитор С реактивного белка плазмы | Plasmaprotease C1 inhibitor | IC1 | 55.154 |
| Макрофагальный колониестимулирующий фактор | Macrophagecolony-stimulatingfactor 1 | M-CSF | 60.179 | |
| Рецептор эпидермального фактора роста | Pro-epidermal growth factor | EGF | 133.99 | |
| Мембранный гликозилфосфатидилинозитол-связанный белок | Lipopolysaccharideco-receptor | CD14 | 40.076 |
Первая группа процессов, отражающая быстрый ответ протеома мочи на выполнение ступенчато-возрастающей локомоторной нагрузки была связана с регуляцией ритма и изменением силы сокращения сердца. Известно, что имеется функциональная область высокой активности карбоангидразы вокруг митохондрий для поддержания клиренса митохондриального СО2, при повышенной дыхательной активности во время выполнения физической нагрузки. Аберрантное распределение карбоангидразной активности, может снизить энергетическую эффективность сердца. Ферменты карбоангидразы, экспрессируемые в участках желудочковых миоцитов, могут влиять на клиренс митохондриального CO2, катализируя гидратацию CO2, приводящую к образованию H+ и HCO3–, и изменяя градиент распределения CO2 [19]. В исследованиях карбоангидразы при физических нагрузках различной длительности установлено изменение концентрации ферментов карбоангидразы в зависимости от длительности выполнения нагрузки [20]. Это подтверждается полученными нами данными, поскольку в настоящем исследовании активность карбоангидразы первоначально быстро увеличивалась.
Лизосомальная α-глюкозидаза, приводит к накоплению гликогена в лизосомах, прежде всего в клетках сердца и скелетных мышц, оказывая влияние на силу мышечного сокращения и выносливость, т.е. физическую работоспособность при ступенчато возрастающей локомоторной нагрузке [21].
Вторая ключевая группа процессов – регуляция сосудистого тонуса, включает вазодилатацию, вазоконстрикцию, сосудодвигательные реакции, регулирующие диаметр кровеносных сосудов и объемный кровоток соответственно. В них участвуют кининоген-1 и калликреин, входящие в ключевую протеолитическую систему [22], вовлеченную в свертывание крови, сокращение гладких мышц, диурез, снижение уровня глюкозы в крови [23, 24]. Кининоген вызывает повышение уровня внутриклеточного кальция, стимулирует выработку эндотелиального оксида азота и простациклина [25]. В условиях 5-суточной сухой иммерсии быстрый протеомный ответ сердечно-сосудистой системы проявился в динамике калликреина-1 в моче [26]. H. Yu et al., на основании экспериментальных и клинических исследований показали обратную корреляцию между содержанием в моче калликреина-1 и показателями АД. Авторы предполагают, что калликреин-1 способствует улучшению сердечной, ренальной и неврологической функций [27]. Брадикинин образуется при действии фермента калликреина на молекулу предшественника – кининогена. Вновь синтезированный брадикинин быстро разрушается на неактивные метаболиты, время полужизни данного пептида in vivo составляет всего 17 с, поэтому его концентрация в плазме крови и тканях изменяется в очень больших пределах [28]. По этой причине определить взаимосвязь между адаптационной реакцией организма и содержанием брадикинина практически невозможно. Предполагается защитная роль калликреина при гипоксии, опосредованная через вазодилатацию и защиту эндотелия [29, 30].
Таким образом, кининоген может играть важную роль в поддержании нормальной функции эндотелия, кровотока и служить кардиозащитным пептидом при выполнении локомоторной физической нагрузки, что согласуется с мнением других авторов [31, 32].
После воздействия ступенчато-возрастающей локомоторной нагрузки изменилось присутствие в моче простагландин-H2 D-изомеразы, катализируещей превращение простагландин-H2 в простагландин-D2, который, наряду с другими функциями, участвует в сокращении и расслаблении гладких мышц, является мощным ингибитором агрегации тромбоцитов, регулирует расширение сосудов [33–36]. Важно, что этот белок является маркером скорости клубочковой фильтрации [3, 37]. В настоящем исследовании подтверждается роль простагландина-H2 как маркера ответа почек и сердечно-сосудистой системы на физическую нагрузку.
Ответ на гемодинамический стресс во время физической нагрузки – это физиологический процесс, который требует скоординированной передачи сигналов между эндотелиальными, воспалительными и сосудистыми гладкомышечными клетками не только путем ингибирования апоптоза, но также посредством регуляции иммунной гетерогенности сосудистых клеток, экспрессии цитокинов/хемокинов и ремоделирования внеклеточного матрикса [38]. Поскольку тирозин-специфичная протеинкиназа регулирует миграцию клеток, фагоцитоз и апоптоз, можно предположить, что она будет играть роль в состоянии эндотелия сосудов при выполнении ступенчато-возрастающей локомоторной нагрузки.
Следующая группа процессов связана с регуляцией проницаемости сосудов. Ферменты, участвующие в этом физиологическом процессе, инактивируются ингибитором С-реактивного белка плазмы, который также является ингибитором сосудистого воспаления, а его дефицит приводит к увеличению проницаемости сосудов. Разнообразные данные указывают на то, что эта роль в первую очередь является продуктом регуляции контактной системы протеаз, фактора XIIa и калликреина плазмы [39–43].
Ступенчато-возрастающая локомоторная нагрузка физиологически сопровождается изменением экспрессии макрофагального колониестимулирующего фактора. In vivo физическая нагрузка увеличивает экспрессию его мРНК в скелетных мышцах [44, 45]. Также макрофагальный колониестимулирующий фактор мобилизует эндотелиальные клетки-предшественники из костного мозга в периферическую кровь, что приводит к увеличению количества работающих сосудов и кровотока [46], защищая кардиомиоциты и миотубы от индуцированной гипоксией гибели, апоптоза [47].
Рецептор эпидермального фактора роста участвует в ряде процессов с прямыми и непрямыми проангиогенными маркерами. Прямая проангиогенная группа маркеров состоит из сосудистого эндотелиального фактора роста, основного фактора роста фибробластов и фактора роста гепатоцитов, тогда как косвенные проангиогенные маркеры включают трансформирующий фактор роста-β, интерлейкин 6, интерлейкин 8 и тромбоцитарный фактор роста. Сосудистый эндотелиальный фактор роста и основной фактор роста фибробластов стимулируют миграцию и пролиферацию эндотелиальных клеток в существующих сосудах для генерации и стабилизации новых кровеносных сосудов.
Сосудистый эндотелиальный фактор роста высвобождается в условиях гипоксии как эффект индуцируемого гипоксией фактора (HIF-1α) и вызывает ответ дыхательной системы. Гипоксия приводит к выработке эпидермального фактора роста, что может объяснить особенности реакций, связанных с выполнением ступенчато-возрастающей локомоторной нагрузки [48].
Посредством ингибитора тирозинкиназ рецептора эпидермального фактора роста (EGFR), тестостерон как анаболик повышает толерантность к физической нагрузке и влияет на синтез коллагена сосудистыми гладкомышечными клетками. Таким образом, тирозин-специфичная протеинкиназа – важная составная часть тестостерон-регулируемых процессов, которая лежит в основе защитного действия тестостерона для поддержания состояния сосудов [49].
Известно, что макрофаги и моноциты экспрессируют мембранный гликозилфосфатидилинозитол-связанный белок. Из него высвобождается растворимый мембранный гликозилфосфатидилинозитол-связанный белок, который потенциально может активировать воспалительную передачу сигналов и может действовать в качестве ключевого регулятора продукции сосудистого эндотелиального фактора роста [50]. Физические нагрузки улучшают эндотелий-зависимую вазодилатацию, тогда как гипоксический стресс вызывает дисфункцию эндотелия сосудов. Полученные нами данные о динамике этого белка при ступенчато-возрастающей локомоторной нагрузке совпадают с результатами исследования [51] и свидетельствуют о его роли в повышении функциональности эндотелиальных клеток и защите от развития эндотелиальной дисфункции.
ЗАКЛЮЧЕНИЕ
Во время физических упражнений изменение метаболических процессов происходит на всех уровнях функциональной системы, обеспечивающей сохранение гомеостаза и это непосредственно отражается в протеоме внеклеточных жидкостей [1, 2, 52, 53].
Сердечно-сосудистая система обеспечивает стабильное поддержание работоспособности при любом виде физической активности. В ответ на физическую нагрузку сердечно-сосудистая система должна удовлетворять требованиям адекватной перфузии активной скелетной мышцы при одновременном поддержании системного артериального давления. Сердечный выброс увеличивается, и в активной скелетной мышце вазоконстрикция и вазодилатация функционируют интегрированным образом, чтобы регулировать сосудистое сопротивление и оптимизировать перфузию активных мышечных волокон. Вазомоторные процессы в активной скелетной мышце облегчают согласование локальной доставки кислорода в соответствии с его потребностью [54]. Именно поэтому в настоящем исследовании основные процессы и соответствующие им белки, вовлеченные в быстрый ответ сердечно-сосудистой системы на физическую нагрузку в настоящем исследовании, были связаны с сокращением сердечной мышцы и сосудистым тонусом.
Повышение податливости артерий во время локомоторной, особенно аэробной нагрузки, хорошо известный феномен [55]. Механизм увеличения жесткости сосудов связан с повышением их тонуса, обусловленным активацией симпатической нервной системы [56]. При этом эффект физической тренировки может быть в большей мере обусловлен повышенной вазодилататорной и антиоксидантной способностью эндотелия сосудов [57], чем сниженной реактивностью симпатоадреналовой системы или сосудистой стенки [58, 59].
Проведенный анализ участия комплекса белков внеклеточной жидкости в остром ответе сердечно-сосудистой системы на физическую нагрузку подтверждает вышесказанное.
При ступенчато-возрастающей локомоторной нагрузке было выделено 429 белков, 69 из которых достоверно изменяли, а 10 белков отражали процессы срочной реакции сердечно-сосудистой системы здоровых мужчин на дозированную физическую нагрузку. Показано, что лизосомальная α-глюкозидаза регулирует силу мышечного сокращения и выносливость, т.е. физическую работоспособность. Кининоген поддерживает нормальную функцию эндотелия, кровотока и служит кардиозащитным пептидом – этим, по нашему мнению, обусловлено его изменение после выполнения ступенчато-возрастающей локомоторной нагрузки. Вероятно, мембранный гликозилфосфатидилинозитол-связанный белок, повышающий активность эндотелиальных клеток и участвующий в подавлении эндотелиальной дисфункции, как и тирозин-специфичная протеинкиназа, играющая роль в развитии эндотелиального ответа, изменяют свою присутственность после воздействия локомоторной нагрузки в результате реакции эндотелия на нее. На основании вышеизложенных результатов протеомные регуляторы, способствующие защите и восстановлению эндотелия, могут рассматриваться как средство гемодинамической адаптации во время ступенчато-возрастающей локомоторной нагрузки.
Поиск неинвазивных индикаторов, обладающих интегральными характеристиками относительно процессов адаптации, становится особенно актуальным в условиях планирования полетов в дальний космос. В связи с этим анализ биологических жидкостей организма является одним из перспективных направлений для оценки успешности протекания процессов адаптации к физической нагрузке и основой для коррекции методов профилактики гипогравитационных нарушений в длительном КП.
Этические нормы. Все исследования проведены в соответствии с принципами биомедицинской этики, сформулированными в Хельсинкской декларации 1964 г. и ее последующих обновлениях, и одобрены комиссией по биомедицинской этике Института медико-биологических проблем РАН, протокол № 483 от 3 августа 2018 г. (Москва).
Информированное согласие. Каждый участник исследования представил добровольное письменное информированное согласие, подписанное им после разъяснения ему потенциальных рисков и преимуществ, а также характера предстоящего исследования.
Финансирование работы. Работа выполнена в рамках базовых тем РАН 63.1, 64.1 и 65.3. на 2013–2020 гг.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией данной статьи.
Список литературы
Griffin K.L., Woodman C.R., Price E.M. et al. Endothelium-mediated relaxation of porcine collateral-dependent arterioles is improved by exercise training // Circulation. 2001. V. 104. № 12. P. 1393.
Heaps C.L., Mattox M.L., Kelly K.A. et al. Exercise training increases basal tone in arterioles distal to chronic coronary occlusion // Am. J. Physiol. Heart Circ Physiol. 2006. V. 290. № 3. P. 1128.
Fomina E.V., Lisova N.Iu., Kireev K.S. et al. Kidney function and urine protein composition in healthy volunteers during space station fitness tests // Aerosp. Med. Hum. Perform. 2015. V. 86. № 5. P. 1.
Баевский Р.М., Иванов Г.Г., Чирейкин Л.В. и др. Анализ вариабельности сердечного ритма при использовании различных электрокардиографических систем (методические рекомендации) // Вестник аритмологии // 2001. № 24. С. 65.
Traustadóttir T., Bosch P.R., Cantu T., Matt K.S. Hypothalamic-Pituitary-Adrenal Axis Response and Recovery from High-Intensity Exercise in Women: Effects of Aging and Fitness // J. Clin. Endocrinol. Metab. 2004. V. 89. № 7. P. 3248.
O’Sullivan S.E., Bell C. Training Reduces Autonomic Cardiovascular Responses to Both Exercise-Dependent and -Independent Stimuli in Humans // Auton. Neurosci. 2001. V. 91. № 1–2. P. 76.
Thayer J.F., Ahs F., Fredrikson M. et al. A meta-analysis of heart rate variability and neuroimaging studies: implications for heart rate variability as a marker of stress and health // Neurosci. Biobehav. Rev. 2012. V. 36. № 2. P. 747.
Beissner F., Meissner K., Bär K.J., Napadow V. The autonomic brain: an activation likelihood estimation meta-analysis for central processing of autonomic function // J. Neurosci. V. 33. № 25. P. 10503.
Little H.C., Tan S.Y., Cali F.M. et al. Multiplex Quantification Identifies Novel Exercise-regulated Myokines/Cytokines in Plasma and in Glycolytic and Oxidative Skeletal Muscle // Mol. Cell. Proteomics. 2018. V. 17. № 8. P. 1546.
Ларина И.М., Иванисенко В.А., Николаев Е.Н., Григорьев А.И. Протеомика в исследованиях экстремальных состояний человека как инструмент системной биологии // Acta Naturae. 2014. Т. 6. № 3. С. 71. Larina I.M., Ivanisenko V.A., Nikolaev E.N., Grigorev A.I. The proteome of a healthy human during physical activity under extreme conditions // Acta Naturae. 2014. V. 6. № 22. P. 66.
Фомина Е.В., Уськов К.В., Рыкова М.П. и др. Адаптивный иммунитет как показатель оптимальной физической нагрузки в условиях 520-суточной изоляции // Физиология человека. 2017. Т. 43. № 3. С. 100. Fomina E.V., Uskov K.V., Rykova M.P. et al. Adaptive immunity as an indicator of optimum physical loads during 520-day isolation // Human Physiology. 2017. V. 43. № 3. P. 301.
Nkuipou-Kenfack E., Koeck T., Mischak H. et al. Proteome analysis in the assessment of ageing // Ageing Res. Rev. 2014. V. 18. P. 74.
Виноградова О.Л., Зайцев В.В., Сонькин В.Д. Сравнительный анализ результатов ступенчатого бегового теста, выполняемого при вертикальном и горизонтальном положении тела // Физиология человека. 2005. Т. 31. № 6. С. 65. Vinogradova O.L., Zaitseva V.V., Son’kin V.D. Comparative analysis of the results of a stepped running test performed in the vertical and horizontal positions // Human Physiology. 2005. V. 31. № 6. P. 677.
Ivanisenko V.A., Saik O.V., Ivanisenko N.V. et al. ANDSystem: an Associative Network Discovery System for automated literature mining in the field of biology // BMC Systems Biology. 2015. V. 9. № 2. https://doi.org/10.1186/1752-0509-9-S2-S2
Heart rate variability. Standarts of measurement, physiological interpretation, and clinical use. Task Forse of The European Society of Cardiology and The North American Society of Pacing and Electrophysiology (Membership of the Task Force listed in the Appendix) // Eur. Heart J. 1996. V. 17. P. 334.
Олешкевич А.А., Носовский А.М., Пашовкин Т.Н. и др. Патент № 2 640 177 от 21.09.2015 “Способ определения степени влияния физических факторов на биологические объекты”. Опубликовано: 26.12.2017. Бюл. № 9. С. 32.
Shapiro S.S., Wilk M.B. An analysis of variance test for normality // Biometrika. 1965. V. 52. № 3. P. 591.
Кобзарь А.И. Прикладная математическая статистика. М.: Физматлит, 2006. 403 с.
Schroeder M.A., Ali M.A., Hulikova A. et al. Extramitochondrial domain rich in carbonic anhydrase activity improves myocardial energetics // Proc. Natl. Acad. Sci. USA. 2013. V. 110. № 10. P. 958.
Tas M., Senturk E., Ekinci D. et al. Comparison of blood carbonic anhydrase activity of athletes performing interval and continuous running exercise at high altitude // J. Enzyme Inhib. Med. Chem. 2019. V. 34. № 1. P. 218.
Benz K., Hahn P., Hanisch M. et al. Systematic review of oral and craniofacial findings in patients with Fabry disease or Pompe disease // Br. J. Oral Maxillofac Surg. 2019. V. 57. № 9. P. 831.
Chen Z.B., Huang D.Q., Niu F.N. et al. Human urinary kallidinogenase suppresses cerebral inflammation in experimental stroke and downregulates nuclear factor-kappa B // J. Cereb. Blood Flow Metab. 2010. V. 30. № 7. P. 1356.
Яровая Г.А. Биорегулирующие функции и патогенетическая роль протеолиза // Лаб. Мед. 2002. № 5. С. 39.
Siltari A, Roivanen J., Korpela R., Vapaatalo H. Long-term feeding with bioactive tripeptides in aged hypertensive and normotensive rats: special focus on blood pressure and bradykinin-induced vascular reactivity // J. Physiol. Pharmacol. 2017. V. 68. № 3. P. 407.
Kolte D., Osman N., Yang J., Shariat-Madar Z. High molecular weight kininogen activates B2 receptor signaling pathway in human vascular endothelial cells // J. Biol. Chem. 2011. V. 286. № 28. P. 24561.
Пастушкова Л.Х., Доброхотов И.В., Веселова О.М. и др. Идентификация белков сердечно-сосудистой системы у здоровых лиц в “сухой” иммерсии посредством изучения протеомного профиля мочи // Физиология человека. 2014. Т. 40. № 3. С. 109. Pastushkova L.K., Dobrokhotov I.V., Veselova O.M. et al. Identification of proteins of cardiovascular system in healthy subjects’ urine during “dry” immersion // Human Physiology. 2014. V. 40. № 3. P. 330.
Yu H., Song Q., Freedman B.I. et al. Association of the tissue kallikrein gene promoter with ESRD and hypertension // Kidney Int. 2002. V. 61. № 3. P. 1030.
Murphey L.J., Hachey D.L., Oates J.A. et al. Metabolism of bradykininIn vivo in humans: identification of BK1-5 as a stable plasma peptide metabolite // J. Pharmacol. Exp. Ther. 2000. V. 294. № 1. P. 263.
Sharma J.N. The kinin system in hypertensive pathophysiology // Inflammopharmacology. 2013. V. 21. № 1. P. 1.
Amiral J., Seghatchian J. The contact system at the crossroads of various key patho-physiological functions: Update on present understanding, laboratory exploration and future perspectives // Transfus. Apher. Sci. 2019. V. 8. № 2. P 216.
Kolte D., Osman N., Yang J., Shariat-Madar Z. High molecular weight kininogen activates B2 receptor signaling pathway in human vascular endothelial cells // J. Biol. Chem. 2011. V. 286. № 28. P. 24561.
Brailoiu E., McGuire M., Shuler S.A. et al. Modulation of cardiac vagal tone by bradykinin acting on nucleus ambiguous // Neuroscience. 2017. V. 365. P. 23.
Gray S.J., Giles H., Posner J.Br. The effect of a prostaglandin DP-receptor partial agonist (192C86) on platelet aggregation and the cardiovascular system in healthy volunteers // Clin. Pharmacol. 1992. V. 34. № 4. P. 344.
Pastushkova L.Kh., Kashirina D.N., Brzhozovskiy A.G. et al. Evaluation of cardiovascular system state by urine proteome after manned space flight // Acta Astronautica. 2019. V. 160. P. 594.
Miwa Y., Oda H., Shiina Y. et al. Association of serum lipocalin-type prostaglandin D synthase levels with subclinical atherosclerosis in untreated asymptomatic subjects // Hypertens Res. 2008. V. 31. № 10. P. 1931.
Zhou Y., Shaw N., Li Y. et al. Structure-function analysis of human l-prostaglandin D synthase bound with fatty acid molecules // FASEB J. 2010. V. 24. № 12. P. 4668.
White C.A., Ghazan-Shahi S., Adams M.A. β-Trace protein: a marker of GFR and other biological pathways // Am. J. Kidney Dis. 2015. V. 65. № 1. P. 131.
Gerloff J., Korshunov V.A. Immune modulation of vascular resident cells by Axl orchestrates carotid intima-media thickening // Am. J. Pathol. 2012. V. 180. № 5. P. 2134.
Skriver K., Wikoff W.R., Patston P.A. et al. Substrate properties of C1 inhibitor Ma (alanine 434 → glutamic acid). Genetic and structural evidence suggesting that the P12-region contains critical determinants of serine protease inhibitor/substrate status // J. Biol. Chem. 1991. V. 266. № 14. P. 9216.
Henry Li H., Riedl M., Kashkin J. Update on the Use of C1-Esterase Inhibitor Replacement Therapy in the Acute and Prophylactic Treatment of Hereditary Angioedema // Clin. Rev. Allergy Immunol. 2019. V. 56. № 2. P. 207.
Davis A.E. The pathogenesis of hereditary angioedema // Transfus. Apher Sci. 2003. V. 29. № 3. P. 195.
Schoenfeld A.K., Lahrsen E., Alban S. Regulation of Complement and Contact System Activation via C1 Inhibitor Potentiation and Factor XIIa Activity Modulation by Sulfated Glycans – Structure-Activity Relationships // PLoS One. 2016. V. 11. № 10. P. e0165493.
Hirose T., Ogura H., Kang J. et al. Serial change of C1 inhibitor in patients with sepsis – a preliminary report // Am. J. Emerg. Med. 2016. V. 34. № 3. P. 594.
Eubank T.D., Galloway M., Montague C.M. et al. M-CSF induces vascular endothelial growth factor production and angiogenic activity from human monocytes // J. Immunol. 2003. V. 171. № 5. P. 2637.
Okazaki T., Ebihara S., Takahashi H. et al. Macrophage colony-stimulating factor induces vascular endothelial growth factor production in skeletal muscle and promotes tumor angiogenesis // J. Immunol. 2005. V. 174. № 12. P. 7531.
Nakano K., Adachi Y., Minamino K. et al. Mechanisms underlying acceleration of blood flow recovery in ischemic limbs by macrophage colony-stimulating factor // Stem. Cells. 2006. V. 24. № 5. P. 1274.
Okazaki T., Ebihara S., Asada M. et al. Macrophage colony-stimulating factor improves cardiac function after ischemic injury by inducing vascular endothelial growth factor production and survival of cardiomyocytes // Am. J. Pathol. 2007. V. 171. № 4. P. 1093.
Pool C.M., Jin Y., Chen B. et al. Hypoxic-induction of arginase II requires EGF-mediated EGFR activation in human pulmonary microvascular endothelial cells // Physiol. Rep. 2018. V. 6. № 10. P. e13693.
Chen Y.Q., Zhao J., Jin C.W. et al. Testosterone delays vascular smooth muscle cell senescence and inhibits collagen synthesis via the Gas6/Axl signaling pathway // Age (Dordr). 2016. V. 38. № 3. P. 60.
Umazume K., Usui Y., Wakabayashi Y. et al. Effects of soluble CD14 and cytokine levels on diabetic macular edema and visual acuity // Retina. 2013. V. 33. № 5. P. 1020.
Tsai H.H., Lin C.P., Lin Y.H. et al. High-intensity Interval training enhances mobilization/functionality of endothelial progenitor cells and depressed shedding of vascular endothelial cells undergoing hypoxia // Eur. J. Appl. Physiol. 2016. V. 116. № 11–12. P. 2375.
Griffin K.L., Laughlin M.H., Parker J.L. Exercise training improves endothelium-mediated vasorelaxation after chronic coronary occlusion // J. Appl. Physiol. 1999. V. 87. № 5. P. 1948.
Heaps C.L., Sturek M., Rapps J.A. et al. Exercise training restores adenosine-induced relaxation in coronary arteries distal to chronic occlusion // Am. J. Physiol. Heart Circ. Physiol. 2000. V. 278. P. 1984.
Rowell L.B. Human Cardiovascular Control. New York (N.Y.): Oxford University Press, 1993. P. 520.
Cameron J.D., Dart A.M. Exercise Training Increases Total Systemic Arterial Compliance in Humans // Am. J. Physiol. 1994. V. 266. № 2. P. H693.
Vlachopoulos C., Kosmopoulous F., Alexopoulos N. et al. Acute Mental Stress Has a Prolonged Unfavorable Effect on Arterial Stiffness and Wave Reflections // Psychosom. Med. 2006. V. 68. № 2. P. 231.
Di Francescomarino S., Sciartilli A., Di Valerio V. The Effect of Physical Exercise on Endothelial Function // Sports Med. 2009. V. 39. № 10. P. 797.
Traustadóttir T., Bosch P.R., Cantu T., Matt K.S. Hypothalamic-Pituitary-Adrenal Axis Response and Recovery from High-Intensity Exercise in Women: Effects of Aging and Fitness // J. Clin. Endocrinol. Metab. 2004. V. 89. № 7. P. 3248.
O’Sullivan S.E., Bell C. Training Reduces Autonomic Cardiovascular Responses to Both Exercise-Dependent and -Independent Stimuli in Humans // Auton. Neurosci. 2001. V. 91. № 1–2. P. 76.
Дополнительные материалы отсутствуют.
Инструменты
Физиология человека