Физиология человека, 2021, T. 47, № 4, стр. 91-102
Посттрансляционные окислительные модификации белков плазмы крови космонавтов после продолжительного полета. Часть II
И. М. Ларина 1, *, А. Г. Бржозовский 1, А. М. Носовский 1, М. И. Индейкина 2, А. С. Кононихин 1, 3, Е. Н. Николаев 3, О. И. Орлов 1
1 ФГБУН ГНЦ РФ – Институт медико-биологических проблем РАН
Москва, Россия
2 ФГБУН Институт биохимической физики имени Н.М. Эмануэля РАН
Москва, Россия
3 Сколковский институт науки и технологий
Москва, Россия
* E-mail: irina.larina@gmail.com
Поступила в редакцию 14.12.2020
После доработки 18.01.2021
Принята к публикации 23.03.2021
Аннотация
Во время космического полета (КП) в организме человека вследствие нарушения равновесия продукции и элиминации свободных радикалов и активных форм кислорода происходит более активное, чем в нормальных условиях, оксидативное повреждение основных клеточных компонентов – ДНК, липидов, белков. В работе анализируется, методами протеомики, частота выявления оксидативных посттрансляционных модификаций в белках плазмы крови, полученной от российских участников полугодовых полетов на МКС. Рассматривается влияние оксидативной модификации, регистрируемой после КП, на функциональные особенности групп белков, согласно биоинформатическому анализу, участвующих в метаболизме внеклеточного матрикса (ВКМ), липидов, осуществлении иммунных функций, а также контроле воспаления. Избыточному окислению в послеполетных образцах, по сравнению с их состоянием перед полетом, были подвержены белковые компоненты аполипопротеинов (APOA1, APOA2, APOA4, APOL1, APOE), что нарушает их васкулопротекторные свойства. Выявлена повышенная, в 2 и более раз, интенсивность окислительных модификаций цепей как мембранных, так и секреторных форм иммуноглобулинов. Состав окисленных фрагментов иммуноглобулинов – цепей (κ, γ1, γ2, γ4 и µ) константных доменов иммуноглобулинов (Ig) свидетельствует о возможности изменения эффекторных и/или сигнальных функций Ig. Структурные компоненты ВКМ и ассоциированных с ним во внеклеточной жидкости соединений являются сложным молекулярным хабом, связывающим функции иммунитета, сосудистые компетенции, контроля воспаления, протеазно-контр-протеазный баланс, гемостаз. Компоненты этой системы рассматриваются в тесной взаимосвязи.
Известно более 200 типов посттрансляционных модификаций белков (PTMs), создающих большое разнообразие форм соединения, закодированного в геноме. Изучение PTMs представляет интерес, поскольку модификации влияют на функции белков. Окислительным (оксидативным) модификациям чаще всего приписывают влияние, повреждающее белок. Наши исследования образцов биологических жидкостей космонавтов после продолжительных космических полетов (КП), выполненные панорамными, полуколичественными и количественными методами протеомики на основе хромато-масс-спектрометрии, свидетельствуют о развитии оксидативного стресса, и можно полагать, увеличивает возможность окислительных модификаций как белков, так и других клеточных структур [1].
Изучению функциональных изменений, в ответ на клеточный стресс или другие стимулы, способствующие окислительным модификациям белков у человека, посвящено большое число работ, касающихся, в основном, их влияния на развитие заболеваний [2–4]. Однако в открытых источниках отсутствуют работы, посвященные оценке уровня оксидативных модификаций белков и анализа их значения для физиологических функций в связи с пилотируемым КП.
Ранее в I части статьи, нами была начата работа по оценке влияния факторов КП на частоту выявления PTMs в белках плазмы крови, тех образцах, которые были получены при обследовании российских участников КП на международной космической станции (МКС) [5]. Были рассмотрены модификации белков, окисление в которых происходило в позициях: метионин (М), цистеин (С), гистидин-триптофан (HW) и последовательности аспарагиновая кислота/лизин/аспарагин/пролин/аргинин/триптофан (DKNPRY). Также, учитывалось двойное окисление по метионину. Было установлено, что рост уровня окислительной модификации белков, после полета, был характерен для большинства из 131 белка анализируемой выборки. В том числе, для 30 белков из них – это увеличение было в 2 и более раз, по отношению к существовавшему уровню до полета, и еще у 16 белков оксигенация выявлялась исключительно после полета, но не присутствовала у тех же протеинов в фоне. Уровень окисления лишь 26 белков крови после совершенного космонавтами полета оставался на том же уровне, что и перед стартом. Значение возросшего уровня оксидативных модификаций группы белков, регистрируемых после КП, по данным биоинформатических ресурсов, предположительно, могло сказываться на особенностях функций: каскада гемостаза, активации комплемента, метаболизма внеклеточного матрикса, липидов, и осуществлении иммунных функций, а также контроля воспаления и поддержания равновесия протеазной и контр-протеазной активности во внеклеточной жидкости.
C целью прояснения возможных функциональных изменений, опосредованных определенным белком/белковым комплексом/сигнальным каскадом, был продолжен анализ посттрансляционных окислительных модификаций белков (PTMs), выявленных в группах протеинов образцов крови, собранной у космонавтов после завершения продолжительных полетов.
МЕТОДИКА
Объектами исследования являлись образцы плазмы крови, собранные у 13 российских космонавтов до и после КП на российском сегменте МКС. Длительность полетов составляла 5.5–6.5 мес. Биологические образцы собирали в рамках утвержденного космического эксперимента российской национальной научной программы, перед полетом, а также на 1-ые и 7-ые сут после приземления, оформленного и одобренного в установленном порядке. После получения плазмы, пробы сохраняли до масс-спектрометрического исследования. Вслед за пробоподготовкой выполняли хромато-масс-спектрометрический анализ (ВЭЖХ – МС/МС) на комплексе, состоящем из хроматографа Dionex Ultimate 3000 (Thermo Fisher Scientific, Waltham, США) в сочетании с Tims TOF Pro (Bruker Daltonics, Германия) с использованием источника ионов наноспрея (режим положительных ионов, 1600 В) (Bruker Daltonics, Германия).
Количественную оценку изменений уровня белков крови космонавтов проводили безметочным методом (label-free), как это описано в работе [6]. Анализ МС/МС спектров проводили с помощью программного комплекса Peaks Studios [7] с использованием прямой и обратной базы SwissProt [8] с максимальной ошибкой для дочерних ионов менее 10 ppm. Для определения локуса образования белков использовали базу данных Tissue-specific Gene Expression and Regulation (TiGER) (http://bioinfo.wilmer.jhu.edu/tiger). Молекулярные функции и биологические процессы базы данных GO для анализируемых белков определяли по разделу базы данных UniProt-GOA [9]. Сверхпредставленность биологических процессов для полученных списков белков оценивали программой BiNGO (Biological Network Gene Ontology tool).
Статистический анализ и определение молекулярных функций и биологических процессов, в которых участвуют белки, выполняли с использованием программного пакета Perseus (version: 1.5.5.3). Для статистического анализа использовали программный пакет Statistica 10. Функциональный анализ белков проводили с помощью веб-ресурсов DAVID, String и программы Cytoscape. Статистически значимыми считали корректированные данные с p-value < 0.05 (точный критерий Фишера с поправкой на множественность сравнения Бенджамини-Хокберга). Для выявления в спектрах изменений в массе пептидов, соответствующих определенным PTMs, было просканировано 299 215 MS-спектров и 4 MS/MS-спектров, статистика отфильтрованных результатов представлена в соответствующем разделе I части настоящей статьи [5]. Там же представлено подробное изложение аналитических приемов и методов анализа результатов.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Как было отмечено в I части [5] настоящей статьи, в структуре 131 белка из послеполетных образцов крови выявляются различные посттрансляционные модификации. Среди них были отобраны и в дальнейшем проанализированы только белки с оксидативными PTMs (ox-PTMs). Отбор был выполнен программными средствами, из 9060 отчетов по сканированию спектров. Уровень окислительных модификаций каждого белка, индуцированных КП, устанавливался при сравнении соотношения оксидативных PTMs того же протеина в образцах “после” vs “до полета”. Для составления статистической таблицы относительно динамики числа ox-PTMs в белках устанавливали фильтр, отсекающий результаты выявления данного типа модификаций лишь в 1 или 2-х пептидах данного белка (табл. 1).
Таблица 1.
Число белков с оксидативными модификациями в до- и послеполетных образцах крови
| Группы белков | В белках дополетных образцов | Число ox-PTMs в белках послеполетных проб крови | |
|---|---|---|---|
| рост числа ox-PTMs | сохранение числа ox-PTMs на дополетном уровне | ||
| ox-PTMs присутствуют | 57 60%** |
23* 40%а |
34 |
| ox-PTMs не присутствуют | 38 40%** |
16 42%а |
22 (ox-PTMs не выявлены) |
| Всего белков с ox-PTMs | 95 72%# |
39 | 55 |
| Всего белков с PTMs всех типов | 131 | ||
Статистика числа PTMs в белках крови космонавтов до совершения ими КП показывает, что ox-PTMs являются наиболее распространенным их типом (оксидативные модификации составляют 72% от общего числа). В то же время после выполненного полета дополнительно у значительной части белков крови выявляются окислительные модификации. К ним относятся как протеины с достоверно возросшим уровнем ox-PTMs после полета, по сравнению с таковым в предполетных образцах крови (p < 0.05), так и белки, в которых перед полетом окислительные модификации не обнаруживались (табл. 2, 3).
Таблица 2.
Белки крови с достоверно увеличившимся уровнем окислительной модификации после полугодовых космических полетов (КП)
| Белок | Сумма оксидативных PTMs (до полета) | Сумма оксидативных PTMs (после полета) | Соотношение оксидативных PTMs после/до полета |
|---|---|---|---|
| α-Цепь фибриногена | 80 | 136 | 1.7 |
| β-Цепь фибриногена | 142 | 251 | 1.8 |
| γ-Цепь фибриногена | 144 | 250 | 1.7 |
| С3 компонент комплемента | 6 | 25 | 4.2 |
| Альбумин | 5 | 93 | 18.6 |
| Фактор комплемента Н | 15 | 32 | 2.1 |
| Аполипопротеин A-I | 18 | 54 | 3 |
| Аполипопротеин A-IV | 3 | 13 | 4.3 |
| C1s субкомпонент комплемента | 7 | 33 | 4.7 |
| Фактор коагуляции 5 | 1 | 3 | 3.0 |
| Легкая цепь С-домена иммуноглобулина | 4 | 15 | 3.8 |
| Константа иммуноглобулина κ | 4 | 15 | 3.8 |
| Аполипопротеин А-II | 3 | 16 | 5.3 |
| Аполипопротеин L-I | 1 | 4 | 4.0 |
| Кластерин | 17 | 34 | 2.0 |
| Интер-α-трипсиновый ингибитор | 2 | 6 | 3.0 |
| Плазминоген | 8 | 17 | 2.1 |
| γ1-Цепь С-домена иммуноглобулина | 12 | 24 | 2.0 |
| µ-Цепь С-домена иммуноглобулина | 7 | 13 | 1.9 |
| Аполипопротеин Е | 5 | 13 | 2.6 |
| γ4-Цепь С-домена иммуноглобулина | 5 | 13 | 2.6 |
| γ2-Цепь С-домена иммуноглобулина | 8 | 20 | 2.5 |
| Субъединица В компонента комплемента С1q | 9 | 21 | 2.3 |
Таблица 3.
Белки послеполетных образцов крови космонавтов с вновь выявленными оксидативными модификациями
| Кодировка белка по базе данных IPI | Код белка в базе данных Uniprot | Наименование белка |
|---|---|---|
| P01023 | A2MG_HUMAN | α-2-Макроглобулин |
| P02787 | TRFE_HUMAN | Серотрансферрин |
| P01009 | A1AT_HUMAN | α-1-Антитрипсин |
| P04264 | K2C1_HUMAN | Кератин 2 типа, цитоскелетный |
| P00738 | HPT_HUMAN | Гаптоглобин |
| P01008 | ANT3_HUMAN | Антитромбин-3 |
| P48740 | MASP1_HUMAN | Маннан-связывающая лектин-сериновая протеаза 1 |
| P00739 | HPTR_HUMAN | Гаптоглобин-связывающий протеин |
| P35527 | K1C9_HUMAN | Кератин 1 типа, цитоскелетный 9 |
| P02788 | TRFL_HUMAN | Лактотрансферрин |
| P02654 | APOC1_HUMAN | Аполипопротеин С-1 |
| Q15166 | PON3_HUMAN | Сывороточная параоксоназа/лактоназа 3 |
| Q96PD5 | PGRP2_HUMAN | Пептидогликан распознающий белок 2 |
| Q12805 | FBLN3_HUMAN | EGF-содержащий фибулин-подобный белок 1 внеклеточного матрикса |
| Q9UK55 | ZPI_HUMAN | Ингибитор протеин Z-зависимой протеазы |
| P11226 | MBL2_HUMAN | Манноза-связывающий белок С; коллектин-1 |
В другой группе белков оксидативные модификации выявлялись исключительно в протеинах послеполетных образцов (табл. 3).
Были обнаружены и устойчивые к данному виду модификаций белки, уровень окисления которых в послеполетных образцах оставался на том же уровне, что и перед полетом. Анализ возможных причин их устойчивости к окислению и ее значения для физиологических систем организма выходит за рамки данной статьи и не приводится.
Учитывая, что, согласно биоинформатическому анализу, 106 протеинов из общего списка являются белками, функционирующим во внеклеточной жидкости (с FDR 7.33e-81), можно предположить, что в процессе осуществления своих функций они тесно взаимодействуют с внеклеточным матриксом (ВКМ).
В настоящее время является общепризнанным, что структурные компоненты ВКМ и ассоциированных с ним во внеклеточной жидкости соединений оказываются своеобразным сложным молекулярным хабом, связывающим в один “распределительный узел” функции иммунитета, сосудистые компетенции, контроль воспаления, протеазно-контр-протеазный баланс, гемостаз. И с этой точки зрения оказывается невозможным рассматривать компоненты этих систем в качестве действующих изолированно, в рамках “своей” функциональной системы.
Предваряя анализ окисленных в послеполетных образцах плазмы белков, следует уделить внимание некоторым аспектам, касающимся функций ВКМ, в том числе – его взаимодействия с клеточным окружением.
С одной стороны, недавние исследования показали, что ВКМ чрезвычайно восприимчив к окислительному повреждению из-за его значительной представленности во внеклеточной жидкости, низкой скорости метаболизма (что приводит к накоплению повреждений) и относительно низких уровней внеклеточных антиоксидантов и компонентов репаративных систем [2, 10, 11]. В литературе представлен значительный объем данных, демонстрирующих, что оксиданты, генерируемые активированными лейкоцитами (нейтрофилами, моноцитами, тканевыми макрофагами), могут вызывать структурные и функциональные изменения компонентов ВКМ, в т.ч. протеогликанов [12–14]. Показано, что оксидативное повреждение ВКМ по сайтам метионина происходит вследствие ферментативного действия миелопероксидазы (MPO), высвобождаемой активированными лейкоцитами [15]. Активированные лейкоциты генерируют супероксидные радикалы (${\text{O}}_{2}^{{ \bullet {\kern 1pt} - }}$) и перекись водорода (H2O2) с помощью ферментов НАДФН-оксидазы (NOX), а нейтрофилы, моноциты и тканевые макрофаги высвобождают миелопероксидазу (МPО) из внутриклеточных гранул [3]. В присутствии хлорид-ионов (Cl-) MPO использует H2O2 для образования мощного окислителя, хлорноватистой кислоты (HClO), реагирующего со многими биологическими мишенями, но в основном – из-за их большого количества и высокой реактивности – с белками [3, 15].
Показано, что ВКМ первично (т.е. непосредственно) чувствителен к механическим воздействиям [16]. Поэтому на экспрессию компонентов ВКМ может влиять механическое напряжение [17], создаваемое гравитацией, одним из наиболее важных физических факторов, влияющих на все виды жизни на Земле. И поскольку является общепризнанным фактом развитие оксидативного стресса в организме человека во время КП [1, 18], интерес к изучению оксидативных модификаций компонентов ВКМ в условиях микрогравитации становится обоснованным и неизбежным.
Кроме того, большинством исследователей признается, что ВКМ и его реорганизация (ремоделирование) имеют первостепенное значение в формировании и контроле иммунного микроокружения, а также для взаимодействия иммунная клетка – ВКМ [19, 20]. Сопряжение функций иммунитета и внеклеточного матрикса в последнее время достаточно документировано. Показано, что в механизмы ответа на окислительный стресс, факторы роста и провоспалительную активацию вовлечены как иммунные клетки, так и ВКМ, а также лизилоксигеназы (LOX) [21]. За счет внеклеточного сигнального пути, ERK (одного из каскадов МАРК) продукты метаболизма ВКМ способны контролировать стресс эндоплазматического ретикулума [22, 23]. Белки-компоненты ВКМ принадлежат к молекулярным паттернам, связанным с опасностью (DAMP), индуцирующим провоспалительное состояние и активирующим врожденную иммунную систему [24, 25]. Также, недавние следования показали роль гиалуронана (HA) и его рецепторов в адаптивном иммунитете, особенно в отношении эффекторной и регуляторной функции Т-клеток [26]. Поэтому в нашем исследовании было важно обратить внимание на оксидативные модификации белков иммунной системы. Так, было показано значимое повышение уровня окисления фрагментов иммуноглобулинов (табл. 4).
Таблица 4.
Группа фрагментов иммуноглобулинов, с выявленными оксидативными PTMs
| Белок | Кратность увеличения числа оксидативных PTMs после полета | Характеристика белка |
|---|---|---|
| β-Цепь интегрина 3 (ITGB3) | 3.8 | *Белок ITGB3, также известный как CD61 или GP3A, является одним из наиболее хорошо изученных компонентов семейства интегринов. Рецептор адгезии на поверхности клетки, ITGB3 участвует в перепрограммировании метаболизма, формировании стромального и иммунного микроокружения. Является основным рецептором клеточной адгезии для ВКМ. Играет биологическую роль в межклеточном взаимодействии и связывании клеток с лигандами в ВКМ (витронектином и фибронектином). Активация интегрина может регулировать сборку ВКМ |
| κ-Цепь С-домена иммуноглобулина | 3.8 | **Цепи (κ, γ1, γ2, γ4 и µ) константных доменов иммуноглобулинов (Ig). Ig – B-клеточные рецепторы, состоят из двух идентичных тяжелых цепей и двух одинаковых легких цепей; с дисульфидными связями между ними. Цепи кодируются в отдельных локусах генома. Комбинаторика генов, случайная и палиндромная вставка нуклеотидов в сайты сплайсинга в процессе образования Ig обеспечивает разнообразие этих белков, составляющих у человека, по оценкам, 1012 |
| γ1-Цепь С-домена иммуноглобулина | 2.0 | |
| µ-Цепь С-домена иммуноглобулина | 1.9 | |
| γ4-Цепь С-домена иммуноглобулина | 2.6 | |
| γ2-Цепь С-домена иммуноглобулина | 2.5 |
Примечание: * – по [26]; ** – по IMGT® http://www.imgt.org.
Как показывает анализ данных, полученных в гравитационной физиологии при моделировании условий микрогравитации и после пилотируемых КП, в тканях человека создается гипоксическая среда [18]. Следует рассмотреть возможные изменения функций белков, собранные в табл. 4. Показано, что при гипоксии в эндотелиальных клетках терминального сосудистого русла человека транскрипция белка ITGB3 активируется с помощью индуцированного гипоксией фактора 1A (HIF1A) [27, 28]. Кроме того, данные продемонстрировали, что в гипоксической среде и при доступности витронектина рецептор эпидермального фактора роста vIII (EGFRvIII) и ITGB3 имеют тенденцию к формированию комплексов [29].
Показано, что интегрины могут также стимулироваться внеклеточным кислым pH. Более того, кислое микроокружение также способствует активности матриксных металлопротеаз, которые связываются с интегринами β3 [30]. Анализ нескольких наборов данных показывает, что транспортер глюкозы 3 типа (GLUT3) устойчиво положительно коррелирует с ITGB3. Таким образом, ITGB3 активирует экспрессию GLUT3, поглощение глюкозы, продукцию лактата и уровень гликолиза. ITGB3 связывается с ВКМ через свой лиганд витронектин и матриксные металлопротеиназы (MMPs), позволяя MMP2 ремоделировать внеклеточный матрикс, что способствует активации эндотелиальных клеток [31]. Подавление функции ITGB3, в результате его оксигенации, приводит к потере молекулы адгезии эндотелиальных клеток (ECAM), вызывая интернализацию VEGFR-2 [32]. В свою очередь, ингибирование фосфорилирования и инактивация VEGFR-2 угнетает миграцию эндотелиальных клеток [33].
Космический полет изменяет фенотип иммунных клеток в костном мозге, лимфоидном органе, в котором происходит гемопоэз [34], а во время модельного эксперимента с вывешиванием грызунов количество предшественников B-клеток в костном мозге снижается [35]. Реакция популяции В-клеток на КП не исследована столь тщательно, как это делается для Т-клеток. Только в отдельных работах исследовали влияние КП на репертуар Ig. Стимуляция человеческих В-клеток in vitro во время КП приводила к более низким концентрациям секретируемых Ig [36]. Достоверной разницы в уровнях Ig до и после полета в периферической крови космонавтов, летавших на борту МКС, не наблюдалось [37]. Измерение общего репертуара Ig селезенки мышей, экспонированных на МКС в течение 3 нед., показало, что не было влияния КП на использование сегмента B-гена [38]. Исследования эффектов КП на модели иммунизированных амфибий показали измененное семейство VH-генов и использование класса Ig [39, 40].
Известно, что при созревании B-клеток в костном мозге экспрессия иммуноглобулинов претерпевает ряд изменений. Предшественники зрелых В-клеток, пре-B-клетки, синтезируют только мембранные формы тяжелых цепей класса μ. Также незрелые и зрелые B-клетки синтезируют легкие цепи классов κ и λ, которые, соединяясь с тяжелыми цепями класса μ, образуют антитела IgM. Зрелые B-клетки экспрессируют мембранные формы IgM и IgD, которые служат распознающими антигены рецепторами и запускают активацию B-клеток. Рецепторы незрелых и зрелых B-клеток нековалентно связаны с интегринами, сигнальные функции которых необходимы для экспрессии поверхностных форм IgM и IgD [38]. Когда B-клетки активируются антигенами и другими стимулами, они превращаются в плазматические клетки, секретирующие антитела. В это же время переходит переключение классов антител, и клетка перестает синтезировать IgM и IgD, но начинает – IgA, IgE или IgG.
Нами выявлена повышенная, в 2 и более раз, интенсивность окислительных модификаций цепей как мембранных, так и секреторных форм иммуноглобулинов (табл. 2). И поскольку окисление по дисульфидным мостикам, как наиболее вероятным сайтам окисления, ведет к их разрывам, можно предполагать фатальное изменение структуры и функции иммуноглобулинов, как минимум, классов М и G. Обращает на себя внимание состав окисленных фрагментов иммуноглобулинов – цепи (κ, γ1, γ2, γ4 и µ) константных доменов Ig. Поскольку каждая тяжелая цепь Ig имеет С-концевую константную (С) область, кодируемую отдельным геном С-области, которая определяет изотип антитела, окислительные модификации этой области выражено изменяют эффекторные или сигнальные функции этих молекул.
Как следует из табл. 5, группа аполипопротеинов (АПО) так же, как и фрагменты иммуноглобулинов, оказалась подвержена избыточному окислению в послеполетных образцах, по сравнению с их состоянием перед полетом (APOA1, APOA2, APOA4, APOL1, APOE). Липопротеины высокой плотности (ЛПВП), с входящими в их состав АПО, представляют собой соединения, обладающие васкулопротекторными свойствами. Окисление считается наиболее распространенной посттрансляцинной модификацией в аполипопротеинах, особенно в APOA1 (что обнаружено и нами). Так, окислительные модификации по остатку Trp в APOA1, обнаруженные в ткани и плазме, тесно связаны с потерей васкулопротекторных свойств ЛПВП у пациентов с абдоминальной аневризмой аорты [41]. Показано также, что окислительная модификация различных остатков APOA1 присутствует в атеросклеротических бляшках и связана с дисфункцией ЛПВП [4, 42, 43]. Окисленные формы циркулирующего APOA1 были выявлены в исследованиях у пациентов с различными сердечно-сосудистыми заболеваниями [44, 45].
Таблица 5.
Основные функции группы аполипопротеинов с выявленными оксидативными PTMs
| Белок | Кратность увеличения числа оксидативных PTMs после КП | Основные функции белка |
|---|---|---|
| Аполипопротеин A-I | 3.0 | Исключительно важен для обратного переноса холестерина из тканей в печень для экскреции; стимулирует отток холестерина из клеток и выступает в качестве кофактора для лецитинхолестеринацилтрансферазы (ЛХАТ) |
| Аполипопротеин A-IV | 4.3 | Играет роль в секреции и катаболизме хиломикронов и ЛПОНП. Требуется для эффективной активации липопротеинлипазы ApoC-II. Мощный активатор ЛХАТ. Является основным компонентом ЛПВП и хиломикронов |
| Аполипопротеин А-II | 5.3 | Стабилизирует структуру ЛПВП (липопротеинов высокой плотности) путем его ассоциации с липидами, и тем самым влияет на метаболизм ЛПВП |
| Аполипопротеин L-I | 4.0 | Минорный апопротеиновый компонент ЛПВП, синтезируется в печени, а также во многих других тканях. Обнаруживается в эндотелии сосудов, печени, сердце, легких, плаценте, подоцитах, проксимальных канальцах почек. Имеет секретируемую форму. Образует комплекс, известный как трипаносомный литический фактор (TLF), с частицами липопротеинов высокой плотности 3 (HDL3), (APOA1) и гемоглобинсвязывающим, связанный с гаптоглобином белком (HPR). Играет роль в воспалительной реакции. Провоспалительные цитокины интерферон-γ, фактор некроза опухоли-α (ФНО-α) и р53 повышают его экспрессию |
| Аполипопротеин Е | 2.6 | Основной апопротеин хиломикрона. Он связывается со специфическим рецептором печени и периферических клеток и необходим для клиренса остатков хиломикрона и ЛПОНП |
Примечание: PTMs – посттрансляционные модификации; ЛХАТ- лецитинхолестеринацилтрансфераза; ЛПОНП – липопротеины очень низкой плотности; ApoC-II – аполипопротеин С-II; ЛПВП – липопротеины высокой плотности; TLF – трипаносомный литический фактор; HDL3 – липопротеины высокой плотности-3; APOA1 – аполипопротеин А-I; и HPR – гемоглобинсвязывающий, связанный с гаптоглобином белок; ФНО-α – фактор некроза опухоли-α; р53 – белок р53, регулирующий клеточный цикл.
Мощными источниками окислительного стресса во внеклеточной жидкости, за счет высвобождения миелопероксидазы (МПО), и потенцирования процесса окислительно-восстановительным действием Fe2+ из свободного гемоглобина, являются нейтрофилы и эритроциты. В основном МПО выделяется активированными нейтрофилами, затем фермент катализирует реакцию между перекисью водорода и ионами хлорида с образованием хлорноватистой кислоты в качестве основного окислителя. MPO связан с ЛПВП, причем подтверждено, что ЛПВП от пациентов с аневризмой аорты несет более высокие уровни MPO, по сравнению с ЛПВП в образцах от здоровых лиц [46]. Среди окислительных модификаций, происходящих под действием МПО, выделяется окисление сайта Trp72 [44], что подтверждено in vitro и in vivo. Кроме оксидантов, полученных из нейтрофилов, важную роль в окислении APOA1 могут играть другие источники АФК, такие как двухвалентное железо [47] или ферменты нейтрофилов, вышедшие из внеклеточных микрочастиц: никотинамидадениндинуклеотидфосфат (НАДФН) оксидазы [48]. Остатки Trp являются ключевыми локусами, регулирующими MPO-опосредованную потерю акцепторной активности холестерина APOA1 [49], следовательно, их окислительные модификации, могут объяснить снижение способности оттока холестерина из клеток [41].
Анализ основных функций сверхокисленных белковых компонентов аполипопротеинов дает представление о функциях и биологических процессах, которые могут быть вследствие этого нарушены. Кроме влияния на метаболизм холестерина, клиренс остатков хиломикронов и ЛПОНП, провоспалительную активацию [50, 51], липопротеины входят в единую молекулярно-клеточную сеть, объединяющую функции иммунитета, регуляции комплемента, гемостаз, ремоделирование ВКМ [2, 16, 52].
Для прояснения и наглядного представления возможных механизмов, с помощью которых осуществляется влияние ВКМ на различные функции, с помощью программы ANDsystem были найдены связи некоторых “сверхокисленных” белков крови космонавтов после КП с процессами внеклеточного матрикса (рис. 1), в том числе – реализующимися через сигнальный путь ERK (рис. 2).
Рис. 1.
Ассоциативная связь белков крови, с повышенным содержанием окислительных модификаций после космического полета (КП), с внеклеточным матриксом.

Рис. 2.
Участие белков крови с повышенным содержанием окислительных модификаций после космического полета (КП) в сигнальном пути ERK.
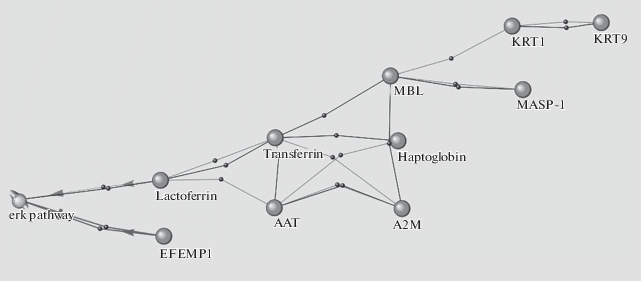
Участниками сети взаимодействий, воссозданной на рис. 1, оказались не только сверхокисленные белки, но и протеины, подвергшиеся de novo оксидативной модификации после полета. В целях упрощения схем взаимодействия мы ограничились воссозданием молекулярных цепочек без молекул-посредников (т.е. сети прямых взаимодействий). Однако в действительности молекулярные сети многозвенны. Так, рис. 1 иллюстрирует, как могут быть многообразны пути воздействия на ВКМ оксидативно измененных белков. Можно отметить, что в схему связей белков с внеклеточным матриксом вошли не все сверхокисленные белки. Кроме того, у некоторых белков связь оказалась не прямой (гаптоглобин-связывающий протеин – HPR, маннан-связывающая лектин-сериновая протеаза 1 – MASP1, кератин 1 типа, цитоскелетный 9 – KRT9), а через одного посредника из числа анализируемых белков. В то же время прямые связи с ВКМ были показаны для 8 белков: P01023|A2MG_HUMAN – альфа-2-макроглобулина, P02787|TRFE_HUMAN – серотрансферрина, P01009|A1AT_HUMAN – альфа-1-антитрипсина, P04264|K2C1_HUMAN – кератина 2 типа, цитоскелетного, P00738|HPT_HUMAN – гаптоглобина, P02788|TRFL_HUMAN – лактотрансферрина, Q12805|FBLN3_HUMAN – EGF-содержащего фибулин-подобного белка 1 внеклеточного матрикса, P11226|MBL2_HUMAN – коллектина-1.
Сигнальным путем, через который белки с окислительной модификацией могут воздействовать на внутриклеточные события, по-видимому, является ERK, один из каскадов МАРК (рис. 2). Сопряжение функций иммунитета и внеклеточного матрикса отражено в работах [23–27], показывающих многообразие и сложность диалога клетка – внеклеточный матрикс. Интересно, что 2 белка из выше представленных (лактотрансферрин и EGF-содержащий фибулин-подобный белок 1 внеклеточного матрикса) напрямую участвуют в сигнальном пути ERK. Все остальные анализируемые белки были связаны с этим каскадом через молекулярных посредников.
ЗАКЛЮЧЕНИЕ
Таким образом, можно считать установленным, что посттрансляционные модификации белковых компонентов основного внеклеточного хаба (в который входит ВКМ), в т.ч. окислительные, индуцируются продолжительным пребыванием человека на борту космического объекта. При этом окисление белков, компонентов такой сложной сети взаимодействий, сказываются на функциях, осуществляемых как внеклеточно, так и внутри клеток. В перспективе особенное внимание предстоит уделить взаимодействию этой молекулярной сети внеклеточной жидкости с эндотелиальными и гладкомышечными компонентами сосудов, поскольку приспособление к условиям КП сердечно-сосудистой системы лежит в основе многих интегративных функций, таких как физическая работоспособность, ортостатическая устойчивость, водно-электролитный баланс, терморегуляция.
Этические нормы. Исследования с участием Российских космонавтов проведены в рамках космического эксперимента “Протеом”, в соответствии с принципами биомедицинской этики, сформулированными в Хельсинкской декларации 1964 г. и ее последующих обновлениях, и одобрены комиссией по биомедицинской этике Института медико-биологических проблем РАН (Москва).
Информированное согласие. Каждый участник исследования представил добровольное письменное информированное согласие для участия в исследовании.
Финансирование работы. Исследования поддержаны программой фундаментальных научных исследований РАН 65.3. Исследование ПТМ белков плазмы крови с использованием масс-спектрометрии высокого разрешения проводилось в рамках проекта РНФ № 19-14-00306.
Благодарности. Авторы статьи выражают искреннюю благодарность космонавтам, принимавшим участие в исследовании.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией данной статьи.
Список литературы
Ларина И.М., Григорьев А.И. Маркеры оксидативного стресса в жидкостях тела космонавтов после продолжительных космических полетов на МКС // Технологии живых систем. 2019. Т. 16. № 5. С. 5. Larina I.M., Grigoriev A.I. Markers of oxidative stress in body fluids of astronauts after prolonged space flights on the ISS // Technologies of Living Systems. 2019. V. 16. № 5. P. 5.
Chuang C.Y., Degendorfer G., Davies M.J. Oxidation and modification of extracellular matrix and its role in disease // Free. Radic. Res. 2014. V. 48. № 9. P. 970.
Winterbourn C.C., Kettle A.J., Hampton M.B. Reactive oxygen species and neutrophil function // Annu. Rev. Biochem. 2016. V. 85. P. 765.
Zheng L., Nukuna B., Brennan M.-L. et al. Apolipoprotein A-I is a selective target for myeloperoxidase-catalyzed oxidation and functional impairment in subjects with cardiovascular disease // J. Clin. Invest. 2004. V. 114. № 4. P. 529.
Ларина И.М., Бржозовский А.Г., Носовский А.М. и др. Посттрансляционные окислительные модификации белков плазмы крови космонавтов после продолжительного полета. Часть I // Физиология человека. 2020. Т. 46. № 5. С. 81. Larina I.M., Brzhzovsky A.G., Nosovsky A.M. et al. Post-Translational Oxidation Modifications of Blood Plasma Proteins of Cosmonauts after a Long-term Flight: Part I // Human Physiology. 2020. V. 46. № 5. P. 531.
Brzhozovskiy A.G., Kononikhin A.S., Indeykina M.I. et al. The effects of space flight factors on the human plasma proteome, including both real space missions and ground-based model experiments // Int. J. Mol. Sci. 2019. V. 20. № 13. P. 3194.
Bairoch A., Apweiler R. The SWISS-PROT protein sequence database and its supplement TrEMBL in 2000 // Nucleic. Acids. Res. 2000. V. 28. № 1. P. 45.
Gene Ontology Consortium, Blake J.A., Dolan M. et al. Gene Ontology annotations and resources // Nucleic. Acids. Res. 2013. V. 41(Database issue). P. D530.
Maere S., Heymans K., Kuiper M. BiNGO: a Cytoscape plugin to assess overrepresentation of gene ontology categories in biological networks // Bioinformatics. 2005. V. 21. № 16. P. 3448.
Kennett E.C., Rees M.D., Malle E. et al. Peroxynitrite modifies the structure and function of the extracellular matrix proteoglycan perlecan by reaction with both the protein core and the heparan sulfate chains // Free Radic. Biol. Med. 2010. V. 49. № 2. P. 282.
Degendorfer G., Chuang C.Y., Hammer A. et al. Peroxynitrous acid induces structural and functional modifications to basement membranes and its key component, laminin // Free Radic. Biol. Med. 2015. V. 89. P. 721.
Degendorfer G., Chuang C.Y., Kawasaki H. et al. Peroxynitrite-mediated oxidation of plasma fibronectin // Free Radic. Biol. Med. 2016. V. 97. P. 602.
Nybo T., Dieterich S., Gamon L.F. et al. Chlorination and oxidation of the extracellular matrix protein laminin and basement membrane extracts by hypochlorous acid and myeloperoxidase // Redox Biol. 2019. V. 20. P. 496.
Davies M.J., Hawkins C.L., Pattison D.I. et al. Mammalian heme peroxidases: from molecular mechanisms to health implications. Antioxid // Redox Signal. 2008. V. 10. № 7. P. 1199.
Pattison D.I., Davies M.J. Absolute rate constants for the reaction of hypochlorous acid with protein side chains and peptide bonds // Chem. Res. Toxicol. 2001. V. 14. № 10. P. 1453.
Ebnerasuly F., Hajebrahimi Z., Tabaie S.M. et al. Simulated Microgravity Condition Alters the Gene Expression of some ECM and Adhesion Molecules in Adipose Derived Stem Cells // Int. J. Mol. Cell. Med. 2018. V. 7. № 3. P. 146.
Seitzer U., Bodo M., Muller P.K. et al. Microgravity and hypergravity effects on collagen biosynthesis of human dermal fibroblasts // Cell. Tissue Res. 1995. V. 282. № 3. P. 513.
Ларина И.М., Буравкова Л.Б., Григорьев А.И. Кислород-зависимые адаптационные процессы в организме человека в обычных условиях жизнедеятельности и в космическом полете // Авиакосм. и экол. мед. 2021. Т. 55. № 1. С. 5. Larina I.M., Buravkova L.B., Grigoriev A.I. [Oxigen-dependent adaptation processes in the human organism in usual living conditions and during space flight] // Aviakosm. Ekol. Med. 2021. V. 55. № 1. P. 5.
Vannucci L. Stroma as an active player in the development of the tumor microenvironment // Cancer Microenviron. 2015. V. 8. № 3. P. 159.
Varol C., Sagi I. Phagocyte-extracellular matrix crosstalk empowers tumor development and dissemination // FEBS J. 2018. V. 285. № 4. P. 734.
Tenti P., Vannucci L. Lysyl oxidases: linking structures and immunity in the tumor microenvironment // Cancer Immunol. Immunother. 2020. V. 69. № 2. P. 223.
Schinzel R.T, Higuchi-Sanabria R., Shalem O. et al. The Hyaluronidase, TMEM2, Promotes ER Homeostasis and Longevity Independent of the UPRER // Cell. 2019. V. 179. № 6. P. 1306.
Goncalves R.L.S., Hotamisligil G.S. TMEM2 Modulates ER Stress in a Non-canonical Manner // Cell. Metab. 2019. V. 30. № 6. P. 999.
Patel S. Danger-Associated Molecular Patterns (DAMPs): the Derivatives and Triggers of Inflammation // Curr. Allergy Asthma Rep. 2018. V. 18. № 11. P. 63.
Chen Zhu, Ziqing Kong, Biao Wang et al. ITGB3/CD61: a hub modulator and target in the tumor microenvironment // Am. J. Transl. Res. 2019. V. 11. № 12. P. 7195.
Nagy N., Kuipers H.F., Marshall P.L. et al. Hyaluronan in immune dysregulation and autoimmune diseases // Matrix Biol. 2019. V. 78−79. P. 292.
Befani C., Liakos P. Hypoxia upregulates integrin gene expression in microvascular endothelial cells and promotes their migration and capillary-like tube formation // Cell. Biol. Int. 2017. V. 41. № 7. P. 769.
Sesé M., Fuentes P., Esteve-Codina A. et al. Hypoxia-mediated translational activation of ITGB3 in breast cancer cells enhances TGF-β signaling and malignant features in vitro and in vivo // Oncotarget. 2017. V. 70. № 8. P. 114856.
Liu Z., Han L., Dong Y. et al. EGFRvIII/integrin β3 interaction in hypoxic and vitronectinenriching microenvironment promote GBM progression and metastasis // Oncotarget. 2016. V. 7. № 4. P. 4680.
Paradise R.K., Lauffenburger D.A., Van Vliet K.J. Acidic extracellular pH promotes activation of integrin alpha(v)beta(3) // PLoS One. 2011. V. 6. № 1. P. e15746.
Silletti S., Kessler T., Goldberg J. et al. Disruption of matrix metalloproteinase 2 binding to integrin alpha vbeta 3 by an organic molecule inhibits angiogenesis and tumor growth in vivo // Proc. Natl. Acad. Sci. U.S.A. 2001. V. 98. № 1. P. 119.
Imamaki R., Ogawa K., Kizuka Y. et al. Glycosylation controls cooperative PECAM-VEGFR2-β3 integrin functions at the endothelial surface for tumor angiogenesis // Oncogene. 2018. V. 37. № 31. P. 4287.
Huang R., Rofstad E.K. Integrins as therapeutic targets in the organ-specific metastasis of human malignant melanoma // J. Exp. Clin. Cancer Res. 2018. V. 37. № 1. P. 92.
Ortega M.T., Pecaut M.J., Gridley D.S. et al. Shifts In Bone Marrow Cell Phenotypes Caused By Spaceflight // J. Appl. Physiol. (1985). 2009. V. 106. № 2. P. 548.
Lescale C., Schenten V., Djeghloul D. et al. Hind limb unloading, a model of spaceflight conditions, leads to decreased B lymphopoiesis similar to aging // FASEB J. 2015. V. 29. № 2. P. 455.
Fitzgerald W., Chen S., Walz C. et al. Immune Suppression Of Human Lymphoid Tissues And Cells In Rotating Suspension Culture And Onboard The International Space Station // In Vitro Cell. Dev. Biol. Anim. 2009. V. 45. № 10. P. 622.
Моруков Б.В., Рыкова М.П., Антропова Е.Н. Иммунологические аспекты пилотируемого марсианского полета // Физиология человека. 2013. Т. 39. № 2. С. 19. Morukov B.V., Rykova M.P., Antropova E.N. et al. [Immunological aspects of a piloted mission to Mars] // Fiziol. Cheloveka. 2013. V. 39. № 2. P. 19.
Ward C., Rettig T.A., Hlavacek S. et al. Effects of spaceflight on the immunoglobulin repertoire of unimmunized C57BL/6 mice // Life Sci. Space Res (Amst). 2018. V. 16. № 2. P. 63.
Boxio R., Dournon C., Frippiat J.P. Effects of a long-term spaceflight on immunoglobulin heavy chains of the urodele amphibian Pleurodeles Waltl // J. Appl. Physiol. (1985). 2005. V. 98. № 3. P. 905.
Bascove M., Gueguinou N., Schaerlinger B. et al. Decrease in antibody somatic hypermutation frequency under extreme, extended spaceflight conditions // Faseb J. 2011. V. 25. № 9. P. 2947.
Martínez-López D., Camafeita E., Cedó L. et al. APOA1 oxidation is associated to dysfunctional high-density lipoproteins in human abdominal aortic aneurysm // EBioMedicine. 2019. V. 43. P. 43.
Zheng L., Nukuna B., Brennan M.-L. et al. Apolipoprotein A-I is a selective target for myeloperoxidase-catalyzed oxidation and functional impairment in subjects with cardiovascular disease // J. Clin. Invest. 2004. V. 114. № 4. P. 529.
Bergt C., Pennathur S., Fu X. et al. The myeloperoxidase product hypochlorous acid oxidizes HDL in the human artery wall and impairs ABCA1-dependent cholesterol transport // Proc. Natl. Acad. Sci. U.S.A. 2004. V. 101. № 35. P. 13032.
Huang Y., DiDonato J.A., Levison B.S. et al. An abundant dysfunctional apolipoprotein A1 in human atheroma // Nat. Med. 2014. V. 20. № 2. P. 193.
Shao B., Tang C., Sinha A. et al. Humans with atherosclerosis have impaired ABCA1 cholesterol efflux and enhanced high-density lipoprotein oxidation by myeloperoxidase // Circ Res. 2014. V. 114. № 11. P. 1733.
Ortiz-Muñoz G., Houard X., Martín-Ventura J.-L. et al. HDL antielastase activity prevents smooth muscle cell anoikis, a potential new antiatherogenic property // FASEB J. 2009. V. 23. № 9. P. 3129.
Martinez-Pinna R., Lindholt J.S., Madrigal-Matute J. et al. From tissue iron retention to low systemic haemoglobin levels, new pathophysiological biomarkers of human abdominal aortic aneurysm // Thromb. Haemost. 2014. V. 112. № 1. P. 87.
Smith C.K., Vivekanandan-Giri A., Tang C. et al. Neutrophil extracellular trap-derived enzymes oxidize high-density lipoprotein: an additional proatherogenic mechanism in systemic lupus erythematosus // Arthritis Rheumatol. 2014. V. 66. № 9. P. 2532.
Peng D.-Q., Brubaker G., Wu Z. et al. Apolipoprotein A-I tryptophan substitution leads to resistance to myeloperoxidase-mediated loss of function // Arterioscler. Thromb. Vasc. Biol. 2008. V. 28. № 11. P. 2063.
Sorokin L. The impact of the extracellular matrix on inflammation // Nature Rev. Immunol. 2010. V. 10. № 10. P. 712.
Gaggar A., Jackson P.L., Noerager B.D. et al. A novel proteolytic cascade generates an extracellular matrix-derived chemoattractant in chronic neutrophilic inflammation // J. Immunol. 2008. V. 180. № 8. P. 5662.
Bonnans C., Chou J., Werb Z. Remodelling the extracellular matrix in development and disease // Nat. Rev. Mol. Cell. Biol. 2014. V. 15. № 12. P. 786.
Дополнительные материалы отсутствуют.
Инструменты
Физиология человека


